
文章信息
- 何丽斌, 杨求华, 李慧耀, 罗辉玉, 郑乐云. 2024.
- HE Libin, YANG Qiuhua, LI Huiyao, LUO Huiyu, ZHENG Leyun. 2024.
- 复方中草药对小丑鱼非特异性免疫、消化酶活性的影响及对刺激隐核虫杀灭效果分析
- Effects of a Chinese herbal compound on nonspecific immunity, digestive enzyme activities, and extermination of the parasite Cryptocaryon irritans from Amphiprion frenatus
- 海洋科学, 48(2): 32-42
- Marine Sciences, 48(2): 32-42.
- http://dx.doi.org/10.11759/hykx20221109003
-
文章历史
- 收稿日期:2022-11-09
- 修回日期:2023-01-04
随着人们生活水平的提高、经济多元化的发展, 海洋观赏鱼走进大众视野并深受广大消费者的喜爱。目前市场上海洋观赏鱼的供应大部分依赖人工捕捞, 近年来由于人为滥捕, 海域生态遭到严重破坏, 不合理的捕获方式对珊瑚礁和鱼的体质都造成很大影响[1], 通过人工采捕后进入市场流通的鱼其成活率不足20%[2], 这直接导致海洋观赏鱼数量锐减, 甚至供不应求。随着海洋观赏鱼人工繁育技术的成熟与推广, 其规模化繁养日趋成熟。小丑鱼(也称海葵鱼)隶属于雀鲷科(Pomacentridae), 海葵鱼属(Amphiprion)[3], 在全世界范围内共有20多种[4], 主要分布在印度洋和太平洋水温较暖的瑚礁海域。因为小丑鱼体态娇小, 色彩靓丽, 具有较高的观赏性和商品价值, 在市场上备受青睐, 也是热带海洋观赏鱼中繁育技术最为成熟的品种之一。
刺激隐核虫(Cryptocaryon irritans)俗称“海水小瓜虫”, 隶属于隐核虫科(Family Cryptocaryonidae), 隐核虫属(Genus cryptocaryon)[5-6], 是一种纤毛类专性寄生虫, 大多寄生在热带海水鱼类鳃、鱼鳍、体表等部位[7-8]。鱼体感染刺激隐核虫后, 其周身分布明显的白点, 俗称“白点病”[9-10], 该病感染性强, 传播性广, 感染率、死亡率均较高, 是一种严重危害海水养殖鱼类的寄生虫疾病[11-14], 给养殖户造成了巨大的经济损失[15]。近年来, 刺激隐核虫病同样也殃及了不断崛起和发展的海水观赏鱼养殖业, 不仅危害水族箱养殖鱼类, 甚至常常给水族馆大水体海水观赏鱼带来毁灭性打击, 鱼类大量死亡, 造成了巨大的经济损失[16-17]。海水观赏鱼病虫害防治技术越来越受到广泛关注。
目前, 对刺激隐核虫的防治方法大致分为物理学法和化学法。物理学法的方法主要为: 淡水浸泡、热处理、干燥、转换养殖、紫外线和臭氧处理养殖水体等[18-21]。化学法主要为使用化合物浸泡病鱼或虫体防治刺激隐核虫病, 高锰酸钾、氯化磺胺噻唑、青霉素、硫酸铜单独或联合福尔马林、生物染料、福尔马林、吖啶黄、亚甲基蓝、次氯酸钠、氯化苯甲烃铵[22-28]等均被证明可以有效可以杀灭刺激隐核虫的包囊、幼虫及成虫, 对治疗该病取得了一定的效果。化学法虽然取得了一定的成效, 但长期使用可降低鱼体免疫力和抗病力, 还会造成环境污染。中草药是具有化学结构多样性, 生物活性丰富等优势的天然药物, 具有毒副作用小、安全可靠, 对环境无污染等特点。本研究将苦参、地肤子、蛇床子、黄芪、甘草等为主要成分的复方中草药“XCY-1”添加到基础饲料中, 探究其对小丑鱼血液、肝脏非特异性免疫指标及肠道消化酶活性的影响, 并进行了对感染刺激隐核虫鱼体的药浴加口服联合杀灭效果研究, 为开发无公害、环保型天然植物源杀虫药提供理论参考和技术支撑。
1 材料与方法 1.1 实验材料 1.1.1 实验用中草药实验用复方中草药“XCY-1”为本实验室前期筛选配伍的药物组方, 均采购于福建省厦门市同仁堂大药房, 其主要成分为苦参、地肤子、蛇床子、黄芪、甘草等, 经超微粉碎200目筛绢网过滤后收集粉末备用。
称取2 g药粉, 加入400 mL海水经文火煎煮30 min, 冷却后再用灭菌海水定量调制成1 g/L的母液, 放置4 ℃备用。各取20 g用500 mL海水浸泡30 min后煎煮2 h, 纱布过滤浓缩药液至200 mL, 其终浓度相当于原药100 mg/mL。
1.1.2 实验用鱼实验用鱼取自厦门翔安福建省水产研究所观赏鱼繁育车间, 挑选白条双锯鱼(Amphiprion frenatus)暂养于玻璃培养缸中, 鱼平均体质量为(8.16±0.12) g, 体长为(5.2±0.26) cm, 每日分别于上午8: 30、下午2: 30投喂基础饲料, 持续10 d后开始实验, 培养缸中水温控制在(26±1) ℃, PH值在7.5~8.1, 盐度30~32, 氨0.02 mg/L, 亚硝酸盐0.01 mg/L, 溶解氧高于5.5 mg/L。养殖用海水为二级沙滤海水。
1.1.3 实验用刺激隐核虫刺激隐核虫为本实验室建立的刺激隐核虫ZP1菌株, 参考但学明等[29]方法, 以青石斑鱼(Epinephelus awoara)作为动物模型进行该实验虫株传代系统, 以便易于获取实验用刺激隐核虫。
1.2 饲料处理及实验设计将复方中草药按照0 g/kg(对照)、5 g/kg、10 g/kg、20 g/kg、40 g/kg的配比添加到基础水产饲料(购于厦门华普饲料有限公司)中, 制成粒径为1.5 mm的颗粒型缓沉料。随机选取白条双锯鱼投放至实验玻璃培养缸中(L50 cm×W45 cm×H40 cm)开展实验, 实验设置5个组, 每组3个平行样, 每缸50尾鱼, 连续投喂28 d, 实验期间饲养管理、养殖环境与暂养期间保持一致。
1.3 样品的采集与制备实验期间分别于第7 d、14 d、21 d、28 d随机从每组培养缸中挑取5尾鱼, 用0.1 mL/L丁香酚麻醉实验鱼后, 断尾采血, 1 h后置于4 ℃冰箱静置过夜, 10 000 r/min离心10 min, 取上层血清; 将鱼置于冰盘上解剖, 取出肝脏、肠道组织。将血清及组织样本置于−80 ℃冰箱保存备用。
1.4 血清与肝脏中非特异性免疫指标及肠道消化酶活性指标测定和方法血清中溶菌酶(lysozyme, LZM)活性, 超氧化物歧化酶(superoxide dismutase, SOD)活性, 碱性磷酸酶(alkaline phosphatase, AKP), 酸性磷酸酶(acid phosphatase, ACP); 肝脏中超氧化物歧化酶(superoxide dismutase, SOD), 过氧化氢酶(catalase, CAT), 总抗氧化能力(total antioxidant capacity, T-AOC), 谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-PX); 肠道中淀粉酶(amylase, AMS)、脂肪酶(lipase, LPS)、蛋白酶(protase, PRO)含量测定均使用南京建成生物工程研究所生产的试剂盒, 相关操作详见说明书。
1.5 复方中草药“XCY-1”对刺激隐核虫幼虫的药浴杀灭实验收集鱼体表和鳃脱落于养殖缸底部的刺激隐核虫包囊, 放入海水玻璃杯中孵化, 虹吸出孵化1 h内的幼虫进行实验。实验在24孔细胞培养板上进行, 用清洁海水将幼虫密度调整至400个/mL左右, 以无菌海水调节药物终质量浓度为50 mg/L、100 mg/L、200 mg/L、400 mg/L、800 mg/L, 于每个细胞孔中加入50 µL不同浓度药液和50 µL含幼虫海水, 每个浓度组设置3个平行组, 对照组加50 µL无菌海水和50 µL含幼虫海水。将24孔板放人26 ℃培养箱内, 于用药后10 min、30 min、1 h、2 h、3 h、4 h将培养板于倒置显微镜下镜检观察刺激隐核虫死亡情况。刺激隐核虫死亡判断标准: 虫体沉底且纤毛停止摆动。
1.6 复方中草药“XCY-1”对感染刺激隐核虫鱼体的口服加药浴联合杀灭实验根据前期实验结果确定口服计量为20 g/kg[30], 实验分为A、B、C、D四组, A组按20 g/kg添加“XCY-1”中草药到基础饲料中, 口服无药浴; B组按20 g/kg添加“XCY-1”中草药到基础饲料中, 口服且同时按50 mg/L进行药浴; C组按20 g/kg添加“XCY-1”中草药到基础饲料中, 口服且同时按100 mg/L进行药浴; D组为对照组, 仅投喂基础饲料。药浴时间为每日19: 00至第二天早上7: 00, 投喂中草药饵料时间为每日上午8: 30和下午2: 30。实验容器为底部锥形的玻璃钢桶, 每日在投饵30 min后换水30%并将沉底的包囊及残饵排出桶外, 实验期间饲养管理、养殖环境与暂养期间保持一致。
实验用感染鱼: 在黑暗条件下用新孵化出1 h内的幼虫感染红小丑鱼, 感染浓度为10 000个/尾/L。当鱼体表黏液、鳃丝置于光学显微镜下观察, 确认已感染刺激隐核虫或鱼体能看到“白点”时进行实验。挑选体表有少量“白点”且摄食、游动正常的初期患病鱼随机分为3组, 另取未感染组作为对照组, 每组设6个平行, 每个平行组30尾鱼。其中3个平行组为取样组, 另外3个平行组用于存活率的统计。
实验第0 d、2 d、4 d、6 d取样组每组随机挑取3尾鱼, 麻醉后将两侧第一片鳃剪下制成水浸片, 置于光学显微镜下计数滋养体数量; 存活率组每天观察实验鱼摄食、游动状态, 记录死亡数量。
1.7 数据统计分析采用Excel 2010和SPSS 20.0统计学软件对数据进行单因素方差分析(One-Way ANOVA), 当差异显著时(P<0.05), 用Duncan法进行多重比较。
2 结果 2.1 复方中草药“XCY-1”对小丑鱼血清非特异性免疫指标的影响由图 1可知, 投喂不同剂量复方中草药均可使小丑鱼血清中SOD、LZM、AKP、ACP活性呈现先升后降趋势。其中, 小丑鱼血清SOD活性, 第7 d时, 20 g/kg和40 g/kg药物组SOD活性显著高于其他药物组和对照组(P<0.05)。第14 d时, 20 g/kg药物组SOD活性显著高于其他药物组(P<0.05)。第21 d, 20 g/kg药物组SOD活性达到最高值且与其他药物组之间差异性显著。第28 d, 20 g/kg药物组SOD活性有所下降但仍高于其他药物组。4个时间取样点中20 g/kg药物组SOD活性高于其他各药物组; 小丑鱼血清LZM活性, 第7 d, 10 g/kg、20 g/kg药物组活性高于对其他药物组和对照组(P<0.05)。第14~28 d各药物组LZM活性均高于对照组且差异性显著。第21 d, 20 g/kg药物组LZM活性达到最高值。4个时间取样点中20 g/kg药物组LZM活性高于其他各药物组; 小丑鱼血清AKP活性, 第7 d时, 10 g/kg和20 g/kg药物组AKP活性显著高于其他药物组(P<0.05)。第14 d, 40 g/kg药物组AKP活性高于其他药物组且差异性显著。第21 d, 20 g/kg药物组AKP活性达到最高值且与其他3个药物组间差异性显著。第28 d, 除10 g/kg药物组外, 其他药物组AKP活性下降, 20 g/kg药物组仍显著高于其他药物组(P<0.05); 小丑鱼血清ACP活性, 第7 d, 除5 g/kg药物组外, 其他三组药物组ACP活性显著高于对照组(P<0.05), 但三组药物组间差异不显著(P>0.05)。第14 d, 40 g/kg药物组ACP活性显著高于其他药物组(P<0.05)。第21 d, 20 g/kg药物组ACP活性达到最高值且与其他药物组差异性显著。第28 d各药物组ACP活性下降, 10 g/kg和20 g/kg药物组ACP活性高于其他药物组且差异显著, 但二者之间差异不显著(P>0.05)。
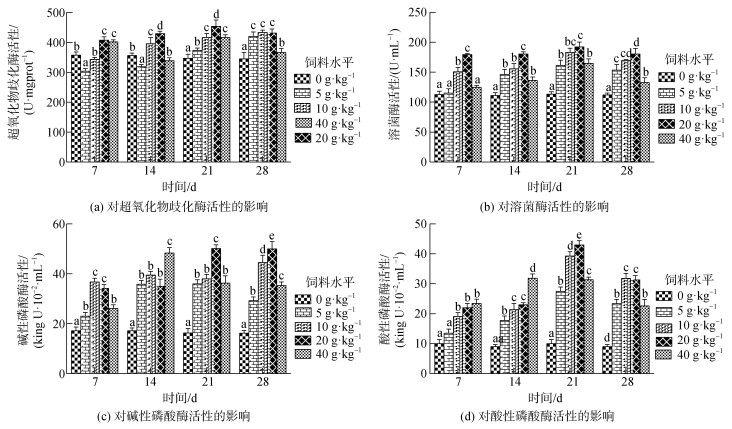 |
| 图 1 复方中草药XCY-1对小丑鱼血清免疫指标的影响 Fig. 1 Effects of the Chinese herbal medicine XCY-1 on serum non-specific immunity indices in A. frenatus 注: 不同字母表示同一时间各实验组之间差异显著(P<0.05) |
由图 2所示, 投喂不同剂量复方中草药均可使小丑鱼肝脏中SOD、GSH-PX、CAT、T-AOC活性呈现先升后降趋势, 各时间点药物组活性均显著高于对照组(P<0.05)。其中, 小丑鱼肝脏SOD活性, 第7~14 d, 20 g/kg和40 g/kg药物组SOD活性显著高于其他药物组, 但二者之间差异性不显著(P>0.05)。第21 d, 20 g/kg药物组SOD活性达到最高值且与其他药物组差异性显著(P<0.05)。第28 d各药物组SOD活性下降。4个时间取样点中20 g/kg药物组SOD活性均高于其他药物组; 小丑鱼肝脏CAT活性, 第7~ 14 d, 20 g/kg和40 g/kg药物组CAT活性显著高于其他药物组(P<0.05), 但二者之间差异不显著(P>0.05)。第21 d, 20 g/kg药物组CAT活性达到最高值且与5 g/kg和10 g/kg药物组差异性显著。第28 d, 各药物组SOD活性下降, 但20 g/kg药物组CAT活性仍显著高于其他药物组(P<0.05); 小丑鱼肝脏T-AOC活性, 第7~14 d, 20 g/kg和40 g/kg药物组T-AOC活性显著高于其他药物组(P<0.05), 但二者之间差异不显著(P>0.05)。第21 d, 20 g/kg药物组T-AOC活性达到最高值且与其他药物组间差异性显著。第28 d, 各药物组T-AOC活性下降, 但20 g/kg药物组T-AOC活性仍显著高于其他药物组; 小丑鱼肝脏GSH-PX活性, 第7~14 d, 各药物组GSH-PX活性上升, 20 g/kg药物组GSH-PX活性显著高于其他药物组(P<0.05), 第21 d, 20 g/kg药物组GSH-PX活性达到最高值且与其他药物组差异显著, 第28 d, 各药物组GSH-PX活性下降, 4个时间取样点中20 g/kg药物组T-AOC活性显著高于其他各药物组。
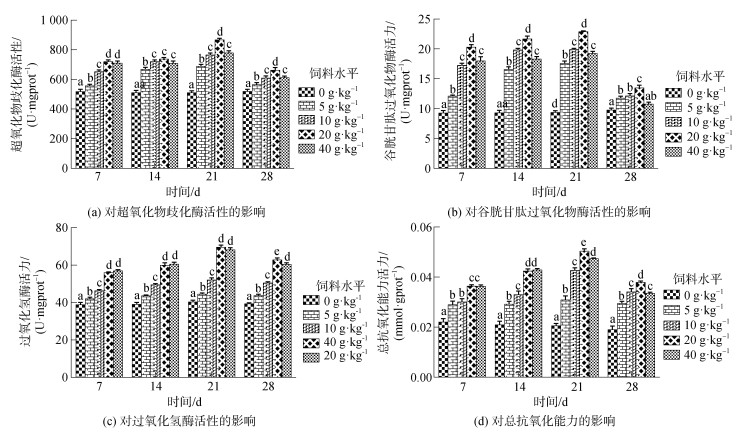 |
| 图 2 复方中草药XCY-1对小丑鱼肝脏免疫指标的影响 Fig. 2 Effects of the Chinese herbal medicine XCY-1 on liver non-specific immunity indices in A. frenatus 注: 不同字母表示同一时间各实验组之间差异显著(P<0.05) |
由图 3所示, 投喂不同剂量复方中草药均可使小丑鱼肠道胰蛋白酶、LPS、AMS活性升高。其中, 小丑鱼肠道胰蛋白酶活性, 第7 d, 各药物组与对照组胰蛋白酶活性差异性不显著(P>0.05)。第14~28 d, 20 g/kg和40 g/kg药物组胰蛋白酶活性显著高于其他药物组和对照组(P<0.05)。第21 d, 20 g/kg药物组胰蛋白酶活性达到最高值。第28 d, 各药物组胰蛋白酶活性下降, 但20 g/kg药物组胰蛋白酶活性仍显著高于其他药物组(P<0.05); 小丑鱼肠道LPS活性, 第7~14 d, 各药物组LPS活性上升但差异不显著(P>0.05)。第21 d, 20 g/kg药物组LPS活性达到各时间点取样的最高值。第28 d, 20 g/kg、40 g/kg药物组LPS活性显著高于其他药物组(P<0.05), 但两组间差异不显著(P>0.05); 小丑鱼肠道AMS活性, 第7 d, 各药物组和对照组之间AMS活性差异性不显著(P>0.05), 第14~21 d, 10 g/kg、20 g/kg和40 g/kg 3个药物组AMS活性升高且与对照组差异性显著(P<0.05), 但3个药物组之间AMS差异性不显著。第21 d, 20 g/kg药物组AMS活性达到各时间点取样的最高值。第28 d, 除5 g/kg药物组外其他药物组AMS活性开始下降, 各药物组活性均显著高于对照组(P<0.05), 但各药物组之间AMS活性差异不显著(P>0.05)。
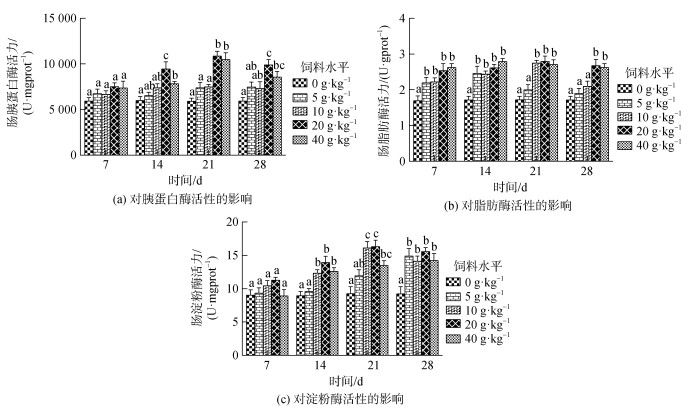 |
| 图 3 复方中草药XCY-1对小丑鱼消化酶活性的影响 Fig. 3 Effects of XCY-1 on A. frenatus digestive enzyme activities 注: 不同字母表示同一时间各实验组之间差异显著(P<0.05) |
由图 4所示, 复方中草药对刺激隐核虫幼虫体外杀灭效果显著。3 h后, 经100, 200, 400, 800 mg/L的复方中草药药物处理, 幼虫死亡率分别为41.2%、62.4%、83.3%和100%, 各药物组死亡率均显著高于对照组(P<0.05); 4 h后, 50, 100, 200, 400 mg/L药物处理, 幼虫死亡率分别达, 21.3%、63.6%、82.1%和100%, 各药物组死亡率均显著高于对照组(P<0.05)。
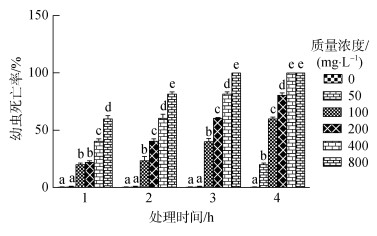 |
| 图 4 复方中草药XCY-1药浴4 h处理刺激隐核虫幼虫死亡率的影响 Fig. 4 Death rate of C. irritans after the XCY-1 herbal compound treatment for 4 h 注: 不同字母表示同一时间各实验组之间差异显著(P<0.05) |
实验初期对照组小丑鱼活动开始逐渐减少, 或趴于缸内, 又或侧身迅速游动蹭痒, 后期严重时, 鱼体鳃丝充血、出血严重且布满大量刺激隐核虫滋养体, 大量黏液覆盖整个鳃部, 这些状况严重影响了气体交换, 导致鱼体供氧不足, 呼吸困难直至死亡。
由图 5所示, 实验第6 d, A、B、C三个药物组与对照组的存活率分别为: 51.1%、53.3%、57.7%、0, 各药物组存活率均显著高于对照组(P<0.05)。
 |
| 图 5 复方中草药XCY-1对红小丑鱼存活率的影响 Fig. 5 Survival rate of A. frenatus after the XCY-1 herbal compound treatment 注: A: XCY-1饲料水平20 mg/kg; B: XCY-1饲料水平20 mg/kg, 药浴浓度50 mg/L; C: XCY-1饲料水平20 mg/kg, 药浴浓度100 mg/L; D: XCY-1饲料水平0 mg/kg, 对照组; 不同小写字母表示同一时间各实验组之间差异显著(P<0.05) |
如图 6所示, A、B、C三个药物组在红小丑鱼第一片鳃上的刺激隐核虫滋养体数量均显著低于对照组且差异性显著(P<0.05)。各药物处理组至第4 d鱼体鳃上滋养体数量明显下降, 第6 d药物处理组每片鳃上仅有1~2个滋养体, 甚至有的鳃上未观察到滋养体。对照组每片鳃上滋养体数量呈快速上升趋势, 第4 d, 对照组滋养体数量是用药组的14倍左右, 第6 d, 对照组滋养体数量是用药组65倍左右。
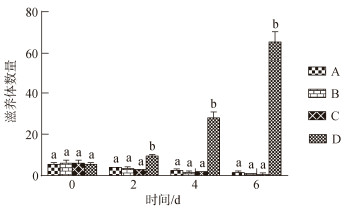 |
| 图 6 各实验组红小丑鱼鳃上滋养体数量 Fig. 6 Number of trophonts in the gill filaments 注: A: XCY-1饲料水平20 mg/kg; B: XCY-1饲料水平20 mg/kg, 药浴浓度50 mg/L; C: XCY-1饲料水平, 20 mg/kg, 药浴浓度100 mg/L; D: XCY-1饲料水平0 mg/kg, 对照组; 不同小写字母表示同一时间各实验组之间差异显著(P<0.05) |
中草药中含有生物碱、有机酸和多糖等多种免疫活性物质, 能够提高动物机体内细胞的吞噬能力、促进机体代谢、提高抗氧化力从而提高机体免疫力[31-33]。
血清中超氧化物歧化酶(SOD)、溶菌酶(LZM)、碱性磷酸酶(AKP)、酸性磷酸酶(ACP)是具有代表性的非特异性免疫酶类, 通过其数值变化可以确定中草药对小丑鱼免疫力的影响。本研究结果表明, 投喂复方中草药XCY-1可使小丑鱼血清中SOD、LZM、AKP、ACP活性显著上升, 投喂7 d后各中草药添加剂组4种酶活力开始上升, 第21 d各项指标达到最高值。这与丁建英等[34]用黄芪、金银花等4种中草药添加剂可显著提高克氏原螯虾血清中的T-SOD、ACP和AKP活力; 李梅芳等[35]研究了投喂中草药可以提高大黄鱼血清中T-SOD和LZM活性; 王广军等[36]报道了复方中草药添加剂可以提高血清中SOD、AKP、LZM等非特异性免疫酶的活性的结论一致。投喂至28 d时各中草药添加剂组4种酶活性并没有持续升高, 反而出现下降, 这说明复方中草药对小丑鱼的免疫效果不会随着添加剂量的增加而不断增强, 过量添加会对机体免疫力产生负向影响[37]。这与崔晓翠等[38]报道的槟榔、川楝子复方中草药连续投喂至28 d时出现免疫疲劳, 酶活力开始下降高度一致。从药物添加量分析, 添加药物浓度为20 g/kg剂量组在各取样点4种酶活力显著高于其他剂量组, 效果最佳。
3.2 复方中草药“XCY-1”对小丑鱼肝脏非特异性免疫指标的影响肝脏中超氧化物歧化酶(SOD)是主要的抗氧化金属酶, 是清除ROS的最关键酶, 间接反映了机体清除氧自由基的能力, 在保护细胞免受氧自由基的毒害中发挥着重要作用[39]。谷胱甘肽过氧化物酶(GSH-PX)是机体内普遍存在的一种催化过氧化氢分解的酶, 保护细胞膜结构、功能的完整性[40-41]。过氧化氢酶(CAT)是一种酶类清除剂, 能清除体内过氧化氢, 避免细胞受其毒害[42]。SOD、GSH-PX和CAT是通过协同完成抗氧化过程的, 对机体的氧化与抗氧化平衡起着重要的作用[43]。本研究结果表明, 实验期间肝脏中SOD、GSH-PX和CAT活力均呈上升趋势且在21 d达到最大值, 说明复方中草药添加剂能够提高小丑鱼体内抗氧化能力, 有助于增强机体对外界刺激的防御能力。这与刘逊等[44]研究复方中草药免疫添加对肝脏中SOD和GSH-PX活力有增强作用; 梁拥军等[45]研究的复方中草药对宝石鲈肝脏中CAT活力有促进作用的结论一致。连续投喂至28 d时, 各中草药添加剂组SOD、GSH-PX和CAT活力在肝脏内开始下降, 但仍高于未添加组且差异性显著, 与血清中非特异性免疫酶活力随着中草药添加剂量的增加出现下降的结果相同, 说明复方中草药添加剂对小丑鱼具有双向调节作用, 只有适量添加才能提高动物机体免疫力。这与孙学亮等[46]报道复方中草药使白点鲑肝脏中T-SOD、CAT活力先升高后下降的结论一致。总抗氧化能力(T-AOC)是衡量对机体体液、细胞、组织酶系统和非酶系统抗氧化能力的综合指标, 其主要作用是分解、清除鱼体代谢过程产生的活性氧自由基[47]。实验表明, 投喂复方中草药添加剂可以显著提高小丑鱼肝脏中T-AOC活力, 这与孙学亮等[46]报道复方中草药可以提高白点鲑、亚东鲑肝脏中T-AOC结论一致。但连续投喂至28 d时, 其活力下降并未持续升高, 这与长期投喂高浓度免疫增强剂使机体产生免疫疲劳现象有关[48-49]。从药物添加量分析, 添加药物浓度为20 g/kg剂量组SOD、GSH-PX、CAT和T-AOC活力在各取样点数据显著高于其他剂量组, 效果最佳。
3.3 复方中草药“XCY-1”对小丑鱼肠道消化酶活性的影响淀粉酶(AMS)、脂肪酶(LPS)、胰蛋白酶是鱼类体内主要的肠道消化酶, 其活性表明鱼体对营养物质的吸收和利用, 是反映鱼体生理机能的重要指标[50]。本研究结果表明, 饲料中添加复方中草药肠道中AMS、LPS和胰蛋白酶活性均高于对照组。第21 d, 添加药物浓度为20 g/kg剂量组上述3种消化酶活性达到最高值。这与孙学亮等[51]、黄景军等[52]研究发现饲料中添加复方中草药能有效促进肠道消化酶活性一致。第28 d, 各浓度药物组胰蛋白酶和LPS活性开始下降, 10 g/kg和20 g/kg药物浓度组AMS活性下降。这与叶建生等[53]研究的中药制剂在凡纳滨对虾肠道中消化酶活性随着添加量的增多呈现先增后降趋势, 且均高于对照组结果一致。从药物添加量分析, 添加药物浓度为20 g/kg剂量组在各取样点胰蛋白酶和AMS活性高于其他剂量组, 添加药物浓度为20 g/kg和40 g/kg剂量组在各取样点LPS活性最高且差异性不显著。因此, 综合肠道消化酶活性指标, 该复方中草药适宜添加浓度为20 g/kg。
3.4 复方中草药“XCY-1”对刺激隐核虫幼虫的体外杀灭效果刺激隐核虫各个阶段虫体对药物敏感性不同, 幼虫最易杀死, 包囊则因为有包囊壁使药物难以渗透进入虫体而难以杀灭[54]。因此在幼虫阶段杀灭虫体, 截断其生活史, 是防止感染发生最好的方法。焦恺强等[55]报道了刺激隐核虫幼虫4 h存活率达97%, 对大黄鱼感染率高达80.6%; 但学明等[29]报道了刺激隐核虫4 h存活率为100%, 4 h后开始死亡, 此时对卵形鲳鲹等鱼的感染率可达51.9%以上。本研究结果表明, 4 h内, 50 mg/L药物浓度即对刺激隐核虫幼虫有一定的杀灭效果, 400 mg/L药物浓度即可杀灭全部幼虫, 当药物浓度达到800 mg/L时, 3 h内幼虫全部死亡, 杀灭效果良好。
3.5 复方中草药“XCY-1”对小丑鱼鳃丝及成活率的影响刘振勇等[56]报道刺激隐核虫滋养体寄生在鳃丝上, 破坏大黄鱼鱼体的呼吸机能导致其窒息死亡, 造成的伤害是致命性的。本实验结果显示, 各药物组鳃丝上滋养体数量一直呈明显下降趋势, 第6 d每片鳃丝上仅有1~2个甚至未观察到滋养体, 各药物组小丑鱼游动、摄食正常, 鳃丝颜色、形状未见异常现象。但对照组每片鳃丝上滋养体数量呈快速上升趋势, 实验结束时, 对照组鳃上滋养体数量增长了10多倍。本实验结果表明, 复方中草药通过口服吸收经血液流动到全身组织器官中, 对虫害起到积极的预防和治疗效果。口服A组与口服加药浴B、C两组之间鳃上刺激隐核虫滋养体数量没有显著差异, 这与崔晓翠[38]报道复方中草药治疗大黄鱼刺激隐核虫病, 口服中草药加药浴与仅口服中草药鳃丝上虫体数目无显著差异结果一致。
4 结论饲料中添加20 g/kg的复方中草药“XCY-1”, 投喂时间14~21 d, 可以提升小丑鱼血清、肝脏非特异性免疫指标和肠道消化酶活性, 对刺激隐核虫病起到积极的预防和治疗效果。
| [1] |
GREEN B S. Embryogenesis and oxygen consumption in benthic egg clutches of a tropical clownfish, Amphiprion melanopus (Pomacentridae)[J]. Comparative Biochemistry and Physiology, Part A, 2004, 138(1): 33-38. DOI:10.1016/j.cbpb.2004.02.014 |
| [2] |
DHANEESH K V, DEVI K N, KUMAR T T A, et al. Breeding, embryonic development and salinity tolerance of Skunk clownfish Amphiprion akallopisos[J]. Journal of King Saud University-Science, 2012, 24(3): 201-209. DOI:10.1016/j.jksus.2011.03.005 |
| [3] |
GORDON A K. The effect of diet and age-at-weaning on growth and survival of clownfish Amphiprion percula (Pisces: Pomacentridae)[D]. Grahamstown: Rhodes University, 1999.
|
| [4] |
MARCIONETTI A, ROSSIER V, BERTRAND J A M, et al. First draft genome of an iconic clownfish species (Amphiprion frenatus)[J]. Molecular Ecology Resources, 2018, 18(5): 1092-1101. DOI:10.1111/1755-0998.12772 |
| [5] |
DIGGLES B K, ADLARD R D. Taxonomic affinities of Cryptocaryon irritans and Ichthyophthirius multifiliis inferred from ribosomal RNA sequence data[J]. Disea ses of Aquatic Organisms, 1995, 22(1): 39-43. |
| [6] |
WRIGHT A D G, COLORNI A. Taxonomic re-assignment of Cryptocaryon irritans, a marine fish parasite[J]. European Journal Protistology, 2002, 37(4): 375-378. DOI:10.1078/0932-4739-00858 |
| [7] |
COLORNI A, BURGESS P. Cryptocaryon irritans Brown 1951, the cause of 'white spot disease' in marine fish: an update[J]. Aquarium Science and Conservation, 1997, 1(4): 217-238. DOI:10.1023/A:1018360323287 |
| [8] |
COLORNII A. Aspects of the biology of Cryptocaryon irritans, and hyposalinity as a control measure in cultured gilthead sea bream Sparus aurata[J]. Diseases of Aquatic Organisms, 1985, 1(1): 19-22. |
| [9] |
CHEUNG P J, NIGRELLI R F, RUGGIERI G D. Studies on cryptocaryoniasis in marine fish: effect of temperature and salinity on the reproductive cycle of Cryptocaryon irritans brown, 1951[J]. Journal of Fish Diseases, 1979, 2(2): 93-97. DOI:10.1111/j.1365-2761.1979.tb00146.x |
| [10] |
COLORNI A, DIAMANT A. Ultrastural featural of Cryptocaryon irritans, a ciliate parasite of marine fish[J]. European Journal of Protistology, 1993, 29(4): 425-434. DOI:10.1016/S0932-4739(11)80405-0 |
| [11] |
苏跃中. 福建省主要养殖区海水网箱养殖鱼类刺激隐核虫病的调查及防控对策[J]. 水产科技情报, 2009, 36(1): 4-7. SU Yuezhong. Investigation and control strategy of Cryptocaryon irritans by marine cage fish in main aquaculture areas of Fujian Province[J]. Aquatic Science and Technology Information, 2009, 36(1): 4-7. DOI:10.3969/j.issn.1001-1994.2009.01.007 |
| [12] |
侯秀琼. 海水网箱养殖鱼类刺激隐核虫病的诊断及防治[J]. 科学养鱼, 2012(2): 59-60. HOU Xiuqiong. Diagnosis and prevention of Cryptocaryon irritans in fish cultured in seawater cages[J]. Science to Breed Fish, 2012(2): 59-60. |
| [13] |
梁前才, 车南吉, 李民, 等. 2009年水东湾网箱鱼类刺激隐核虫病调查初报[J]. 海洋与渔业, 2010(8): 53-54. LIANG Qiancai, CHE Nanji, LI Min, et al. Preliminary report on the investigation of Cryptocaryon irritans in cage fish in Shuidong Bay in 2009[J]. Oceans and Fisheries, 2010(8): 53-54. DOI:10.3969/j.issn.1672-4046.2010.08.022 |
| [14] |
张世义, 伍玉明. 观赏鱼[J]. 生物学通报, 2010, 45(4): 10-12. ZHANG Shiyi, WU Yuming. Ornamental fish[J]. Biology Bulletin, 2010, 45(4): 10-12. DOI:10.3969/j.issn.0006-3193.2010.04.004 |
| [15] |
COLORNI A. Aspects of the biology of Cryptocaryon irritans, and hyposalinity as a control measure in cultured gilthead sea bream Sparus aurata[J]. Diseases of Aquatic Organisms, 1985, 1: 19-22. DOI:10.3354/dao001019 |
| [16] |
郑伟, 闻达. 海水观赏鱼常见疾病的防治方法[J]. 科学养鱼, 2011(9): 48-49. ZHENG Wei, WEN Da. Prevention and control of common diseases of Marine ornamental fish[J]. Science to Breed Fish, 2011(9): 48-49. |
| [17] |
卓琦. 海水观赏鱼的刺激隐核虫病[J]. 中国观赏鱼, 2001(1): 29-31. ZHUO Qi. Cryptocaryon irritans of marine ornamental fish[J]. Chinese Ornamental Fish, 2001(1): 29-31. |
| [18] |
WILKIE D W, GORDIN H. Outbreak of cryptocaryoniasis in marine aquaria at Scripps Institution of Oceanography[J]. California Fish and Game, 1969, 55: 227-236. |
| [19] |
HIRAZAWA N, GOTO T, SHIRASU K. Killing effect of various treatments on the monogenean Heterobothrium okamotoi eggs and oncomiracidia and the ciliate Cryptocaryon irritans cysts and theronts[J]. Aquaculture, 2003, 223(1/4): 1-13. |
| [20] |
COLORNI A. Biology of Cryptocaryon irritans and strategies for its control[J]. Aquaculture, 1987, 67: 236-237. DOI:10.1016/0044-8486(87)90041-X |
| [21] |
GRATZEK J B, GILBERT J P, LOHR A L, et al. Ultraviolet light control of Ichthyophthirius multifiliis Fouquet in a closed fish culture recirculation system[J]. Journal of Fish Diseases, 1983, 6(2): 145-153. DOI:10.1111/j.1365-2761.1983.tb00062.x |
| [22] |
JIANG B, LI Y W, ABDULLAHI A Y, et al. Placematand rotational culturing: a novel method to control control Cryptocaryon irritans infection by removing tomonts[J]. Aquaculture, 2016, 459: 84-88. DOI:10.1016/j.aquaculture.2016.03.028 |
| [23] |
HERWIG N. Notes on the treatment of Cryptocaryon[J]. Drum and Croaker, 1978, 18(1): 6-12. |
| [24] |
LOM J, DYKOVA I. Protozoan parasites of fish[J]. Developments in Aquaculture and Fisheries Science, 1992, 26: 258-259. |
| [25] |
PIRONET F N, JONES J B. Treatments for ectoparasites and diseases in captive Westem Australian dhufish[J]. Aquaculture Interational, 2008, 8(4): 349-361. |
| [26] |
郑晓叶, 刘顺, 周旻曦, 等. 几种理化因子对刺激隐核虫包囊及幼虫活力的影响[J]. 宁波大学学报(理工版), 2015, 28(1): 15-20. ZHENG Xiaoye, LIU Shun, ZHOU Minxi, et al. Influence of environmental factors and chemotherapeutants on Cryptocaryon irritans tomont and theront[J]. Journal of Ningbo Universit(NSEE), 2015, 28(1): 15-20. |
| [27] |
KAWANO F, HIRAZAWA N, GRAVNINGEN K, et al. Antiparasitic effect of dietary Romet 30(SDMX-OMP) against ciliate Cryptocaryon irritans infection in the red sea bream Pagrus major and tiger puffer Takifugu rubripes[J]. Aquaculture, 2012, 344/349: 35-39. DOI:10.1016/j.aquaculture.2012.02.028 |
| [28] |
YOSHINAGA T, IM H J, NISHIDA S, et al. In vitro and in vivoefficacies of ionophores against Cryptocaryon irritans[J]. Aquaculture, 2011, 321(3/4): 167-172. |
| [29] |
但学明. 刺激隐核虫(Cryptocaryon irritans)的传代、保存及刺激隐核虫病的防治研究[D]. 广州: 暨南大学, 2006. DAN Xueming. The propagation, preservation of Cryptocaryon irritans brown 1951, and control of cryptocaryonosis[D]. Guangzhou: Jinan University, 2006. |
| [30] |
徐润林, 江静波, 陈毕生. 刺激隐核虫生活史的光镜观察[J]. 海洋科学, 1992, 16(3): 42-44. XU Runlin, JIANG Jingbo, CHEN Bisheng. Light microscopy observation on the life cycle of the Cryptocaryon irritans[J]. Marine Sciences, 1992, 16(3): 42-44. |
| [31] |
张耀武, 郑建武, 李文辉, 等. 复方中草药制剂对黄颡鱼生长和非特异性免疫功能的影响[J]. 水产科学, 2010, 29(4): 225-228. ZHANG Yaowu, ZHEGN Jianwu, LI Wenhui, et al. Effects of Chinese herbal medicines on growth and nonspecific immunity in yellow catfish Pelteobagrus fulvidraco[J]. Fisheries Science, 2010, 29(4): 225-228. DOI:10.3969/j.issn.1003-1111.2010.04.009 |
| [32] |
AWAD E, AWAAD A. Role of medicinal plants on growth performance and immune status in fish[J]. Fish&Shellfish Immunology, 2017, 67: 40-54. |
| [33] |
ARDÓL, YIN G J, XU P, et al. Chinese herbs (Astragalus membranaceus and Lonicera japonica) and boron enhance the non-specific immune response of Nile tilapia (Oreochromis niloticus) and resistance against Aeromonas hydrophila[J]. Aquaculture, 2008, 275(1/4): 26-33. |
| [34] |
丁建英, 邵菁, 徐建荣, 等. 复方中草药饲料添加剂对克氏原螯虾非特异性免疫功能的影响[J]. 安徽农业科学, 2012, 40(31): 15266-15267, 15270. DING Jianying, SHAO Jing, XU Jianrong, et al. Effect of compound feed additive of Chinese herbal medicine on non-specific immunity function of Procambarus clarkii[J]. Journal of Anhui Anhui Agricultural Sciences, 2012, 40(31): 15266-15267, 15270. DOI:10.3969/j.issn.0517-6611.2012.31.066 |
| [35] |
李梅芳, 张文杰, 毛芝娟, 等. 投喂中草药对大黄鱼几种免疫酶活性的影响[J]. 水产科学, 2014, 35(11): 718-722. LI Meifang, ZHANG Wenjie, MAO Zhijuan, et al. Influence of oral administration of Chinese herbal medicines on activity of several immunity related enzymes from large yellow croaker Pseudosciaena crocea[J]. Fisheries Science, 2014, 35(11): 718-722. DOI:10.3969/j.issn.1003-1111.2014.11.010 |
| [36] |
王广军, 谢骏, 胡隐昌, 等. 中草药添加剂对日本鳗鲡生长和非特异性免疫效应的研究[J]. 淡水渔业, 2008, 38(6): 38-41. WANG Guangjun, XIE Jun, HU Yinchang, et al. Study of Chinese herbal additives on the growth and non- specific immune response of Japanese eel, Anguilla japonica[J]. Freshwater Fisheries, 2008, 38(6): 38-41. DOI:10.3969/j.issn.1000-6907.2008.06.008 |
| [37] |
吕耀平, 程永旭, 吴旭干, 等. 紫苏子提取物对异育银鲫存活、生长以及体生化组成的影响[J]. 水生生物学报, 2008(2): 258-266. LV Yaoping, CHENG Yongxu, WU Xugan, et al. Effects of extractives of perilla seed on survival, growth and body biochemical composition of Carassius Auratus Gibelio[J]. Acta Hydrobiologica Sinica, 2008(2): 258-266. DOI:10.3321/j.issn:1000-3207.2008.02.019 |
| [38] |
崔晓翠, 王印庚, 陈霞, 等. 槟榔、川楝子复方中草药对大黄鱼4种酶活性的影响及对刺激隐核虫的杀灭效果分析[J]. 中国水产科学, 2017, 24(2): 362-373. CUI Xiaocui, WANG Yingeng, CHEN Xia, et al. Effect of a Chinese herbal compound on non-specific immune activities and extermination of parasite Cryptocaryon irritans in Larimichthys crocea[J]. Journal of Fishery Sciences of China, 2017, 24(2): 362-373. |
| [39] |
MCCORD J M. The evolution of free radicals and oxidative stress[J]. Medicine, 2000, 108(8): 652-659. DOI:10.1016/S0002-9343(00)00412-5 |
| [40] |
INGRAHAM L L, MEYER D L. Biochemistry of dioxygen[M]. New York: Plenum Press, 1985: 3-27.
|
| [41] |
PROHASKA J R, GUTSCH D E. Development of glutathione peroxidase activity during dietary and genetic copper deficiency[J]. Biological Trace Element Research, 1983(5): 35-45. |
| [42] |
孙学亮, 郭永军, 季延滨, 等. 3种复方中草药对中华绒螯蟹生长和部分抗氧化指标的影响[J]. 经济动物学报, 2015(2): 86-94. SUN Xueliang, GUO Yongjun, JI Yanbin, et al. Effects of Three Kinds of Compound Chinese Herbal on growth and antioxidative indicators of Eriocheir sinensis[J]. Journal of Economic Animal, 2015(2): 86-94. |
| [43] |
AUST S D, SVINGEN B A. The role of lron in enzymatic lipid peroxidation[J]. Free Radicals in Biology, 1982, 1-28. |
| [44] |
刘逊, 王荻, 卢彤岩, 等. 复方中草药免疫添加剂对史氏鲟生长性能和抗氧化力的影响[J]. 中国农学通报, 2012, 28(14): 130-134. LIU Xun, WANG Di, LU Tongyan, et al. The effects of Chinese Herbal Compound on growth and antioxidant defenses in Amur Sturgeon as immune additive[J]. Chinese Agriculture Science Bulletin, 2012, 28(14): 130-134. |
| [45] |
梁拥军, 孙向军, 孙砚胜, 等. 复方中草药对宝石鲈抗氧化能力及免疫功能的影响[J]. 安徽农业科学, 2009, 37(15): 7026-7029. LIANG Yongjun, SUN Xiangjun, SUN Yansheng, et al. Effect of the compound Chinese herbal medicine on the antioxidant capacity and immune function of Perch[J]. Journal of Anhui Agricultural Sciences, 2009, 37(15): 7026-7029. |
| [46] |
孙学亮, 杨树元, 王耀浒, 等. 复方中草药对山女鳟、白点鲑和亚东鲑肝脏抗氧化及非特异性免疫指标的影响[J]. 饲料研究, 2019, 42(3): 16-20. SUN Xueliang, YANG Shuyuan, WANG Yaohu, et al. Effects of Chinese herbal medicine compounds on antioxidant indices and non-specific immunity of Oncorynchus masou masou, Salvelinus leucomaenisf pipiuvius and Salmo truttafario[J]. Feed Research, 2019, 42(3): 16-20. |
| [47] |
崔惟东, 冷向军, 李小勤, 等. 虾青素和角黄素对虹鳟肌肉着色和肝脏总抗氧化能力的影响[J]. 水产学报, 2009, 33(6): 987-995. CUI Weidong, LENG Xiangjun, LI Xiaoqin, et al. Effects of astaxanthin and canthaxanthin on pigmentation of muscle and total antioxidant capacity of liver in rainbow trout (Oncorhynchus mykiss)[J]. Journal of Fisheries of China, 2009, 33(6): 987-995. |
| [48] |
YOSHIDA T, KRUGER R, INGLIS V. Augmentation of non-specific protection in African catfish, Clarias gariepinus (Burchell), by the long-term oral administration of immunostimulants[J]. Journal of Fish Diseases, 1995, 18: 195-198. |
| [49] |
GANNAM A L, SCHROCK R M. Immunostimulants in fish diets[J]. Journal of Applied Aquaculture, 1999, 9(4): 53-70. |
| [50] |
CAHU C, RONNESTAN I, GRANGIER V, et al. Expression and activities of pancreatic enzymes in developing sea bass larvae (Dicentrarchus labrax) in relation to intact and hydrolyzed dietary protein; involvement of cholecystokinin[J]. Aquaculture, 2004, 238(1): 295-308. |
| [51] |
孙学亮, 杨树元, 陈奇书, 等. 复方中草药对白点鲑和亚东鲑抗氧化、非特异性免疫及消化酶指标的影响[J]. 水产学杂志, 2020, 33(3): 7-12. SUN Xueliang, YANG Shuyuan, CHEN Qishu, et al. Effects of Compound Chinese Herbal Medicine on antioxidant, non-specific immunity and digestive enzyme activity in Salvelinus pluvius and Salmo trutta fario[J]. Chinese Journal of Fisheries, 2020, 33(3): 7-12. |
| [52] |
黄景军, 何琪, 赵会宏, 等. 饲料中添加复方中草药对鞍带石斑鱼生长与消化酶活性的影响[J]. 饲料工业, 2021, 42(4): 53-59. HUANG Jingjun, HE Qi, ZHAO Huihong, et al. Effcet of compound Chinese herbal on growth and digestive enzyme activities of Giant Grouper (E. Lanceolatus)[J]. Siliao Gongye, 2021, 42(4): 53-59. |
| [53] |
叶建生, 马甡, 王兴强, 等. 中草药制剂对凡纳滨对虾生长和消化酶活性的影响[J]. 中国海洋大学学报(自然科学版), 2007, 37(S1): 151-154, 150. YE Jiansheng, MA Shen, WANG Xingqiang, et al. Effects of dietary traditional Chinese medicines on the growth and activities of digestive enzymes of Litopenaeus vannamei[J]. Periodical of Ocean University of China, 2007, 37(S1): 151-154, 150. |
| [54] |
陈达丽, 张其中. 杀灭离体小瓜虫的药物实验[J]. 淡水渔业, 2005, 35(1): 54-55. CHEN Dali, ZHANG Qizhong. Drug experiment for killing the isolated Ichthyophthirius multifiliis[J]. Freshwater Fisheries, 2005, 35(1): 54-55. |
| [55] |
焦恺强, 王印庚, 荣小军, 等. 刺激隐核虫对大黄鱼致病力及中草药抑制其世代繁殖的研究[J]. 水产学报, 2019, 43(5): 1326-1337. JIAO Kaiqiang, WANG Yingeng, RONG Xiaojun, et al. Pathogenicity of Cryptocaryon irritants to Larimichthgs crocea and Chinese herbal inhibition on the parasitic generation reproduction[J]. Journal of Fisheries of China, 2019, 43(5): 1326-1337. |
| [56] |
刘振勇, 谢友佺, 林小金, 等. 福建宁德海水鱼类刺激隐核虫病流行病学的研究[J]. 福建水产, 2014, 36(5): 351-358. LIU Zhenyong, XIE Youquan, LIN Xiaojin, et al. Research on the Cryptocaryoniosis of marine fishes from the perspective of epidemiology in Ningde of Fujian[J]. Journal of Fujian Fisheries, 2014, 36(5): 351-358. |
 2024, Vol. 48
2024, Vol. 48

