
文章信息
- 冯泽斌, 王进京, 范家伟, 刘桂龙, 徐鑫, 许贺, 王春德, 宁军号, 卢霞. 2024.
- FENG Zebin, WANG Jinjing, FAN Jiawei, LIU Guilong, XU Xin, XU He, WANG Chunde, NING Junhao, Lu Xia. 2024.
- Ficolin在毛蚶抗弧菌感染中的作用
- Immune role of Ficolin in Scapharca subcrenata against Vibrio infection
- 海洋科学, 48(2): 43-57
- Marine Sciences, 48(2): 43-57.
- http://dx.doi.org/10.11759/hykx20240119001
-
文章历史
- 收稿日期:2024-01-19
- 修回日期:2024-02-26
2. 中国科学院烟台海岸带研究所, 山东 烟台 264003;
3. 烟台海之春水产种业有限公司, 山东 烟台 264006;
4. 江苏宝源生物科技有限公司, 江苏 连云港 222144;
5. 江苏海泰海洋科技有限公司, 江苏 连云港 222144
2. Yantai Institute of Coastal Zone, Chinese Academy of Sciences, Yantai 264003, China;
3. Yantai Spring-Sea Aquaseed Co., Ltd., Yantai 264006, China;
4. Jiangsu Baoyuan Biotechnology Co., Ltd., Lianyungang 222144, China;
5. Jiangsu Haitai Marine Technology Co., Ltd., Lianyungang 222144, China
纤维胶凝蛋白(Ficolin)是纤维蛋白原相关蛋白家族(Fibrinogen-related protein family, FREP)的重要成员, 是一类进化上保守的蛋白质, 在其C端含有纤维蛋白原样结构域(Fibrinogen-like domain, FBG)[1-2]。FBG结构域由200~250个氨基酸残基构成, 其中包括由24个疏水氨基酸残基构成的恒定区和40个氨基酸残基构成的高度保守区[3]。
迄今, 发现的多种Ficolin家族成员已被证实为参与机体固有免疫的关键分子 [4]。Ficolin可通过补体凝集素途径识别入侵机体的病原体并激活补体系统, 入侵的病原可通过补体介导的细胞裂解途径或其他的细胞免疫反应途径从动物体内清除[3]。Ficolin单体可以通过胶原样结构域之间的交联形成三聚体, 由四个三聚体组装构成的多聚体形式的Ficolin参与甘露糖结合凝集素相关丝氨酸蛋白酶(MBL-associated serine protease, MASP)的激活, 进而对机体的补体凝集素途径实现激活[5], 从而参与宿主细胞的病原体清除过程。此外, Ficolin还具有调理素功能, 能够调控血细胞吞噬能力并参与形成免疫复合物清除入侵的病原体。硏究表明, Ficolin发挥作用的机制与Clq分子和凝集素类似, 通过其球状顶端结构与病原体的糖类位点结合, 从而实现清除并裂解病原生物的功能[6]。Ficolin参与的吞噬作用主要是由其胶原样区介导[6], 并与病原体结合并激活MASP产生C3b、C4b等调理素; 此外, Ficolin还能够直接与吞噬细胞表面的特异性受体结合, 从而有利于对病原体的吞噬与清除[7-8]。
Ficolin广泛存在于哺乳动物的多种组织中。迄今已在人类中发现了3种Ficolin分子, 分别是L-Ficolin、H-Ficolin和M-Ficolin。L-Ficolin与H-Ficolin主要存在于血清中, 而M-Ficolin则主要存在于肺和单核细胞膜表面。H-Ficolin最初在亚急性感染性心内膜炎(Subacute infective endocarditis, SIE)患者的血清中被发现, 在肝脏和肺组织表达并与患者体内的自身抗体产生作用[9]。此外, 研究者在猪和小鼠中均鉴定出2种Ficolin, 分别为Ficolin-A和Ficolin-B。Ficolin-A的mRNA肝脏和脾脏中的表达丰度较高, 它的结构与人的L-Ficolin类似; Ficolin-B则在骨髓和脾脏中的表达丰度较高, 大约有60%的序列与Ficolin-A同源[10]。
近年来, 在真海鞘(Halocynthia roretzi Drasche)、近江牡蛎(Ostrea rivularis Gould)、文昌鱼(Branchiostoma belcheri)、紫海胆(Anthocidaris crassispina)、仿刺参(Apostichopus japonicus)等无脊椎动物和脊索动物体内也陆续证明了Ficolin的存在[11]。从文昌鱼中鉴定的BbFREP可与革兰氏阴性菌和革兰氏阳性菌结合[12]; 在黑腹果蝇(Drosophila melanogaster)中, FREP蛋白参与R8细胞分化侧向抑制剂的编码[13]; 在白腹丛蚊(Armigeres subalbatus)的凝集素中发现, 类似的FREP可与藤黄微球菌(Micrococcus luteus)和大肠杆菌(Escherichia coli)结合[14]; 按蚊(Anopheles sinensis)的FBNs可在宿主的细菌防御和疟原虫入侵中发挥作用[15]; 在甲壳动物中, 首次在淡水小龙虾(Pacifastacus leniusculus)中鉴定出两种FREP样蛋白(PlFico1和PlFico2), 发现这两种Ficolin蛋白参与其体内革兰氏阴性细菌的结合与清除[16]。在对软体动物中, 扇贝中两种FREPs具有明显的模式识别受体(PRR)特性[1, 17], 缢蛏(Sinonovacula constricta)的FREPs可对多种细菌产生凝集反应[18], 香港巨牡蛎(Crassostrea hongkongensis)的FREPs可对大肠杆菌进行凝集并促进其血细胞的吞噬作用[19], 而光滑双脐螺(Biomphalaria glabrata)的FREP可识别从原核生物到真核生物的多种病原, 且其FREP针对不同病原发挥相应的免疫功能[20]。
毛蚶(Scapharca subcrenata)主要分布于东亚地区的中国、日本、朝鲜等潮间带区域。在中国, 毛蚶主要分布于莱州湾、渤海湾、辽东湾等浅海地区, 资源丰富, 是我国及亚洲地区重要的滩涂经济贝类之一[21]。毛蚶肉质鲜美, 含有丰富的蛋白质、维生素等营养成分, 药用和保健价值较高[22]。近年来, 随着海洋污染的加剧, 海水质量呈现逐年恶化的现象, 导致弧菌病等细菌感染疾病频发, 造成毛蚶等蚶科贝类大规模死亡事件屡有发生[23]。科学家针对毛蚶的免疫防御机制已开展了大量研究工作[24-26], 但有关Ficolin基因在毛蚶免疫防御中的作用尚未见报道。
本研究以毛蚶为研究对象, 通过基因克隆技术得到其Ficolin基因的核苷酸序列, 命名为SsFic1, 并利用生物信息学工具分析SsFic1的序列特征。本研究分析了SsFic1基因在雌性和雄性毛蚶的不同组织以及不同胚胎发育时期的表达量差异, 并检测了其在病原菌和不同免疫刺激物刺激后的表达量差异。利用RNA干扰技术抑制毛蚶SsFic1基因的表达, 分析其对其他免疫相关基因表达水平的调控作用以及在副溶血弧菌感染后的免疫功能。本研究的结果可阐明SsFic1基因在毛蚶免疫防御中的作用, 为毛蚶健康养殖和抗病品种的选育提供一定的理论基础。
1 材料与方法 1.1 实验材料毛蚶种贝采自山东东营海域, 置于莱州中培育至性腺自然成熟, 其平均湿质量为8.95±0.69 g (n=30), 实验前将其在适宜条件下暂养10 d。实验所用的副溶血弧菌PL2菌株(Vibrio parahaemolyticus)由青岛农业大学提供。实验中所用的脂多糖(lipopolysaccharide, LPS)和葡聚糖(Glucan, Glu)分别购自上海吉至生物科技有限公司与上海翌圣生物科技股份有限公司。
1.2 毛蚶SsFic1基因克隆通过序列比对, 在毛蚶副溶血弧菌刺激转录组数据中发现1条Unigene序列, 与虾夷扇贝(Patinopecten yessoensis)Ficolin-1序列的相似性为40.67%, 且具有典型的FBG结构域, 因此将其命名为SsFic1。设计SsFic1基因特异性引物SsFic1-F和SsFic1-R扩增SsFic1的编码区(Coding sequence, CDS)片段, SsFic1-F的序列为5′-cgataaggatccgagctcgagATGAACGTTTTCTTATTATTTCAGATATTTC -3′, SsFic1-R的序列为5′-aaacagccaagcttcgaattcTTAATGATTATCTGTACCAAGTTTACGG -3′。使用2×Hieff Canace® Plus PCR Master Mix(With dye)(Yeasen, 上海)高保真酶预混液进行PCR扩增, 反应体系终体积为50 μL, 包括2×Hieff Canace® Plus PCR Master Mix(With dye) 25 μL, SsFic1-F(10 μM)2 μL, SsFic1-R(10 μM)2 μL, cDNA模板2 μL, RNAase-free water 19 μL。PCR反应程序为98 ℃预变性3 min; 33个循环(98 ℃, 10 s; 60 ℃, 20 s; 72 ℃, 30 s); 72 ℃延伸5 min。扩增完成后, 对扩增产物进行1%琼脂糖凝胶电泳, 并将目的片段进行切胶回收, 将回收产物与pBAD/His B质粒进行同源重组并转化至大肠杆菌DH5α感受态细胞。通过菌落PCR实验验证插入目的片段的阳性转化子, 提取阳性转化子质粒并送生工(上海)青岛测序部进行一代测序。
1.3 基因序列分析利用BLAST工具(http://www.ncbi.nlm.nih.gov/BLAST)分析基因的核苷酸与氨基酸序列; 利用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)预测基因的开放阅读框; 利用CD Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白功能结构域; 利用ExPASy(https://www.ncbi.nlm.nih.gov/orffinder/)推测蛋白的理论等电点与相对分子量; 利用ClustalW分析不同物种Ficolin蛋白的序列相似性; 利用MEGA 7软件的邻接法(neighbor-joining, NJ)构建不同物种Ficolin蛋白序列的进化树, 引导值设为1 000。
1.4 SsFic1基因在不同组织、胚胎发育时期以及病原菌和免疫刺激物刺激下的表达模式 1.4.1 毛蚶胚胎及幼虫样品的制备毛蚶种贝采用阴干结合升温海水刺激方法诱导产卵排精并人工授精, 不同发育阶段(卵细胞、四细胞、囊胚、原肠胚、担轮幼虫、D形幼虫)的样品利用0.1 mol/L无菌PBS缓冲溶液洗涤3次, 放入液氮中速冻并置于–80 ℃冰箱保存备用。
1.4.2 毛蚶组织样品的制备选取健康的雌性、雄性成体毛蚶解剖, 分别取其肝胰腺、鳃、血细胞、外套膜、闭壳肌和性腺等组织。毛蚶血细胞样品采集步骤如下: 在无菌的1.5 mL的EP管中加入500 μL提前预冷的抗凝剂, 解剖毛蚶后用一次性无菌注射器吸取血淋巴液500 μL, 4 ℃、2 000 r/min离心5 min后, 加入1 mL 0.1 mol/L无菌PBS缓冲溶液重悬并洗涤3次。所有样品均在液氮中速冻并置于–80 ℃冰箱中保存。
1.4.3 病原菌和免疫刺激物刺激后样品制备免疫刺激物的制备: 将副溶血弧菌于TSB(trypticase soy broth)培养基37 ℃培养12 h至对数生长期, 用无菌的PBS(phosphate buffered saline)缓冲溶液洗涤两次后, 在分光光度计600 nm的波长下测定吸光度值为0.5, 此时菌液浓度约为5×108 cfu/mL, 并将该浓度菌液稀释至1×107 cfu/mL。用分析天平准确称量脂多糖0.1 g置于1.5 mL无菌无酶的EP管中, 加入1 mL 0.1 mol/L无菌PBS缓冲溶液配制成0.1 g/mL的母液, 充分溶解后再将母液稀释100倍至终质量浓度为1 mg/mL。用分析天平准确称量葡聚糖0.1 g置于1.5 mL无菌无酶的EP管中, 加入1 mL 0.1 mol/L的无菌PBS缓冲溶液配制成0.1 g/mL的母液, 充分溶解后再将母液稀释50倍至终质量浓度为2 mg/mL。
选取300枚健康毛蚶随机分成5组, 每组60枚。设置5个处理组, 分别为空白对照组(不作任何处理)、PBS处理组(每枚注射10 μL 0.1 mol/L无菌PBS缓冲溶液)、副溶血弧菌处理组(每枚注射10 μL 1×107 cfu/mL的副溶血弧菌), 脂多糖处理组(每枚注射10 μL 1 mg/mL脂多糖)和葡聚糖处理组(每枚注射10 μL 2 mg/mL葡聚糖)。分别在处理后的0、3、6、12、24、48和72 h随机解剖6枚毛蚶取肝胰腺组织。组织样品均在液氮中速冻并置于–80 ℃冰箱中保存。
1.4.4 总RNA提取与cDNA合成样品的总RNA通过利用TRIeasy总RNA提取试剂盒(Yeasen, 上海)进行提取, RNA样品的完整度通过1.0%琼脂糖凝胶电泳检验, RNA样品的浓度通过Nanodrop 2000(Thermo Scientific, 美国)进行测定。随后, 使用Hifair®Ⅱ 1st Strand cDNA synthesis Supermix反转录试剂盒(Yeasen, 上海)去除RNA中的基因组DNA, 然后将mRNA反转录为cDNA, 置于–20 ℃保存、待用。
1.4.5 实时荧光定量PCR利用实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)检测SsFic1基因在毛蚶的各组织、各胚胎时期及病原菌和不同免疫刺激物刺激后的表达量, 实验中的各组设置5个生物学重复。荧光定量实验所用的基因特异性引物见表 1, 内参基因为18S rRNA。所用试剂盒为Hieff UNICON® Universal Blue qPCR SYBR Master Mix(Yeasen, 上海), SYBR Green І作为荧光染料。荧光定量的反应终体系为20 μL, 包括10 μL Hieff UNICON® Universal Blue qPCR SYBR Master Mix, 0.4 μL的正反向引物(浓度为10 μmol/L), 2 μL稀释的cDNA模板以及7.2 μL ddH2O。实时荧光定量PCR的反应程序为95 ℃, 2 min; 40个循环(95 ℃, 10 s; 55 ℃, 30 s)。利用ABI QuantStudioTM 5仪器进行反应, 基因的相对表达量的计算方法为2–ΔΔCT [27]。
| 基因名称 | 引物序列(5′-3′) |
| 18S(内参) | 正向: CTTTCAAATGTCTGCCCTATCAACT |
| 反向: TCCCGTATTGTTATTTTTCGTCACT | |
| PAF | 正向: ATTGGCATATGAGTCCTAGACAC |
| 反向: AACATCAATATCCCATTGCCTCC | |
| LYZ | 正向: CAAAGATCCTCCAGGGCTACCAC |
| 反向: TCTGGATGTCGTCCTTTAGACTGC | |
| Dscam | 正向: TGGCGACATACAGTAAAACTCCC |
| 反向: TGTAATTAGCAGCATCACTACCG | |
| Fic1 | 正向: ATTCACCTACTAGCCAGCAA |
| 反向: ATATACAGCCTCTCTGCTCAC | |
| Fic2 | 正向: TGGCATATCACAAAGGATTCCAG |
| 反向: GTGACAGTGCCTATACCACCA | |
| Fic3 | 正向: GCAACAAAACTGAGAGACCGAT |
| 反向: TATTACAGTCCATCCACCTCCG | |
| C1q2 | 正向: ACATGAATATGAGCCTTTATCCCAA |
| 反向: GCGACAATGATCTAAAGGACAAGC | |
| C1qDC | 正向: ATGACTAAAGGGTCACCATCAAATG |
| 反向: AGACACCACTGAAATACGAAACTCC | |
| CD109 | 正向: TACACAGGATACCGTTATTGCT |
| 反向: AGTTTGTTTCCGTTATCTATAGACA | |
| TEP | 正向: TTACAAATGTTACGTATGGCAGT |
| 反向: AAGGAATTGTCATTATAGCCCAA | |
| Complement C3 | 正向: ATCATTTTCACAGTTAGTGCAAG |
| 反向: TTTCAGGTAAAATGATGCCGTTC |
T7启动子RNA干扰转录试剂盒(Vazyme, 南京)用于合成与纯化实验中所用的小干扰RNA(small interfering RNA, siRNA)。利用特异性siRNA(序列为: 5′-AAGACGCGATGGCATATATAC-3′)抑制SsFic1基因的表达。将上述特异性siRNA序列随机打乱顺序, 获得阴性对照序列(5′-TATATACCGATGGCAAAGACG-3′)。合成后的siRNAs利用1%的琼脂糖凝胶电泳以及Nanodrop 2000(Thermo Scientific, 美国)检测其完整性及其浓度。
1.5.2 SsFic1基因干扰后的样品制备选取180枚健康毛蚶随机分成空白组、对照组和实验组, 每组60枚。分别注射5 μL SsFic1-random-siRNA(阴性对照组)和SsFic1-siRNA(RNAi实验组)至毛蚶体腔内(注射剂量为2 μg/g体质量), 空白组不作任何处理。分别在注射后的12、24、48、72 h, 每组随机选取5枚毛蚶, 进行肝胰腺和血细胞组织取样。组织样品均在液氮中速冻并置于–80 ℃冰箱中保存。
1.5.3 敲降SsFic1基因表达对免疫相关基因表达的影响抑制SsFic1基因表达后, 选取干扰效果最好的时间点取样, 通过实时荧光定量PCR技术检测免疫相关基因的表达情况, 这些基因包括溶菌酶(lysozyme, LYZ), 酚氧化酶原激活因子(Phenoloxidase-activating factor, PAF), 唐氏综合症细胞黏附分子(down syndrome cell adhesion molecule, Dscam), 补体相关基因(C1q2、C1qDC、C3), 补体C3样分子(硫酯蛋白Thioestercontaining protein, TEP、CD109)以及Ficolin的同源基因(SsFic2, SsFic3)。
1.5.4 SsFic1基因干扰对免疫和抗氧化相关酶活力的影响抑制SsFic1基因表达后, 选取干扰效果最好的时间点的血淋巴样品进行酶活力的测定, 酶活力测定的样品分为阴性对照组(注射SsFic1-random- siRNA)和RNAi实验组(注射SsFic1-siRNA), 所测定的酶活力的种类包括溶菌酶(Lysozyme, LYZ)、酚氧化酶(Phenoloxidase, PO)、过氧化氢酶(Catalase, CAT)和超氧化物歧化酶(Superoxide dismutase, SOD)。溶菌酶和酚氧化酶检测试剂盒从上海原鑫生物科技有限公司购买, 过氧化氢酶检测试剂盒则购自于南京建成生物工程研究所, 超氧化物歧化酶检测试剂盒购自于上海碧云天生物技术有限公司。按照试剂盒说明书的操作步骤进行各种酶活测定。
1.5.5 SsFic1基因干扰对毛蚶的血细胞活性的影响选取150枚健康毛蚶随机分成2组, 每组75枚, 分为对照组(每枚注射5 μL SsFic1-random-siRNA)和RNAi实验组(每枚注射5 μL SsFic1-siRNA), 注射后的毛蚶放在相同的养殖条件下的养殖槽中暂养。在注射后24 h, 向养殖水体中加入副溶血弧菌, 使胁迫的终浓度为1×107 cfu/ mL。在加入弧菌后的0、3、6、12、24 h, 分别从对照组和实验组中随机选取3枚毛蚶采集血细胞。血细胞样品采集步骤如下: 在无菌的1.5 mL的EP管中加入500 μL提前预冷的抗凝剂, 解剖毛蚶后用一次性无菌注射器吸取血淋巴液500 μL, 4 ℃、2 000 rpm离心5 min后, 加入1 mL 0.1 mol/L无菌PBS缓冲溶液重悬并洗涤3次后用300目筛绢过滤, 制成血细胞悬液, 并进行血细胞数目、凋亡以及吞噬活力的检测。
血细胞凋亡率的检测: 利用细胞凋亡检测试剂盒(碧云天, 上海)检测毛蚶血细胞凋亡率。取200 μL血细胞悬液, 4 ℃、1 000 r/min离心10 min, 弃上清, 加入5 μL Annexin V-FITC、10 μL碘化丙啶(PI)染色液和195 μL Annexin V-FITC结合液, 用移液枪轻轻吹打混匀, 室温下避光孵育15 min。孵育结束后, 将待测样品置于冰上, 用流式细胞仪(BECKMAN COULTER, 美国)检测血细胞凋亡情况。实验设置阴性对照组(不添加染料)、FITC单染组以及PI单染组来确定荧光染料染色的阴性范围。血细胞凋亡率以FITC染色阳性细胞的数目占所检测细胞数量的百分比来表示。
血细胞吞噬活力的检测: 实验中的每个样品均设置实验组和对照组, 实验组中向200 μL的血细胞悬液中加入50 μL 2%的荧光微球(YG 1.0 μm, Polyscience, 美国)稀释液混匀, 对照组中则加入50 μL 0.1mol/L无菌PBS缓冲溶液混匀, 在室温下避光孵育1 h。将10 μL 37%福尔马林溶液(上海吉至生化有限公司)加入至上述孵育后的样品中轻轻混匀, 使反应终止。样品在提前预冷好的4 ℃冷冻离心机中以1 000 r/min的转速离心10 min, 弃上清, 加入200 μL 0.1 mol/L无菌PBS缓冲溶液, 重悬血细胞, 并通过流式细胞仪检测其吞噬活力。
血细胞计数的具体操作如下: 取1 μL 10 000×的SYBR Green І荧光染料(Biosharp, 合肥), 加入999 μL 0.1 mol/L无菌PBS缓冲溶液配制成10×的SYBR Green І染色工作液。实验中的每个样品均设置实验组和对照组, 实验组中向200 μL的血细胞悬液中加入20 μL SYBR Green І染色工作液, 对照组中则向200 μL的血细胞悬液中加入20 μL 0.1mol/L无菌PBS缓冲溶液, 用移液枪轻轻吹打均匀, 室温避光孵育1 h, 孵育完成后用流式细胞仪中的FL-1通道检测。根据未加染色工作液的对照组以确定各样品的SYBR Green І染色的阴性范围, 然后对各样品的SYBR Green І染色的阳性范围进行计数, 最后通过设置流式细胞仪的血细胞染色液的进样体积为50 μL计算各样品的血细胞数目。
1.5.6 敲降SsFic1基因表达后弧菌胁迫对毛蚶存活率的影响选取270枚健康毛蚶随机分成3组, 每组90枚, 分别为空白组(每枚注射5 μL 0.1 mol/L无菌PBS缓冲溶液)、阴性对照组(每枚注射5 μL SsFic1-random- siRNA)和RNAi实验组(每枚注射5 μL SsFic1- siRNA), 每组设置3个平行, 每个平行30枚毛蚶。在注射后的24 h, 将对照组和实验的毛蚶置于含有浓度为1×107 cfu/mL的副溶血弧菌的海水中充气养殖, 空白组毛蚶置于不含有副溶血弧菌的正常海水中养殖, 海水水温为25 ℃, 每隔12 h统计3个处理组中毛蚶的死亡个数。
1.6 数据分析利用IBM SPSS Statistics 23对实验数据进行统计分析, 组间的差异显著性利用单因素方差(one-way ANOVA)和Duncan’s法进行分析, 当P<0.05时, 表明数据之间具有显著差异, 用字母标记法代表不同处理之间的差异显著性, 用星号*标记两个处理组之间的显著性。
2 结果 2.1 毛蚶SsFic1基因的克隆和序列分析毛蚶SsFic1基因的序列特征如图 1所示, 利用PCR和同源克隆技术得到SsFic1基因的CDS长度为897 bp, 编码氨基酸数目为298个。SsFic1推测蛋白的信号肽为第1~19位氨基酸, Coiled coil结构域为第53~90个氨基酸, FBG结构域为第84~255个氨基酸, 预测蛋白相对分子量为29.64 kDa, 理论等电点为4.88, SsFic1蛋白的钙离子结合位点为241位与244位氨基酸残基处。
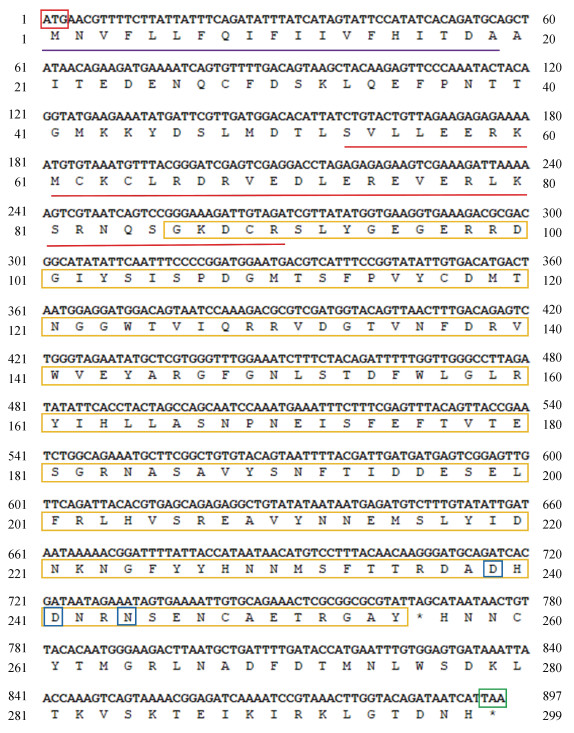 |
| 图 1 毛蚶SsFic1基因核苷酸序列与预测的氨基酸序列 Fig. 1 Nucleotide and deduced amino acid sequences of SsFic1 SsFic1的起始密码子(ATG)与终止密码子(TAA)分别用红色与绿色方框标出, 信号肽和Colied coil结构域分别用紫色和红色下划线标出, FBG结构域用黄色方框标出, 钙离子结合位点用蓝色方框标出 |
毛蚶SsFic1基因的保守结构域多序列比对与系统进化分析如图 2所示。比对结果发现毛蚶的SsFic1与杂色蛤(Ruditapes philippinarum)和长牡蛎(Crassostrea gigas)的FBG结构域相似度较高, 分别为44.19%和42.94%, 而与人(Homo sapiens)的相似度最低, 仅为34.5%。
 |
| 图 2 SsFic1的多序列比对 Fig. 2 Multiple sequence alignment of SsFic1 Ficolin蛋白序列的物种拉丁名及其序列登录号如下: 小鼠(Mus musculus, NP_032021.1), 斑马鱼(Danio rerio, XP_021330110.1), 萼柱珊瑚(Stylophora pistillata, PFX17164.1), 海葵(Exaiptasia diaphana, KXJ24541.1), 长牡蛎(C. gigas, ANH09330.1), 玉足海参(Holothuria leucospilota, KAJ8047558.1), 人(H. sapiens, XP_047277533.1), 杂色蛤(Ruditapes philippinarum, XP_060565429.1), 缢蛏(S. constricta, UBR18753.1) |
Ficolin基因的系统进化树如图 3所示。由图 3可见系统进化树可明显分为脊椎动物分支与无脊椎动物分支, 毛蚶的SsFic1蛋白首先与虾夷扇贝(M. yessoensis)的Ficolin蛋白聚在一起, 再与砂海螂(Mya arenaria)、硬壳蛤(Mercenaria mercenaria)、缢蛏等双壳贝类聚为一支, 最后与其他物种的Ficolin蛋白聚为一个大分支, 这一结果显示SsFic1在系统进化上的关系与物种分类地位具有一致性。
 |
| 图 3 不同物种的Ficolin蛋白的进化树 Fig. 3 Phylogenetic tree of ficolin in different species 物种中文名与拉丁文名对应如下: 小鼠(M. musculus), 人(H. sapiens), 红腹铃蟾(Bombina bombina), 玉米锦蛇(Pantherophis guttatus), 紫贻贝(Mytilus galloprovincialis), 海葵(Exaiptasia diaphana), 南海软珊瑚(Dendronephthya gigantea), 杯状珊瑚(Pocillopora verrucosa), 杂色蛤(R. philippinarum), 毛蚶(S. subcrenata), 虾夷扇贝(M. yessoensis), 砂海螂(Mya arenaria), 硬壳蛤(Mercenaria mercenaria), 缢蛏(S. constricta) |
SsFic1基因在毛蚶各组织中的表达量如图 4a所示, 该基因在毛蚶的各组织中分布广泛, 肝胰腺和鳃中的表达丰度较高。通过比较SsFic1基因在雄性和雌性毛蚶不同组织中的表达量发现, 雄性毛蚶在肝胰腺中的表达量显著高于雌性, 而在血细胞中的表达量则无显著差异, 在检测的其他组织中, SsFic1基因在雌性毛蚶中的表达量均显著高于雄性。
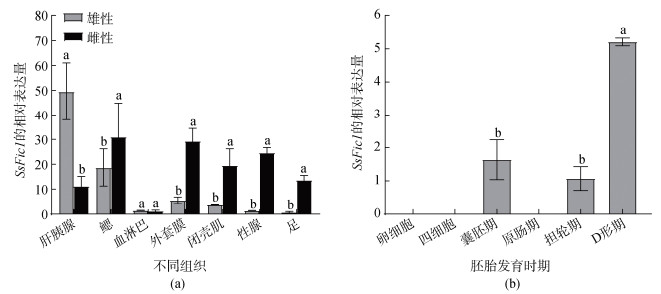 |
| 图 4 SsFic1在毛蚶不同组织中(a)和不同胚胎发育时期(b)的相对表达量 Fig. 4 Relative expression levels of SsFic1 in different tissues (a) and at different developmental stages (b) |
毛蚶SsFic1基因在不同胚胎发育时期的表达量如图 4b所示, 该基因未检测到在卵细胞和四细胞期表达, 随着胚胎发育的进行, 在囊胚期、担轮期以及D形幼虫期检测到SsFic1基因的表达, 其中D形幼虫期的表达量最高, 且D形幼虫期的表达量显著高于囊胚期和担轮期(P<0.05)。
2.4 毛蚶SsFic1基因在病原菌和不同免疫刺激物刺激下的表达分析毛蚶SsFic1基因在副溶血弧菌胁迫下的表达如图 5a所示。副溶血弧菌刺激后, SsFic1基因的表达呈先下降再升高, 然后再下降的趋势。在弧菌刺激后12 h, SsFic1基因的表达量达到最高值且均显著高于对照组(P<0.05)。SsFic1基因在脂多糖刺激下的表达如图 5b所示。SsFic1基因的表达呈先升高再急剧下降的趋势。在刺激后的12 h, 脂多糖处理组中SsFic1基因的表达量达到最高水平并显著高于对照组, 而在72 h的表达量则显著低于对照组(P<0.05)。SsFic1基因在葡聚糖刺激下的表达如图 5c所示。SsFic1基因的表达呈先升高再急剧下降的趋势。在刺激后的12 h, 脂多糖处理组中SsFic1基因的表达量最高并显著高于对照组(P<0.05)。
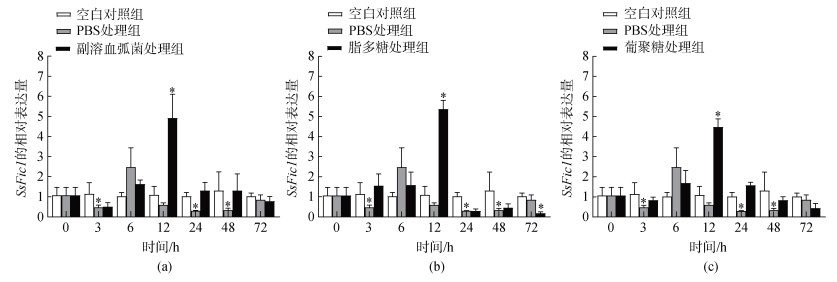 |
| 图 5 SsFic1在副溶血弧菌(a)、脂多糖(b)、葡聚糖(c)刺激后的相对表达量 Fig. 5 Relative expression levels of SsFic1 after stimulation by Vibrio parahaemolyticus (a), LPS (b), and glucan (c) |
毛蚶SsFic1-siRNA基因的干扰效率见图 6所示。RNA干扰后, SsFic1基因的表达量呈现先升高再显著降低, 然后恢复至正常水平的现象。与阴性对照组相比, 在RNAi实验组处理后的72 h具有显著干扰效果, 干扰效率达到77.7 %。
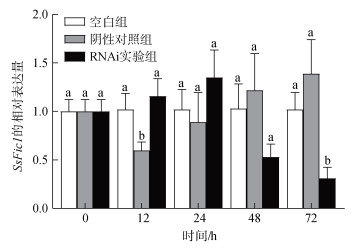 |
| 图 6 SsFic1-siRNA注射后SsFic1的相对表达量 Fig. 6 Relative expression levels of SsFic1 after SsFic1- siRNA injection |
抑制SsFic1基因表达后对免疫相关基因表达的影响如图 7所示。RNAi实验组中PAF、C1qDC、Complement C3、Fic3基因的表达水平显著低于阴性对照组(P<0.05), 而TEP、C1q2、Fic2基因的表达水平与阴性对照组相比显著上调(P<0.05), Dscam、LYZ、CD109基因的表达量与阴性对照组相比无显著差异。
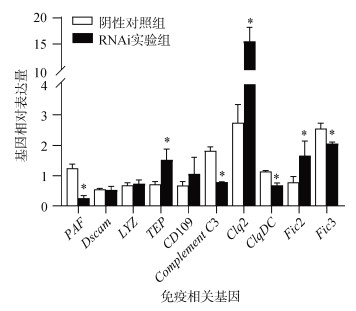 |
| 图 7 SsFic1-siRNA干扰后其他免疫相关基因的相对表达量 Fig. 7 Relative expression levels of other immune-related genes after the injection of SsFic1-siRNA |
抑制SsFic1基因表达后对过氧化氢酶、超氧化物歧化酶、溶菌酶和酚氧化酶活力的影响如图 8所示, RNAi实验组的CAT、SOD和PO酶活力均显著低于阴性对照组(P<0.05), 而两个处理组间的LYZ酶活力则无显著差异。
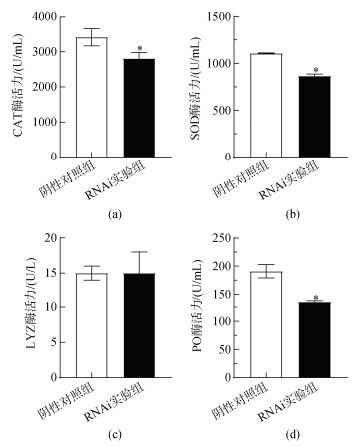 |
| 图 8 SsFic1-siRNA干扰后对过氧化氢酶(a)、超氧化物歧化酶(b)、溶菌酶(c)和酚氧化酶(d)活力的影响 Fig. 8 Effects of SsFic1-siRNA on the enzyme activity of CAT (a), SOD (b), LYZ(c), and PO (d) |
弧菌胁迫对SsFic1基因干扰对毛蚶的血细胞数目、凋亡以及吞噬活力与累计存活率的影响如图 9所示, 在副溶血弧菌胁迫后0、6和24 h, 实验组毛蚶的血细胞凋亡率与对照组相比显著升高。在攻毒后0、3和12 h, 实验组毛蚶的血细胞凋亡率显著低于对照组。在攻毒后0、3和24 h, 实验组毛蚶的血细胞数目显著少于对照组(P<0.05)。在副溶血弧菌攻毒12 h后的各个时间点, 实验组毛蚶的累计存活率与对照组相比均显著降低。在攻毒后的48 h, 实验组有超过50%以上的个体死亡; 在攻毒后的84 h, 实验组的累计存活率为0%, 而对照组的累计存活率为34.44%。
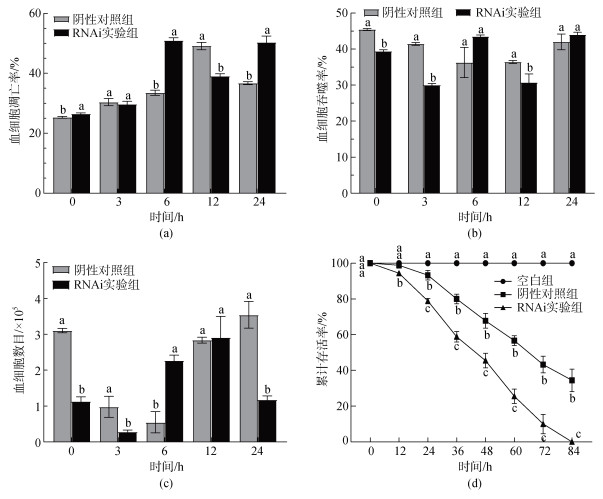 |
| 图 9 SsFic1-siRNA干扰对弧菌攻毒后毛蚶的血细胞凋亡、血细胞吞噬活力、血细胞数目和累计存活率的影响 Fig. 9 Effects of SsFic1-siRNA on apoptotic rates (a), phagocytic activity (b), counts of hemocytes (c), and cumulative survival rates (d) of blood clams challenged with Vibrio parahaemolyticus |
越来越多的研究发现, Ficolin基因在无脊椎动物的固有免疫中发挥重要作用, 可作为模式识别受体识别多种病原体并介导病原清除[28-31]。本研究从毛蚶中克隆获得一条新的Ficolin基因(命名为SsFic1), 其预测蛋白序列C端是保守的FBG结构域, 且其N端含有Coiled coil结构域, 但却少了类似脊椎动Ficolin蛋白的胶原(collagen)结构域, 这与一些甲壳动物中报道的Ficolin蛋白结构一致[28, 31], 但牡蛎Ficolin蛋白中未发现Coiled coil结构域[32]。多序列比对结果表明该基因编码的蛋白质较为保守, 与脊椎动物与无脊椎动物中Ficolin蛋白序列结构上具有高度相似性, 甚至有文献推测三疣梭子蟹Ficolin蛋白Coiled coil结构域与脊椎动物Ficolin蛋白胶原结构域类似[28]。此外, 系统进化分析表明, SsFic1与虾夷扇贝的Ficolin在进化上的关系最近, 然后与其他贝类及软体动物具有一定的进化关系。这些结果表明SsFic1是软体动物Ficolin家族的新成员。
本研究中, SsFic1基因的mRNA在以上各组织中均能被检测到, 且表达量较高的组织为肝胰腺和鳃。这一结果与在牡蛎[32]和中华绒螯蟹(Eriocheir sinensis)[31]中报道的结果一致, 表明Ficolin基因在无脊椎动物固有免疫中发挥重要作用。通常免疫基因在血细胞中表达水平较高, 但本研究中SsFic1在血细胞中的表达最低, 在凡纳滨对虾(Litopenaeus vannamei)[33]和罗氏沼虾(Macrobrachium rosenbergii)[34]的研究中也发现了类似的情况。但也有研究发现, Ficolin基因只在斑节对虾(Penaeus monodon)的肠中特异性表达[29]。SsFic1在毛蚶组织中的表达具有性别差异, 雄性毛蚶SsFic1在肝胰腺的表达水平显著高于雌性, 而在其他组织中则趋势相反。这与母源性免疫基因在三疣梭子蟹(Portunus trituberculatus)卵巢中的表达显著高于精巢的结果相似[35]。然而, 本研究的结果表明SsFic1不是母源性免疫基因, 因为该基因在毛蚶卵细胞和四细胞等胚胎发育早期均未检测到, 待毛蚶合子基因组激活后, 我们在囊胚期发现了SsFic1基因的表达。有研究表明, 在胚胎发育早期, 母源性基因的mRNAs随着发育的进行而被消耗, 当合子基因组被激活后, 其表达量显著上升[36-37]。
已有研究报道, 无脊椎动物Ficolin基因在病原微生物刺激后在短时间内显著上调[31-32], 本研究中, SsFic1基因副溶血弧菌刺激后3 h出现下调趋势, 推测该基因转录产物在清除体内病原微生物时消耗所致。Ficolin基因这种短时间内的下调在对日本沼虾(Macrobrachium nipponense)[30]和三疣梭子蟹[28]的研究中均有发现。随后, SsFic1基因表达量呈先升高后降低的表达模式, 这符合典型免疫基因清除病原微生物期间的表达趋势[30-31, 38-39], 表明SsFic1基因在毛蚶抵御病原感染中发挥了显著作用。此外, 经脂多糖和葡聚糖刺激后, 毛蚶SsFic1基因均呈现先升高后降低的表达模式, 提示该基因具有广谱抗菌作用。因为作为模式识别受体, Ficolin蛋白不但能特异性结合多种病原微生物[28-31], 而且可与脂多糖和葡聚糖等病原相关模式识别分子特异性结合[28], 进而发生抑菌和凝集反应。
已有报道表明, Ficolin在高等动物中与MBL的功能相似, 可通过识别病原表面的多糖激活补体凝集素途径, 进而促进血细胞对病原的吞噬、凝集和裂解[40]。在无脊椎动物中的研究发现, Ficolin作为模式识别受体或补体激活凝集素可显著促进血细胞的吞噬作用[28, 31, 32]。本研究中, 敲降SsFic1基因表达后补体C3基因显著下调表达, 血细胞对病原体的吞噬作用显著降低, 推测SsFic1基因对毛蚶血细胞吞噬功能的调节作用可能通过调控补体系统来实现的。此结果与该基因在三疣梭子蟹中的研究结果类似, 当Ficolin基因的表达受到抑制后, 补体C3样基因(alpha-2 macroglobulin, TEP)的mRNA转录水平下调, 血细胞的吞噬作用减弱[28]。然而, 当毛蚶的SsFic1基因的mRNA表达量下降时, 补体C3样基因(TEP)的表达量显著上调, 说明毛蚶中补体C3样同源基因发挥不同功能。与本研究结果相似, 敲降三疣梭子蟹TEP基因后2个alpha-2 macroglobulin基因表达均显著下降[41], 而毛蚶Ficolin分子与补体C3样分子之间调控关系有待深入研究。
病原感染将导致动物体内活性氧的不断积累, 而此时机体的抗氧化防御系统会发挥关键作用, 例如超氧化物歧化酶(SOD)催化超氧阴离子自由基转变为过氧化氢(H2O2)和氧气, 而后过氧化氢酶(CAT)将H2O2催化为水和氧气, 从而维持机体生理功能平衡[42-43]。本研究中, 敲降SsFic1基因的表达后, 毛蚶血淋巴中SOD和CAT活力均显著低于对照组, 说明该基因可能参与了毛蚶的抗氧化防御系统。溶菌酶作为一种广谱抗菌的免疫因子, 在机体不同组织中广泛分布[44]。本研究中, 敲降SsFic1基因表达后溶菌酶基因LYZ未出现显著变化, 溶菌酶的活力与对照组无显著差异。但对三疣梭子蟹的研究发现, 敲降TEP基因表达后溶菌酶LYZ基因显著下调[41], 这可能是物种、基因和处理条件等差异引起的。
本研究中, 敲降SsFic1基因后酚氧化酶激活因子PAF基因表达量和酚氧化酶活力均显著下调表达, 相似的研究结果也在三疣梭子蟹中报道[28], 表明无脊椎动物的Ficolin分子可能是酚氧化酶原激活系统的调控因子之一。此外, 敲降三疣梭子蟹TEP基因, 酚氧化酶激活因子(PAF)和酚氧化酶原基因(proPO)的表达量均显著上调[41], 这与本研究结果互为支撑, 说明无脊椎动物的补体系统和酚氧化酶原激活系统之间存在紧密联系。因此, 本研究进一步分析了Ficolin同源基因之间及其与补体样分子C1qDC之间的相互作用。结果显示, 敲降SsFic1基因后毛蚶SsC1qDC和SsFic3基因的表达显著下调, 而SsC1q2和SsFic2基因的表达显著上调, 说明作为模式识别受体和抗菌效应分子, Ficolin和C1qDC同源基因在参与免疫反应时存在补偿作用。与本研究结果相似, 敲降日本沼虾MnFico1和MnFico2均能显著降低抗菌肽基因的表达[38], 在三疣梭子蟹的研究中也发现了类似结果[28]。
细胞凋亡是生物体中一种重要的生理保护机制, 可通过外界刺激包括病原体侵染而激活凋亡通路, 使机体中被病原体感染以及损伤的细胞被清除[45]。本研究发现, 毛蚶的血细胞凋亡率在SsFic1基因的表达被抑制且遭受副溶血弧菌感染后显著提升, 而血细胞数目则显著减少, 进而导致血细胞吞噬活力显著下降。这与我们近期研究结果相一致, 敲降毛蚶补体样激活因子C1qDC基因表达且感染副溶血弧菌后, 毛蚶血细胞凋亡水平显著升高, 而血细胞数量和吞噬活力显著下降[46], 说明毛蚶补体样激活因子Ficolin和C1qDC既能作为模式识别受体启动多种免疫通路清除病原, 又能作为免疫效应分子或抗菌肽发挥免疫功能。然而, 使用siRNA敲降SsFic1基因的实验结果表明, 在外界胁迫下, SsFic1基因的表达量下降导致毛蚶对副溶血弧菌胁迫的耐受性降低, 最终导致存活率显著下降, 而在其他的研究中也有相应的例证[43], 说明SsFic1基因具有重要的免疫保护功能, 有利于毛蚶抵御副溶血弧菌的感染。
4 结论综上, 本研究在毛蚶中克隆获得一条含有FBG和Coiled-coil结构域的Ficolin序列, 该基因在毛蚶的肝胰腺和鳃等主要免疫组织高表达, 但在卵细胞和4细胞期未检测到, 说明该基因不是母源性免疫基因。在副溶血弧菌、脂多糖和葡聚糖刺激下, 均能诱导SsFic1基因高表达。利用RNAi技术敲降SsFic1基因表达, 酚氧化酶原激活和补体相关基因的表达显著变化, SOD、CAT和PO等酶活力显著下降。同时, 敲降SsFic1基因使毛蚶对副溶血弧菌胁迫更加敏感, 导致毛蚶死亡率和血细胞凋亡率显著升高, 而血细胞数量和吞噬活力下降。结果表明, SsFic1基因可能是毛蚶免疫防御反应中的重要免疫效应分子, 参与毛蚶抵御副溶血弧菌胁迫的免疫过程。
| [1] |
DONG Y M, DIMOPOULOS G. Anopheles fibrinogen- related proteins provide expanded pattern recognition capacity against bacteria and malaria parasites[J]. The Journal of Biological Chemistry, 2009, 284(15): 9835-9844. DOI:10.1074/jbc.M807084200 |
| [2] |
ADEMA C M, HERTEL L A, MILLER R D, et al. A family of fibrinogen-related proteins that precipitates parasite-derived molecules is produced by an invertebrate after infection[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(16): 8691-8696. |
| [3] |
VALERIA L R, WILHELM S, DANIELA N M. Ficolins: Novel pattern recognition molecules of the innate immune response[J]. Immunobiology, 2007, 213(3): 297-306. |
| [4] |
MATSUSHITA M, ENDO Y, TAIRA S, et al. A novel human serum lectin with collagen- and fibrinogen-like domains that functions as an opsonin[J]. The Journal of Biological Chemistry, 1996, 271(5): 2448-2454. DOI:10.1074/jbc.271.5.2448 |
| [5] |
ENDO Y, MATSUSHITA M, FUJITA T. Role of Ficolin in innate immunity and its molecular basis[J]. Immunobiology, 2007, 212(4/5): 371-379. |
| [6] |
乔滨, 熊思东. 糖类模式识别分子纤维胶凝蛋白与补体凝集素活化途径[J]. 生命的化学, 2003, 5: 358-361. QIAO Bin, XIONG Sidong. Carbohydrate pattern recognition molecules, fiber binding proteins, and complement lectin activation pathways[J]. Chemistry of Life, 2003, 5: 358-361. DOI:10.3969/j.issn.1000-1336.2003.05.015 |
| [7] |
陈勰, 陈海冰. 纤维蛋白胶凝素-3研究进展[J]. 中国临床保健杂志, 2011, 14(2): 213-216. CHEN Xie, CHEN Haibing. Research progress on fibrinogen binding protein-3[J]. Chinese Journal of Clinical Health, 2011, 14(2): 213-216. DOI:10.3969/J.issn.1672-6790.2011.02.040 |
| [8] |
MATSUSHITA M, FUJITA T. Cleavage of the third component of complement C3 by mannose-binding protein-associated serine protease (MASP) with subsequent complement activation[J]. Immunobiology, 1995, 194: 443-448. DOI:10.1016/S0171-2985(11)80110-5 |
| [9] |
MATSUSHITA M, ENDO Y, FUJITA T. Complement activation complex of Ficolin and mannose-binding lectin associated serine protease[J]. Immunology, 2000, 164: 2281-2284. |
| [10] |
ENDO Y, MATSUSHITA M, FUJITA T. The role of Ficolins in the lectin pathway of innate immunity[J]. International Journal of Biochemistry and Cell Biology, 2011, 43(5): 705-712. DOI:10.1016/j.biocel.2011.02.003 |
| [11] |
彭茂潇, 牛东红, 李家乐. 海洋无脊椎动物补体系统研究进展[J]. 海洋渔业, 2016, 38(3): 320-328. PENG Maoxiao, NIU Donghong, LI Jiale. Research progress on complement systems in marine invertebrates[J]. Marine Fisheries, 2016, 38(3): 320-328. DOI:10.3969/j.issn.1004-2490.2016.03.012 |
| [12] |
FAN C X, ZHANG S C, LI L, et al. Fibrinogen-related protein from amphioxus Branchiostoma belcheri is a multivalent pattern recognition receptor with a bacteriolytic activity[J]. Molecular Immunology, 2008, 45(12): 3338-3346. DOI:10.1016/j.molimm.2008.04.019 |
| [13] |
BAKER N E, MLODZIK M, RUBIN G M. Spacing differentiation in the developing Drosophila eye: a fibrinogen-related lateral inhibitor encoded by scabrous[J]. Science, 1990, 250(4986): 1370-1377. DOI:10.1126/science.2175046 |
| [14] |
WANG X, ROCHELEAU T A, FUCHS J F, et al. A novel lectin with a fibrinogen-like domain and its potential involvement in the innate immune response of Armigeres subalbatus against bacteria[J]. Insect Molecular Biology, 2004, 13(3): 273-282. DOI:10.1111/j.0962-1075.2004.00484.x |
| [15] |
WU C L, SÖDERHÄLL K, SÖDERHÄLL I. Two novel Ficolin-like proteins act as pattern recognition receptors for invading pathogens in the freshwater crayfish Pacifastacus leniusculus[J]. Proteomics, 2011, 11(11): 2249-2264. DOI:10.1002/pmic.201000728 |
| [16] |
YANG C Y, WANG L L, ZHANG H, et al. A new fibrinogen-related protein from Argopecten irradians (AiFREP-2) with broad recognition spectrum and bacteria agglutination activity[J]. Fish and Shellfish Immunology, 2014, 38(1): 221-229. DOI:10.1016/j.fsi.2014.03.025 |
| [17] |
ZHANG H, WANG L L, SONG L S, et al. A fibrinogen-related protein from bay scallop Argopecten irradians involved in innate immunity as pattern recognition receptor[J]. Fish and Shellfish Immunology, 2008, 26(1): 56-64. |
| [18] |
WU Y, ZHENG Y, LI Y, et al. Two fibrinogen-related proteins (FREPs) in the razor clam (Sinonovacula constricta) with a broad recognition spectrum and bacteria agglutination activity[J]. Developmental and Comparative Immunology: Ontogeny, Phylogeny, Aging: The Official Journal of the International Society of Developmental and Comparative Immunology, 2021, 121: 121. |
| [19] |
XIANG Z, QU F, WANG F, et al. Characteristic and functional analysis of a ficolin-like protein from the oyster Crassostrea hongkongensis[J]. Fish and Shellfish Immunology, 2014, 40(2): 514-523. DOI:10.1016/j.fsi.2014.08.006 |
| [20] |
ZHANG S M, ZENG Y, LOKER E. Expression profiling and binding properties of fibrinogen-related proteins (FREPs), plasma proteins from the schistosome snail host Biomphalaria glabrata[J]. Innate Immunity, 2008, 14(3): 175-189. DOI:10.1177/1753425908093800 |
| [21] |
王庆志, 张明, 滕炜鸣, 等. 毛蚶养殖生物学研究进展[J]. 大连海洋大学学报, 2015, 30(4): 437-443. WANG Qingzhi, ZHANG Ming, TENG Weiming, et al. Research progress in the biology of clam farming[J]. Journal of Dalian Ocean University, 2015, 30(4): 437-443. |
| [22] |
徐艳, 张秀国, 黄国强, 等. 毛蚶抗菌活性筛选及低极性组分GCMS分析[J]. 食品工业科技, 2015, 36(11): 127-130. XU Yan, ZHANG Xiuguo, HUANG Guoqiang, et al. Screening of antibacterial activity and GCMS analysis of low polarity components in Scapharm[J]. Food Industry Technology, 2015, 36(11): 127-130. |
| [23] |
翟毓秀, 郭萌萌, 江艳华, 等. 贝类产品质量安全风险分析[J]. 中国渔业质量与标准, 2020, 10(4): 1-25. ZHAI Yuxiu, GUO Mengmeng, JIANG Yanhua, et al. Risk analysis of quality and safety of shellfish products[J]. China Fisheries Quality and Standards, 2020, 10(4): 1-25. DOI:10.3969/j.issn.2095-1833.2020.04.001 |
| [24] |
SONG X D, JIANG J W, XING J, et al. Isolation and biochemical characteristics analyses of phenoloxidases (POs) in three cultured mollusk species[J]. Journal of Ocean University of China, 2022, 21(2): 465-472. DOI:10.1007/s11802-022-4808-6 |
| [25] |
WANG S F, LIU Y L, LIN S, et al. Hemoglobins from Scapharca subcrenata (Bivalvia: Arcidae) likely play anti-bactericidal role through their peroxidase activity[J]. Comparative Biochemistry and Physiology-Part B, Biochemistry and Molecular Biology, 2020, 253: 110545. |
| [26] |
GAO F, JIANG J, WANG J, et al. Real-time quantitative isothermal detection of Ostreid herpesvirus-1 DNA in Scapharca subcrenata using recombinase polymerase amplification[J]. Journal of Virological Methods, 2018, 255: 71-75. DOI:10.1016/j.jviromet.2018.02.007 |
| [27] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [28] |
LIU Y, ZHANG A, GUO N, et al. A pattern recognition receptor ficolin from Portunus trituberculatus (Ptficolin) regulating immune defense and hemolymph coagulation[J]. International Journal of Biological Macromolecules, 2022, 221: 558-572. DOI:10.1016/j.ijbiomac.2022.09.041 |
| [29] |
OANGKHANA P, AMPARYUP P, TASSANAKAJON A, et al. Characterization and functional analysis of fibrinogen-related protein (FreP) in the black tiger shrimp, Penaeus monodon[J]. Fish and Shellfish Immunology, 2021, 109: 87-96. DOI:10.1016/j.fsi.2020.12.012 |
| [30] |
QIN N, WU M, TANG T, et al. A fibrinogen-related protein (Mnfico3) acts as a novel pattern recognition receptor in Macrobrachium nipponense[J]. Fish and Shellfish Immunology, 2020, 100: 272-282. DOI:10.1016/j.fsi.2020.02.066 |
| [31] |
ZHAO K, QIN Y, et al. The role of ficolin as a pattern recognition receptor in antibacterial immunity in Eriocheir sinensis[J]. Fish & Shellfish Immunology, 2022, 128: 494-504. DOI:10.12264/JFSC2021-0481 |
| [32] |
XIANG Z, QU F, WANG F, et al. Characteristic and functional analysis of a ficolin-like protein from the oyster Crassostrea hongkongensis[J]. Fish and Shellfish Immunology, 2014, 40(2): 514-523. DOI:10.1016/j.fsi.2014.08.006 |
| [33] |
TIAN Y, CHEN T, LUO P, et al. A fibrinogen related protein, LvFREP2, from Litopenaeus vannamei facilitates the clearance of Vibrio harveyi[J]. Fish and Shellfish Immunology, 2018, 78: 364-371. DOI:10.1016/j.fsi.2018.05.007 |
| [34] |
HAN K, CHEN X, WU L, et al. Novel fibrinogen-related protein with single FReD contributes to the innate immunity of Macrobrachium rosenbergii[J]. Fish and Shellfish Immunology, 2018, 82: 350-360. DOI:10.1016/j.fsi.2018.08.036 |
| [35] |
宁军号. 三疣梭子蟹补体样分子结构及免疫功能研究[D]. 青岛: 中国科学院大学(中国科学院海洋研究所), 2019. NING Junhao. A study on the complement like molecular structure and immune function of the three spotted swimming crab[D]. Qingdao: University of Chinese Academy of Sciences (Institute of Oceanography, Chinese Academy of Sciences), 2019. |
| [36] |
WALSER C B, LIPSHITZ H D. Transcript clearance during the maternal-to-zygotic transition[J]. Current Opinion in Genetics and Development, 2011, 21(4): 431-443. DOI:10.1016/j.gde.2011.03.003 |
| [37] |
TADROS W, LIPSHITZ H D. The maternal-to-zygotic transition: a play in two acts[J]. Development, 2009, 136(18): 3033-3042. DOI:10.1242/dev.033183 |
| [38] |
LI T, WU L, JIN M, et al. Function of two ficolin-like proteins in innate immune defense of the oriental river prawn, Macrobrachium nipponense[J]. Fish and Shellfish Immunology, 2017, 68: 488-499. DOI:10.1016/j.fsi.2017.07.059 |
| [39] |
OANGKHANA P, AMPARYUP P, TASSANAKAJON A, et al. Characterization and functional analysis of fibrinogen-related protein (FReP) in the black tiger shrimp, Penaeus monodon[J]. Fish and Shellfish Immunology, 2021, 109: 87-96. DOI:10.1016/j.fsi.2020.12.012 |
| [40] |
ENDO Y, MATSUSHITA M, FUJITA T. The role of ficolins in the lectin pathway of innate immunity[J]. International Journal of Biochemistry and Cell Biology, 2011, 43(5): 705-712. DOI:10.1016/j.biocel.2011.02.003 |
| [41] |
NING J, LIU Y, CUI Z. Identification and functional analysis of a thioester-containing protein from Portunus trituberculatus reveals its involvement in the prophenoloxidase system, phagocytosis and AMP synthesis[J]. Aquaculture, 2019, 510: 9-21. DOI:10.1016/j.aquaculture.2019.05.025 |
| [42] |
SOLDATOV A, GOSTYUKHINA O, GOLOVINA I. Antioxidant enzyme complex of tissues of the bivalve Mytilus galloprovincialis. Under normal and oxidative- stress conditions: A review[J]. Applied Biochemistry and Microbiology, 2007, 43(5): 556-562. DOI:10.1134/S0003683807050092 |
| [43] |
ZOU D S, NING J H, LU X, et al. Physiological and transcriptional responses to acute and chronic thermal stress in the ark Shell Scapharca subcrenata[J]. Frontiers in Marine Science, 2021, 8: 11. |
| [44] |
WANG P, JIANG C, LIU S, et al. Trans-generational enhancement of C-type lysozyme level in eggs of zebrafish by dietary β-glucan[J]. Comparative Immunology, 2017, 74: 25-31. DOI:10.1016/j.dci.2017.04.006 |
| [45] |
TERAHAR A, KAZUTAK A, TAKAHASH I, et al. Mechanisms and immunological roles of apoptosis in molluscs[J]. Current Pharmaceutical Design, 2008, 14(2): 131-137. DOI:10.2174/138161208783378725 |
| [46] |
彭强, 王进京, 王春德, 等. SsC1qDC基因在毛蚶免疫防御中的作用[J]. 海洋科学, 2023, 47(9): 40-52. PENG Qiang, WANG Jinjing, WANG Chunde, et al. A novel C1q domain-containing gene (SsC1qDC) from Scapharca subcrenata participates in the immune defense against pathogen infection[J]. Marine Sciences, 2023, 47(9): 40-52. |
 2024, Vol. 48
2024, Vol. 48


