文章信息
- 林嘉祺, 庄岩, 刘骁, 曾翰庭, 张玉苍, 产竹华, 曾润颖. 2024.
- LIN Jiaqi, ZHUANG Yan, LIU Xiao, ZENG Hanting, ZHANG Yucang, CHAN Zhuhua, ZENG Runying. 2024.
- 一株海洋红法夫酵母Phaffia rhodozyma RP-306产虾青素的发酵条件优化
- Optimization of fermentation conditions for astaxanthin production by marine Phaffia rhodozyma RP-306
- 海洋科学, 48(2): 69-78
- Marine Sciences, 48(2): 69-78.
- http://dx.doi.org/10.11759/hykx20220726002
-
文章历史
- 收稿日期:2022-07-26
- 修回日期:2022-09-16
2. 自然资源部第三海洋研究所 自然资源部海洋生物资源开发利用工程技术创新中心, 福建 厦门 361005;
3. 福州大学 先进制造学院, 福建 晋江 362200
2. Marine Biological Resources Development and Utilization Engineering Technology Innovation Center, TIO, MNR, Xiamen 361005, China;
3. School of Advanced Manufacturing, Fuzhou University, Fuzhou 362200, China
虾青素(Astaxanthin)是一种具有超强抗氧化性的类胡萝卜素[1], 表现为具有自由基清除和增强细胞抗氧化性的能力[2]。虾青素还有抗炎症[3]与抗癌[4]、预防心血管疾病[5]、增强免疫功能[6]、肉类着色[7]等功能, 在医药、水产养殖、化妆品、食品等行业得到广泛应用[8]。
红法夫酵母(Phaffia rhodozyma)与雨生红球藻(Haematococcus pluvialis)是虾青素主要的微生物来源[9]。红法夫酵母中产十多种类胡萝卜素, 虾青素在这些类胡萝卜素中占比达70%以上[10]。相比于雨生红球藻, 红法夫酵母产虾青素有发酵周期短、无需日光照射、细胞壁容易破碎和易规模化培养等优点[11]。目前提高红法夫酵母虾青素产量的研究主要集中于诱变选育高产菌株、优化发酵条件、基因工程改造等方面[9]。
本研究以实验室前期通过诱变选育筛选出的红法夫酵母(Phaffia rhodozyma RP-306)作为研究对象, 进行发酵条件优化, 以期得到高产虾青素的发酵条件。首先通过单因素优化初步确定碳源、有机氮源的种类及添加量、无机氮源的种类及添加量、pH、温度和装液量, 其次通过Plackett-Burman实验设计与Minitab 17软件分析显著性因素, 最后利用最陡爬坡实验、响应面分析法获得提高虾青素产量的发酵条件。以优化后发酵条件对Phaffia rhodozyma RP-306进行分批发酵, 其虾青素产量达到了较高水平, 为进一步生产应用奠定了前提条件。
1 材料和方法 1.1 菌种与培养基红法夫酵母(Phaffia rhodozyma RP-306)菌株由本实验室采用等离子体诱变选育获得(数据未列出); 出发菌株来源于福建漳江口红树林保护区(23°55′45″N, 117°27′33″E), 保藏于海洋微生物菌种保藏中心, 编号2A00437。
种子培养基组成(YPD培养基): 酵母粉10.0 g/L, 蛋白胨20.0 g/L, 葡萄糖20.0 g/L, 自然pH, 添加20.0 g/L琼脂即为固体培养基, 115 ℃灭菌30 min后备用。
发酵培养基组成: 蔗糖30.0 g/L, 酵母粉2.0 g/L, (NH4)2SO4 5.0 g/L, KH2PO4 1.0 g/L, MgSO4·7H2O 0.05 g/L, CaCl2·2H2O 0.01 g/L, 115 ℃灭菌30 min后备用。
1.2 培养方法 1.2.1 种子制备方法取−80 ℃保存的菌种接种于固体平板培养基活化, 活化后接种于装液量20.0 mL的100.0 mL摇瓶中, 25 ℃, 200 r/min培养24~36 h。
1.2.2 摇瓶发酵培养按体积分数8.0%接种量接种于装液量50.0 mL的250.0 mL摇瓶中, 25 ℃, 200 r/min培养72 h。
1.3 单因素实验摇瓶发酵培养Phaffia rhodozyma RP-306菌株, 考察碳源种类、碳源添加量、氮源种类、有机氮源添加量、无机氮源添加量、pH、温度、装液量对其生物量和虾青素产量的影响。各组进行3次平行实验, 实验结果取平均值。
1.4 响应面实验设计 1.4.1 Plackett-Burman实验根据单因素实验结果, 选择蔗糖、酵母粉、硫酸铵、pH、温度和装液量6个因素, 采用六因素二水平的析因实验设计, 分析影响Phaffia rhodozyma RP-306虾青素产量的显著因素(表 1)。
| 因素 | 单位 | 符号 | 水平 | |
| −1 | +1 | |||
| 蔗糖 | g/L | X1 | 25 | 35 |
| 酵母粉 | g/L | X2 | 1.5 | 2.5 |
| 硫酸铵 | g/L | X3 | 4 | 6 |
| pH | — | X4 | 5 | 6 |
| 温度 | ℃ | X5 | 18 | 22 |
| 装液量 | mL | X6 | 30 | 50 |
根据Plackett-Burman实验结果, 采用最陡爬坡实验确定显著因素变化的取值范围在最优范围内, 最优组合在后续实验中继续寻找。
1.4.3 响应面实验采用中心组合实验设计进行优化(表 2), 将优化所得数据与响应面进行拟合, 进行验证实验。
| 符号 | 因子 | 单位 | 水平 | ||||
| −1.68 | −1 | 0 | 1 | 1.68 | |||
| X1 | 蔗糖 | g/L | 26 | 28 | 31 | 34 | 36 |
| X2 | pH | — | 5.0 | 5.2 | 5.4 | 5.6 | 5.8 |
| X3 | 温度 | ℃ | 17.4 | 19 | 20 | 21 | 22.6 |
在5.0 L发酵罐中使用优化后发酵培养基培养, 装液量3.0 L, 接种量8.0%, 温度20 ℃, pH 5.3, 控制搅拌转速和通气量使得溶解氧保持在30.0%~ 50.0%。
1.6 分析方法 1.6.1 细胞干重测定取50.0 mL发酵液8 000 r/min, 10 min离心去除上清, 冷冻干燥12 h, 烘箱烘干15 min, 称量菌体质量。
1.6.2 虾青素提取采用二甲基亚砜法[12], 取5.0 mL发酵液, 8 000 r/min离心10 min去除上清, 洗涤两次。加入二甲基亚砜(60 ℃预热)5.0 mL, 60 ℃水浴30 min。加入5.0 mL丙酮振荡提取, 离心收集上层提取液。
1.6.3 虾青素浓度测定采用紫外分光光度计检测[13], 配制不同浓度梯度的虾青素标准品, 测定波长474 nm的吸光度, 绘制虾青素与吸光度的标准曲线, 根据标准曲线计算虾青素浓度。
2 结果与讨论 2.1 单因素优化菌株Phaffia rhodozymas RP-306摇瓶发酵 2.1.1 不同碳源种类的影响在无碳源发酵培养基中, 分别添加20.0 g/L果糖、葡萄糖、乳糖、木糖、蔗糖、麦芽糖。发酵培养Phaffia rhodozyma RP-306, 测定其虾青素浓度和细胞干重, 结果如图 1。
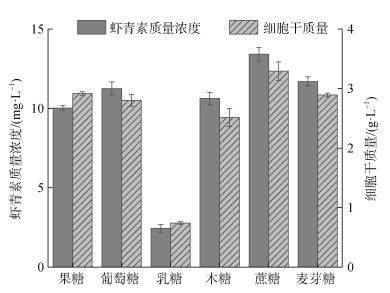 |
| 图 1 不同碳源对菌株生长及虾青素产量的影响 Fig. 1 Effect of different carbon sources on cell growth and yield of astaxanthin |
微生物能利用碳源为自身生长提供能量, 碳源也能转化为微生物自身细胞的组成成分, 还对微生物酶具有直接影响[14]。图 1可以看出, 果糖、葡萄糖、木糖、蔗糖、麦芽糖为碳源时, 虾青素质量浓度和细胞干质量处于较高水平; 而乳糖作为碳源时, 虾青素质量浓度和细胞干质量则明显降低, 可能由于Phaffia rhodozymaRP-306中缺乏代谢乳糖的相关基因, 使得菌株对乳糖利用率降低, 从而抑制生长和代谢。蔗糖作为唯一碳源时, 其虾青素质量浓度最高, 达到13.41 mg/L, 细胞干质量也最大, 达到3.29 g/L。Vazquez等[15]研究中发现红法夫酵母菌株ATCC 24203、ATCC 24261在利用蔗糖的情况下拥有最大的细胞干质量; 张森[16]在培养红法夫酵母AS2.1557使用蔗糖得到了最大虾青素产量。本实验与上述实验结果一致, 采用蔗糖得到了最大虾青素产量。
2.1.2 不同蔗糖浓度的影响在无碳源发酵培养基中, 蔗糖作为单一碳源按照20.0 g/L、25.0 g/L、30.0 g/L、35.0 g/L、40.0 g/L、45.0 g/L分别加入。发酵培养Phaffia rhodozyma RP-306, 测定其虾青素质量浓度和细胞干质量, 结果如图 2。
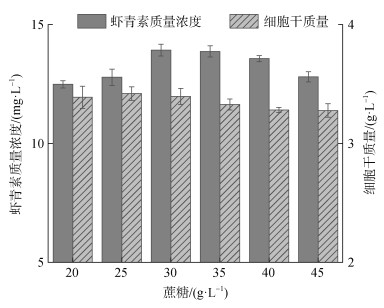 |
| 图 2 蔗糖浓度对菌株生长及虾青素产量的影响 Fig. 2 Effect of sucrose concentrations on cell growth and yield of astaxanthin |
蔗糖30.0 g/L时, 总虾青素浓度达到最大值。此时虾青素质量浓度和细胞干质量分别为13.92 mg/L和3.39 g/L。蔗糖在30.0 g/L以下时, 蔗糖添加量增加, 虾青素质量浓度和细胞干质量随之增加; 而当蔗糖添加量大于30.0 g/L时, 虾青素质量浓度和细胞干质量都开始下降。可能是高浓度蔗糖引起代谢通路的变化而不利于菌株生长[17]。
2.1.3 不同氮源种类的影响在无氮源发酵培养基中, 分别添加5.0 g/L氯化铵、硫酸铵、硝酸钾、酵母粉、蛋白胨、牛肉膏。发酵培养Phaffia rhodozyma RP-306, 测定其虾青素浓度和细胞干质量, 结果如图 3。
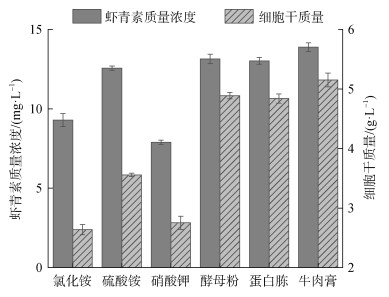 |
| 图 3 不同氮源对菌株生长及虾青素产量的影响 Fig. 3 Effect of different nitrogen sources on cell growth and astaxanthin yield |
氮源主要用途是合成细胞内的含氮物质。无机氮源中硫酸铵效果最好, 虾青素质量浓度达到12.55 mg/L, 细胞干质量达到3.55 g/L; 有机氮源培养时虾青素质量浓度和细胞干质量均高于无机氮源, 其中酵母粉培养时虾青素产量达到13.14 mg/L, 细胞干质量达到4.88 g/L。有机氮源价格较为昂贵, 其中牛肉膏价格更是为酵母粉的2~3倍, 且其开封后易变质, 牛肉膏培养时虾青素质量浓度比酵母粉提高了0.74 mg/L。无机氮源中硫酸铵价格低廉, 硫酸铵培养时虾青素质量浓度比酵母粉降低了0.59 mg/L, 它可以作为氮源也能作为培养基的无机盐。综合考虑添加少量酵母粉作为生长因子, 而硫酸铵作为主要氮源。
2.1.4 不同无机氮源添加量的影响硫酸铵作为单一氮源按照3.0 g/L、4.0 g/L、5.0 g/L、6.0 g/L、7.0 g/L加入无氮源发酵培养基中。发酵培养Phaffia rhodozyma RP-306, 测定其虾青素质量浓度和细胞干质量, 结果如图 4。
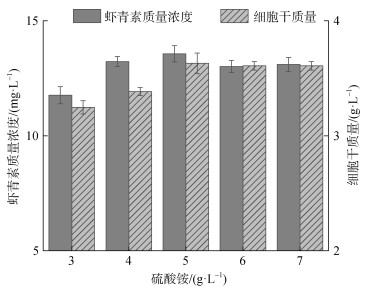 |
| 图 4 硫酸铵浓度对菌株生长及虾青素产量的影响 Fig. 4 Effect of (NH4)2SO4 concentrations on cell growth and yield of astaxanthin |
硫酸铵质量浓度5.0 g/L时, 虾青素质量浓度与细胞干质量达到最大值, 分别为13.56 mg/L和3.63 g/L。当硫酸铵质量浓度超过5.0 g/L, 虾青素质量浓度和细胞干质量开始下降。低浓度氮源可以增强柠檬酸裂解酶活性[18], 也在一定程度上增加了虾青素合成限制因素乙酰辅酶A数量[19], 促进虾青素积累。
2.1.5 不同有机氮源添加量的影响酵母粉分别按照0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L、3.0 g/L加入含有5.0 g/L硫酸铵的无有机氮源发酵培养基中。发酵培养Phaffia rhodozyma RP-306, 测定其虾青素质量浓度和细胞干质量, 结果如图 5。
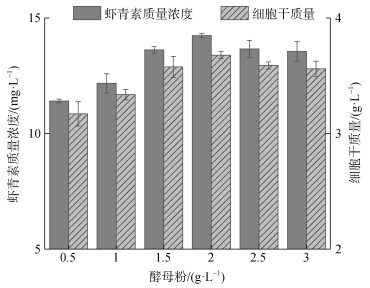 |
| 图 5 酵母粉质量浓度对菌株生长及虾青素产量的影响 Fig. 5 Effect of yeast extract powder concentrations on cell growth and astaxanthin yield |
酵母粉浓度在2.0 g/L时, 虾青素质量浓度与细胞干质量达到最大值, 分别为14.24 mg/L和3.67 g/L。酵母粉浓度继续升高, 虾青素质量浓度和细胞干质量开始下降。酵母粉和硫酸铵同时作为氮源, 使得氮源浓度过高, 菌株生长代谢物积累过多导致不利于生长。此时只需要低浓度的酵母粉充当生长因子。
2.1.6 不同温度的影响基于上述优化配制发酵培养基, 调节温度18 ℃、20 ℃、22 ℃、24 ℃、26 ℃。发酵培养Phaffia rhodozyma RP-306, 测定其虾青素浓度和细胞干质量, 结果如图 6。
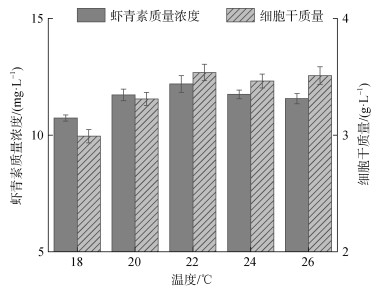 |
| 图 6 温度对菌株生长及虾青素产量的影响 Fig. 6 Effect of temperature on cell growth and yield of astaxanthin |
温度为22 ℃时, 虾青素质量浓度和细胞干质量达到最大值, 分别为12.19 mg/L和3.53 g/L。温度通过影响酶活进一步影响细胞内代谢速率, 改变代谢物产量。Shi[20]等人实验发现温度不同时色素合成途径中crtE、crtYB、crtI以及cHMG1基因表达量不同。温度较低时利于色素的合成, 温度高时利于菌体的生长。
2.1.7 不同pH的影响基于上述优化配制发酵培养基, 将发酵培养基pH调节为4、4.5、5、5.5、6和6.5。发酵培养Phaffia rhodozyma RP-306, 测定其虾青素浓度和细胞干质量, 结果如图 7。
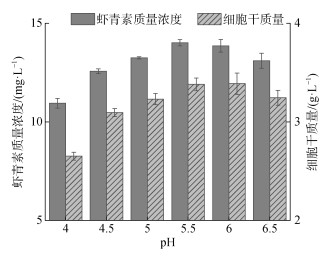 |
| 图 7 pH值对菌株生长及虾青素产量的影响 Fig. 7 Effect of pH on cell growth and yield of astaxanthin |
pH5.5时虾青素浓度和细胞干质量达到最大值, 分别为14.01 mg/L和3.38 g/L。细胞结构、代谢途径、代谢速率、细胞中酶的活性等因素都受pH的影响。合适的pH能够促进细胞生长, 提高目标产物产量。肖安风[12]等人发现高pH利于菌体生长, 低pH利于虾青素积累。
2.1.8 不同装液量的影响基于上述优化配制发酵培养基, 分别配制发酵培养基20.0、30.0、40.0、50.0、60.0、70.0 mL于250.0 mL摇瓶中。发酵培养Phaffia rhodozyma RP-306, 测定其虾青素质量浓度和细胞干质量, 结果如图 8。
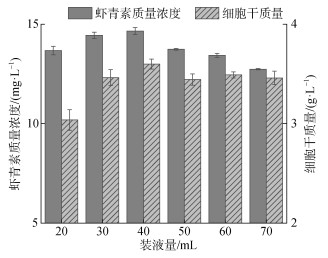 |
| 图 8 装液量对菌株生长及虾青素产量的影响 Fig. 8 Effect of liquid volume in the flask on cell growth and astaxanthin yield |
装液量为40.0 mL时, 虾青素质量浓度和细胞干质量达到最大值, 分别为14.65 mg/L和3.60 g/L。
红法夫酵母的生长以及虾青素的合成都需要氧气的参与[21]。在虾青素的生物合成中, 尤其在八氢番茄红素转化为β-胡萝卜素进而生成虾青素的过程中, 存在多次脱氢、加氧反应[22]。装液量对氧气的溶解有很大影响, 过多的装液量使得溶氧不足, 发酵液的流动性降低, 从而影响菌体生长与虾青素合成, 装液量太少影响产品的总体产量和收率。
2.2 Plackett-Burman实验设计根据单因素实验选择上述因素: 蔗糖(X1)、硫酸铵(X2)、酵母粉(X3)、pH(X4)、温度(X5)、装液量(X6)6个因素作为考察对象, 采用实验次数N=12的Plackett-Burman实验设计方案, 以虾青素浓度作为响应值, 结果如表 3。
| 实验号 | 水平 | 虾青素/(mg·L–1) | |||||
| X1 | X2 | X3 | X4 | X5 | X6 | ||
| 1 | 1 | −1 | 1 | 1 | −1 | 1 | 16.60 |
| 2 | −1 | −1 | 1 | 1 | 1 | −1 | 13.64 |
| 3 | −1 | 1 | 1 | 1 | −1 | 1 | 14.07 |
| 4 | −1 | 1 | −1 | −1 | −1 | 1 | 13.46 |
| 5 | −1 | 1 | 1 | −1 | 1 | −1 | 12.43 |
| 6 | 1 | 1 | 1 | −1 | 1 | 1 | 13.80 |
| 7 | −1 | −1 | −1 | −1 | −1 | −1 | 12.68 |
| 8 | 1 | 1 | −1 | 1 | 1 | −1 | 13.91 |
| 9 | 1 | 1 | −1 | 1 | −1 | −1 | 17.05 |
| 10 | 1 | −1 | −1 | −1 | 1 | 1 | 13.49 |
| 11 | −1 | −1 | −1 | 1 | 1 | 1 | 12.60 |
| 12 | 1 | −1 | 1 | −1 | −1 | −1 | 14.73 |
| 注: 以上每组实验均进行3个重复 | |||||||
利用Minitab 17对表 3中的实验结果进行分析, 可以发现各组间的差异显著(P<0.05)。如表 4所示, 在考察的6个因素中, 蔗糖(X1)、pH(X4)、温度(X5)对实验结果影响显著, 蔗糖与pH值呈正效应, 温度与装液量呈负效应。酵母粉(X2)、硫酸铵(X3)、装液量(X6)影响较小, 在后续实验中固定酵母粉2.0 g/L, 硫酸铵5.0 g/L, 装液量40.0 mL不变, 对蔗糖、pH、温度这3个因素进行进一步优化。
| 因素 | 效应 | 标准误差 | P值 |
| X1 | 1.781 | 0.214 | 0.009 |
| X2 | 0.165 | 0.214 | 0.715 |
| X3 | 0.346 | 0.214 | 0.455 |
| X4 | 1.211 | 0.214 | 0.037 |
| X5 | −1.453 | 0.214 | 0.019 |
| X6 | −0.067 | 0.214 | 0.882 |
对虾青素(A)产量进行回归分析得到的多元一次回归方程为: A=14.038+0.891X1+0.083X2−0.173X3+0.605X4− 0.727X5−0.033X6。该方程的方差分析结果F值为6.29 > 2, 表明该模型在α=0.05水平显著, 同时该方程拟合度较好(相关系数R2 =88.30%)。
2.3 最陡爬坡实验由以上分析结果, 对蔗糖、pH、温度进行最陡爬坡实验, 各因素变化的步长、方向以及实验结果如下(表 5)。
| Step | 蔗糖/(g·L–1) | pH | 温度/℃ | 虾青素/(mg·L–1) |
| −2 | 22 | 4.8 | 23 | 13.38 |
| −1 | 25 | 5.0 | 22 | 14.73 |
| 0 | 28 | 5.2 | 21 | 15.81 |
| 1 | 31 | 5.4 | 20 | 16.94 |
| 2 | 34 | 5.6 | 19 | 16.17 |
| 3 | 37 | 5.8 | 18 | 15.78 |
| 4 | 40 | 6.0 | 17 | 12.57 |
| 注: 以上每组实验均进行3个重复 | ||||
1号实验组中虾青素产量达到最大值。将1号实验组的蔗糖、pH、温度用于以下响应面优化实验。
2.4 响应面分析的实验设计及结果蔗糖、pH、温度是对虾青素产量影响显著的3个因素, 最陡爬坡实验确定了接近最大响应值的蔗糖、pH和温度取值, 采用中心组合设计实验对这些因素进一步优化。
对表 6的实验设计做回归分析得到回归方程为: A=16.775−0.398 7X1−0.332 4X2−0.075 7X3−0.506 4X12−0.246 6X22−0.304 9X32−0.054X1X2+0.105X1X3−0.083X2X3, 其中, A代表虾青素的浓度。回归方程的方差分析模型显著, 拟合程度较高(相关系数R2=89.88%), 失拟不显著(P=0.440 > 0.05)说明该方程为Phaffia rhodozyma RP-306发酵生产虾青素产量变化提供了一个合适的模型。
| 实验号 | X1 | X2 | X3 | 虾青素/(mg·L−1) |
| 1 | −1 | −1 | −1 | 16.79 |
| 2 | −1 | −1 | 1 | 16.47 |
| 3 | −1 | 1 | −1 | 16.22 |
| 4 | −1 | 1 | 1 | 15.56 |
| 5 | 1 | −1 | −1 | 15.98 |
| 6 | 1 | −1 | −1 | 15.35 |
| 7 | 1 | 1 | −1 | 14.93 |
| 8 | 1 | 1 | 1 | 14.70 |
| 9 | −1.68 | 0 | 0 | 15.74 |
| 10 | 1.68 | 0 | 0 | 14.79 |
| 11 | 0 | −1.68 | 0 | 16.34 |
| 12 | 0 | 1.68 | 0 | 15.66 |
| 13 | 0 | 0 | −1.68 | 15.81 |
| 14 | 0 | 0 | 1.68 | 15.86 |
| 15 | 0 | 0 | 0 | 16.56 |
| 16 | 0 | 0 | 0 | 16.95 |
| 17 | 0 | 0 | 0 | 16.37 |
| 18 | 0 | 0 | 0 | 16.97 |
| 19 | 0 | 0 | 0 | 16.73 |
| 20 | 0 | 0 | 0 | 17.12 |
| 注: 以上每组实验均进行3个重复 | ||||
从图 9可以直观的看出各个因子对响应的变化趋势, 回归模型存在最大值。利用Mintab 17软件的响应优化器对响应进行优化, 得到预测的响应为16.96 mg/L。此时蔗糖为29.93 g/L, pH为5.27, 温度为19.9 ℃。以上述条件做验证实验, 实验三次得到平均虾青素产量为17.04 mg/L, 与理论预测值相差不大(P > 0.05), 证实模型有效, 虾青素产量比优化前提高了26.61%。
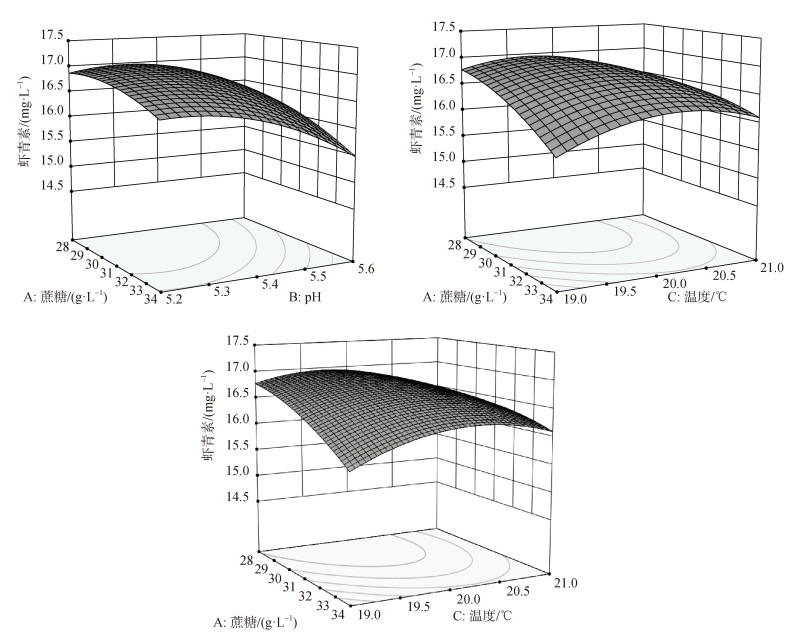 |
| 图 9 各因素交互作用对虾青素产量影响的响应面及等高线 Fig. 9 Response surface and contour lines of the interaction of various factors with the astaxanthin yield |
摇瓶培养过程中pH值与溶解氧是无法控制的, 然而pH值与溶解氧对红法夫酵母产虾青素尤为重要。摇瓶实验的培养环境往往与实际发酵罐的培养环境有所差别, 发酵罐培养不可简单套用摇瓶实验的结果。为了进一步研究Phaffia rhodozyma RP-306生产虾青素的能力, 使用5.0 L发酵罐进行分批发酵, 培养时控制pH5.5与溶氧30.0%~50.0%。
相比于摇瓶, 使用5.0 L发酵罐培养红法夫酵母时, 溶氧量充足, pH能够保持, 糖底物被彻底利用, 虾青素产量进一步提高, 达到28.86 mg/L(图 10)。与表 7中其他研究实验结果相比, Phaffia rhodozyma RP-306在分批发酵时虾青素产量能够达到较高水平, 具备了作为虾青素生产菌株的初步条件, 本课题组拟进一步开发此菌株的补料生产工艺。
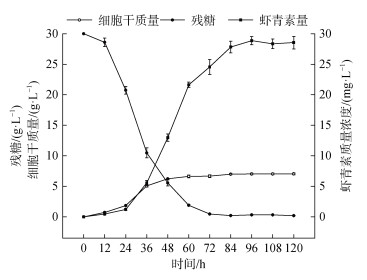 |
| 图 10 Phaffia rhodozyma RP-306分批发酵产虾青素 Fig. 10 Astaxanthin yield in Phaffia rhodozyma RP-306 batch fermentation |
| 菌株 | 虾青素/(mg·L−1) | 引用 |
| Phaffia rhodozyma RP-306 | 28.86 | 本研究 |
| Phaffia rhodozyma 7B12 | 7.71 | [23] |
| Phaffia rhodozyma NRRLY-17268 | 10.40 | [24] |
| Phaffia rhodozyma ZJUT46 | 32.48 | [25] |
| Phaffia rhodozyma AS 2.1557 | 14.32 | [26] |
| Phaffia rhodozyma MTCC 7536 | 8.60 | [27] |
| Phaffia rhodozyma CSR19 | 25.30 | [28] |
| Phaffia rhodozyma 5308 | 4.94 | [29] |
虾青素在多个领域具有广泛应用, 市场上虾青素主要是采用雨生红球藻生产的, 关键原因是其来源的虾青素在食品目录。然而, 雨生红球藻生产虾青素具有周期长(15~20 d左右)、环境要求高、生产成本高等缺点, 造成虾青素价格高、市场供应不足。红法夫酵母培养周期短, 能利用多种营养物质, 可在生物反应器中封闭高密度培养, 其虾青素生产强度达到雨生红球藻的4~6倍, 也是虾青素良好的生物来源。红法夫酵母菌体中含有多种蛋白质、维生素和矿物质等, 破壁处理后无需萃取与提纯即可直接添加到动物饲料中, 其虾青素主要以游离和未修饰的形式存在, 易于吸收。虽然红法夫酵母来源的虾青素不在食品目录, 但是多个研究报道表明, 红法夫酵母虾青素具有活性高、安全性高、生产成本低等特点, 目前已被允许在水产养殖上广泛使用。现今国内外正在推动红法夫酵母虾青素作为新食品原料的申报工作, 未来其在食品、日化、饲料等行业具有良好的应用前景。
本研究对Phaffia rhodozyma RP-306的细胞生长及其虾青素产量进行发酵条件优化, 提高了虾青素产量。研究结果表明, 在虾青素生产过程中, 碳源浓度、pH和温度是影响虾青素产量的主要因素。优化后发酵条件为: 蔗糖29.93 g/L、酵母粉2.0 g/L、硫酸铵5.0 g/L、pH 5.27、温度19.9 ℃, 虾青素产量17.04 mg/L, 相比优化前提高26.61%。在5.0 L发酵罐中, 通过pH与溶解氧调控, 虾青素产量进一步提高, 达到28.86 mg/L, 具备工业化生产菌株的发酵水平。此外, Phaffia rhodozyma RP-306生产虾青素的最佳发酵温度为19.9 ℃, 该菌在生产过程中可减少温控能耗。研究结果显示, 单位体积发酵液中的虾青素产量已达到较高水平, 然而单位体积发酵液中红法夫酵母生物量仍处于较低水平。未来需要在单位质量菌体虾青素含量不降低的情况下, 继续优化策略提高菌株的生物量, 进一步提高虾青素的产量。尝试采用连续或补料发酵策略替代分批发酵, 提升空间、设备、能量的利用率; 结合高效真菌破壁系统提升虾青素的得率, 以推动红法夫酵母虾青素的规模化制备以及应用开发。
| [1] |
SZTRETYE M, DIENES B, GÖNCZI M, et al. Astaxanthin: a potential mitochondrial-targeted antioxidant treatment in diseases and with aging[J]. Oxidative Medicine and Cellular Longevity, 2019(11): 3849692. |
| [2] |
DOSE J, MATSUGO S, YOKOKAWA H, et al. Free radical scavenging and cellular antioxidant properties of astaxanthin[J]. International Journal of Molecular Sciences, 2016, 17(1): 103-117. DOI:10.3390/ijms17010103 |
| [3] |
KOHANDEL Z, FARKHONDEH T, ASCHNER M, et al. Anti-inflammatory action of astaxanthin and its use in the treatment of various diseases[J]. Biomedicine & Pharmacotherapy, 2022, 145: 112179. |
| [4] |
FARAONE I, SINISGALLI C, OSTUNI A, et al. Astaxanthin anticancer effects are mediated through multiple molecular mechanisms: A systematic review[J]. Pharmacological Research, 2020, 155: 104689. DOI:10.1016/j.phrs.2020.104689 |
| [5] |
FAKHRI S, ABBASZADEH F, DARGAHI L, et al. Astaxanthin: a mechanistic review on its biological activities and health benefits[J]. Pharmacological Research, 2018, 136: 1-20. DOI:10.1016/j.phrs.2018.08.012 |
| [6] |
FAKHRI S, NOURI Z, MORADI S Z, et al. Astaxanthin, COVID-19 and immune response: Focus on oxidative stress, apoptosis and autophagy[J]. Phytotherapy Research, 2020, 34(11): 2790-2792. DOI:10.1002/ptr.6797 |
| [7] |
LIM K C, YUSOFF F M, SHARIFF M, et al. Astaxanthin as feed supplement in aquatic animals[J]. Reviews in Aquaculture, 2018, 10(3): 738-773. DOI:10.1111/raq.12200 |
| [8] |
AMBATI R R, PHANG S M, RAVI S, et al. Astaxanthin: Sources, extraction, stability, biological activities and its commercial applications—A review[J]. Marine Drugs, 2014, 12(1): 128-152. DOI:10.3390/md12010128 |
| [9] |
ZHUANG Y, ZHU M J. Recent developments in astaxanthin production from Phaffia rhodozyma and its applications[M]//GOKARE A R, AMBATI R R. Global perspectives on astaxanthin from industrial production to food, health, and pharmaceutical applications. Amsterdam: Elsevier Academic Press, 2021: 225-251.
|
| [10] |
OJIMA K, BREITENBACH J, VISSER H, et al. Cloning of the astaxanthin synthase gene from Xanthophyllomyces dendrorhous (Phaffia rhodozyma) and its assignment as a β-carotene 3-hydroxylase/4-ketolase[J]. Molecular Genetics and Genomics, 2006, 275(2): 148-158. DOI:10.1007/s00438-005-0072-x |
| [11] |
XIAO A F, NI H, CAI H N, et al. An improved process for cell disruption and astaxanthin extraction from Phaffia rhodozyma[J]. World Journal of Microbiology and Biotechnology, 2009, 25(11): 2029-2034. DOI:10.1007/s11274-009-0104-5 |
| [12] |
肖安风, 于广仁, 蔡慧农, 等. 法夫酵母发酵过程的pH值控制策略及对虾青素合成的影响[J]. 中国食品学报, 2015, 15(1): 66-72. XIAO Anfeng, YU Guangren, CAI Huinong, et al. pH control strategy and its effect on astaxanthin production in Phaffia rhodozyma fermentation[J]. Journal of Chinese Institute of Food Science and Technology, 2015, 15(1): 66-72. |
| [13] |
倪辉. 法夫酵母虾青素发酵条件的优化及提取与分析研究[D]. 杭州: 浙江大学, 2005. NI Hui. Optimization of Phaffia rhodozyma cultivation conditions, astaxnathin extraction and analysis[D]. Hangzhou: Zhejiang University, 2005. |
| [14] |
潘运国, 陈义伦, 张策, 等. 霉菌液态培养产酯化酶规律研究[J]. 酿酒科技, 2005(11): 35-37. PAN Yunguo, CHEN Yilun, ZHANG Ce, et al. Study on the Production Rules of Esterified Enzyme by Mould Liquid Culture[J]. Liquor-Making Science & Technology, 2005(11): 35-37. DOI:10.3969/j.issn.1001-9286.2005.11.005 |
| [15] |
VAZQUEZ M, SANTOS V, PARAJO J C. Effect of the carbon source on the carotenoid profiles of Phaffia rhodozyma strains[J]. Journal of Industrial Microbiology and Biotechnology, 1997, 19(4): 263-268. DOI:10.1038/sj.jim.2900376 |
| [16] |
张森. 红法夫酵母生产虾青素的研究[D]. 北京: 北京化工大学, 2012. ZHANG Sen. Fermentation production of astaxanthin by Xanthophyllomyces dendrorhous[D]. Beijing: Beijing University of Chemical Technology, 2012. |
| [17] |
HAGMAN A, SÄLL T, PIŠKUR J. Analysis of the yeast short-term Crabtree effect and its origin[J]. The FEBS Journal, 2014, 281(21): 4805-4814. DOI:10.1111/febs.13019 |
| [18] |
MIAO L, CHI S, TANG Y, et al. Astaxanthin biosynthesis is enhanced by high carotenogenicgene expression and decrease of fatty acids and ergosterol in a Phaffia rhodozyma mutant strain[J]. FEMS Yeast Research, 2011, 11(2): 192-201. DOI:10.1111/j.1567-1364.2010.00705.x |
| [19] |
VUSTIN M M, BELYKH E N, KISHILOVA S A. Relationship between astaxanthin production and the intensity of anabolic processes in the yeast Phaffia rhodozyma[J]. Microbiology, 2004, 73(6): 643-649. DOI:10.1007/s11021-005-0004-0 |
| [20] |
SHI F, ZHAN W, LI Y, et al. Temperature influences β-carotene production in recombinant Saccharomyces cerevisiae expressing carotenogenic genes from Phaffia rhodozyma[J]. World Journal of Microbiology and Biotechnology, 2014, 30(1): 125-133. DOI:10.1007/s11274-013-1428-8 |
| [21] |
JOHNSON E A, LEWIS M J. Astaxanthin formation by the yeast Phaffia rhodozyma[J]. Microbiology, 1979, 115(1): 173-183. |
| [22] |
VERDOES J C, SANDMANN G, VISSER H, et al. Metabolic engineering of the carotenoid biosynthetic pathway in the yeast Xanthophyllomyces dendrorhous (Phaffia rhodozyma)[J]. Applied and Environmental Microbiology, 2003, 69(7): 3728-3738. DOI:10.1128/AEM.69.7.3728-3738.2003 |
| [23] |
NI H, CHEN Q H, RUAN H, et al. Studies on optimization of nitrogen sources for astaxanthin production by Phaffia rhodozyma[J]. Journal of Zhejiang University Science B, 2007, 8(5): 365-370. DOI:10.1631/jzus.2007.B0365 |
| [24] |
PARAJÓ J C, SANTOS V, VÁZQUEZ M. Production of carotenoids by Phaffia rhodozyma growing on media made from hemicellulosic hydrolysates of Eucalyptus globulus wood[J]. Biotechnology and Bioengineering, 1998, 59(4): 501-506. DOI:10.1002/(SICI)1097-0290(19980820)59:4<501::AID-BIT13>3.0.CO;2-C |
| [25] |
HU Z C, ZHENG Y G, WANG Z, et al. Production of astaxanthin by Xanthophyllomyces dendrorhous ZJUT46 with fed-batch fermentation in 2.0 m3 fermentor[J]. Food Technology and Biotechnology, 2007, 45(2): 209-212. |
| [26] |
WANG W, YU L. Effects of oxygen supply on growth and carotenoids accumulation by Xanthophyllomyces dendrorhous[J]. Zeitschrift für Naturforschung C, 2009, 64(11/12): 853-858. |
| [27] |
BATGHARE A H, SINGH N, MOHOLKAR V S. Investigations in ultrasound–induced enhancement of astaxanthin production by wild strain Phaffia rhodozyma MTCC 7536[J]. Bioresource Technology, 2018, 254: 166-173. DOI:10.1016/j.biortech.2018.01.073 |
| [28] |
CHI S, HE Y, REN J, et al. Overexpression of a bifunctional enzyme, CrtS, enhances astaxanthin synthesis through two pathways in Phaffia rhodozyma[J]. Microbial Cell Factories, 2015, 14: 1-12. DOI:10.1186/s12934-014-0183-3 |
| [29] |
TROPEA A, GERVASI T, MELITO M R, et al. Does the light influence astaxanthin production in Xanthophyllomyces dendrorhous[J]. Natural Product Research, 2013, 27(7): 648-654. DOI:10.1080/14786419.2012.688045 |
 2024, Vol. 48
2024, Vol. 48


