文章信息
- 戴佳佳, 宋金明, 李学刚, 马骏, 袁华茂, 段丽琴, 温丽联. 2024.
- DAI Jiajia, SONG Jinming, LI Xuegang, MA Jun, YUAN Huamao, DUAN Liqin, WEN Lilian. 2024.
- 水环境中新污染物的分离富集与测定——以磺胺类合成药物为例
- Separation, preconcentration, and determination of emerging contaminants in aquatic environments: A review on sulfonamides
- 海洋科学, 48(2): 88-101
- Marine Sciences, 48(2): 88-101.
- http://dx.doi.org/10.11759/hykx20230428001
-
文章历史
- 收稿日期:2023-04-28
- 修回日期:2023-05-24
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237;
3. 中国科学院大学, 北京 100049;
4. 中国科学院海洋大科学研究中心, 山东 青岛 266071
2. Qingdao National Laboratory for Marine Ecology and Environmental Sciences, Pilot Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
人工合成药物作为一类新污染物对环境的污染问题目前备受关注, 其广泛使用可能对水环境及水生生物产生不利影响, 最终通过食物链威胁人类健康[1], 但对此人们的了解十分有限, 正如联合国教科文组织发布的《2022海洋状况报告》中所报道的“除了在报告中综述的这些常见污染之外, 人们对其他类型的污染知之甚少, 例如药物污染”。磺胺类(SAs)作为应用最早的一类人工合成抗菌药物, 因其高效和廉价等特点已被广泛应用于人类、农业、畜牧业和水产养殖。磺胺类合成药物具有对氨基苯磺酰胺母核结构(图 1), 自1935年至今, 已经开发了150多种具有抑菌作用的磺胺类合成药物, 其作用是通过抑制对氨基苯甲酸的合成代谢过程以干扰叶酸的合成, 从而抑制细菌的生长繁殖。据统计, 2018年全球磺胺类合成药物的产量高达7万吨, 而我国产量达1.45万吨, 这其中有90%为兽用, 人用仅占10%[2]。磺胺类合成药物进入体内后不能完全吸收, 约有40%~90%通过粪便和尿液以母体或代谢产物的形式排出体外, 经下水道系统进入污水处理厂[3]。然而, 目前污水处理厂对污水中磺胺类合成药物的去除效果并不完全, 由于在生物处理过程中磺胺类代谢产物可能发生反向转化, 甚至导致磺胺类合成药物在流出水中的浓度增加, 因此, 仍有大量的磺胺类合成药物及其代谢产物进入水环境中, 在地表水、地下水、海水以及饮用水中都检测到了磺胺类合成药物的存在[4-5]。尽管水环境中磺胺类合成药物的残留质量浓度较低, 处于ng/L至μg/L水平, 但是由于其频繁的使用及持续的排放导致呈现出“假持久性”的特点, 对水生生物所产生的毒性以及可能造成的生态危害仍不可忽视, 同时会诱导抗生素抗性基因及耐药菌的形成, 最终对人类产生潜在的健康风险[6-7]。
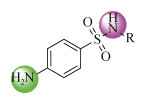 |
| 图 1 磺胺类合成药物的结构通式 Fig. 1 General structural formula of sulfonamides |
为了鉴定和量化水环境中的磺胺类合成药物, 需要开发快速灵敏的分析测定方法。磺胺类合成药物在水环境中大多以痕量或超痕量的水平存在, 然而现有分析仪器的灵敏度并不足以对其直接检测。因此需要选择适当的样品前处理技术, 去除干扰物并从复杂样品中分离和富集目标分析物, 从而提高检测的灵敏度。低检测限、短检测时间和多组分同时检测是磺胺类合成药物分析测定的突破方向。近年来, 已经开发出多种样品前处理技术, 包括液液萃取(Liquid-liquid extraction, LLE)和固相萃取(Solid phase extraction, SPE)等, 其中SPE现已替代传统的LLE成为最常用的样品前处理技术, 被广泛用于水环境中磺胺类合成药物的分离富集[8]。随着新型吸附剂材料的不断发展, 磺胺类合成药物的富集效率也越来越高。此外, 分析仪器的改进也是提高所开发方法灵敏度的关键。目前, 超高效液相色谱(Ultra performance liquid chromatography, UPLC)和串联质谱(Tandem mass spectrometry, MS/MS)联用技术提供了高灵敏度和高选择性, 成功用于不同水环境介质中磺胺类合成药物的分析检测[9]。
针对目前的状况, 本文概述了近年来水环境中磺胺类合成药物的样品前处理技术和分析方法的研究进展, 对水环境中不同的样品前处理技术进行了比较, 总结了磺胺类合成药物的最新分析方法, 给出了近五年(2018—2022年)不同水环境介质中磺胺类合成药物分析测定的实例, 可望能为今后水环境中痕量磺胺类合成药物的分析测定提供借鉴和参考。
1 磺胺类合成药物的理化性质充分了解目标分析物的理化性质是进行样品前处理的重要前提, 磺胺类合成药物的结构通式如图 1所示, 它们都含有对氨基苯磺酰胺母核结构。磺酰胺基上的氢可以被不同杂环(R为杂环基, 如嘧啶、噻唑、恶唑和异恶唑等)取代, 以形成不同的磺胺类合成药物。不同的侧链部分导致不同的理化性质, 几种常见的磺胺类合成药物的理化性质见表 1。正辛醇-水分配系数(Kow)指示物质亲疏水性的强弱, 低lgKow值(如小于1)表示该物质可能优先分配到水中、亲水性强, 而高lgKow值(如大于1)意味着该物质疏水性强[10]。磺胺类合成药物大多具有相对较低的lgKow值, 亲水性强。酸度系数(pKa)是衡量物质酸碱性的指标[11]。磺胺类合成药物通常含有一个碱性伯氨基(–NH2)和一个酸性磺酰胺基(–SO2NH–), 呈现酸碱两性, 可溶解于酸碱溶液中, 且存在两个pKa值, 大多在2至2.5或5至8。
| 合成药物 | CAS号 | 化学结构 | 摩尔质量/(g·mol−1) | lgKowa | 水溶性a/(mg·L−1) | pKab |
| 磺胺甲恶唑(SMX) | 723-46-6 | 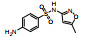 |
253.28 | 0.89 | 610 (37℃) | 1.97; 6.16 |
| 磺胺嘧啶(SDZ) | 68-35-9 | 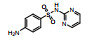 |
250.28 | −0.09 | 77 (25℃) | 2.01; 6.99 |
| 磺胺二甲嘧啶(SMZ) | 57-68-1 | 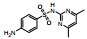 |
278.33 | 0.19 | 1 500 (29℃) | 2.00; 7.59 |
| 磺胺吡啶(SPY) | 144-83-2 | 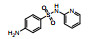 |
249.29 | 0.35 | 268 (25℃) | 2.14; 8.43 |
| 磺胺氯哒嗪(SCP) | 80-32-0 | 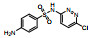 |
284.72 | 0.31 | 7 000 (37℃) | 2.02; 6.60 |
| 磺胺甲嘧啶(SMR) | 127-79-7 | 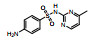 |
264.31 | 0.14 | 202 (20℃) | 2.00; 6.99 |
| 磺胺噻唑(STZ) | 72-14-0 | 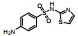 |
255.30 | 0.05 | 373 (25℃) | 2.04; 7.20 |
| a数据来源于Chemical Aquatic Fate and Effects (CAFE)数据库(2023); b数据来源于DrugBank数据库(2023) | ||||||
样品前处理技术是对水环境中磺胺类合成药物分析检测前的关键步骤, 包括样品的预处理与分离富集。磺胺类合成药物在水环境中的残留量大多为痕量或超痕量水平(ng/L至μg/L级), 此外水环境中样品成分十分复杂, 残留的合成药物含量低、种类多, 因此, 需要对环境样品进行适当的处理以最大限度地降低乃至去除样品中杂质的干扰, 并从中分离和富集目标分析物以实现灵敏测定。
2.1 环境样品的预处理 2.1.1 水体样品对于水体样品而言, 从环境中采集水样后, 为了防止样品中目标分析物降解通常将水样保存至棕色玻璃瓶中, 同时应保证在低温条件下(4 ℃)进行运输。将样品运送至实验室后, 首先对其进行过滤处理, 主要用于去除固体颗粒并减少后续分析过程中颗粒物所造成的干扰, 如可能导致SPE柱堵塞从而增加样品前处理的时间。通常选择孔径为0.45 μm的玻璃纤维或尼龙膜过滤器进行预过滤, 有时为了防止膜饱和需要先进行离心以去除较大颗粒物。
由于环境水体中含有许多金属离子, 包括二价或多价阳离子, 因此, 在处理多残留目标物的水样时, 往往需要添加乙二胺四乙酸(Ethylene diamine tetraacetic acid, EDTA)作为螯合剂, 这是为了防止水样中残留的氟喹诺酮类、四环素类或大环内酯类等与这些离子形成络合物, 不可逆地与SPE萃取小柱结合从而降低回收率。然而单独处理磺胺类合成药物时则不需要此步骤, 因为它们不会与水中的二价和多价阳离子形成络合物, 因此无需添加EDTA。磺胺类合成药物具有酸碱两性, 溶液的pH值决定了它们的离解形态, 在pH值为2的酸性条件下带正电, 在pH 2和5之间呈中性, 在pH值高于5时带负电。大多数情况下, 通过加入硫酸或盐酸将样品溶液的pH值调节至3左右, 在处理多残留目标物的样品时将pH值范围调节至2~4, 可以提高样品的回收率[12]。此外, 海水与淡水样品的预处理操作基本无差异[13]。
2.1.2 沉积物样品与水体样品相比, 沉积物样品的预处理步骤更为繁琐, 需要经过冷冻干燥、研磨和过筛等操作。冷冻干燥的优势在于可以避免活性成分的化学变化、减少挥发性成分的损失且使大部分干沉积物颗粒保持分散状态。将冷冻干燥后的样品置于研钵中进行研磨, 过筛并混匀。样品在进行后续分析前需要冷冻保存, 快速深度冷冻可以最好地保持样品的完整性, 温度越低越好, −80 ℃是建议保存的最低温度[14]。
此外, 与水体样品不同的是, 沉积物样品在进行进一步的SPE分离富集前, 必须先将其中的磺胺类合成药物由吸附态转变为溶解态。为此, 多数研究选择将弱酸性Mcllvaine或柠檬酸作为缓冲液加入至预处理过的样品中, 经超声混匀后离心, 使用0.45 μm的玻璃纤维过滤器过滤[15]。过滤后的液体样品的分离富集方法与水体样品相同。
2.1.3 生物体样品关于生物体样品中磺胺类合成药物及其代谢产物的研究大多涉及鱼类, 也有一些关于虾类及贝类的报道, 其中有从环境中直接捕捞获得, 也有一些是从水产养殖场采集而来。生物体样品中往往含有大量的脂肪和蛋白质, 这使样品的预处理变得更加复杂, 一般步骤包括样品均质化、使用酸或有机溶剂将蛋白质沉淀、机械振荡或超声处理以将吸附的磺胺类合成药物释放到溶液中以及沉淀物和液相的分离等[16]。首先需要对生物组织进行均质化, 后伴随研磨或者超声处理。其中, 使用极性或非极性有机溶剂从匀浆样品中分离磺胺类合成药物时, 乙腈最为常用, 也有研究使用甲醇、乙酸乙酯或二氯甲烷[17]。此外, 可通过SPE进一步分离纯化以及使用正己烷有效去除脂肪。
2.2 磺胺类合成药物的分离富集水环境中磺胺类合成药物的分离富集方法主要包括LLE和SPE等, 其中, SPE已取代传统的LLE成为目前应用最广泛的样品前处理技术。
2.2.1 液液萃取LLE是应用最早的一种样品前处理技术, 其作用原理是根据样品中不同组分在两种不相混溶液体中溶解度或分配系数的差异以实现分离或富集。LLE虽无需特殊装置, 但其操作繁琐、耗时长且使用大量有毒溶剂、可能对环境造成二次污染。因此, 自2000年以来, LLE技术并未被广泛用于水环境中磺胺类合成药物的分离富集。为了克服其缺点, 经改进后逐渐发展出单滴微萃取(Single-drop microextraction, SDME)、中空纤维液相微萃取(Hollow fiber liquid- phase microextraction, HF-LPME)及分散液液微萃取(Dispersive liquid-liquid microextraction, DLLME)等液相微萃取(Liquid-phase microextraction, LPME)技术[18-20]。LPME是一种溶剂最小化的LLE样品前处理技术, 仅需几微升溶剂即可浓缩来自各种样品的分析物, 而不是传统LLE所需的数百毫升, 其操作简便、成本低、回收率高且环保[21]。其中, DLLME目前受到广泛关注。
DLLME是由Rezaee等于2006年提出的一种新型LPME技术, 通过将微升萃取溶剂和毫升分散溶剂快速注入水性样品溶液中, 形成浑浊的溶液, 其中目标分析物可以被萃取溶剂浓缩, 离心后萃取溶剂沉积在管底, 之后用微量注射器将其取出, 用于进一步分析[22]。DLLME萃取过程简单、有机溶剂用量低, 但其主要缺点是无法将亲水性化合物萃取到萃取溶剂中、样品体积受限以及离心步骤耗时多。由于磺胺类合成药物多为极性化合物, 易溶于水, 故而DLLME技术对磺胺类合成药物的实际应用并不理想。近年来, 已经采用了多种策略来解决DLLME在实际应用中遇到的问题。其中, 使用离子液体(Ionic liquids, ILs)代替有毒有机溶剂作为萃取溶剂不仅环保、省时, 也为磺胺类合成药物的分离富集提供了更高的效率[23]。在2018年, Chatzimitakos等[24]提出了一种基于磁性离子液体(Magnetic ionic liquids, MILs)的新型DLLME技术, 以石英为MILs的固体载体, 从城市污水处理厂的污水和湖水中富集磺胺类合成药物。将固体载体与MILs混合, 克服了MILs称量及控制MILs均匀分散的难题, 显著提高了方法的重现性和效率。通过调节pH值大大缩短了富集时间, 仅15 min即可从同一样品中同时富集三嗪类和磺胺类合成药物。该方法具有良好的灵敏度、精度和回收率(89%~101%)[24]。此外, 采用基于离子对的表面活性剂辅助微萃取能够克服传统DLLME无法将亲水化合物萃取到萃取溶剂中这一困难[25]。使用基于离子对的在线乳化液相微萃取法对水样中的磺胺类合成药物进行萃取, 磺胺类合成药物与阳离子表面活性剂形成离子对络合物后, 被萃取到分散的有机萃取溶剂液滴中。然后将水溶液中的萃取相乳液通过在线过滤器, 基于乳液过滤进行分离, 检测限(Limit of detection, LOD)为0.1~0.3 μg·L−1, 相对标准偏差为4.7%~5.8%, 回收率在41%~97%之间。该方法避免了DLLME中最耗时的离心步骤、简化了操作, 此外, 整个过程中使用的有机溶剂很少、较为环保[26]。
2.2.2 固相萃取SPE技术是从20世纪80年代中期开始发展起来, 采用选择性吸附与选择性洗脱的方式对样品溶液中的目标分析物进行分离、纯化和富集, 是一种包含固相和液相的萃取过程。样品溶液中的目标分析物首先通过固体吸附剂被富集吸附, 然后使用适当强度的溶剂洗去杂质, 最后用少量溶剂将目标分析物从吸附剂中洗脱出来, 用于后续的仪器分析。与传统的LLE相比, SPE可以提高目标分析物的回收率, 降低有机溶剂消耗量, 减少样品处理时间, 降低成本, 减轻环境负荷, 还可以实现整个过程的自动化。SPE还为同时从水样中富集多种目标分析物提供了更高的选择性和重现性。此外, SPE不需要进行LLE所需的相分离, 从而避免了LLE中由于测量体积不准确所引起的误差[27]。近年来, SPE逐渐替代传统的LLE技术, 被广泛用于水环境中磺胺类合成药物样品的前处理。采用SPE技术成功从中国天津和北京的牲畜污水、地表水和地下水样中富集到包括磺胺类合成药物在内的35种不同类别的药物, 具有处理时间短、样品消耗量小及重现性好等优点[28]。此外, SPE技术也可用于沉积物中磺胺类合成药物的分离和富集[29]。然而, SPE技术仍然存在一些缺点, 如柱填料消耗量较大以及在复杂样品的处理中易出现柱堵塞。为了进一步提高样品处理速度、降低成本, 同时适应所需的分析仪器, 以传统SPE为基础进一步改进后逐渐发展出磁性固相萃取(Magnetic solid phase extraction, MSPE)和分子印迹固相萃取(Molecularly imprinted solid phase extraction, MISPE)等新技术。
MSPE于1999年首次提出, 是一种使用磁性吸附剂从大批量样品中富集目标分析物的新型SPE技术, 该方法首先将磁性吸附剂加入到含有目标分析物的样品溶液中, 目标分析物将被吸附到磁性吸附剂上, 然后使用适当的磁力分离器回收磁性吸附剂, 最后洗脱目标分析物并进行分析[30]。MSPE通过施加外部磁场易与样品基质分离, 并且由于吸附剂可以通过涡旋或搅拌均匀分散在样品溶液中, 显著增加了吸附剂与目标分析物之间的接触面积, 这大大提高了萃取效率。与传统SPE相比, MSPE不需要装填萃取柱, 简化了操作过程、克服了因大体积样品所耗费的时间。此外, 磁性吸附剂可通过甲醇等有机溶剂再生以重复利用, 环保且成本低。因此, MSPE近年来逐渐发展并用于水环境中磺胺类合成药物的分离、纯化和富集。通过赋予新型材料磁性, 可以在萃取过程中实现更简单、更快速的分离过程和更大的接触面积。将卟啉官能化的核壳磁性纳米球作为一种新型的磁性吸附剂, 用于富集湖水样品中的6种磺胺类合成药物如磺胺嘧啶、磺胺甲嘧啶、磺胺二甲嘧啶、磺胺间甲氧嘧啶、磺胺甲恶唑和磺胺二甲氧嘧啶, 加标回收率为95.7%~107.3%, 相对标准偏差≤6.7%。该方法具有较高的灵敏度、精密度和回收率[31]。大多数研究中仅采用一种磁性材料作为吸附剂, 导致其与目标分析物之间的作用位点相对单一, 而采用混合吸附剂可满足对多类别目标分析物的同时富集。有研究者将磁性大孔有机共聚物材料与磁性金属有机骨架材料作为混合吸附剂, 同时富集水中12种磺胺类和喹诺酮类合成药物。与以往的MSPE技术相比, 此法具有操作简单、省时、样品不易损失和有机溶剂消耗量少等优势[32]。以上研究表明这些新型的磁性材料可以作为一种潜在的吸附剂用于水环境中痕量磺胺类合成药物的高效萃取。
MISPE是一种以分子印迹聚合物(Molecularly imprinted polymers, MIPs)作为吸附剂的由传统SPE发展而来的新型萃取技术。MIPs作为SPE选择性吸附剂的应用最早由Sellergren于1994年提出[33], 它是采用分子印迹技术制备的对特定模板分子(目标分子)具有特异性识别和选择性吸附的聚合物。首先使模板分子与功能单体以共价或非共价结合的方式形成复合物, 然后加入交联剂在引发剂(热或光)的作用下进行聚合生成高度交联的聚合物, 通过适当的方式洗脱除去模板分子, 从而形成具有识别模板分子的结合位点, 最终得到对模板分子具有特异性识别能力的MIPs。MIPs除了具有高度热稳定性和化学稳定性的优点外, 与其他技术相比, 主要优势在于其高亲和力和高选择性, 理论上MIPs可以从样品基质中特异性地吸附目标化合物, 无需分离直接对目标物进行分析[34]。将MISPE技术应用于水环境中磺胺类合成药物的分离富集得到了较好的效果。以磺胺嘧啶为模板分子, 甲基丙烯酸为功能单体, 合成了对磺胺嘧啶具有高亲和力的MIPs, 用于胶州湾海水样品中磺胺嘧啶的选择性富集, 测得加标海水样品的回收率高达88%, 成功建立了MISPE高选择性样品净化方法[35]。以3-氨丙基三乙氧基硅烷为功能单体, 磺胺嘧啶为模板分子, 采用反相微乳液表面接枝法制备了分子印迹二氧化硅层(MIP-QDs), 并成功应用于海水和虾样品中磺胺嘧啶的检测, 均获得了良好的加标回收率(82.7%~ 99.9%), 该法为海水及海洋生物样品中磺胺嘧啶的快速灵敏检测提供了有力支撑[36]。然而这种方法因其特异性太强并不适用于多残留目标分析物的快速同时富集, 因而在实际测定中并不常用。
为了获得最佳萃取效果, 吸附剂的选择尤为关键, 这种选择主要取决于目标分析物的理化性质(极性和官能团)以及吸附剂与目标分析物之间的相互作用, 此外样品基质的极性也需考虑。常用的SPE吸附剂类型包括聚合物(如Oasis HLB)、碳材料(如碳纳米管、石墨烯、氧化石墨烯)、MIPs、金属有机骨架(Metal organic frameworks, MOFs)、共价有机骨架(Covalent organic frameworks, COFs)和磁性材料等。目前, 大多数研究仍选择使用Oasis HLB柱进行萃取。Oasis HLB是一种亲水亲脂性平衡聚合物, 由两种单体成分的平衡比例组成: 亲水性的N-乙烯基吡咯烷酮和亲脂性的二乙烯基苯乙烯基吡咯烷酮, 可用于极性和非极性化合物的萃取, 而且在整个pH范围(从1到14)内都具有高度稳定性, 因此可以富集酸性、碱性和中性化合物[37]。如前所述, MIPs表现出不同于其他吸附剂的高特异性和选择性的独特优势, 此外MIPs具有廉价易得、机械性能好与使用寿命长等优点, 因而在水环境中磺胺类合成药物的富集方面具有广泛的应用前景, 但因其特异性强故不适用于多残留分析物的快速同时富集。MOFs和COFs是两种具有相似特征的新型吸附剂, 均具有多孔性及大的比表面积。尽管其使用率相对较低, 但它们仍有相当大的潜力用于富集水环境中的磺胺类合成药物, 比如与其他吸附材料相结合使用。值得注意的是, 磁性材料作为一种新型吸附剂由于其易回收和再利用等优点目前受到广泛关注, 有望实现环境水样中磺胺类合成药物的高效富集。此外, 还可将磁性材料与其他新型材料相结合、赋予其磁性。与使用Oasis HLB萃取柱的传统SPE方法相比, MMIPs方法使用的溶剂更少、几乎不需要进行样品处理, 而且其基质效应也相对较低[38]。
样品的前处理对于水环境中磺胺类合成药物的灵敏检测至关重要。表 2列出了近五年水环境中磺胺类合成药物样品前处理的方法条件, 表 3比较了不同样品前处理技术的优缺点, 它们在提高磺胺类合成药物的富集性能方面各有优势。此外, 随着对新型吸附剂的不断探索, 相信未来水环境中磺胺类合成药物的富集将更加有效、精确且更加具有靶向特异性。
| 分析物 | 样品来源 | 预处理 | 分离富集 | 回收率/% | 参考文献 |
| SMX等5个 | 巢湖, 湖水 | 过滤(0.45 μm玻璃纤维膜), pH 2~3, EDTA | SPE(Oasis HLB, 500 mg, 6 mL), 超纯水淋洗, 甲醇洗脱, 10%甲醇复溶 | 69~95 | [39] |
| SMZ等5个 | 西班牙地中海沿岸, 淡水和海水 | 过滤(1 μm玻璃纤维膜, 0.45 μm尼龙膜), pH 2.5, EDTA | SPE(Oasis HLB, 200 mg, 6 mL), 超纯水淋洗, 甲醇洗脱, 50%甲醇复溶 | 55.3~123.1 | [13] |
| SDZ及代谢产物等9个 | 珠江三角洲, 河水 | 过滤(0.45 μm尼龙膜), pH 3, EDTA | SPE(Poly-Sery HLB, 500 mg, 6 mL), 超纯水淋洗, 甲醇洗脱、复溶 | 54~138 | [40] |
| SMX等10个 | 渤海大连近岸海域, 海水 | 过滤(0.45 μm玻璃纤维膜), pH 2.5, EDTA | SPE(Oasis HLB, 500 mg, 6 mL), 超纯水淋洗, 甲醇洗脱、复溶 | 68.4~114.6 | [41] |
| SDZ等16个 | 胶州湾, 沉积物 | 柠檬酸+氯化镁+乙腈, 超声, pH 4, 过滤(0.7 μm玻璃纤维膜) | SPE(Oasis HLB, 500 mg, 6 mL), 超纯水淋洗, 甲醇洗脱, 30%乙腈复溶 | 79~95 | [15] |
| SMX等6个 | 淀山湖, 沉积物 | 甲醇+丙酮, 超声, pH 3 | SPE(Oasis HLB, 500 mg, 6 mL), 甲醇淋洗、洗脱、复溶 | 41.9~76.1 | [42] |
| SMX等13个 | 太湖, 鱼、蟹和虾肝脏和肌肉 | 醋酸钠+甲醇, 超声, pH 4, EDTA | SPE(SAX/PSA-HLB, 500mg/500 mg+200 mg, 6 mL), 甲醇洗脱、复溶 | 肝脏48.6~123 肌肉53.7~108 |
[43] |
| SMX等8个 | 北部湾, 蟹、虾和牡蛎肌肉 | 甲醇+乙酸, 超声, pH 3, EDTA | SPE(SAX/PSA-HLB), 甲醇洗脱、复溶 | 82~106 | [44] |
| 样品前处理技术 | 优点 | 缺点 |
| LLE | 设备易获取 | 操作繁琐; 耗时长; 有机溶剂用量大; 成本高; 环境污染 |
| DLLME | 与LLE相比, 操作简易; 有机溶剂用量少; 成本低; 环保 | 样品体积受限; 离心耗时长 |
| SPE | 与LLE相比, 回收率高; 灵敏度高; 操作简易; 节省时间; 有机溶剂用量少; 成本低; 环保; 可实现自动化; 重现性好 | 柱填料消耗量较大; 处理复杂样品时易出现柱堵塞 |
| MSPE | 与SPE相比, 回收率高; 无需装填萃取柱、避免柱堵塞; 操作简易; 节省时间; 有机溶剂用量少; 成本低; 环保 | 磁性吸附剂易附着在分析物上 |
| MISPE | 与SPE相比, 特异性和选择性高; 回收率高 | 模板泄漏; MIPs合成困难 |
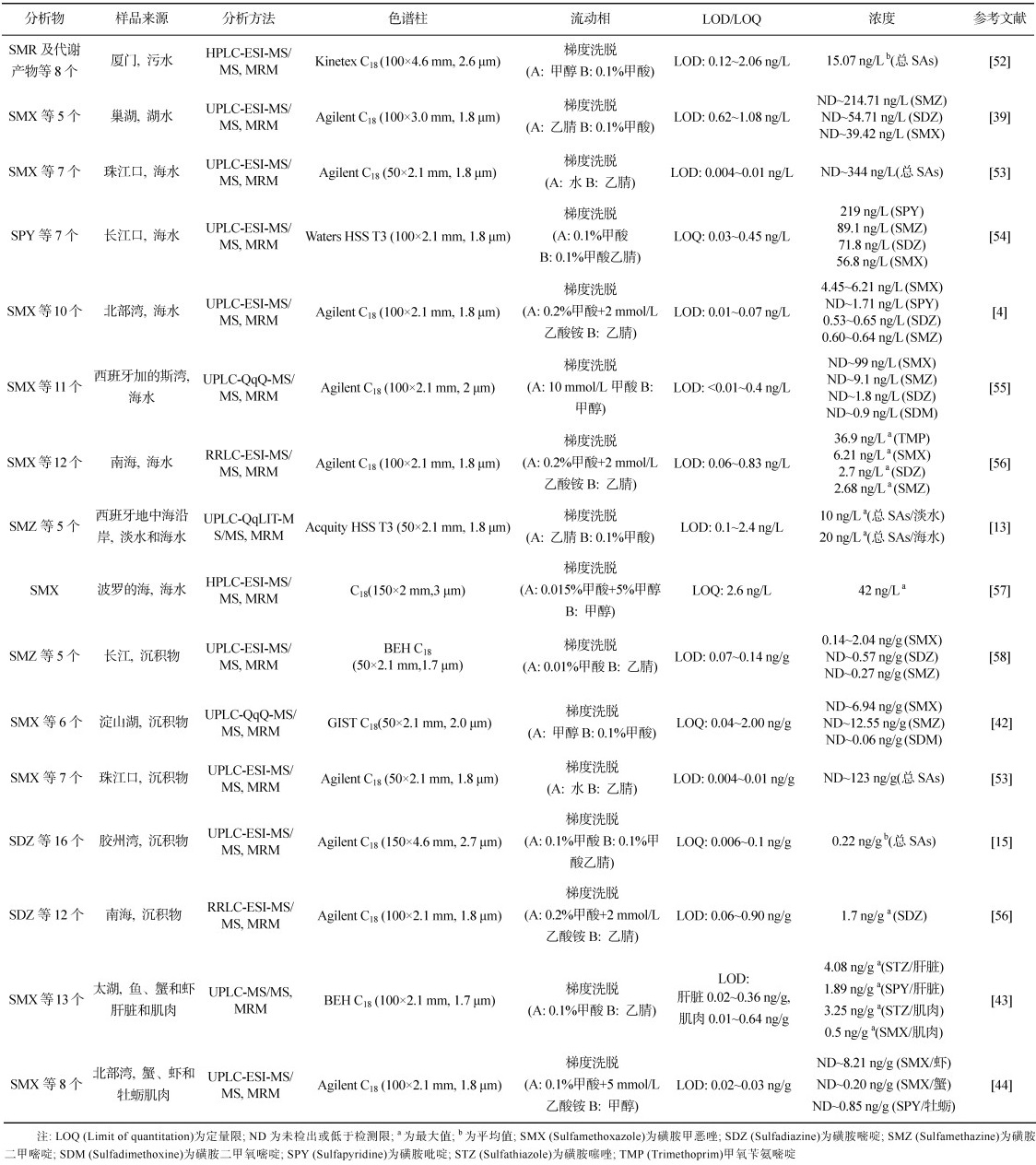
水环境中磺胺类合成药物的分析方法主要包括液相色谱(Liquid chromatography, LC)、液相色谱-质谱联用(LC-MS)和酶联免疫吸附测定(Enzyme-linked immunosorbent assay, ELISA)等。ELISA是一种相对新的磺胺类合成药物分析方法, 利用抗原抗体特异性结合的免疫反应来实现对水环境中磺胺类合成药物的定性和定量分析[45]。ELISA法对于结构类似的化合物存在交叉反应, 降低了检测的特异性, 适用于目标分析物的初步筛选, 检测对象相对单一, 不能同时满足多类别目标分析物的定性和定量分析, 其准确性和灵敏度相对较低。LC是目前最常用的一种高效且快速的色谱分离方法, 可以与特定的检测器联合以进行药物的分析测定。首先通过LC将目标待测物分离, 然后选择不同类型的检测器对目标待测物进行定性和定量分析。通常根据目标分析物的理化性质选择特定类型的检测器, 如紫外、荧光和质谱(MS)检测器[13, 46-47]。紫外检测器主要用于具有紫外光吸收基团的药物分析, 具有噪声低、线性范围宽等优点。紫外检测是最便宜、最通用的检测方法, 但是其选择性和灵敏度也是最低的。荧光检测器具有相对较高的灵敏度和选择性, 但是仅限于检测产生荧光的化合物, 而且还需要进行额外的衍生化处理, 因而导致其应用受限。尽管紫外和荧光检测器是相对简单和廉价的选择, 但是其灵敏度不足以量化水环境中的痕量磺胺类合成药物, 且可靠性较差, 无法确证目标分析物的确切结构。与紫外和荧光检测器相比, MS作为一种确证性的检测器, 可以鉴定具有高分子特异性和高检测灵敏度的化合物, 准确提供目标分析物的分子结构和定量数据。LC-MS将LC优秀的分离性能与MS灵敏的检测能力相结合, 这种组合有效提高了分析的精确度和灵敏度并且缩短了分析时间。由于其灵敏度高、选择性高、检测限低及重现性好等优势, LC-MS已成为目前应用最广泛的药物分析方法, 特别是对水环境中磺胺类合成药物的分析测定。表 4总结了近五年来使用LC-MS方法测定不同水环境样品(海水、淡水、污水、沉积物和生物体)中磺胺类合成药物的分析条件, 同时对比了全球范围内不同环境介质中磺胺类合成药物的浓度水平。
|
磺胺类合成药物的LC分离大多使用反相C18色谱柱。柱温会对目标分析物的保留作用产生一定的影响, 不稳定的柱温可能会导致保留时间的偏移和洗脱顺序的改变, 这主要是因为温度不同会导致溶质在流动相中的溶解度不同, 因此维持恒定的柱温非常重要。磺胺类合成药物的柱温通常选择在30 ℃至40 ℃之间。流动相一般由甲醇、乙腈或水组成。为了提高电离效率和灵敏度, 通常选择向流动相中加入乙酸铵、甲酸或乙酸等挥发性添加剂[48]。一般使用由极性和非极性溶剂组成的混合液体流动相进行洗脱, 其中大多选择水作为极性溶剂, 乙腈作为非极性溶剂。多数研究均采用梯度洗脱的方式用于分离复杂基质中的大量目标分析物。选择合适的色谱柱、优化流动相的组成和洗脱过程是提高LC分离性能的关键。
高效液相色谱(High performance liquid chromatography, HPLC)是LC系列的重要组成部分, 根据固定相和流动相之间的相互作用将目标分析物从多组分混合物中分离出来, 因其具有高压、高速、高效、高灵敏度和应用范围广等特点而被广泛用于痕量磺胺类合成药物的分析。然而, HPLC有时受限于分离效率低和用于痕量分析的检测限不足。目前, UPLC越来越多地应用于磺胺类合成药物的快速分离。UPLC在HPLC的基础上, 使用了更小颗粒的色谱柱填料, 粒径可低至1.6 μm, 而HPLC则大多在2.5~5 μm范围内[49]。此外, UPLC还提高了色谱的速度、分离度和灵敏度, 减少了分析时间, 同时降低了溶剂的消耗量和分析成本, 可在不损失高质量分析结果的前提下实现快速分离。由于色谱柱粒径的减小, 仪器内部所产生的压力也相应增大, 但是这种过大的压力可能会导致泵的使用寿命降低以及仪器的连接部位老化速度加快等问题的出现。
MS的检测原理是先将目标分析物离子化, 根据离子的质荷比(m/z)进行分离, 最终提供目标分析物的分子量和分子结构信息。经LC分离的待测物通过离子源进入MS仪中, 离子源的类型包括电喷雾电离(Electrospray ionization, ESI)、大气压化学电离(Atmospheric pressure chemical ionization, APCI)和大气压光电离(Atmospheric pressure photo-ionization, APPI)等。其中, ESI仍然是目前磺胺类合成药物分析中的首选。在ESI中, 电离以正或负离子模式运行。磺胺类合成药物由于呈现酸碱两性, 因而在正负模式下都能够发生电离, 但通常首选正电离模式, 这主要是因为在该模式下可以进行多数不同种药物的同时检测。为了进一步提高MS的分析和鉴定能力, 增加其灵敏度和准确性, MS/MS在磺胺类合成药物的分析中得到了广泛应用。大多在多反应监测(Multiple reaction monitoring, MRM)模式下进行, 首先于MS/MS的一级MS中选择特定的母离子, 然后进入含有中性气体(如氩气、氮气或氦气)的碰撞池诱导解离, 其中产生的主要碎片离子由二级MS选择并转移到离子检测器进行定量分析。质子化的分子[M+H]被选作定量的母离子, 磺胺类合成药物通常产生m/z为92、108和156的子离子, 其中代表磺酰胺的子离子m/z 156被用于大多数磺胺类合成药物的定量。随着三重四级杆(QqQ)-MS、四极杆飞行时间(QTOF)-MS、四极杆线性离子阱(QqLIT)-MS和Q-Orbitrap-MS等新型仪器的不断发展, 水环境中痕量磺胺类合成药物的检测效率也得到了明显提升[50]。
HPLC-MS/MS具有高选择性和高灵敏度的特点, 已成为鉴定不同水环境基质中磺胺类合成药物的主要分析技术。Wei等[51]开发了一种基于LC-MS/MS的灵敏快速分析方法, 同时测定了地表水、沉积物以及鱼类肌肉中包括磺胺类合成药物在内的四类抗生素, 采用LC-MS/MS技术在MRM模式下对所有化合物进行定量, 该方法分析时间短、灵敏度高, 能够在一次运行中从每一种水、沉积物和鱼类基质中同时测定多种抗生素。然而在使用HPLC-MS/MS进行药物分析的过程中仍然存在一些不足, 如有机溶剂和HPLC-MS/MS设备导致的高成本。UPLC的发展大大缩短了分析时间, 通过将色谱柱填料的粒径降低到2 μm以下, 分辨率可以得到明显提高, 从而在更短的时间内实现更加有效的分离。有报告称已经建立了一种优化的SPE与UPLC-MS/MS联合的方法[28], 成功用于环境水样中磺胺类合成药物等35种不同抗生素的有效分析, 整个分析过程在不到10 min的时间内完成, LOD为0.29~4.03 ng/L, 这种新开发的方法具有样品消耗量小、检测时间短、灵敏度高及重现性好等优点, 为同时检测水环境中的多种药物残留提供了一种可靠且有效的方法。最近有研究者提出了一种“直接进样”的新型且快速的UPLC-MS/MS方法[9], 并验证了其在ng/L浓度水平下对污水中135种包括磺胺类合成药物在内的新污染物的定量测定, 总分析时间仅为5 min, 且可在24 h内进行多达261次进样。该法的新颖之处在于提高了样品制备的便利性, 并成功应用了UPLC-MS/MS方法, 大大降低了分析时间。由于进样体积仅为10 μL, 这种方法还有助于方便且经济高效地进行较小样品的国际运输, 并减少了存储所需的空间。这种直接分析的方法将有可能实现人工合成药物等新污染物在水环境中的快速分析, 最终进行对环境风险的评估。
4 结语与展望水环境中磺胺类合成药物的使用后续残留问题已在全球范围内受到广泛关注。开发快速、灵敏的分析方法有助于及时监测和探明水环境中磺胺类合成药物的生态环境效应。近年来, 已经开发一些较为成熟的的分析方法来检测不同水环境介质中痕量磺胺类合成药物的残留。样品前处理技术对于实现磺胺类合成药物的灵敏检测至关重要, 其中SPE技术以其高回收率、高选择性、高重现性、低成本、低环境负荷及可自动化等优势广泛用于水环境中磺胺类合成药物的分离、纯化和富集。新型吸附剂材料的开发对于磺胺类合成药物的高效富集至关重要。目前, 水环境中磺胺类合成药物的分析方法主要为LC-MS/MS, 其具有灵敏度高、重现性好及检测限低等优点, 此外还适用于多种药物的同时检测和定量。
尽管近年来对水环境中磺胺类合成药物的样品前处理技术及分析方法进行了许多研究, 然而对于不同水环境样品中磺胺类合成药物分析测定的进一步优化仍然具有挑战性。有以下几点建议可供参考: (1)重点关注代谢产物及降解产物的分析测定。考虑到进入水环境中的磺胺类合成药物有很大部分是以其代谢产物的形式存在, 然而目前针对水环境中磺胺类代谢产物及降解产物的测定方法不多, 大多为对其已知乙酰化代谢产物的分析, 然而更应该关注的是未知代谢产物以及降解产物的监测。(2)开发对多种分析物残留的标准化分析方法, 实现对多种人工合成药物的同时检测。磺胺类合成药物在水环境中并不是单独存在, 往往是多种人工合成药物共存, 因此开发出对不同分析物的同时分析方法有望更全面地监测水环境中人工合成药物的污染情况。(3)进行在线SPE分离富集, 实现自动化。未来需要建立人工合成药物及其未知代谢产物和降解产物的在线检测方案, 以便更好更快地对其进行监测和管控。(4)开发更为简便易操作的的分析测定方法。目前使用的HPLC、UPLC及MS分析仪器设备较复杂, 费用较高, 且操作较为复杂。未来还需在保证快速、灵敏的基础上开发操作更为简便的分析方法。
| [1] |
PENG Q C, SONG J M, LI X G, et al. Biogeochemical characteristics and ecological risk assessment of pharmaceutically active compounds (PhACs) in the surface seawaters of Jiaozhou Bay, North China[J]. Environmental Pollution, 2019, 255(Pt 1): 113247. |
| [2] |
戴佳佳, 宋金明, 李学刚, 等. 中国典型水域磺胺类合成药物的环境生物地球化学特征[J]. 海洋与湖沼, 2023, 54(4): 935-950. DAI Jiajia, SONG Jinming, LI Xuegang, et al. Environmental biogeochemical characteristics of sulfonamides in typical aquatic environments of China[J]. Oceanologia et Limnologia Sinica, 2023, 54(4): 935-950. |
| [3] |
MOTOYAMA M, NAKAGAWA S, TANOUE R, et al. Residues of pharmaceutical products in recycled organic manure produced from sewage sludge and solid waste from livestock and relationship to their fermentation level[J]. Chemosphere, 2011, 84(4): 432-438. DOI:10.1016/j.chemosphere.2011.03.048 |
| [4] |
WU Q, PAN C G, WANG Y H, et al. Antibiotics in a subtropical food web from the Beibu Gulf, South China: Occurrence, bioaccumulation and trophic transfer[J]. Science of The Total Environment, 2021, 751: 141718. DOI:10.1016/j.scitotenv.2020.141718 |
| [5] |
ZENG H P, LI J X, ZHAO W H, et al. The current status and prevention of antibiotic pollution in groundwater in China[J]. International Journal of Environmental Research and Public Health, 2022, 19(18): 11256. DOI:10.3390/ijerph191811256 |
| [6] |
XIONG J Q, GOVINDWAR S, KURADE M B, et al. Toxicity of sulfamethazine and sulfamethoxazole and their removal by a green microalga, Scenedesmus obliquus[J]. Chemosphere, 2019, 218: 551-558. DOI:10.1016/j.chemosphere.2018.11.146 |
| [7] |
彭全材, 宋金明, 李宁. 胶州湾表层海水中6类抗菌药物的分布、来源与生态风险[J]. 海洋学报, 2018, 40(10): 71-83. PENG Quancai, SONG Jinming, LI Ning. Compositions, sources and ecological risk of 6 antibacterial agents in surface water of the Jiaozhou Bay, China[J]. Haiyang Xuebao, 2018, 40(10): 71-83. DOI:10.3969/j.issn.0253-4193.2018.10.008 |
| [8] |
范素素, 方烨渟, 蔡萌, 等. 水环境中磺胺类抗生素固相萃取-液质联用检测方法的建立及效果评估[J]. 环境工程学报, 2022, 16(8): 2764-2774. FAN Susu, FANG Yeting, CAI Meng, et al. Establishment of solid phase extraction-liquid masss pectrometry method for detection of sulfa antibiotics in water environment and its effect evaluation[J]. Chinese Journal of Environmental Engineering, 2022, 16(8): 2764-2774. |
| [9] |
NG K T, RAPP-WRIGHT H, EGLI M, et al. High-throughput multi-residue quantification of contaminants of emerging concern in wastewaters enabled using direct injection liquid chromatography-tandem mass spectrometry[J]. Journal of Hazardous Materials, 2020, 398: 122933. DOI:10.1016/j.jhazmat.2020.122933 |
| [10] |
PAVLOVIĆ D M, BABIĆ S, HORVAT A J M, et al. Sample preparation in analysis of pharmaceuticals[J]. TrAC Trends in Analytical Chemistry, 2007, 26(11): 1062-1075. DOI:10.1016/j.trac.2007.09.010 |
| [11] |
QIANG Z M, ADAMS C. Potentiometric determination of acid dissociation constants (pKa) for human and veterinary antibiotics[J]. Water Research, 2004, 38(12): 2874-2890. DOI:10.1016/j.watres.2004.03.017 |
| [12] |
KIM C, RYU H D, CHUNG E G, et al. A review of analytical procedures for the simultaneous determination of medically important veterinary antibiotics in environmental water: Sample preparation, liquid chromatography, and mass spectrometry[J]. Journal of Environmental Management, 2018, 217: 629-645. DOI:10.1016/j.jenvman.2018.04.006 |
| [13] |
SERRA-COMPTE A, PIKKEMAAT M G, ELFERINK A, et al. Combining an effect-based methodology with chemical analysis for antibiotics determination in wastewater and receiving freshwater and marine environment[J]. Environmental Pollution, 2021, 271: 116313. DOI:10.1016/j.envpol.2020.116313 |
| [14] |
FÖRSTNER U. Traceability of sediment analysis[J]. TrAC Trends in Analytical Chemistry, 2004, 23: 217-236. DOI:10.1016/S0165-9936(04)00312-7 |
| [15] |
PENG Q C, SONG J M, LI X G, et al. Pharmaceutically active compounds (PhACs) in surface sediments of the Jiaozhou Bay, north China[J]. Environmental Pollution, 2020, 266: 115245. DOI:10.1016/j.envpol.2020.115245 |
| [16] |
SANTOS L, RAMOS F. Analytical strategies for the detection and quantification of antibiotic residues in aquaculture fishes: A review[J]. Trends in Food Science & Technology, 2016, 52: 16-30. |
| [17] |
DMITRIENKO S G, KOCHUK E V, APYARI V V, et al. Recent advances in sample preparation techniques and methods of sulfonamides detection – A review[J]. Analytica Chimica Acta, 2014, 850: 6-25. DOI:10.1016/j.aca.2014.08.023 |
| [18] |
LI G, ROW K H. Single-drop microextraction technique for the determination of antibiotics in environmental water[J]. Journal of Separation Science, 2022, 45(4): 883-895. DOI:10.1002/jssc.202100682 |
| [19] |
MADIKIZELA L M, PAKADE V E, NCUBE S, et al. Application of hollow fibre-liquid phase microextraction technique for isolation and pre-concentration of pharmaceuticals in water[J]. Membranes, 2020, 10(11): 311. DOI:10.3390/membranes10110311 |
| [20] |
施艺玮, 张宁, 操雯, 等. 分散液液微萃取技术及其在生物样品分析中的研究进展[J]. 色谱, 2020, 38(5): 491-501. SHI Yiwei, ZHANG Ning, CAO Wen, et al. Advances in dispersive liquid-liquid microextraction and its application to analysis of biological samples[J]. Chinese Journal of Chromatography, 2020, 38(5): 491-501. |
| [21] |
SHARIFI V, ABBASI A, NOSRATI A. Application of hollow fiber liquid phase microextraction and dispersive liquid–liquid microextraction techniques in analytical toxicology[J]. Journal of Food and Drug Analysis, 2016, 24(2): 264-276. DOI:10.1016/j.jfda.2015.10.004 |
| [22] |
REZAEE M, ASSADI Y, MILANI HOSSEINI M R, et al. Determination of organic compounds in water using dispersive liquid–liquid microextraction[J]. Journal of Chromatography A, 2006, 1116(1): 1-9. |
| [23] |
XU X, SU R, ZHAO X, et al. Ionic liquid-based microwave-assisted dispersive liquid–liquid microextraction and derivatization of sulfonamides in river water, honey, milk, and animal plasma[J]. Analytica Chimica Acta, 2011, 707(1): 92-99. |
| [24] |
CHATZIMITAKOS T G, PIERSON S A, ANDERSON J L, et al. Enhanced magnetic ionic liquid-based dispersive liquid-liquid microextraction of triazines and sulfonamides through a one-pot, pH-modulated approach[J]. Journal of Chromatography A, 2018, 1571: 47-54. DOI:10.1016/j.chroma.2018.08.013 |
| [25] |
SALEH A, YAMINI Y, FARAJI M, et al. Ultrasound- assisted emulsification microextraction method based on applying low density organic solvents followed by gas chromatography analysis for the determination of polycyclic aromatic hydrocarbons in water samples[J]. Journal of Chromatography A, 2009, 1216(39): 6673-6679. DOI:10.1016/j.chroma.2009.08.001 |
| [26] |
EBRAHIMPOUR B, YAMINI Y, REZAZADEH M. A sensitive emulsification liquid phase microextraction coupled with on-line phase separation followed by HPLC for trace determination of sulfonamides in water samples[J]. Environmental Monitoring and Assessment, 2014, 187(1): 4162. |
| [27] |
PŁOTKA-WASYLKA J, SZCZEPAŃSKA N, DE LA GUARDIA M, et al. Modern trends in solid phase extraction: New sorbent media[J]. TrAC Trends in Analytical Chemistry, 2016, 77: 23-43. DOI:10.1016/j.trac.2015.10.010 |
| [28] |
XUE Q, QI Y J, LIU F. Ultra-high performance liquid chromatography-electrospray tandem mass spectrometry for the analysis of antibiotic residues in environmental waters[J]. Environmental Earth Sciences, 2014, 71(3): 1433-1440. DOI:10.1007/s12665-013-2548-z |
| [29] |
AWAD Y M, KIM S C, ABD EL-AZEEM S A M, et al. Veterinary antibiotics contamination in water, sediment, and soil near a swine manure composting facility[J]. Environmental Earth Sciences, 2014, 71(3): 1433-1440. DOI:10.1007/s12665-013-2548-z |
| [30] |
ŠAFAŘÍKOVÁ M, ŠAFAŘÍK I. Magnetic solid-phase extraction[J]. Journal of Magnetism and Magnetic Materials, 1999, 194(1): 108-112. |
| [31] |
ZHANG J, CHEN Z P, TANG S, et al. Fabrication of porphyrin-based magnetic covalent organic framework for effective extraction and enrichment of sulfonamides[J]. Analytica Chimica Acta, 2019, 1089: 66-77. DOI:10.1016/j.aca.2019.08.066 |
| [32] |
魏丹, 张菊, 国明. 基于混合吸附剂磁性固相萃取/高效液相色谱-串联质谱法测定水中磺胺和喹诺酮类抗生素残留[J]. 分析测试学报, 2022, 41(2): 187-195. WEI Dan, ZHANG Ju, GUO Ming. Determination of sulfonamides and quinolones antibiotics residues in water samples by high performance liquid chromatography-tandem mass spectrometry with mixed adsorbents based magnetic solid phase extraction[J]. Journal of Instrumental Analysis, 2022, 41(2): 187-195. |
| [33] |
SELLERGREN B. Direct drug determination by selective sample enrichment on an imprinted polymer[J]. Analytical Chemistry, 1994, 66(9): 1578-1582. DOI:10.1021/ac00081a036 |
| [34] |
FIGUEIREDO L, ERNY G L, SANTOS L, et al. Applications of molecularly imprinted polymers to the analysis and removal of personal care products: A review[J]. Talanta, 2016, 146: 754-765. DOI:10.1016/j.talanta.2015.06.027 |
| [35] |
LIAN Z R, HE X L, WANG J T. Determination of sulfadiazine in Jiaozhou Bay using molecularly imprinted solid-phase extraction followed by high-performance liquid chromatography with a diode-array detector[J]. Journal of Chromatography B, 2014, 957: 53-59. DOI:10.1016/j.jchromb.2014.02.053 |
| [36] |
DING H, JIAO H F, SHI X Z, et al. Molecularly imprinted optosensing sensor for highly selective and sensitive recognition of sulfadiazine in seawater and shrimp samples[J]. Sensors and Actuators B: Chemical, 2017, 246: 510-517. DOI:10.1016/j.snb.2017.02.096 |
| [37] |
ANDRADE-EIROA A, CANLE M, LEROY- CANCELLIERI V, et al. Solid-phase extraction of organic compounds: A critical review (Part I)[J]. TrAC Trends in Analytical Chemistry, 2016, 80: 641-654. DOI:10.1016/j.trac.2015.08.015 |
| [38] |
CHEN H Y, ZHANG Y Q, GAO B, et al. Fast determination of sulfonamides and their acetylated metabolites from environmental water based on magnetic molecularly imprinted polymers[J]. Environmental Science and Pollution Research, 2013, 20(12): 8567-8578. DOI:10.1007/s11356-013-1795-6 |
| [39] |
ZHOU Q Q, LIU G J, ARIF M, et al. Occurrence and risk assessment of antibiotics in the surface water of Chaohu Lake and its tributaries in China[J]. Science of The Total Environment, 2022, 807: 151040. DOI:10.1016/j.scitotenv.2021.151040 |
| [40] |
CUI J, FU L F, TANG B, et al. Occurrence, ecotoxicological risks of sulfonamides and their acetylated metabolites in the typical wastewater treatment plants and receiving rivers at the Pearl River Delta[J]. Science of The Total Environment, 2020, 709: 136192. DOI:10.1016/j.scitotenv.2019.136192 |
| [41] |
DU J, ZHAO H X, WANG Y, et al. Presence and environmental risk assessment of selected antibiotics in coastal water adjacent to mariculture areas in the Bohai Sea[J]. Ecotoxicology and Environmental Safety, 2019, 177: 117-123. DOI:10.1016/j.ecoenv.2019.03.075 |
| [42] |
CAO S S, DUAN Y P, TU Y J, et al. Pharmaceuticals and personal care products in a drinking water resource of Yangtze River Delta Ecology and Greenery Integration Development Demonstration Zone in China: Occurrence and human health risk assessment[J]. Science of The Total Environment, 2020, 721: 137624. DOI:10.1016/j.scitotenv.2020.137624 |
| [43] |
ZHOU L J, WANG W X, LV Y J, et al. Tissue concentrations, trophic transfer and human risks of antibiotics in freshwater food web in Lake Taihu, China[J]. Ecotoxicology and Environmental Safety, 2020, 197: 110626. DOI:10.1016/j.ecoenv.2020.110626 |
| [44] |
ZHANG R L, PEI J Y, ZHANG R J, et al. Occurrence and distribution of antibiotics in mariculture farms, estuaries and the coast of the Beibu Gulf, China: Bioconcentration and diet safety of seafood[J]. Ecotoxicology and Environmental Safety, 2018, 154: 27-35. DOI:10.1016/j.ecoenv.2018.02.006 |
| [45] |
ZHOU Q, PENG D P, WANG Y L, et al. A novel hapten and monoclonal-based enzyme-linked immunosorbent assay for sulfonamides in edible animal tissues[J]. Food Chemistry, 2014, 154: 52-62. DOI:10.1016/j.foodchem.2014.01.016 |
| [46] |
JI H Y, WU Y, DUAN Z J, et al. Sensitive determination of sulfonamides in environmental water by capillary electrophoresis coupled with both silvering detection window and in-capillary optical fiber light-emitting diode-induced fluorescence detector[J]. Electrophoresis, 2017, 38(3/4): 452-459. |
| [47] |
LI X Y, LI Q L, XUE A F, et al. Dispersive liquid–liquid microextraction coupled with single-drop microextraction for the fast determination of sulfonamides in environmental water samples by high performance liquid chromatography-ultraviolet detection[J]. Analytical Methods, 2016, 8(3): 517-525. DOI:10.1039/C5AY02619A |
| [48] |
HOFF R, PIZZOLATO T M, DIAZ-CRUZ M S. Trends in sulfonamides and their by-products analysis in environmental samples using mass spectrometry techniques[J]. Trends in Environmental Analytical Chemistry, 2016, 9: 24-36. DOI:10.1016/j.teac.2016.02.002 |
| [49] |
HE J, SONG L, ZHOU G Y, et al. The rapid analysis of antibiotics in animal meat and egg using a novel SEP method and UPLC–MS/MS[J]. Chromatographia, 2017, 80(9): 1329-1342. DOI:10.1007/s10337-017-3366-3 |
| [50] |
BECCARIA M, CABOOTER D. Current developments in LC-MS for pharmaceutical analysis[J]. Analyst, 2020, 145(4): 1129-1157. DOI:10.1039/C9AN02145K |
| [51] |
WEI Y M, ZHANG Y, XU J, et al. Simultaneous quantification of several classes of antibiotics in water, sediments, and fish muscles by liquid chromatography-tandem mass spectrometry[J]. Frontiers of Environmental Science & Engineering, 2014, 8(3): 357-371. |
| [52] |
王大鹏, 张娴, 颜昌宙. 高效液相色谱串联质谱法测定污水污泥中4种磺胺类药物及其乙酰化代谢物[J]. 环境化学, 2018, 37(10): 2143-2151. WANG Dapeng, ZHANG Xian, YAN Changzhou. Determination of four sulfonamides and their corresponding acetyl metabolites in wastewater and sludge by high performance liquid chromatography tandem mass spectrometr[J]. Environmental Chemistry, 2018, 37(10): 2143-2151. DOI:10.7524/j.issn.0254-6108.2017120804 |
| [53] |
LI S, SHI W Z, LI H M, et al. Antibiotics in water and sediments of rivers and coastal area of Zhuhai City, Pearl River estuary, south China[J]. Science of The Total Environment, 2018, 636: 1009-1019. DOI:10.1016/j.scitotenv.2018.04.358 |
| [54] |
YAN C X, YANG Y, ZHOU J L, et al. Antibiotics in the surface water of the Yangtze Estuary: Occurrence, distribution and risk assessment[J]. Environmental Pollution, 2013, 175: 22-29. DOI:10.1016/j.envpol.2012.12.008 |
| [55] |
BIEL-MAESO M, BAENA-NOGUERAS R M, COARADA-FERNÁNDEZ C, et al. Occurrence, distribution and environmental risk of pharmaceutically active compounds (PhACs) in coastal and ocean waters from the Gulf of Cadiz (SW Spain)[J]. Science of The Total Environment, 2018, 612: 649-659. DOI:10.1016/j.scitotenv.2017.08.279 |
| [56] |
CHEN H, LIU S, XU X R, et al. Antibiotics in the coastal environment of the Hailing Bay region, South China Sea: Spatial distribution, source analysis and ecological risks[J]. Marine Pollution Bulletin, 2015, 95(1): 365-373. DOI:10.1016/j.marpolbul.2015.04.025 |
| [57] |
NÖDLER K, VOUTSA D, LICHA T. Polar organic micropollutants in the coastal environment of different marine systems[J]. Marine Pollution Bulletin, 2014, 85(1): 50-59. DOI:10.1016/j.marpolbul.2014.06.024 |
| [58] |
ZHANG G D, LU S Y, WANG Y Q, et al. Occurrence of antibiotics and antibiotic resistance genes and their correlations in lower Yangtze River, China[J]. Environmental Pollution, 2020, 257: 113365. DOI:10.1016/j.envpol.2019.113365 |
 2024, Vol. 48
2024, Vol. 48


