文章信息
- 唐紫琦, 宋敏杰, 王馨, 孔凡洲, 耿慧霞, 颜天. 2024.
- TANG Ziqi, SONG Minjie, WANG Xin, KONG Fangzhou, GENG Huixia, YAN Tian. 2024.
- 2022年南黄海绿潮分布与浮游生物群落关系初探
- Relationship between green tide distribution and plankton community in the South Yellow Sea in 2022
- 海洋科学, 48(3): 26-41
- Marine Sciences, 48(3): 26-41.
- http://dx.doi.org/10.11759/hykx20240108003
-
文章历史
- 收稿日期:2024-01-08
- 修回日期:2024-02-04
2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
绿潮是一种由大型绿藻脱离固着基形成漂浮群体后, 快速增殖或聚集导致的海洋生态灾害。自2007年起, 我国南黄海频繁爆发大规模绿潮。研究表明, 绿潮在每年的4—5月苏北近岸暴发, 6月向北漂移并不断扩大影响范围, 7月主要分布于南黄海的35 °N以北区域[1-2]。绿潮的发生对海洋生态环境会带来许多影响。大型藻类的过度繁殖, 会造成海面被遮蔽, 从而影响了其他海洋浮游生物的繁殖与生长。除了生态危害之外, 绿潮的暴发严重地影响了当地的旅游业及渔业。据统计, 2009年黄海绿潮造成了6.4×108元的损失[3]。研究表明黄海绿潮原因种为浒苔。浒苔是一种拥有多种繁殖方式的大型藻类。相比于其他的竞争藻种, 浒苔具有较强的漂浮能力以及较高的营养盐吸收速率, 从而使得其具有较高的生长速率[4]。
浮游生物包括浮游植物、浮游动物以及浮游细菌。浮游生物是海洋生态系统重要组成部分。浮游生物的生理和代谢过程对海洋生态系统动力学和营养循环起着重要作用[5], 同时因为对环境的高度敏感也经常成为环境评价指标的一种[6-8]。研究表明, 浒苔能够吸收多种形式的氮磷营养盐, 与其他浮游植物形成强烈的竞争关系, 其中包括营养竞争和化感作用[9-12]。二者的竞争会导致浮游植物的生物量、优势种以及品质等发生变化, 从而引起浮游植物的捕食者-浮游动物受到类似的影响。已有的研究报道, 浮游动物在摄食低质量的浮游植物后可能会出现生长受抑制, 甚至死亡的现象[13]。在浒苔绿潮的持续影响下, 耐受物种逐渐占据优势地位从而引发次生灾害。除了食物网的级联影响, 浒苔可以为浮游动物提供良好孵育、生长、摄食场所。浮游细菌作为分解者, 与环境中的生物地球化学循环息息相关, 可以介导海洋中的碳、氮、硫以及磷循环。同时针对不同生境细菌呈现不同的分布模式[14]。研究显示, 绿潮发生后期水环境易缺氧并富含有机物, 从而引起某些功能细菌的增长, 如硫酸盐还原细菌[15]、纤维素降解细菌[16-21]等。浮游生物之间构成了一个较为完整的食物网, 掌握其变化过程可以更整体、系统地阐明绿潮对生态系统的影响。
文本采用提取eDNA, 然后利用高通量测序的方法分析浮游生物群落多样性。该方法无需分离生物个体, 就能提取浮游生物遗留的DNA[22]。在浮游植物和浮游动物群落研究中, 该方法可以避免传统分类学对物种进行鉴定过程中的误判[23-26]。在浮游细菌群落研究中, 该方法也能避免遗失非可培养菌株[27]信息。本研究利用高通量测序的方法调查了绿潮发生时浒苔覆盖区和无浒苔覆盖区的浮游生物群落, 以期全面了解绿潮期间, 浒苔分布与浮游生态系统的关系及其影响。
1 材料与方法 1.1 采样站位与时间2022年7月3日到8日期间, 根据卫星遥感(https://ncs.mnr.gov.cn/n1/n128/n298/230608173943784711.html)所示的绿潮分布情况, 在南黄海(119 °E~122.5 °E, 34.5 °N~37 °N)区域开展航次调查, 共设置了25个站位, 采样站位如图 1所示。
 |
| 图 1 南黄海采样站位分布图 Fig. 1 Sampling station in the South Yellow Sea |
各站位水温、盐度及叶绿素a参数通过CTD剖面仪(Maestro3, 加拿大RBR)现场获取。营养盐样品取自表层海水, 并在经过450 ℃灼烧6 h的GF/F玻璃纤维滤膜(Whatman、ф=25 mm)上过滤, 然后由全自动营养盐分析仪(QuAAtro, 德国SEAL)测定物质的量的浓度(下文简称浓度), 测定的营养盐包括硝酸盐(NO3−-N, µmol/L)、亚硝酸盐(NO2−-N, µmol/L)、铵盐(NH4+-N, µmol/L)、总溶解氮(TDN, µmol/L)、无机磷酸盐(PO43−-P, µmol/L)、总溶解磷(TDP, µmol/L)、硅酸盐(SiO32−-Si, µmol/L)。硝酸盐、亚硝酸盐、铵盐浓度之和为溶解无机氮(DIN, μmol/L)。TDN减去DIN得到溶解有机氮(DON, μmol/L)。TDP与无机磷酸盐浓度之差为溶解有机磷(DOP, μmol/L)。盐度、溶解氧(DO)、pH由梅特勒多参分析仪(SevenExcellence S479-uMix, 梅特勒·托利多)测定。各站位表层营养盐样品采集按照《海洋检测规范》[28]相关技术规程进行。
1.3 绿藻采集与定量分析浒苔生物量的获得与计算参照孔凡洲等[29]。用网口边长为1 m, 网眼边长1 cm的网具浮拖表层海水, 保持船速2~3 n mile/h, 浮拖5~10 min。获取漂浮绿藻后, 立即挤干水并记录生物量湿重。根据拖网距离, 计算浒苔生物量(t/km2)。各站位浒苔的平均生物量(B, 单位为t/km2)用如下公式计算:
其中, W为拖网获取漂浮藻类质量(g);a为海里与千米的换算值=1.852×1 000 m/km;V为调查船对地速度(km/h);T为拖网时间(h);L为网口边长=1 m。
1.4 浮游生物样品采集在各站位采取两份表层海水, 每份量取500 mL, 用200 µm筛绢除去大型浮游生物后, 一份通过0.45 µm的聚碳酸酯膜过滤, 保存滤膜作为浮游植物样品。第二份海水先通过2.0 µm的聚碳酸酯膜再经过0.22 µm的聚碳酸酯膜过滤, 收集滤膜分别作为浮游动物和浮游细菌样品, 全部样品由液氮冷冻保存待运回实验室后进行分析。
1.5 高通量测序高通量测序基于Illumina Novaseq平台进行, 浮游植物测序区域为18s V4区域[30], 所用引物为TAReuk454 FWD1F(5′-CCAGCASCYGCGGTAATTCC-3′)和TAReuk REv3R(5′-ACTTTCGTTCTTGATYRA-3′)。浮游动物测序区域为co 1[31], 所用引物为mICO1-intF(5′-GGWACWGGWTGAACWGTWTAYCCYCC-3′)和jgHCO2198(5′-TAIACYTCIGGRTGICCRAARAAYCA-3′)。浮游细菌测序区域为16s V3+V4区域[32], 所用引物为338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。测序以及数据前处理由北京百迈客生物科技有限公司完成。在97%的相似度水平上, 对获得的有效序列进行OTU划分。使用朴素贝叶斯分类器进行分类学注释, 以获取各站位浮游生物群落组成信息。
1.6 数据处理与分析使用R软件对浮游生物群落的Shannon、Simpson、Chao1、Richness指数计算并画图。使用IBM SPASS Statistics 28对浮游生物与环境因子进行斯皮尔曼(Spearman)相关性分析。使用Surfer对南黄海的环境状况进行画图。使用STAMP软件分析组间差异物种。使用Gephi绘制生物共线性网络。
2 结果 2.1 2022年7月南黄海浒苔生物量及分布2022年7月上旬调查区浒苔平均生物量达到1.81 t/km2, 以南黄海35 °N以北4×108 km2面积计, 生物量湿重估计值为7.24×104 t。其总体分布表现为山东近岸以及海州湾附近堆积, 南黄海中部(121 °E~122.5 °E, 35 °N~36 °N)处生物量较低(图 2)。根据浒苔平均生物量大小对调查区域进行划分, 平均生物量高于0.001 t/km2站位称为浒苔覆盖区(UCR), 平均生物量低于0.001 t/km2的站位称为无浒苔覆盖区(NUCR)。
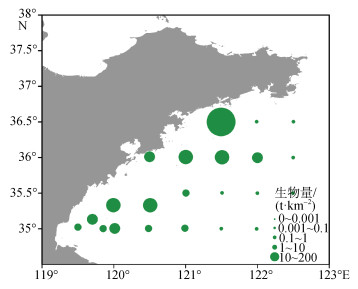 |
| 图 2 2022年7月上旬南黄海浒苔生物量分布图 Fig. 2 Biomass distribution of Ulva prolifera in the Southern Yellow Sea in early July 2022 |
2022年7月南黄海基础环境特征如图 3所示。叶绿素a浓度平均值为1.65 µg/L在海州湾附近达到最大值, 为6.25 µg/L。溶解氧趋势表现为黄海中部含量较低近岸较高, 温度和pH分布趋势与溶解氧含量相反。PO43−-P表现为近岸向外海逐渐降低, DOP则与之相反。海区内DIN含量较低, 平均值为4.55 µmol/L。整体N/P平均值为35.34, 大于Redfield值, 表现为磷限制。
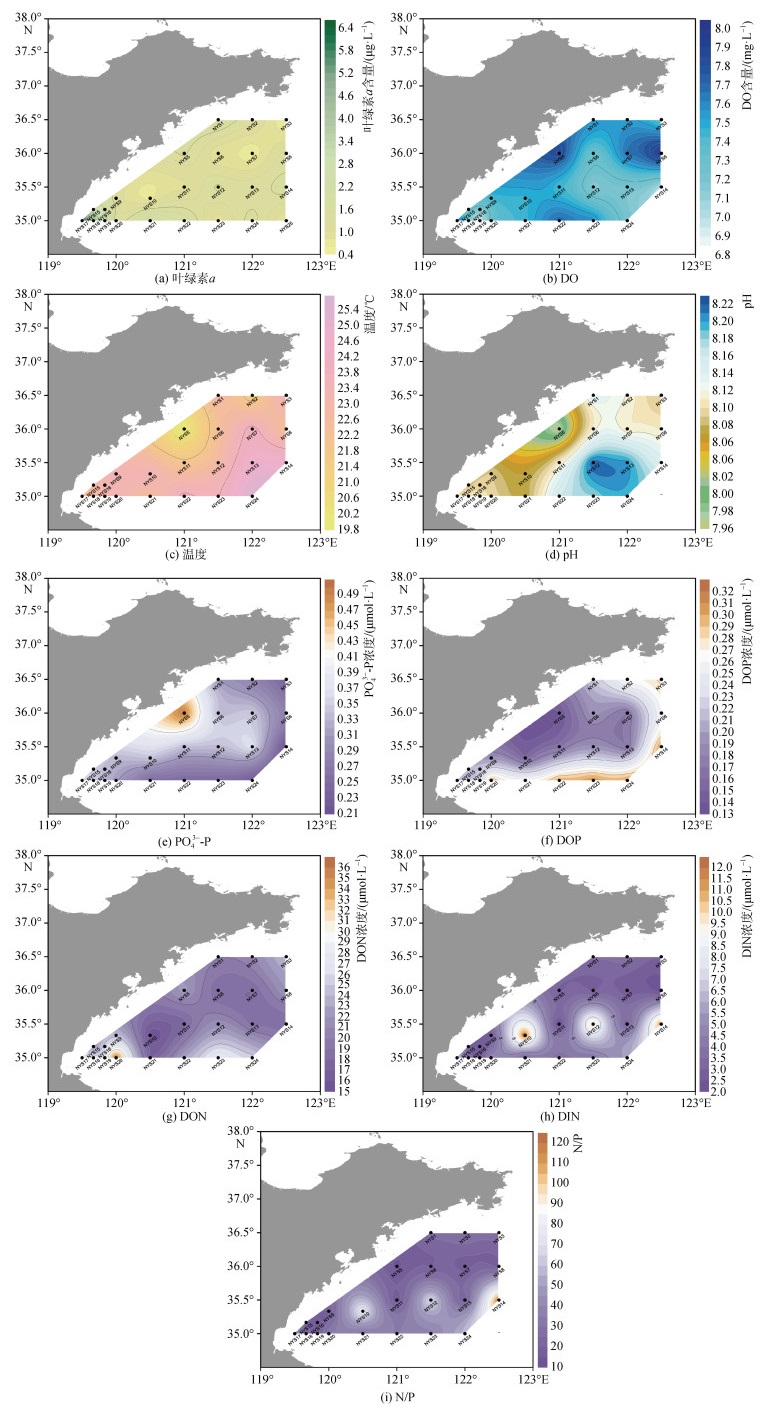 |
| 图 3 2022年7月南黄海表层环境因子及营养物质分布 Fig. 3 Distribution of surface environmental factors and nutrients in the Southern Yellow Sea, July 2022 |
如表 1所示, 浒苔与环境因子进行相关性计算。浒苔生物量与pH, DOP呈显著负相关, 与PO43−-P表现为正相关。
| pH | PO43‒-P浓度/(µmol·L–1) | DOP浓度/(µmol·L–1) | |
| 生物量/(t·km–2) | −0.52** | 0.52* | −0.51* |
| 注: *表示P < 0.05水平, 显著相关;**表示P < 0.01水平, 极显著相关 | |||
2022年7月南黄海浮游植物群落中, 甲藻门(Dinophyta)(27.5%~92.2%)为主要优势类群(图 4)。褐藻门(Ochrophyta)在部分站位呈现优势地位, 如NYS13、NYS21。
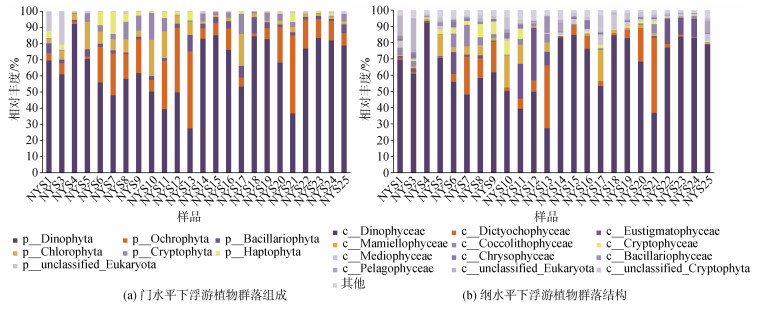 |
| 图 4 2022年7月南黄海浮游植物群落组成 Fig. 4 Phytoplankton community structure in the South Yellow Sea, July 2022 |
通过主坐标分析法(Principal coordinates analysis, PCoA)分析浮游植物群落组间差异(见图 5), 并对组间进行adonis差异检验。结果表明UCR与NUCR的浮游植物群落结构有显著性差异(P < 0.05), 说明浒苔的覆盖可能是引起浮游植物群落结构变化的原因之一。此外, UCR丰富度指数明显大于NUCR(P < 0.05), 而多样性指数却并没有显著差异(P > 0.05), 说明浒苔覆盖区浮游植物丰富度高于无浒苔覆盖区。
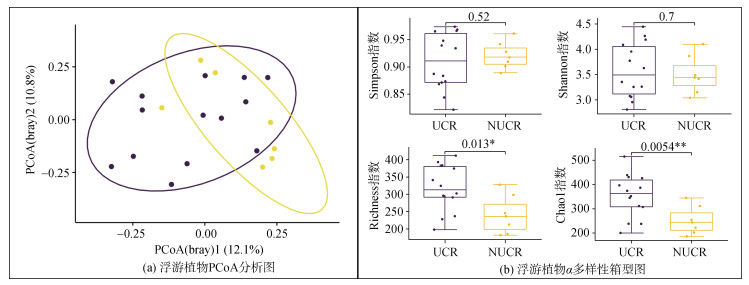 |
| 图 5 2022年7月南黄海浮游植物PCoA分析图及组间α多样性箱型图 Fig. 5 PCoA analysis map and intergroup α-diversity of phytoplankton in the South Yellow Sea, July 2022 注: *表示P < 0.05水平, 显著相关;**表示P < 0.01水平, 极显著相关 |
浮游植物优势物种如图 6a所示。图 6a统计了属水平下各个站位排名前三的优势类群。两区域的共同优势种为未注释到属的甲藻和未注释到属的共甲藻目, 二者在浒苔覆盖区域占比更大。浒苔覆盖区域的优势种还包括新角藻属(Neoceratium)。无浒苔覆盖区的优势种还包括未分类到属的真眼藻目(unclassified Eustigmatales), 未分类到属的硅鞭藻目(unclassified Dictyochales)等。由此可见, 浒苔覆盖区的优势种更加单一。
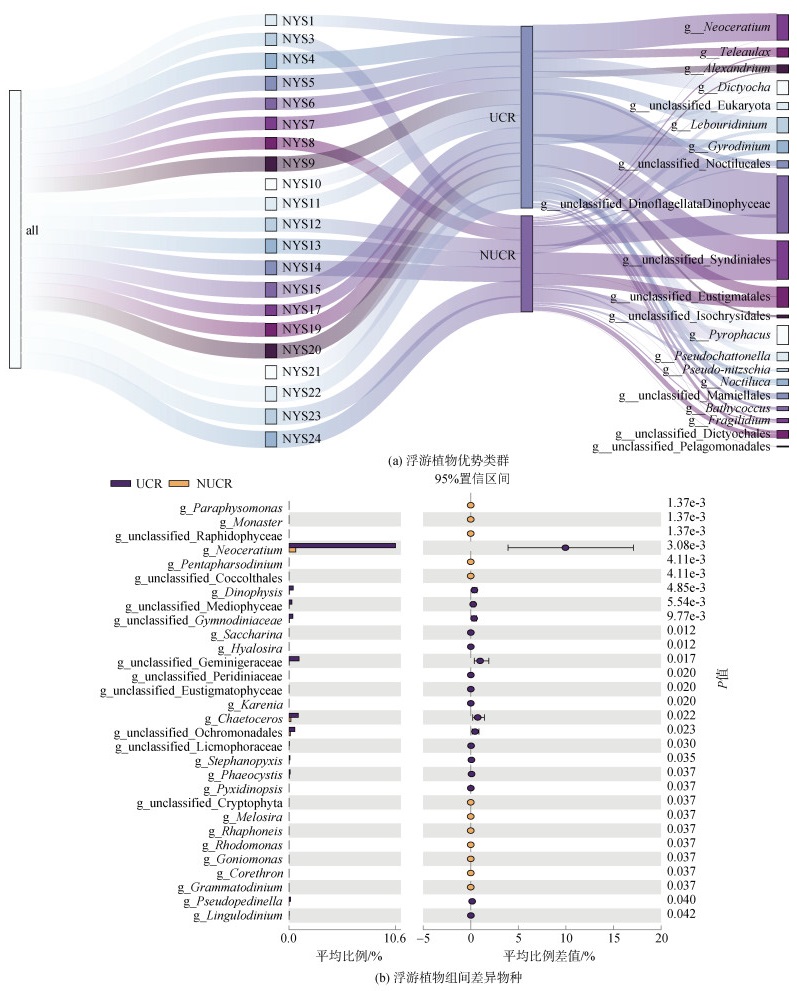 |
| 图 6 2022年7月南黄海浮游植物优势类群及组间差异物种 Fig. 6 Dominant phytoplankton groups and component differential species in the South Yellow Sea, July 2022 |
选取组间具有差异性的物种(P < 0.05)见图 6b, 差异显著的类群为新角藻属、角毛藻(Chaetoceros)以及unclassified Geminigeraceae。总体表现为, 在浒苔覆盖区的相对丰度远大于无浒苔覆盖的区域, 且新角藻变化量大于其他两类。
2.4 2022年7月南黄海浮游动物群落结构2022年7月南黄海浮游动物群落中, 节肢动物(Arthropoda)(27.5%~92.2%)为主要优势类群(图 7)。刺胞动物(Cnidaria)和原生动物(Amoebozoa)分别在NYS17和NYS6站位呈现优势。纲水平下, 桡足类(Copepoda)为主要优势类群(17.8%~94.7%), 其他优势类群有水螅纲(Hydrozoa)、鳃足类(Branchiopoda)以及Discosea。
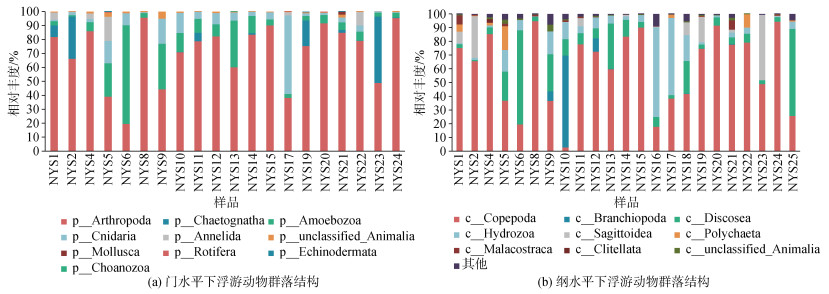 |
| 图 7 2022年7月南黄海浮游动物群落组成 Fig. 7 Zooplankton community structure in the South Yellow Sea, July 2022 |
通过主坐标分析法(Principal coordinates analysis, PCoA)分析浮游动物群落组间差异(见图 8), 并对组间进行adonis差异检验。结果表明UCR与NUCR的浮游动物群落组成具有显著性差异(P < 0.05), 说明浒苔的覆盖可能是影响浮游动物群落结构的原因之一。此外, 如图 8b所示UCR丰富度指数显著大于NUCR(P < 0.05), 而多样性指数却并没有显著差异(P > 0.05)。该结果表明了在浒苔覆盖区, 浮游动物的丰富度更高。
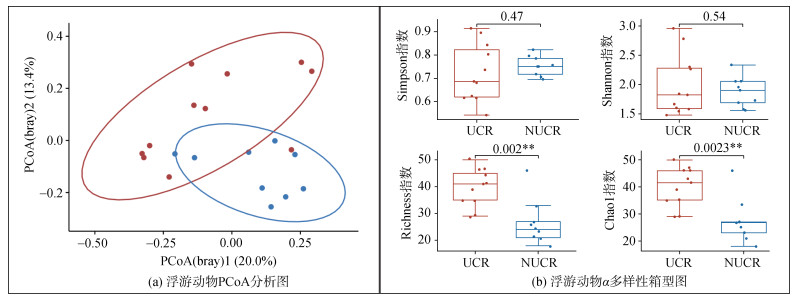 |
| 图 8 2022年7月南黄海浮游动物PCoA分析图及组间α多样性箱型图 Fig. 8 PCoA analysis map and intergroup α-diversity of Zooplankton in the South Yellow Sea, July 2022 注: *表示P < 0.05水平, 显著相关;**表示P < 0.01水平, 极显著相关 |
P1、P2优势物种如图 9a所示。图 9a统计了属水平下各个站位排名前三的优势类群。拟哲水蚤(Paracalanus)为共同优势种, 但在Z2组中的比例明显大于Z1。Z1组中薮枝螅水母(Obelia)、尖头溞(Penilia)占据比例较大, 胸刺水蚤(Centropages)为独特优势种。Z2中拟哲水蚤、Clytia、滨箭虫(Aidanosagitta)、拟猛水蚤(Harpacticella)、大眼剑水蚤(Corycaeus)占据比例较大, 且存在独特优势种如, 唇角水蚤(Labidocera)、三角溞(Pseudevadne)等。该结果中优势浮游动物优势种类与往年调查一致, 并且浒苔覆盖区还有占比较大的水母类浮游动物。
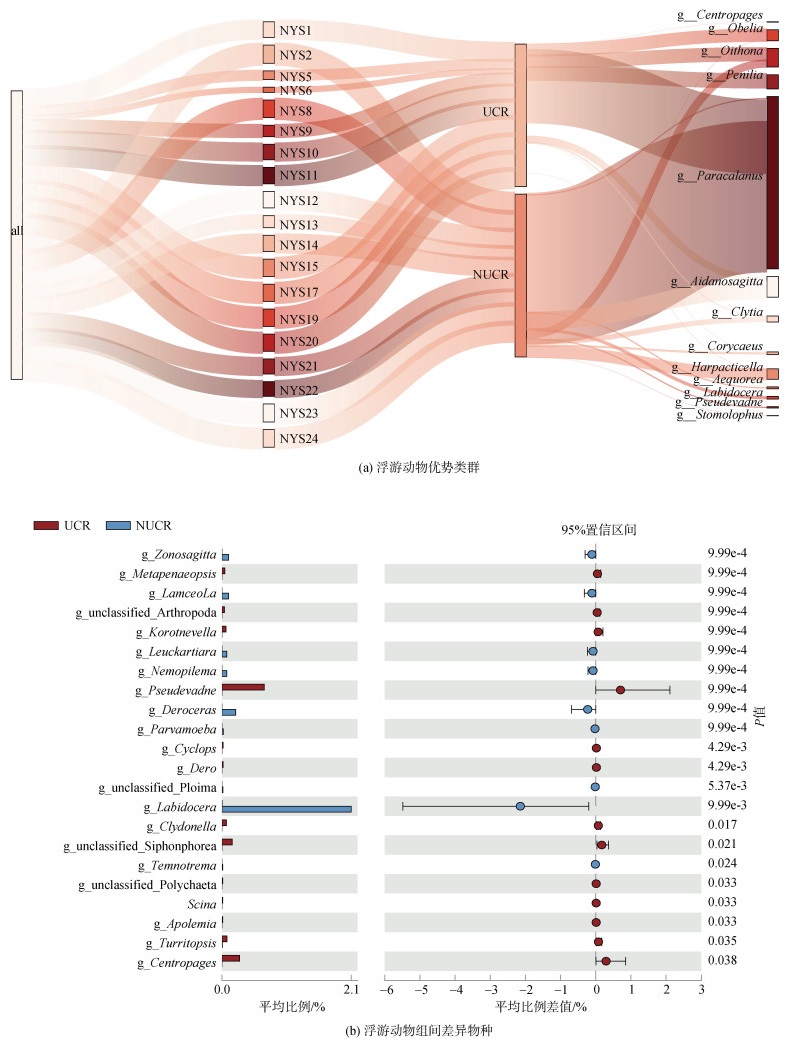 |
| 图 9 2022年7月南黄海浮游动物优势类群及组间差异物种 Fig. 9 Dominant zooplankton groups and component differential species in the South Yellow Sea, July 2022 |
选取组间具有差异性的物种(P < 0.05)如图 9b所示, 差异显著的类群有三角溞、胸刺水蚤和唇角水蚤。其中只有唇角水蚤在NUCR的相对丰度显著高于UCR。
2.5 2022年7月南黄海浮游细菌群落结构2022年7月上旬南黄海浮游细菌群落中, 优势细菌类群是γ-变形菌纲(Gammaproteobacteria) (14.4%~52.4%) (见图 10), 且远岸站位的丰度高于近岸站位。科水平下(见图 11), 假交替单胞菌科(Pseudoalteromonadaceae)(1.5%~51.3%)和交替单胞菌科(Alteromonadaceae)(1.5%~27.8%)为γ-变形菌纲的主要亚类群。
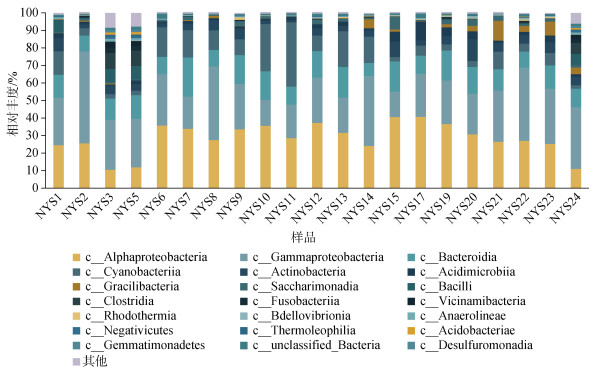 |
| 图 10 2022年7月南黄海浮游细菌纲水平群落组成 Fig. 10 Bacterioplankton community structure in the South Yellow Sea, July 2022 |
 |
| 图 11 2022年7月南黄海γ-变形菌纲下类群组成 Fig. 11 Group composition of Gammaproteobacteria in the South Yellow, July 2022 |
在纲水平下, 对浒苔生物量和细菌相对丰度百分比做Spearman相关性分析(见图 12), 发现γ-变形菌纲和脱硫单胞菌纲(Desulfuromonadia)分别与浒苔生物量有着显著的负相关和正相关。脱硫单胞菌纲相对丰度百分比在NSY9站位达到最高(见图 10), 并在该站位周围富集。在NYS2站位该细菌相对丰度百分比最低, 低于0.01%。γ-变形菌纲在NYS2、NYS8以及NYS22等站位的相对丰度较大。
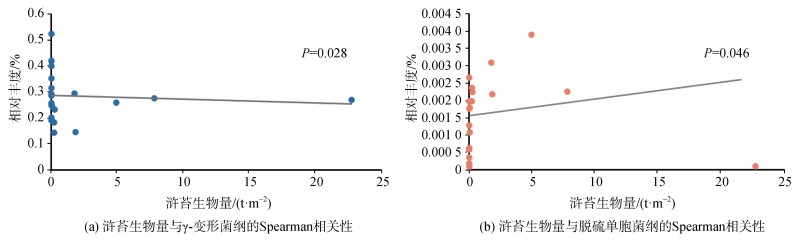 |
| 图 12 浒苔生物量与γ-变形菌纲、脱硫单胞菌纲的Spearman相关性 Fig. 12 Spearman's correlation between the Ulva prolifera biomass and Gammaproteobacteria, and Desulfuromonadia |
通过共现网络, 可以确定浮游生物之间的相互关系。如图 13所示, 基于Spearman相关性构建浒苔覆盖区和无浒苔覆盖区的浮游生物共现网络。节点代表浮游生物(纲水平下), 节点越大与之相互关联的物种越多。连线表示网络中的相关关系(P < 0.05), 连线的多少表示生物网络的复杂程度, 连线的粗细表示相互关系的强弱。UCR和NUCR均展示了58个节点, 分别得到168和107条边, UCR网络复杂度高于NUCR网络。UCR和NUCR样本组正相关关系分别占总相关关系58.3%和50.5%。既浒苔覆盖区域浮游生物之间的互作关系、共生关系强于无浒苔覆盖区域。
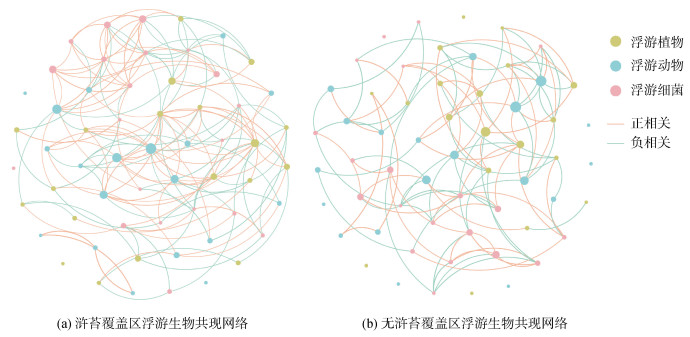 |
| 图 13 2022年南黄海浮游生物共线性网络 Fig. 13 Cooccurrence network of plankton communities in the South Yellow Sea, July 2022 |
Spearman相关性显示(表 2), 浮游植物、浮游动物丰富度与pH、DOP有显著负相关, 与PO43−-P有显著正相关。浮游细菌主要与DON、TDN呈显著正相关。对浒苔与浮游生物群落进行相关性分析, 发现浒苔与浮游动物群落有显著正相关, 浮游动物群落与浮游植物群落有显著正相关(图 14)。
| pH | 盐度 | 温度/℃ | PO43−-P浓度/(μmol·L–1) | DOP浓度/(μmol·L–1) | DON浓度/(μmol·L–1) | TDP浓度/(μmol·L–1) | TDN浓度/(μmol·L–1) | SiO32−-Si浓度/(μmol·L–1) | ||
| 浮游植物 | Shannon | −0.02 | 0.47* | −0.24 | 0.26 | −0.48* | −0.53* | −0.47* | −0.34 | −0.05 |
| Richness | −0.48* | −0.12 | −0.37 | 0.46* | −0.51* | −0.17 | −0.08 | −0.11 | 0.31 | |
| 浮游动物 | Shannon | −0.02 | 0.12 | −0.43* | 0.24 | −0.36 | −0.10 | 0.26 | −0.14 | 0.04 |
| Richness | −0.72** | −0.21 | −0.36 | 0.47* | −0.52* | −0.11 | 0.16 | −0.09 | 0.49* | |
| 浮游细菌 | Shannon | −0.12 | −0.30 | 0.06 | −0.27 | 0.40 | 0.78** | 0.57** | 0.66** | 0.24 |
| Richness | −0.05 | −0.21 | 0.15 | −0.25 | 0.28 | 0.57** | 0.36 | 0.64** | 0.05 | |
| 注: *表示P < 0.05水平, 显著相关;**表示P < 0.01水平, 极显著相关 | ||||||||||
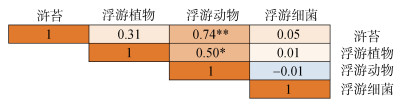 |
| 图 14 浒苔与浮游生物群落丰富度相关性 Fig. 14 Spearman's rank correlation coefficient between Ulva prolifera and richness index of plankton 注: *表示P < 0.05水平, 显著相关;**表示P < 0.01水平, 极显著相关 |
浒苔覆盖区浮游植物优势种类大部分属于甲藻(unclassified Dinophyceae, unclassified Syndiniales, Neoceratium), 而无浒苔覆盖区除了甲藻外还存在褐藻为优势种(unclassified Dinophyceae, unclassified Syndiniales, Eustigmatales, unclassified Dictyochales)。此外, 对比有/无浒苔覆盖区域物种变化情况, 新角藻(甲藻)表现为浒苔覆盖区域相对丰度显著高于无浒苔覆盖的区域, 并且增加量最大。研究表明, 绿潮发生时, 甲藻可以替换其他浮游植物在群落的优势地位, 并在一段时间内保持优势地位[33-34]。本研究中浒苔覆盖区由于腐败等作用有机营养盐可能增高, 而甲藻可以摄食有机营养盐补充生长所需要的能量[35-36], 从而成为该区域的优势种。利用高通量测序的方法研究浮游植物群落可以得到比较全面的生物信息, 但是由于甲藻是一类具有较大的核基因组[37]以及较高拷贝数的一类浮游植物, 最终可能导致甲藻丰度偏高, 但本结果与镜检的方法进行了比较[38-39], 趋势大致相同。
2022年7月上旬南黄海浮游动物群落以桡足类为主要优势类群, 对比有/无浒苔覆盖的区域, 桡足类在浒苔覆盖区域所占的比例更小。有研究报道, 绿潮的连年发生导致海域中原本的优势种桡足类丰度下降, 而水母等浮游生物比例逐渐上升, 在一些研究中水母类在绿潮发生时的丰度可达到平时的2~3倍[40]。本研究中薮枝螅水母是水母中的主要类群, 在浒苔覆盖区域可达无浒苔覆盖区域的35倍。除了推动优势种的更替, 薮枝螅水母还是南黄海常见污损生物[41], 该物种能够堵塞网箱与海洋设备[42]。研究表明该种经常附在大型藻类表面[43-45], 本次浒苔绿潮可能为该类物种提供适宜的附着场所, 从而导致浮游动物优势种的更替, 并存在次生灾害的可能性。
浮游细菌群落调查中, 脱硫单胞菌纲与浒苔生物量有着显著正相关关系。该类细菌通常在沉积物以及厌氧水体中分布[25], 并能够还原无机磷酸盐[46-49], 本文中, 浒苔大量覆盖的区域可能为脱硫单胞菌提供了低氧以及高有机质的环境, 促进了脱硫单胞菌的硫还原反应[50]。此外, 脱硫单胞菌还参与铁的还原反应。据研究表明[51], 脱硫单胞菌属可以利用大型藻降解的简单化合物作为铁还原反应的电子供体, 从而推进水体中生物地球化学循环[52-53]。本次调查中另外一类与浒苔生物量相关的细菌是γ-变形菌纲, 该菌不仅是该海域的主要优势类群, 还与浒苔生物量呈现显著的负相关。γ-变形菌纲是一类海洋常见优势类群, 且有着降解海洋大分子有机物质能力[27]。在本研究中也发现Alteromonas、Pseudomonas、Pseudalteromonas、Vibrio等有杀藻作用和具有DMS降解酶的Marinobacterium、Alcaligenes等菌群[16-21]。本研究中γ-变形菌主要分布于浒苔覆盖低的区域, 可能对浒苔有一定的分解作用[54-55]。
浮游生物共线性网络显示, 浮游生物在浒苔覆盖区有着强烈的相互关系。生物间的相关关系往往是食物网结构的主要驱动因素[56], 本文中浒苔覆盖区有着较高的生物丰富度, 可能为浮游动物提供了丰富的食物资源, 从而对浮游植物与浮游细菌群落有着“下行”控制。也有研究表明[57-59], 绿潮发生会使得环境营养结构发生改变, 从而导致海域中的某些浮游植物生长受限, 最终影响浮游动物的摄食。浮游细菌作为分解者[60], 将环境中的颗粒态和溶解态有机物转化为可溶解态物质, 从而影响浮游植物和浮游动物。由此可见浒苔绿潮对其覆盖区的浮游生物影响比较错综复杂。
4 结论2022年7月初南黄海绿潮分布以近岸溶解态无机磷酸盐较高的海域为主。在绿潮发生的浒苔覆盖区域, 浮游生物丰富度高且关系紧密复杂。
浒苔绿潮的发生海域浮游生物优势种明显, 浮游植物表现为浒苔覆盖区以甲藻为主要优势种, 而无浒苔覆盖的区域呈现多种优势物种。对比有无浒苔覆盖的区域, 浮游动物表现为桡足类群落比例下降胶质水母类比例上升。这类现象容易导致次生灾害的发生。
浮游细菌多样性与南黄海环境中总溶解性氮、磷以及溶解性有机氮显著相关。发现脱硫的单胞菌和γ-变形菌与浒苔生物量密切相关。
致谢: 感谢中国科学院海洋研究所张德超老师对本论文的指导。
| [1] |
王俊杰, 于志刚, 韦钦胜, 等. 2017年春、夏季南黄海西部营养盐的分布特征及其与浒苔暴发的关系[J]. 海洋与湖沼, 2018, 49(5): 1045-1053. WANG Junjie, YU Zhigang, WEI Qinsheng, et al. Distributions of nutrients in the western south Yellow South Sea in spring and summer of 2017 and their relationship with Ulva prolifera outbreaks[J]. Oceanologia et Limnologia Sinica, 2018, 49(5): 1045-1053. |
| [2] |
张广宗, 吴孟泉, 孙晓, 等. 南黄海浒苔漂移轨迹年际变化规律及驱动因素[J]. 海洋与湖沼, 2018, 49(5): 1084-1093. ZHANG Guangzong, WU Mengquan, SUN Xiao, et al. The inter-annual drift and driven force of Ulva prolifera bloom in the Southern Yellow Sea[J]. Oceanologia et Limnologia Sinica, 2018, 49(5): 1084-1093. |
| [3] |
于仁成, 刘东艳. 我国近海藻华灾害现状、演变趋势与应对策略[J]. 中国科学院院刊, 2016, 31(10): 1167-1174. YU Rencheng, LIU Dongyan. Harmful algal blooms in the coastal waters of China: current situation, longterm changes and prevention strategies[J]. Bulletin of Chinese Academy of Sciences, 2016, 31(10): 1167-1174. |
| [4] |
王宗灵, 傅明珠, 肖洁, 等. 黄海浒苔绿潮研究进展[J]. 海洋学报, 2018, 40(2): 1-13. WANG Zongling, FU Mingzhu, XIAO Jie, et al. Progress on the study of the Yellow Sea green tides caused by Ulva prolifera[J]. Haiyang Xuebao, 2018, 40(2): 1-13. |
| [5] |
SREERAG A, MISHRA R K, NAIK R K, et al. Plankton diversity and dynamics in the upper surface of the Indian sector of the Southern Ocean ecosystem and biogeochemical processes[J]. Regional Studies in Marine Science, 2023, 65: 103095. DOI:10.1016/j.rsma.2023.103095 |
| [6] |
代涛涛, 钟家有, 杨平, 等. 东江源区浮游生物群落结构特征和主要环境因子及水质评价[J]. 环境科学与技术, 2023, 46(S2): 17-24. DAI Taotao, ZHONG Jiaoyou, YANG Ping, et al. Plankton community structure charateristics, main environmental factors and water quality evaluation in Dongjiang River basin[J]. Environmental Science and Technology, 2023, 46(S2): 17-24. |
| [7] |
文威, 李双双, 冯桃辉, 等. 基于浮游生物完整性的汉江中下游生态健康评价[J]. 水生态学杂志, 2023, 44(4): 85-91. WEN Wei, LI Shuangshuang, FENG Taohui, et al. Ecological health assessment of the middle and lower Hanjiang River based on plankton integrity[J]. Journal of Hydroecology, 2023, 44(4): 85-91. |
| [8] |
赵秀玲, 朱虹, 耿立佳, 等. 现代海洋环境监测体系和海洋管理背景下的浮游生物监测[J]. 海洋开发与管理, 2018, 35(10): 31-38. ZHAO Xiuling, ZHU Hong, GENG Lijia, et al. Plankton monitoring under the background of modern marine environmental monitoring system and merine management[J]. Ocean Development and Managemen, 2018, 35(10): 31-38. |
| [9] |
史华明. 浒苔对氮磷吸收和释放及与中肋骨条藻竞争关系的初步研究[D]. 青岛: 中国海洋大学, 2009. SHI Huaming. The preliminary study of Enteromorpha absorption and release properties of nitrogen and phosphorus and the competition with Skeletonema costatum[D]. Qingdao: Ocean University of China, 2009. |
| [10] |
林锟, 杨雪, 谭丽菊, 等. 不同状态浒苔对东海原甲藻生长的影响[J]. 海洋学报, 2020, 42(8): 69-75. LIN Kun, YANG Xue, TAN Liju, et al. Effects of Ulva prolifera in different states on the growth of Prorocentrum donghaiense[J]. Haiyang Xuebao, 2020, 42(8): 69-75. |
| [11] |
罗敏. 江苏海域浒苔绿潮分布及对生态系统的影响[J]. 环境与发展, 2019, 31(11): 177, 179. LUO Min. Distribution of green tides of canola in Jiangsu Province and its impact on ecosystems[J]. Environment and Development, 2019, 31(11): 177, 179. |
| [12] |
高颖超, 杨雪, 林锟, 等. 不同光照条件下浒苔与三种赤潮微藻的竞争[J]. 中国环境科学, 2019, 39(8): 3404-3411. GAO Yingchao, YANG Xue, LIN Kun, et al. Comprtition between Ulva prolifera and three red tide microalgea under different light conditions[J]. China Environmental Science, 2019, 39(8): 3404-3411. |
| [13] |
陈蕾. N/P比失衡对海洋浮游生物的影响及其沿食物网的传递[D]. 北京: 中国科学院大学, 2015. CHAN Lei. Impacts of the N/P ratio imbalance on marine plankton and its cascading effect along the food web[D]. Beijing: University of Chinese Academy of Sciences, 2015. |
| [14] |
刘吉文. 典型海域微生物群落结构及其生物地球化学意义[D]. 青岛: 中国海洋大学, 2014. LIU Jiwen. Studies on microbial community structure in typical sea areas and their biogeochemical implications[D]. Qingdao: Ocean University of China, 2014. |
| [15] |
王春忠, 孙富林, 侯代云, 等. 基于浒苔暴发海水池塘的微生物生态特征研究[J]. 海洋学报, 2017, 39(4): 107-116. WANG Chunzhong, SUN Fulin, HOU Dailin, et al. Study on the microbial characteristics of seawater pond based on Enteromorpha bloom[J]. Haiyang Xuebao, 2017, 39(4): 107-116. |
| [16] |
DE SOUZA M P, CHEN Y P, YOCH D C. Dimethylsulfoniopropionate lyase from the marine macroalga Ulva curvata: Purification and characterization of the enzyme[J]. Planta, 1996, 199(3): 433-438. |
| [17] |
FUSE H, TAKIMURA O, MURAKAMI K, et al. Utilization of dimethyl sulfide as a sulfur source with the aid of light by Marinobacterium sp strain DMS-S1[J]. Applied and Environmental Microbiology, 2000, 66(12): 5527-5532. |
| [18] |
HIRANO H, YOSHIDA T, FUSE H, et al. Marinobacterium sp strain DMS-S1 uses dimethyl sulphide as a sulphur source after light-dependent transformation by excreted flavins[J]. Environmental Microbiology, 2003, 5(6): 503-509. |
| [19] |
QU T F, ZHAO X Y, HAO Y, et al. Ecological effects of Ulva prolifera green tide on bacterial community structure in Qingdao offshore environment[J]. Chemosphere, 2020, 244: 125477. |
| [20] |
VAN ALSTYNE K L, WOLFE G V, FREIDENBURG T L, et al. Activated defense systems in marine macroalgae: evidence for an ecological role for DMSP cleavage[J]. Marine Ecology Progress Series, 2001, 213: 53-65. |
| [21] |
刘敏. 我国黄、东海典型生态过程中的微生物群落结构[D]. 青岛: 中国科学院研究生院(中国科学院海洋研究所), 2011. LIU Min. Microbial community structure in specific ecological processes in the Yellow Sea and East China Sea, China[D]. Qingdao: The Graduate University, Chinese Academy of Sciences (Institute of Oceanology, CAS), 2011. |
| [22] |
吴泳江, 蔡明成, 孙翰昌, 等. 环境DNA宏条形码在浮游动植物多样性研究中的应用[J]. 渔业研究, 2023, 45(4): 399-407. WU Yongjiang, CAI Mingcheng, SUN Hanchang, et al. Application of environmental DNA metabarcoding in study biodiversity of zooplankton and phytoplankton[J]. Journal of Fisheries Research, 2023, 45(4): 399-407. |
| [23] |
SCHROEDER A, STANKOVIĆ D, PALLAVICINI A, et al. DNA metabarcoding and morphological analysis-assessment of zooplankton biodiversity in transitional waters[J]. Marine Environmental Research, 2020, 160: 104946. |
| [24] |
刘奎艳, 王洪淑, 刘峰, 等. 2021~2022年荣成海域多相赤潮的分子鉴定[J]. 海洋与湖沼, 2023, 54(6): 1645-1655. LIU Kuiyan, WANG Hongshu, LIU Feng, et al. Molecular analysis of a polyphasic red tide in Rongcheng offshore, Shandong Peninsula in 2021─2022[J]. Oceanologia et Limnologia Sinica, 2023, 54(6): 1645-1655. |
| [25] |
赵丽娜. 应用DNA复合条形码技术研究三门峡水库浮游动物多样性[D]. 西安: 陕西师范大学, 2019. ZHAO Lina. Application of DNA compound barcode technology to study the diversity of zooplankton in Sanmenxia Reservoir[D]. Xi'an: Shaanxi Normal University, 2019. |
| [26] |
陈楠生, 丁翔翔, 崔宗梅. 山东近海赤潮物种多样性研究进展[J]. 海洋与湖沼, 2023, 54(5): 1258-1273. CHEN Nansheng, DING Xiangxiang, CUI Zongmei. Advances in the study of red tide species biodiversity around Shandong paninsula[J]. Oceanologia et Limnologia Sinica, 2023, 54(5): 1258-1273. |
| [27] |
王煜. 典型近岸海洋环境微型生物群落种类和功能多样性研究[D]. 厦门: 厦门大学, 2018. WANG Yu. Taxonomic and functional diversity of microbial communities in typical coastal marine environments[D]. Xiamen: Xiamen University, 2018. |
| [28] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 海洋监测规范 第4部分: 海水分析: GB 17378.4-2007[S]. 北京: 中国标准出版社, 2007. State General Administration of the People's Republic of China for Quality Supervision and Inspection and Quarantine, Standardization Administration of the P. R. C. The specification for marine monitoring─Part 4: Seawater analysis: GB 17378.4-2007[S]. Beijing: Standards Press of China, 2007. |
| [29] |
孔凡洲, 姜鹏, 魏传杰, 等. 2017年春、夏季黄海35°N共发的绿潮、金潮和赤潮[J]. 海洋与湖沼, 2018, 49(5): 1021-1030. KONG Fanzhou, JIANG Peng, WEI Chuanjie, et al. Co-occurrence of green tide and red tides along the 35°N transect in the Yellow Sea during spring and summer in 2017[J]. Oceanologia et Limnologia Sinica, 2018, 49(5): 1021-1030. |
| [30] |
LIU S Y, CUI Z M, ZHAO Y F, et al. Composition and spatial-temporal dynamics of phytoplankton community shaped by environmental selection and interactions in the Jiaozhou Bay[J]. Water Research, 2022, 218: 118488. |
| [31] |
ZHAO L N, ZHANG X, XU M Y, et al. DNA metabarcoding of zooplankton communities: species diversity and seasonal variation revealed by 18S rRNA and COI[J]. PeerJ, 2021, 9: e11057. |
| [32] |
XU N, TAN G C, WANG H Y, et al. Effect of biochar additions to soil on nitrogen leaching, microbial biomass and bacterial community structure[J]. European Journal of Soil Biology, 2016, 74: 1-8. |
| [33] |
LI X Y, YU R C, GENG H X, et al. Increasing dominance of dinoflagellate red tides in the coastal waters of Yellow Sea, China[J]. Marine Pollution Bulletin, 2021, 168: 112439. |
| [34] |
高舒静. 东西连岛邻近海域绿潮发生前后浮游植物的群落变化[J]. 环境生态学, 2023, 5(2): 43-50. GAO Shujing. Changes of phytoplankton community before and after green tide in Dongxilian Island area[J]. Environmental Ecology, 2023, 5(2): 43-50. |
| [35] |
STOECKER D, LI A, COATS D, et al. Mixotrophy in the dinoflagellate Prorocentrum minimum[J]. Marine Ecology Progress Series, 1997, 152: 1-12. |
| [36] |
张淑雯. 光照、营养盐对甲藻吞噬营养行为的调控机制研究[D]. 广州: 暨南大学, 2011. ZHANG Shuwen. Regulation of light and nutrients on the phagotrophic behavior of harmful dinoflagelates. Guangzhou: Jinan University, 2011. |
| [37] |
张军毅, 孙蓓丽, 朱冰川, 等. 基于分子标记的藻类鉴定研究进展[J]. 湖泊科学, 2021, 33(6): 1607-1625. ZHANG Junyi, SUN Beili, ZHU Bingchuan, et al. Research progress in the taxonomic identification of algae on the basis of molecullar markers[J]. Journal of Lake Sciences, 2021, 33(6): 1607-1625. |
| [38] |
黄备, 魏娜, 唐静亮, 等. 南黄海2007—2017年浮游植物群落结构及多样性变化[J]. 中国环境监测, 2018, 34(6): 137-148. HUANG Bei, WEI Na, TANG Jingliang, et al. Changes of phytoplankton community structure and diversity in the South Yellow Sea during 2007─2017[J]. Environmental Monitoring in China, 2018, 34(6): 137-148. |
| [39] |
杨洋, 孙晓霞, 郑珊, 等. 南黄海夏初网采浮游植物分布与长期变化[J]. 海洋与湖沼, 2016, 47(4): 755-763. YANG Yang, SUN Xiaoxia, ZHENG Shan, et al. Distrubution and long-term varation of net phytoplankton in South Yellow Sea in early summer[J]. Oceanologia et Limnologia Sinica, 2016, 47(4): 755-763. |
| [40] |
WANG W C, ZHANG G T, SUN X X, et al. Temporal variability in zooplankton community in the western Yellow Sea and its possible links to green tides[J]. PeerJ, 2019, 7: e6641. |
| [41] |
张明明, 赵文, 于世超. 我国海洋污损生物的研究概况[J]. 水产科学, 2008, 27(10): 545-549. ZHANG Mingming, ZHAO Wen, YU Shichao. Research progress of marine fouling organism in China[J]. Fisheries Science, 2008, 27(10): 545-549. |
| [42] |
YAN T, LIN M Q, CAO W H, et al. Fouling characteristics of cnidarians (Hydrozoa and Anthozoa) along the coast of China[J]. Journal of Oceanology and Limnology, 2021, 39(6): 2220-2236. |
| [43] |
GETACHEW P, NAM B H, HONG Y K. Comparison of proteomic profiles of the phaeophyte Saccharina japonica thalli proximal to and beneath the front of epiphytic hydrozoan colonies against healthy tissue[J]. Botanica Marina, 2019, 62(4): 369-378. |
| [44] |
刘国山, 佟飞, 蔡星媛, 等. 威海双岛海域人工鱼礁区大型海藻夏季群落结构变化[J]. 中国水产科学, 2014, 21(5): 1010-1019. LIU Guoshan, TONG Fei, CAI Xingyuan, et al. Variation in the macroalgae community structure during summer in the artificial reef zones of Shuangdao Bay, Weihai, Shandong Province, China[J]. Journal of Fishery Sciences of China, 2014, 21(5): 1010-1019. |
| [45] |
徐东会, 齐衍萍, 张炫钊, 等. 秦皇岛近岸海域夏季小型水母分布特征[J]. 海洋科学, 2022, 46(11): 29-37. XU Donghui, QI Yanping, ZHANG Xuanzhao, et al. Distribution characteristics of small medusae in the Qinhuangdao coastal waters during summer[J]. Marine Sciences, 2022, 46(11): 29-37. |
| [46] |
FINSTER K, BAK F, PFENNIG N. Desulfuromonas Acetexigens Sp-Nov, a dissimilatory sulfur-reducing eubacterium from anoxic fresh-water sediments[J]. Archives of Microbiology, 1994, 161(4): 328-332. |
| [47] |
张雅庆. 硫酸盐还原细菌对蓝藻水华厌氧分解的适应性响应研究[D]. 武汉: 湖北大学, 2022. ZHANG Yaqing. Adaptive response of sulfate reducing bacteria to anaerobic decomposition of cyanobacterial bloom biomass[D]. Wuhan: Hubei University, 2022. |
| [48] |
谭小琴. 珠江水体硫氧化细菌多样性及其硫代谢途径研究[D]. 广州: 华南理工大学, 2016. TAN Xiaoqin. The diversity and sulfur metabolic pathway of Sulfur oxidizing bacteria in the Pearl River water[D]. Guangzhou: South China University of Technology, 2016. |
| [49] |
邹松保, 高强, 程海华, 等. 罗氏沼虾(Macrobrachium rosenbergii)养殖池塘沉积物中细菌、硫酸盐还原菌和硫氧化菌的垂直分布特征[J]. 微生物学报, 2022, 62(7): 2719-2734. ZOU Songbao, GAO QIang, CHENG Haihua, et al. Vertical distribution of bacterial, sulfate-reducing and sulfur-oxidizing bacterial communities in sediment cores from freshwater prawn (Macrobrachium rosenbergii) aquaculture pond[J]. Acta Microbiologica Sinica, 2022, 62(7): 2719-2734. |
| [50] |
方安琪, 贺志理, 王成, 等. 红树林沉积物中微生物驱动硫循环研究进展[J]. 微生物学报, 2020, 60(1): 13-25. FANG Anqi, HE Zhili, WANG Cheng, et al. Progress in studying microbially-driven sulfur cycling in mangrove sediments[J]. Acta Microbiologica Sinica, 2020, 60(1): 13-25. |
| [51] |
AROMOKEYE D A, WILLIS-PORATTI G, WUNDER L C, et al. Macroalgae degradation promotes microbial iron reduction via electron shuttling in coastal antarctic sediments[J]. Environment International, 2021, 156: 106602. |
| [52] |
FAN Y Y, LI B B, YANG Z C, et al. Abundance and diversity of iron reducing bacteria communities in the sediments of a heavily polluted freshwater lake[J]. Applied Microbiology and Biotechnology, 2018, 102(24): 10791-10801. |
| [53] |
NEALSON K, SAFFARINI D. Iron and manganese in anaerobic respiration-environmental significance, physiology, and regulation[J]. Annual Review of Microbiology, 1994, 48: 311-343. |
| [54] |
胡珍珍. 浒苔长期降解过程不同阶段细菌群落特征及有机碳利用特点[D]. 青岛: 山东大学(青岛), 2020. HU Zhenzhen. Characteristics of the bacterial community and their organic carbon utilization at different stages during the long-term degradation of Ulva prolifera[D]. Qingdao: Shandong University (Qingdao), 2020. |
| [55] |
郭丛. 绿潮爆发期及爆发后表层海水微生物群落差异初步研究[D]. 南京: 南京农业大学, 2010. GUO Cong. Bacterial diversity in surface water of the Yellow Sea during and after a green alga tide[D]. Nanjing: Nanjing Agricultural University, 2010. |
| [56] |
ZAMORA-TEROL S, NOVOTNY A, WINDER M. Reconstructing marine plankton food web interactions using DNA metabarcoding[J]. Molecular Ecology, 2020, 29(17): 3380-3395. |
| [57] |
冯立娜, 张海波, 孙雨嫣, 等. 浒苔绿潮消亡腐败过程中的营养盐释放及其对近海环境的影响[J]. 海洋学报, 2020, 42(8): 59-68. FENG Lina, ZHANG Haibo, SUN Yuyan, et al. On nutrient releases from the decomposition of Ulva prolifera green tide and their impacts on nearshore seawaters in the southern Yellow Sea[J]. Haiyang Xuebao, 2020, 42(8): 59-68. |
| [58] |
宋秀凯, 张秀珍, 刘爱英, 等. 浒苔过量繁殖后海区环境因子与浮游植物群落演替规律研究[J]. 安全与环境学报, 2011, 11(2): 150-157. SONG Xiukaim, ZHANG Xiuzhen, LIU Aiying, et al. Relationship between phytoplankton community succession and environmental factors after Enteromorpha prolifra bloom[J]. Journal of Safety and Environment, 2011, 11(2): 150-157. |
| [59] |
付萍, 杨鹏, 何健龙, 等. 浒苔绿潮暴发对丁字湾毗邻海域大中型浮游动物群落结构的影响[J]. 海洋环境科学, 2023, 42(4): 604-611, 621. FU Ping, YANG Peng, HE Jianlong, et al. Effects of the outbreak of green tide on the community structure of large and medium-sized zooplankton in the adjacent sea area of Dingzi Bay[J]. Marine Environmental Science, 2023, 42(4): 604-611, 621. |
| [60] |
POMEROY L R, WILLIAMS P J LEB, AZAM F, et al. The Microbial Loop[J]. Oceanography, 2007, 20(2): 28-33. |
 2024, Vol. 48
2024, Vol. 48


