
文章信息
- 周慧欣, 王锦秀, 王馨, 徐子钧, 颜天. 2024.
- ZHOU Huixin, WANG Jinxiu, WANG Xin, XU Zijun, YAN Tian. 2024.
- 日本虎斑猛水蚤在抑食金球藻中存活、发育和繁殖的实验研究
- Experimental study on survival, growth, and reproduction of Tigriopus japonicus in Aureococcus anophagefferens-rich environments
- 海洋科学, 48(3): 42-49
- Marine Sciences, 48(3): 42-49.
- http://dx.doi.org/10.11759/hykx20231220001
-
文章历史
- 收稿日期:2023-12-20
- 修回日期:2024-02-27
2. 中国科学院大学, 北京 100049;
3. 自然资源部北海生态中心, 山东 青岛 266033
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. North China Sea Environmental Monitoring Center, State Oceanic Administration, Qingdao 266033, China
抑食金球藻(Aureococus anophagefferens)属于棕鞭藻门(Ochrophyta), 海金藻纲(Pelagophyceae), 是一种个体微小、非运动性的单细胞藻类, 呈球形或椭球形, 金色, 直径约为2 μm, 无细胞壁和鞭毛[1]。抑食金球藻能够暴发性增殖形成褐潮, 先后在美国东北部近海、南非的萨尔达尼亚湾以及中国秦皇岛海域暴发[2-5]。褐潮发生时, 抑食金球藻能够抑制滤食性双壳类的摄食, 还会对急游虫、汤氏纺锤水蚤、哈德逊纺锤水蚤等浮游动物的摄食、存活、生长发育及产卵产生影响, 见表 1。
| 实验生物 | 藻细胞密度/(个·mL−1) | 效应 |
| 硬壳蛤(Mercenaria mercenaria) | 2×105~3.7×105 | 幼体生长率下降[19] |
| 紫贻贝(Mytilus edulis) | 7.2×106±1.2×106 | 摄食率降低、死亡率增高、无法繁殖[20] |
| 海湾扇贝(Argopecten irradians) | 2×105 1×106 |
清滤率降低[21] 死亡率增高[21] |
| 急游虫(Strombidium sp.) | ≥2.0×106 | 生长受到抑制, 种群增长速率下降[22] |
| 汤氏纺锤水蚤(Acatia tonsa) | 2×105~5×105 | 摄食率下降、无节幼体发育速率下降、产卵率降低[23] |
| 哈德逊纺锤水蚤(Acartia hudsonica) | 5×105 | 桡足幼体存活率降低[24] |
| 卤虫(Artemia salina) | 8×105 | 影响存活、抑制摄食[25] |
| 褶皱臂围轮虫(Brachionus plicatilis) | 8×105 | 抑制摄食[25] |
由于同一种有毒有害藻对不同浮游动物的影响是不同的, 所以选取不同代表性的多种浮游动物才能全面反映有毒有害藻对海洋浮游动物的影响, 进而反映对海洋浮游动物群落结构及海洋生态系统的影响。
日本虎斑猛水蚤(Tigriopus japonicus)隶属于节肢动物门, 甲壳纲, 桡足亚纲, 猛水蚤目, 属于小型底栖浮游动物, 广泛分布于西太平洋近海, 在中国、日本和韩国附近海域均有分布, 生活在潮上带含较浅海水的岩石槽水洼中[6]。由于日本虎斑猛水蚤具有个体较小、世代周期短、繁殖能力强、雌雄异形和易于在实验室培养等优点, 被国内外广泛应用于重金属、内分泌干扰物和防污杀菌剂等毒性污染物的检测, 是开展生态毒理学实验的理想生物, 被经济合作与发展组织(Organization for Economic Cooperation and Development, OECD)列为毒性测试的标准生物[7-10]。
目前, 实验室内检测有毒有害藻对浮游动物影响实验所使用到的浮游动物主要有轮虫、卤虫、中华哲水蚤、黑褐新糠虾等[11-18], 而日本虎斑猛水蚤具有与这几种浮游动物不同的特点, 由于其属于底栖浮游动物, 日本虎斑猛水蚤的生存适应能力较强, 环境波动较大时具有较强的耐受性, 包括较强的耐温性和耐盐性。因此, 以日本虎斑猛水蚤为实验生物, 探究有毒有害藻对日本虎斑猛水蚤的毒性影响, 可以更加全面地反映有毒有害藻对不同浮游动物的影响。
为比较抑食金球藻对不同浮游动物的敏感性, 掌握褐潮对海洋生态系统的影响, 本文研究了日本虎斑猛水蚤在抑食金球藻中摄食、无节幼体发育至桡足幼体及成体的存活和生长以及雌体12 d内的产卵次数及产卵量。
1 材料与方法 1.1 实验生物抑食金球藻于2016年分离自秦皇岛褐潮。对照组所使用的藻为青岛大扁藻(Platymonas helgolandica), 由中国科学院海洋研究所藻种中心提供。两种藻均在L1培养基中培养, 所用海水引自青岛胶州湾外太平角无污染海水, 使用前经0.45 μm混合纤维滤膜过滤, 高温煮沸消毒。藻培养温度为(20±1) ℃, 光照为白色LED光源, 光暗周期L∶D为14 h∶10 h。
日本虎斑猛水蚤由中国科学院海洋研究所实验海洋生物学重点实验室提供[26]。转移至本实验室后在培养箱内连续培养多代, 培养温度为23.5 ℃, 光暗周期L∶D为14 h∶10 h, 用青岛大扁藻、球等鞭金藻(Isochrysis galbana)和三角褐指藻(Phaeodactylum tricorntum)混合后定期投喂。
日本虎斑猛水蚤无节幼体的获得通过以下方式: 实验前一天挑选出卵囊颜色发红、较为活跃(说明卵较为成熟)的挂卵雌体约100只于培养皿中, 投喂充足的饵料待其孵化。实验当天用滴管吸出孵化的无节幼体, 并小心转移至干净的培养皿内, 得到孵化时间小于24 h的无节幼体。更换3次灭菌海水, 保证水体内基本没有饵料藻。
1.2 实验方法 1.2.1 日本虎斑猛水蚤在抑食金球藻中的摄食实验由于抑食金球藻能抑制多种生物的摄食, 本实验利用高效液相色谱分析方法检测日本虎斑猛水蚤在投喂抑食金球藻后体内的色素组成, 探究日本虎斑猛水蚤在抑食金球藻中的摄食情况。
将实验室内培养的日本虎斑猛水蚤用200 μm筛绢过滤, 过滤到筛绢后用干净灭菌海水冲洗3遍, 放入盛有400 mL干净灭菌海水的烧杯中, 共2个烧杯, 每烧杯约有150只个体, 进行24 h饥饿处理。
24 h后从2只烧杯中各取出50只个体, 共100只, 收集到GF/F玻璃纤维滤膜上, 用锡纸包上放入40 ℃的冰箱中备用。将烧杯中的海水倒出, 分别加入400 mL密度为1×107个/mL的抑食金球藻藻液和密度为2×105个/mL的青岛大扁藻藻液。
4 d后将2个烧杯中培养的日本虎斑猛水蚤分别取出, 先用200 μm筛绢将个体过滤到筛绢上, 然后用干净的灭菌海水冲洗3遍, 之后分别收集在GF/F玻璃纤维滤膜上, 每只滤膜收集到约100只个体, 用锡纸包上放入−40 ℃的冰箱中备用。
色素的分析方法(色素提取、高效液相色谱分析方法、色素定性与定量分析)与文献中的方法相同[27], 采用Waters公司Empower 2软件进行色素数据收集与分析。
1.2.2 日本虎斑猛水蚤在抑食金球藻中的存活、生长发育、繁殖实验实验共有7组, 实验组及对照组各3组, 灭菌海水为饥饿组, 每组3个平行, 每个平行10只无节幼体, 在解剖镜下用移液枪将孵化时间小于24 h的无节幼体转移至12孔板中。抑食金球藻及青岛大扁藻的特征参数见表 2, 用含碳量表示生物量, 两种微藻细胞密度设置及生物量见表 3。
| 藻类 | 藻细胞密度/(个·mL−1) | 生物量/(μg·mL–1) |
| 抑食金球藻 | 1×107 | 7.2 |
| 1×106 | 0.7 | |
| 1×105 | 0.1 | |
| 青岛大扁藻 | 2×105 | 72.2 |
| 2×104 | 7.2 | |
| 2×103 | 0.7 |
实验中日本虎斑猛水蚤的培养条件与日常培养条件相同。实验用藻均处于指数生长期, 抑食金球藻在显微镜下用血球计数板进行计数, 青岛大扁藻用浮游植物计数框进行计数, 然后用灭菌海水调节至相应密度。每日更换80%相应浓度的新鲜藻液, 每隔12 h观察无节幼体的发育情况。
当无节幼体发育为桡足幼体及成体时, 分别记录无节幼体的发育时间及存活个数, 以雄性出现执握肢为桡足幼体发育为成体的标志。在实验过程中清除死亡个体。无节幼体发育为桡足幼体及成体的存活率计算公式为:
| 存活率(%)=桡足幼体数量或成体数量/初始无节幼体数×100, | (1) |
根据50%的原则估计幼体发育至每个阶段的时间[30]。
当成体挂卵后, 将各个组中前6只挂卵的雌体转移至24孔板中, 每孔1只, 实验体积为2 mL。如果有的组别挂卵雌体不足6只则取所有挂卵雌体。在12 d内, 当有雌体产卵时, 移除幼体并记录所产幼体数量, 更换相应密度的新鲜藻液, 记录每只雌体的挂卵次数, 每次产卵的幼体数量相加即为每只雌体12 d内总的产卵数量。
使用SPSS Statistics 22进行数据分析, 使用Origin 2021进行作图。
2 结果与分析 2.1 日本虎斑猛水蚤在抑食金球藻中的摄食表 4及图 1显示当日本虎斑猛水蚤饥饿24 h后, 体内还残留绿藻的一些色素: 紫黄素(Violaxanthin, Viol)和叶绿素a(Chlorophyll a, Chl a)(图 1a); 图 1b可以看出, 日本虎斑猛水蚤在投喂青岛大扁藻4 d后体内检测到紫黄素的含量显著升高, 此外, 还检测到了绿藻的其他色素: 微量叶绿素b(Chlorophyll b, Chl b)和新黄素(Neoxanthin, Neox), 由此表明日本虎斑猛水蚤对青岛大扁藻进行了摄食。
| 培养条件 | 色素含量/(ng·ind–1) | ||||
| Viol | Chl a | Neox | Fuco | But-fuco | |
| 饥饿 | 0.14 | 0.57 | — | — | — |
| 青岛大扁藻 | 0.92 | 0.46 | 0.92 | — | — |
| 抑食金球藻 | — | 0.20 | — | 2.01 | 0.34 |
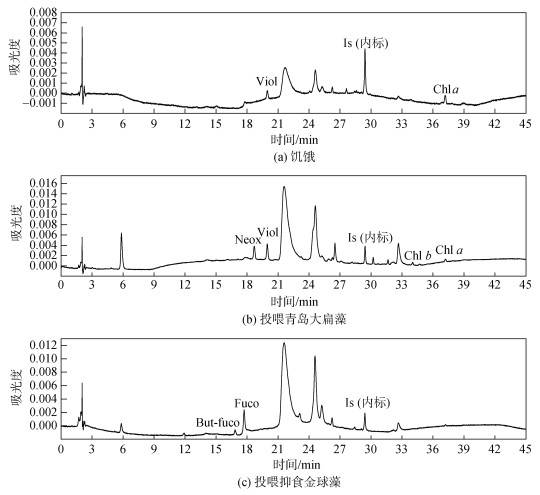 |
| 图 1 日本虎斑猛水蚤在不同藻类暴露条件下的色素分析色谱图(检测波长440 nm) Fig. 1 Chromatograms of T. japonicus exposed to different algae (detection wavelength = 440 nm) |
从图 1 c可以看出, 在日本虎斑猛水蚤投喂抑食金球藻4 d后体内检测到了岩藻黄素(Fucoxanthin, Fuco), 以及抑食金球藻的特征色素19’-丁酰氧基岩藻黄素(19’-butanoyloxyfucoxanthin, But-fuco), 由此表明日本虎斑猛水蚤对抑食金球藻进行了摄食。
2.2 日本虎斑猛水蚤无节幼体在抑食金球藻中的存活无节幼体发育至桡足幼体的实验共进行8 d。在无节幼体发育至桡足幼体阶段, 如图 2所示, 当生物量同为0.7 μg/mL及以上时, 无节幼体在抑食金球藻和青岛大扁藻中存活率均较高, 为70%以上。其中, 当生物量同为0.7 μg/mL和7.2 μg/mL时, 无节幼体的存活率在抑食金球藻中较高, 但与在青岛大扁藻中无显著差异(P = 0.694, P = 0.438)。以上说明无节幼体发育至桡足幼体阶段在抑食金球藻藻液中可以很好的存活。
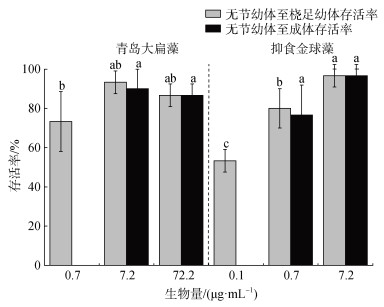 |
| 图 2 日本虎斑猛水蚤无节幼体在抑食金球藻中的存活率 Fig. 2 Effects of A. anophagefferens on T. japonicus survival rate |
无节幼体发育至成体的实验共进行34 d。在无节幼体发育至成体阶段, 如图 2所示, 当生物量同为0.7 μg/mL时, 无节幼体在青岛大扁藻中没有发育至成体, 在抑食金球藻中发育至成体, 且成活率较高, 为70%以上。当生物量同为7.2 μg/mL时, 无节幼体在抑食金球藻中存活率高于在青岛大扁藻中, 但无显著差异(P = 0.374)。以上说明无节幼体发育至成体阶段在抑食金球藻藻液中可以很好地存活。
2.3 日本虎斑猛水蚤无节幼体在抑食金球藻中的生长发育从图 3中可以看出, 在无节幼体发育至桡足幼体阶段, 发育时间在抑食金球藻和青岛大扁藻中均随着生物量的升高显著降低(P < 0.001, P < 0.001)。当生物量同为0.7 μg/mL和7.2 μg/mL时, 无节幼体在抑食金球藻中的发育时间显著低于在青岛大扁藻中的发育时间(P < 0.001, P < 0.001)。当生物量为72.2 μg/mL时在青岛大扁藻中的发育时间与当生物量为7.2 μg/mL时在抑食金球藻中的发育时间相当。
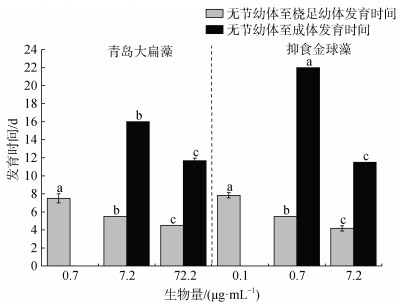 |
| 图 3 日本虎斑猛水蚤无节幼体在抑食金球藻中的发育时间 Fig. 3 Effects of A. anophagefferens on T. japonicas nauplii development time |
在无节幼体发育至成体阶段, 当抑食金球藻生物量为0.1 μg/mL时, 与当青岛大扁藻生物量为0.7 μg/mL时, 无节幼体均没有发育至成体。当生物量同为7.2 μg/mL时, 无节幼体在抑食金球藻中的发育时间显著低于在青岛大扁藻中的发育时间(P < 0.001)。当生物量为72.2 μg/mL时, 在青岛大扁藻中的发育时间与当生物量为7.2 μg/mL时在抑食金球藻中的发育时间相当。
以上说明, 抑食金球藻能很好地支持日本虎斑猛水蚤的生长发育。
2.4 日本虎斑猛水蚤雌体在抑食金球藻中的繁殖由图 4可知, 当生物量同为0.7 μg/mL时, 在整个实验过程中, 无节幼体在青岛大扁藻中没有发育至成体, 所以雌体也就没有产卵, 而在抑食金球藻中雌体12 d内进行了产卵。当生物量同为7.2 μg/mL时, 在抑食金球藻中雌体12 d内的产卵次数和产卵量显著高于在青岛大扁藻中(P < 0.001, P < 0.001)。当生物量为72.2 μg/mL时, 在青岛大扁藻中雌体12 d内的产卵次数和产卵量比当生物量为7.2 μg/mL时在抑食金球藻中低。以上说明日本虎斑猛水蚤在抑食金球藻中能更好地繁殖。
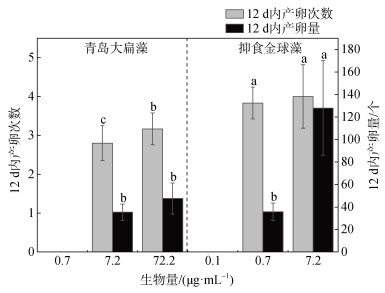 |
| 图 4 抑食金球藻对日本虎斑猛水蚤雌体12 d内产卵的影响 Fig. 4 Effects of A. anophagefferens on female T. japonicas egg production in the 12 day |
综上结果表明, 日本虎斑猛水蚤能以抑食金球藻为食, 与青岛大扁藻相比, 抑食金球藻能更好地支持日本虎斑猛水蚤的存活、生长发育和繁殖。
3 讨论以上实验结果表明抑食金球藻对日本虎斑猛水蚤没有不利影响。影响浮游动物摄食的因素主要有食物的大小、密度和食物质量。有研究表明桡足类偏向于摄食的食物粒径是本身粒径的1/10~1/100[31]。日本虎斑猛水蚤的体长约为1 mm, 偏向于摄食的食物粒径为10~100 μm, 相比于抑食金球藻, 青岛大扁藻个体大小更适合其摄食。在本作者其他的实验中(未发表), 相比于青岛大扁藻, 个体较大的链状亚历山大藻更有利于日本虎斑猛水蚤的生活。因此, 抑食金球藻有利于日本虎斑猛水蚤存活的原因不是因为其个体大小。
Haney[32]研究桡足类摄食时发现, 当饵料浓度达到106 cells/mL时, 动物的摄食才开始稳定。在本实验中, 当某些组生物量(7.2 μg·mL和0.7 μg·mL)相同时, 其对应的藻细胞密度却差有500倍, 较高的藻细胞密度可能为日本虎斑猛水蚤的摄食提供了便利条件。
藻类的营养价值通常与其脂质部分中特定必需脂肪酸有关[33]。研究表明, 抑食金球藻体内的ω3多不饱和脂肪酸, 如20:5n-3和22:6n-3, 含量与具有高营养价值的藻类相当, 能够满足双壳类对长链ω3多不饱和脂肪酸的需求, 抑食金球藻对双壳类的危害与营养价值的缺乏无关。抑食金球藻与青岛大扁藻相比, 20:5n-3(EPA)的含量相当, 而22:6n-3(DHA)的含量显著高于后者(实验结果未发表)。结合本研究的实验结果, 日本虎斑猛水蚤能在其藻液中进行正常生命活动, 表明抑食金球藻能够为其提供足够的营养价值[34]。
以上从三个方面分析了抑食金球藻有利于日本虎斑猛水蚤生活的原因, 个体大小不是主要原因, 藻细胞密度和较高的营养价值可能为其主要原因。众所周知, 受抑食金球藻危害最大的生物是双壳类软体动物。证据表明, 抑食金球藻对双壳类软体动物造成危害的原因不是因为体积小、难以消化、营养质量差和细胞密度高等因素, 而是因为当二者进行接触时, 抑食金球藻会产生一种类似多巴胺的化合物, 使双壳类鳃丝的侧纤毛停止运动, 从而阻止摄食[35]。但日本虎斑猛水蚤的摄食方式与双壳类软体动物不同, 且日本虎斑猛水蚤具有较强的解毒能力, 所以没有受到抑食金球藻的危害。
以上可知, 抑食金球藻既可为日本虎斑猛水蚤提供较高的食物密度和营养价值, 还不会被抑食金球藻危害, 所以造成了抑食金球藻有利于日本虎斑猛水蚤生活的结果。以往的研究报道发现抑食金球藻对贝类及其他浮游动物能产生不利影响, 如降低哈德逊纺锤水蚤桡足幼体的存活率、汤氏纺锤水蚤的产卵率和无节幼体发育速率[23-24], 由此说明抑食金球藻对于不同生物具有不同的影响。因此, 当褐潮发生时, 不同生物的存活、生长发育以及繁殖情况有所不同, 贝类幼体、纺锤水蚤等敏感性较强的生物会受到较大的危害, 而包括日本虎斑猛水蚤在内的这类抗性较强的浮游动物则会变为优势种, 从而影响浮游动物群落结构的组成, 进而会使整个海洋生态系统发生变化。所以, 在评价有毒有害藻的危害时, 建议对多种不同代表性的生物组合进行毒性实验, 以便全面了解有毒有害藻的危害。
4 结论通过以上实验可以认识到日本虎斑猛水蚤在抑食金球藻中能进行正常的生命活动, 本研究首次报道了能够在抑食金球藻中进行正常生命活动的浮游动物——日本虎斑猛水蚤, 表明同种有毒有害藻对不同浮游动物的影响不同。作为一种对环境适应能力较强的生态毒理学模式生物, 日本虎斑猛水蚤适合将其作为有毒有害藻毒性效应的测试生物, 结合其他敏感性较强的生物, 全面评价有毒有害藻的危害。
| [1] |
SIEBURTH J M, JOHNSON P W, HARGRAVES P E. Ultrastructure and ecology of Aureococcus anophageferens gen. et sp. nov. (chrysophyceae): the dominant picoplankter during a bloom in narragansett bay, Rhode Island, summer 1985[J]. Journal of Phycology, 1988, 24(3): 416-425. |
| [2] |
NUZZI R, WATERS R M. Long-term perspective on the dynamics of brown tide blooms in Long Island coastal bays[J]. Harmful Algae, 2004, 3(4): 279-293. DOI:10.1016/j.hal.2004.04.001 |
| [3] |
PROBYN T, PITCHER G, PIENAAR R, et al. Brown tides and mariculture in Saldanha Bay, South Africa[J]. Marine Pollution Bulletin, 2001, 42(5): 405-408. DOI:10.1016/S0025-326X(00)00170-3 |
| [4] |
ZHANG Q C, QIU L M, YU R C, et al. Emergence of brown tides caused by Aureococcus anophagefferens Hargraves et Sieburth in China[J]. Harmful Algae, 2012, 19: 117-124. DOI:10.1016/j.hal.2012.06.007 |
| [5] |
KONG F Z, YU R C, ZHANG Q C, et al. Pigment characterization for the 2011 bloom in Qinhuangdao implicated "brown tide" events in China[J]. Chinese Journal of Oceanology and Limnology, 2012, 30(3): 361-370. DOI:10.1007/s00343-012-1239-z |
| [6] |
ITO T. The biology of a harpacticoid copepod, Tigriopus japonicus Mori[J]. Journal of the Faculty of Science Hokkaido University, 1970, 17(3): 474-500. |
| [7] |
LEE K W, RAISUDDIN S, HWANG D S, et al. Acute toxicities of trace metals and common xenobiotics to the marine copepod Tigriopus japonicus: Evaluation of its use as a benchmark species for routine ecotoxicity tests in Western Pacific coastal regions[J]. Environ mental Toxicology, 2007, 22(5): 532-538. DOI:10.1002/tox.20289 |
| [8] |
RAISUDDIN S, KWOK K W, LEUNG K M, et al. The copepod Tigriopus: a promising marine model organism for ecotoxicology and environmental genomics[J]. Aquatic Toxicology, 2007, 83(3): 161-173. DOI:10.1016/j.aquatox.2007.04.005 |
| [9] |
史天一, 洪海征, 王明华, 等. 中国海洋生态毒理学研究中的毒性测试生物[J]. 环境科学, 2022, 43(11): 4888-4904. SHI Tianyi, HONG Haizheng, WANG Minghua, et al. Toxicity testing organisms for marine ecotoxicological research in China[J]. Environmental Science, 2022, 43(11): 4888-4904. |
| [10] |
曾艳艺, 黄小平. 日本虎斑猛水蚤的重金属急性毒性及其作为标准测试生物的潜在意义[J]. 生态毒理学报, 2011, 6(2): 182-188. ZENG Yanyi, HUANG Xiaoping. Acute toxicity of heavy metals to Tigriopus japonicus and its implication as a standard test animal[J]. Asian Journal of Ecotoxi cology, 2011, 6(2): 182-188. |
| [11] |
LI X D, YAN T, LIN J N, et al. Detrimental impacts of the dinoflagellate Karenia mikimotoi in Fujian coastal waters on typical marine organisms[J]. Harmful Algae, 2017, 61: 1-12. DOI:10.1016/j.hal.2016.11.011 |
| [12] |
WANG L P, YAN T, YU R C, et al. Experimental study on the impact of dinoflagellate Alexandrium species on populations of the rotifer Brachionus plicatilis[J]. Harmful Algae, 2005, 4(2): 371-382. DOI:10.1016/j.hal.2004.06.014 |
| [13] |
LI X D, YAN T, ZHANG Q C, et al. Inhibition to crucial enzymes in the lethal effects of the dinoflagellate Karenia mikimotoi on the rotifer Brachionus plicatilis[J]. Marine Environmental Research, 2020, 157: 104866. DOI:10.1016/j.marenvres.2019.104866 |
| [14] |
YAN T, WANG Y F, WANG L P, et al. Application of rotifer Brachionus plicatilis in detecting the toxicity of harmful algae[J]. Chinese Journal of Oceanology and Limnology, 2009, 27(2): 376-382. DOI:10.1007/s00343-009-9104-4 |
| [15] |
颜天, 谭志军, 李钧, 等. 塔玛亚历山大藻和赤潮异弯藻对黑褐新糠虾和卤虫的急性毒性作用[J]. 海洋学报, 2004, 26(1): 76-81. YAN Tian, TAN Zhijun, LI Jun, et al. The toxicity study of Alexandrium tamarense and Heterosigma akashiwo to two crustacean species Neomysis awotschensis and Artemia salina[J]. Acta Oceanologica Sinaica, 2004, 26(1): 76-81. |
| [16] |
颜天, 张艺, 韩刚, 等. 东海大规模赤潮危害影响的实验研究——对黑褐新糠虾和卤虫的毒性效应[J]. 海洋科学集刊, 2007, 48: 166-175. YAN Tian, ZHANG Yi, HAN Gang, et al. Experimetal study on the harmful effects of large-scale HABs in the east china sea - the toxicity to Neomysis awotschensis and Artemia salina[J]. Studia Marina Sinica, 2007, 48: 166-175. |
| [17] |
谭志军, 颜天, 周名江, 等. 塔玛亚历山大藻对黑褐新糠虾存活、生长以及种群繁殖的影响[J]. 生态学报, 2002, 22(10): 1635-1639. TAN Zhijun, YAN Tian, ZHOU Mingjiang, et al. The effects of Alexandrium tamarense on survival, growth and reproduction of Neomysis awotschensis[J]. Acta Ecologica sinica, 2002, 22(10): 1635-1639. DOI:10.3321/j.issn:1000-0933.2002.10.008 |
| [18] |
韩刚. 东海大规模赤潮对中华哲水蚤和黑褐新糠虾的生态毒理学研究[D]. 青岛: 中国科学院研究生院(海洋研究所), 2006. HAN Gang. Ecotoxicological study of large-scale HABs in the East China Sea on Neomysis awotschensis and Artemia salina[D]. Qingdao: University of Chinese Academy of Sciences (Institute of Oceanology, Chinese Academy of Sciences), 2006. |
| [19] |
WAZNIAK C E, GLIBERT P M. Potential impacts of brown tide, Aureococcus anophagefferens, on juvenile hard clams, Mercenaria mercenaria, in the Coastal Bays of Maryland, USA[J]. Harmful Algae, 2004, 3(4): 321-329. |
| [20] |
TRACEY G A. Feeding reduction, reproductive failure, and mortality in Mytilus edulis during the 1985 'brown tide' in Narragansett Bay, Rhode Island[J]. Marine Ecology Progress Series, 1988, 50(1/2): 73-81. |
| [21] |
MONICA V B, DARCY LONSDALE J. Aureococcus anophagefferens: Causes and ecological consequences of brown tides in U. S. mid-Atlantic coastal waters[J]. Limnology and Oceanography, 1997, 42(5): 1023-1038. |
| [22] |
CARON D A, GOBLER C J, LONSDALE D J, et al. Microbial herbivory on the brown tide alga, Aureococcus anophagefferens: results from natural ecosystems, mesocosms and laboratory experiments[J]. Harmful Algae, 2004, 3(4): 439-457. |
| [23] |
SMITH J K, LONSDALE D J, GOBLER C J, et al. Feeding behavior and development of Acartia tonsa nauplii on the brown tide alga Aureococcus anophagefferens[J]. Journal of Plankton Research, 2008, 30(8): 937-950. |
| [24] |
LONSDALE D J, COSPER E M, KIM W S, et al. Food web interactions in the plankton of Long Island bays, with preliminary observations on brown tide effects[J]. Marine Ecology Progress Series, 1996, 134(1/3): 247-263. |
| [25] |
公晗, 孔凡洲, 王云峰, 等. 秦皇岛海域"褐潮"海水对卤虫、轮虫存活和摄食的影响研究[J]. 海洋科学, 2015, 39(4): 30-36. GONG Han, KONG Fanzhou, WANG Yunfeng, et al. Effects of "Brown Tide" on survival and ingestion of Artemia salina and Brachionus plicatilis in Qinhuangdao[J]. Marine Sciences, 2015, 39(4): 30-36. |
| [26] |
姜鹏, 吴春辉, 张光涛, 等. 一种清除大型经济海藻生活史微观阶段杂藻污染的方法: 中国, CN103999763A[P/OL]. 2014-08-27, [2016-01-20]. JIANG Peng, WU Chunhui, ZHANG Guangtao, et al. A method for removing algal contamination at the microscopic stage of the life history of macroeconomic seaweeds: China, CN103999763A[P/OL]. 2014-08-27, [2016-01-20]. |
| [27] |
王锦秀, 孔凡洲, 陈振帆, 等. 六株球形棕囊藻的色素组成特征研究[J]. 海洋与湖沼, 2019, 50(3): 611-620. WANG Jinxiu, KONG Fanzhou, CHEN Zhenfan, et al. Characterization of pigment composition of six strains of Phaeocystis globosa[J]. Oceanologia et Limnologia Sinica, 2019, 50(3): 611-620. |
| [28] |
SUN J, LIU D Y. Geometric models for calculating cell biovolume and surface area for phytoplankton[J]. Journal of Plankton Research, 2003, 25(11): 1331-1346. |
| [29] |
孙军, 刘东艳, 钱树本. 浮游植物生物量研究Ⅰ. 浮游植物生物量细胞体积转化法[J]. 海洋学报, 1999, 21(2): 75-85. SUN Jun, LIU Dongyan, QIAN Shuben. Study on phytoplankton biomassⅠ. Phytoplankton measurement biomass from cell volum or plasma volume[J]. Acta Oceanologica Sinaica, 1999, 21(2): 75-85. |
| [30] |
PETERSON W T, PAINTING S J. Developmental rates of the copepods Calanus australis and Calanoides carinatus in the laboratory, with discussion of methods used for calculation of development time[J]. Journal of Plankton Research, 1990, 2(12): 861-862. |
| [31] |
王小冬, 孙军, 刘东艳, 等. 海洋中型浮游动物的选择性摄食对浮游植物群落的控制[J]. 海洋科学进展, 2005, 23(4): 524-535. WANG Xiaodong, SUN Jun, LIU Dongyan, et al. Control of phytoplankton community by marine mesozooplankton selective grazing[J]. Advances in Marine Science, 2005, 23(4): 524-535. |
| [32] |
HANEY J F. An in situ examination of the grazing activities of natural zooplankton communities[J]. Archiv Fur Hydrobiologie, 1973, 72(1): 87-132. |
| [33] |
ENRIGHT C T, NEWKIRK G F, CRAIGIE J S, et al. Evaluation of phytoplankton as diets for juvenile Ostrea edulis L.[J]. Journal of Experimental Marine Biology and Ecology, 1986, 96(1): 1-13. |
| [34] |
BRICELJ V M, FISHER N S, GUCKERT J B, et al. Lipid composition and nutritional value of the brown tide Alga Aureococcus anophagefferens[M]//COSPER E M, BRICELJ V M, CARPENTER E J. Novel phytoplankton blooms. Coastal and Estuarine Studies, Vol. 35. Springer, Berlin, Heidelberg. https://doi.org/10.1007/978-3-642-75280-3_6.
|
| [35] |
GAINEY L F, SHUMWAY, E. S. The physiological effect of Aureococcus anophagefferens ("brown tide") on the lateral cilia of bivalve mollusks[J]. Biological Bulletin, 1991, 181(2): 298-306. |
 2024, Vol. 48
2024, Vol. 48


