
文章信息
- 孙虎, 高新芃, 孟潇, 苏荣国. 2024.
- SUN Hu, GAO Xinpeng, MENG Xiao, SU Rongguo. 2024.
- 南黄海溶解态氨基酸组成特征及DON生物可利用性研究
- Composition characteristics of dissolved amino acids and bioavailability of dissolved organic nitrogen in the South Yellow Sea
- 海洋科学, 48(3): 75-84
- Marine Sciences, 48(3): 75-84.
- http://dx.doi.org/10.11759/hykx20230526002
-
文章历史
- 收稿日期:2023-05-26
- 修回日期:2023-06-20
溶解有机氮(DON)是海洋生态系统中重要的氮储库, 特别是生物可利用性有机氮(BDON), 在氮的海洋生物地球循环中起重要作用[1]。氨基酸(AAs)是常见的小分子DON, 占DON的10%~20%[2], 可以直接被浮游植物吸收利用[3], 是BDON的重要组成部分。研究表明春季南黄海表层海水中总溶解氨基酸(THAA, total hydrolysable amino acid)的平均物质的量的浓度(下文简称浓度)为2.98±1.72 μmol/L[4], 秋季表层THAA浓度变化范围为1.12~8.69 μmol/L, 平均浓度为2.08 μmol/L[5]。Jin等[6]调查发现, 黄海DON浓度自2月至6月DON浓度逐渐降低, DON占TDN的比例均超过60%; 2018年4月及7月南黄海DON平均浓度分别5.30±2.30 μmol/L、4.83±2.49 μmol/L[7]。AAs是海洋中重要的活性组分, 在降解过程中被选择性地保留或去除, AAs的来源不同也会导致组成差异, Dauwe等[8]根据这种现象, 利用主成分分析总结出降解因子(DI)来表征沉积物早期成岩过程中有机质的降解程度。DI也可应用于指示海水DON生物可利用性[9-11], DI值越正, 表明海洋溶解有机质越新鲜, DON的生物可利用性潜力越高[12]。
近年来, 南黄海频繁暴发浒苔绿潮, 浒苔会优先利用海水中的溶解无机氮(DIN), 在DIN含量水平处于低值时会消耗海水中的DON[13], DON在浒苔绿潮的发展中起着重要的作用[10]。研究DON、THAA的组成及分布特征, 对于海洋氮循环具有重要意义, 本文重点研究南黄海春、夏季THAA和DON组成和时空分布特征, 阐明南黄海DON的生物可利用性及其主要影响因素。
1 材料与方法 1.1 样品采集分别于2021年4月16—22日和7月16—21日搭载黄海水产研究所的“蓝海101”科考船对南黄海海域春、夏2个季节进行大面采样调查, 航次分别命名NORC2021-1、NORC2021-2, 调查站位均为38个, 调查范围为32.0°N~37.5°N, 120.5°E~124.6°E, 如图 1所示。
 |
| 图 1 2021年南黄海春夏季航次站位图 Fig. 1 Map of the sampling sites in the Southern Yellow Sea in 2021 |
使用CTD采水器采集表、中、底三层海水样品, 以0.7 µm玻璃纤维滤膜(Whatman GF/F)过滤水样, 滤液储存于棕色玻璃瓶中, −20 ℃环境中冷冻保存直至分析。采样过程使用的棕色玻璃瓶和玻璃纤维滤膜均已在450 ℃的马弗炉中高温灼烧过4 h。
1.2 氨基酸的测定方法取2 mL海水样品、2 mL盐酸(6 mol/L)和20 µL抗坏血酸溶液0.2%(w/v)加入5 mL安瓿瓶中, 使用氮吹仪氮气吹扫5 min排除安瓿瓶内的空气。将样品置于鼓风干燥机中, 在110 ℃条件下水解22 h。取2 mL水解液在60 ℃条件下旋蒸15 min至完全干燥, 蒸干后的样品加入1 mL的Milli-Q水振荡溶解, 所测浓度即为THAA浓度。
本研究采用OPA-MPA衍生化方法[14], 使用Primaide高效液相色谱仪(HITACHI, Japan)测定THAA, 配有Venusil AA氨基酸分析柱(4.6 mm×250 mm, 5 µm)。实验使用了17种氨基酸的混标: 天冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)、甘氨酸(Gly)、组氨酸(His)、精氨酸(Arg)、苏氨酸(Thr)、丙氨酸(Ala)、脯氨酸(Pro)、酪氨酸(Tyr)、缬氨酸(Val)、甲硫氨酸(Met)、胱氨酸(Cys)、异亮氨酸(Ile)、亮氨酸(Leu)、苯丙氨酸(Phe)、赖氨酸(Lys)绘制标准曲线。以醋酸钠缓冲溶液(pH=7.2±0.05, 按体积比加入1%四氢呋喃)作为流动相A和乙腈∶甲醇∶Milli-Q水(V/V/V)=1∶1∶1作为流动相B (所有流动相均经过0.45 μm聚醚砜膜过滤)进行梯度洗脱, 梯度洗脱程序如表 1所示。取0.5 mL样品经0.45 μm聚醚砜膜过滤后, 加入200 μL衍生化试剂, 衍生15 min后进行测定。进样量为20 μL, 柱温为35 ℃, 荧光检测波长为λex=337 nm、λem=454 nm。
| 时间/min | 流动相A/% | 流动相B/% | 流速/(mL·min−1) |
| 0 | 90 | 10 | 0.45 |
| 5 | 80 | 20 | 0.45 |
| 15 | 70 | 30 | 0.45 |
| 30 | 50 | 50 | 0.45 |
| 40 | 30 | 70 | 0.45 |
| 55 | 0 | 100 | 0.45 |
| 60 | 90 | 10 | 0.45 |
使用QUAATRO型营养盐自动分析仪测定海水样品中的氨氮(NH4+-N)、亚硝酸盐(NO2–-N)、硝酸盐(NO3–-N)浓度, 加和求出海水样品中DIN的浓度。以碱性过硫酸钾作为氧化剂, 在120 ℃条件下消解0.5 h, 将海水样品中DON全部氧化为DIN后测定TDN, 利用公式DON=TDN−DIN可以得到DON的浓度。
1.4 氨基酸的降解因子(1) 根据Dauwe和Middelburg[8]提出的公式通过主成分分析来计算DI值:
其中DI为氨基酸降解指数, Vari是每种氨基酸摩尔占比,
(2) Gly、Thr和Ser在硅藻细胞壁上相对富集, 在降解中被选择性保存下来, 因此也可以用(Gly+Thr+ Ser)%简单指征DOM降解程度[16]。
(3) 氨基酸对有机氮的贡献率[THAA(%DON)], 降解过程中THAA对DON的贡献逐渐降低。因此, THAA(%DON)可以有效表征有机质的降解程度, 反应DON的生物可利用性。
2 结果与讨论 2.1 南黄海氨基酸的分布特征南黄海海域春季THAA浓度范围为0.50~1.77 μmol/L, 平均浓度为0.98±0.28 μmol/L; 夏季THAA浓度范围0.34~2.40 μmol/L, 平均浓度为1.11±0.34 μmol/L (表 2), 与高新芃等[17]研究结果相似, 低于日本伊势湾和北海、挪威海等陆架区THAA浓度[18]。春、夏季THAA高值主要集中在近岸海域, 且夏季THAA呈现北高南低的特征。春季表、中、底层氨基酸的平均浓度分别为1.04± 0.26 μmol/L、1.02±0.29 μmol/L、0.90±0.25 μmol/L, 夏季表、中、底层氨基酸的平均浓度分别为1.05±0.41 μmol/L、1.22±0.38 μmol/L、1.07± 0.22 μmol/L, 相对于春季分别升高了0.96%、19.61%、18.88%。海水中氨基酸浓度受浮游生物活动和陆源输入共同影响, 夏季生物活动旺盛, 且季节性降水河流径流量增加, 是导致夏季THAA浓度整体升高的重要原因。
| 航次 | 项目 | THAA (µmol·L−1) | |
| 平均值±S.D. | 范围 | ||
| 春 | 表 | 1.04±0.26 | 0.61~1.55 |
| 中 | 1.02±0.29 | 0.68~1.77 | |
| 低 | 0.90±0.25 | 0.50~1.37 | |
| 整体 | 0.98±0.27 | 0.50~1.77 | |
| 夏 | 表 | 1.05±0.41 | 0.41~1.76 |
| 中 | 1.22±0.38 | 0.45~1.62 | |
| 低 | 1.07±0.22 | 0.34~2.04 | |
| 整体 | 1.11±0.34 | 0.34~2.04 | |
春季表、中、底层THAA浓度高值区主要出现在苏北浅滩和长江口海域等近岸海域(图 2), 这与王朋等[4]的研究基本一致, 说明THAA受陆源输入影响显著。同时, 4月底浒苔绿潮覆盖了整个苏北浅滩沿岸水域, 东至122°E, 北至34°N, 对THAA的含量与分布产生明显影响[19]。THAA在南黄海中层、底层H24附近海域出现高值, 这可能与沉积物再悬浮, THAA以间隙水的形式向外释放有关。夏季THAA水平分布上大体呈现北高南低的特征, 高值主要集中在海州湾至山东半岛南部海域, 此时浒苔绿潮主要分布在此海域内。6月中旬时北纬35°8′以北的海域绿潮覆盖面积超过以南海域, 浒苔绿潮主要覆盖在山东半岛南部海域, 重心分布于山东领海基线附近, 同时浒苔覆盖面积达到峰值高达1 086.9 km2。7月浒苔绿潮进入消亡阶段, 覆盖面积开始减少, 此时绿潮主要分布于连云港至青岛海域, 重心位于青岛海域, 八月中下旬彻底消亡[20]。采样期间该海域浒苔开始进入衰亡阶段[7], 7月浒苔生物量274.4 g·m−2迅速下降至35.9 g·m−2 [19], 平均覆盖面积下降751 km2 [20], 浒苔腐烂向水体中释放新鲜有机质造成THAA出现高值[21]。另外, 海州湾北部海域渔业生产及养殖活动产生的大量营养物质排放入海[22], 灌河和射阳河的陆源输入也是导致附近海域THAA浓度相对较高的重要原因。
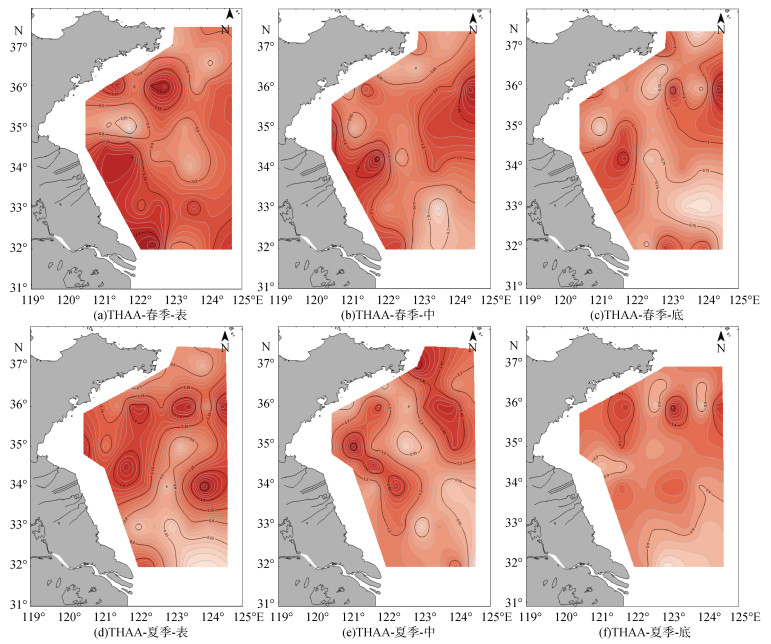 |
| 图 2 2021年春夏季南黄海总溶解氨基酸(THAA)的平面分布 Fig. 2 Plane distribution of total hydrolysable amino acid (THAA) in the South Yellow Sea in the spring and summer of 2021 |
在南黄海海域检出14种氨基酸, 春夏季氨基酸浓度与个体氨基酸摩尔百分比分别如表 3和图 3所示, 其中THAA中含量较高的氨基酸主要为谷氨酸(Glu)、丝氨酸(Ser)、甘氨酸+苏氨酸(Gly+Thr)、精氨酸(Arg)、丙氨酸(Ala)、天冬氨酸(Asp)等, 这也是构成海洋藻类蛋白质的主要氨基酸[23], 与夏清艳等[24]对南海北部表层海水中溶解氨基酸的调查结果基本一致, 主要氨基酸Gly、Ser、Glu、Ala、Asp约占THAA的67.03%。由于Gly、Ser在硅藻细胞壁相对富集, 细胞壁相对较难降解, 在有机质矿化过程中被选择性保存[25], 因此春夏季Gly、Ser的含量都比较高。与春季相比, 夏季Asp和Glu含量明显升高, Asp和Glu同属酸性氨基酸, 是浒苔中含量最高的氨基酸[5]。7月浒苔绿潮处于发展后期, 浒苔腐烂会向海水中释放氨基酸, 对水体氨基酸组成具有显著影响, 这可能是导致Asp和Glu占比升高的重要原因, 也表明夏季有机质生物可利用性较高。Arg属于难以降解的氨基酸, 在春季南黄海海域其摩尔百分比高达12.05%, 这是由于其侧链基团较大, 易于吸附到矿物表面, 微生物降解缓慢[26], 使其在水体中呈现较高的含量。
| 春季浓度/(μmol·L−1) | 夏季浓度/(μmol·L−1) | ||||||
| 表层 | 中层 | 底层 | 表层 | 中层 | 底层 | ||
| Asp | 0.041±0.016 | 0.035±0.017 | 0.044±0.033 | 0.135±0.085 | 0.167±0.082 | 0.132±0.026 | |
| Glu | 0.076±0.037 | 0.079±0.048 | 0.082±0.026 | 0.117±0.014 | 0.154±0.024 | 0.143±0.031 | |
| Ser | 0.131±0.058 | 0.141±0.062 | 0.138±0.071 | 0.112±0.004 | 0.157±0.053 | 0.125±0.064 | |
| His | 0.026±0.011 | 0.023±0.016 | 0.036±0.014 | 0.028±0.006 | 0.041±0.007 | 0.036±0.004 | |
| Gly+Thr | 0.248±0.130 | 0.195±0.084 | 0.169±0.056 | 0.158±0.047 | 0.123±0.036 | 0.147±0.032 | |
| Arg | 0.117±0.071 | 0.135±0.053 | 0.108±0.079 | 0.086±0.026 | 0.124±0.019 | 0.078±0.047 | |
| Ala | 0.072±0.039 | 0.117±0.046 | 0.065±0.036 | 0.074±0.053 | 0.096±0.054 | 0.069±0.023 | |
| Tyr | 0.082±0.044 | 0.076±0.037 | 0.063±0.012 | 0.031±0.026 | 0.052±0.028 | 0.057±0.018 | |
| Val | 0.090±0.063 | 0.080±0.046 | 0.056±0.035 | 0.092±0.077 | 0.081±0.014 | 0.070±0.128 | |
| Met | 0.036±0.009 | 0.067±0.031 | 0.043±0.041 | 0.078±0.084 | 0.087±0.036 | 0.069±0.136 | |
| Phe | 0.043±0.018 | 0.043±0.011 | 0.044±0.027 | 0.064±0.046 | 0.060±0.015 | 0.057±0.014 | |
| Ile | 0.029±0.014 | 0.027±0.015 | 0.031±0.015 | 0.031±0.013 | 0.036±0.026 | 0.047±0.027 | |
| Leu | 0.025±0.008 | 0.035±0.028 | 0.033±0.019 | 0.044±0.031 | 0.042±0.011 | 0.039±0.018 | |
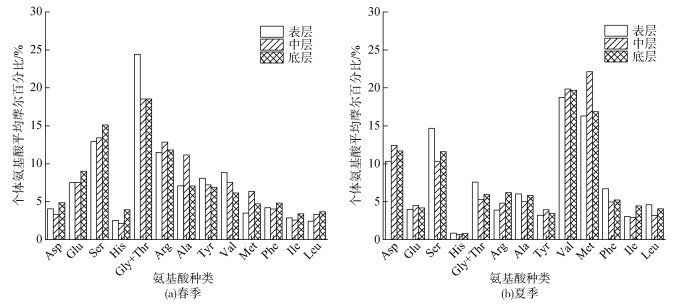 |
| 图 3 2021年春夏季个体氨基酸占THAA的平均摩尔百分比 Fig. 3 Average mole percentage of individual amino acids in THAA in the spring and summer of 2021 |
由图 4看出, 南黄海DON分布呈现出春季高于夏季、近岸高于远岸、垂直方向呈现层化现象的特征, 说明陆源输入是南黄海DON的重要来源。春夏季南黄海DON平均浓度分别是8.17±5.06 μmol/L和5.72± 2.82 μmol/L。春季DON高值站位主要集中于苏北浅滩东南部的如东县附近海域, 其附近海域表、中、底层平均浓度分别为16.88±6.89 μmol/L、12.99± 5.04 μmol/L、15.51±8.97 μmol/L, 呈现出表层 > 底层 > 中层的特征。苏北浅滩重要的紫菜养殖基地, 也是灌河、射阳河等河流的入海口, 陆地径流输入向该海域输送大量养殖废水, 这导致苏北浅滩海域在表、中、底各水层都出现DON高值。夏季南黄海整体DON含量显著降低, 夏季表、中、底层DON的平均浓度分别为7.33±2.71 μmol/L、4.85±2.41 μmol/L、4.90±2.63 μmol/L。黄海冷水团强盛, 水体层化明显使下层溶解有机氮难以补给, 同时随深度增加, 有机质矿化程度增加, 故表层DON浓度远高于中层和底层。除苏北浅滩出现高值外, 在青岛近岸海域出现DON次高值区。受洋流影响, 夏季浒苔绿潮主要聚集在青岛近岸海域。张鹏燕等[27]的研究表明, 浒苔生长和腐烂过程中会释放NH4+-N和DON, 使得青岛近岸DON浓度稍高于周边海域。
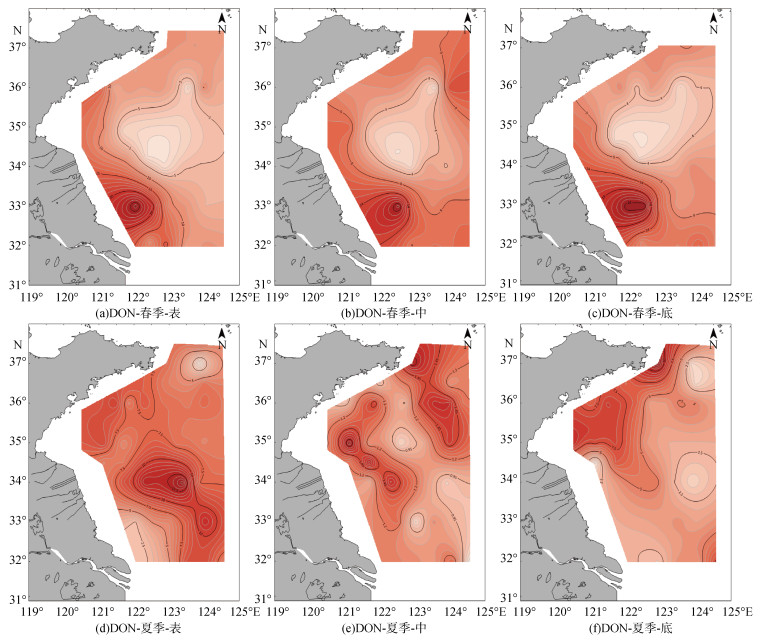 |
| 图 4 南黄海2021年春夏季DON平面分布 Fig. 4 Plane distribution of dissolved organic nitrogen in the South Yellow Sea in the spring and summer of 2021 |
如表 4所示, 春、夏季THAA(%DON)平均值分别为15.41%和21.91%, 表明夏季南黄海生物可利用性DON占比提高了42.18%。如图 5所示, 南黄海THAA(%DON)春季呈现出表层 > 中层 > 底层的特点, 夏季表现为底层 > 中层 > 表层的特征, 水平分布无明显规律。以35°N为分界线, 春季35°N以北海域THAA(%DON) (29.74%)低于35°N以南海域(36.95%), 而夏季35°N以北海域THAA(%DON)平均值高达50.21%远高于南部海域的29.09%, 与该研究中夏季THAA分布类似, 呈现南高北低的特征。此时浒苔在风和海流作用下, 向北漂移, 主要聚集在山东半岛以南海域。张海波等[7]的研究表明35°N以北海域DON占TDN的比重高于南部海域, 在夏季DON/TDN达到60%以上, 说明浒苔腐烂释放新鲜DON, 对南黄海DON分布及其生物可利用性有重要影响。
| 航次 | 水层 | DI平均值±S.D. | DI范围 | THAA(%DON)平均值±S.D. | THAA(%DON)范围 |
| 春 | 表 | 0.47±0.37 | –0.23~1.29 | 19.17±12.26 | 4.15~43.29 |
| 中 | 0.40±0.31 | –0.24~0.98 | 14.97±8.76 | 4.73~40.52 | |
| 低 | 0.39±0.25 | –0.23~1.03 | 12.08±7.22 | 3.14~36.88 | |
| 整体 | 0.42±0.32 | –0.24~1.29 | 15.41±8.18 | 3.14~43.29 | |
| 夏 | 表 | 0.50±0.40 | –0.37~1.23 | 15.98±9.13 | 4.50~36.41 |
| 中 | 0.47±0.38 | –0.31~1.14 | 24.35±9.94 | 10.47~39.19 | |
| 低 | 0.35±0.18 | –0.09~0.78 | 25.41±11.38 | 7.67~34.98 | |
| 整体 | 0.40±0.31 | –0.37~1.23 | 21.91±10.15 | 4.50~39.19 |
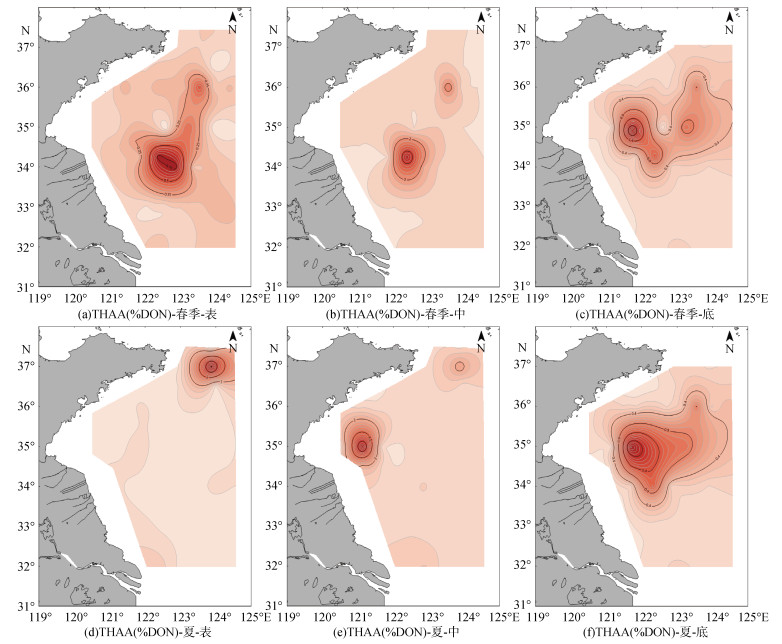 |
| 图 5 南黄海2021年春夏季THAA(%DON)的平面分布图 Fig. 5 Plane distribution of THAA (%DON) in the South Yellow Sea in the spring and summer of 2021 |
如表 4和图 6所示, 春夏季南黄海DI平均值大于零, 呈现表层 > 中层 > 底层的特征, 表层相较于中层提高了18.41%, 并(Gly+Thr+Ser)%值随水深增加而增加, 说明浮游植物的初级生产对有机质的贡献起主导作用, 随水深增加DON生物可利用性逐渐降低。表层海水初级生产力水平高, 浮游植物生长过程中释放大量生物可利用性高的新鲜DON; 随水深增加光合作用减弱, 微生物分解作用占主导作用, DON逐渐被降解, 生物可利用性降低, DON的生物可利用性受浮游植物生产和微生物降解作用共同调节。相较于春季, 夏季DI值升高了10.52%, 7月浒苔绿潮覆盖面积达到最大, 主要集中在35°N以北海域[7], 浒苔的释放使海域的整体的DON生物可利用性升高。春季表层及中层DI在海州湾附近站位, DI明显高于周边海域, 并且(Gly+ Thr+Ser)% 出现低值。连云港是中国重要的紫菜养殖区, 紫菜养殖废水排入使此海域THAA浓度较高, 导致DON生物可利用性升高[28]。夏季表层和中层DI高值主要集中于山东半岛南部海域, 整体高于底层, 在35°N以北海域存在一个DI的高值锋面, 与THAA和THAA(%DON)分布基本一致, 表明35°N以北海域DON具有更高的生物可利用性。春夏季在南黄海中南部存在DI显著低值区, (Gly+Thr+Ser)%高于均值20%, 表明该区域新鲜DON较少, 降解程度较高。在长江口海域表层、中层也出现(Gly+Thr+Ser)%低值和DI高值区, 夏季长江径流量增大, 陆源输入大量新鲜营养盐, 生物活动旺盛, 生产具有高生物可利用性的DON, 对THAA和DON分布具有明显影响。DI值和THAA(%DON)值表明高生物可利用性DON春季主要集中在苏北浅滩海域和夏季主要集中在山东半岛南部海域(与浒苔绿潮暴发区相重合), 显示了这一区域具有丰富的营养物质和旺盛的生物活动。
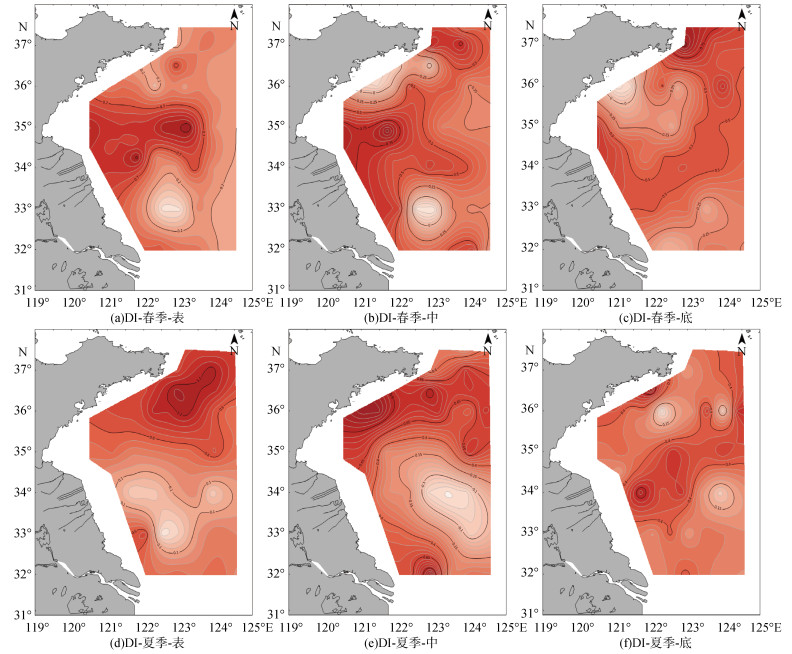 |
| 图 6 南黄海春夏季氨基酸降解指数(DI)的平面分布图 Fig. 6 Plane distribution of DI in the South Yellow Sea in the spring and summer of 2021 |
南黄海THAA和DON含量与分布特征受浒苔绿潮暴发影响明显, 浒苔绿潮4月底由苏北浅滩向西北方向发展, 到6月中旬浒苔绿潮主要覆盖在山东海域, 7月浒苔绿潮进入消亡阶段, 此时南黄海北部THAA含量水平明显升高, 浒苔主要氨基酸Asp和Glu显著增加。夏季水体层化明显, 下层营养盐难以补给, 夏季南黄海整体DON含量显著低于春季。受浒苔生长和腐烂释放NH4+-N和DON影响, 青岛近岸DON浓度稍高于周边海域。夏季南黄海THAA分布与DI和THAA(%DON)值分布呈现一致性, 呈现南部高于北部的特征。夏季南黄海DON含量水平降低, 但DON整体生物可利用性增强, 且在35°N以北海域DON具有更高的生物可利用性, 恰与浒苔绿潮暴发区相重合, 说明浒苔绿潮后期生长和腐烂过程释放大量新鲜的生物可利用性DON。
| [1] |
BASTOS E, GOUVÊA L P, HORTA P A, et al. Interaction between salinity and phosphorus availability can influence seed production of Ulva ohnoi (Chlorophyta, Ulvales)[J]. Environmental and Experimental Botany, 2019, 167: 103860. DOI:10.1016/j.envexpbot.2019.103860 |
| [2] |
HANSELLD A, CARLSON C A. Biogeochemistry of marine dissolved organic matter[M]. San Diego: Academic Press, 2002: 153-247.
|
| [3] |
BURDIGE D J. Microbial processes affecting alanine and glutamic acid in anoxic marine sediments[J]. FEMS Microbiology Letters, 1991, 85(3): 211-231. DOI:10.1111/j.1574-6968.1991.tb04728.x |
| [4] |
王朋, 陈岩, 杨桂朋, 等. 春季中国南黄海与东海海水中溶解氨基酸的分布和组成[J]. 海洋环境科学, 2015, 34(2): 217-224. WANG Peng, CHEN Yan, YANG Guipeng, et al. Distribution and composition of dissolved amino acids in the seawater of the South Yellow Sea and the East China Sea in spring[J]. Marine Environmental Sciences, 2015, 34(2): 217-224. |
| [5] |
孙岩, 杨桂朋, 陈岩, 等. 秋季南黄海表层海水中溶解氨基酸的分布与组成研究[J]. 中国海洋大学学报(自然科学版), 2012, 42(10): 81-87. SUN Yan, YANG Guipeng, CHEN Yan, et al. Distribution and composition of dissolved amino acids in surface seawater of the South Yellow Sea in autumn[J]. Periodical of Ocean University of China, 2012, 42(10): 81-87. |
| [6] |
JIN J, SU M L, JING L R, et al. Nutrient dynamics and coupling with phytoplankton species composition during the spring blooms in the Yellow Sea[J]. Deep Sea Research Part Ⅱ Topical Studies in Oceanography, 2013, 97: 16-32. DOI:10.1016/j.dsr2.2013.05.002 |
| [7] |
张海波, 王爽, 尹航, 等. 2018年南黄海浒苔绿潮发展规律及氮组分的作用探究[J]. 海洋学报, 2020, 42(8): 40-49. ZHANG Haibo, WANG Shuang, YIN Hang, et al. Exploration on the development law and the role of nitrogen components in the South Yellow Sea in 2018[J]. Haiyang Xuebao, 2020, 42(8): 40-49. |
| [8] |
DAUWE B, MIDDELBURG J J. Amino acids and hexosamines as indicators of organic matter degradation state in North Sea sediments[J]. Limnology and Oceanography, 1998, 43(5): 782-798. DOI:10.4319/lo.1998.43.5.0782 |
| [9] |
张宁, 陈岩, 高先池, 等. 西北太平洋低纬度区域海水中溶解氨基酸的分布及组成研究[J]. 海洋科学, 2020, 44(5): 60-70. ZHANG Ning, CHEN Yan, GAO Xianchi, et al. Distribution and composition of dissolved amino acids in seawater in the low-latitude region of the Northwest Pacific Ocean[J]. Marine Sciences, 2020, 44(5): 60-70. |
| [10] |
KAISER K, BENNER R. Biochemical composition and size distribution of organic matter at the Pacific and Atlantic time-series stations[J]. Marine Chemistry, 2009, 113(1/2): 63-77. |
| [11] |
DAVIS J, KAISER K, BENNER R. Amino acid and amino sugar yields and compositions as indicators of dissolved organic matter diagenesis[J]. Organic Geochemistry, 2009, 40(3): 343-352. |
| [12] |
李明. 氨基酸降解指数(Dauwe DI指数)在溶解有机氮中的验证和再修订[D]. 上海: 华东师范大学, 2017. LI Ming. Validation and rerevision of the Amino Acid Degeneration Index (Dauwe DI Index) in dissolved organic nitrogen[D]. Shanghai: East China Normal University, 2017. |
| [13] |
李鸿妹. 营养盐与黄海浒苔绿潮暴发关系的探究[D]. 青岛: 中国海洋大学, 2015. LI Hongmei. Investigation into the relationship between nutrient salt and green tide outbreak in the Yellow Sea[D]. Qingdao: Ocean University of China, 2015. |
| [14] |
杨桂朋, 李静, 高先池, 等. 高效液相色谱法测定海水中溶解态游离氨基酸[J]. 中国海洋大学学报: 自然科学版, 2007, 37(1): 125-128. YANG Guipeng, LI Jing, GAO Xianchi, et al. Determination of dissolved free amino acids in seawater by HPLC[J]. Periodical of Ocean University of China, 2007, 37(1): 125-128. |
| [15] |
DAUWE B, MIDDELBURG J J, HERMAN P M J, et al. Linking diagenetic alteration of amino acids and bulk organic matter reactivity[J]. Limnology and Oceanography, 1999, 44(7): 1809-1814. |
| [16] |
COWIE G L, HEDGES J I. The role of anoxia in organic matter preservation in coastal sediments: relative stabilities of the major biochemicals under oxic and anoxic depositional conditions[J]. Organic Geochemistry, 1992, 19(1/3): 229-234. |
| [17] |
高新芃, 景玉婷, 苏荣国, 等. 南黄海浒苔绿潮暴发区氨基酸时空分布特征[J]. 中国环境科学, 2021, 41(6): 2902-2909. GAO Xingpeng, JING Yuting, SU Rongguo, et al. The spatial and temporal distribution of amino acids in the outbreak region of the South Yellow Sea[J]. Environmental Science in China, 2021, 41(6): 2902-2909. |
| [18] |
GARRASI C, DEGENS E T, MOPPER K. The free amino acid composition of seawater obtained without desalting and preconcentration[J]. Marine Chemistry, 1979, 8(1): 71-85. |
| [19] |
WANG Z L, XIAO J, YUAN C, et al. The drifting and spreading mechanism of floating Ulva mass in the waterways of Subei shoal, the Yellow Sea of China–Application for abating the world's largest green tides[J]. Marine Pollution Bulletin, 2023, 190: 114789. |
| [20] |
詹雅婷, 王玉军, 宋珂, 等. 南黄海海域2021年绿潮的遥感监测与分析[J]. 地质学刊, 2022, 46(3): 300-304. ZHAN Yating, WANG Yujun, SONG Ke, et al. Remote sensing monitoring and analysis of green tide in 2021 in the South Yellow Sea[J]. Journal of Geology, 2022, 46(3): 300-304. |
| [21] |
冯立娜, 张海波, 孙雨嫣, 等. 浒苔绿潮消亡腐败过程中的营养盐释放及其对近海环境的影响[J]. 海洋学报, 2020, 42(8): 59-68. FENG Lina, ZHANG Haibo, SUN Yuyan, et al. Salt release in the process of Enteromorpha green tide and its influence on offshore environment[J]. Journal of Oceanography, 2020, 42(8): 59-68. |
| [22] |
郑江鹏, 袁广旺, 魏爱泓, 等. 海州湾北部海域营养盐时空分布及富营养化研究[J]. 江苏海洋大学学报(自然科学版), 2021, 30(3): 25-32. ZHENG Jiangpeng, YUAN Guangwang, WEI Aihong, et al. Spationutrient distribution and eutrophication in the northern waters of Haizhou Bay[J]. Journal of Jiangsu Ocean University (Natural Science Edition), 2021, 30(3): 25-32. |
| [23] |
HAYASHI T, SUITANI Y, MURAKAMI M, et al. Protein and amino acid compositions of five species of marine phytoplankton[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1986, 52(2): 337-343. |
| [24] |
夏清艳, 杨桂朋, 高先池, 等. 南海北部表层海水中溶解氨基酸的分布与组成研究[J]. 海洋环境科学, 2011, 30(6): 774-779. XIA Qingyan, YANG Guipeng, GAO Xianchi, et al. Distribution and composition of dissolved amino acids in the surface seawater of the northern South China Sea[J]. Marine Environmental Sciences, 2011, 30(6): 774-779. |
| [25] |
SIEZEN R J, MAGUE T H. Amino acids in suspended particulate matter from oceanic and coastal waters of the Pacific[J]. Marine Chemistry, 1978, 6(3): 215-231. |
| [26] |
徐大伦. 浒苔主要化学组分的分析及多糖活性的研究. 青岛: 中国海洋大学, 2004. XU Dalun. Analysis of the main chemical components of Enteromorpha and the study of polysaccharide activity. Qingdao: Ocean University of China, 2004. |
| [27] |
张鹏燕, 严振伟, 钟晓松等. 浒苔生长-衰亡过程中氮形态的迁移转化过程[J]. 中国环境科学, 2019, 39(5): 1967-1976. ZHANG Pengyan, YAN Zhenwei, ZHONG Xiaosong, et al. The migration and transformation of nitrogen forms during the growth and decay of Enteromorpha[J]. Environmental Science of China, 2019, 39(5): 1967-1976. |
| [28] |
PETRONE K C, RICHARDS J S, GRIERSON P F. Bioavailability and composition of dissolved organic carbon and nitrogen in a near coastal catchment of south-western Australia[J]. Biogeochemistry, 2009, 92: 27-40. |
 2024, Vol. 48
2024, Vol. 48


