文章信息
- 张子阳, 成永旭, 李凤辉, 陈四清, 常青, 陈莹, 徐荣静, 彭立成, 吴丹, 边力. 2024.
- ZHANG Ziyang, CHENG Yongxu, LI Fenghui, CHEN Siqing, CHANG Qing, CHEN Ying, XU Rongjing, PENG Licheng, WU Dan, BIAN Li. 2024.
- 盐度对绿鳍马面鲀存活、抗氧化酶及组织结构的影响
- Effect of salinity on survival, antioxidant enzymes and tissue structure of Thamnaconus septentrionalis
- 海洋科学, 48(3): 85-94
- Marine Sciences, 48(3): 85-94.
- http://dx.doi.org/10.11759/hykx20230926001
-
文章历史
- 收稿日期:2023-09-26
- 修回日期:2023-12-06
2. 中国水产科学研究院黄海水产研究所 海水养殖生物育种与可持续产出全国重点实验室, 山东 青岛 266071;
3. 烟台开发区天源水产有限公司, 山东 烟台 264001;
4. 宁德市南海水产科技有限公司, 福建 宁德 352102
2. State Key Laboratory of Mariculture Biobreeding and Sustainable Goods, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Yantai Development Zone Tianyuan Fishery Co, Yantai 264001, China;
4. Ningde Nanhai Aquatic Technology Co, Ningde 352102, China
盐度是影响水生生物生长、代谢、免疫和生存的重要环境因素之一[1], 盐度耐受性与鱼类渗透压调节密切相关。盐度的变化会引起鱼类体内产生一系列的生理活动, 来维持体内稳态, 达到适应外界盐度的目的[2]。水生生物只有在适宜的盐度范围内才能有更快的生长和更好的质量[3], 低盐和高盐环境均会影响水生生物的生理代谢和组织结构。Na+-K+-ATP酶作为重要的离子转运酶, 对维持体内渗透压平衡起关键作用, 在低盐或高盐环境中时, Na+-K+-ATP酶活性迅速增加, 从而促进离子运输来维持渗透压动态平衡[4]。有研究表明, 当外界盐度变化时鱼类体内抗氧化酶例如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-PX)等[5]相关酶的活性会发生变化。在低盐环境中, 大黄鱼(Larimichthys crocea)的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性均显著低于对照组[6]。此外, 在不适合的盐度中生长的鱼类其组织结构还会发生一定的改变, 大鳞副泥鳅(Paramisgurnus dabryanus)在高盐度环境中其鳃小片间距变大, 出现上皮层破坏溶解, 肝细胞空泡化现象增多的情况[7]。所以, 适宜盐度对水生生物的养殖极为关键。
绿鳍马面鲀(Thamnaconus septentrionalis)属于鲀形目(Tetraodontiformes), 单角鲀科(Monacanthidae), 马面鲀属(Thamnaconus septentrionalis), 俗称马面鱼、橡皮鱼、剥皮鱼, 面包鱼等[8], 曾是中国沿海地区重要的捕捞对象, 现以人工养殖为主, 是中国海洋主要经济鱼类之一[9], 其鱼肉具有高蛋白、低脂肪的特点, 富含多种必需氨基酸和鲜味氨基酸, 深受中国大众的喜爱[10-11], 在中国东海、黄海、渤海、日本沿海、朝鲜沿海一带均有分布[12]。现阶段绿鳍马面鲀的养殖主要为网箱养殖[13], 集中在山东和福建等地区, 其地区河流入海口较多, 夏季雨量充沛, 江河净流量大, 冲淡海水, 存在盐度降低过程。山东和福建为主要养殖区, 苗种和成体在两地间运输, 不同地区盐度也不同, 存在盐度降低或升高过程。现在关于盐度对绿鳍马面鲀的影响的研究较少, 只知道其盐度耐受范围较大, 可在10~45盐度下生存[14], 而盐度对绿鳍马面鲀抗氧化酶及组织结构的影响未见报道。本研究通过测定绿鳍马面鲀在低盐与高盐条件下存活情况, 鱼鳃Na+/K+-ATP酶和肝脏抗氧化酶活性, 对比观察组织结构差异, 探究盐度对绿鳍马面鲀存活、抗氧化酶及组织结构的影响, 以期为绿鳍马面鲀健康养殖提供参考。
1 材料与方法 1.1 实验材料绿鳍马面鲀来自烟台开发区天源水产公司, 挑选同一批次健康活力好、规格接近(全长20±2 cm, 体质量120±10 g)的鱼600尾, 于3 m×3 m×1.5 m的水泥池中暂养1周, 连续充气, 保持水体溶解氧≥7 mg/L, 水温(20±1) ℃, pH 8.0±0.5, 盐度30。暂养和实验期间每天按照鱼体质量2%投喂商品饵料, 分别于8: 00和20: 00分两次投喂, 每天换水1/3, 进行1次吸底。
1.2 实验方法实验于养殖水桶中进行, 设置5、10、15、20、25、30、35、40、45、50 10个盐度组, 每个实验组3个平行, 每个平行10尾鱼。利用过滤自来水和海盐调节海水盐度, 用盐度计测定, 以(5‰)/d的速度升降盐度, 每天用事先配好的对应盐度的水换水1/3, 换水后维持盐度不变。到达设定盐度后开始计时, 在24、48、72、96 h观察鱼活动存活情况, 记录死亡个数, 并及时捞出死鱼, 防止破坏水质。最后计算96 h半致死盐度和对应每个时间的死亡率。
根据得出的96 h半致死盐度, 设置1个低盐组(15)、1个高盐组(40)和正常盐度对照组(30), 每个实验组3个平行, 每个平行30尾鱼, 放在100 L养殖桶中。换水、盐度调节方法相同。到达设定盐度后开始计时, 开始实验后于3、6、12、24、48、96 h取样。
1.3 Na+/K+-ATP酶和抗氧化酶活性测定采用50 mg/L MS-222进行麻醉, 待鱼昏厥后用吸水纸吸干表面水分, 称质量测量体长记录。解剖分别采取肝、鳃组织液氮保存, 随后带至实验室于–80 ℃冰箱保存。肝、鳃组织解冻并用生理盐水清洗干净, 用吸水纸吸去表面干水分称质量, 按照1∶9加入生理盐水, 冰水浴条件下用组织捣碎机10 000~ 15 000 r/min进行匀浆, 制备成10%的组织匀浆液, 匀浆液在4 ℃, 2 000 r/min离心10 min, 取上清液备用。上清液用BCA法测定肝、鳃组织蛋白质含量, 用南京建成Na+/K+-ATPase试剂盒测定鳃的Na+/K+-ATPase活性, 用南京建成超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)和丙二醛(MDA)试剂盒测定肝脏抗氧化酶活性和丙二醛含量, 测定具体操作参照试剂盒说明书进行。Na+/K+-ATP酶活力单位为每小时每毫克鳃丝组织蛋白中ATP酶分解ATP产生1 μmol无机磷的量(μmol/(mg·h))。
1.4 组织切片制备解剖采取肝、鳃、肾组织用生理盐水清洗后放于波恩氏液中固定常温保存, 肝脏统一取较大肝叶中间部位, 鳃取鱼身体右侧的第二对鳃弓; 肾取中肾。固定24 h后进行洗涤、酒精浓度梯度脱水、二甲苯透明、浸蜡包埋、石蜡切片机切片(厚6 mm)、干燥脱蜡后He染色、风干、封片, 显微镜扫描观察拍照。
1.5 数据分析使用SPSS 25.0软件进行数据统计分析, Origin 2018软件作图。采用ANOVA方差分析和Duncan氏多重比较检验分析组间差异的显著性, 以P < 0.05为差异显著水平, 结果用平均值和均值标准差(mean± SD)表示。
2 结果与分析 2.1 绿鳍马面鲀不同盐度条件下的死亡率不同盐度条件下绿鳍马面鲀的死亡率如图 1所示, 盐度25、30和35组实验期间无死亡情况, 96 h死亡率为0。盐度5和50组的在第24小时死亡率达到了100%, 其余组均不超过20%。盐度15、20和40组的96 h死亡率较低分别为13.33%、6.67%、13.33%, 盐度10组为40%, 盐度45组为60%。由结果可知绿鳍马面鲀存活盐度为10~45, 经计算得到绿鳍马面鲀的96 h半致死低盐度为10.74, 半致死高盐度为42.95。实验中发现, 较低盐度组的鱼行动迟缓, 对外界刺激反应较弱, 体色较浅。较高盐度组的鱼游动快速且无规律, 鳃呼吸急促, 对外界刺激反应敏感, 经常露出水面, 体色变深。
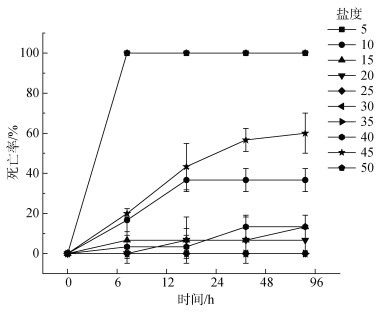 |
| 图 1 不同盐度条件下绿鳍马面鲀的死亡率 Fig. 1 Mortality of T. septentrionalis under different salinity conditions |
不同盐度下绿鳍马面鲀肝脏Na+-K+-ATP酶活性变化见图 2。从图 2中可以看出, 低盐组和高盐组实验时间内酶活性均高于对照组, 整体呈上升趋势。低盐组48 h酶活性达到最大值5.98 U/mg蛋白, 12~96 h酶活性显著高于对照组(P < 0.05)。高盐组96 h酶活性达到最大值6.23 U/mg蛋白, 酶活性一直显著高于对照组, 并在6和96 h显著高于低盐组(P < 0.05)。
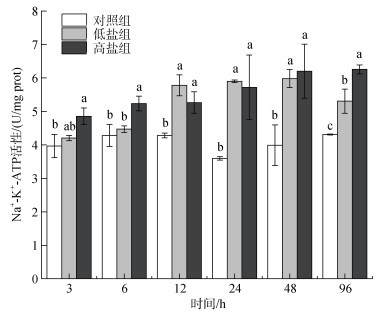 |
| 图 2 不同盐度下绿鳍马面鲀肝脏Na+-K+-ATP酶活性变化 Fig. 2 Changes in the liver Na+-K+-ATPase activity of T. septentrionalis under different salinity conditions 注: 小写字母a、b、c代表各组之间有显著性差异(P < 0.05), 下同 |
不同盐度下绿鳍马面鲀肝脏超氧化物歧化酶(SOD)活性变化见图 3a。从图 3a中可以看出, 3 h时低盐组和高盐组与对照组酶活性相比均有上升, 低盐组显著高于对照组和高盐组(P < 0.05); 6 h时低盐组和高盐组SOD酶活性继续上升达到最大值分别为107.19和93.91 U/mg蛋白, 均显著高于对照组(P < 0.05); 6~24 h各处理组SOD酶活性呈先下降后上升的趋势, 期间内低盐组和高盐组酶活性显著高于对照组(P < 0.05); 24~96 h各处理组SOD酶活性一直呈下降趋势且均低于对照组, 在96 h降到最小值, 低盐组65.84 U/mg蛋白、高盐组67.52 U/mg蛋白。
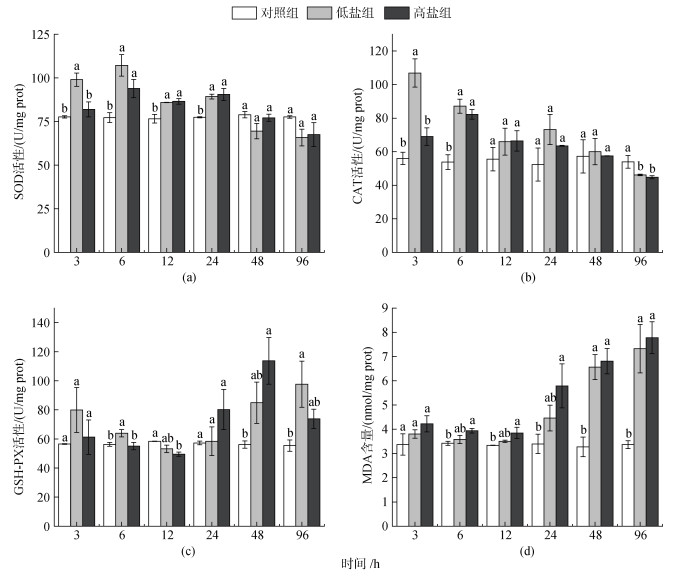 |
| 图 3 不同盐度下绿鳍马面鲀肝脏抗氧化酶活性和丙二醛含量变化 Fig. 3 Changes of antioxidant enzyme activity and malondialdehyde content in the liver of T. septentrionalis under different salinities 注: a. 超氧化物歧化酶(SOD); b. 过氧化氢酶(CAT); c. 谷胱甘肽过氧化物酶(GSH-PX); d. 丙二醛(MDA) |
不同盐度下绿鳍马面鲀肝脏过氧化氢酶(CAT)活性变化见图 3b。从图 3b中可以看出, 3 h时各处理组与对照组的酶活性相比均有上升, 低盐组酶活性达到最大值106.91 U/mg蛋白并显著高于对照组和高盐组(P < 0.05); 6 h时低盐组酶活性开始下降, 高盐组酶活性上升并达到最大值82.25 U/mg蛋白, 低盐组和高盐组酶活性显著高于对照组(P < 0.05); 6~24 h低盐组呈现先下降后上升的趋势, 高盐组一直呈下降趋势; 24~96 h各处理组呈下降趋势, 在96 h酶活性降到最小值, 低盐组46.14 U/mg蛋白、高盐组44.79 U/mg蛋白且均显著低于对照组。
不同盐度下绿鳍马面鲀肝脏谷胱甘肽过氧化物酶(GSH-PX)活性变化见图 3c。从图 3c中可以看出, 3 h时各处理组酶活性相比对照组上升; 3~12 h低盐组和高盐组GSH-PX酶活性呈下降趋势, 12 h时降到最小值, 低盐组53.18 U/mg蛋白, 高盐组49.52 U/mg蛋白, 且高盐组显著低于对照组(P < 0.05); 12~96 h低盐组酶活性呈上升趋势, 96 h达到最大值97.59 U/mg蛋白, 显著高于对照组(P < 0.05); 12~96 h高盐组酶活性呈先上升后下降的趋势, 48 h到达最大值113.73 U/mg蛋白, 显著高于对照组(P < 0.05)。
不同盐度下绿鳍马面鲀肝脏丙二醛(MDA)含量变化见图 3d。从图 3d中可以看出, 低盐组和高盐组MDA含量呈先下降后上升的趋势; 3~12 h低盐组和高盐组MDA含量呈下降但还均高于对照组, 12 h时低盐组和高盐组MDA含量降到最小值分别为3.51和3.85 nmol/mg蛋白; 12~96 h低盐组和高盐组MDA含量显著上升, 在96 h分别达到最大值7.33和7.78 nmol/mg蛋白, 高盐组6~96 h间MDA含量显著高于对照组, 低盐组48~96 h间MDA含量显著高于对照组(P < 0.05)。
2.4 绿鳍马面鲀组织结构通过显微观察发现, 对照组肝组织中央静脉周围肝细胞排列整齐, 分布均匀, 细胞结构完整, 细胞间界限明显, 细胞间脂肪占比大小正常(图 4a)。低盐组肝组织中央静脉周围肝细胞分布杂乱, 部分细胞界限模糊, 出现肝细胞空泡化、细胞核固缩等现象, 细胞间脂肪占比变大(图 4b)。高盐组肝组织中央静脉周围肝细胞数量减少且分布杂乱, 细胞界限模糊, 细胞空泡化、细胞核固缩等现象严重, 细胞间脂肪占据绝大部分空间(图 4c)。
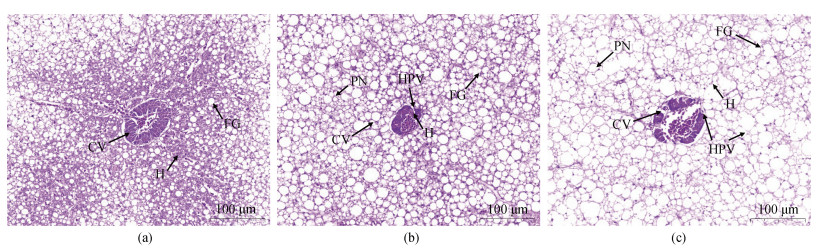 |
| 图 4 不同盐度96 h绿鳍马面鲀肝脏组织结构变化 Fig. 4 Changes in the liver tissue structure of 96 h T. septentrionalis under different salinity conditions 注: a. 肝脏(对照组); b. 肝脏(低盐组); c. 肝脏(高盐组); CV. 中央静脉; H. 肝细胞; FG. 细胞间脂肪; HPV. 肝细胞空泡; PN. 细胞核固缩 |
通过显微观察发现, 对照组鳃丝排列整齐, 鳃小片均匀分布在鳃丝两侧, 上皮细胞排列有序, 柱细胞和泌氯细胞结构完整, 柱细胞清晰可见呈球状起支撑作用, 泌氯细胞分布在鳃小片基部(图 5a)。低盐组鳃丝变宽, 鳃小片明显变长, 泌氯细胞数量减少, 上皮细胞排列紊乱(图 5b)。高盐组鳃丝萎缩, 鳃丝轮廓模糊不清, 鳃小片间距变大, 上皮细胞排列紊乱, 泌氯细胞数量增加, 细胞结构不完整甚至坏死, 出现严重的组织损伤(图 5c)。
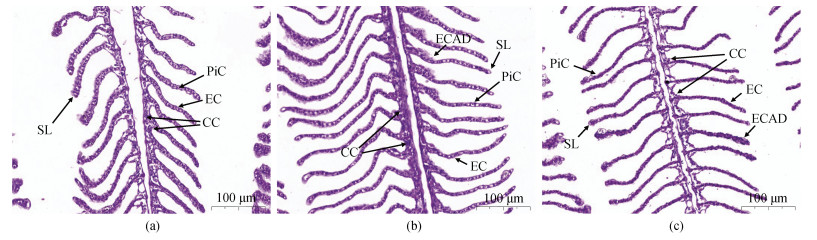 |
| 图 5 不同盐度96 h绿鳍马面鲀鳃组织结构变化 Fig. 5 Changes in the gill tissue structure of 96 h T. septentrionalis under different salinity conditions 注: a. 鳃(对照组); b. 鳃(低盐组); c. 鳃(高盐组); CC. 泌氯细胞; EC. 上皮细胞; PiC. 柱细胞; SL. 鳃小片; ECAD. 上皮细胞排列紊乱 |
通过显微观察发现, 肾组织主要由肾小体和肾小管组成。肾小体是由肾小囊包裹着肾小球组成。肾小管根据细胞形态功能又可分为颈段、近曲小管、远曲小管、集合管。颈段、管腔较小, 一般在肾小球附近, 形状规矩, 细胞边界清晰。第一近曲小管, 管腔较大, 不规则, 一般为椭圆形, 上皮细胞呈柱状, 细胞界限模糊, 游离缘有刷状缘。第二近曲小管管径较小, 呈圆形, 上皮细胞锥柱形, 细胞界限模糊。对照组肾小球发达, 较为饱满, 肾小管组织结构完整(图 6a)。低盐组和高盐组均存在肾小管管腔扩张、肾小囊腔膨大的问题, 相比低盐组高盐组肾组织损更严重, 还存在肾小管、肾小球坏死的问题(图 6b、6c)。
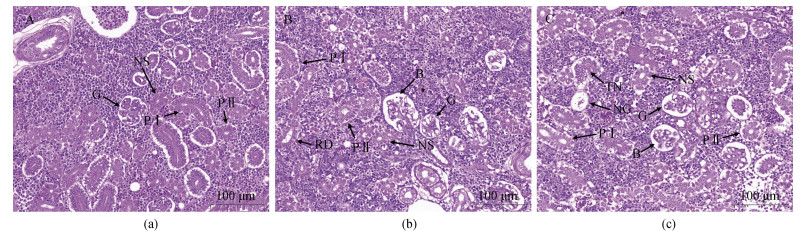 |
| 图 6 不同盐度96 h绿鳍马面鲀肾组织结构变化 Fig. 6 Changes in the kidney tissue structure of 96 h T. septentrionalis under different salinity conditions 注: a. 肾(对照组); b. 肾(低盐组); c. 肾(高盐组); G. 肾小球; NS. 颈段; PⅠ. 第一近曲小管; PⅡ. 第二近曲小管; RD. 肾小管管腔扩张; B. 肾小囊腔膨大; NG. 肾小球坏死; TN. 肾小管坏死 |
盐度是海水鱼类生存、生长的重要影响因素之一, 鱼类通过渗透压调节来维持体内环境稳态来适应一定范围的盐度变化。有研究文献报道, 绿鳍马面鲀存活盐度范围为10~45, 适宜生长盐度范围为25~35 [15]。本研究结果显示, 盐度在25~35范围内绿鳍马面鲀死亡率为0为适宜生长盐度范围, 盐度在15~40的存活率也较高, 与上述研究结果相符。本研究发现, 低盐度和高盐度中的鱼出现行为和体色上的差异。在低盐度海水中的绿鳍马面鲀行为迟缓, 体色较浅。在高盐度海水中的绿鳍马面鲀行为活跃, 体色变深。施钢等[15]研究褐点石斑(Epinephelus fuscoguttatus)幼鱼中发现, 在高盐胁迫下出现幼鱼行为异常, 体色变深的现象。秦志清等[16]研究漠斑牙鲆(Paralichthys lethostigma)幼鱼出现盐度变化影响体色改变, 说明盐度可以使鱼类产生应激, 造成行为和体色上的差异。
3.2 盐度对绿鳍马面鲀Na+-K+-ATP酶活性的影响鳃是鱼类渗透压调节的重要器官, 是与外界进行离子运输的主要场所, 这些都主要依赖于鳃丝上含有的泌氯细胞。泌氯细胞表面含有大量的Na+-K+-ATP酶, Na+-K+-ATP酶可以通过主动运输消耗能量的方法, 排出体内Na+, 吸收体外K+, 维持高K+低Na+的电位势, 启动离子通道和二级膜蛋白, 从而使得渗透压维持稳定[17]。有研究表明, 大多数广盐性鱼类鱼鳃Na+-K+-ATP酶活性呈倒“U”形[18], 即低盐与高盐环境中Na+-K+-ATP酶活性较高, 适宜盐度下Na+-K+-ATP酶活性较低。本研究结果显示, 绿鳍马面鲀低盐组和高盐组Na+-K+-ATP酶活性较高, 对照组Na+-K+-ATP酶活性较低, 与倒“U”形结论相符; 处理组Na+-K+-ATP酶活性呈上升趋势, 表明绿鳍马面鲀在不适合的盐度环境中Na+-K+-ATP酶被激活, 主动调节渗透压; 96 h低盐组酶活性显著低于高盐组, 与王梦洁等[19]研究的小黄鱼(Larimichthys polyactis)结果相似, 可能是因为96 h低盐组鳃丝上的泌氯细胞减少导致。
3.3 盐度对绿鳍马面鲀抗氧化酶活性的影响盐度胁迫可以使鱼类产生应激, 从而产生大量自由基等活性氧化物, 积累过量会对机体造成氧化损伤[20], SOD、CAT和GSH-PX是清除自由基的主要作用酶, 可以有效清除自由基等活性氧化物。SOD和CAT为协同关系[21], SOD先与自由基反应, 将其转化为过氧化氢和氧气, 产生的过氧化氢再被CAT分解为水和氧气, 完成对自由基的清除。GSH-PX可以通过催化作用, 使过氧化物还原成羟基化合物, 同时促进过氧化氢分解, 保护细胞免受氧化损伤。
本研究结果发现, 绿鳍马面鲀肝脏SOD和CAT酶活变化趋势相似, 与其为协同关系相符, 随着实验时间的延长先升高, 再下降, 最后趋于稳定, 96 h的SOD和CAT酶活受到抑制。可能是由于盐度变化导致鱼类应激, 产生的大量自由基激发鱼体的抗氧化防御系统, 提高酶活来清除自由基, 防止氧化损伤[22]; 时间延长机体自由基积累过量, 超过SOD和CAT酶调节能力, 导致最后酶活受到抑制[23], 胡润豪等[24]研究的葛氏长臂虾(Palaemon gravieri)也有类似结果, 低盐组和高盐组96 h总SOD和CAT酶活也低于对照组受到抑制。本实验低盐组与高盐组相比, SOD和CAT酶低盐组反应迅速, 酶活性峰值高; 高盐组反应较慢, 酶活性较低, 说明高盐环境对绿鳍马面鲀肝脏SOD和CAT酶影响较大。
GSH-PX酶活性一开始呈下降趋势, 直到12 h酶活性低于对照组, 可能是因为同时点的SOD和CAT酶活性较高, 过氧化氢被及时降解清除, 导致GSH-PX酶活性较低。12 h后酶活性上升趋势, 一方面可能因为SOD和CAT受到抑制, GSH-PX酶开始成为清除自由基的主要酶。另一方面可能是因为实验时间的延长, 脂质类过氧化物增多[25], 导致GSH-PX酶活性上升。孙雪娜等[26]研究的金钱鱼(Scatophagus argus)幼鱼, 35‰高盐度组0~96 h肝脏GSH-PX酶活变化趋势与本实验相反, 为先上升在最大值时高于对照组, 后下降低于对照组。
MDA为细胞膜脂质过氧化产物, 过量积累会引起生命大分子异常, 造成细胞膜结构功能改变[27], 因而MDA含量也显示了细胞损伤的程度。低盐胁迫的云纹石斑鱼(Epinehelus moara)[28]和高盐胁迫的鲶鱼(Ictalurus punctatus) [29]都因盐度变化造成MDA含量增加, 与文研究结果一致。本研究中, 0~12 h MDA含量下降, 为抗氧化酶进行调节的结果; 24 h开始上升, 是因为时间延长, SOD和CAT酶受到抑制, 大量自由基与细胞膜发生脂质氧化, 生成大量MDA, 李雪等[7]研究的大鳞副泥鳅(Paramisgurnus dabryanus)最高盐度组也出现过类似情况。低盐组与高盐组相比, 高盐组MDA含量在各个时间点均高于低盐组, 说明高盐对绿鳍马面鲀肝脏的氧化损伤较大。
3.4 盐度对绿鳍马面鲀组织结构的影响肝脏是重要的代谢和防御免疫器官, 肝糖原分解可为渗透压调节供能, 肝脏抗氧化酶还可防止细胞氧化损伤, 当水体盐度改变时, 鱼类肝脏也会受到影响[30]。HOSSAIN F等[31]研究发现鲶鱼(Pangasionodon hypophthalmus)在高盐胁迫下肝脏出现细胞空泡、核溶解、坏死等现象, 且盐度越高胁迫时间越长差异越明显。刘伟等[32]低盐胁迫大麻哈鱼(Oncorhynchus keta)肝脏也出现了空泡现象, 且盐度恢复到正常水平后肝脏组织异常也有所减少。上述现象与本研究结果相似, 低盐组和高盐组出现肝细胞空泡和细胞核固缩的现象, 高盐组较为严重, 可能是因为长时间暴露在不适合的盐度环境中渗透压调节耗能增加, 导致肝细胞内物质合成速度低于向循环系统的释放速度[7], 造成肝细胞大量空泡化。肝组织结构被破坏也造成了细胞间脂肪占据了原本细胞的空间。
鱼鳃直接与水体环境接触, 是重要的渗透压调节器官, 当水体盐度变化时, 第一时间就会引起鳃丝的变化[33]。本实验低盐组与对照组相比, 鳃丝变宽, 鳃小片变长, 在低盐环境中宽鳃丝和长鳃小片更有利于与水充分接触, 可以更好地吸收水中的无机盐离子, 来维持渗透压平衡; 高盐组与对照组相比, 鳃丝萎缩, 鳃小片间距变大, 在高盐环境中较大的间距有利于增加水氧交换量, 提高供能来排出过多离子, 这与孙梦蕾等[34]对红鳍东方鲀(Takifugu rubripes)和刘龙龙等[35]对珍珠龙胆石斑鱼(Gentian grouper)的研究结果一致。鳃上皮泌氯细胞内含有大量Na+/K+-ATPase和线粒体, 是细胞外环境与内环境进行离子交换的主要场所之一, 盐度变化会导致泌氯细胞的数量与形态改变, 低盐环境泌氯细胞缩小数量减少, 高盐环境泌氯细胞变大数量增加[36], 来适应盐度的变化。上皮细胞排列紊乱、细胞坏死, 可能是因为长时间暴露在过低或过高盐度环境中造成的损伤。
肾脏也是渗透压调节的重要器官, 肾脏通过肾小球的过滤、肾小管的重吸收及分泌系统排出水分, 来达到渗透压平衡, 维持内环境稳态。当处于低盐环境中时, 鱼体内渗透压高于外环境, 进入鱼体的水需要排出体外, 肾脏处于负荷工作状态, 所以会产生肾小管管腔扩张、肾小囊腔膨大的现象[35]; 当处高盐低盐环境中时, 鱼体内渗透压低于外环境, 鱼体处于失水状态, 不需要肾脏排水, 时间久了肾脏退化, 所以产生肾小囊腔膨大、肾小管和肾小球坏死的现象[37]。
4 结论绿鳍马面鲀的存活盐度范围为10~45, 96 h半致死低盐度为10.74, 半致死高盐度为42.95。盐度改变会造成行为差异。低盐和高盐环境会引起绿鳍马面鲀渗透压调节抗氧化活性改变, 96 h具体表现为鱼鳃Na+-K+-ATP酶活性升高, 肝脏SOD和CAT抗氧化酶活性受到抑制, GSH-PX酶活性上升, 导致MDA含量升高, 细胞受到氧化损伤。还会引起组织结构改变, 低盐和高盐环境下绿鳍马面鲀肝、鳃、肾分别有不同的组织损伤, 且相比之下高盐损伤更为严重。综上, 本研究通过分析讨论不同盐度下绿鳍马面鲀的存活、酶活和组织结构改变, 为绿鳍马面鲀不同地区间运输和网箱养殖提供理论支持。
| [1] |
LU M Y, SU M L, LIU N X, et al. Effects of environmental salinity on the immune response of the coastal fish Scatophagus argus during bacterial infection[J]. Fish and Shellfish Immunology, 2022, 124: 401-410. DOI:10.1016/j.fsi.2022.04.029 |
| [2] |
FUJIMOTO M, SAKAMOTO T, KANETOH T, et al. Prolactin-releasing peptide is essential to maintain the prolactin level and osmotic balance in freshwater teleost fish[J]. Peptides, 2006, 27(5): 1104-1109. DOI:10.1016/j.peptides.2005.06.034 |
| [3] |
安丽, 朱树人, 董学飒, 等. 盐度对大口黑鲈幼鱼生长性能、肌肉品质及抗氧化能力的影响[J]. 淡水渔业, 2023, 53(4): 34-43. AN Li, ZHU Shuren, DONG Xuesa, et al. Effects of salinity on growth, flesh quality and antioxidant capacity of juveniles Micropterus salmoides[J]. Freshwater Fisheries, 2023, 53(4): 34-43. |
| [4] |
SARAVANAN M, RAMESH M, PETKAM R, et al. Influence of environmental salinity and cortisol pretreatment on gill Na+/K+-ATPase activity and survival and growth rates in Cyprinus carpio[J]. Aquaculture Reports, 2018, 11: 1-7. DOI:10.1016/j.aqrep.2018.04.002 |
| [5] |
裴瑞华, 郑梓瑶, 张诺, 等. 盐度胁迫对彩虹明樱蛤存活、抗氧化酶和Na+-K+-ATP酶活性的影响[J]. 海洋渔业, 2023, 45(2): 162-171. PEI Ruihua, ZHENG Ziyao, ZHANG Nuo, et al. Effects of salinity stress on survival, antioxidant enzymes and Na+/K+-ATPase activities of Moerella iridescens[J]. Marine Fisheries, 2023, 45(2): 162-171. |
| [6] |
何亮银, 史晓丽, 周逢芳, 等. 低盐胁迫对大黄鱼非特异性免疫酶活力的影响[J]. 应用海洋学学报, 2022, 41(2): 347-354. HE Liangyin, SHI Xiaoli, ZHOU Fengfang, et al. Effect of low salinity stress on non-specific immunity enzymetic activity of Larimichthys crocea[J]. Journal of Applied Oceanography, 2022, 41(2): 347-354. |
| [7] |
李雪, 赵建, 王玮欣, 等. 盐度对大鳞副泥鳅抗氧化酶及组织结构的影响[J]. 水生态学杂志, 2022, 43(6): 139-145. LI Xue, ZHAO Jian, WANG Weixin, et al. Effects of salinity on antioxidant enzymes and histological structure of Paramisgurnus dabryanus[J]. Journal of Hydroecology, 2022, 43(6): 139-145. |
| [8] |
BIAN L, LI F H, GE J L, et al. Chromosome-level genome assembly of the greenfin horse-faced filefish (Thamnaconus septentrionalis) using Oxford Nanopore PromethION sequencing and Hi-C technology[J]. Molecular Ecology Resources, 2020, 20(4): 1169-1179. |
| [9] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2022. Fishery and Fishery Administration Bureau of Ministry of Agriculture and Rural Affairs, National Aquatic Technology Extension Station, Chinese Fisheries Society. The China Fisheries Statistical Yearbook[M]. Beijing: China Agricultural Press, 2022. |
| [10] |
陈涛, 李伟峰. 野生绿鳍马面鲀(Navodon septentrionalis)幼鱼、成鱼肌肉营养成分分析[J]. 黑龙江畜牧兽医, 2018, 17(17): 185-187. CHEN Tao, LI Weifeng. Nutrient composition analysis of the muscle of wild greenfin horseface triggerfish (Navodon septentrionalis) juveniles and adults[J]. Heilongjiang Animal Science and Veterinary Medicine, 2018, 17(17): 185-187. |
| [11] |
徐大凤, 刘琨, 王鹏飞, 等. 绿鳍马面鲀肌肉营养成分分析和营养评价[J]. 海洋科学, 2018, 42(5): 122-129. XU Dafeng, LIU Kun, WANG Pengfei, et al. Analysis of nutritional composition in the muscle of Thamnaconus septentrionalis[J]. Marine Sciences, 2018, 42(5): 122-129. |
| [12] |
XU Z X, ZHANG P F, CHANG Q, et al. Effects of dietary protein and lipid levels on growth performance, muscle composition, immunity index and biochemical index of the greenfin horse-faced filefish(Thamnaconus septentrionalis) juvenile[J]. Journal of Ocean University of China, 2021, 20(5): 1245-1252. |
| [13] |
刘琨, 刘刚, 黄亮, 等. 绿鳍马面鲀大规格苗种网箱培育试验[J]. 渔业现代化, 2019, 46(6): 54-60. LIU Kun, LIU Gang, HUANG Liang, et al. Experiment on cage cultivation of large-size Thamnaconus septentrionalis Günther[J]. Fishery Modernization, 2019, 46(6): 54-60. |
| [14] |
薛美岩, 张静, 杜荣斌, 等. 温度、盐度对绿鳍马面鲀幼鱼存活及生长的影响[J]. 海洋湖沼通报, 2012(1): 63-67. XUE Meiyan, ZHANG Jing, DU Rongbin, et al. Effects of temperature and salinity on survival and growth of larvae navodon septentrionalis[J]. Transactions of Oceanology and Limnology, 2012(1): 63-67. |
| [15] |
施钢, 张健东, 潘传豪, 等. 盐度渐变和骤变对褐点石斑鱼存活和摄饵的影响[J]. 广东海洋大学学报, 2011, 31(1): 45-51. SHI Gang, ZHANG Jiandong, PAN Chuanhao, et al. Effect of gradient and acute salinity stress experiment on survivorship and food intake of brown-marbled grouper, Epinephelus fuscoguttatus[J]. Journal of Guangdong Ocean University, 2011, 31(1): 45-51. |
| [16] |
秦志清, 张雅芝, 林越赳, 等. 盐度对漠斑牙鲆幼鱼生长与存活的影响[J]. 水产学杂志, 2010, 23(4): 1-5. QIN Zhiqing, ZHANG Yazhi, LIN Yuejiu, et al. Effects of salinity on growth and survival of young Paralichthys lethostigma[J]. Chinese Journal of Fisheries, 2010, 23(4): 1-5. |
| [17] |
章龙珍, 罗集光, 赵峰, 等. 盐度对点篮子鱼血清渗透压、离子含量及鳃丝Na+, K+-ATPase酶活力的影响[J]. 海洋渔业, 2015, 37(5): 449-456. ZHANG Longzhen, LUO Jiguang, ZHAO Feng, et al. Influence of salinity on serum osmolarity, ion content and gill Na+, K+-ATPase activity of Siganus guttatas[J]. Marine Fisheries, 2015, 37(5): 449-456. |
| [18] |
刘龙龙, 罗鸣, 陈傅晓, 等. 盐度对珍珠龙胆石斑鱼幼鱼渗透调节与耗氧率的影响[J]. 中国水产科学, 2020, 27(6): 692-700. LIU Longlong, LUO Ming, CHEN Fuxiao, et al. Effect of salinity on osmoregulation and oxygen consumption rate in juvenile pearl Gentian grouper[J]. Journal of Fishery Sciences of China, 2020, 27(6): 692-700. |
| [19] |
王梦洁, 储天琪, 刘峰, 等. 盐度胁迫对小黄鱼(Larimichthys polyactis)抗氧化酶、非特异性免疫酶和Na+, K+-ATP酶活力的影响[J]. 海洋学报, 2021, 43(2): 59-66. WANG Mengjie, CHU Tianqi, LIU Feng, et al. Effect of salinity stress on the antioxidant enzymes, non-specific immuneenzymes, and Na+/K+-ATPase activities in Larimichthys polyactis[J]. Haiyang Xuebao, 2021, 43(2): 59-66. |
| [20] |
HOSEINIFAR H S, YOUSEFI S, DOAN V H, et al. Oxidative stress and antioxidant defense in fish: The implications of Probiotic, Prebiotic, and Synbiotics[J]. Reviews in Fisheries Science and Aquaculture, 2020, 29(2): 1-20. |
| [21] |
LIVINGSTONE R D. Contaminant-stimulated reactive oxygen species production and oxidative damage in aquatic organisms[J]. Marine Pollution Bulletin, 2001, 42(8): 656-666. |
| [22] |
WEI H J, CHEN M Q, DENG Z H, et al. Immune and antioxidant responses of pearl oyster Pinctada axima exposed to acute salinity stress[J]. Aquaculture Research, 2022, 53(6): 2439-3447. |
| [23] |
许友卿, 唐旎, 丁兆坤. 海水酸化对水生动物主要抗氧化酶的影响及机理[J]. 水产科学, 2016, 35(4): 453-458. XU Youqing, TANG Ni, DING Zhaokun. Effect and mechanism of ocean acidification on main antioxidant enzyme activity in aquatic animals[J]. Fisheries Science, 2016, 35(4): 453-458. |
| [24] |
胡润豪, 史文军, 王盼, 等. 温度、盐度变化对葛氏长臂虾存活和抗氧化能力的影响[J]. 中国水产科学, 2022, 29(4): 535-548. HU Runhao, SHI Wenjun, WANG Pan, et al. Effects of temperature and salinity on the survival and antioxidant capacity of Palaemon gravieri[J]. Journal of Fishery Sciences of China, 2022, 29(4): 535-548. |
| [25] |
张惠, 曾霖, 熊逸飞, 等. 盐度驯化改善大黄鱼盐度胁迫耐受性的作用机制[J]. 中国水产科学, 2023, 30(3): 334-343. ZHANG Hui, ZENG Lin, XIONG Yifei, et al. Mechanism of salinity acclimation in Larimichthys crocea improving tolerance to salinity stress[J]. Journal of Fishery Sciences of China, 2023, 30(3): 334-343. |
| [26] |
孙雪娜, 冯广朋, 刘鉴毅, 等. 盐度骤变对金钱鱼幼鱼抗氧化状态的影响[J]. 海洋渔业, 2021, 43(6): 661-670. SUN Xuena, FENG Guangpeng, LIU Jianyi, et al. Effects of abrupt salinity changes on antioxidant status of juvenile Scatophagus argus[J]. Marine Fisheries, 2021, 43(6): 661-670. |
| [27] |
VINAGRE C, MADEIRA D, NARCISO L, et al. Effect of temperature on oxidative stress in fish: Lipid peroxidation and catalase activity in the muscle of juvenile seabass, Dicentrarchus labrax[J]. Ecological Indicators, 2012, 23: 274-279. |
| [28] |
廖雅丽, 张晨捷, 彭士明, 等. 盐度对云纹石斑鱼抗氧化酶及溶菌酶活性的影响[J]. 上海海洋大学学报, 2016, 25(2): 169-176. LIAO Yali, ZHANG Chenjie, PENG Shiming, et al. Effects of salinity on activities of liver antioxidant enzymes and plasma lysozyme of Epinehelus moara[J]. Journal of Shanghai Ocean University, 2016, 25(2): 169-176. |
| [29] |
ZHANG S Y, DUAN Y Q, ZHONG L Q, et al. Using comparative transcriptome analysis to identify molecular response mechanisms to salinity stress in channel catfish (Ictalurus punctatus)[J]. Environmental pollution (Barking, Essex: 1987), 2023, 333: 121911. |
| [30] |
DAWOOD M A, NORELDIN A E, SEWILAM H. Long term salinity disrupts the hepatic function, intestinal health, and gills antioxidative status in Nile tilapia stressed with hypoxia[J]. Ecotoxicology and Environmental Safety, 2021, 220: 112412. |
| [31] |
FARZANA H, MAJHARUL S I, SADIQUL M I, et al. Behavioral and histo-pathological indices of striped catfish (Pangasionodon hypophthalmus) exposed to different salinities[J]. Aquaculture Reports, 2022, 23: 101038. |
| [32] |
刘伟, 支兵杰, 战培荣, 等. 盐度对大麻哈鱼幼鱼血液生化指标及肝组织的影响[J]. 应用生态学报, 2010, 21(9): 2411-2417. LIU Wei, ZHI Bingjie, ZHAN Peirong, et al. Effects of salinity on haematological biochemistrical indices and liver tissue in juvenile Oncorhynchus keta[J]. Chinese Journal of Applied Ecology, 2010, 21(9): 2411-2417. |
| [33] |
CARMONA R, GARCIA-GALLRGO M, SANZ A, et al. Chloride cells and pavement cells in gill epithelia of Acipenser naccarii: ultrastructural modifications in seawater‐acclimated specimens[J]. Journal of Fish Biology, 2004, 64(2): 553-566. |
| [34] |
孙梦蕾, 蒋洁兰, 王莉苹, 等. 低盐胁迫下红鳍东方鲀幼鱼鳃、肾和肠组织结构的变化[J]. 广东海洋大学学报, 2016, 36(6): 38-43. SUN Menglei, JIANG Jielan, WANG Liping, et al. Structural changes in gill, kidney and intestine of juvenile Takifugu rubripes under low salinity treatment[J]. Journal of Guangdong Ocean University, 2016, 36(6): 38-43. |
| [35] |
刘龙龙, 罗鸣, 陈傅晓, 等. 盐度对珍珠龙胆石斑鱼幼鱼生长及鳃肾组织学结构的影响[J]. 大连海洋大学学报, 2019, 34(4): 505-510. LIU Longlong, LUO Ming, CHEN Fuxiao, et al. Effects of salinity on growth, and gill and kidney histological structures of juvenile pearl Gentian grouper[J]. Journal of Dalian Ocean University, 2019, 34(4): 505-510. |
| [36] |
AMIRI M B, XU G E, KUPSCO A, et al. The effect of chlorpyrifos on salinity acclimation of juvenile rainbow trout (Oncorhynchus mykiss)[J]. Aquatic Toxicology, 2018, 195: 97-102. |
| [37] |
AZHAR A, MD G A, BHAKTA S S, et al. Repercussion of salinity on hematological parameters and tissue morphology of gill and kidney at early life of tilapia[J]. Aquaculture and Fisheries, 2022, 14(4): 6. |
 2024, Vol. 48
2024, Vol. 48


