
文章信息
- 田璐琦, 杨皓月, 邢荣娥, 刘松, 李克成, 于华华, 李鹏程. 2024.
- TIAN Luqi, YANG Haoyue, XING Ronge, LIU Song, LI Kecheng, YU Huahua, LI Pengcheng. 2024.
- 制备羟基磷灰石的贝壳种类优选及方法比较
- Comparison of raw materials and preparation methods for seashell hydroxyapatite
- 海洋科学, 48(3): 95-102
- Marine Sciences, 48(3): 95-102.
- http://dx.doi.org/10.11759/hykx20230303001
-
文章历史
- 收稿日期:2023-03-03
- 修回日期:2023-04-03
2. 青岛海洋科学与技术国家实验室 海洋药物与生物制品功能实验室, 山东 青岛 266237;
3. 中国科学院海洋大科学研究中心, 山东 青岛 266071;
4. 中国科学院大学, 北京 100049
2. National Laboratory of Marine Science and Technology, Qingdao 266237, China;
3. Marine Research Center, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
羟基磷灰石[Ca10(PO4)6(OH)2](hydroxyapatite, HA)是一种钙磷比为1.67的钙磷化合物, 因化学组成以及晶体结构与人体骨骼和牙齿极为相似而被广泛研究, 具有很好的生物相容性和骨诱导能力, 可以作为填料[1]、金属涂层[2]以及药物载体[3]应用于骨骼和牙齿的修复过程。研究表明, HA的生物活性与其形态学参数, 例如形状、大小以及表面电荷密切相关[4], 而制备方法以及合成原料对这些参数具有有效的调控作用[5]。
目前, 以贝壳为原料制备HA的方法包括固相法[6], 机械化学法[7], 化学沉淀法[8]、水热法[3]以及微波加热法[9]等, 不同制备方法得到的HA在形态学参数上略有差异, 固相法、机械化学法和化学沉淀法合成的HA往往倾向于聚集形成大且无规则的微米级颗粒[6, 10-11], 水热法制备虽然可以有效地调控颗粒的形态及大小, 但需要高温高压的反应条件, 危险系数高且反应时间较长[12]。反相微乳液法是利用表面活性剂在水相和油相界面形成稳定的胶束, 反应离子被包覆在胶束中, 通过带不同粒子的胶束之间相互碰撞、融合, 反应随即发生在包覆粒子的微型反应池中, 该方法条件温和, 形成的羟基磷灰石具有可控的形态和大小[4]; 微波法则是利用高微波功率将能量迅速地转化为反应物的内能, 加快反应速度, 具有成本低, 生产效率高的特点。贝壳由95%以上的碳酸钙和1%~5%的有机质组成[6, 9, 13], 是自然界天然的“钙库”。长期复杂的生长环境使贝壳结构中掺杂Zn2+、Sr2+、Mg2+和CO32–等多种活性离子, 这些离子的存在使以贝壳为原料制备的羟基磷灰石在晶体结构上发生畸变[6, 14-15], 加快了其在体内的降解速度, 溶出的活性离子则通过影响细胞黏附、增殖以及分化过程对生物活性产生积极的影响[16], 相较于化学试剂合成的HA, 贝壳制备的HA更贴近人体骨骼的天然矿物[15]。
本研究以太平洋牡蛎(Crassostrea gigas)壳、杂色蛤蜊(Ruditapes variegata)壳、栉孔扇贝(Chlamys farreri)壳以及脉红螺(Repanavenosa)壳四种常见的贝壳废弃物以及化学试剂CaO为原料, 对比了反相微乳液法和微波加热法制备的羟基磷灰石在化学组成、物理特性以及形态学参数等方面的差异, 以期获得一种安全可持续的原料和高效的合成方式, 从而制备形貌可控的纳米HA应用于医学材料等领域。
1 材料与方法 1.1 试剂NaOH(天津奥普升化工有限公司, 分析纯); Span 80(天津致远化学试剂有限公司, 化学纯); 醋酸(天津富宇试剂, 分析纯)。氧化钙(分析纯)、正戊醇(分析纯)、环己烷(分析纯)、Na2HPO4(分析纯)、聚乙二醇6000(化学纯)均购买自国药集团化学试剂有限公司。
1.2 贝壳的收集和处理牡蛎壳、蛤蜊壳、扇贝壳和脉红螺壳均收集自青岛海鲜市场。贝壳经刷洗后在0.5 mol/L NaOH溶液中浸泡48 h去除表面杂质, 冲洗多次后烘干, 将贝壳碾压至碎片, 用粉碎机进一步粉碎并用200目筛网过滤。将得到的贝壳粉在950 ℃煅烧2 h去除有机物。
1.3 反相微乳液法制备HA根据Ma等[4]的方法, 将11.7 g Span 80、23.4 g正戊醇和100 g环己烷混合后剧烈搅拌制备油相, 其中Span 80为表面活性剂, 正戊醇为助表面活性剂。将CaO和煅烧后的贝壳粉溶解在体积分数为7%的醋酸中配制成为0.5 mol/L的醋酸钙溶液((CH3COO)2Ca), 同时配制0.3 mol/L的Na2HPO4溶液, 取0.6 mL配制好的(CH3COO)2Ca溶液和Na2HPO4溶液分别滴加到60 mL的油相中, 放入超声粉碎仪(JY92-Ⅱ, 宁波新芝)中进行超声乳化(超声功率20%; 超声时长3 s; 间隔时长1 s; 总超声时长7 min), 得到透明的钙微乳液和磷微乳液。将钙微乳液和磷微乳液按照1∶1的比例混合并用1 mol/L NaOH调节pH到10.0, 在磁力搅拌器上搅拌5 h, 反应结束后在6 000 r/min下离心5 min, 弃去上清液, 先后用无水乙醇和超纯水洗涤白色沉淀3~5次, 得到的产物在−80 ℃超低温冷冻24 h后在冷冻干燥机(FD-1A-80, 北京博医康)中干燥24 h。为除净产物中的有机杂质, 冻干后的产物在650 ℃下继续煅烧3 h获得HA。
1.4 微波辅助法制备HA实验借鉴Che[17]的方法, 采用聚乙二醇(PEG 6000)作为模板剂辅助HA的合成。将CaO和煅烧后的贝壳粉溶解在50 mL含质量分数为6% PEG的醋酸溶液(体积分数为7%)中得到1 mol/L的(CH3COO)2Ca, 并配制等体积0.6 mol/L的Na2HPO4溶液, 该溶液中同样含有质量分数6% 的PEG。将Na2HPO4溶液逐滴滴加到(CH3COO)2Ca溶液中, 并用1 mol/L NaOH溶液将pH调整到10.0, 得到的白色悬浊液在微波条件下(800 W, 2.45 GHz)反应15 min, 反应结束后在6 000 r/min下离心5 min, 弃去上清液, 得到的白色沉淀分别用无水乙醇和超纯水洗涤3次, 冷冻干燥后在马弗炉中煅烧(650 ℃, 3 h)。
1.5 样品测试与分析 1.5.1 HA的化学表征通过傅里叶变换红外光谱仪(Fourier transform infrared spectrometer, FTIR)(Nicolet iS10, 美国赛默)和X射线衍射仪(X-ray powder diffractometer, XRD) (D8 ADVANCE, 德国布鲁克)对产物进行化学表征。X射线扫描仪的Cu靶波长为1.540 6 Å, 管电流和电压分别为40 mA和40 kV, 扫射步长为0.02°, 扫描速率为3°/min, 扫描范围在20°~ 60°之间; 采用能谱仪(ICPOES730, 美国安捷伦)测定HA中的钙磷含量。
1.5.2 HA的表面形貌采用扫描电子显微镜(scanning electron microscope, SEM)(SU8020, 日本日立)观察颗粒的微观形态, 扫描电压是3.0 kV, 扫描模式为二次电子扫描。
1.5.3 HA的表面特征颗粒表面的Zeta电位采用纳米粒度仪(NanoZS90, 英国马尔文)测量, 测试前将样品以1 mg/mL的浓度分散在超纯水中; 颗粒的表面亲水性采用接触角测量仪(JC2000C, 上海中晨) 进行测量, 测量之前, 粉末状样品以固液比1∶50溶解在无水乙醇中, 使用喷枪将悬浮液均匀喷洒在载玻片上, 置于室温下24 h使溶剂挥发。
1.5.4 数据分析采用Origin 2019 b和Graphpad 8.0进行图像的绘制, 并使用Image J测量颗粒大小; 使用Jade 6软件分析样品的X射线衍射图谱。
2 结果与分析 2.1 HA的傅里叶变换红外光谱通过FTIR对样品进行了表征, 如图 1所示, 两种方法均成功合成了HA, 图中1 018 cm–1和1 086 cm–1处的峰(v3)代表PO43–的不对称伸缩振动峰, 962 cm–1处的峰(v4)归属于P-O键的对称伸缩振动峰, 562 cm–1和599 cm–1处的双峰(v1)则代表O-P-O的不对称弯曲峰[9, 13]。在以脉红螺壳为原料时, 两种方法制备的HA在873 cm–1, 1 411 cm–1和1 455 cm–1处都可以看到归属于CO32–的振动峰(图 1a(2)、b(2)), CO32–的存在有以下三种可能的原因: (1)来自于贝壳原料本身含有的方解石和霰石的掺入; (2)制备过程中样品与空气的接触导致[18]; (3)煅烧过程产生的含碳物质在HA表面的掺入, 后两种原因具有加工层面上的偶然性, 但两种方法制备的脉红螺壳HA均具有CO32–的掺杂, 因此原因(1)的可能性更大。需说明的是, CO32–在HA晶体中的取代方式包括A型取代(取代-OH)和B型(取代PO43–)取代[19], 两种取代方式都可以通过出峰位置在图谱中呈现出来, 本实验中CO32–的取代方式属于典型的B型取代, 且CO32–竞争PO43–位点的能力往往会影响PO43–-v3处的峰强[20], 这使得该原料制备的HA与人体骨骼和牙齿中的无机质化学组成和结构更加接近[21-22]。
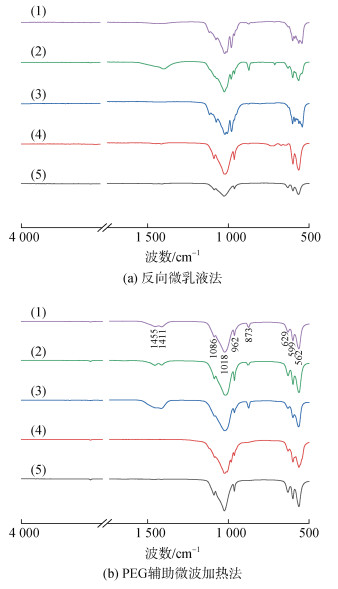 |
| 图 1 氧化钙及不同贝壳原料通过不同制备方法合成的羟基磷灰石(HA)傅里叶变换红外光谱图 Fig. 1 Fourier transform infrared spectra of hydroxyapatite synthesized by CaO and different shells through different preparation methods 注: 化学羟基磷灰石(1), 脉红螺壳羟基磷灰石(2); 扇贝壳羟基磷灰石(3); 蛤蜊壳羟基磷灰石(4); 牡蛎壳羟基磷灰石(5) |
采用XRD进一步检测了样品的化学特性。通过与粉末衍射标准联合委员会(JCPDS)的数据库进行比对, 所有产物的XRD图谱与HA的标准卡片(JCPDS # 74-0565)高度匹配(图 2), 并具有较强的衍射峰。以反相微乳液法制备时, 各组的产物组成除HA外, 均含有β-磷酸钙(β-tri calcium phosphate, β-TCP)和NaCaPO4的存在(图 2a); 采用PEG辅助微波加热法制备时, 以扇贝壳和蛤蜊壳制备的HA中也存在杂质β-TCP和NaCaPO4, 但CaO、脉红螺壳和牡蛎壳得到的产物均为纯净的HA(图 2b), 相较于微波加热法, 反相微乳液制备HA时更需要关注β-TCP向HA的完全转化。NaCaPO4的存在有两方面的原因: 一是贝壳原料本身存在的钠元素的掺杂[15, 23], 二是制备过程中pH调节剂的不完全去除。值得一提的是, 与其他各组相比, 两种方法制备的脉红螺壳HA在(002)表现出高于其他组别的衍射强度, 强调了该原料合成的HA更倾向于沿c轴方向生长[24]。
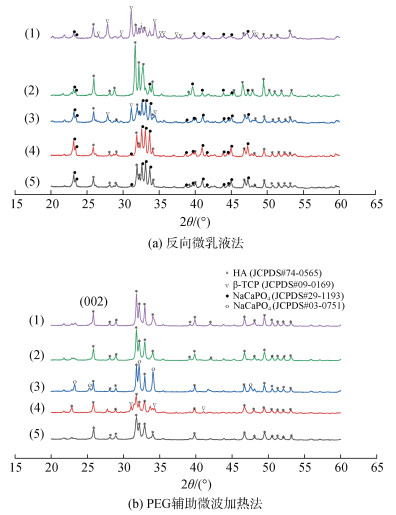 |
| 图 2 氧化钙及不同贝壳原料通过不同制备方法合成的羟基磷灰石(HA) X射线衍射图谱 Fig. 2 X-ray diffraction spectra of hydroxyapatite synthesized by CaO and different shells through different preparation methods 注: 化学羟基磷灰石(1); 脉红螺壳羟基磷灰石(2); 扇贝壳羟基磷灰石(3); 蛤蜊壳羟基磷灰石(4); 牡蛎壳羟基磷灰石(5) |
通过SEM对产物进行微观形态学观察, 根据图 3, 两种制备方法得到的HA均可以达到纳米级别。其中, 反相微乳液法得到的产物倾向于形成近球形的颗粒, 部分晶粒融合形成大且不规则的颗粒, 而微波辅助法得到的HA则更倾向于形成尺寸更小的棒状和椭圆状颗粒, 形态的变化在以贝壳为原料制备的HA中更加显著。进一步测量了颗粒的粒径大小, 如图 4所示, 采用反相微乳液法制备的HA颗粒大小在(104.10±1.95) nm与(207.90±3.75) nm之间变化, 而PEG辅助微波加热法制备的HA颗粒大小在(61.17±3.11) nm与(182.70±1.05) nm之间变化(图 4a)。同时, 相较于CaO合成的HA, 贝壳在向HA的转化过程中似乎更容易保持纳米结构, 且粒径大小均与化学HA具有显著性差异(图 4b), 其中以蛤蜊壳为原料制备的HA在两种制备方法下均表现出最小的粒径分布, 分别为(104.10±1.95) nm(反相微乳液法)和(61.17±3.11) nm(微波加热法), 其次是脉红螺壳, 在两种方法下制备得到的产物粒径均低于110 nm。
 |
| 图 3 氧化钙及不同贝壳原料通过不同制备方法合成的羟基磷灰石(HA)微观形貌 Fig. 3 Morphology of hydroxyapatite synthesized by CaO and different shells through different preparation methods |
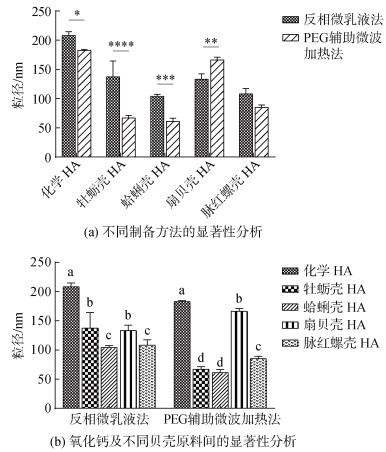 |
| 图 4 氧化钙及不同贝壳原料通过不同制备方法合成的羟基磷灰石(HA)粒径大小 Fig. 4 Particle size of hydroxyapatite synthesized by CaO and different shells through different preparation methods 注: *P < 0.05; **P < 0.01; ***P < 0.001; ****P < 0.000 1; 采用邓肯分析, 字母“a”代表的是均值最大的组别, 从“a”到“d”平均值依次下降, 字母相同的两组间无显著差异。不同字母组间差异有统计学意义, P≤0.05 |
Zeta电位指分散介质与覆盖在颗粒表面的流体稳定层之间的电势差[25], 可以反映颗粒的带电性以及稳定性。如图 5所示, 所有样品的Zeta电位都呈现负数, 数值在−12.37 mV与−39.63 mV之间变化。其中, 采用微波加热法制备的HA的zeta电位绝对值均显著高于同原料条件下采用反相微乳液法制备的HA, 且牡蛎壳HA的电位绝对值可以高达39.63 mV, 其他原料制备的HA的zeta电位绝对值虽然低于该值, 但仍大于25 mV。
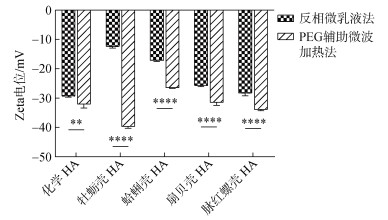 |
| 图 5 氧化钙及不同贝壳来源通过不同方法合成的羟基磷灰石(HA) Zeta电位 Fig. 5 Zeta potential of hydroxyapatite synthesized by CaO and different shells through different preparation methods 注: **P < 0.01; ****P < 0.000 1 |
通过测量HA的接触角判断其亲水性, 实验结果表明, PEG辅助微波加热法制备得到的HA接触角均为0°, 表现出完全的亲水性, 而采用反相微乳液法制备的HA在各组之间表现出差异性, 其中脉红螺壳HA表现出完全的亲水性, 其他各组的接触角则分别为3.33°(化学HA), 11.67°(牡蛎壳HA), 3.67°(扇贝壳HA), 2°(蛤蜊壳HA)。
通过上述多方面的材料评估, 以PEG辅助微波加热法制备的HA具有更加显著的应用优势, 在此基础上, 利用能谱仪测定了不同原料制备得到的HA的钙磷含量并计算钙磷比。如图 6所示, 脉红螺壳制备的HA钙磷比高于理论值1.67, 为1.69, 接近天然骨的钙磷比1.71[26], 而其他各组HA的钙磷比均低于1.67。
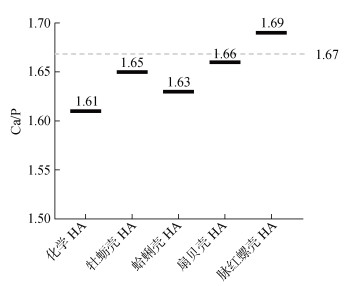 |
| 图 6 氧化钙及不同原料制备得到的羟基磷灰石(HA)钙磷比(PEG辅助微波加热法) Fig. 6 Ca/P ratio of hydroxyapatite synthesized by CaO and different shells (microwave method) |
制备方法可以直接影响HA的形态学参数这一论点在本文中得到了充分论证, 两种方法均可以得到纳米HA晶体, 但在进一步的形貌分析和表面特性分析中表现出了显著的差异。反相微乳液法的条件温和, 反应不需要高温或高压即可形成规则的纳米HA, 不同的表面活性剂通过形成形状和大小不同的胶束直接影响颗粒的形态学参数[5], 在该方法中, 由于煅烧过程中分子内部的结构发生破坏并重结晶, 导致颗粒间发生相对融合从而增大了颗粒的粒径[6]; 微波加热法是通过微波能向分子内能的快速转化加速HA的结晶过程, Mohd[27]的综述中提出微波加热结合高温煅烧可以增加反应的动力学, 从而有效改善产物的物理特性, 使产物具有更小更均一的粒径分布, 这与本文得到的结论相一致, 然而, 微波条件下离子的高速运动往往使离子无定形的结合导致颗粒间的聚合[28], 本研究添加的PEG通过PEG-OH与Ca2+的结合降低了离子在体系中的运动速率[5], 缓解了颗粒间的融合和聚集, 另一方面, PEG在反应过程中的降解进一步控制了颗粒的粒径大小。据报道, 颗粒的粒径越小, 一定程度上反映了颗粒具有更大的比表面积和表面能, 这为细胞的黏附提供了足够的空间和作用力[5, 29]。相较于反相微乳液法, PEG辅助微波加热法制备的HA更倾向于沿c轴方向生长, 形成类似棒状的形态, 这种形态的变化在以贝壳为原料制备的HA中更加显著。棒状HA为成骨细胞的黏附和增殖提供了充足的空间, 使细胞活动可以扩散至整个支架, 而不只是集中在颗粒的顶部[24], 更重要的是棒状HA更加接近人体骨骼和牙齿中磷灰石的形态[30-32], 因此被认为具有比其他形状HA更大的应用潜力[33]。
Zeta电位的测试结果显示采用两种方法得到的HA表面都带有负电荷, Smith等人[34]验证了带负电荷的HA在细胞黏附、Ca2+沉积等方面具有巨大的利用优势, 更适用于作为骨修复材料应用于医学领域[35]。通常认为, Zeta电势的绝对值与颗粒的稳定性有关, 绝对值越大, 颗粒越稳定[36], 越容易抵抗聚集的发生, 且更有利于细胞的黏附[37], 相反, 较低的Zeta电位绝对值意味着颗粒之间的吸引力大于排斥力, 颗粒之间容易发生聚集[12]。本文中PEG辅助微波加热法制备的HA在溶剂中更加稳定, 其中牡蛎壳HA Zeta电位绝对值最大, 稳定性最好, 其他三种贝壳HA的Zeta电位绝对值虽然低于牡蛎壳HA, 但仍然维持在较高的水平。此外, 通过测试样品的接触角评估了样品的亲水性, 接触角越小, 样品的亲水性越强, 对于植入性的材料, 高亲水性有助于提高细胞在其表面的黏附性[14, 38], 本研究采用PEG辅助微波加热法制备的HA表现出完全的亲水性, 而反相微乳液法制备的HA中, 只有脉红螺壳HA表现出完全的亲水性。此外, 在所有HA样品中, 脉红螺壳HA的钙磷比(1.69)更加接近天然骨的钙磷比1.71[26, 39]。
4 结论本研究以化学试剂CaO、牡蛎壳、蛤蜊壳、扇贝壳和脉红螺壳为原料, 分别采用反相微乳液法和PEG辅助微波加热法制备了纳米HA。其中, 以反相微乳液法制备的HA形成了(104.10±1.95) nm~(207.90± 3.75) nm的近球形颗粒, PEG辅助微波加热法制备的HA则形成了(61.17±3.11) nm~(182.70±1.05) nm的椭圆以及棒状颗粒。PEG辅助微波加热法制备的HA尺寸更小, 比表面积更大, 稳定性好且具有完全的亲水性, 更适用于在医学材料领域的应用。此外, 四种贝壳均可以制备出接近化学计量值1.67的HA, 且产物相较于CaO制备的HA更倾向于维持纳米结构, 在两种制备方法中, 以脉红螺壳为原料制备的HA粒径始终维持在110 nm以下, 具完全的亲水性且Zeta电位绝对值始终维持较高水平, 钙磷比更接近天然骨, 在医用材料领域具有更大的应用优势。
| [1] |
DU M, CHEN J, LIU K, et al. Recent advances in biomedical engineering of nano-hydroxyapatite including dentistry, cancer treatment and bone repair[J]. Composites Part B: Engineering, 2021, 215: 108790. DOI:10.1016/j.compositesb.2021.108790 |
| [2] |
HUSSAIN S, SHAH Z A, SABIRUDDIN K, et al. Characterization and tribological behaviour of Indian clam seashell-derived hydroxyapatite coating applied on titanium alloy by plasma spray technique[J]. Journal of the Mechanical Behavior Biomedical Materials, 2023, 137: 105550. DOI:10.1016/j.jmbbm.2022.105550 |
| [3] |
HUANG H, DU M, CHEN J, et al. Preparation and characterization of abalone shells derived biological mesoporous hydroxyapatite microspheres for drug delivery[J]. Materials Science Engineering C Materials Biological Applications, 2020, 113: 110969. DOI:10.1016/j.msec.2020.110969 |
| [4] |
MA X, CHEN Y, QIAN J, et al. Controllable synthesis of spherical hydroxyapatite nanoparticles using inverse microemulsion method[J]. Materials Chemistry and Physics, 2016, 183: 220-229. DOI:10.1016/j.matchemphys.2016.08.021 |
| [5] |
SADAT-SHOJAI M, KHORASANI M T, DINPANAH-KHOSHDARGI E, et al. Synthesis methods for nanosized hydroxyapatite with diverse structures[J]. Acta Biomaterialia, 2013, 9(8): 7591-7621. DOI:10.1016/j.actbio.2013.04.012 |
| [6] |
HUSSAIN S, SABIRUDDIN K. Effect of heat treatment on the synthesis of hydroxyapatite from Indian clam seashell by hydrothermal method[J]. Ceramics International, 2021, 47(21): 29660-29669. DOI:10.1016/j.ceramint.2021.07.137 |
| [7] |
CHEN T Y, HUANG H C, CAO J L, et al. Preparation and characterization of alginate/HACC/oyster shell powder biocomposite scaffolds for potential bone tissue engineering applications[J]. RSC Advances, 2016, 6(42): 35577-35588. DOI:10.1039/C5RA26805B |
| [8] |
ŞAHIN Y M, GÜNDÜZ O, BULUT B, et al. Nano-bioceramic synthesis from tropical sea snail shells (Tiger Cowrie - Cypraea Tigris) with simple chemical treatment[J]. Acta Physica Polonica A, 2015, 127(4): 1055-1058. DOI:10.12693/APhysPolA.127.1055 |
| [9] |
KUMAR G S, GIRIJA E K, VENKATESH M, et al. One step method to synthesize flower-like hydroxyapatite architecture using mussel shell bio-waste as a calcium source[J]. Ceramics International, 2017, 43(3): 3457-3461. DOI:10.1016/j.ceramint.2016.11.163 |
| [10] |
RAMESH S, NATASHA A N, TAN C Y, et al. Characteristics and properties of hydoxyapatite derived by sol–gel and wet chemical precipitation methods[J]. Ceramics International, 2015, 41(9): 10434-10441. DOI:10.1016/j.ceramint.2015.04.105 |
| [11] |
WU S C, HSU H C, HSU S K, et al. Preparation and characterization of hydroxyapatite synthesized from oyster shell powders[J]. Advanced Powder Technology, 2017, 28(4): 1154-1158. DOI:10.1016/j.apt.2017.02.001 |
| [12] |
CHEN J, WEN Z, ZHONG S, et al. Synthesis of hydroxyapatite nanorods from abalone shells via hydrothermal solid-state conversion[J]. Materials & Design, 2015, 87: 445-449. |
| [13] |
CASTRO M A M, PORTELA T O, CORREA G S, et al. Synthesis of hydroxyapatite by hydrothermal and microwave irradiation methods from biogenic calcium source varying pH and synthesis time[J]. Boletín de la Sociedad Españ ola de Cerámica y Vidrio, 2022, 61(1): 35-41. DOI:10.1016/j.bsecv.2020.06.003 |
| [14] |
PAL A, NASKER P, PAUL S, et al. Strontium doped hydroxyapatite from Mercenaria clam shells: Synthesis, mechanical and bioactivity study[J]. Journal of Mechanical Behavior Biomedical Materials, 2019, 90: 328-336. DOI:10.1016/j.jmbbm.2018.10.027 |
| [15] |
ZULIANTONI Z, SUPRAPTO W, SETYARINI P H, et al. Extraction and characterization of snail shell waste hydroxyapatite[J]. Results in Engineering, 2022, 14: 100390. DOI:10.1016/j.rineng.2022.100390 |
| [16] |
KARUNAKARAN G, CHO E B, THIRUMURUGAN K, et al. Mesoporous Mn-doped hydroxyapatite nanorods obtained via pyridinium chloride enabled microwave-assisted synthesis by utilizing Donax variabilis seashells for implant applications[J]. Material Science Engineering C Material Biological Applications, 2021, 126: 112170. DOI:10.1016/j.msec.2021.112170 |
| [17] |
CHE Y, MIN S, WANG M, et al. Biological activity of hydroxyapatite/poly (methylmethacrylate) bone cement with different surface morphologies and modifications for induced osteogenesis[J]. Journal of Applied Polymer Science, 2019, 136(47): 48188. DOI:10.1002/app.48188 |
| [18] |
WIBISONO Y, PRATIWI A Y, OCTAVIANI C A, et al. Marine-derived biowaste conversion into bioceramic membrane materials: contrasting of hydroxyapatite synthesis methods[J]. Molecules, 2021, 26(21): 6344. DOI:10.3390/molecules26216344 |
| [19] |
PERMATASARI H A, SARI M, AMINATUN, et al. Nano-carbonated hydroxyapatite precipitation from abalone shell (Haliotisasinina) waste as the bioceramics candidate for bone tissue engineering[J]. Nanomaterials and Nanotechnology, 2021, 11: 18479804211032851.
|
| [20] |
LEMOS A F, ROCHA J H G, QUARESMA S S F, et al. Hydroxyapatite nano-powders produced hydrothermally from nacreous material[J]. Journal of the European Ceramic Society, 2006, 26(16): 3639-3646. DOI:10.1016/j.jeurceramsoc.2005.12.011 |
| [21] |
WANG H, YAN K, CHEN J. Preparation of hydroxyapatite microspheres by hydrothermal self-assembly of marine shell for effective adsorption of Congo Red[J]. Materials Letters, 2021, 304: 130573. DOI:10.1016/j.matlet.2021.130573 |
| [22] |
SURESH KUMAR C, DHANARAJ K, VIMALATHITHAN R M, et al. Hydroxyapatite for bone related applications derived from sea shell waste by simpleprecipitation method[J]. Journal of Asian Ceramic Societies, 2020, 8(2): 416-429. DOI:10.1080/21870764.2020.1749373 |
| [23] |
GRIGORAVICIUTE-PURONIENE I, ZARKOV A, TSURU K, et al. A novel synthetic approach for the calcium hydroxyapatite from the food products[J]. Journal of Sol-Gel Science and Technology, 2019, 91(1): 63-71. DOI:10.1007/s10971-019-05020-4 |
| [24] |
HEMBRICK-HOLLOMAN V, SAMUEL T, MOHAMMED Z, et al. Ecofriendly production of bioactive tissue engineering scaffolds derived from egg- and sea-shells[J]. Journal of Materials Research and Technology, 2020, 9(6): 13729-13739. DOI:10.1016/j.jmrt.2020.09.093 |
| [25] |
WANG H, XING H, YAN K, et al. Oyster shell derived hydroxyapatite microspheres as an effective adsorbent for remediation of Coomassie brilliant blue[J]. Advanced Powder Technology, 2022, 33(2): 103425. DOI:10.1016/j.apt.2022.103425 |
| [26] |
SARI M, HENING P, CHOTIMAH, et al. Porous structure of bioceramics carbonated hydroxyapatite-based honeycomb scaffold for bone tissue engineering[J]. Materials Today Communications, 2021, 26: 102135. DOI:10.1016/j.mtcomm.2021.102135 |
| [27] |
MOHD PU'AD N A S, KOSHY P, ABDULLAH H Z, et al. Syntheses of hydroxyapatite from natural sources[J]. Heliyon, 2019, 5(5): e01588. DOI:10.1016/j.heliyon.2019.e01588 |
| [28] |
DHANARAJ K, SURESH G. Conversion of waste sea shell (Anadara granosa) into valuable nanohydroxyapatite (nHAp) for biomedical applications[J]. Vacuum, 2018, 152: 222-230. DOI:10.1016/j.vacuum.2018.03.021 |
| [29] |
CAI Y, LIU Y, YAN W, et al. Role of hydroxyapatite nanoparticle size in bone cell proliferation[J]. Journal of Materials Chemistry, 2007, 17(36): 3780-3787. DOI:10.1039/b705129h |
| [30] |
BRICHA M, BELMAMOUNI Y, ESSASSI EL M, et al. Surfactant-assisted hydrothermal synthesis of hydroxyapatite nanopowders[J]. Journal of Nanoscience and Nanotechnology, 2012, 12(10): 8042-8049. DOI:10.1166/jnn.2012.6664 |
| [31] |
KLINKAEWNARONG J, UTARA S. Ultrasonic-assisted conversion of limestone into needle-like hydroxyapatite nanoparticles[J]. Ultrasonics Sonochemistry, 2018, 46: 18-25. DOI:10.1016/j.ultsonch.2018.04.002 |
| [32] |
WANG Z, JIANG S, ZHAO Y, et al. Synthesis and characterization of hydroxyapatite nano-rods from oyster shell with exogenous surfactants[J]. Material Science Engineering C Materials Biological Applications, 2019, 105: 110102. DOI:10.1016/j.msec.2019.110102 |
| [33] |
DHANARAJ K, SURESH KUMAR C, SOCRATES S H, et al. A comparative analysis of microwave assisted natural (Murex virgineus shell) and chemical nanohydroxyapatite: structural, morphological and biological studies[J]. Journal of the Australian Ceramic Society, 2020, 57(1): 173-183. |
| [34] |
SMITH I O, BAUMANN M J, MCCABE L R. Electrostatic interactions as a predictor for osteoblast attachment to biomaterials[J]. Journal of Biomedical Materials Research Part A, 2004, 70(3): 436-441. |
| [35] |
ZHONG S, WEN Z, CHEN J, et al. Effects for rapid conversion from abalone shell to hydroxyapaptite nanosheets by ionic surfactants[J]. Material Science Engineering C Materials Biological Applications, 2017, 77: 708-712. DOI:10.1016/j.msec.2017.04.009 |
| [36] |
LI Q, WEN Z, CHEN J, et al. Preparation of controllable hydroxyapaptite nanoparticles with abalone shells[J]. Materials Letters, 2019, 236: 562-565. DOI:10.1016/j.matlet.2018.11.021 |
| [37] |
MOCIOIU A M, TUTUIANU R, CURSARU L M, et al. 3D structures of hydroxyapatite obtained from Rapanavenosa shells using hydrothermal synthesis followed by 3D printing[J]. Journal of Materials Science, 2019, 54(22): 13901-13913. DOI:10.1007/s10853-019-03872-3 |
| [38] |
JAAFAR A, SCHIMPF C, MANDEL M, et al. Sol–gel derived hydroxyapatite coating on titanium implants: Optimization of sol–gel process and engineering the interface[J]. Journal of Materials Research, 2022, 37(16): 2558-2570. DOI:10.1557/s43578-022-00550-0 |
| [39] |
PERMATASARI H A, SARI M, AMINATUN, et al. Nano-carbonated hydroxyapatite precipitation from abalone shell (Haliotis asinina) waste as the bioceramics candidate for bone tissue engineering[J]. Nanomaterials and Nanotechnology, 2021, 11: 18479804211032851.
|
 2024, Vol. 48
2024, Vol. 48


