文章信息
- 董傲, 蔡春尔, 何培民. 2024.
- DONG Ao, CAI Chuner, HE Peimin. 2024.
- 海藻资源应用于聚羟基脂肪酸酯生产的研究进展
- Research progress of the application of seaweed in polyhydroxyalkanoate production
- 海洋科学, 48(3): 103-111
- Marine Sciences, 48(3): 103-111.
- http://dx.doi.org/10.11759/hykx20221004001
-
文章历史
- 收稿日期:2022-10-04
- 修回日期:2023-11-06
2. 上海河湖生物链构建与资源化利用工程技术研究中心, 上海 201702
2. Shanghai Engineering Research Center of River and Lake Biochain Construction and Resource Utilization, Shanghai 201702, China
近年来, 一次性塑料的需求量不断上升, 据统计2020年全国塑料制品年产量达到了76 032.2 kt[1], 过度使用塑料制品带来的白色污染逐年上升[2]。随着“限塑令”的不断深入, 研究人员逐渐将目光从不可降解塑料转至可降解塑料原料的开发领域, 如聚乳酸(PLA)、聚丁二酸丁二醇酯(PBS)和聚羟基脂肪酸酯(PHA)等[3]。
PHA是微生物代谢过程中产生的一种天然的高分子生物材料, 以颗粒形式储存在细胞质中, 具有良好的生物相容性、生物降解性和机械性能, 拥有约150种单体, 使得其可应用范围极其广泛, 既可作为生物医用材料, 又可作为生物可降解包装材料, 成为近年来生物材料领域最为活跃的研究热点之一[4-5]。其在现阶段的研究中, 既可通过化学方法合成, 也可通过微生物发酵的方法进行生物合成, 但生物方法更加容易制备出分子量较大的PHA, 因此是合成的首选方法[6]。目前的研究中, PHA的生产成本约为4~20美元/kg, 而传统的石化塑料如聚苯乙烯、聚丙烯和聚氯乙烯等的相关生产成本均低于2美元/kg。高昂的生产成本严重限制PHA的规模化生产, 使其多应用于高端材料行业, 而在生活塑料领域应用进展缓慢[7]。而对于微生物发酵生产的工业制品, 其成本主要取决于所选取的发酵原料价格, 据相关文献指出, PHA在生产过程中原料成本就占到了总生产成本的50%~60%, 因此, 为在今后的生产过程中能够降低PHA的生产成本, 使其大规模应用于生活塑料领域, 微生物发酵碳源的选取是进行PHA生产的研究热点[8]。但并不是所有的碳源都适合用来进行PHA生产, 要求所选取的碳源对环境没有影响, 并能够制备出分子量更大、更多种类的PHA共聚物, 才能够满足可持续发展的要求。
大型海藻及微藻由于其庞大的生物量, 且易于繁殖, 如可将其资源充分开发利用, 意义重大。2016年, 全球人工养殖海藻产量约3×107 t, 其中83%应用于食品行业, 其余用于肥料、营养剂等[9]。开发海藻应用于PHA生产, 既可解决PHA生产原料的问题, 又可充分利用海藻资源, 并为有害藻华的防治提供一个新途径。本文综述PHA近年来在生产工艺上发展的不足, 阐明微藻合成PHA及大型海藻作为PHA生产的碳源的可行性, 并为未来的发展方向做出了展望。
1 PHA发酵工艺研究现状PHA因其良好的性能而被人们广泛关注, 生产成本较高, 但在生物医药领域发展较快, 由于其卓越的性能, 人们希望将其应用于生物可降解塑料领域, 但由于其与传统的聚乳酸(PLA)等可降解材料相比, 生产成本高, 竞争力不强, 使得其向塑料制品发展的进度缓慢[10]。针对这一问题, 近年来PHA的研究主要集中在3个方面(图 1): 1)通过降低原料碳源的成本, 从而使得PHA的生产成本有所降低; 2)通过自然筛选、基因工程等手段获得高产菌株; 3)通过研究影响PHA产量的因素, 获得最佳生产条件及发酵工艺。
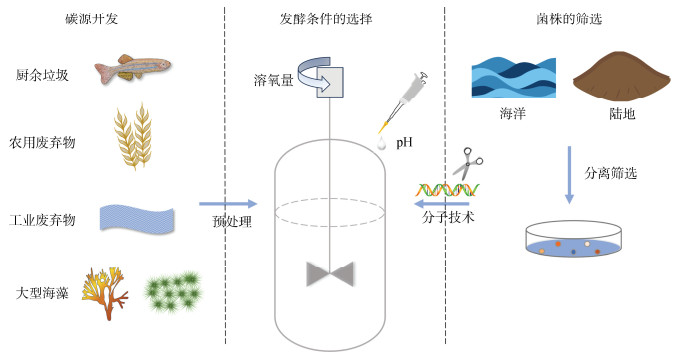 |
| 图 1 当前PHA生产的研究现状 Fig. 1 Current research status of PHA production |
当微生物处于胁迫条件下时, 往往会发生PHA的积累, 这种胁迫包括碳、氮、磷、氧气缺乏等不利条件, 而碳源作为PHA合成的先决条件, 往往显得至关重要[11]。在工业生产中, 大多通过寻找廉价的碳源, 如食品加工、日常生活、农业生产等产生的废弃物, 从而达到降低成本的目的, 并且对这些碳源的利用, 可以减少环境问题, 达到资源再利用的目的。目前针对这一问题, 研究人员探究了各种废弃物作为碳源的可能性。如Zhang等[12]通过研究食物垃圾发酵液, 发现其中主要成分为乳酸盐和挥发性脂肪酸, 于是探究了混合碳源对PHA产量的影响, 并以此提高了脱氮效率, 从而避免了氮污染; Lee等[13]利用PLA生产过程中的废乳酸为碳源, 并通过分离出的芽孢杆菌生产聚羟基丁酸脂(polyhydroxybutyrate, PHB, PHA的一种, 是最早发现并研究的一类PHA), 由于其高盐的培养基, 使得操作过程中无需严格的无菌环境, 从而大大降低了成本; Cai等[14]利用经乙醇提取过叶绿素的蚕沙, 并添加少量葡萄糖, 大大提高了PHA的产量, 同时证明了废蚕沙的可利用性; Mahari等[15]利用医用塑料废物及废煎炸油为原料制成了液态油产品, 并以此发酵芽孢杆菌, 最终获得11%的PHB。除此之外, 还可以利用稻草秸秆[16]、水果废料[17]和糖蜜[18]等作为碳源, 从而进行PHA的生产, 达到废物再利用和降低成本的目的。
尽管有大量的废弃物可作为PHA生产的碳源, 但在作为细菌培养基的过程中都需要进行复杂的酸或碱预处理过程, 即将大分子物质尽可能地转化为可为微生物利用的小分子物质, 如脂肪酸、单糖等[19]。但并不是所有的废弃物碳源都可作为生物塑料PHA的合成原料, 原料的特殊性往往会导致产生的PHA及其副产物对环境造成不可估量的影响, 同时富含的杂质, 也使得提取分离较为困难, 大大增加了下游生产成本[20]。因此寻找更合适的碳源, 降低杂质的含量, 降低生产成本, 进行PHA的生产是必要的。
1.2 菌株的筛选合适的菌株, 对PHA生产具有决定性的作用。在近年来的研究中, 生产PHA的菌种培养方式分为纯培养和混培养两种方式, 而混培养是由Chakravarty在2010年第一次尝试的[21]。相对于纯培养来说, 混合培养具有成本低, 无须严格灭菌环境, 废物利用率高等特点, 但其还有一个严重的问题, 即生产PHA的效率较低[22-23]。目前, 从不同的生态环境中共筛选到75个不同属的微生物用于PHA的生产, 而其中, 真养产碱杆菌(Alcaligenes eutrophus)、假单胞菌属(Pseudomonas)、甲基营养菌属(Methylotrophs)、固氮菌属(Azotobacter)等由于其良好的发酵性能, 而被广泛研究, 并应用于纯培养[24]。而极端酸性嗜盐菌, 在近年来成为良好的PHA生产菌株, 由于耐高温、盐、pH等特点, 使得生产过程中无需灭菌, 即可获得较高产量的PHA; 且由于天然的盐度胁迫, 导致在发酵过程中无须设置其他的营养限制, 即可获得一定产量的PHA, 操作较为简单, 因而在未来的研究中, 海洋细菌可能成为生产PHA的研究热点[10, 25]。这也表明了海洋资源应用于生产PHA的可能性逐渐上升。
随着近年来分子生物学技术的发展, 一些研究人员利用基因工程等技术手段, 构建重组菌, 从而提高PHA的生产效率。如Wu等[26]以蔗糖为唯一碳源, 通过分子技术手段, 构建出了重组大肠杆菌, 使得PHB的产率提高了80%; Povolo等[27]利用基因工程的手段, 将一种不能以乳糖为碳源的假单胞菌进行改造, 使其可以在含有乳糖的废弃物中生产PHA, 并提高了产率。
1.3 PHA发酵条件的影响因素微生物发酵水平既取决于所选菌株自身的性能, 又受人为提供的环境因子水平的影响, 因此进行微生物发酵的前提, 是需要掌握微生物菌株生产PHA所需的生长条件, 如培养基的组成成分、pH值和溶氧量(dissolved oxygen, DO)等。为满足工业化需求, 在生产中会进一步优化, 研究人员往往通过响应面法(response surface methodology, RSM)来进行实验数据处理, 从而进一步优化实验条件[28]。表 1列举了研究人员针对不同微生物探究最佳的发酵条件, 从而提高产量。
| 影响因素 | 研究内容 | 参考文献 |
| 培养基组成 | 研究了培养基中铵盐对PHB生产的影响 | [29] |
| 研究菌株在培养基中缺氮条件下, PHA的积累情况 | [30] | |
| pH | 优化菌株的碳源及pH, 使巨大芽孢杆菌(Bacillus megaterium)的生产PHA的能力, 达到之前的两倍 | [31] |
| 分析某些微生物在中性条件下, 比在酸性和碱性条件生产PHA能力更强的原因 | [32] | |
| 真氧产碱杆菌在中性环境、弱酸和弱碱环境下生产能力的比较 | [33] | |
| Paraburkholderia sacchari以麦草秸秆水解液为碳源培养时, pH保持不变, 才能达到最大产量 | [34] | |
| 研究不控制发酵液pH时, PHA的产量积累 | [35] | |
| 研究PHA单体组成与pH的变化之间的关系 | [36] | |
| 溶解氧 | 研究了限制溶解氧量对菌株生产PHB的影响 | [37] |
| 通过调节搅拌速度和通气速率保持溶解氧含量不变, 从而提高PHA的生产 | [34, 38-39] | |
| 研究表明氧限制可能能够提高PHA的积累量 | [40] |
一些PHA可直接在微藻中积累, 是一种常见的积累形式, 因而可通过改变提取方法, 从而直接获得。Tanweer等[41]通过蓝藻Synechocystis PCC6803应用于PHA的生产。微藻产PHA的缺点在于多数只能获得PHB, 而其他结构较少, 且PHB相对于其他PHA家族, 性能较差, 且多为复合物, 因此微藻不适合用于PHA的规模化生产[42]。Hong等[43]利用尼罗红染液和荧光显微镜技术, 对20种蓝藻进行了分析, 结果发现其中6种, 具有荧光染色颗粒, 通过基于PHA合成酶构建系统发育树, 分析亲缘关系, 有助于筛查可合成PHA的蓝藻。由于微藻生产PHA的产量相较于异养细菌较低, 且纯培养导致微藻培养需在严格无菌的环境, 同时提供的碳源也是无菌的, 这就导致微藻生产PHA从经济上的不可行性, 因而需要开发混合微生物培养模式进行PHA的生产[44]。2013年, Fradinho等[45]通过混合微生物培养形式, 首次研究了微藻加细菌的方式, 微藻通过光合作用产生氧气, 细菌经历缺氧, 氧气充足的环境, 从而积累PHA, 这种模式通过光照控制PHA的积累, 为调控其积累过程提供了新的方法。在Phalanisong等[44]的研究中, 不仅通过混合微生物生产PHA, 通过光照控制PHA的生产, 同时通过对氮源和磷酸盐的限制, 使PHA的积累量达到了11.38%和10.24%, 进一步说明营养限制在微藻的混合培养模式下促进PHA的积累。但由于PHA为胞内产物, 通过微藻获得的PHA, 存在着微藻细胞壁难以去除等问题, 使得提取成本相对于细菌的提取成本较高, 因而往往不适用于大规模的工业化生产。
2.1.2 以大型海藻为原料生产PHA大型海藻指的是一群肉眼能看见的, 绝大多数是多细胞的丝状体、膜状体、管状体或叶状体植物。基于光合色素的不同, 可将大型海藻分为褐藻、红藻及绿藻三种类型[46-47]。用于生产时, 虽然相对于传统的农作物资源来说, 木质素含量较少或者没有, 预处理的形式相对简单, 但其难点在于将多糖或者其他碳水化合物转化为可利用的小分子, 由于化学方法低成本, 却高污染, 而酶方法能够产生较多的糖产量, 但价格较高, 研究人员往往采用化学和酶法的组合进行处理[48-49]。
通过褐藻生产PHA的研究中, 由于其所含的杂质较多, 往往需经过复杂的预处理过程, 使得产生的经济效益不高。研究多集中于将褐藻中的主要成分海藻酸盐提出, 加入到培养基中, 以增加PHB的产量[50-51]。Azizi等[52]也通过以马尾藻为原料, 利用Cupriavidusr necator PTCC 1615生产PHB, 通过酸和酶的组合方法水解、糖化马尾藻, 获得单糖, 用于发酵实验。但较高的预处理成本和较低的产量, 使得对其研究往往集中于其他领域[53]。
对于红藻的资源化利用, 多为利用红藻中的多糖, 通过添加增塑剂, 进而制成生物塑料, 以代替传统的化石塑料, 可操作性强, 同时成本较低[54-55]。但此种方法产生的生物塑料, 从自身的性能到可应用的范围都无法与由PHA制成的生物塑料相比较。因此也有人尝试使用红藻作为碳源, 通过简单的酸处理生产PHA, 结果也是可行的[56]。Sawant等[57]通过将降解多糖的海洋细菌与芽孢杆菌混合培养, 生产出了PHB, 但产量较低, 显示了红藻在PHA生产上的可利用性, 但仍需进一步研究及开发。
绿潮是广泛发生在中国沿海地区的一种藻华现象, 严重危害了海洋生态环境, 对近海旅游业、水产养殖业和生态系统造成了不可估量的损失[58]。大量的海上调查和实验室研究工作表明绿潮的形成是由于大型藻类的漂流、积累和过度繁殖导致的, 而其中最具代表性的大型藻类是浒苔属[59]。2020年尚伟涛等基于遥感技术, 对搁浅的黄海浒苔绿潮进行估测, 总生物量达到7 247 t[60]。绿潮爆发形成的庞大生物量直接冲击沿海的生态环境、养殖和旅游等产业, 而资源化利用是浒苔防治的重要方面, 可达到一举多得的效果, 并与碳汇相关联[61]。但近年来针对浒苔资源化利用的方向少有创新, 目前主要集中在食品[62]、化妆品[63]、饲料[64]、肥料[65]、药品[66]及能源[67-69]等方面, 范围虽较广, 但在很多方面仍然处于初步阶段, 能实现规模化、工业化生产的主要集中在海藻肥和海藻饲料[70]。生物量的利用效率和利用质量对于整个黄海绿潮来说仍显不足, 有很大上升空间。而浒苔作为天然的高蛋白、高纤维和低脂肪的海藻, 含有丰富的多糖(42.1%~55.69%)和纤维素(4.1%~10.2%), 且明显高于同类海藻[61]。利用浒苔作为PHA生产的原料, 既可解决黄海绿潮的资源利用问题, 具有生态效益, 同时能够增加开发产品的价值, 是今后研究的重点方向[71]。Gnaim等[10]利用海水培养基和尼罗蓝染液, 分离出100多种海洋细菌, 通过对不同碳源的添加, 筛选出了最优菌株, 并通过混合培养, 利用浒苔水解液, 同时分析产生的PHA的结构及含量, 表明产生的PHA性能较好, 为PHB及3-羟基丁酸酯和3-羟基戊酸酯的共聚物(poly-3-hydroxybutyrate-co-3-hydroxy valerate, PHBV)的混合物。Ghosh等[72]通过利用超临界亚水解的方法, 处理浒苔, 用于发酵PHA, 并通过经济盈亏分析及温室气体分析, 表明通过获得副产物生物炭, 能够达到发挥经济效益的目的, 同时表明浒苔是利用Haloferax mediterranei生产PHA最有前景的原料。此外, Steinbruch等[8]通过将绿潮生物量直接水热处理, 从而利用水解液发酵生产PHA, 与将绿潮生物量进行纤维素和淀粉的分离, 进而生产多糖和生物炭进行比较, 经济盈亏分析的结果表明, 直接将绿潮水解液用于PHA生产的方式, 在价格合理的前提下更加可行。因而通过绿藻进行PHA的方案, 具有一定的可行性, 但仅仅依靠PHA的生产往往成本会偏高, 后续需要研究相应附加值较高的副产物, 从而能够达到经济效益的目的。
2.2 海藻作为PHA生产原料的优劣通过可再生资源合成PHA, 来源广泛, 如农用作物废料、工业废料、厨余垃圾及藻类聚合物[73]。农用作物废料存在纤维素、半纤维素及木质素结构较多, 导致在实际生产过程中需要很高的成本去降解这些成分[74-75]; 而工业废料和厨余垃圾往往在实践过程中, 存在着二次污染等相关环境问题。海藻生长速度快, 木质素含量较低, 易于开发, 且不干扰农业生产, 因此研究人员选择了海藻生物质资源作为PHA生产原料[76]。海藻作为生产PHA的原料具有以下特点: (1)无需土地种植, 即可获得, 大大降低了对土地面积的依赖性; (2)藻类生长仅需要非常低的营养补充, 而农作物需要大量的氮肥、磷肥等使用, 可能破坏生态环境; (3)不会与传统的生物塑料制备的原料相竞争, 保持了自己的独立性[77-78]。
同时藻类作为碳源, 也有其一定的缺陷。藻类多糖含量较高, 且所含的成分有所不同, 一种微生物往往不能全部利用, 因而在后续的实验中, 需根据不同的多糖成分, 筛选不同的微生物进行发酵生产, 进而进行后续实验, 同时不同的藻类所含的碳水化合物的总量不同, 因而需调配合适的碳水化合物组成, 从而充分有效的利用其碳源[79-82], 这是后续实验的一大难点。这也与之前藻类简单地作为肥料、饲料等资源化利用的方面相一致, 不至于造成资源的浪费。
3 展望通过海藻资源生产PHA, 具有一定的可行性, 不少研究人员都做过相应的探索。其中微藻始终存在着工艺成本过高, 产生的PHA质量较差等特点, 因而暂时还需要在实验室阶段进行不断的探索新工艺。
而大型海藻作为碳源, 生产PHA, 通过算法分析, 已经能够达到产生经济效益的目的, 但仍缺乏实际应用的例子, 但这也充分预示着未来将大型海藻, 尤其是绿潮暴发种浒苔应用于PHA的生产, 具有较高的前景。未来还需不断探索相关副产物的开发, 以期获得更高的经济价值, 同时相关菌株的改造也是必要的, 通过筛选微生物, 对海藻多糖、纤维素进行分解利用, 以求在PHA的质量和产量上, 能够得到进一步的突破。
| [1] |
PARASHAR N, HAIT S. Plastics in the time of COVID-19 pandemic: Protector or polluter?[J]. Science of the Total Environment, 2021, 759: 144274. DOI:10.1016/j.scitotenv.2020.144274 |
| [2] |
DE-LA-TORRE G E, ARAGAW T A. What we need to know about PPE associated with the COVID-19 pandemic in the marine environment[J]. Marine Pollution Bulletin, 2021, 163: 111879. DOI:10.1016/j.marpolbul.2020.111879 |
| [3] |
姚建, 苟敏, 汤岳琴. "绿色塑料"聚羟基脂肪酸酯生物合成研究进展[J]. 应用与环境生物工程, 2021, 27(6): 1662-1667. YAO Jian, GOU Min, TANG Yueqin. Research progress on biosynthesis of "green plastics": polyhydroxyalkanoates[J]. Chinese Journal of Applied and Environmental Biology, 2021, 27(6): 1662-1667. |
| [4] |
KOLLER M, RODRIGUEZ-CONTRERAS A. Techniques for tracing PHA-producing organisms and for qualitative and quantitative analysis of intra- and extracellular PHA[J]. Engineering in Life Sciences, 2015, 15(6): 558-581. DOI:10.1002/elsc.201400228 |
| [5] |
MONTANO-HERRERA L, LAYCOCK B, WERKER A, et al. The evolution of polymer composition during PHA accumulation: The significance of reducing equivalents[J]. Bioengineering (Basel), 2017, 4(1): 20. |
| [6] |
CHEN G Q. Plastics completely synthesized by bacteria: Polyhydroxyalkanoates[J]. Springer Berlin Heidelberg, 2010, 14: 17-37. |
| [7] |
TAN G Y A, CHEN C L, LI L. Start a research on biopolymer polyhydroxyalkanoate (PHA): A review[J]. Polymers, 2014, 6(3): 706-754. DOI:10.3390/polym6030706 |
| [8] |
STEINBRUCH E, DRABIK D, EPSTEIN M, et al. Hydrothermal processing of a green seaweed Ulva sp. for the production of monosaccharides, polyhydroxyalkanoates, and hydrochar[J]. Bioresource Technology, 2020, 318: 124263. DOI:10.1016/j.biortech.2020.124263 |
| [9] |
FERDOUSE F, HOLDT S L, SMITH R. The global status of seaweed production, trade and utilization[J]. Globefish Research Programme, 2018, 124: 1. |
| [10] |
GNAIM R, POLIKOVSKY M, UNIS R, et al. Marine bacteria associated with the green seaweed Ulva sp. for the production of polyhydroxyalkanoates[J]. Bioresource Technology, 2021, 328: 124815. DOI:10.1016/j.biortech.2021.124815 |
| [11] |
BEHERA S, PRIYADARSHANEE M, VANDANA, et al. Polyhydroxyalkanoates, the bioplastics of microbial origin: Properties, biochemical synthesis, and their applications[J]. Chemosphere, 2022, 294: 133723. DOI:10.1016/j.chemosphere.2022.133723 |
| [12] |
ZHANG M, WANG X, YANG J, et al. Nitrogen removal performance of high ammonium and high salt wastewater by adding carbon source from food waste fermentation with different acidogenic metabolic pathways[J]. Chemosphere, 2022, 292: 133512. DOI:10.1016/j.chemosphere.2022.133512 |
| [13] |
LEE H J, KIM S G, CHO D H, et al. Finding of novel lactate utilizing Bacillus sp. YHY22 and its evaluation for polyhydroxybutyrate (PHB) production[J]. International Journal of Biological Macromolecules, 2022, 201: 653-661. DOI:10.1016/j.ijbiomac.2022.01.025 |
| [14] |
CAI S, WU Y, LI Y, et al. Production of polyhydroxyalkanoates in unsterilized hyper-saline medium by Halophiles using waste silkworm excrement as carbon source[J]. Molecules, 2021, 26(23): 7122. DOI:10.3390/molecules26237122 |
| [15] |
MAHARI W A W, KEE S H, FOONG S Y, et al. Generating alternative fuel and bioplastics from medical plastic waste and waste frying oil using microwave co-pyrolysis combined with microbial fermentation[J]. Renewable and Sustainable Energy Reviews, 2022, 153: 111790. DOI:10.1016/j.rser.2021.111790 |
| [16] |
THUOC D V, CHUNG N T, HATTI-KAUL R. Polyhydroxyalkanoate production from rice straw hydrolysate obtained by alkaline pretreatment and enzymatic hydrolysis using Bacillus strains isolated from decomposing straw[J]. Bioresources and Bioprocessing, 2021, 8(1): 1-11. DOI:10.1186/s40643-020-00357-z |
| [17] |
SILVA F, MATOS M, PEREIRA B, et al. An integrated process for mixed culture production of 3-hydroxyhexanoate-rich polyhydroxyalkanoates from fruit waste[J]. Chemical Engineering Journal, 2022, 427: 131908. DOI:10.1016/j.cej.2021.131908 |
| [18] |
TYAGI B, TAKKAR S, MEENA R, et al. Production of polyhydroxybutyrate (PHB) by Parapedobacter sp. ISTM3 isolated from mawsmai cave utilizing molasses as carbon source[J]. Environmental Technology & Innovation, 2021, 24: 101854. |
| [19] |
CHANDRA R, IQBAL H M N, VISHAL G, et al. Algal biorefinery: A sustainable approach to valorize algal-based biomass towards multiple product recovery[J]. Bioresource Technology, 2019, 278: 346-359. |
| [20] |
VEA E B, FABBRI S, SPIERLING S, et al. Inclusion of multiple climate tipping as a new impact category in life cycle assessment of polyhydroxyalkanoate (PHA)-based plastics[J]. Science of the Total Environment, 2021, 788: 147544. DOI:10.1016/j.scitotenv.2021.147544 |
| [21] |
CHAKRAVARTY P, MHAISALKAR V, CHAKRABARTI T. Study on poly-hydroxyalkanoate (PHA) production in pilot scale continuous mode wastewater treatment system[J]. Bioresource Technology, 2010, 101(8): 2896-2899. DOI:10.1016/j.biortech.2009.11.097 |
| [22] |
LI D, YAN X, LI Y, et al. Achieving polyhydroxyalkanoate production from rubber wood waste using mixed microbial cultures and anaerobic-aerobic feeding regime[J]. International Journal of Biological Macromolecules, 2022, 199: 162-171. DOI:10.1016/j.ijbiomac.2021.12.132 |
| [23] |
MATOS M, CRUZ R A P, CARDOSO P, et al. Sludge retention time impacts on polyhydroxyalkanoate productivity in uncoupled storage/growth processes[J]. Science of the Total Environment, 2021, 799: 149363. DOI:10.1016/j.scitotenv.2021.149363 |
| [24] |
项兰, 翁庆北, 周桂雄. 利用廉价碳源发酵生产聚羟基脂肪酸酯(PHAs)的研究进展[J]. 现代化工, 2022, 42(3): 64-68, 73. XIANG Lan, WENG Qingbei, ZHOU Guixiong. Research progress in production of polyhydroxyalkanoates by fermentation of low-cost carbon sources[J]. Modern Chemical Industry, 2022, 42(3): 64-68, 73. |
| [25] |
PALMEIRO-SANCHEZ T, O'FLAHERTY V, LENS P N L. Polyhydroxyalkanoate bio-production and its rise as biomaterial of the future[J]. Journal of Biotechnology, 2022, 348: 10-25. DOI:10.1016/j.jbiotec.2022.03.001 |
| [26] |
WU F, ZHOU Y, PEI W, et al. Biosynthesis of poly-(3-hydroxybutyrate) under the control of an anaerobically induced promoter by recombinant escherichia coli from sucrose[J]. Molecules, 2022, 27(1): 294. DOI:10.3390/molecules27010294 |
| [27] |
POVOLO S, TOFFANO P, BASAGLIA M, et al. Polyhydroxyalkanoates production by engineered Cupriavidus necator from waste material containing lactose[J]. Bioresource Technology, 2010, 101(20): 7902-7907. DOI:10.1016/j.biortech.2010.05.029 |
| [28] |
DUBEY S, MISHRA S. Natural sea salt based polyhydroxyalkanoate production by wild Halomonas hydrothermalis strain[J]. Fuel, 2022, 311: 122593. DOI:10.1016/j.fuel.2021.122593 |
| [29] |
JOHNSON K, KLEEREBEZEM R, VAN LOOSDRECHT M C. Influence of ammonium on the accumulation of polyhydroxybutyrate (PHB) in aerobic open mixed cultures[J]. Journal of Biotechnology, 2010, 147(2): 73-79. DOI:10.1016/j.jbiotec.2010.02.003 |
| [30] |
ILLMAN S. Hilbert's fifth problem: Review[J]. Journal of Mathematical Sciences, 2001, 105(2): 1843-1847. DOI:10.1023/A:1011323915468 |
| [31] |
KUMAR M, GUPTA A, THAKUR I S. Carbon dioxide sequestration by Chemolithotrophic oleaginous bacteria for production and optimization of polyhydroxyalkanoate[J]. Bioresource Technology, 2016, 213: 249-256. DOI:10.1016/j.biortech.2016.02.038 |
| [32] |
AMULYA K, REDDY M V, ROHIT M V, et al. Wastewater as renewable feedstock for bioplastics production: Understanding the role of reactor microenvironment and system PHA[J]. Journal of Cleaner Production, 2016, 112: 4618-4627. DOI:10.1016/j.jclepro.2015.08.009 |
| [33] |
LEE W H, LOO C Y, NOMURA C T, et al. Biosynthesis of polyhydroxyalkanoate copolymers from mixtures of plant oils and 3-hydroxyvalerate precursors[J]. Bioresource Technology, 2008, 99(15): 6844-6851. DOI:10.1016/j.biortech.2008.01.051 |
| [34] |
CESÁRIO M T, RAPOSO R S, DE ALMEIDA M C, et al. Enhanced bioproduction of poly-3-hydroxybutyrate from wheat straw lignocellulosic hydrolysates[J]. New Biotechnology, 2014, 31(1): 104-113. DOI:10.1016/j.nbt.2013.10.004 |
| [35] |
MONTIEL-JARILLO G, CARRERA J, SUÁREZ-OJEDA M E. Enrichment of a mixed microbial culture for polyhydroxyalkanoates production: Effect of pH and N and P concentrations[J]. Science of the Total Environment, 2017, 583: 300-307. DOI:10.1016/j.scitotenv.2017.01.069 |
| [36] |
GOUVEIA A R, FREITAS E B, GALINHA C F, et al. Dynamic change of pH in acidogenic fermentation of cheese whey towards polyhydroxyalkanoates production: Impact on performance and microbial population[J]. New Biotechnology, 2017, 37: 108-116. DOI:10.1016/j.nbt.2016.07.001 |
| [37] |
NATH A, DIXIT M, BANDIYA A, et al. Enhanced PHB production and scale up studies using cheese whey in fed batch culture of Methylobacterium sp. ZP24[J]. Bioresource Technology, 2008, 99(13): 5749-5755. DOI:10.1016/j.biortech.2007.10.017 |
| [38] |
HERMANN-KRAUSS C, KOLLER M, MUHR A, et al. Archaeal production of polyhydroxyalkanoate (PHA) co- and terpolyesters from biodiesel industry-derived by-products[J]. Archaea, 2013, 2013: 129268. |
| [39] |
KACHRIMANIDOU V, KOPSAHELIS N, VLYSIDIS A, et al. Downstream separation of poly(hydroxyalkanoates) using crude enzyme consortia produced via solid state fermentation integrated in a biorefinery concept[J]. Food and Bioproducts Processing, 2016, 100: 323-334. DOI:10.1016/j.fbp.2016.08.002 |
| [40] |
KIM B S. Production of poly(3-hydroxybutyrate) from inexpensive substrates[J]. Enzyme and Microbial Technology, 2000, 27(10): 774-777. DOI:10.1016/S0141-0229(00)00299-4 |
| [41] |
TANWEER S, PANDA B. Prospect of Synechocystis sp. PCC 6803 for synthesis of poly(3-hydroxybutyrate-co-4-hydroxybutyrate)[J]. Algal Research, 2020, 50: 101994. DOI:10.1016/j.algal.2020.101994 |
| [42] |
FERRE-GUELL A, WINTERBURN J. Biosynthesis and characterization of polyhydroxyalkanoates with controlled composition and microstructure[J]. Biomacromolecules, 2018, 19(3): 996-1005. DOI:10.1021/acs.biomac.7b01788 |
| [43] |
HONG K, BELD J, DAVIS T D, et al. Screening and characterization of polyhydroxyalkanoate granules, and phylogenetic analysis of polyhydroxyalkanoate synthase gene phaC in cyanobacteria[J]. Journal of Phycology, 2021, 57(3): 754-765. DOI:10.1111/jpy.13123 |
| [44] |
PHALANISONG P, PLANGKLANG P, REUNGSANG A. Photoautotrophic and mixotrophic cultivation of polyhydroxyalkanoate-accumulating microalgae consortia selected under nitrogen and phosphate limitation[J]. Molecules, 2021, 26(24): 7613. DOI:10.3390/molecules26247613 |
| [45] |
FRADINHO J C, DOMINGOS J M, CARVALHO G, et al. Polyhydroxyalkanoates production by a mixed photosynthetic consortium of bacteria and algae[J]. Bioresource Technology, 2013, 132: 146-153. DOI:10.1016/j.biortech.2013.01.050 |
| [46] |
LEE J, LI P, LEE J, et al. Ethanol production from Saccharina japonica using an optimized extremely low acid pretreatment followed by simultaneous saccharification and fermentation[J]. Bioresource Technology, 2013, 127: 119-125. DOI:10.1016/j.biortech.2012.09.122 |
| [47] |
YAZDANI P, ZAMANI A, KARIMI K, et al. Characterization of Nizimuddinia zanardini macroalgae biomass composition and its potential for biofuel production[J]. Bioresource Technology, 2015, 176: 196-202. DOI:10.1016/j.biortech.2014.10.141 |
| [48] |
ABD-RAHIM F, WASOH H, ZAKARIA M R, et al. Production of high yield sugars from Kappaphycus alvarezii using combined methods of chemical and enzymatic hydrolysis[J]. Food Hydrocolloids, 2014, 42(SI): 309-315. |
| [49] |
KIM S W, HONG C H, JEON S W, et al. High-yield production of biosugars from Gracilaria verrucosa by acid and enzymatic hydrolysis processes[J]. Bioresource Technology, 2015, 196: 634-641. DOI:10.1016/j.biortech.2015.08.016 |
| [50] |
JEONG D W, HYEON J E, LEE M E, et al. Efficient utilization of brown algae for the production of polyhydroxybutyrate (PHB) by using an enzyme complex immobilized on Ralstonia eutropha[J]. International Journal of Biological Macromolecules, 2021, 189: 819-825. DOI:10.1016/j.ijbiomac.2021.08.149 |
| [51] |
MORIYA H, TAKITA Y, MATSUMOTO A, et al. Cobetia sp. Bacteria, which are capable of utilizing alginate or waste laminaria sp. for poly(3-hydroxybutyrate) synthesis, isolated from a marine environment[J]. Front Bioeng Biotechnol, 2020, 8: 974. DOI:10.3389/fbioe.2020.00974 |
| [52] |
AZIZI N, NAJAFPOUR G, YOUNESI H. Acid pretreatment and enzymatic saccharification of brown seaweed for polyhydroxybutyrate (PHB) production using Cupriavidus necator[J]. International Journal of Biological Macromolecules, 2017, 101: 1029-1040. |
| [53] |
ROSSIGNOLO J A, DURAN A J F P, BUENO C, et al. Algae application in civil construction: A review with focus on the potential uses of the Pelagic sargassum spp. Biomass[J]. Journal of Environmental Management, 2022, 303: 114258. |
| [54] |
ASIF M, TABASSUM A, ALI T M, et al. Preparation and estimation of physio-mechanical properties of eco-friendly bioplastics of Gracilaria corticata from karachi coast[J]. Pakistan Journal of Botany, 2021, 53(4): 1525-1529. |
| [55] |
SUDHAKAR M P, MAGESH PETER D, DHARANI G. Studies on the development and characterization of bioplastic film from the red seaweed (Kappaphycus alvarezii)[J]. Environmental Science and Pollution Research, 2021, 28(26): 33899-33913. |
| [56] |
ALKOTAINI B, KOO H, KIM B S. Production of polyhydroxyalkanoates by batch and fed-batch cultivations of Bacillus megaterium from acid-treated red algae[J]. Korean Journal of Chemical Engineering, 2016, 33(5): 1669-1673. DOI:10.1007/s11814-015-0293-6 |
| [57] |
SAWANT S S, SALUNKE B K, KIM B S. Consolidated bioprocessing for production of polyhydroxyalkanotes from red algae Gelidium amansii[J]. International Journal of Biological Macromolecules, 2018, 109: 1012-1018. DOI:10.1016/j.ijbiomac.2017.11.084 |
| [58] |
蒋雪蕾, 周晓见, 林佳宁, 等. 黄海浒苔绿潮生态效应研究进展[J]. 海洋环境科学, 2021, 40(4): 647-652. JIANG Xuelei, ZHOU Xiaojian, LIN Jianing, et al. Research progress in the ecological consequences of Ulva prolifera green tides in the Yellow Sea[J]. Marine Environmental Science, 2021, 40(4): 647-652. |
| [59] |
BLOMSTER J, BACK S, FEWER D P, et al. Novel morphology in enteromorpha (Ulvophyceae) forming green tides[J]. American Journal of Botany, 2002, 89(11): 1756-1763. DOI:10.3732/ajb.89.11.1756 |
| [60] |
尚伟涛, 高志强, 姜晓鹏, 等. 基于无人机遥感的黄海绿潮搁浅生物量估算[J]. 海洋科学, 2021, 45(10): 11-19. SHANG Weitao, GAO Zhiqiang, JIANG Xiaopeng, et al. Estimation of green tide stranded biomass in the Yellow Sea based on unmanned aerial vehicle remote sensing[J]. Marine Sciences, 2021, 45(10): 11-19. |
| [61] |
周伟, 邓银银, 田翠翠, 等. 大型绿藻浒苔的产业化开发应用[J]. 广西科学, 2021, 28(2): 113-118. ZHOU Wei, DENG Yinyin, TIAN Cuicui, et al. Industrial develpoment and application of large green algae Enteromorpha prolifera[J]. Guangxi Sciences, 2021, 28(2): 113-118. |
| [62] |
宁劲松, 翟毓秀, 赵艳芳, 等. 青岛近海浒苔的营养分析与食用安全性评价[J]. 食品科技, 2009, 34(8): 74-75, 79. NING Jinsong, ZHAI Yuxiu, ZHAO Yanfang, et al. Nutrition analysis and food safety evaluation of Enteromorpha from Qingdao coast[J]. Food Science and Technology, 2009, 34(8): 74-75, 79. |
| [63] |
郭子叶, 蔡春尔, 耿中雷, 等. 浒苔粗多糖化妆品开发潜力研究[J]. 中国海洋药物, 2014, 33(2): 57-62. GUO Ziye, CAI Chuner, GENG Zhonglei, etc. Study on potential use of crude polysaccharides from Ulva prolifera in cosmetic[J]. Chinese Journal of Marine Drugs, 2014, 33(2): 57-62. |
| [64] |
张文立, 李晓庆, 乔丹, 等. 肉仔鸡浒苔代谢能及氨基酸利用率的测定[J]. 中国饲料, 2015(4): 21-23, 27. ZHANG Wenli, LI Xiaoqin, QIAO Dan, et al. Determination of metabolizable energy and amino acid availability of Enteromorpha in broilers[J]. China Feed, 2015(4): 21-23, 27. |
| [65] |
李秀珍, 宋海妹, 单俊伟, 等. 浒苔海藻肥在白菜上的增产效果研究[J]. 现代农业科技, 2011(20): 292, 295. LI Xiuzhen, SONG Haimei, SHAN Junwei, et al. Study on yield-increasing effect of Enteromorpha prolifera seaweed fertilizer on cabbage[J]. Modern Agricultural Science and Technology, 2011(20): 292, 295. |
| [66] |
孙文, 张国琛, 李秀辰, 等. 浒苔资源利用的研究进展及应用前景[J]. 水产科学, 2011, 30(9): 588-590. SUN Wen, ZHANG Guochen, LI Xiuchen, et al. Potential utilization of Enteromorpha prolifera as biotic marine resources[J]. Fisheries Science, 2011, 30(9): 588-590. |
| [67] |
查国军, 罗永平, 欧惠, 等. 室温下鲜浒苔发酵产沼气潜力的研究[J]. 新余学院学报, 2013, 18(4): 101-102. ZHA Guojun, LUO Yongping, OU Hui, et al. Study on biogas production potential from fresh Enteromorpha prolifera at ambient temperature[J]. Journal of Xinyu University, 2013, 18(4): 101-102. |
| [68] |
冯涛, 宋林花, 张道祥, 等. 浒苔热裂解制取生物油的试验[J]. 化工进展, 2012, 31(S1): 72-76. FENG Tao, SONG Linhua, ZHANG Daoxiang, et al. Experimental study on pyrolysis of Enteromorpha prolifera to bio-oil[J]. Chemical Industry and Engineering Progress, 2012, 31(S1): 72-76. |
| [69] |
夏艳秋, 朱强, 李伟伟, 等. 低值海藻浒苔乙醇发酵条件的研究[J]. 中国酿造, 2017, 36(8): 95-98. XIA Yanqiu, ZHU Qiang, LI Weiwei, et al. Ethanol fermentation conditions base on low-value seaweed Enteromorpha prolifera[J]. China Brewing, 2017, 36(8): 95-98. |
| [70] |
单俊伟, 刘海燕, 马栋. 浒苔的研究与资源化利用进展[J]. 现代农业科技, 2016(15): 258-260. SHAN Junwei, LIU Haiyan, MA Dong. Research and Resourcfulization Application Progress of Enteromorpha[J]. Modern Agricultural Science and Technology, 2016(15): 258-260. |
| [71] |
GHOSH S, GNAIM R, GREISERMAN S, et al. Macroalgal biomass subcritical hydrolysates for the production of polyhydroxyalkanoate (PHA) by Haloferax mediterranei[J]. Bioresource Technology, 2019, 271: 166-173. |
| [72] |
GHOSH S, GREISERMAN S, CHEMODANOV A, et al. Polyhydroxyalkanoates and biochar from green macroalgal Ulva sp. Biomass subcritical hydrolysates: Process optimization and a priori economic and greenhouse emissions break-even analysis[J]. Science of the Total Environment, 2021, 770: 145281. |
| [73] |
DEVADAS V V, KHOO K S, CHIA W Y, et al. Algae biopolymer towards sustainable circular economy[J]. Bioresource Technology, 2021, 325: 124702. |
| [74] |
NOREEN A, ZIA K M, ZUBER M, et al. A critical review of algal biomass: A versatile platform of bio-based polyesters from renewable resources[J]. International Journal of Biological Macromolecules, 2016, 86: 937-949. |
| [75] |
YANG J, CHING Y C, CHUAH C H. Applications of lignocellulosic fibers and lignin in bioplastics: A review[J]. Polymers (Basel), 2019, 11(5): 751. |
| [76] |
ZANCHETTA E, DAMERGI E, PATEL B, et al. Algal cellulose, production and potential use in plastics: Challenges and opportunities[J]. Algal Research, 2021, 56: 102288. |
| [77] |
FERNAND F, ISRAEL A, SKJERMO J, et al. Offshore macroalgae biomass for bioenergy production: Environmental aspects, technological achievements and challenges[J]. Renewable and Sustainable Energy Reviews, 2017, 75: 35-45. |
| [78] |
JIANG R, INGLE K N, GOLBERG A. Macroalgae (seaweed) for liquid transportation biofuel production: What is next?[J]. Algal Research, 2016, 14: 48-57. |
| [79] |
CHEMODANOV A, ROBIN A, GOLBERG A. Design of marine macroalgae photobioreactor integrated into building to support seagriculture for biorefinery and bioeconomy[J]. Bioresource Technology, 2017, 241: 1084-1093. |
| [80] |
INGLE K, VITKIN E, ROBIN A, et al. Macroalgae biorefinery from Kappaphycus alvarezii: Conversion modeling and performance prediction for india and philippines as examples[J]. BioEnergy Research, 2017, 11(1): 22-32. |
| [81] |
ROBIN A, CHAVEL P, CHEMODANOV A, et al. Diversity of monosaccharides in marine macroalgae from the eastern mediterranean sea[J]. Algal Research, 2017, 28: 118-127. |
| [82] |
VITKIN E, GOLBERG A, YAKHINI Z. BioLEGO — a web-based application for biorefinery design and evaluation of serial biomass fermentation[J]. Technology, 2015, 3(2/3): 89-98. |
 2024, Vol. 48
2024, Vol. 48


