
文章信息
- 张绪涛, 李蒙, 黄骞, 张菊, 胡丽君, 宋书群, 李才文. 2024.
- ZHANG Xutao, LI Meng, HUANG Qian, ZHANG Ju, HU Lijun, SONG Shuqun, LI Caiwen. 2024.
- 海洋寄生甲藻血卵涡鞭虫孢子活力评估及抑制药物筛选研究
- Assessment of dinospore motility and screening of inhibitory drugs for the parasitic dinoflagellate Hematodinium
- 海洋科学, 48(6): 1-10
- Marine Sciences, 48(6): 1-10.
- http://dx.doi.org/10.11759/hykx20240110002
-
文章历史
- 收稿日期:2024-01-10
- 修回日期:2024-03-08
2. 崂山国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237;
3. 中国科学院大学 北京 100049
2. Marine Ecology and Environmental Science Laboratory, Laoshan Laboratory, Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
血卵涡鞭虫(Hematodinium spp.)是一类主要寄生于海洋甲壳类动物的寄生甲藻, 隶属于甲藻纲(Dinophyceae), 寄生藻目(Syndiniales), 寄生藻科(Syndiniaceae), 血卵涡鞭虫属(Hematodinium)[1-2]。血卵涡鞭虫主要寄生于甲壳动物的血淋巴和组织器官内, 其引发的流行性病害, 危害着美国蓝蟹、挪威龙虾等多种重要海捕渔业健康发展[2-4]。2004年, 我国首次在浙江舟山地区的三疣梭子蟹养殖中检测到血卵涡鞭虫[5]。随后, 广东汕头、河北、山东和天津等地的主要经济蟹类养殖区也相继报道了血卵涡鞭虫流行性感染[4, 6-9]。血卵涡鞭虫已逐渐成为危害海水经济甲壳类的新兴致病性病原, 给我国水产养殖产业带来了严峻挑战。
国内外学者对挪威龙虾(Nephrops norvegicus)、美国蓝蟹(Callinectes sapidus)、三疣梭子蟹(Portunus trituberculatus)等多种宿主中的血卵涡鞭虫株系进行了生活史研究, 发现其经历大致类似的生活史发展过程[8, 10-12]。血卵涡鞭虫感染初期, 主要为在宿主体内的营养体阶段, 包括丝状滋养体和类变形虫滋养体, 此后血卵涡鞭虫在宿主心脏、肝胰腺等组织器官及血腔内经历复杂的蛛网状滋养体增殖过程, 到感染后期发展为团块状聚合体、孢子母细胞, 再发展成为具有双鞭毛、可运动的孢子, 最终从宿主体内释放至环境水体中, 再度感染新宿主。血卵涡鞭虫孢子有大孢子和小孢子两种, 大多能在水体中短暂存活3天左右; 孢子被认为是其传播扩散, 导致流行性疾病的关键生活史阶段[1-2]。
目前, 国内外尚未有防控血卵涡鞭虫流行病的有效方法, 使用药物处理养殖水体, 可抑制环境水体中的血卵涡鞭虫孢子, 切断疾病传播途径。在进行药物效果评价时, 细胞的运动能力是重要的评价指标[13-14], 前期血卵涡鞭虫孢子的活力评价主要依据细胞是否运动定性进行[15]。近年来, 计算机图像分析被广泛应用于细胞运动的定量研究[16], 使用显微高速摄像机拍摄图像, 分离出逐帧图像中的目标细胞, 而后分析单位时间内细胞的运动情况, 广泛应用于舟形藻[17]、剧毒卡尔藻[18]、精子[19-20]及弧菌[21]等的运动分析中, 该技术可为血卵涡鞭虫孢子运动活力评估提供技术支撑。
本研究首先建立了基于计算机图像分析的血卵涡鞭虫孢子运动活力评估方法, 进而评估了4种水产药物(苯扎溴铵、戊二醛、辛硫磷、聚维酮碘)对血卵涡鞭虫孢子运动活力的影响, 以期为丰富血卵涡鞭虫孢子活力评估方法, 筛选水产应用防控药物提供依据。
1 材料与方法 1.1 血卵涡鞭虫孢子的获取试验螃蟹采集: 自山东省青岛市西海岸新区梭子蟹养殖池塘周边渠道布置网笼诱捕天津厚蟹(Helice tientsinensis), 将收集到的天津厚蟹置于塑料箱中, 保持湿润、常温运送至中国科学院海洋研究所实验室。随后, 采用中性红染色血涂片法[1]对天津厚蟹进行了血卵涡鞭虫感染状况的初步筛查, 然后经特异性PCR检测方法[22]进一步确认血卵涡鞭虫感染状况。血卵涡鞭虫感染个体与健康个体分别置于独立循环水养殖系统中, 于室温条件下(23±0.5) ℃饲养, 每周喂食蛤蜊肉2次, 每周更换1次海水以保持水质。
实验室感染保持: 使用自然感染血卵涡鞭虫的天津厚蟹作为初始供体, 人工注射感染健康天津厚蟹以在实验室中获取更多感染个体。具体步骤如下: 选择1只自然条件下重度感染的天津厚蟹作为初始供体, 使用75%酒精棉球擦拭其第五附肢基部关节膜, 1 mL注射器抽取血淋巴, 健康天津厚蟹经同样消毒后, 小心注入50 µL(约2×105个血卵涡鞭虫滋养体细胞)血淋巴[23-25]。注射后的天津厚蟹被置于独立的循环水养殖系统中, 于室温条件下(23±0.5) ℃饲养, 每周喂食蛤蜊肉2次, 每周更换1次海水以保持水质。3周后, 注射感染个体发展至重度滋养体阶段, 根据试验需要从中再次挑选供体, 进行下一轮人工注射感染。将重度感染个体单独养殖, 待进一步发展至感染晚期释放血卵涡鞭虫孢子。本研究以不同自然感染个体作为初始供体, 获得了分别发展成为大孢子、小孢子的2个感染体系。
释放孢子获取: 天津厚蟹注射感染后4周, 多数个体发展成为重度感染状态[12]。显微镜观察感染个体血淋巴以确定血卵涡鞭虫发展至孢子母细胞或孢子前细胞阶段, 将每只天津厚蟹分别置入1 L烧杯中, 加入200 mL经0.22 μm纤维膜(Millipore, Germany)过滤的天然海水(盐度30.0±0.1), 于室温(25 ℃)下监测、观察感染个体释放血卵涡鞭虫孢子情况。孢子释放过程中, 大量孢子(大孢子或小孢子)从感染个体的口器处排出, 水体逐渐变浑浊呈乳白色。镜检可观察到大量的、运动活跃的血卵涡鞭虫孢子即可进行药物筛选试验。
1.2 计算机图像分析评估孢子运动活力运动视频采集: 将含血卵涡鞭虫孢子的待测水体混合均匀, 取100 µL加至XB-K-25血球计数板腔室并盖上盖玻片。使用Olympus BX53显微镜(200×)观察, Olympus DP73高速相机、Cell Sens Standard 1.7软件采集图像, 每秒拍摄10帧, 每视野录制5~10 s, 像素为1 185×875 pixels, 转化率0.625 µm/pixel, 观测视野范围实际为711 µm×525 µm, 可满足试验采集图像并分析的需求。利用视频剪辑软件FastStone Capture取出包含血卵涡鞭虫孢子稳定运动的目标区段视频, 转为图片序列并按照处理和观察时间进行分组。
孢子个体识别: 在ImageJ中导入图片序列, 选定待分析区域, 将图片序列进行灰度化处理, 使用滤波器高亮边缘(Process → Fitters → Variance...), 半径设定为2 µm对应的像素大小; 使用自动阈值初步划分细胞与背景(Image → Adjust → Auto Threshold... → Li Method); 填补细胞上出现的空洞(Process → Binary → Fill Holes)。在matlab中读取处理结果为图像矩阵, 进行背景降噪, 使用bwlabel、regionprops函数将连通域面积小于0.3细胞大小的孤立点消除; 使用高斯平滑滤波器、形态学操作(腐蚀和膨胀)进一步平滑处理。最终转化为待分析的二值图片序列, 其中被细胞占据的像素以1表示, 背景像素以0表示。
孢子运动面积计算: 在matlab中处理二值图片矩阵, 每一帧矩阵减去前一帧矩阵得到像素变动矩阵(公式1), 然后将像素变动矩阵所有数字求绝对值后求和(公式2), 求取所有帧变动像素数的平均水平(公式3), 使用比例尺将像素数量转换为实际面积(公式4), 再将分析视野下的实际运动面积换算为每毫升样品内的运动面积(公式5):
| Di=Mi−Mi−1, | (1) |
| Si=n∑j=1m∑k=1|Di(j,k)|, | (2) |
| μ=1TT∑i=1Si, | (3) |
| P1=R×μ, | (4) |
| P2=P1V, | (5) |
式中, Mi为第i帧图片矩阵, Di为计算得到的像素变动矩阵。j为矩阵行序号, k为列序号, Si为两帧之间由运动引发的变动像素数。T为所分析的总帧数, μ为所有帧变动的平均像素数量。R为比例尺(单位μm/pix), P1为分析视野下的实际运动面积。由分析视野的面积及血球计数板计数腔室的深度, 得到分析视野的液体体积V, P2为换算后每毫升样品内变动的运动面积, 该面积为水体中血卵涡鞭虫孢子在显微镜平面上的运动投影面积, 单位μm2·s–1·mL–1。
1.3 水产药物对孢子运动活力的影响本研究筛选了苯扎溴铵、戊二醛、辛硫磷、聚维酮碘(商品相关信息见表 1) 4种水产养殖中常用的化学药品用于试验研究, 各药品标签说明书标注的常规使用浓度与2017年中国《兽药质量标准(化学药品卷)》中标注相一致[26], 使用超纯水配置不同浓度的药物母液。按水产疾病防治中常规用药量适当扩大而设置6个梯度浓度组、1个对照组(表 2), 选用12孔板, 每孔注入3 mL含孢子水体, 100~200 µL药物母液, 混合均匀, 以达到表 2设定的药物浓度, 血卵涡鞭虫孢子终密度为106~107 cells/mL。每个浓度设3个平行, 置于培养箱20 ℃, 黑暗条件下培养。
| 药品名称 | 外观性状 | 生产厂家 | 常规使用质量浓度/(mg·L–1) |
| 苯扎溴铵 | 淡黄色液体 | 河南惠康动物药业有限公司 | 0.15 |
| 戊二醛 | 淡黄色液体 | 河南惠康动物药业有限公司 | 0.008 |
| 辛硫磷 | 黄褐色液体 | 河南百草元兽药有限公司 | 0.012 |
| 聚维酮碘 | 红棕色液体 | 河南龙马动物药业有限公司 | 0.075 |
| 试验对象 | 药物名称 | 质量浓度/(mg·L–1) | |||||
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | ||
| 大孢子 | 苯扎溴铵 | 0.075 | 0.15 | 0.3 | 0.75 | 1.5 | 4.5 |
| 戊二醛 | 0.016 | 0.08 | 0.32 | 0.8 | 1.6 | 3.2 | |
| 辛硫磷 | 0.12 | 0.6 | 2.4 | 6 | 12 | 24 | |
| 聚维酮碘 | 0.75 | 3.75 | 15 | 37.5 | 75 | 150 | |
| 小孢子 | 苯扎溴铵 | 0.15 | 0.3 | 0.75 | 1.5 | 3 | 7.5 |
| 戊二醛 | 0.016 | 0.08 | 0.32 | 0.8 | 1.6 | 3.2 | |
| 辛硫磷 | 0.1 | 0.5 | 2 | 5 | 10 | 20 | |
试验分为4批进行, 第一批为大孢子的苯扎溴铵、戊二醛, 第二批为大孢子的辛硫磷、聚维酮碘, 第三批为小孢子的苯扎溴铵、戊二醛, 第四批为小孢子的辛硫磷。使用显微镜监测并录制初始及2 h后孢子状态, 监测其群体运动活力作为判断药物效果的标准, 如1.2所述。计算药物处理组细胞的相对运动活力(以下简称为细胞活力):
半数效应浓度(median effective concentration, EC50)为引起受试生物50%最大效应时的药物浓度[27-28], 使用GraphPad Prism 8.0建立药物浓度与细胞活力回归方程[29], 计算出当细胞活力为50%时, 药物浓度即为EC50。使用SPSS 23.0软件, 对不同药物浓度处理水体中血卵涡鞭虫孢子的细胞活力是否存在差异进行单因素方差分析(one way ANOVA, P < 0.05)。
2 结果 2.1 血卵涡鞭虫孢子形态及其运动特征经人工注射感染4周后, 天津厚蟹体内血卵涡鞭虫基本完成体内生活史发展过程, 部分感染晚期宿主能够自然释放血卵涡鞭虫大孢子或者小孢子至水体中。观察表面, 血卵涡鞭虫孢子呈白色“烟雾状”自天津厚蟹口器部位排出, 最终导致水体呈乳白色“牛奶状”液体(图 1a)。血卵涡鞭虫孢子释放过程持续约20 min, 期间天津厚蟹能够正常活动; 血卵涡鞭虫孢子释放完成后, 天津厚蟹逐渐死亡。
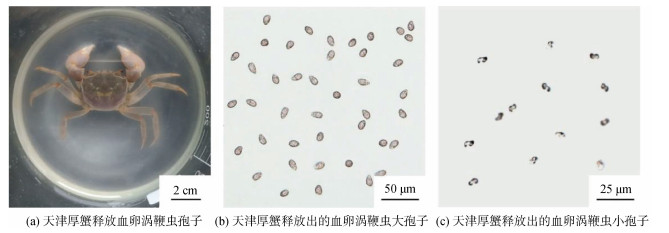 |
| 图 1 实验室内天津厚蟹释放血卵涡鞭虫孢子 Fig. 1 Release of Hematodinium dinospores from Helice tientsinensis in the laboratory experiment |
血卵涡鞭虫大孢子形态呈椭球形, 长轴约为13~15 μm [(14.0±0.6) µm, n=25](图 1b)。大孢子沿运动方向螺旋运动, 快速运动的大孢子速度约为20 µm/s。椭球形一端略尖为头部, 指向运动方向, 旋转半径大摆动剧烈; 椭球形钝端为尾部, 旋转半径小摆动缓慢。血卵涡鞭虫小孢子形态呈螺旋形, 较远两端长度约为5~7 μm [(6.2±0.5) µm, n=25](图 1c)。小孢子同样沿运动方向螺旋前进, 快速运动的小孢子速度可达100 µm/s。小孢子细胞较小, 整个细胞可沿螺旋线路径进行运动, 同时自身沿体轴自转, 螺旋路径中心轴即运动方向。
2.2 血卵涡鞭虫孢子运动图像分析在显微镜下录制了血卵涡鞭虫大孢子(图 2a)及血卵涡鞭虫小孢子(图 2e)的原始图像, 首先分离细胞与背景, 然后捕捉帧间的细胞体位置变化。方差滤波处理原始图像, 初步分离了细胞与背景(图 2b, 图 2f), 血球计数板的刻线显示出了低程度的影像, 细胞表面也存在小面积噪点, 需要进一步处理。通过设定面积阈值的方法消除孤立的噪点, 并平滑处理细胞表面, 使细胞与背景完全分离(图 2c, 图 2g)。
 |
| 图 2 基于计算机图像分析检测血卵涡鞭虫孢子运动面积 Fig. 2 Detection of Hematodinium dinospore movement area through computer image analysis 注: 红色代表细胞新进入的位置, 蓝色为细胞离开的位置 |
将细胞、背景分离开的每帧图像之间作差, 捕捉由运动引起的细胞体位置变化。血卵涡鞭虫大孢子基本沿着运动方向进入新位置, 部分细胞体离开原先位置(图 2d)。血卵涡鞭虫小孢子在同样时间间隔内, 能够变动更大比例的细胞体, 运动更快(图 2h), 同样沿运动方向, 细胞离开一部分并进入新的一部分。
2.3 试验药物对血卵涡鞭虫孢子运动活力的影响在药物抑制血卵涡鞭虫大孢子运动活力试验中, 0.3 mg·L–1苯扎溴铵处理2 h后细胞活力显著降低至59.3%±16.7%, 0.75 mg·L–1、1.5 mg·L–1处理组细胞活力明显下降, 4.5 mg·L–1处理组细胞活力降至最低为18.7%±11.0%(图 3a); 计算其2 h EC50值为0.380 mg·L–1, 2 h EC90值为1.718 mg·L–1, 孢子细胞结构破坏、破裂死亡。戊二醛处理2 h后, 0.016 mg·L–1处理组细胞活力显著降低至84.4%±17.8%, 药物浓度升高处理组细胞活力逐渐下降, 3.2 mg·L–1处理组细胞活力降至29.8%± 3.1%(图 3b); 计算其2 h EC50值为1.411 mg·L–1, 细胞被固定为圆形、失去活力。辛硫磷处理2 h后, 0.6 mg·L–1处理组细胞活力显著降低至82.4%±14.9%, 2.4 mg·L–1处理组细胞活力明显降低至36.5%±14.4%, 24 mg·L–1处理组细胞活力仅为6.4%±4.5%(图 3 c); 计算其2 h EC50值为1.808 mg·L–1, 多数细胞形态呈圆形、静止。聚维酮碘处理2 h后, 0.75 mg·L–1浓度处理组细胞活力反而增强至122.6%±18.2%, 3.75 mg·L–1、15 mg·L–1、37.5 mg·L–1处理组细胞活力与对照组无显著差异, 75 mg·L–1处理组细胞活力显著下降为72.2%±6.6%(图 3 d); 计算其2 h EC50值为108.694 mg·L–1, 多数细胞形态呈圆形、静止。
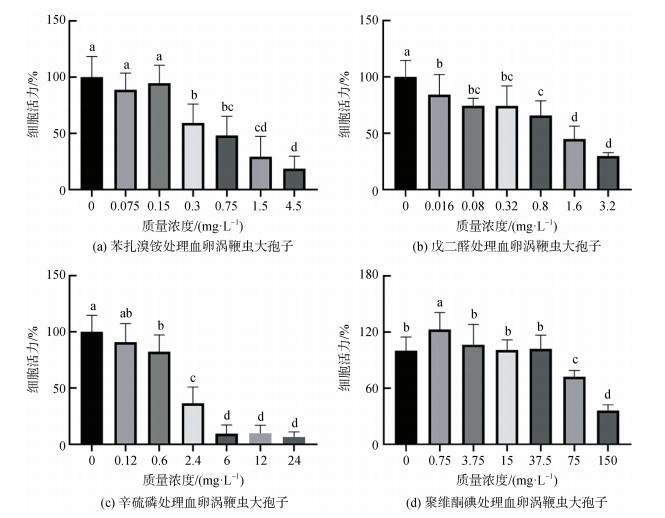 |
| 图 3 不同浓度药物处理下血卵涡鞭虫大孢子的运动活力变化 Fig. 3 Variation in the cell motility of Hematodinium macrospores treated with different concentrations of experimental chemicals 注: 组间无相同字母符号者表示差异显著(P < 0.05) |
在药物抑制血卵涡鞭虫小孢子运动活力试验中, 0.15 mg·L–1苯扎溴铵处理2 h后细胞活力显著降低至61.0%±10.3%, 0.75 mg·L–1处理组细胞活力持续降低为12.2%±8.1%(图 4a), 1.5 mg·L–1、3 mg·L–1、7.5 mg·L–1处理组视野内小孢子均破裂消失, 细胞活力均为0; 计算其2 h EC50值为0.172 mg·L–1, 2 h EC90值为0.347 mg·L–1。戊二醛处理2 h后, 0.016 mg·L–1处理组细胞活力显著降低至75.4%±20.5%, 药物浓度升高处理组细胞活力处于较低值, 3.2 mg·L–1处理组细胞活力降至最低为8.0%± 2.3%(图 4b); 计算其2 h EC50值为0.038 mg·L–1, 多数细胞由螺旋形变为圆形。辛硫磷处理2 h后, 在0.1 mg·L–1处理组细胞活力降低至50.5%± 8.1%, 药物浓度升高处理组细胞活力降低, 20 mg·L–1处理组细胞活力降至最低为11.3%±3.1%(图 4c); 计算其2 h EC50值为0.101 mg·L–1, 多数细胞形态呈圆形、静止。
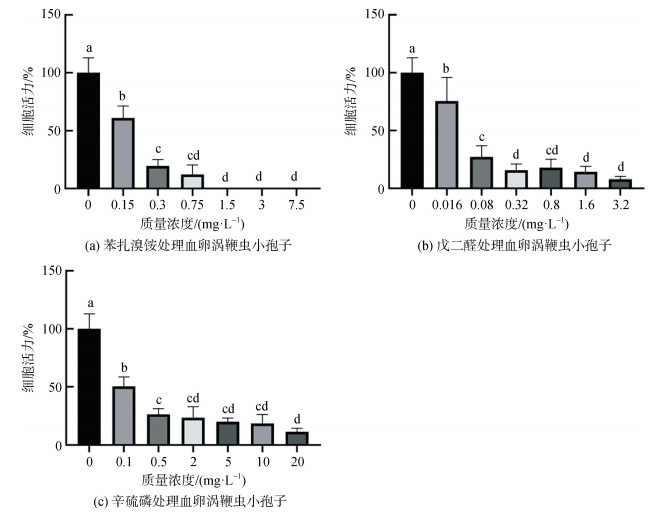 |
| 图 4 不同浓度药物处理下血卵涡鞭虫小孢子的运动活力变化 Fig. 4 Variation in the cell motility of Hematodinium microspores treated with different concentrations of experimental chemicals 注: 组间无相同字母符号者表示差异显著(P < 0.05) |
本研究首次基于计算机图像分析建立了一种利用运动面积评估细胞运动活力的方法, 并采用该方法评估了血卵涡鞭虫孢子运动活力以及水产药物对其抑制效果。传统计算机图像分析细胞运动的方法通过捕捉运动轨迹实现, 将每帧图像中的细胞简化为一个质点, 记录质点在帧与帧之间的x、y坐标变化, 计算运动速度来获取细胞运动活力[21, 30]。本研究评估细胞运动的方法, 数据同样源自显微录制视频, 但关注了整个细胞体影像所有位置的坐标运动, 而非一个中心质点; 通过帧与帧之间细胞体占据的像素位置变化, 计算单位时间内变动的运动面积来获取细胞的运动活力。通过分析运动面积, 能更准确地捕捉目标对象边界及局部的运动, 包括细胞旋转、摆动以及形变等运动信息, 进而全面反映细胞生理活跃状态。该方法适用于海洋甲藻(包括血卵涡鞭虫孢子)等具有复杂运动方式细胞的运动活力监测及评估。
我国水产养殖中处理水体的常见药物主要为消毒防腐剂、水体改良剂、驱虫杀虫剂等, 全池泼洒化学药物处理养殖水体是目前常用的疾病控制方法[31]。苯扎溴铵是季铵盐类消毒剂, 其表面阳离子具有强效活性作用, 可改变生物细胞膜通透性; 其理化性质较稳定、毒性低, 属于环境安全程度较高的水产药物[32-33]。戊二醛是一种蛋白质交联剂, 通过交联反应破坏细胞表面的蛋白受体, 杀灭水体中的病原生物[34]。辛硫磷是一种低毒高效的有机磷杀虫剂, 能够干扰寄生虫的神经传导, 致使虫体麻痹死亡, 还能加速寄生虫宿主胃肠蠕动, 促进虫体排出体外, 其杀虫谱广、应用简单[35]。聚维酮碘在水溶液中释放游离碘和次碘酸, 破坏细胞膜的稳定性并引发蛋白质裂解, 对革兰氏阳性和阴性菌、原虫和病毒等多种病原生物有杀灭效果[36], 广泛应用于池塘水处理中[37-38]。本研究对于上述4种水产药物抑制血卵涡鞭虫孢子活力的效果进行了定性、定量评估。
在血卵涡鞭虫大孢子的运动活力抑制试验中, 辛硫磷、戊二醛、聚维酮碘达到明显抑制效果的用量远超各药物的安全使用标准, 苯扎溴铵在0.380~ 1.718 mg·L–1浓度下可在2 h内使血卵涡鞭虫大孢子的运动活力降低50%~90%, 具有明显抑制效果。在血卵涡鞭虫小孢子的运动活力抑制试验中, 戊二醛与辛硫磷需要近5倍以上药物常规用量才具有明显抑制效果, 而苯扎溴铵在0.172~0.347mg·L–1浓度下可在2 h内使血卵涡鞭虫小孢子的运动活力降低50%~ 90%, 具有明显抑制效果。结果表明, 苯扎溴铵抑制2种孢子运动活力的效果明显优于其余3种药物, 可作为水产养殖中防控血卵涡鞭虫流行病的候选药物。学者测定了苯扎溴铵对中华绒螯蟹幼蟹的安全浓度为1.78 mg·L–1, 防治该蟹养殖中出现的寄生纤毛虫病推荐泼洒0.35 mg·L–1苯扎溴铵[39-40], 综合考虑, 建议防治血卵涡鞭虫大孢子的泼洒浓度为0.38~1.72 mg·L–1, 小孢子泼洒浓度为0.17~0.35 mg·L–1, 具体浓度应视养殖生物以及需防治的血卵涡鞭虫孢子类型而定。此外, 试验发现了血卵涡鞭虫小孢子比大孢子对药物处理(苯扎溴铵、戊二醛、辛硫磷)的敏感性更高。
近年来, 血卵涡鞭虫对我国三疣梭子蟹、拟穴青蟹的养殖造成了严重危害, 明晰养殖过程中的流行病学特征, 在关键时间节点采取有效控制措施是流行病防控的关键所在。我国山东、河北等地区的三疣梭子蟹养殖期通常为每年4—11月, 其中多在4—5月蟹苗入池; 血卵涡鞭虫感染在6—10月采集的养殖蟹及周边野生蟹中均有发现, 而7—8月一般为池塘中血卵涡鞭虫流行发病高峰期[8, 41]。前期流行病调查研究发现, 拟穴青蟹、美国蓝蟹以及挪威龙虾的幼体阶段更易受到血卵涡鞭虫感染[7, 42-43]。池塘周边野生蟹类可作为血卵涡鞭虫的中间宿主, 是养殖池塘中易感甲壳动物宿主的潜在病原来源[44]; 血卵涡鞭虫孢子是其在水体中传播扩散的关键生活史阶段[1-2]。因此, 在养殖蟹类幼体频繁蜕壳、快速生长的养殖早期阶段做好针对性防控, 施用杀灭效果显著、环境安全性高、成本价格合理的药物抑制血卵涡鞭虫关键生活史阶段活力及感染力, 能够有效控制血卵涡鞭虫流行病的传播扩散。
4 结论本研究基于计算机图像分析技术首次建立了一种可定量评估血卵涡鞭虫孢子运动活力的新方法, 并进一步采用该方法评估了4种水产药物(苯扎溴铵、戊二醛、辛硫磷、聚维酮碘)对血卵涡鞭虫大、小孢子运动活力的影响, 发现了苯扎溴铵可明显抑制血卵涡鞭虫孢子的运动活力, 可作为水产养殖中防控血卵涡鞭虫流行病的候选药物。苯扎溴铵防治血卵涡鞭虫大孢子和小孢子的建议泼洒浓度分别为0.38~ 1.72 mg·L–1和0.17~0.35 mg·L–1, 具体浓度应视养殖生物以及需防治的血卵涡鞭虫孢子类型而定。
| [1] |
STENTIFORD G D, SHIELDS J D. A review of the parasitic dinoflagellates Hematodinium species and Hematodinium-like infections in marine crustaceans[J]. Diseases of Aquatic Organisms, 2005, 66(1): 47-70. |
| [2] |
LI C W, LI M, HUANG Q. The parasitic dinoflagellate Hematodinium infects marine crustaceans[J]. Marine Life Science & Technology, 2021, 3(3): 313-325. |
| [3] |
SMALL H J. Advances in our understanding of the global diversity and distribution of Hematodinium spp.- Significant pathogens of commercially exploited crustaceans[J]. Journal of Invertebrate Pathology, 2012, 110(2): 234-246. DOI:10.1016/j.jip.2012.03.012 |
| [4] |
李才文, 许文军. 海水甲壳类寄生性病原血卵涡鞭虫(Hematodinium spp.) 研究进展[J]. 海洋与湖沼, 2014, 45(1): 1-10. LI Caiwen, XU Wenjun. Review on parasitic dinoflagellates Hematodinium spp. in major marine crustaceans[J]. Oceanologia et Limnologia Sinica, 2014, 45(1): 1-10. |
| [5] |
许文军, 施慧, 徐汉祥, 等. 养殖梭子蟹血卵涡鞭虫感染的初步研究[J]. 水生生物学报, 2007, 31(5): 637-640. XU Wenjun, SHI Hui, XU Hanxiang, et al. Preliminary study on the Hematodinium infection in cultured Portunus trituberculatus[J]. Acta Hydrobiologica Sinica, 2007, 31(5): 637-640. DOI:10.3321/j.issn:1000-3207.2007.05.004 |
| [6] |
许文军, 谢建军, 施慧, 等. 池塘养殖脊尾白虾(Exopalaemon carinicauda)感染血卵涡鞭虫的研究[J]. 海洋与湖沼, 2010, 41(3): 396-402. XU Wenjun, XIE Jianjun, SHI Hui, et al. Infection of Hematodinium sp. in farmed ridgetail white prawn Exopalaemon carinicauda[J]. Oceanologia et Limnologia Sinica, 2010, 41(3): 396-402. |
| [7] |
刘顺, 戴瑜来, 周素明, 等. 拟穴青蟹(Scylla paramamosain)血卵涡鞭虫病的流行病学分析[J]. 海洋与湖沼, 2014, 45(3): 595-601. LIU Shun, DAI Yulai, ZHOU Suming, et al. Epidemiology analysis of Hematodinium sp. disease in Scylla paramamosain[J]. Oceanologia et Limnologia Sinica, 2014, 45(3): 595-601. |
| [8] |
WANG J F, LI M, XIAO J, et al. Hematodinium spp. infections in wild and cultured populations of marine crustaceans along the coast of China[J]. Diseases of Aquatic Organisms, 2017, 124(3): 181-191. DOI:10.3354/dao03119 |
| [9] |
王印庚, 杨洋, 张正, 等. 津冀地区养殖三疣梭子蟹大量死亡的病原和病理分析[J]. 中国水产科学, 2017, 24(3): 596-605. WANG Yingeng, YANG Yang, ZHANG Zheng, et al. Etiological and pathological analyses of massive mortality in cultured crab Portunus trituberculatus along the coasts of Tianjin and Hebei, China[J]. Journal of Fishery Sciences of China, 2017, 24(3): 596-605. |
| [10] |
APPLETON P L, VICKERMAN K. In vitro cultivation and developmental cycle in culture of a parasitic dinoflagellate (Hematodinium sp.) associated with mortality of the Norway lobster (Nephrops norvegicus) in British waters[J]. Parasitology, 1998, 116(Pt 2): 115-130. |
| [11] |
LI C W, MILLER T L, SMALL H J, et al. In vitro culture and developmental cycle of the parasitic dinoflagellate Hematodinium sp. from the blue crab Callinectes sapidus[J]. Parasitology, 2011, 138(14): 1924-1934. DOI:10.1017/S0031182011001405 |
| [12] |
吕晓阳, 黄骞, 李蒙, 等. 海洋寄生甲藻血卵涡鞭虫生活史及温度对其发展的影响[J]. 海洋与湖沼, 2022, 53(6): 1430-1440. LV Xiaoyang, HUANG Qian, LI Meng, et al. Life cycle of marine parasitic dinoflagellate Hematodinium perezi and effect of temperature on growth[J]. Oceanologia et Limnologia Sinica, 2022, 53(6): 1430-1440. |
| [13] |
李雪菡, 齐红莉, 吕湘琳, 等. 多子小瓜虫对三种化学药物的敏感性研究[J]. 天津农学院学报, 2021, 28(3): 69-74. LI Xuehan, QI Hongli, LV Xianglin, et al. Study on the sensitivity of Ichthyophthirius multifiliis to three chemical drugs[J]. Journal of Tianjin Agricultural University, 2021, 28(3): 69-74. |
| [14] |
唐煜坤, 马健伟, 于忠臣, 等. 微纳米气泡臭氧氧化对剑水蚤和圆水蚤的灭活效能及机理分析[J]. 净水技术, 2023, 42(11): 67-75, 119. TANG Yukun, MA Jianwei, YU Zhongchen, et al. Efficacy and mechanism analysis of micro-nano bubble ozonation for Cyclops and Daphnia inactivation[J]. Water Purification Technology, 2023, 42(11): 67-75, 119. |
| [15] |
COFFEY A H, LI C, SHIELDS J D. The effect of salinity on experimental infections of a Hematodinium sp. in blue crabs, Callinectes sapidus[J]. Journal of Parasitology, 2012, 98(3): 536-542. DOI:10.1645/GE-2971.1 |
| [16] |
AMANN R P, WABERSKI D. Computer-assisted sperm analysis (CASA): capabilities and potential developments[J]. Theriogenology, 2014, 81(1): 5-17. DOI:10.1016/j.theriogenology.2013.09.004 |
| [17] |
王峰, 赵丽侠, 朱政, 等. 硅酸盐浓度对羽纹纲藻类圆弧运动的影响——以舟形藻为例[J]. 华东师范大学学报(自然科学版), 2019(2): 135-146. WANG Feng, ZHAO Lixia, ZHU Zheng, et al. The effect of dissolved silicic acid on circular motion behaviors in pennatae: A case study on diatom Navicula arenaria var. rostellata[J]. Journal of East China Normal University (Natural Science), 2019(2): 135-146. |
| [18] |
LI S W, LIN P H, HO T Y, et al. Change in rheotactic behavior patterns of dinoflagellates in response to different microfluidic environments[J]. Scientific Reports, 2021, 11(1): 11105. DOI:10.1038/s41598-021-90622-8 |
| [19] |
ŠIMONÍK O, ŠICHTAŘ J, TURNEROVA A, et al. Computer assisted sperm analysis - The relationship to bull field fertility, possible errors and their impact on outputs: A review[J]. The Indian Journal of Animal Sciences, 2014, 85: 3-11. |
| [20] |
GALLAGHER M T, SMITH D J, KIRKMAN-BROWN J C. CASA: tracking the past and plotting the future[J]. Reproduction, Fertility and Development, 2018, 30(6): 867-874. DOI:10.1071/RD17420 |
| [21] |
GAO C, GARREN M, PENN K, et al. Coral mucus rapidly induces chemokinesis and genome-wide transcriptional shifts toward early pathogenesis in a bacterial coral pathogen[J]. The ISME Journal, 2021, 15(12): 3668-3682. DOI:10.1038/s41396-021-01024-7 |
| [22] |
SMALL H J, SHIELDS J D, HUDSON K L, et al. Molecular detection of Hematodinium sp. infecting the blue crab, Callinectes sapidus[J]. Journal of Shellfish Research, 2007, 26(1): 131-139. DOI:10.2983/0730-8000(2007)26[131:MDOHSI]2.0.CO;2 |
| [23] |
SHIELDS J D, SQUYARS C M. Mortality and hematology of blue crabs, Callinectes sapidus, experimentally infected with the parasitic dinoflagellate Hematodinium perezi[J]. Fishery Bulletin, 2000, 98(1): 139-152. |
| [24] |
SMALL H J, SHIELDS J D, MOSS J A, et al. Conservation in the first internal transcribed spacer region (ITS1) in Hematodinium species infecting crustacean hosts found in the UK and Newfoundland[J]. Diseases of Aquatic Organisms, 2007, 75(3): 251-258. |
| [25] |
LI M, HUANG Q, LV X Y, et al. Integrative omics analysis highlights the immunomodulatory effects of the parasitic dinoflagellate Hematodinium on crustacean hemocytes[J]. Fish & Shellfish Immunology, 2022, 125: 35-47. |
| [26] |
中国兽药典委员会. 兽药质量标准化学药品卷2017年版[M]. 北京: 中国农业出版社, 2017. Commission of Chinese Erinary Pharmacopoeia. Quality standards for veterinary drugs–Chemical drugs volume 2017 edition[M]. Beijing: China Agriculture Press, 2017. |
| [27] |
NEUBIG R R, SPEDDING M, KENAKIN T, et al. International Union of Pharmacology Committee on Receptor Nomenclature and Drug Classification. XXXVIII. update on terms and symbols in quantitative pharmacology[J]. Pharmacological Reviews, 2003, 55(4): 597-606. |
| [28] |
CHEN Z, BERTIN R, FROLDI G. EC50 estimation of antioxidant activity in DPPH assay using several statistical programs[J]. Food Chemistry, 2013, 138(1): 414-420. |
| [29] |
于童, 白喜云, 解晓晶, 等. 应用GraphPad Prism 5.0®软件计算药物的EC50[J]. 药学进展, 2012, 36(4): 180-183. YU Tong, BAI Xiyun, XIE Xiaojing, et al. Calculation of in vitro EC50 of a drug by GraphPad Prism 5.0® software[J]. Progress in Pharmaceutical Sciences, 2012, 36(4): 180-183. |
| [30] |
CHENG H J, HSU C H, HUNG C L, et al. A review for cell and particle tracking on microscopy images using algorithms and deep learning technologies[J]. Biomedical Journal, 2022, 45(3): 465-471. |
| [31] |
王玉堂, 吕永辉. 水产养殖用药与水产品质量安全[J]. 农业工程, 2011, 1(3): 44-49. WANG Yutang, LV Yonghui. Aquaculture drugs and safety of aquatic products[J]. Agricultural Engineering, 2011, 1(3): 44-49. |
| [32] |
王艳萍. 苯扎溴铵消毒液杀菌试验观察[J]. 安徽农业科学, 2014, 42(20): 6530-6531. WANG Yanping. Observation on germicidal efficacy of benzalkonium bromide disinfectant solution[J]. Journal of Anhui Agricultural Sciences, 2014, 42(20): 6530-6531. |
| [33] |
李云南, 刘青. 新型苯扎溴铵对克氏原螯虾急性毒性的研究[J]. 水产养殖, 2017, 38(4): 31-34. LI Yunnan, LIU Qing. Model of benzalkonium bromide on Procambarus clarkia study on acute toxicity[J]. Journal of Aquaculture, 2017, 38(4): 31-34. |
| [34] |
高富红. 戊二醛消毒剂研究进展[J]. 安徽农业科学, 2016, 44(30): 121-122, 126. GAO Fuhong. Research progress of glutaraldehyde disinfectant[J]. Journal of Anhui Agricultural Sciences, 2016, 44(30): 121-122, 126. |
| [35] |
邹伟, 李梦圆, 唐秀琴, 等. 秀丽隐杆线虫对辛硫磷趋化效应研究[J]. 生物化工, 2022, 8(4): 34-38. ZOU Wei, LI Mengyuan, TANG Xiuqin, et al. The investigation about lure process by phoxim in Caenorhabditis elegans[J]. Biological Chemical Engineering, 2022, 8(4): 34-38. |
| [36] |
MU W B, XU B Y, GUO W T, et al. Outcome of irrigation and debridement with topical antibiotics delivery for the management of periprosthetic joint infection occurring within 3 months since the primary total joint arthroplasty[J]. Journal of Arthroplasty, 2021, 36(5): 1765-1771. |
| [37] |
刘波, 周群兰, 孙存鑫, 等. 聚维酮碘对池塘消毒效果研究[J]. 科学养鱼, 2023(7): 57-59. LIU Bo, ZHOU Qunlan, SUN Cunxin, et al. Study on disinfection effect of providone-iodine on culture pond[J]. Scientific Fish Farming, 2023(7): 57-59. |
| [38] |
谢永广, 魏朝宇, 魏秀英, 等. 4种水产消毒剂对棘胸蛙蝌蚪急性毒性研究[J]. 水产科学, 2023, 42(3): 502-508. XIE Yongguang, WEI Chaoyu, WEI Xiuying, et al. Acute toxicity of four conventional disinfectants in aquaculture on tadpoles of frog Quasipaa spinosa[J]. Fisheries Science, 2023, 42(3): 502-508. |
| [39] |
余伟楠, 陆宏达, 朱磊, 等. 苯扎溴铵对几种淡水水生动物的急性毒性[J]. 广东农业科学, 2014, 41(15): 111-115, 120. YU Weinan, LU Hongda, ZHU Lei, et al. Acute toxicity of benzalkonium bromide on several hydrocoles in fresh water[J]. Guangdong Agricultural Sciences, 2014, 41(15): 111-115, 120. |
| [40] |
朱磊, 陆宏达, 余伟楠. 蟹寄江氏伪钟虫Pseudovorticella jiangi防治药物的筛选[J]. 广东农业科学, 2013, 40(11): 119-123. ZHU Lei, LU Hongda, YU Weinan. Screening of prevention and control drug against Pseudovorticella jiangi parasiting on Eriocheir sinensis[J]. Guangdong Agricultural Sciences, 2013, 40(11): 119-123. |
| [41] |
刘炜鑫, 陈晓玲, 李蒙, 等. 日照沿海养殖三疣梭子蟹血卵涡鞭虫流行病发生过程研究[J]. 海洋与湖沼, 2023, 54(5): 1373-1382. LIU Weixin, CHEN Xiaoling, LI Meng, et al. Epidemic outbreak of Hematodinium disease in cultured Portunus trituberculatus along Rizhao coast[J]. Oceanologia et Limnologia Sinica, 2023, 54(5): 1373-1382. |
| [42] |
MESSICK G A, SHIELDS J D. Epizootiology of the parasitic dinoflagellate Hematodinium sp. in the American blue crab Callinectes sapidus[J]. Diseases of Aquatic Organisms, 2000, 43(2): 139-152. |
| [43] |
STENTIFORD G. The relationship of Hematodinium infection prevalence in a Scottish Nephrops norvegicus population to season, moulting and sex[J]. ICES Journal of Marine Science, 2001, 58(4): 814-823. |
| [44] |
HUANG Q, LI M, WANG J, et al. Transmission pattern of the parasitic dinoflagellate Hematodinium perezi in polyculture ponds of coastal China[J]. Aquaculture, 2021, 538: 736549. |
 2024, Vol. 48
2024, Vol. 48


