
文章信息
- 黄会, 马元庆, 刘京熙, 桑亚楠, 孙贵芹, 付萍, 王明磊, 刘永春, 刘小静, 王玮云. 2024.
- HUANG Hui, MA Yuanqing, LIU Jingxi, SANG Yanan, SUN Guiqin, FU Ping, WANG Minglei, LIU Yongchun, LIU Xiaojing, WANG Weiyun. 2024.
- 基于物种敏感度分布法——评价山东省某海湾除草剂扑草净的生态风险
- Ecological risk assessment of herbicide prometryn in a bay of Shandong Province based on species sensitivity distribution
- 海洋科学, 48(6): 11-20
- Marine Sciences, 48(6): 11-20.
- http://dx.doi.org/10.11759/hykx20240106001
-
文章历史
- 收稿日期:2024-01-06
- 修回日期:2024-03-15
2. 烟台市海珍品质量安全控制与精深加工重点实验室, 山东 烟台 264006;
3. 莱州市海洋发展和渔业服务中心, 山东 烟台 264006
2. Yantai Key Laboratory of Quality and Safety Control and Deep Processing of Marine Food, Yantai 264006, China;
3. Laizhou Provincial Department of Ocean and Fisheries Services Centre, Yantai 264006, China
近年来, 扑草净作为一种重要的三嗪类除草剂, 在农业和非农业领域被用于防除多种杂草[1], 也被广泛用于水产养殖业, 其污染已经从陆地扩展到海洋生态环境[2]。我国近岸海洋环境中频频检出扑草净, 如黄河口近岸[3]、莱州湾[4]、乳山近海[5]、黄海、渤海近岸[6]、海南八门湾[7]等, 国外海洋环境中也多次检出[8-9]。欧盟已于2004年全面禁止销售和使用扑草净, 美、日两国允许将扑草净作为除草剂使用, 但未将其用于水产养殖。我国仍允许扑草净在农业中使用, 因其引起水生动物代谢规律不明显等原因先后被列入农业农村部第627号、第1435号公告, 但尚未对水产品中扑草净的残留限量作出要求。由于扑草净化学性质较稳定, 可长时间存在于海洋环境中, 对海洋动物产生慢性低剂量毒性效应[10], 由扑草净产生的生态效应已引起广泛重视, 亟待开展海洋环境中扑草净的生态风险评价。
物种敏感性分布法(species sensitivity distribution, SSD)是国际通用的水环境生态风险评价及水质基准制定等研究工作的方法[11], 由于不同地区敏感物种有所差异, 采用SSD法进行生态风险评价时, 物种选择会影响预测无效应浓度(predicted no effect concentration, PNEC)的推导及风险评价结果的分析, 增加风险评价地区物种的毒性数据可能降低其不确定性[12]。由于缺少扑草净对我国海洋生物急性毒性数据, 鲜见采用SSD法评价我国近岸海洋环境中扑草净生态风险。因此, 有必要开展扑草净对山东沿海常见海洋生物急性毒性研究, 为海洋环境中扑草净的生态风险评价提供基础数据。
本文系统研究了扑草净对我国近海典型生物类群的急性效应, 基于现场调查分析其在近海典型海湾的分布规律, 基于SSD法采用商值法评价其生态风险, 以期为我国海洋环境中扑草净生态风险评价提供数据参考, 为相关污染物的生态风险评价提供借鉴。
1 材料与方法 1.1 实验生物中华咸剑水蚤(Halicyclops sinensis)、太平洋纺锤水蚤(Acartia pacifica)、太平洋真宽水蚤(Eurytemora pacifica)、小毛猛水蚤(Microsetella norvegica)采自烟台近岸。自然海水经0.45 μm混合纤维素滤膜过滤使用, 水温(20±0.5) ℃, 光暗比L∶D =12 h∶12 h。驯化培养3 d后, 挑取健康活跃的成体作为实验对象。
亚心形扁藻(Platymonas subcordiformis)、球等鞭金藻(Isochrysis galbana)、纤细角毛藻(Chaetoceros gracilis)、小新月菱形藻(Nitzschia closterium)由山东省海洋资源与环境研究院藻种室提供。自然海水经0.45 μm混合纤维素滤膜过滤后加入f/2培养液, 经灭菌后用于海洋微藻的培养, 水温(20±0.5) ℃, 光照强度3 000 lx, 光暗比为L∶D =12 h∶12 h。预培养3代, 镜检细胞正常, 进入对数生长期进行实验。
1.2 实验试剂实验用海水取自烟台近岸。扑草净购自德国Dr. Ehrenstorfer公司, 用无水乙醇配制为1.00 g·L–1的储备液, 于4 ℃保存; 使用时用纯水稀释, 按设定质量浓度加入到实验海水中。
实验用到的仪器设备包括6孔细胞培养板(康宁costar 3516); Blue-Pard光照培养箱(上海一恒科学仪器有限公司); DM500生物显微镜(德国徕卡仪器公司); U-2900紫外可见分光光度计(日本日立高新技术公司); Sigma 3K15台式高速冷冻离心机(德国Sigma公司); SCIENTZ-ⅡD超声波细胞粉碎机(宁波新芝生物科技股份有限公司)。
1.3 实验方法 1.3.1 海洋桡足类参考《水生生物毒性试验方法》[13], 采用静水生物实验法。在正式毒性实验开始前分别对4种海洋桡足类进行预实验, 根据预实验结果确定正式试验扑草净的浓度范围。
桡足类急性毒性试验在6孔细胞培养板中进行, 根据预试验结果设置实验组扑草净质量浓度分别为50, 80, 125, 200, 300, 500, 800, 1 200, 2 000, 3 000 μg·L–1、1个溶剂对照组, 每组设6个平行, 每个平行20只桡足类个体, 每天投喂1次球等鞭金藻, 实验过程中随时观察和记录桡足类的生命状态, 及时挑出死亡的个体, 记录24、48、72和96 h的死亡个体数。
1.3.2 海洋微藻微藻生长抑制实验设计参照《化学农药环境安全评价试验准则第14部分: 藻类生长抑制试验》[14]。100 mL对数生长期藻液于250 mL锥形瓶中, 以无水乙醇为助溶剂, 根据预实验结果采用等对数间距法设置7~11个实验组(见表 1)、1个溶剂对照组, 每组3个平行, 分别于药物暴露第0、24、48和72 h取样, 于750 nm测光密度(optical delnsity, OD), 统计各组微藻细胞密度, 计算各组微藻比生长率(μ)、抑制率(%), 获得其半数抑制浓度EC50。
| 受试微藻名称 | 扑草净质量浓度/(μg·L–1) |
| 亚心形扁藻 | 1.0, 2.0, 3.0, 6.0, 10.0, 18.0, 32.0, 56.0, 100 |
| 球等鞭金藻 | 1.0, 3.0, 8.0, 22.0, 60.0, 180, 500 |
| 纤细角毛藻 | 1.0, 2.0, 4.0, 8.0, 18.0, 36.0, 75.0, 150, 300, 600 |
| 小新月菱形藻 | 1.0, 2.0, 4.0, 6.0, 11.0, 20.0, 35.0, 70.0, 120, 220, 400 |
藻液的OD750与藻细胞密度的相关性确证: 取处于对数生长期的藻液, 将其稀释成7个不同的吸光度梯度(OD750 = 0.01~0.50), 每个梯度3个平行, 分别用分光光度计测OD750、用血球计数板在显微镜下统计藻细胞密度, 计算OD750与细胞密度之间的线性回归方程。
比生长率(μ)的计算: μ= (lnNt – lnN0)/(t – t0),
式中Nt和N0分别为t时刻(t)和开始时(t0)的微藻细胞密度。
在山东某海湾近岸海域设置18个采样点, 采样站位见图 1, 采样时间为2020年3月、5月、8月、10月。参照韩典峰等[3]的方法采集及保存表层海水样品; 采用山东省地方标准《养殖水体中三嗪类、酰胺类、二硝基苯胺类除草剂的测定气相色谱-质谱法》[15]检测扑草净。
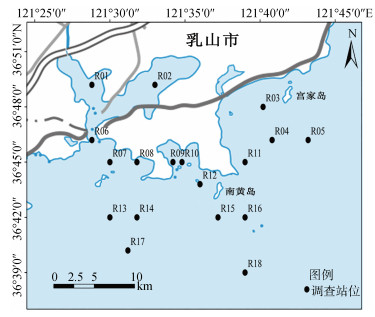 |
| 图 1 调查海域采样站位点[根据审图号鲁SG(2023)026号制作] Fig. 1 Sampling stations in the investigated sea area |
毒性数据来自美国EPA的ECOTOX数据库(https://cfpub.epa.gov/ecotox/)、Web of Science(http://apps.webofknowledge.com/)、中国知网(http://www.cnki.net/)和本研究实验数据。按照《海洋生物水质基准推导技术指南(试行)》[16]中采用SSD法对物种“5门8种”的要求, 海洋动物采用急性毒性实验的96 h半致死浓度(median lethal concentration, LC50)作为评估终点, 海洋微藻采用急性毒性实验24 h半效应浓度(median effect concentration, EC50)作为评估终点。对于同一物种相同暴露时间存在多个可用数据, 采用毒性值的几何平均值作为毒理数据, 而毒性值差异超过一个数量级的, 舍弃离群值数据。
数据筛选遵循准确性、相关性和可靠性的原则, 实验设计应依据国家或国际标准毒性测试方法, 依据《海洋生物水质基准推导技术指南(试行)》[16]执行。
1.5 数据处理实验结果取重复组的平均值, 用excel 2016对数据进行初步处理, 用SPSS 20.0中概率单位回归(Probit)方程对数据进行卡方检验, 分别计算LC50、EC50及95%置信区间。采用中华人民共和国生态环境部推荐的国家生态环境基准计算软件物种敏感度分布法EEC-SSD(1.0版)[17]拟合SSD曲线, 以对数浓度为横轴, 累计概率为纵轴建立坐标系, 对数据进行Anderson-Darling检验, 构建SSD曲线并计算5%物种危害浓度(HC5)。
1.6 生态风险表征采用欧盟发布的《风险评价技术指南》商值法[18]对调查海域表层海水中扑草净的生态风险进行定性评价。通过扑草净的环境监测浓度(environmental exposure concentration, EEC)除以PNEC得到风险熵(risk quotient, RQ), 来表征调查海域扑草净的生态风险。当RQ < 0.1时, 表明环境处于低风险; 当0.1≤RQ≤1时, 表明环境处于中风险; 当RQ > 1时, 表明环境处于高风险[19]。
2 结果与分析 2.1 急性毒性实验研究 2.1.1 扑草净对桡足类的急性毒性扑草净对4种海洋桡足类的急性毒性实验结果见表 2, 其96 h LC50分别为67.7、127、553和720 μg·L–1, 48 h LC50分别为339、377、1.15×103、1.51×103 μg·L–1, 4种桡足类对扑草净的敏感程度有明显差异, 具体为中华咸剑水蚤 > 太平洋纺锤水蚤 > 小毛猛水蚤 > 太平洋真宽水蚤。以扑草净对数质量浓度为横坐标(x)、死亡率为纵坐标(y)得出直线回归方程, 各组均有良好的线性相关性。桡足类的死亡率随扑草净质量浓度的升高、胁迫时间的延长而升高, 呈现明显的剂量-效应和时间-效应。
| 受试生物 | 时间/h | LC50/(μg·L−1) | 回归方程 | R2 | 95%可信限 |
| 中华咸剑水蚤 | 48 | 339 | y= –7.35+10.3x | 0.991 | 193~493 |
| 96 | 67.7 | y= –3.29+1.56x | 0.994 | 41.5~77.5 | |
| 太平洋纺锤水蚤 | 48 | 377 | y= –8.36+2.29x | 0.921 | 206~559 |
| 96 | 127 | y= –2.84+1.30x | 0.862 | 54.3~244 | |
| 太平洋真宽水蚤 | 48 | 1.15×103 | y= –16.7+9.23x | 0.919 | 867~1.35×103 |
| 96 | 553 | y= 3.24+1.18x | 0.901 | 418~680 | |
| 小毛猛水蚤 | 48 | 1.51×103 | y= –18.6+9.97x | 0.881 | 1.16×103~1.93×103 |
| 96 | 720 | y= 5.88+2.03x | 0.941 | 429~1.08×103 |
4种微藻的藻细胞密度与其OD750之间均有良好的线性相关性, 线性回归方程见表 3, 可用OD750预测其藻细胞密度。
| 受试微藻 | 回归方程 | 相关系数r |
| 亚心形扁藻 | y = 3.240 3x + 0.023 | 0.990 |
| 球等鞭金藻 | y = 10.155x + 0.003 1 | 0.992 |
| 纤细角毛藻 | y = 4.939 6x + 0.141 | 0.994 |
| 小新月菱形藻 | y = 13.474x –0.588 7 | 0.992 |
| 注: x为藻液OD750; y为藻细胞密度, 单位: ×106 cell·L–1 | ||
扑草净对4种微藻EC50见表 4, 其24 h EC50分别为9.94、15.8、55.1、36.8 μg·L–1, 72 h EC50分别为12.8、24.3、26.5、70.4 μg·L–1, 可以看出, 亚心形扁藻、球等鞭金藻敏感度明显高于纤细角毛藻、小新月菱形藻。
| 受试微藻 | 时间/h | EC50/(μg·L–1) | 回归方程 | R2 | 95%可信限 |
| 亚心形扁藻 | 24 | 9.94 | y= –2.12+1.18x | 0.875 | 3.82~15.8 |
| 72 | 12.8 | y= 3.24+2.64x | 0.953 | 4.82~20.8 | |
| 球等鞭金藻 | 24 | 15.8 | y= –1.83+2.51x | 0.923 | 7.35~26.5 |
| 72 | 24.3 | y= 1.46+1.93x | 0.859 | 8.56~39.7 | |
| 纤细角毛藻 | 24 | 55.1 | y= 0.95+4.07x | 0.906 | 40.3~70.9 |
| 72 | 26.5 | y= 1.61+1.29x | 0.915 | 15.4~46.7 | |
| 小新月菱形藻 | 24 | 36.8 | y= 3.95+3.03x | 0.983 | 22.9~58.7 |
| 72 | 70.4 | y= –1.58+3.22x | 0.897 | 35.6~106 |
搜集、筛选出符合要求的7门13科的13个物种的急性毒性数据, 如表 5所示, 涵盖了生态系统中生产者、初级消费者和高级消费者, 满足HJ 1260—2022要求的“5科8种”最少毒性数据。采用EEC-SSD(1.0版)拟合的SSD曲线, 如图 2所示, 经Anderson-Darling检验显示P > 0.05, 说明所用毒性数据符合正态分布, 因此本研究采用Log-Normal曲线, 得到扑草净的HC5为8.42 μg·L–1。欧盟《风险评价技术指南》[18]中指明, 采用SSD法推导PNEC时, 评价因子(assessment factor, AF)范围为1~5, 综合考虑数据数量与质量、物种结构、污染物的作用模式和统计方法的不确定性等[19], 参照国内大部分相关研究, AF取2, 基于HC5得到急性PNEC为4.21 μg·L–1。
| 物种分类 | 物种名称 | 96 h LC50和24 h EC50/(μg·L–1) | 参考文献 | |
| 门 | 科 | |||
| 棘皮动物门 | 刺参科 | 刺参幼参(Apostichopus japonicus) | 4.39×104 | [20] |
| 脊索动物门 | 鳉科 | 杂色鳉(Cyprinodon variegatus) | 5.10×103* | [21] |
| 节肢动物门 | 对虾科 | 凡纳滨对虾(Litopenaeus vannamei) | 8.91×103 | [22] |
| 糠虾科 | 巴西拟糠虾(Mysidopsis bahia) | 1.70×103 | [23] | |
| 猛水蚤科 | 小毛猛水蚤(Microsetella norvegica) | 720 | 本研究数据 | |
| 真宽水蚤科 | 太平洋真宽水蚤(Eurytemora pacifica) | 553 | 本研究数据 | |
| 纺锤水蚤科 | 太平洋纺锤水蚤(Acartia pacifica) | 127 | 本研究数据 | |
| 剑水蚤科 | 中华咸剑水蚤(Halicyclops sinensis) | 67.7 | 本研究数据 | |
| 硅藻门 | 角毛藻科 | 纤细角毛藻(Chaetoceros gracilis) | 55.1* | 本研究数据 |
| 菱形藻科 | 小新月菱形藻(Nitzschia closterium) | 36.8* | 本研究数据 | |
| 绿藻门 | 衣藻科 | 亚心形扁藻(Platymonas subcordiformis) | 9.94* | 本研究数据 |
| 金藻门 | 等鞭金藻科 | 球等鞭金藻(Isochrysis galbana) | 15.8* | 本研究数据 |
| 被子植物门 | 水鳖科 | 卵叶盐藻(Halophila ovalis) | 11.0* | [24] |
| 注: *为24 h EC50; 其余为96 h LC50 | ||||
 |
| 图 2 扑草净的急性毒性数据SSD曲线 Fig. 2 SSD curves of prometryn based on chronic toxicity data |
2020年3月、5月、8月、10月山东某海湾近岸海域表层海水中扑草净检出浓度见表 6, 各月份扑草净检出率均为100%, 浓度范围分别为15.0~1.07×103 ng·L–1, 24.4~2.04×103 ng·L–1, 2.18~90.7 ng·L–1, 8.96~170 ng·L–1, 结合图 1可以看出, 扑草净分布呈从近岸到海洋辐射状递减趋势; 3月份、5月份最高检出浓度1.07×103 ng·L–1 (R02)、2.04×103 ng·L–1 (R02)均达到μg·L–1级别, 且3月份、5月份各站位扑草净检出浓度明显高于8月份和10月份, 有明显的季节变化特征。
| 站位 | 2020年3月 | 2020年5月 | 2020年8月 | 2020年10月 |
| R01 | 478 | 143 | 87.4 | 155 |
| R02 | 1.07×103 | 2.04×103 | 90.7 | 33.7 |
| R03 | 54.8 | 43.0 | 32.7 | 34.3 |
| R04 | 57.4 | 80.0 | 27.9 | 40.6 |
| R05 | 43.4 | 59.3 | 2.18 | 44.2 |
| R06 | 289 | 124 | 67.4 | 170 |
| R07 | 214 | 109 | 52.7 | 120 |
| R08 | 179 | 100 | 44.5 | 16.3 |
| R09 | 152 | 101 | 53.3 | 78.0 |
| R10 | 121 | 83.0 | 41.8 | 68.5 |
| R11 | 68.6 | 55.8 | 50.6 | 16.5 |
| R12 | 105 | 98.4 | 37.6 | 36.9 |
| R13 | 39.8 | 36.2 | 43.3 | 28.6 |
| R14 | 15.4 | 49.8 | 41.7 | 28.3 |
| R15 | 88.8 | 57.8 | 34.6 | 35.9 |
| R16 | 36.9 | 46.3 | 32.9 | 31.5 |
| R17 | 36.2 | 46.4 | 58.7 | 40.4 |
| R18 | 15.0 | 24.4 | 37.5 | 8.96 |
采用商值法即每个站位的扑草净实测浓度除以PNEC来表征山东某海湾近岸海域表层海水中扑草净的生态风险, RQ如表 7所示。基于敏感物种急性毒性数据, 2020年3月、5月、8月、10月RQ范围为0.004~0.255, 0.006~0.484, 0.001~0.022, 0.002~0.040, 调查海域扑草净RQ均小于1.0。3月R01、R02两个站位, 5月份R02站位的RQ大于0.1, 为中风险, 其余站位和月份RQ均小于0.1, 为低风险。
| 站位 | 3月 | 5月 | 8月 | 10月 |
| R01 | 0.114* | 0.034 | 0.021 | 0.037 |
| R02 | 0.255* | 0.484* | 0.022 | 0.008 |
| R03 | 0.013 | 0.010 | 0.008 | 0.008 |
| R04 | 0.014 | 0.019 | 0.007 | 0.010 |
| R05 | 0.010 | 0.014 | 0.001 | 0.011 |
| R06 | 0.069 | 0.029 | 0.016 | 0.040 |
| R07 | 0.051 | 0.026 | 0.013 | 0.029 |
| R08 | 0.042 | 0.024 | 0.011 | 0.004 |
| R09 | 0.036 | 0.024 | 0.013 | 0.019 |
| R10 | 0.029 | 0.020 | 0.010 | 0.016 |
| R11 | 0.016 | 0.013 | 0.012 | 0.004 |
| R12 | 0.025 | 0.023 | 0.009 | 0.009 |
| R13 | 0.009 | 0.009 | 0.010 | 0.007 |
| R14 | 0.004 | 0.012 | 0.010 | 0.007 |
| R15 | 0.021 | 0.014 | 0.008 | 0.009 |
| R16 | 0.009 | 0.011 | 0.008 | 0.007 |
| R17 | 0.009 | 0.011 | 0.014 | 0.010 |
| R18 | 0.004 | 0.006 | 0.009 | 0.002 |
| 注: *为中风险 | ||||
通过搜集数据发现扑草净对国内海洋生物急性毒性数据较少, 为降低SSD法中由缺少本地物种急性毒性数据带来的不确定性, 本研究开展了扑草净对我国4种海洋桡足类、4种海洋微藻的急性毒性研究, 获得了8个急性毒性数据。《化学农药环境安全评价试验准则第13部分: 溞类急性活动抑制试验》[25]中, 采用EC50划分农药对溞急性毒性等级, 其中, 剧毒为48 h EC50≤0.1 mg·L–1、高毒为0.1 mg·L–1 < 48 h EC50≤1.0 mg·L–1、中毒为1.0 mg·L–1 < 48 h EC50≤10.0 mg·L–1、低毒为48 h EC50 > 10 mg·L–1, 参照该标准划分其毒性等级, 扑草净对太平洋纺锤水蚤、中华咸剑水蚤为高毒, 小毛猛水蚤、太平洋真宽水蚤为中毒。不同海洋微藻对污染物的敏感度差异可能与微藻自身的生物学特性有关[26]。小新月菱形藻、纤细角毛藻细胞壁外层为硅质壳体, 内层为纤维质, 能在一定程度上阻挡污染物进入藻细胞[27], 而亚心形扁藻细胞外仅有一层比较薄的纤维质细胞壁, 球等鞭金藻细胞裸露没有细胞壁[28], 因此2者对扑草净的敏感度更高, 这与李怡蕾等[29]得到的扑草净对三角褐指藻(Phaeodactylum tricornutum)、球等鞭金藻急性毒性规律一致。依据《化学农药环境安全评价试验准则第14部分: 藻类生长抑制试验》[14]中农药对藻类的毒性等级划分可知, 扑草净对4种海洋微藻均为高毒。不同海洋生物对扑草净的敏感度存在明显差异, 海洋微藻对扑草净的敏感度高于海洋动物。在今后研究中, 可增加扑草净对本地海洋贝类、鱼类等急性毒性研究, 补充相关研究数据, 以增加SSD曲线的可靠性。
基于7门13科的13个物种的急性毒性数据, 采用SSD法得到扑草净的HC5为8.42 μg·L–1, 推导得到其急性PNEC为4.21 μg·L–1, 鲜见有研究推导海洋环境中扑草净急性PNEC。徐雄等[30]与本研究采用不同的推导方法, 用1种生物的慢性无观察效应浓度(no observed effect concentration, NOEC)得到扑草净的慢性PNEC 1.1 μg·L–1; 郑磊等[31]筛选了扑草净对15种水生生物慢性毒性数据, 利用SSD法, 得到扑草净的淡水水质基准即慢性PNEC为82.4 ng·L–1。慢性毒性数据各种实验程序尚未标准化, 本研究未能获得充足、可靠的慢性毒性数据来推导扑草净对海洋生物的慢性毒性PNEC。有研究表明, 可以使用急性数据和急慢性数据的比率(Acute and chronic toxicity ratio, ACR)或急慢性比率的默认值, 计算其慢性PNEC, 使用该方法的前提是假设急性毒性数据和慢性毒性数据存在一定的关系, 而且这种关系在不同物种和化学物质之间是相同的[32]。本研究采用经济合作发展组织[33]、澳大利亚和新西兰环境和保护理事会[34]等推荐的ACR默认值10, 推导其慢性PNEC为0.421 μg·L–1, 高于郑磊等[31]推导的扑草净慢性PNEC 82.4 ng·L–1, 说明淡水生物对扑草净的敏感度高于海洋生物, 在海洋环境中扑草净生态评价中使用该PNEC对海洋敏感生物产生“过保护”结果, 即会导致生态风险偏高。因此, 本推导值可为我国近岸海洋环境中扑草净生态风险评价提供基础数据。
3.2 调查海域表层海水中扑草净污染状况及生态风险本调查海域沿岸海参、对虾等海水池塘养殖规模较大, 养殖过程中使用的含扑草净的净水剂、水质改良剂等随养殖尾水排入海洋, 可能会导致部分站位扑草净检出浓度较高; 依照山东省农业生产中扑草净的使用特点和规律, 扑草净大多在苗前使用, 入海河流上游地区使用的扑草净经地表径流、雨水冲刷最终也会排入海洋, 也可导致3月、5月份扑草净检出浓度较高。这与2015年5月—10月乔丹等[5]在乳山湾调查的扑草净变化规律一致。从4次调查结果来看, 除8月份R05站位外, 其余站位扑草净检出浓度均高于莱州湾海域表层海水中平均浓度(6.49 ng·L–1)[4]、渤海某海域海水中检出浓度(4.75 ng·L–1)[35], 3月份、5月份最高检出浓度均高于黄渤海近岸海域(627.5 ng·L–1)[6]、海南八门湾(440 ng·L–1)[7]最高检出浓度, 本调查海域表层海水中扑草净检出浓度略高于以上调查区域。个别站位扑草净浓度远高于其对4种桡足类的96 h LC50和4种微藻的24 h、96 h EC50, 说明该区表层海水中的扑草净可能会影响海洋浮游生物的生长。
由表 7可以看出, 2020年开展山东省某海湾表层海水中扑草净调查中, 3月R01、R02两个站位, 5月份R02站位的RQ大于0.1, 为中风险, 其余时间和站位均为低风险。本研究的生态风险评价基于我国近海典型海洋生物毒性数据建立的SSD曲线, 提高了本次生态风险评价的准确性、可靠性, 较为真实地反映了该海域表层海水中扑草净的生态风险。大量研究发现, 一定浓度的扑草净会对刺参(Apostichopus japonicus)[36]、四角蛤蜊(Mactra veneriformis)[10]、凡纳滨对虾(Penaeus vannamei)[37]、日本虎斑猛水蚤(Tigriopus japonicus)[38]等海洋动物产生一定的损伤, 如诱导或抑制抗氧化酶活力、损伤组织细胞、延长卵孵化时间、降低繁育能力等, 还会降低常见大型海藻叶绿素含量、抑制其光合作用[39], 显著改变浮游植物和浮游细菌的群落结构[40]。本研究海域的扑草净残留可能会对该海域海参、贝类、桡足类、微藻等海洋生物产生一定的干扰, 进而影响海洋生态系统稳定性, 应引起重视。
3.3 不确定性分析生态风险评价过程中不确定性不可避免, 本研究不确定性主要来源于: 扑草净在实验室条件下开展的毒性研究与真实环境暴露存在生态上的差异、采集的毒性数据物种覆盖度不全面; 调查海域的扑草净时空分布不均匀; 采用的SSD模型和风险表征方法等。
开展对海洋桡足类、海洋微藻的急性毒性研究中, 由于实验室环境和海洋环境暴露存在较大的生态差异, 由污染调查数据可知海洋环境中扑草净暴露存在季节性变化, 生物体受到扑草净影响存在间歇性, 在浓度较低的时间, 生物体可能会自身修复由扑草净暴露引起的非永久性损伤。采用的毒性数据严格按照相关原则搜集和筛选, 涵盖了海洋生态系统中生产者、初级消费者和高级消费者, 同时采用了本研究获得的山东近岸常见海洋动物的毒性数据, 增加本地物种的毒性数据可能降低风险评价的不确定性。本研究PNEC是基于可控的室内实验获得, 与野外原位实验及海洋环境存在一定差异, 相比实验室, 海洋生态系统稳定性较高, 具有较强的抵抗力和恢复力, 本研究生态风险可能会被高估。同时, SSD模型的构建和风险表征方法多种多样, 不同的研究人员对其理解不同、应用方式不同, 风险等级可能会有一定差异。
4 结论本研究通过急性毒性实验得到扑草净对8种海洋生物的急性毒性数据; 基于我国13个海洋生物毒性数据建立SSD曲线, 得到HC5为8.42 μg·L–1、急性毒性PNEC为4.21 μg·L–1。2020年山东省某海湾近岸海域扑草净分布有明显的区域和季节变化特征, 其残留可能会对该海域海洋生物产生干扰。采用商值法评价该海域扑草净的生态风险, 3月、5月个别站位点具有中风险, 应持续关注扑草净长期危害对海洋生态系统稳定性的影响。基于本地生物毒性数据的SSD法推导的PNEC, 提高了本次生态风险准确性、可靠性, 可较为真实地反映该海域扑草净的生态风险状况。本研究可望为我国近岸海洋环境中扑草净生态风险评估提供基础数据和方法参考, 为相关海洋环境水质基准的制定提供数据支撑。
| [1] |
DAYAN F E. Current status and future prospects in herbicide discovery[J]. Plants-Basel, 2019, 8(9): 341. DOI:10.3390/plants8090341 |
| [2] |
刘明杰, 高亚平, 张玉, 等. 除草剂对海草的影响研究进展[J]. 海洋科学, 2023, 47(4): 165-175. LIU Mingjie, GAO Yaping, ZHANG Yu, et al. A review of the effects of herbicides on seagrass[J]. Marine Sciences, 2023, 47(4): 165-175. |
| [3] |
韩典峰, 秦华伟, 张华威, 等. 黄河三角洲贝类增养殖区海水中16种除草剂污染特征及评价[J]. 海洋环境科学, 2022, 41(5): 683-688. HAN Dianfeng, QIN Huawei, ZHANG Huawei, et al. Pollution characteristics and evaluation of 16 herbicides in seawater of shellfish culture area in Yellow River Delta[J]. Marine Environmental Science, 2022, 41(5): 683-688. |
| [4] |
徐英江, 刘慧慧, 任传博, 等. 莱州湾海域表层海水中三嗪类除草剂的分布特征[J]. 渔业科学进展, 2014, 35(3): 34-39. XU Yingjiang, LIU Huihui, REN Chuanbo, et al. Distributions of the triazine herbicides in the surface seawater of Laizhou Bay[J]. Progress in Fishery Sciences, 2014, 35(3): 34-39. |
| [5] |
乔丹, 刘小静, 张华威, 等. 山东沿海贝类中除草剂污染特征及风险评价[J]. 中国渔业质量与标准, 2017, 7(3): 22-29. QIAO Dan, LIU Xiaojing, ZHANG Huawei, et al. Pollution characteristics and risk assessment of herbicide residues in shellfish from Shandong coastal area[J]. Chinese Fishery Quality and Standards, 2017, 7(3): 22-29. |
| [6] |
YANG L Q, LI H M, ZHANG Y Y, et al. Environmental risk assessment of triazine herbicides in the Bohai Sea and the Yellow Sea and their toxicity to phytoplankton at environmental concentrations[J]. Environment International, 2019, 133(Part A): 105175. |
| [7] |
DSIKOWITZKY L, IVETA NGUYEN T M, KONZER L, et al. Occurrence and origin of triazine herbicides in a tropical coastal area in China: A potential ecosystem threat[J]. Estuarine, Coastal and Shelf Science, 2020, 235(3): 106612. |
| [8] |
MUNARON D, TAPIE N, BUDZINSKI H, et al. Pharmaceuticals, alkylphenols and pesticides in Mediterranean coastal waters: Results from a pilot survey using passive samplers[J]. Estuarine, Coastal and Shelf Science, 2012, 114(12): 82-92. |
| [9] |
MAI C, THEOBALD N, LAMMEL G, et al. Spatial, seasonal and vertical distributions of currently-used pesticides in the marine boundary layer of the North Sea[J]. Atmospheric Environment, 2013, 75(8): 92-102. |
| [10] |
黄会, 王共明, 任利华, 等. 扑草净对四角蛤蜊抗氧化酶活性及组织细胞的影响[J]. 中国水产科学, 2021, 28(11): 1457-1465. HUANG Hui, WANG Gongming, REN Lihua, et al. Effect of prometryn on the antioxidant enzyme activities and histopathology of Mactra veneriformis[J]. Journal of Fishery Sciences of China, 2021, 28(11): 1457-1465. |
| [11] |
DING T T, ZHANG Y H, ZHU Y, et al. Deriving water quality criteria for China for the organophosphorus pesticides dichlorvos and malathion[J]. Environmental Science and Pollution Research International, 2019, 26(33): 34622-34632. |
| [12] |
张家玮, 齐观景, 赵昊铎, 等. 基于物种敏感性分布评价长三角地区地表水壬基酚生态风险[J]. 生态毒理学报, 2020, 15(3): 134-148. ZHANG Jiawei, QI Guanjing, ZHAO Haoduo, et al. Ecological risk assessment of nonylphenol in surface waters of the Yangtze River Delta based on species sensitivity distribution model[J]. Asian Journal of Ecotoxicology, 2020, 15(3): 134-148. |
| [13] |
周永欣, 章宗涉. 水生生物毒性实验方法[M]. 北京: 农业出版社, 1989. ZHOU Yongxin, ZHANG Zongshe. Toxicity test methods for aquatic organisms[M]. Beijing: Agricultural Press, 1989. |
| [14] |
中华人民共和国国家质量监督检验检疫总局. 化学农药环境安全评价试验准则第14部分: 藻类生长抑制试: 验GB/T 31270.14—2014[S]. 北京: 中国标准出版社, 2015. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. Test guidelines on environmental safety assessment for chemical pesticides. Part 14: Alga growth inhibition test: GB/T 31270.14—2014[S]. Beijing: Standards Press of China, 2015. |
| [15] |
山东省市场监督管理局. 养殖水体中三嗪类、酰胺类、二硝基苯胺类除草剂的测定气相色谱-质谱法: DB37/T 4013—2020[S]. 济南: 山东省市场监督管理局, 2020. Shandong Administration for Market Regulation. Determination of triazine, amide, dinitroaniline herbicides in aquaculture water by gas chromatography mass spectrometry: DB37/T 4013—2020[S]. Jinan: Shandong Administration for Market Regulation, 2020. |
| [16] |
中华人民共和国生态环境部. 海洋生物水质基准推导技术指南(试行): HJ 1260—2022[S]. 北京: 中国环境科学出版社, 2022. Ministry of Ecology and Environment of the People's Republic of China. Technical guideline for deriving water quality criteria for marine organisms(on trial): HJ 1260—2022[S]. Beijing: China Environmental Science Press, 2022. |
| [17] |
国家生态环境基准专家委员会. 国家生态环境基准计算软件物种敏感度分布法[CP/OL]. (2022-03-04). https://www.mee.gov.cn/ywgz/fgbz/hjjzgl/mxrj/202203/t20220304_970658.shtml. National Ecological Environment Criteria Expert Committee. National ecological environment criteria calculation software species sensitivity distribution method, EEC SSD[CP/OL]. (2022-03-04). https://www.mee.gov.cn/ywgz/fgbz/hjjzgl/mxrj/202203/t20220304_970658.shtml. |
| [18] |
European Commission. European commission technical guidance document in support of commission directive 93/67/EEC on risk assessment for new notified substances and commission regulation (EC) No 1488/94 on risk assessment for existing substances, Part Ⅱ. In: Commission E (Ed.)[R]. Luxembourg: Office for Official Publications of the European Communities, 2003.
|
| [19] |
GAO P, LI Z Y, GIBSON M, et al. Ecological risk assessment of nonylphenol in coastal waters of China based onspecies sensitivity distribution model[J]. Chemosphere, 2014, 104(6): 113-119. |
| [20] |
曾范双. 除草剂扑草净对刺参幼参生长、抗氧化及组织结构的影响[D]. 大连: 大连海洋大学, 2022. ZENG Fanshuang. Effects of chronic prometryn exposure on growth performance, antioxidative status, and morphology in sea cucumber (Apostichopus japonicus)[D]. Dalian: Dalian Ocean University, 2022. |
| [21] |
Environmental Protection Agency. Reregistration eligibility decision (RED) prometryn [EB/OL]. (1996-02-01). http://www.epa.gov/pesticides/reregistration/statuspagep.html.
|
| [22] |
谢剑, 戴习林, 臧维玲, 等. 扑草净对两种虾和两种水草的毒性研究[J]. 湖南农业科学, 2010, 40(23): 147-150. XIE Jian, DAI Xilin, ZANG Weiling, et al. The toxicity of prometryne on two varieties of shrimp and two Varieties of aquatic-weed[J]. Hunan Agricultural Sciences, 2010, 40(23): 147-150. |
| [23] |
SURPRENANT D. Acute toxicity of prometryn technical to mysid shrimp (Mysidopsis bahia)[R]. Massachusetts: Spring born Life Sciences, Inc, 1988: 52.
|
| [24] |
WILKINSON D A, COLLIER C J, FLORES F, et al. Florita flores acute and additive toxicity of ten photosystem-Ⅱ herbicides to seagrass[J]. Scientific Reports, 2015, 5(11): 17443. |
| [25] |
中华人民共和国国家质量监督检验检疫总局. 化学农药环境安全评价试验准则第13部分: 溞类急性活动抑制试验: GB/T 31270.13—2014[S]. 北京: 中国标准出版社, 2015. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. Test guidelines on environmental safety assessment for chemical pesticides—Part 13: Daphnia sp. acute immobilisation test: GB/T 31270.13—2014[S]. Beijing: Standards Press of China, 2015. |
| [26] |
王林林, 张光富, 何谐, 等. 除草剂百草枯对浮萍科不同植物的毒性效应比较[J]. 生态学杂志, 2013, 32(6): 1551-1556. WANG Linlin, ZHANG Guangfu, HE Xie, et al. Comparison of toxic effects of herbicide paraquat on different plants of duckweed family[J]. Chinese Journal of Ecology, 2013, 32(6): 1551-1556. |
| [27] |
马健荣, 刘明, 徐信, 等. 硅藻研究与应用展望[J]. 山东农业科学, 2010, 42(8): 52-56. MA Jianrong, LIU Ming, XU Xin, et al. Prospects for research and application of diatoms[J]. Shandong Agricultural Sciences, 2010, 42(8): 52-56. |
| [28] |
LEMAHIEU C, BRUNEEL C, DEJONGHE C, et al. The cell wall of autotrophic microalgae influences the enrichment of long chain omega-3 fatty acids in the egg[J]. Algal Research, 2016, 16(6): 209-215. |
| [29] |
李怡蕾, 梁伟, 赵子昂, 等. 三嗪除草剂扑草净对海洋浮游植物群落的影响-基于对微藻种群动态、种间竞争和光合能力的分析[J]. 中国环境科学, 2023, 43(10): 5591-5603. LI Yilei, LIANG Wei, ZHAO Ziang, et al. Effects of triazine herbicide prometryn on marine phytoplankton communities—Based on analysis of microalgae population dynamics, interspecific competition and photosynthetic capacity[J]. China Environmental Science, 2023, 43(10): 5591-5603. |
| [30] |
徐雄, 李春梅, 孙静, 等. 我国重点流域地表水中29种农药污染及其生态风险评价[J]. 生态毒理学报, 2016, 11(2): 347-354. XU Xiong, LI Chunmei, SUN Jing, et al. Residue characteristics and ecological risk assessment of twenty-nine pesticides in surface water of major river-basin in China[J]. Asian Journal of Ecotoxicology, 2016, 11(2): 347-354. |
| [31] |
郑磊, 杨文龙, 董亮, 等. 扑草净水环境质量基准及风险评估[J]. 中国环境科学, 2021, 41(8): 3825-3831. ZHENG Lei, YANG Wenlong, DONG Liang, et al. Derivation of water quality criteria and ecological risk assessment for prometryn[J]. China Environmental Science, 2021, 41(8): 3825-3831. |
| [32] |
WARNE M S J. Derivation of the Australian and New Zealand water quality guidelines for toxicants[J]. Australasian Journal of Ecotoxicology, 2001, 7(2): 123-136. |
| [33] |
OECD. Report of the OECD workshop on extrapolation of laboratory aquatic toxicity data to the real environment[R]. Paris: OECD. Environment Monographs No. 59. 1992.
|
| [34] |
ARMCANZ and ANZECC. Paper No. 4. Australian and New Zealand guidelines for fresh and marine water quality[R]. Australia: Australian and New Zealand Environment and Conservation Council and Agriculture and Resource Management Council of Australia and New Zealand, 2000: 1-132.
|
| [35] |
任传博, 田秀慧, 张华威, 等. 固相萃取-超高效液相色谱-串联质谱法测定海水中13种三嗪类除草剂残留量[J]. 质谱学报, 2013, 34(6): 353-361. REN Chuanbo, TIAN Xiuhui, ZHANG Huawei, et al. Determination of triazine herbicides in seawater using solid phase extraction-UPLC-MS/MS[J]. Journal of Chinese Mass Spectrometry Society, 2013, 34(6): 353-361. |
| [36] |
ZENG F H, WU L, REN X, et al. Effects of chronic prometryn exposure on antioxidative status, intestinal morphology, and microbiota in sea cucumber (Apostichopus japonicus)[J]. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2021, 250(12): 109187. |
| [37] |
周桂娴, 马荣荣, 杨宗英, 等. 扑草净、辛硫磷和亚甲基蓝制剂对凡纳滨对虾的急性毒性及组织病理改变[J]. 生态毒理学报, 2020, 15(6): 279-289. ZHOU Guixian, MA Rongrong, YANG Zongying, et al. Acute toxicity of prometryn, phoxim, and methylene blue and their histopathological effects on Penaeus vannamei[J]. Asian Journal of Ecotoxicology, 2020, 15(6): 279-289. |
| [38] |
WANG D, YANG G X, RU S G, et al. Herbicide prometryn adversely affects the development and reproduction of Tigriopus japonicus by disturbing the ecdysone signal pathway and chitin metabolic pathway[J]. Aquatic Toxicology, 2023, 254(1): 106378. |
| [39] |
高亚平, 蒋增杰, 杜美荣, 等. 除草剂扑草净和阿特拉津对海草与大型藻类的毒性比较[J]. 水生生物学报, 2017, 41(4): 930-934. GAO Yaping, JIANG Zengjie, DU Meirong, et al. Comparison of the herbicide atrazine and prometryn's toxicity on seagrass and seaweed[J]. Acta Hydrobiologica Sinica, 2017, 41(4): 930-934. |
| [40] |
YANG L Q, MOU S L, LI H M, et al. Terrestrial input of herbicides has significant impacts on phytoplankton and bacterioplankton communities in coastal waters[J]. Limnology and Oceanography, 2021, 66(11): 4028-4045. |
 2024, Vol. 48
2024, Vol. 48


