
文章信息
- 金维美, 肖昌延, 乔燕, 冯丽娟. 2024.
- JIN Weimei, XIAO Changyan, QIAO Yan, FENG Lijuan. 2024.
- 裂片石莼水培液对海水养殖环境分离弧菌的抑制特性及其活性物质类型分析
- Inhibitory performance of Ulva fasciata hydroponic solution on Vibro from mariculture and analysis of its active substances
- 海洋科学, 48(6): 21-32
- Marine Sciences, 48(6): 21-32.
- http://dx.doi.org/10.11759/hykx20230803001
-
文章历史
- 收稿日期:2023-08-03
- 修回日期:2023-11-17
2. 浙江海洋大学 国家海洋设施养殖工程技术研究中心, 浙江 舟山 316022;
3. 浙江省石油化工环境污染控制重点实验室, 浙江 舟山 316022
2. National Engineering Research Center of Marine Facility Aquaculture, Zhejiang Ocean University, Zhoushan 316022, China;
3. Zhejiang Provincial Key Laboratory of Petrochemical Engineering and Environmental Pollution Control, Zhoushan 316022, China
近年来, 水产养殖业的迅速发展为全球经济发展带来巨大利益[1-3]。但随着海水养殖大规模的推广应用, 海水养殖病害也频频发生。其中, 弧菌(Vibrio, V.)是海水养殖鱼类中最具威胁性的一类病原菌, 严重制约海水养殖业的健康持续发展[4]。弧菌种类多样, 包括溶藻弧菌(V. alginolyticus)、创伤弧菌(V. vulnificus)、副溶血性弧菌(V. parahaemolyticus)、哈维弧菌(V. harveyi)等[5]。弧菌可在海洋生物如鱼类、虾类和贝壳类等中积累成为食源性病原菌威胁人类健康[6]。据报道, 海水和双壳类样品中副溶血性弧菌检出率较高, 是许多国家海鲜传播疾病最常见的病原体之一[7], 受副溶血性弧菌感染的患者出现典型的呕吐、腹泻、肠胃炎等临床症状[8]。栖息在海洋和河口环境中的溶藻弧菌也是引起对虾病害的主要细菌病原体之一, 侵入对虾会损害肝胰腺等组织器官, 引起其生理功能改变[9]。目前, 抗菌药物因其具有见效快、范围广、操作简单等优势成为防治海洋细菌性疾病的常见手段。然而, 抗生素的滥用及药物残留使得细菌产生耐药性, 从而严重威胁生态环境的平衡[10-11]。因此, 关注海洋弧菌污染并合理使用抗菌药物降低耐药性意义重大。
海藻除了能够显著降低水环境中的氮、磷等营养物质, 净化水质外[12], 还具有良好的抗菌活性, 是一种天然药物, 可用于预防和治疗水产养殖中细菌感染导致的疾病[13]。目前, 对大型海藻抑菌作用的研究主要集中于提取物上, 研究发现六种海藻(线形硬毛藻、刚毛藻、硬江蓠、纤细江蓠、龙须菜和浒苔)的氯仿/甲醇脂质提取物对奥氏弧菌、杀鲑弧菌、溶藻弧菌和创伤弧菌具有较高的抗菌活性[14]; 将硬毛藻乙醇提取物注射到对虾的肌肉中, 发现其对副溶血弧菌表现出良好的抗氧化和抗菌活性[15]; 红海藻、马尾藻的提取物对副溶血弧菌和哈维氏弧菌具有抑制作用[16-17]。绿藻门石莼属的裂片石莼(Ulva fasciata)作为广泛分布的经济型海藻, 其有机提取物在抑制弧菌等病原菌方面表现出比其他海藻更强的广谱抑菌活性[18]。裂片石莼含有多糖、蛋白质、萜类、氨基酸和脂肪酸等多种活性物质, 其提取物对耐药病原菌有显著抑制作用[19-21]。值得关注的是, 有研究发现栽培的活体大型海藻在海水环境中亦能对弧菌起到干扰作用[22-23], 且活体海藻被证明能够改善虾对副溶血弧菌的免疫反应[24]。课题组研究也发现, 裂片石莼活体组织与副溶血性弧菌共培养1 d后, 弧菌抑制率超过90%, 其运动行为和生物膜形成受到不同程度的抑制, 并发现裂片石莼上调差异基因富集在13~16种代谢产物合成通路上, 包括萜类、不饱和脂肪酸、甾醇、肽类等[25-26], 这些都与分泌的抑菌物质息息相关。然而, 有关大型海藻水培液中活性物质的结构分析罕见报道。本文以裂片石莼为代表性海藻, 分析不同条件下裂片石莼水培液的组成成分及其对分离到的不同耐药弧菌株的抑菌作用, 以期对海水养殖弧菌病害的预防和治疗提供参考。
1 材料与方法 1.1 实验材料裂片石莼(Ulva fasciata)购自于广东省汕头市南澳岛(117°02′E, 23°42′N), 清洗干净后置于人工海水(1 kg海水素溶于28.5 L纯水, 盐度为35, 海水素购自青岛海之盐水族科技有限公司)中适应性培养2 d。为减少细菌的影响, 用抗生素(0.75 mg/L多黏菌素、0.75 mg/L氯霉素、0.9 mg/L新霉素和100 mg/L氨苄青霉素)处理48 h[27]。
为获得不同密度海藻分泌物水培液, 称取上述新鲜裂片石莼1.25 g、2.5 g、5 g、10 g和分别置于1 L灭菌后的人工海水中培养(光强为(200±25) μmol/m2/s, 光周期为24 h光照: 0 h黑暗, 25 ℃下持续曝气)。收集培养1 d和3 d的水培液, 通过0.22 μm的无菌滤膜过滤后储存在无菌离心管中用于后续实验。
用于分离弧菌的养殖水、沉积物和养殖动物样品分别从浙江省舟山市普陀区朱家尖的白虾、南美白对虾和菲律宾蛤仔3种不同海水养殖场中采集。
药敏纸片: 头孢唑林(Cefazolin)、头孢他啶(Ceftazidime)、头孢噻肟(Cefotaxime)、头孢西丁(Cefoxitin)、阿莫西林(Amoxicillin)、氨苄青霉素(Ampicillin)、哌拉西林(Piperacillin)、左氧氟沙星(Levofloxacin Tablets)、美罗培南(Meropenem)、亚胺培南(Imipenem)、环丙沙星(Ciprofloxacin)、阿米卡星(Amikacin)、卡那霉素(Kanamycin)、复方新诺明(Sulfamethoxazole)、庆大霉素(Gentamycin)、氯霉素(Chloramphenicol)、四环素(Tetracycline)、链霉素(Streptomycin), 以上全部购自于杭州微生物试剂有限公司。实验药剂邻苯二甲酸单(2-乙基己基)酯(MEHP)、乙缩醛(Acetal)、2-(4-羟基苯)乙醇(p-HPEA)和2, 4, 6-三溴苯酚(TBP)购于上海阿拉丁生化科技股份有限公司, 阿莫西林、氨苄青霉素、头孢唑啉和哌拉西林购于上海源叶生物科技有限公司。
1.2 弧菌分离鉴定和耐药性表征 1.2.1 弧菌分离鉴定取10 mL水样转移到40 mL 3% NaCl碱性蛋白胨水(APW)中; 取10 g沉积物加入10 mL人工海水并离心(4 000 r/min, 10 min); 将虾、蛤仔内部组织肉经研磨后加入10 mL蒸馏水离心(4 000 r/min, 10 min), 将上清液加入到3% NaCl APW中, 并在37 ℃条件下培养24 h获得不同的菌悬液。采用平板划线分离法, 将菌悬液用接种环沾取至硫代硫酸盐柠檬酸盐胆汁酸盐蔗糖琼脂(TCBS)和法国科玛嘉培养基(CHROMagar™)上纯化鉴定, 经多次划线分离后获得较纯的菌株。将分离菌株按照国家标准方法GB 4789.7-2013进行生化鉴定[28], 并进一步进行DNA提取和16S rDNA测序以鉴定菌种。
1.2.2 分离弧菌耐药性表征参考临床和实验室标准化协会[29]推荐的纸片扩散法检测分离弧菌对各种常见抗生素的耐药性。用无菌棉拭蘸取0.5麦氏浊度(1.0×108 CFU/mL)的菌悬液涂布于Mueller-Hinton琼脂平板表面, 再将抗生素药敏纸片贴至平板上, 37 ℃培养24 h后测量抑菌圈的直径大小并判断其药物敏感(sensitive, S)、中介(intermediate, I)及耐药(resistant, R)水平(表 1)。
| 抗生素 | 抑菌圈直径/mm | ||
| 敏感(S) | 中介(I) | 耐药(R) | |
| 阿莫西林 | ≥18 | 14~17 | ≤13 |
| 氨苄青霉素 | ≥17 | 14~16 | ≤13 |
| 头孢唑林 | ≥18 | 15~17 | ≤14 |
| 哌拉西林 | ≥21 | 18~20 | ≤17 |
| 美罗培南 | ≥16 | 14~15 | ≤13 |
| 阿米卡星 | ≥17 | 15~16 | ≤14 |
| 氨苄青霉素 | ≥23 | 15~22 | ≤14 |
| 头孢西丁 | ≥18 | 15~17 | ≤14 |
| 卡那霉素 | ≥18 | 14~17 | ≤13 |
| 头孢他啶 | ≥18 | 15~17 | ≤14 |
| 环丙沙星 | ≥21 | 16~20 | ≤15 |
| 左氧氟沙星 | ≥17 | 14~16 | ≤13 |
| 庆大霉素 | ≥15 | 13~14 | ≤12 |
| 亚胺培南 | ≥16 | 14~15 | ≤13 |
| 氯霉素 | ≥18 | 13~17 | ≤12 |
| 链霉素 | ≥15 | 12~14 | ≤11 |
| 复方新诺明 | ≥16 | 11~15 | ≤10 |
| 四环素 | ≥19 | 15~18 | ≤14 |
采用改良后的紫外分光光度法检测弧菌的生长情况[30]。将分离的弧菌转移到3% NaCl胰蛋白胨大豆肉汤(TSB)中培养获得菌悬液, 通过稀释分别获得1.0×105 CFU/mL和1.0×103 CFU/mL的稀释液, 用酶标仪在600 nm处每隔1 h测定吸光度, 计算不同弧菌24 h内的生长变化, 以无弧菌的3% NaCl TSB溶液作为空白对照, 设置3组平行。
分别取9 mL不同密度的裂片石莼水培液于不同试管中作为实验组, 加入1 mL弧菌菌悬液(1×105 CFU/mL); 阳性组为9 mL的人工海水和1 mL相同浓度的弧菌菌悬液; 分别以9 mL的不同密度裂片石莼水培液和人工海水作为实验组和阳性组的阴性对照, 并加入1 mL灭菌的3% NaCl TSB溶液。所有组别均设置3个生物学重复, 在37 ℃恒温培养箱中培养12 h测定OD600nm值。弧菌抑制率计算公式为:
| I=100×(A−B)/A, | (1) |
| A=C−D, | (2) |
| B=E−F, | (3) |
其中I为弧菌抑制率(%), A为对照组弧菌OD600 nm, B为实验组弧菌OD600 nm, C为阳性组OD600 nm, D为阳性组的阴性对照OD600 nm, E为实验组OD600 nm, F为实验组的阴性对照OD600 nm。
1.3.2 水培液成分分析利用固相萃取(Waters OAsis HLB固相萃取柱)将过滤后的裂片石莼水培液和人工海水浓缩到固相小柱中, 控制流速低于5 mL/min, 每根固相小柱通过2 L样品溶液。加样结束后, 使用30 mL超纯水进行淋洗以洗去柱内杂质, 继续使用真空泵抽干1 h。取10 mL甲醇加至固相小柱中洗脱, 分3~4次进行, 最后将洗脱液通过旋转蒸发仪(35 ℃)浓缩至1 mL, 0.22 μm过滤除菌后备氮气吹干。加入80 μL甲氧铵盐酸盐吡啶溶液(15 mg/mL)涡旋2 min后于37 ℃下进行90 min肟化反应, 再加入80 µL双(三甲基硅烷基)三氟乙酰胺(含1%三甲基氯硅烷)衍生试剂, 涡旋2 min后于70 ℃反应1 h, 室温静置30 min, 采用气相色谱-质谱联用技术(GC-MS)进行检测。
GC-MS分析仪器为8890B-5977B气相色谱质谱联用仪(Agilent, USA), 进样量为1 µL, 分流比为10∶1, 色谱柱为DB-5MS毛细管柱。进样口温度260 ℃, 载气为高纯氦气, 程序升温60~310 ℃, 质谱仪电子轰击能量70 eV。GC-MS的原始文件通过MassHunter workstation Quantitative Analysis(v10.0.707.0)进行搜库鉴定及数据预处理, 将质谱信息与代谢数据库(主要为Fiehn database等商业数据库以及自建的数据库)进行匹配, 根据质谱匹配度鉴定代谢物并予以分析。
1.3.3 裂片石莼水培液主要成分对弧菌的最小抑菌采用微量肉汤稀释法检测代谢物对弧菌的最小抑菌浓度(minimum inhibitory concentration, MIC)[31], 同时以抗生素阿莫西林、氨苄青霉素、头孢唑啉和哌拉西林对弧菌的MIC为参照。在96孔板中通过二倍稀释法得到不同浓度水培液代谢物和抗生素的稀释液, 将100 μL稀释液与等量菌悬液(1.0×105 CFU/mL)于37 ℃培养24 h后, 以孔内完全澄清, 且浓度最低孔的浓度为MIC。
1.4 统计分析方差分析(ANOVA)用于估计统计学上的显著差异, 单样本t检验用于比较样本均值与总体均值之间的差异(IBM SPSS Statistics 26.0), P < 0.05为显著差异。使用Origin 2021绘制主成分分析(PCA), 将PC1和PC2绘制在一起, 根据数据在空间某一方向的投影值的距离进行比较分析, 以确定不同培养时间和密度下的海藻水培液的化合物成分差异。
2 结果与讨论 2.1 分离弧菌的生化鉴定与耐药性表征16S rDNA测序结果显示, 6株与弧菌属同源性超过99%的菌株, 分别为1株副溶血性弧菌(Vp. W1)、1株梅氏弧菌(Vm. R3)、1株锡那罗州弧菌(Vs. W2)和3株溶藻弧菌(Va. W1、Va. S1、Va. M3)(表 2)。6株弧菌均为有动力的革兰氏阴性菌, 且在无盐环境中不能生长。其中, 溶藻弧菌和Vs. W2在高浓度NaCl(10%)环境中可以旺盛生长, 而Vp. W1和Vm. R3只能在3%~8%的NaCl环境中生长。Vs. W2和Vm. R3的氧化酶为阴性反应, 菌落外围有透明环, 具有β-溶血性, 溶血性是决定弧菌毒力的重要特征[32], 因此其致病性较强; 而其余4株弧菌均无透明溶血环, 无致病性, 这可能与它们是否存在溶血素基因相关[33]。
| 16S rDNA | 菌株 | 菌源 | 氧化酶 | 革兰氏染色 | 三糖铁琼脂 | 溶血性 | 嗜盐性实验NaCl/% | ||||
| 0 | 3 | 6 | 8 | 10 | |||||||
| 副溶血性弧菌 | Vp. W1 | 白虾养殖水 | + | + | + | – | – | + | + | + | – |
| 锡那罗州弧菌 | Vs. W2 | 对虾养殖水 | – | + | + | + | – | + | + | + | + |
| 梅氏弧菌 | Vm. R3 | 蛤仔 | – | + | + | + | – | + | + | + | – |
| 溶藻弧菌 | Va. W1 | 白虾养殖水 | + | + | + | – | – | + | + | + | + |
| Va. S1 | 白虾 | + | + | + | – | – | + | + | + | + | |
| Va. M3 | 蛤仔养殖沉积物 | + | + | + | – | – | + | + | + | + | |
| 注: +表示为阳性反应, –表示为阴性反应, Vp. W1: 来源于白虾养殖水的副溶血性弧菌, Vs. W2: 来源于对虾养殖水的锡那罗州弧菌, Vm. R3: 来源于蛤仔的梅氏弧菌, Va. W1: 来源于白虾养殖水的溶藻弧菌, Va. S1: 来源于白虾的溶藻弧菌, Va. M3: 来源于蛤仔养殖沉积物的溶藻弧菌 | |||||||||||
分离弧菌对不同抗生素的耐药水平和药敏性见图 1。抗生素阿莫西林和氨苄青霉素对6株弧菌的抑菌圈直径均小于13 mm, 表明弧菌均对阿莫西林和氨苄青霉素耐药。抗生素哌拉西林对3株溶藻弧菌和Vp. W1的抑菌圈直径小于17 mm, 对Vs. W2的抑菌圈直径小于21 mm, 耐药率和中介率分别为66.7%和16.7%。另外, 抗生素头孢唑林和卡那霉素分别对Va. S1和Va. M3的直径小于18 mm, 中介率均为16.7%。抗生素链霉素对Va. S1和Va. M3的直径小于15 mm, 抗生素环丙沙星对Va. S1和Va. W1的直径小于21 mm, 两种抗生素的中介率均为33.3%。然而, 所有弧菌均对其余抗生素头孢他啶、头孢西丁、头孢噻肟、美罗培南、亚胺培南、阿米卡星、庆大霉素、左氧氟沙星、氯霉素、四环素、复方新诺明敏感。因此, 3株溶藻弧菌和Vp. W1具有阿莫西林、氨苄青霉素和哌拉西林三重耐药性, Vs. W2和Vm. R3则有阿莫西林和氨苄青霉素双重耐药性, 均为β-内酰胺类抗生素。有研究报道, 从贝类和海水样品中分离的弧菌有14.3%至50.0%对至少3种抗生素表现出多重抗生素耐药性, 并且对氨苄青霉素和头孢唑林的耐药率均达50%以上, 对卡那霉素、甲氧嘧啶和链霉素等也具有中等耐药水平[34]。可见, 对多种抗生素耐药的病原菌在海水养殖环境中普遍存在。
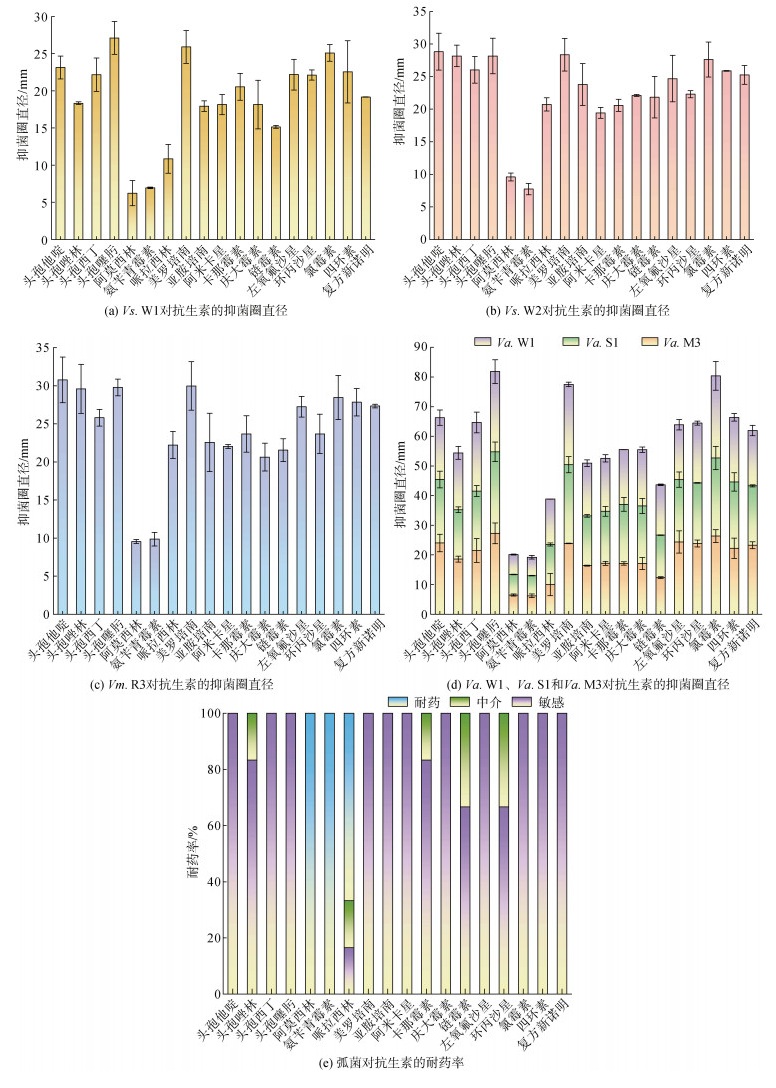 |
| 图 1 弧菌对抗生素的抑菌圈直径(a-d)及耐药率(e) Fig. 1 Diameter of inhibition zone (a-d) and resistance rate (e) of Vibrio to antibiotics 注: Vp. W1: 来源于白虾养殖水的副溶血性弧菌, Vs. W2: 来源于对虾养殖水的锡那罗州弧菌, Vm. R3: 来源于蛤仔的梅氏弧菌, Va. W1: 来源于白虾养殖水的溶藻弧菌, Va. S1: 来源于白虾的溶藻弧菌, Va. M3: 来源于蛤仔养殖沉积物的溶藻弧菌 |
由弧菌24 h生长曲线可知(图 2), 弧菌在高浓度(1.0×105 CFU/mL)条件下比相比于低浓度(1.0× 103 CFU/mL)提前1~3 h到达峰值, 生长更快。初始4 h内, 各弧菌处于生长迟缓期, 生长量无明显增长; 4~12 h为弧菌对数增长期, 各弧菌生长量快速增长; 12~24 h则进入稳定期, 生长量(OD600nm)在小范围内上下浮动, 增加或下降0~0.4。
 |
| 图 2 弧菌24 h生长曲线 Fig. 2 Vibrio growth curves within 24 h |
由上述生长曲线可知, 各弧菌生长进入稳定期至少需要8 h, 且对照组在16~24 h处于增长状态, 因此在12 h计算各弧菌抑制率如图 3。裂片石莼水培液对各弧菌具有不同的抑制作用, Vp. W1、Vs. W2和Vm. R3在1.25~10 g/L的裂片石莼水培液培养1 d时的抑制率范围为1.32%~39.42%, 但在培养3 d时抑制率处于64%~100%, 且10 g/L处理组抑制率达80%以上, 显著高于第1 d (10.37%~ 30.06%) (P < 0.05)。其中, 培养1 d时低密度(2.5 g/L)的水培液对Vs. W2没有抑制作用, 对溶藻弧菌抑制率均不超过35%, 且培养1 d和3 d的抑制效果差异不显著。
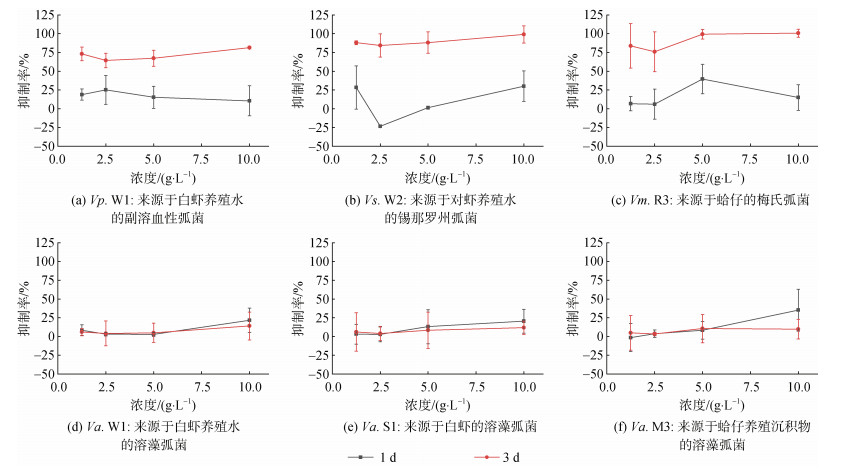 |
| 图 3 不同密度的裂片石莼水培液对弧菌的抑制率 Fig. 3 Inhibition rate of Vibrio with Ulva fasciata hydroponic solution at different concentrations |
研究表明, 大型海藻对弧菌的抑制作用表现出明显的浓度依赖性。随着江蓠提取物浓度的增加, 副溶血性弧菌(V. parahaemolyticus)和哈维氏弧菌(V. harveyi)的抑制率增加[16, 35]。通过先前对副溶血性弧菌的可培养性研究也发现, 裂片石莼在高密度(12 g/L)条件下的抑制作用明显高于低密度(3 g/L)[36]。而在本实验中, 高密度(10 g/L)的裂片石莼水培液对各弧菌的抑制率在10.46%~100%, 低密度(1.25~5 g/L)在1.32%~99.3%, 不具有显著的浓度依赖性, 这可能和水培液与弧菌共培养的时间有关。事实证明, 大型海藻对不同弧菌的抑制作具有时间相关性。等鞭金藻与溶藻弧菌共培养后第2 d开始溶藻弧菌数量迅速下降, 第4 d几乎检测不到弧菌[37]。裂片石莼分泌物对溶藻弧菌的抑制作用与水培液的培养时间紧密相关, 培养3 d时的抑制率显著高于培养1 d, 这可能与活性物质持续释放过程相关[38]。由于大型海藻中含有多种活性物质, 因此对细菌有明显的抑制作用。例如裂片石莼二氯甲烷提取物中的萜类化合物作为有效抗菌成分显示出对副溶血性弧菌和溶藻弧菌明显的抑制作用[19]。裂片石莼甲醇提取物中含有脂肪酸等多种具有抗菌活性的化合物, 对革兰氏阴性菌具有较大的抑菌圈[39]。虽然裂片石莼水培液中的活性物质浓度低于提取物中的活性物质浓度, 但仍显示出一定的抗菌性能。
2.3 裂片石莼水培液成分分析采用GC-MS从不同密度和培养时间下的9组样品中共检测到126种化合物, 与对照组相比具有显著差异的化合物有84种(P < 0.05), 包括酸(24)、醇酚类(10)、醛酮类(10)、烷烃和芳香烃(8)、杂环(8)、酯(7)、胺(5)、醚(3)、氨基酸(2)、腈(2)、糖苷(2)、糖(2)及糖胺(1)等。与数据库匹配得分在70以上的显著差异物质有25种, 主要为醇酚类(24%)和酸类(24%), 且峰面积差异倍数大于50 (X=∑(实验组峰面积/对照组峰面积), X > 50)的显著差异物质有10种(图 4), 包括p-HPEA、二十碳五烯酸、TBP、MEHP、半乳糖胺、2-乙基己酸、Acetal、甲基-β-D-半乳糖苷、肌醇半乳糖苷和正-辛醇, 其中醇酚类占比最大(30%), 其次是酸类(20%)和糖苷类(20%)。峰面积平均差异倍数在40以上的显著差异物质有4种, 分别为2, 4, 6-三溴苯酚、2-(4-羟基苯)乙醇、乙缩醛和邻苯二甲酸单(2-乙基己基)酯。
 |
| 图 4 10 g/L裂片石莼3 d水培液的总离子色谱图 Fig. 4 Total ion chromatogram of a 10 g/L Ulva fasciata hydroponic solution (3 d) |
裂片石莼水培液的GC-MS分析显示MEHP、Acetal、p-HPEA和TBP为最显著的差异活性物质。TBP是一种单体溴酚, 是溴酚中生产最广泛的物质, 据报道对致病菌具有抗菌活性[40-41]。来自双孢蘑菇的乙酸乙酯提取物中浓度最高的MEHP具有抗菌和抗氧化活性[42]。p-HPEA是一种酚醇类化合物, Acetal是由一分子醛和两分子醇缩合的产物, 其含有的醛基可有效增强抗菌活性[43], 大型藻类提取物中含有包括醇类化合物在内的多种生物活性物质具有抗菌潜力[44]。除此之外, 二十碳五烯酸和2-乙基己酸是脂肪酸类化合物, 在植物和藻类中天然存在, 以防御病原体, 包括多重耐药细菌铜绿假单胞菌[45-46]。糖类化合物包括甲基-β-D-半乳糖苷、肌醇半乳糖苷和半乳糖胺, 是由糖基形成的含糖衍生物, 可治疗多种细菌感染[47]。正-辛醇是一种饱和脂肪醇, 具有较强的亲脂性, 作为抗菌剂渗透细胞壁和细胞膜以发挥作用[48]。
进一步以筛选种类最多的溶藻弧菌为研究目标, 裂片石莼水培液4种优势成分对弧菌的MIC如表 3所示。结果表明, TBP对溶藻弧菌的抑菌能力最强, 64~128 μg/mL即可完全抑制溶藻弧菌的生长, 其次是p-HPEA(12 800 μg/mL), 其他物质在最高溶解水平下均无抑菌作用。以抗生素作为对照发现, 阿莫西林等抗生素在4~128 μg/mL时就能够完全抑制弧菌的生长。各活性物质的MICs值是各抗生素MICs值的2~3 200倍, 对弧菌的生长具有一定的抑菌作用, 且TBP对弧菌的抑制作用与抗生素较为相似。因此, 裂片石莼水培液中抑菌活性物质种类丰富, 多种物质协同作用更有助于控制病原菌生长。如有研究表明来自巨型猪草的正辛醇和乙酸正辛酯等脂肪醇和酯类化合物对多种病原菌体具有协同抗菌活性[49]。香芹酚和1, 8-桉叶素联合使用对单核细胞增生李斯特菌、嗜水气单胞菌和荧光假单胞菌的抑制具有协同作用[50]。Zhang[51]等研究结果也表明Reuterin和儿茶素联合使用对变形链球菌的生长、生物膜的表达具有协同抑制作用。
| 代谢物 | Va. W1 | Va. S1 | Va. M3 |
| MEHP | >1 280 | >1 280 | >1 280 |
| Acetal | >12 800 | >12 800 | >12 800 |
| p-HPEA | 12 800 | 12 800 | 12 800 |
| TBP | 128 | 64 | 128 |
| 阿莫西林 | 64 | 64 | 128 |
| 氨苄青霉素 | 64 | 64 | 128 |
| 头孢唑啉 | 64 | 16 | 32 |
| 哌拉西林 | 4 | 4 | 16 |
| 注: Va. W1: 来源于白虾养殖水的溶藻弧菌, Va. S1: 来源于白虾的溶藻弧菌, Va. M3: 来源于蛤仔养殖沉积物的溶藻弧菌 | |||
采用PCA进一步对裂片石莼水培液的差异化合物进行分析(图 5), PC1为52.3%, PC2为16.1%, 总贡献率达到68.4%。对照组人工海水位于第二象限, 与实验处理组(TA1~TD1、TA3~TD3)分布范围较远, 表明裂片石莼水培液中含有丰富的化合物。TA1~TD1 (第二、三、四象限)与TA3~TD3(第一、二、四象限)的距离较远, 表明随着水培液培养时间的增加, 化合物浓度增加。在PC1水平上, TA1~TC1的距离较近, TC1~TD1相距较远, 表明在培养1 d的裂片石莼水培液下, 低密度(1.25~5 g/L)的水培液对化合物浓度影响不大, 高密度(10 g/L)可以增加水培液中化合物的浓度。TA3在第二象限, 在PC1水平上与TB3~ TD3相距较远, 表明在培养3 d的裂片石莼水培液下, 提高水培液密度可以增加化合物的浓度。样本TD1、TD3(第四象限)与其他样本(第一、二、三象限)的距离最远, 进一步表明10 g/L的水培液对化合物浓度的影响最大。这些结果表明, 培养时间和密度对水培液中化合物浓度具有一定的影响。培养相同的时间, 在培养密度(1.25~5 g/L)较低时, 培养密度对水培液中化合物的浓度影响较小, 而提高培养密度(10 g/L)能够增加水培液中化合物的浓度。在10 g/L的培养密度下, 第3 d的裂片石莼水培液中化合物的浓度高于第1 d。
 |
| 图 5 不同条件下裂片石莼水培液中差异化合物的PCA分析 Fig. 5 PCA analysis of differential compounds in Ulva fasciata hydroponic solution under various conditions 注: PC1: 第一主成分; PC2: 第二主成分; A: 1.25 g/L; B: 2.5 g/L; C: 5 g/L; D: 10 g/L; T: 实验组; Control: 对照组; 1: 第1 d; 3: 第3 d |
不同条件方式下, 裂片石莼含有的活性物质具有一定的差异。营养盐、盐度和溶解氧等条件能够影响裂片石莼分泌酚类物质, 营养物质对酚类物质的产生具有促进作用, 而溶解氧和盐度对其具有消极的影响[52]。海藻次级代谢产物和抗氧化活性随季节发生变化, 高氧浓度的强光照可导致藻类产生必需的抗氧化化合物[53]。不同季节褐藻中岩藻黄质的质量分数差异主要是由于光照和温度波动造成的[54]。本研究中, 不同密度及持续光照的培养时间也能够影响裂片石莼活性物质的分泌, 高密度的裂片石莼水培液随着培养时间的增加可以有效促进活性物质的产生。Singpoonga等[38]研究表明蛹虫草的活性物质腺苷和虫草素的质量分数在培养第1周到第7周显著增加。活性物质的产生是一种持续释放的过程, 这与本研究结果一致。综上所述, 活体海藻可持续释放多种抑菌活性物质, 在控制海水养殖环境病原菌污染方面具有重要意义。
3 结论本研究从不同养殖场的水产养殖样品中分离出6株耐药弧菌, 其中3株溶藻弧菌和Vp. W1具有阿莫西林、氨苄青霉素和哌拉西林三重耐药性, Vs. W2和Vm. R3则有阿莫西林和氨苄青霉素双重耐药性。裂片石莼水培液对各弧菌具有不同的抑制作用, 当与弧菌共培养12 h时, 各弧菌在10 g/L抑制效果较好; Vp. W1、Vs. W2和Vm. R3在培养3 d(64%~100%)的裂片石莼水培液(1.25~10 g/L)作用下抑制效果显著高于第1 d (1.32%~39.42%); 溶藻弧菌在培养1 d和3 d的裂片石莼水培液作用下抑制效果差异不显著, 抑制率均不超过35%。此外, 培养时间和密度对水培液中的化合物浓度有一定的影响, 培养3 d的水培液可以增加化合物的浓度, 且高密度(10 g/L)的水培液对化合物浓度影响最大。裂片石莼水培液含有多种化合物, 包括酸类、醇酚类、醛酮类、烷烃和芳香烃、杂环、酯类等, 以MEHP、Acetal、p-HPEA和TBP较为凸显。
| [1] |
COSTELLO C, CAO L, GELCICH S, et al. The future of food from the sea[J]. Nature, 2020, 588(7836): 95-100. DOI:10.1038/s41586-020-2616-y |
| [2] |
Food and Agriculture Organization. The State of World Fisheries and Aquaculture 2022[M]. Rome: Food and Agriculture Organization of the United Nations, 2022.
|
| [3] |
YUE G H, TAY Y X, WONG J, et al. Aquaculture species diversification in China[J]. Aquaculture and Fisheries, 2023, 9(2): 206-217. |
| [4] |
TORANZO A E, MAGARIÑOS B, ROMALDE J L. A review of the main bacterial fish diseases in mariculture systems[J]. Aquaculture, 2005, 246(1/4): 37-61. |
| [5] |
MOHAMAD N, AMAL M N A, YASIN I S M, et al. Vibriosis in cultured marine fishes: a review[J]. Aquaculture, 2019, 512: 734289. DOI:10.1016/j.aquaculture.2019.734289 |
| [6] |
LI W, PIRES S M, LIU Z, et al. Surveillance of foodborne disease outbreaks in China, 2003–2017[J]. Food Control, 2020, 118(10): 107359. |
| [7] |
PARK K, MOK J S, RYU A R, et al. Occurrence and virulence of Vibrio parahaemolyticus isolated from seawater and bivalve shellfish of the Gyeongnam coast, Korea, in 2004–2016[J]. Marine Pollution Bulletin, 2018, 137: 382-387. DOI:10.1016/j.marpolbul.2018.10.033 |
| [8] |
魏大伟. 中国沿海地区副溶血弧菌流行病学调查及遗传多样性分析[D]. 咸阳: 西北农林科技大学, 2018. WEI Dawei. Epidemiological investigationand and genetic diversity of Vibrio parahaemolyticus isolated from coastal areas of china[D]. Xianyang: Northwest A&F University, 2018. |
| [9] |
YIN X, ZHUANG X, LIAO M, et al. Transcriptome analysis of Pacific white shrimp (Litopenaeus vannamei) hepatopancreas challenged by Vibrio alginolyticus reveals lipid metabolic disturbance[J]. Fish & Shellfish Immunology, 2022, 123(4): 238-247. |
| [10] |
VOIGT A M, ZACHARIAS N, TIMM C, et al. Association between antibiotic residues, antibiotic resistant bacteria and antibiotic resistance genes in anthropogenic wastewater – An evaluation of clinical influences[J]. Chemosphere, 2020, 241: 125032. DOI:10.1016/j.chemosphere.2019.125032 |
| [11] |
王瑞旋, 王江勇, 李韵萍, 等. 致病性海洋弧菌对氨基糖苷类药物的耐药传递机制初步研究[J]. 海洋科学, 2020, 44(10): 81-90. WANG Ruixuan, WANG Jiangyong, LI Yunping, et al. Primary research on the transmission mechanism of resistance to aminoglycoside for pathogenic marine Vibrio strains[J]. Marine Sciences, 2020, 44(10): 81-90. |
| [12] |
李睿, 刘嘉伟, 洪春来, 等. 海藻修复富营养化海域与内陆缺碘环境的潜力[J]. 中国环境科学, 2017, 37(1): 284-291. LI Rui, LIU Jiawei, HONG Chunlai, et al. The potential model of seaweeds to remediate eutrophic sea waters and improve inland iodine deficiency environments[J]. China Environmental Science, 2017, 37(1): 284-291. |
| [13] |
THANIGAIVEL S, CHANDRASEKARAN N, MUKHERJEE A, et al. Seaweeds as an alternative therapeutic source for aquatic disease management[J]. Aquaculture, 2016, 464: 529-536. DOI:10.1016/j.aquaculture.2016.08.001 |
| [14] |
CAVALLO R A, ACQUAVIVA M I, STABILI L, et al. Antibacterial activity of marine macroalgae against fish pathogenic Vibrio species[J]. Open Life Sciences, 2013, 8(7): 646-653. DOI:10.2478/s11535-013-0181-6 |
| [15] |
THANIGAIVEL S, VIJAYAKUMAR S, MUKHERJEE A, et al. Antioxidant and antibacterial activity of Chaetomorpha antennina against shrimp pathogen Vibrio parahaemolyticus[J]. Aquaculture, 2014, 433: 467-475. DOI:10.1016/j.aquaculture.2014.07.003 |
| [16] |
KARNJANA K, SOOWANNAYAN C, WONGPRASERT K. Ethanolic extract of red seaweed Gracilaria fisheri and furanone eradicate Vibrio harveyi and Vibrio parahaemolyticus biofilms and ameliorate the bacterial infection in shrimp[J]. Fish & Shellfish Immunology, 2019, 88: 91-101. |
| [17] |
RAJESHKUMAR S, NANDHINI N T, MANJUNATH K, et al. Environment friendly synthesis copper oxide nanoparticles and its antioxidant, antibacterial activities using Seaweed (Sargassum longifolium) extract[J]. Journal of Molecular Structure, 2021, 1242: 130724. DOI:10.1016/j.molstruc.2021.130724 |
| [18] |
SELVINl J, LIPTON A P. Biopotentials of Ulva fasciata and Hypnea musciformis collected from the peninsular coast of Indian[J]. Journal of Marine Science and Technology, 2004, 12(1): 1-6. |
| [19] |
CHAKRABORTY K, LIPTON A P, PAUL RAJ R, et al. Antibacterial labdane diterpenoids of Ulva fasciata Delile from southwestern coast of the Indian Peninsula[J]. Food Chemistry, 2010, 119(4): 1399-1408. DOI:10.1016/j.foodchem.2009.09.019 |
| [20] |
叶方方, 吴后波, 向文洲, 等. 裂片石莼营养价值的评价及其多糖制备的初步研究[J]. 海洋科学, 2015, 39(3): 33-41. YE Fangfang, WU Houbo, XIANG Wenzhou, et al. Nutritional evaluation of Ulva fasciata and polysaccharide extraction from U. fasciata[J]. Marine Sciences, 2015, 39(3): 33-41. |
| [21] |
SIVAKUMAR K, KANNAPPAN S, VIJAYAKUMAR B, et al. Molecular docking study of bio-inhibitors extracted from marine macro-alga Ulva fasciata against hemolysin protein of luminescence disease-causing Vibrio harveyi[J]. Archives of Microbiology, 2021, 203(7): 4243-4258. |
| [22] |
LIU F, PANG S. Nonculturability of the pathogenic Vibrio parahaemolyticus in live culture of Grateloupia turuturu is associated with bacterial attachment to the algal thalli[J]. Acta Oceanologica Sinica, 2010, 29(6): 92-103. |
| [23] |
LU K, LIN W, LIU J. The characteristics of nutrient removal and inhibitory effect of Ulva clathrata on Vibrio anguillarum 65[J]. Journal of Applied Phycology, 2008, 20(6): 1061-1068. |
| [24] |
ANAYA-ROSAS R E, RIVAS-VEGA M E, MIRANDA-BAEZA A, et al. Effects of a co-culture of marine algae and shrimp (Litopenaeus vannamei) on the growth, survival and immune response of shrimp infected with Vibrio parahaemolyticus and white spot virus (WSSV)[J]. Fish & Shellfish Immunology, 2019, 87: 136-143. |
| [25] |
FENG L J, QIAO Y, XIAO C Y, et al. Interaction between live seaweed and various Vibrio species by co-culture: Antibacterial activity and seaweed microenvironment[J]. Algal Research, 2022, 65: 102741. |
| [26] |
QIAO Y, FENG L J, JIA R, et al. Motility, biofilm formation and associated gene expression in Vibrio parahaemolyticus impaired by co-culture with live Ulva fasciata[J]. Journal of Applied Microbiology, 2022, 132(1): 101-112. |
| [27] |
JIN Q, DONG S, WANG C. Allelopathic growth inhibition of Prorocentrum micans (Dinophyta) by Ulva pertusa and Ulva linza (Chlorophyta) in laboratory cultures[J]. European Journal of Phycology, 2005, 40(1): 31-37. |
| [28] |
中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准食品微生物学检验副溶血性弧菌检验: GB 4789.7—2013[S]. 北京: 中国标准出版社, 2013. National Health and Family Planning Commission of the People's Republic of China. National standard for food safety food microbiological examination: Vibrio parahaemolyticus: GB 4789.7–2013[S]. Beijing: China Standards Press, 2013. |
| [29] |
CLINICAL AND LABORATORY STANDARD INSTITUTE (CLSI). Performance standards for antimicrobial susceptibility testing: M100-S26[S]. Wayne, PA: Clinical and Laboratory Standard Institute, 2016.
|
| [30] |
DIAO M, QI D, XU M, et al. Antibacterial activity and mechanism of monolauroyl-galactosylglycerol against Bacillus cereus[J]. Food Control, 2018, 85: 339-344. |
| [31] |
WANDEE S, CHAN R, CHIEMCHAISRI W, et al. Alteration of antibiotic-resistant phenotypes and minimal inhibitory concentration of Escherichia coli in pig farming: Comparison between closed and open farming systems[J]. Science of The Total Environment, 2021, 781(2): 146743. |
| [32] |
RAMACHANDRAN G. Gram-positive and gram- negative bacterial toxins in sepsis: A brief review[J]. Virulence, 2014, 5(1): 213-218. |
| [33] |
DEVI M S, PARIA P, KUMAR V, et al. Molecular identification and pathogenicity study of virulent Vibrio cholerae non O1/O139 serotype associated with mortality of farmed Labeo rohita (Hamilton, 1822), in India[J]. Aquaculture, 2022, 547(1): 737529. |
| [34] |
MOK J S, RYU A, KWON J Y, et al. Abundance, antimicrobial resistance, and virulence of pathogenic Vibrio strains from molluscan shellfish farms along the Korean coast[J]. Marine Pollution Bulletin, 2019, 149: 110559. |
| [35] |
BOONSRI N, RUDTANATIP T, WITHYACHUMNARNKUL B, et al. Protein extract from red seaweed Gracilaria fisheri prevents acute hepatopancreatic necrosis disease (AHPND) infection in shrimp[J]. Journal of Applied Phycology, 2017, 29(3): 1597-1608. |
| [36] |
贾荣. 大型海藻裂片石莼对弧菌的抑制特性研究[D]. 舟山: 浙江海洋大学, 2019. JIA Rong. Study on the inhibition characteristics of macroalgae Ulva fasciata against Vibrio[D]. Zhoushan: Zhejiang Ocean University, 2019. |
| [37] |
MOLINA-CÁRDENAS C A, SÁNCHEZ-SAAVEDRA M D P, LIZARRAGA-PARTIDA M L. Inhibition of pathogenic Vibrio by the microalgae Isochrysis galbana[J]. Journal of Applied Phycology, 2014, 26(6): 2347-2355. |
| [38] |
SINGPOONGA N, SANG-ON B, CHAIPRASART P. Effects of culture periods on fruiting body formation and bioactive compounds production of Cordyceps militaris[J]. Acta Horticulturae. 2020, 1287, 345-352. |
| [39] |
EL-SAYED H S, ELSHOBARY M E, BARAKAT K M, et al. Ocean acidification induced changes in Ulva fasciata biochemistry may improve Dicentrarchus labrax aquaculture via enhanced antimicrobial activity[J]. Aquaculture, 2022, 560(1/4): 738474. |
| [40] |
OFFRET C, DESRIAC F, LE CHEVALIER P, et al. Spotlight on antimicrobial metabolites from the marine bacteria Pseudoalteromonas: Chemodiversity and ecological significance[J]. Marine Drugs, 2016, 14(7): 129. |
| [41] |
HOWE P D, DOBSON S, MALCOLM H M. 2, 4, 6-Tribromophenol and other simple brominated phenols[M]. Geneva: World Health Organization, 2005: 1-35.
|
| [42] |
WAQAS H M, AKBAR M, IQBAL M S. Antibacterial and antioxidant activities of Agaricus bisporus (J. E. Lange) imbach from Pakistan[J]. Bangladesh Journal of Botany, 2019, 48(4): 1075-1081. |
| [43] |
ZI Y, ZHU M, LI X, et al. Effects of carboxyl and aldehyde groups on the antibacterial activity of oxidized amylose[J]. Carbohydrate Polymers, 2018, 192(15): 118-125. |
| [44] |
SHOBIER A H, ABDEL GHANI S A, BARAKAT K M. GC/MS spectroscopic approach and antifungal potential of bioactive extracts produced by marine macroalgae[J]. The Egyptian Journal of Aquatic Research, 2016, 42(3): 289-299. |
| [45] |
MOHAN S V, ROHIT M V, CHIRANJEEVI P, et al. Heterotrophic microalgae cultivation to synergize biodiesel production with waste remediation: Progress and perspectives[J]. Bioresource Technology, 2015, 184: 169-178. |
| [46] |
SELVADOSS P P, NELLORE J, RAVINDRRAN M B, et al. Enhancement of antimicrobial activity by liposomal oleic acid-loaded antibiotics for the treatment of multidrug-resistant Pseudomonas aeruginosa[J]. Artificial Cells, Nanomedicine, and Biotechnology, 2018, 46(2): 268-273. |
| [47] |
MATOS D A M. Recent advances in the development and synthesis of carbohydrate-based molecules with promising antibacterial activity[J]. European Journal of Organic Chemistry, 2023, 26(4): 1-16. |
| [48] |
BARBATO F, CIROCCO V, GRUMETTO L, et al. Comparison between immobilized artificial membrane (IAM) HPLC data and lipophilicity in n-octanol for quinolone antibacterial agents[J]. European Journal of Pharmaceutical Sciences, 2007, 31(5): 288-297. |
| [49] |
SKALICKA-WOŹNIAK K, GRZEGORCZYK A, ŚWIĄTEK Ł, et al. Biological activity and safety profile of the essential oil from fruits of Heracleum mantegazzianum Sommier & Levier (Apiaceae)[J]. Food and Chemical Toxicology, 2017, 109(2): 820-826. |
| [50] |
DE SOUSA J P, DE AZERÊDO G A, DE ARAÚJO TORRES R, et al. Synergies of carvacrol and 1, 8-cineole to inhibit bacteria associated with minimally processed vegetables[J]. International Journal of Food Microbiology, 2012, 154(3): 145-151. |
| [51] |
ZHANG G, TAN Y, YU T, et al. Synergistic antibacterial effects of reuterin and catechin against Streptococcus mutans[J]. Lebensmittel-Wissenschaft und-Technologie, 2021, 139: 110527. |
| [52] |
XU P, TAN H, JIN W, et al. Antioxidative and antimicrobial activities of intertidal seaweeds and possible effects of abiotic factors on these bioactivities[J]. Journal of Oceanology and Limnology, 2018, 36(6): 2243-2256. |
| [53] |
FARIMAN G A, SHASTAN S J, ZAHEDI M M. Seasonal variation of total lipid, fatty acids, fucoxanthin content, and antioxidant properties of two tropical brown algae (Nizamuddinia zanardinii and Cystoseira indica) from Iran[J]. Journal of Applied Phycology, 2016, 28(2): 1323-1331. |
| [54] |
NOMURA M, KAMOGAWA H, SUSANTO E, et al. Seasonal variations of total lipids, fatty acid composition, and fucoxanthin contents of Sargassum horneri (Turner) and Cystoseira hakodatensis (Yendo) from the northern seashore of Japan[J]. Journal of Applied Phycology, 2013, 25(4): 1159-1169. |
 2024, Vol. 48
2024, Vol. 48


