
文章信息
- 唐瑞锴, 杨光, 孙中伟, 唐佳伟, 王鑫, 马晓娜, 冯志华. 2024.
- TANG Ruikai, YANG Guang, SUN Zhongwei, TANG Jiawei, WANG Xin, MA Xiaona, FENG Zhihua. 2024.
- 微塑料对四角蛤蜊滤食、呼吸和免疫指标的影响
- Effects of microplastics on filtration, respiratory, and immune indexes of Mactra veneriformis
- 海洋科学, 48(6): 33-42
- Marine Sciences, 48(6): 33-42.
- http://dx.doi.org/10.11759/hykx20220728005
-
文章历史
- 收稿日期:2022-07-28
- 修回日期:2022-11-09
2. 江苏海洋大学 江苏省海洋生物技术重点实验室, 江苏 连云港 222005;
3. 江苏海洋大学 江苏省海洋生物产业技术协同创新中心, 江苏 连云港 222005
2. Jiangsu Key Laboratory of Marine Biotechnology, Jiangsu Ocean University, Lianyungang 222005, China;
3. Co-Innovation Center of Jiangsu Marine Bio-industry Technology, Jiangsu Ocean University, Lianyungang 222005, China
塑料制品已经成为人类社会必不可少的一部分, 2020年全球塑料产量高达3.67×109 t[1]。先前的研究表明, 有60%的塑料最终进入垃圾填埋场或自然环境中, 在此趋势下, 到2050年环境中将会有1.2×1011 t塑料垃圾[2]。微塑料是指粒径小于5 mm的塑料颗粒, 由于聚合物的密度不同, 微塑料广泛分布于各种海洋环境中[3-4]。微塑料会被海洋贝类、鱼类和甲壳类等生物摄食并在体内积累, 不仅会产生虚假的饱腹感, 还会对生物体的生理代谢产生影响[5-9]。此外, 微塑料会通过食物链传播, 不仅会对生态系统产生影响, 还会进入人体, 对人体健康产生潜在的危害。作为一种新型污染物, 微塑料近几年一直是国内外学者的研究热点, 目前已有大量的研究表明微塑料在中国近海的水体和沉积物中广泛存在[10-11]。
四角蛤蜊(Mactra veneriformis)是中国最常见的底栖贝类之一, 属于双壳纲, 帘蛤目, 蛤蜊科, 蛤蜊属, 由于其养殖简便、产量大、肉质鲜美、营养价值高, 是中国产量第三大的滩涂贝类[12-13]。四角蛤蜊挖洞、滤水的习性导致其与环境介质中的污染物接触密切, 更易受毒害物质的影响。石油烃、重金属和除草剂等污染物均会对四角蛤蜊的生理生化指标产生影响, 并且其可作为上述污染的指示生物[14-16]。
研究表明海洋双壳贝类的微塑料特征与沉积物高度相关, 当沉积物受到扰动时会将微塑料释放入水体, 并被贝类过滤[17-19]。虽然微塑料已被证实对双壳贝类有不良影响[20-21], 但目前关于微塑料对四角蛤蜊生理行为和具体器官中免疫指标影响的研究还较少。因此, 研究微塑料对四角蛤蜊的毒性效应对于评估微塑料对潮间带生态环境效应具有重要意义。
1 材料与方法 1.1 实验材料实验用四角蛤蜊和海水采集于江苏省连云港市青口镇潮间带, 海水经孔径为0.45 μm的醋酸纤维滤膜过滤后曝气24 h。为了使四角蛤蜊适应实验室条件, 实验前将四角蛤蜊放入玻璃缸中暂养7 d, 暂养期间连续曝气, 每天9: 00换水并定量投喂小球藻, 水温控制在(16±1) ℃。实验前停止投喂, 饥饿处理24 h, 选择健康、大小基本一致的四角蛤蜊用于后续实验。
微塑料购于天津倍思乐色谱技术开发中心, 材质选用聚苯乙烯(PS), 粒径1 μm的微塑料浓度为1.80×1010粒/mL, 粒径80 nm的微塑料浓度为3.51× 1013粒/mL。实验用微塑料参数如表 1所示。
| 粒径/μm | 体积/cm3 | 重量/g | 浓度/(粒·mL–1) |
| 1 | 5.23×10–13 | 5.57×10–13 | 1.80×1010 |
| 0.08 | 2.68×10–16 | 2.85×10–16 | 3.51×1013 |
实验设置两个粒径级和两个浓度的PS实验组, PS粒径分别为1 μm和80 nm, 浓度分别为1×104粒/L (低浓度组)和1×106粒/L(高浓度组), 对照组为不添加塑料的天然海水组, 每个处理设置3个平行。实验周期为7 d, 每个玻璃缸中加水10 L, 随机放养四角蛤蜊20只, 全程微量充氧, 水温保持在(16±1) ℃, 实验过程中无光照, 每天9: 00换水并定量投喂小球藻。实验流程如图 1所示。
 |
| 图 1 实验流程图 Fig. 1 Flowchart of the experiment |
滤食率的测定参考Cooper[22]等对河蚬(Corbicula fluminea)滤食率的测定方法。每次从各暴露组中取3只四角蛤蜊, 分别放入200 mL烧杯中, 加入100 mL的中性红溶液(1 mg/L), 避光静止2 h。每个烧杯中分别取330 μL滤食前、后的溶液放入96孔板中, 使用酶标仪在波长530 nm下测量吸光度并绘制标准曲线, 计算出对应的中性红浓度。
滤食率(m, 单位为mL·只–1·h–1)的计算公式为:
| m=[Mnt]log(C0Ct), | (1) |
式中M为中性红溶液的体积(mL); n为烧杯中四角蛤蜊的个数; t为测定时间(h); C0为中性红溶液初始浓度(mg/L), Ct为滤食2 h后烧杯中的中性红溶液浓度(mg/L)。
1.4 呼吸率测定于500 mL烧杯中分别放入1个四角蛤蜊, 待其双壳张开后使用溶解氧测定仪(JPB-607A, 上海仪电)测定水体中的溶解氧浓度, 将烧杯密闭1 h后再次测量水体中的溶解氧浓度。
耗氧率(R)(mg O2·h–1·g–1)的计算公式为:
| R=(Dt−D0)×V/mt, | (2) |
式中D0和Dt分别为实验前后水体中的溶解氧质量浓度(mg·L–1), V为水体体积(L), m为四角蛤蜊鲜质量(g), t为实验时间(h)。
1.5 免疫指标测定每个处理组随机选取3只四角蛤蜊, 用纱布擦干体表水分, 用清洁的解剖刀迅速剥离鳃和肝胰腺组织, 准确称取组织重量, 按质量(g)∶体积(mL)=1∶9的比例, 加入0.9%的生理盐水, 冰水浴条件下机械匀浆, 随后2 500 r/min, 离心10 min, 取上清液待测。采用试剂盒(南京建成生物工程研究所)测定总蛋白、丙二醛(MDA)浓度和过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)的活性。
1.6 统计分析实验结果以平均值±标准差表示, 采用软件Origin pro 2019和SPSS 23.0进行数据分析, 各处理组和对照组之间的差异性分析采用单因素方差分析(One-way ANOVA), 采用多重比较法(LSD检验)进行统计检验, P < 0.05表示显著性差异。
2 结果 2.1 微塑料对四角蛤蜊滤食率的影响如图 2所示, 1 d时各微塑料暴露组四角蛤蜊的滤食率与对照组无显著差异, 随暴露时间的增加, 1 μm低浓度的微塑料对四角蛤蜊的滤食有促进作用, 而在1 μm高浓度、80 nm低浓度和80 nm高浓度的微塑料暴露下, 四角蛤蜊的滤食速率与对照组比略有下降但变化不显著。1 μm低浓度组在3 d时显著高于其他实验组(P < 0.05), 在5 d和7 d时显著高于所有组别(P < 0.05)。
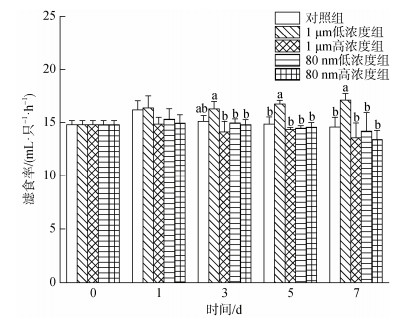 |
| 图 2 微塑料暴露下四角蛤蜊滤食率的变化 Fig. 2 Filtration rate of M. veneriformis exposed to microplastics 注: 不同小写字母表示在同一时间, 不同处理组之间存在显著差异(P < 0.05) |
实验结果显示, 微塑料暴露第1 d时80 nm低浓度组四角蛤蜊的呼吸率与对照组无显著差异, 其余各暴露组四角蛤蜊的呼吸率均显著升高, 随着暴露时间的增加, 微塑料暴露会使四角蛤蜊的呼吸率显著上升(图 3)。在5 d和7 d时, 每个实验组之间均存在显著差异, 暴露于大粒径组四角蛤蜊的呼吸速率显著高于小粒径组, 高浓度组显著高于低浓度组(P < 0.05)。
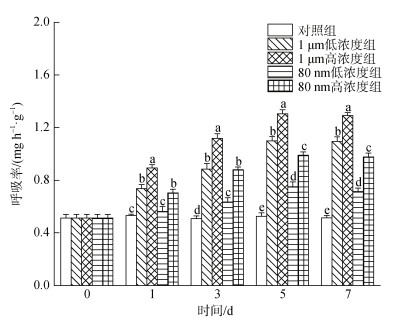 |
| 图 3 微塑料暴露下四角蛤蜊呼吸率的变化 Fig. 3 Respiration rate of M. veneriformis exposed to microplastics 注: 不同小写字母表示在同一时间, 不同处理组之间存在显著差异(P < 0.05) |
微塑料暴露下四角蛤蜊鳃和肝胰腺的SOD活性如图 4所示。鳃中的SOD活性在1 d时迅速升高达到峰值, 3 d时迅速下降并在7 d时再次上升。1 d时, 4个实验组四角蛤蜊的SOD活性均显著高于对照组, 其中1 μm高浓度组SOD活性((84.39±5.02) U/mg prot)显著高于其他3组, 80 nm低浓度组SOD活性((60.91±5.05) U/mg prot)显著低于其他3组(P < 0.05)。
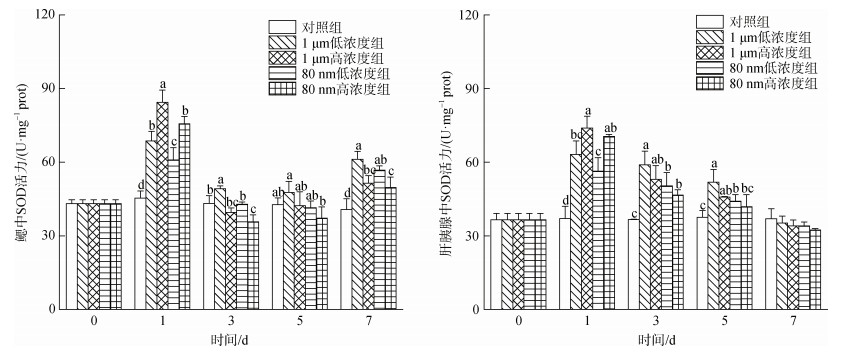 |
| 图 4 微塑料暴露下四角蛤蜊鳃和肝胰腺中超氧化物歧化酶(SOD)活性的变化 Fig. 4 Superoxide dismutase (SOD) activity in the gills and hepatopancreas of M. veneriformis exposed to microplastics 注: 不同小写字母表示在同一时间, 不同处理组之间存在显著差异(P < 0.05) |
微塑料暴露下四角蛤蜊肝胰腺中SOD的活性在1 d时显著上升并达到峰值(P < 0.05), 与鳃的变化相似, 1 d时1 μm高浓度组SOD活性最高((73.84±4.89) U/mg prot), 80 nm低浓度组SOD活性最低((56.33± 5.49) U/mg prot); 3、5、7 d时SOD活性逐渐下降, 与1 d时不同的是SOD活性均为1 μm低浓度组最高。
2.3.2 微塑料对四角蛤蜊过氧化氢酶(CAT)活性的影响如图 5所示, 微塑料暴露下四角蛤蜊鳃中CAT活性在1 d时显著上升, 且各实验组间均存在显著性差异(P < 0.05); 在3 d和5 d时, 各实验组的CAT活性逐渐降低, 但仍显著高于对照组(P < 0.05); 在7 d时, 各实验组的CAT活性继续降低, 其中只有1 μm高浓度组显著高于对照组(P < 0.05)而80 nm高浓度组四角蛤蜊鳃中的CAT活性被显著抑制((30.03±4.89) U/mg prot, P < 0.05)。
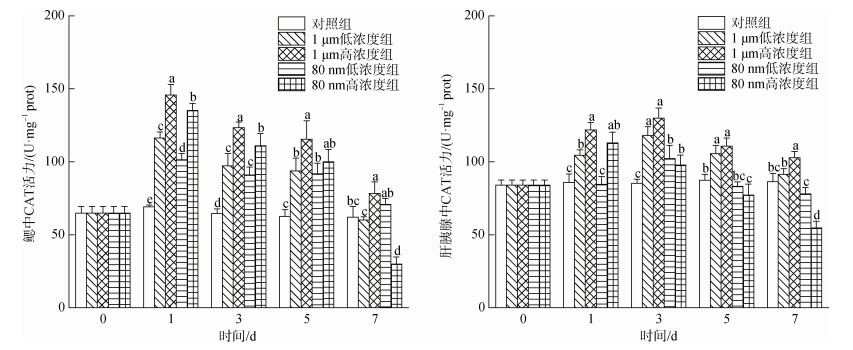 |
| 图 5 微塑料暴露下四角蛤蜊鳃和肝胰腺中过氧化氢酶(CAT)活性的变化 Fig. 5 Catalase (CAT) activity in the gills and hepatopancreas of M. veneriformis exposed to microplastics 注: 不同小写字母表示在同一时间, 不同处理组之间存在显著差异(P < 0.05) |
在肝胰腺中, 1 μm微塑料暴露下的CAT活性呈现先升高后降低的趋势, 1、3、5 d时两个浓度均显著高于对照组(P < 0.05), 7 d时低浓度组活性下降至与对照组无显著性差异, 在整个实验过程中, 1 μm高浓度组的CAT活性均高于1 μm低浓度组。80 nm高浓度组四角蛤蜊肝胰腺中的CAT活性在1 d时显著升高, 随后开始逐渐降低, 并在5 d和7 d时显著低于对照组(P < 0.05)。
2.3.3 微塑料对四角蛤蜊酸性磷酸酶(ACP)活性的影响微塑料暴露下四角蛤蜊ACP活性的变化如图 6所示。1 μm微塑料暴露下四角蛤蜊鳃中的ACP活性在3 d之后均显著高于对照组(P < 0.05); 80 nm低浓度组鳃中的ACP活性在5 d和7 d时显著高于对照组(P < 0.05); 80 nm高浓度组鳃中的ACP活性在3 d时被显著抑制, 在5 d和7 d时显著升高, 在7 d时显著高于其他所有组(P < 0.05)。
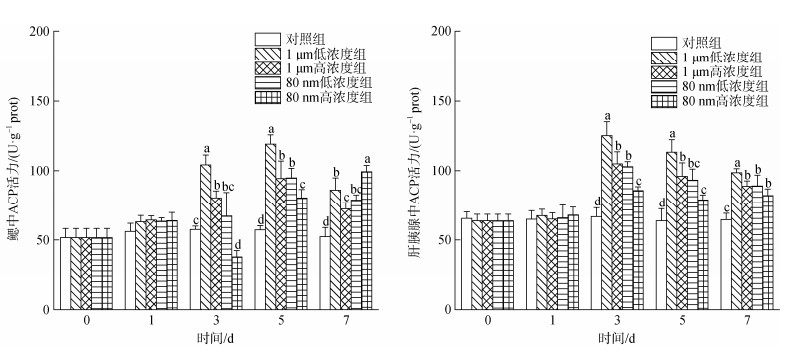 |
| 图 6 微塑料暴露下四角蛤蜊鳃和肝胰腺中酸性磷酸酶(ACP)活性的变化 Fig. 6 Acid phosphatase activity (ACP) in the gills and hepatopancreas of M. veneriformis exposed to microplastics 注: 不同小写字母表示在同一时间, 不同处理组之间存在显著差异(P < 0.05) |
各暴露组四角蛤蜊肝胰腺中的ACP活性在3 d时显著升高达到峰值(P < 0.05), 随后呈下降趋势。在3、5、7 d时, 各实验组的ACP活性均显著高于对照组, 1 μm低浓度组均显著高于80 nm高浓度组(P < 0.05), 并且呈现出大粒径暴露组高于小粒径、低浓度暴露组高于高浓度的规律。
2.3.4 微塑料对四角蛤蜊碱性磷酸酶(AKP)活性的影响微塑料暴露下四角蛤蜊鳃和肝胰腺中的AKP活性变化如图 7所示。1 d时, 不同暴露组四角蛤蜊鳃中的AKP活性均显著升高, 其中1 μm高浓度组的活性最高((15.54±1.27) U/g prot)且显著高于其他各实验组(P < 0.05); 3 d时, 各实验组AKP活性降低, 1 μm高浓度组((11.85±1.55) U/g prot)仍然显著高于其他各组(P < 0.05), 另外3个实验组与对照组无显著性差异(P > 0.05)。各暴露组肝胰腺中的AKP活性在1 d和3 d时均显著高于对照组, AKP活性在3 d时达到最高, 两个高浓度组显著高于两个低浓度组(P < 0.05)。到7 d时, 各暴露组肝胰腺中的AKP活性下降至与对照组之间无显著性差异。总体上, 四角蛤蜊肝胰腺中的AKP活性呈现出高浓度组大于低浓度组、大粒径组高于小粒径组的规律。
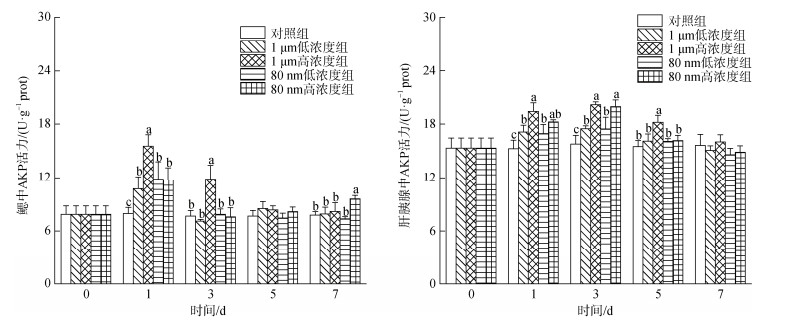 |
| 图 7 微塑料暴露下四角蛤蜊鳃和肝胰腺中碱性磷酸酶(AKP)活性的变化 Fig. 7 Alkali proteinase (AKP) activity in the gills and hepatopancreas of M. veneriformis exposed to microplastics 注: 不同小写字母表示在同一时间, 不同处理组之间存在显著差异(P < 0.05) |
如图 8所示, 微塑料暴露下四角蛤蜊鳃中的MDA浓度呈现先上升后下降的趋势。在1 d和3 d时, 各实验组的MDA浓度显著高于对照组(P < 0.05), 其中80 nm高浓度组最高。在实验的各取样时间, 同粒径下高浓度组四角蛤蜊鳃中的MDA浓度均高于低浓度组, 小粒径组的MDA浓度也呈现出高于大粒径组的规律。
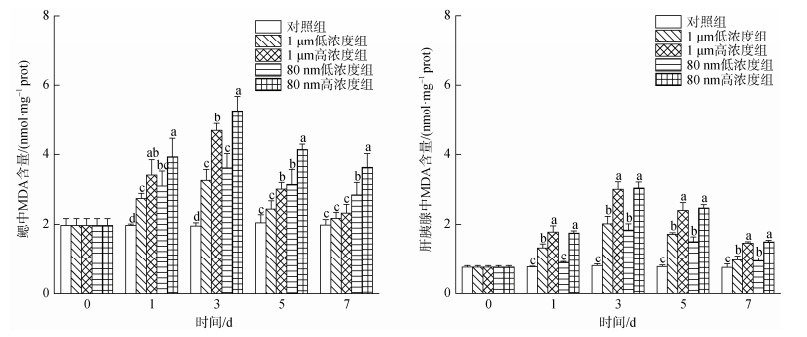 |
| 图 8 微塑料暴露下四角蛤蜊鳃和肝胰腺中丙二醛(MDA)浓度的变化 Fig. 8 Malondialdehyde (MDA) content in the gills and hepatopancreas of M. veneriformis exposed to microplastics 注: 不同小写字母表示在同一时间, 不同处理组之间存在显著差异(P < 0.05) |
微塑料暴露下, 四角蛤蜊肝胰腺中的MDA浓度变化规律与鳃中相似, 也呈现出先上升后下降的规律, 在3 d时浓度最高。在1 d时, 除80 nm低浓度组外, 其他暴露组的MDA浓度显著升高(P < 0.05)。3、5、7 d的各暴露组MDA浓度均显著高于对照组(P < 0.05)。在实验过程中所有时间段同粒径下的高浓度组MDA浓度均显著高于低浓度组的MDA浓度(P < 0.05)。
3 讨论 3.1 微塑料对四角蛤蜊滤食率和呼吸率的影响在本研究中, 仅有1 μm低浓度组蛤蜊的滤食率在实验过程中与对照组存在显著差异, 其他暴露组都呈现出略微下降的规律。目前关于贝类在微塑料暴露下摄食率变化的研究并无统一的规律。徐澎等[23]发现暴露于浓度为4.55×108粒/L, 粒径为0.2 μm的聚苯乙烯(PS)微球中的翡翠贻贝(Perna viridis)滤食率些微提升但并不显著。Sussarellu等[24]发现PS微球暴露下牡蛎对于藻类的摄食率显著上升。Gardon等[25]的研究结果显示, 暴露于2种粒径、3个浓度PS微球下的珠母贝(Pinctada margaritifera)的滤食率无显著变化, 但相比于对照组均有所下降。柳佳佳等[26]发现暴露于两种尺寸20 μg/L PS中的菲律宾蛤仔(Ruditapes philippinarum)对藻类的摄食率均显著降低。不同种类的贝类在面对不同粒径和浓度的微塑料时采取的摄食策略不同, 当环境中的塑料颗粒浓度上升时, 贻贝为了维持恒定的消耗速率会通过关闭瓣膜等方式降低滤食率, 而牡蛎则会因为产生假粪便而导致滤食速率的上升[27-28]。此外, 先前的研究表明贝类对于较大粒径的微塑料具有更强的摄食偏好[25], 因此本研究中微塑料暴露下四角蛤蜊的摄食率变化可能是由于贝类的摄食策略、微塑料粒径和浓度的不同等多种因素导致的。
除1 d时的80 nm低浓度组, 其余各时间、各暴露组中四角蛤蜊的呼吸速率均显著升高, 这与其他关于贝类微塑料暴露的研究结果相似。Green等[29]研究发现, 暴露于高浓度PLA颗粒2个月的牡蛎(Oyster edulis)的呼吸速率远高于对照组。Jiang等[30]将菲律宾蛤仔(R. philippinarum)暴露于浓度为25 μg/L, 粒径分别为5 μm和10 μm的PS颗粒中, 30 d后发现呼吸速率显著升高, 这可能是由于微塑料暴露引起了生物体的应激反应, 为了维持生理的稳态从而导致呼吸速率的升高。在本研究中暴露于高浓度、大粒径微塑料中四角蛤蜊的呼吸速率更高, 可能与微塑料对生物体的胁迫程度有关。
3.2 微塑料对四角蛤蜊免疫指标的影响本研究选择7 d为暴露时间, 进行四角蛤蜊微塑料暴露急性毒理实验, 暴露组微塑料浓度均高于四角蛤蜊样品采集区域表层水体中的微塑料浓度[31]。此前的研究已经证实海州湾地区双壳贝类能够摄入微塑料[32], 通过研究四角蛤蜊对高浓度微塑料暴露的短期响应, 可以为海洋环境中的微塑料污染提供可靠的生物预警指标。
生物体在受到环境污染物胁迫时, 细胞内会产生活性氧产物, 此时机体内的活性氧防护系统被激活, 产生超氧化物歧化酶(SOD)和过氧化氢酶(CAT)等抗氧化物酶。SOD可以催化超氧化物自由基突变为O2和H2O2, 从而阻断活性氧产物的形成, CAT可以将H2O2转化为水和O2, 通过测定抗氧化物酶的活性, 可以有效评估机体受到氧化胁迫的程度[33-36]。Zhang等[21]发现四角蛤蜊(M. veneriformis)暴露于20 μg/L的17 μm PS溶液中时, SOD活性产生显著变化并呈现出上升-下降-上升的规律。Paul-Pont等[37]的研究表明PS微球暴露下贻贝(Mytilus spp.)中的SOD和CAT活性在7 d时均低于对照组, 在14 d时高于对照组。Magara等[38]发现将紫贻贝(Mytilus edulis)暴露于PE微球96 h后, 鳃和消化道中的SOD活性无显著变化, 而CAT活性显著高于控制组。在本研究中, 微塑料的胁迫会让四角蛤蜊鳃和肝胰腺中的SOD和CAT活性在短时间内显著上升, 并且抗氧化物酶活性与微塑料浓度呈现出了显著的剂量-效应关系, 这表明高浓度的微塑料暴露会使四角蛤蜊体内的活性氧产物上升, 导致机体提升抗氧化系统酶的活性进行应对。
酸性磷酸酶(ACP)在贝类体液免疫调节中具有重要作用, 是巨噬细胞溶酶体的标志酶, 可以协助分解被细胞吞噬的异物并提高细胞对异物的识别能力[39-40]。碱性磷酸酶(AKP)在碱性条件下可催化磷酸单酯的水解和磷酸基团的转移, 具有重要的解毒作用[41]。在本研究中, 四角蛤蜊鳃和肝胰腺中ACP的活性在实验前期均显著上升, 在后期逐渐下降至与对照组无显著差异, 这可能是由于实验前期机体识别到外源污染物的入侵, 为清除异物、预防感染而提高ACP的活性[42]。实验前期大粒径、高浓度的微塑料暴露可能会加强细胞对于异物的识别作用, 从而表现出更强的ACP活性。四角蛤蜊鳃和肝胰腺中的AKP活性在3 d后发生显著性变化, 且低浓度组活性高于高浓度组, 这与陈孟玲等[43]对黑海参(Holothuria atra)在微塑料暴露下AKP活性的变化规律相类似。四角蛤蜊在微塑料暴露下的免疫反应增强, 需要更多的能量供应, 从而导致AKP活性的增强, 而高浓度的暴露可能会导致部分细胞的溶酶体膜受损, 致使AKP的活性受到抑制。
丙二醛(MDA)是脂质过氧化反应的产物, 其可以用于评价生物体氧化应激的程度[44-45]。Zhang等[21]发现四角蛤蜊(M. veneriformis)暴露于20 μg/L的17 μm PS溶液中时, MDA浓度呈现先升高后降低的趋势, 并在4 d时显著高于对照组。Li等[46]的研究结果显示, 河蚬在聚苯乙烯纳米颗粒暴露下, 高浓度组鳃中的MDA浓度最高并且不同浓度组之间存在显著差异。在本研究中, 四角蛤蜊鳃和肝胰腺中的MDA浓度显著上升, 这表明微塑料会导致四角蛤蜊细胞膜脂质过氧化损伤。此外, 鳃中的MDA浓度呈现出高浓度组大于低浓度组、小粒径组大于大粒径组的规律, 未来可对其机制进行进一步探索, 建立精准可靠的模型, 从而作为用于评估海洋贝类微塑料污染情况的可靠指标。
在本研究中四角蛤蜊对1 μm微塑料暴露的生理响应更加明显, 这可能与四角蛤蜊对微塑料的摄入和排出有关。Merzel等[47]发现贻贝会将与其喜欢的食物大小相似的微珠(1 000~2 000 nm)的微塑料转移至鳃的纤毛食物槽中, 四角蛤蜊的摄食机制与贻贝相似, 因此1 μm的微塑料可能比80 nm的微塑料更容易进入四角蛤蜊的鳃中从而进一步在体内迁移, 引起机体免疫系统的响应。此外, Brilliant等[48]发现巨扇贝(Placopecten magellanicus)体内大粒径颗粒比小粒径颗粒滞留时间更长, 这也可能是1 μm的微塑料更容易引起四角蛤蜊生理响应的原因。鳃是贝类最先接触微塑料的器官之一, 水体中的微塑料会被鳃所捕获, 其表面的绒毛会将微塑料和其他小型颗粒转移至机体内部[49], 因此四角蛤蜊鳃中的各项免疫指标在微塑料暴露前期变化更为明显, 而肝胰腺中部分指标的变化具有一定的滞后性。关于不同粒径的微塑料颗粒在贝类体内的迁移机制以及微塑料对贝类生理行为和免疫系统的影响机理未来还需要更加深入地研究。
4 结论上述实验表明微塑料暴露会对四角蛤蜊的生理行为和免疫系统产生不同程度的影响,微塑料暴露下四角蛤蜊鳃部的MDA浓度变化最为显著,呈现高浓度组大于低浓度组、小粒径组大于大粒径组的规律。本研究揭示了四角蛤蜊鳃中的MDA浓度可作为评估海洋微塑料污染的有效生物指标,为今后海洋微塑料污染监测以及微塑料对贝类的毒理效应研究提供理论和数据支持。
| [1] |
Plastics Europe. Plastics - the Facts 2021[R]. Brussels: Plastics Europe, 2021.
|
| [2] |
GEYER R, JAMBECK J R, LAW K L. Production, use, and fate of all plastics ever made[J]. Science Advances, 2017, 3(7): e1700782. DOI:10.1126/sciadv.1700782 |
| [3] |
THOMPSON R C, OLSEN Y, MITCHELL R P, et al. Lost at sea: Where is all the plastic?[J]. Science, 2004, 304(5672): 838. DOI:10.1126/science.1094559 |
| [4] |
LUSHER A L, MCHUGH M, THOMPSON R C. Occurrence of microplastics in the gastrointestinal tract of pelagic and demersal fish from the English Channel[J]. Marine Pollution Bulletin, 2013, 67(1/2): 94-99. |
| [5] |
FENG Z, ZHANG T, LI Y, et al. The accumulation of microplastics in fish from an important fish farm and mariculture area, Haizhou Bay, China[J]. Science of The Total Environment, 2019, 696: 133948. DOI:10.1016/j.scitotenv.2019.133948 |
| [6] |
DING J, SUN C, HE C, et al. Microplastics in four bivalve species and basis for using bivalves as bioindicators of microplastic pollution[J]. Science of The Total Environment, 2021, 782: 146830. DOI:10.1016/j.scitotenv.2021.146830 |
| [7] |
ZHANG T, SUN Y, SONG K, et al. Microplastics in different tissues of wild crabs at three important fishing grounds in China[J]. Chemosphere, 2020, 271: 129479. |
| [8] |
WRIGHT S L, THOMPSON R C, GALLOWAY T S. The physical impacts of microplastics on marine organisms: A review[J]. Environmental Pollution, 2013, 178: 483-492. DOI:10.1016/j.envpol.2013.02.031 |
| [9] |
LU Y, ZHANG Y, DENG Y, et al. Uptake and accumulation of polystyrene microplastics in zebrafish (Danio rerio) and toxic effects in liver[J]. Environmental Science & Technology, 2016, 50(7): 4054-4060. |
| [10] |
ZHU L, BAI H, CHEN B, et al. Microplastic pollution in North Yellow Sea, China: Observations on occurrence, distribution and identification[J]. Science of the Total Environment, 2018, 636: 20-29. DOI:10.1016/j.scitotenv.2018.04.182 |
| [11] |
ZHAO S, ZHU L, LI D. Microplastic in three urban estuaries, China[J]. Environmental Pollution, 2015, 206: 597-604. DOI:10.1016/j.envpol.2015.08.027 |
| [12] |
赵匠. 四角蛤蜊的形态和习性[J]. 吉林师范大学学报: 自然科学版, 1992, 1: 41-44. ZHAO Jiang. Habits and Morphology of Mactra veneriformis[J]. Journal of Jilin Normal University(Natural Science Edition), 1992, 1: 41-44. |
| [13] |
闫喜武, 张跃环, 左江鹏, 等. 北方沿海四角蛤蜊人工育苗技术的初步研究[J]. 大连水产学院学报, 2008, 23(5): 348-352. YAN Xiwu, ZHANG Yuehuan, ZUO Jiangpeng, et al. A preliminary study on the technique of artificial breeding of Mactra veneriformis in the north coast of China[J]. Journal of Dalian Ocean University, 2008, 23(5): 348-352. |
| [14] |
任加云, 夏江宝, 尚帅. 镉暴露对文蛤和四角蛤蜊血细胞功能及DNA损伤影响[J]. 海洋湖沼通报, 2021, 43(3): 98-106. REN Jiayun, XIA Jiangbao, SHANG Shuai. Effects of cadmium exposure on hemocyte function and DNA damage in clam Meretrix meretrix and Mactra veneriformis[J]. Transactions of Oceanology and Limnology, 2021, 43(3): 98-106. |
| [15] |
任加云, 夏江宝, 苗晶晶. 石油烃暴露对文蛤和四角蛤蜊解毒指标影响的对比研究[J]. 海洋环境科学, 2017, 36(4): 552-559, 570. REN Jiayun, XIA Jiangbao, MIAO Jingjing. Comparative studies on detoxification biomarkers effects of clam Meretrix meretrix and Mactra veneriformis under petroleum hydrocarbons exposure[J]. Marine Environmental Science, 2017, 36(4): 552-559, 570. |
| [16] |
彭中校, 黄会, 王玮云, 等. 异丙甲草胺对四角蛤蜊鳃和肝胰腺抗氧化酶系和组织结构的影响[J]. 中国水产科学, 2022, 29(4): 574-584. PENG Zhongxiao, HUANG Hui, WANG Weiyun, et al. Effects of metolachlor on the antioxidant enzyme system and histological structure in the gills and hepatopancreas of Mactra veneriformis[J]. Journal of Fishery Sciences of China, 2022, 29(4): 574-584. |
| [17] |
CHRISTOPH D R, JAHNKE A, GOROKHOVA E, et al. Impacts of biofilm formation on the fate and potential effects of microplastic in the aquatic environment[J]. Environmental Science & Technology Letters, 2017, 4(7): 258-267. |
| [18] |
MATHALON A, HILL P. Microplastic fibers in the intertidal ecosystem surrounding Halifax Harbor, Nova Scotia[J]. Marine Pollution Bulletin, 2014, 81(1): 69-79. DOI:10.1016/j.marpolbul.2014.02.018 |
| [19] |
OBERBECKMANN S, LODER M G J, LABRENZ M. Marine microplastic-associated biofilms: a review[J]. Environmental Chemistry, 2015, 12(5): 551-562. DOI:10.1071/EN15069 |
| [20] |
SUN S, SHI W, TANG Y, et al. The toxic impacts of microplastics (MPs) and polycyclic aromatic hydrocarbons (PAHs) on haematic parameters in a marine bivalve species and their potential mechanisms of action[J]. Science of The Total Environment, 2021, 783: 147003. DOI:10.1016/j.scitotenv.2021.147003 |
| [21] |
ZHANG X, WANG X, YAN B. Single and combined effects of phenanthrene and polystyrene microplastics on oxidative stress of the clam (Mactra veneriformis)[J]. Science of The Total Environment, 2021, 771: 144728. DOI:10.1016/j.scitotenv.2020.144728 |
| [22] |
COOPER N L, BIDWELL J R. Cholinesterase inhibition and impacts on behavior of the Asian clam, Corbicula fluminea, after exposure to an organophosphate insecticide[J]. Aquatic Toxicology, 2006, 76(3/4): 258-267. |
| [23] |
徐澎, MUHAMMAD Junaid, 刘燕, 等. 微塑料和全氟辛烷磺酸类物质共暴露对翡翠贻贝滤食率和抗氧化系统的影响[J]. 北京大学学报(自然科学版), 2021, 57(5): 894-902. XU Peng, MUHAMMAD Junaid, LIU Yan, et al. Effects of microplastics and PFOS co-exposure on the filtration rate and antioxidant system of Perna viridis[J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2021, 57(5): 894-902. |
| [24] |
SUSSARELLU R, SUQUET M, THOMAS Y, et al. Oyster reproduction is affected by exposure to polystyrene microplastics[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(9): 2430-2435. |
| [25] |
GARDON T, MORVAN L, HUVET A, et al. Microplastics induce dose-specific transcriptomic disruptions in energy metabolism and immunity of the pearl oyster Pinctada margaritifera[J]. Environmental pollution, 2020, 266(3): 115180. |
| [26] |
柳佳佳, 朱效鹏, 滕佳, 等. 微塑料和芘对菲律宾蛤仔的毒性效应研究[J]. 海洋通报, 2021, 40(6): 644-656. LIU Jiajia, ZHU Xiaopeng, TENG Jia, et al. Toxic effects of polystyrene microplastics and pyrene on Ruditapes philippinarum[J]. Marine Science Bulletin, 2021, 40(6): 644-656. |
| [27] |
LIAO C M, JOU L J, CHEN B C. Risk-based approach to appraise valve closure in the clam Corbicula fluminea in response to waterborne metals[J]. Environmental Pollution, 2005, 135(1): 41-52. DOI:10.1016/j.envpol.2004.10.015 |
| [28] |
GREEN D S, BOOTS B, O'CONNOR N E, et al. Microplastics affect the ecological functioning of an important biogenic habitat[J]. Environmental Science & Technology, 2017, 51: 68-77. |
| [29] |
GREEN D S. Effects of microplastics on European flat oysters, Ostrea edulis and their associated benthic communities[J]. Environmental Pollution, 2016, 216: 95-103. DOI:10.1016/j.envpol.2016.05.043 |
| [30] |
JIANG W, FANG J, DU M, et al. Microplastics influence physiological processes, growth and reproduction in the Manila clam, Ruditapes philippinarum[J]. Environmental Pollution, 2022, 293: 118502. DOI:10.1016/j.envpol.2021.118502 |
| [31] |
李征, 高春梅, 杨金龙, 等. 连云港海州湾海域表层水体和沉积物中微塑料的分布特征[J]. 环境科学, 2020, 41(7): 3212-3221. LI Zheng, GAO Chunmei, YANG Jinlong, et al. Distribution characteristics of microplastics in surface water and sediments of Haizhou Bay, Lianyungang[J]. Environmental Science, 2020, 41(7): 3212-3221. |
| [32] |
TANG R, ZHANG T, SONG K, et al. Microplastics in commercial clams from the intertidal zone of the South Yellow Sea, China[J]. Frontiers in Marine Science, 2022, 9: 905923. DOI:10.3389/fmars.2022.905923 |
| [33] |
HU M, Li L, SUI Y, et al. Effect of pH and temperature on antioxidant responses of the thick shell mussel Mytilus coruscus[J]. Fish & Shellfish Immunology, 2015, 46: 573-583. |
| [34] |
RYU H S, HAN J H, SONG J A, et al. Effects of total residual oxidant on oxidative stress in juvenile olive flounder Paralichthys olivaceus[J]. Ozone: Science & Engineering, 2020, 42(3): 277-285. |
| [35] |
CHOI H J, JI J, CHUNG K H, et al. Cadmium bioaccumulation and detoxification in the gill and digestive gland of the Antarctic bivalve Laternula elliptica[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2007, 145(2): 227-235. |
| [36] |
COPPOLA F, ALMEIDA A, HENRIQUES B, et al. Biochemical impacts of Hg in Mytilus galloprovincialis under present and predicted warming scenarios[J]. Science of The Total Environment, 2017, 601/602: 1129-1138. DOI:10.1016/j.scitotenv.2017.05.201 |
| [37] |
PAUL-PONT I, LACROIX C, FERNÁNDEZ C G, et al. Exposure of marine mussels Mytilus spp. to polystyrene microplastics: Toxicity and influence on fluoranthene bioaccumulation[J]. Environmental Pollution, 2016, 216: 724-737. DOI:10.1016/j.envpol.2016.06.039 |
| [38] |
MAGARA G, ELIA A C, SYBERG K, et al. Single contaminant and combined exposures of polyethylene microplastics and fluoranthene: accumulation and oxidative stress response in the blue mussel, Mytilus edulis[J]. Journal of Toxicology and Environmental Health, Part A, 2018, 81(16): 761-773. DOI:10.1080/15287394.2018.1488639 |
| [39] |
曾祥兴, 张驰, 李康生. 无脊椎动物体液免疫研究进展[J]. 微生物学免疫学进展, 2009, 37(3): 74-77. ZENG Xiangxing, ZHANG Chi, LI Kangsheng. Advances in invertebrate humoral immunity research[J]. Progress in Microbiology and Immunology, 2009, 37(3): 74-77. |
| [40] |
李海兵, 宋晓玲, 韦嵩, 等. WSSV感染对克氏原螯虾血细胞吞噬和肝胰腺磷酸酶活性的影响[J]. 渔业科学进展, 2011, 32(2): 78-82. LI Haibing, SONG Xiaoling, WEI Song, et al. Impacts of WSSV on the activity of haemocyte phagocytosis and hepatopancreas phosphatase in Procambarus clarkia[J]. Progress in Fishery Sciences, 2011, 32(2): 78-82. |
| [41] |
ZHANG R Q, CHEN Q X, ZHENG W Z, et al. Inhibition kinetics of green crab (Scylla serrata) alkaline phosphatase activity by dithiothreitol or 2-mercaptoethanol[J]. The International Journal of Biochemistry & Cell Biology, 2000, 32(8): 865-872. |
| [42] |
CHENG T C. The Role of lysosomal hydrolases in molluscan cellular response to immunologic challenge[M]. New York: Springer US, 1978.
|
| [43] |
陈孟玲, 高菲, 王新元, 等. 微塑料对黑海参(Holothuria atra)免疫和消化生理的影响[J]. 海洋科学, 2021, 45(4): 126-135. CHEN Mengling, GAO Fei, WANG Xinyuan, et al. Effects of microplastics on immunity and digestion of sea cucumber, Holothuria atra[J]. Marine Sciences, 2021, 45(4): 126-135. DOI:10.11759/hykx20201023002 |
| [44] |
LUSHCHAK VI. Environmentally induced oxidative stress in aquatic animals[J]. Aquatic Toxicology, 2011, 101(1): 13-30. DOI:10.1016/j.aquatox.2010.10.006 |
| [45] |
WANG J, DONG B, YU Z X, et al. The impact of acute thermal stress on green mussel Perna viridis: Oxidative damage and responses[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2018, 222: 7-15. |
| [46] |
LI Z, FENG C, WU Y, et al. Impacts of nanoplastics on bivalve: Fluorescence tracing of organ accumulation, oxidative stress and damage[J]. Journal of Hazardous Materials, 2020, 392: 122418. DOI:10.1016/j.jhazmat.2020.122418 |
| [47] |
MERZEL R L, PURSER L, SOUCY T L, et al. Uptake and retention of nanoplastics in Quagga Mussels[J]. Global Challenges, 2019, 4(6): 1800104. |
| [48] |
BRILLANT M G S, MACDONALD B A. Postingestive selection in the sea scallop, Placopecten magellanicus (Gmelin): the role of particle size and density[J]. Journal of Experimental Marine Biology and Ecology, 2000, 253(2): 211-227. DOI:10.1016/S0022-0981(00)00258-6 |
| [49] |
SENDRA M, SPARAVENTI E, NOVOA B, et al. An overview of the internalization and effects of microplastics and nanoplastics as pollutants of emerging concern in bivalves[J]. Science of The Total Environment, 2020, 753: 142024. |
 2024, Vol. 48
2024, Vol. 48


