
文章信息
- 曲丽雯, 刘建国, 于文杰. 2024.
- QU Liwen, LIU Jianguo, YU Wenjie. 2024.
- 虾青素分子结构、活性及其在水产生物中的分布和应用
- Molecular structure and activity of astaxanthin, its distribution and applications in aquatic organisms
- 海洋科学, 48(6): 93-105
- Marine Sciences, 48(6): 93-105.
- http://dx.doi.org/10.11759/hykx20240222001
-
文章历史
- 收稿日期:2024-02-22
- 修回日期:2024-05-06
2. 中国科学院海洋研究所, 山东省实验海洋生物学重点实验室, 水产品种创制与高效养殖重点实验室, 山东 青岛 266071;
3. 青岛海洋科技中心海洋生物学与生物技术功能实验室, 山东 青岛 266237;
4. 黄三角农高区院士工作站, 国家盐碱地综合利用技术创新中心, 山东 东营 257000
2. CAS & Shandong Key Laboratory of Experimental Marine Biology, Key laboratory of Breeding Biotechnology and Sustainable Aquaculture, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
3. Laboratory for Marine Biology and Biotechnology, Qingdao Marine Science and Technology Center, Qingdao 266237, China;
4. Academician Workstation of Agricultural High-tech Industrial Area of the Yellow River Delta, National Center of Technology Innovation for Comprehensive Utilization of Saline-Alkali Land, Dongying 257000, China
近年来, 虾青素受到越来越多人们的关注, 尤其在化妆品、水产、食品、营养保健甚至药品领域方面, 并逐渐成为时尚话题。但是虾青素属于哪类物质、有什么特性和作用功效?大众对此依然陌生, 远未达到广泛了解、全面认知和熟悉的程度。
在日常生活中, 虾青素时常与人们不期而遇或擦肩而过, 比如火烈鸟美丽的红艳羽毛、三文鱼的鲜红肉质以及加热蒸煮后变红的虾蟹外壳, 都是因虾青素所导致的。
虾青素是类胡萝卜素的氧化衍生物的重要成员之一, 呈鲜红色, 具有很强的着色性, 属于具有营养价值的天然色素。虾青素可与不同蛋白或酯类结合, 由此赋予各类海洋生物丰富多样的斑斓色彩。例如, 在虾蟹等甲壳动物外壳中, 虾青素与特殊蛋白质发生互作, 使虾蟹壳呈青蓝色; 随着烹煮过程加热升温, 蛋白质热变性凝固, 虾青素逐渐暴露出其固有的鲜红色泽; 虾青素累积在虾蟹肝胰腺和性腺中, 赋予蟹膏与蟹黄特殊的色泽与营养美味, 并且虾青素越多其颜色就越深、品质也越高[1-2]。同时, 虾青素具很强的抗氧化性, 可有效地淬灭单线态氧和清除自由基, 其抗氧化活性远高于茶多酚、β-胡萝卜素、辅酶Q10、维生素C和维生素E等其他抗氧化物质[3]。
近年来, 虾青素借助其天然色素特性、强着色能力和抗氧化性, 在虾蟹鱼等水产养殖领域的应用也越来越广泛[1, 4]。通过添加虾青素可生产系列优质水产品, 满足消费者追求营养健康和高品质生活的需求, 已成为业内关注的热点话题和时尚潮流新宠与发展趋势。
众所周知, 物质结构决定其功能。尽管不同来源的虾青素在分子层面的结构相同, 但在亚分子层面却具有明显差异和多样性, 其中包括多种顺、反异构体和不同类型的旋光异构体。虾青素亚分子结构的不同, 也决定着其功效存在显著性差异[5]。为此, 本文从虾青素独特的化学分子结构特征、不同旋光与顺反异构体类型入手, 对虾青素的分子和亚分子结构以及在水产生物中的分布与结构特征予以概述, 并分析其生物活性和在水产养殖中的应用效果, 全面提升水产健康养殖水平。
1 虾青素的化学结构及活性虾青素(Astaxanthin)属于一种酮式类胡萝卜素, 化学名称: 3, 3′-二羟基-4, 4′-二酮基-β, β′-胡萝卜素, 化学式为C40H52O4, 为萜烯类不饱和化合物。
如图 1所示, 在虾青素的分子结构中存在一个超级共轭大π键, 该特殊结构由13个双键(11个碳-碳双键与2个碳氧双键)共同组成, 在化学分子中是极为罕见的, 也赋予虾青素在紫外-可见光区具强烈的光吸收能力、鲜红色泽和极强的抗氧化能力, 可有效淬灭单线态氧清除自由基, 防止细胞受到氧化损伤[3, 6]。
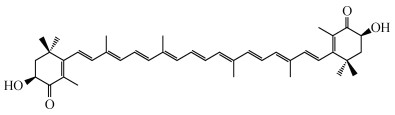 |
| 图 1 虾青素的分子结构 Fig. 1 Molecular structure of astaxanthin |
在虾青素分子中有两个手性中心, 分别位于分子两端环状结构的C-3和C-3'位置(见图 2)。手性中心有R-型或S-型两种构象, 因此虾青素至少存在3种旋光异构体: 分别是2个对映异构体3R, 3'R(右旋)、3S, 3'S(左旋)和一个无旋光性的内消旋异构体3R, 3'S[3]。其中, 左旋体(3S, 3'S)是自然界动植物体内分布最广泛的, 在3种异构体中生物活性最高[5]。
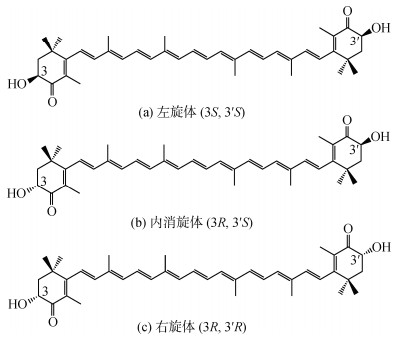 |
| 图 2 虾青素旋光异构体的结构 Fig. 2 Structure of astaxanthin optical isomers |
研究发现, 在自然界存在于细菌、藻类和高等植物的天然虾青素基本都是生物活性最高的3S, 3'S左旋结构, 在真菌中的虾青素通常为3R, 3'R右旋结构, 在天然虾蟹鱼类等动物体内的虾青素基本以左旋结构为主, 但在人工养殖的水产动物中会受到添加虾青素来源的影响而存在明显差异[7]。人工合成的虾青素, 存在着3种异构体类型, 即3S, 3'S左旋体、3R, 3'R右旋体和3R, 3'S内消旋体, 三者的比例大致在1∶1∶2[8]。虾青素内消旋体没有旋光特性, 而同等比率的3S, 3'S左旋体与3R, 3'R右旋体可组成外消旋混合体, 致使其旋光性相互抵消。
1.2 虾青素顺、反异构体在虾青素分子的中间线型部分存在11个碳-碳双键, 双键中的π键不能绕键轴旋转, 所以虾青素理论上存在多种顺反异构体。根据次序规则, 较优基团键合在双键同侧属于Z-型(即顺式结构); 而较优基团键合在双键异侧为E-型(即反式结构)。一般顺式结构的虾青素异构体相对活跃, 但不稳定。因其分支基团并不竞争空间位置, 全E-型结构的虾青素相对稳定[9]。
虾青素每个双键都可能是Z-型或E-型结构, 理论上可推断虾青素有多达211个顺反异构体, 但受分支基团的空间位阻影响, 虾青素顺反异构体的实际数量大幅下降。目前发现在天然虾青素分子的9, 13和15位有Z-型结构(参图 3), 虾青素几何异构体主要为全反式(全-E型), 其次是9-顺式(9Z)、13-顺式(13Z)和15-顺式(15Z)异构体, 另外还发现有少量的9, 13-双顺式(9, 13Z)、9, 15-双顺式(9, 15Z)、13, 15-双顺式(13, 15Z)异构体, 尚不排除存在痕量9, 13, 15-三顺式(9, 13, 15Z)等其他虾青素异构体[10]。
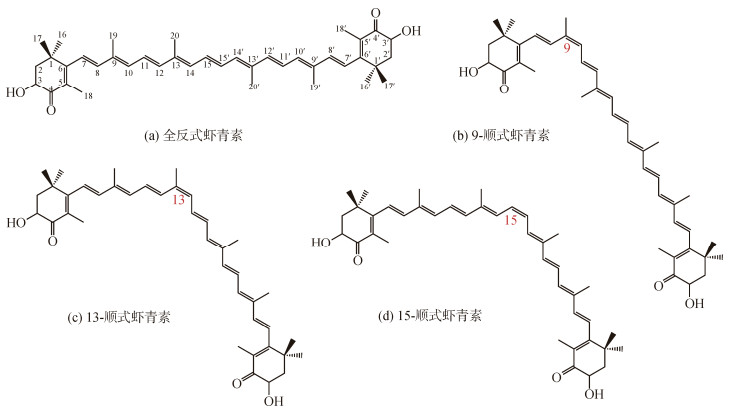 |
| 图 3 虾青素顺反异构体的结构 Fig. 3 Structure of astaxanthin geometric isomers |
无论天然左旋虾青素, 还是右旋虾青素或内消旋虾青素, 基本以全反式结构为主、顺式为辅。
1.3 游离和酯合虾青素天然虾青素的存在形式有游离态和酯化态。在虾青素分子两端的环状结构中分别有一个羟基, 如果羟基都未结合则为游离态虾青素。游离态虾青素通常不稳定, 容易被氧化。化学合成虾青素一般为游离态形式, 目前尚没有酯化态。虾青素上的羟基还可与脂肪酸结合成酯, 如果其中一个羟基与脂肪酸结合成酯, 称为虾青素单酯; 两个羟基都与脂肪酸结合成酯, 则称为虾青素二酯或双酯[11]。雨生红球藻(Haematococcus pluvialis)中的虾青素主要以酯化形式存在, 其游离态虾青素相对较少[12]。水生动物表皮和甲壳动物外壳上的虾青素主要为酯化态, 而某些种类如脊尾白虾(Exopalaemon carinicauda)红色突变体内脏和肌肉中, 以游离态虾青素为主[13-14]。
虾青素酯化后疏水性增加、稳定性提高, 虾青素双酯比单酯的疏水性更高、稳定性也更好。依据脂肪酸的碳链长度与饱和度不同, 脂肪酸分子也存在多种类型, 具体包括C14、C16、C18、C20和C22的饱和/单不饱和/与多不饱和脂肪酸。在各种生物体内, 与虾青素酯合的脂肪酸存在着复杂多样性[3]。在不同生物体内或不同发育阶段以及各个部位中, 虾青素具体与哪类脂肪酸发生酯化反应, 目前还尚未清楚。复杂多样的脂肪酸甚至脂蛋白, 与虾青素酯化形成丰富多样的复合体, 对鱼类、虾类和蟹类等水产动物缤纷色彩的形成、物种生存与环境适应, 以及自然竞争性选择中均发挥着不可替代的重要作用。
1.4 虾青素活性与镶嵌模型目前国内外报道虾青素的化学活性主要集中在其强抗氧化性和有效捕获自由基[15-16]。
强抗氧化活性: 虾青素的抗氧化活性主要体现在它具有良好的自由基清除能力, 虾青素分子中的多个双键结构和环结构, 形成了共轭大π键体系, 这些结构都具有比较活泼的电子效应, 能向自由基提供电子或吸引自由基的未配对电子, 有效地猝灭氧化性极强的单线态氧、清除自由基、防止或阻断单线态氧和自由基引发的链式反应[3, 15-16]。研究表明猝灭活性氧能力随着共轭双键数的增加而增加, 虾青素结构中共轭双键13个(其中11个碳碳双键和2个碳氧双键), 如此之多的共轭双键在化学分子极为少见, 也赋予其极强的猝灭能力, 其猝灭活性氧的能力为VE的550~1 000倍, 比具有类似结构的β-胡萝卜素、维生素E、α-胡萝卜素、叶黄素和番茄红素都高, 是目前已知的自然界可食用物质中最强的[17]。
镶嵌模型: 虾青素分子不仅具有很强的抗氧化性, 而且分子同时兼有亲水(端头环状结构中的羟基)和疏水(碳链的共轭大π键体系)双重特性, 该独特的双重特性也使得虾青素与细胞膜脂质双分子层特征(两侧亲水极性头与中间疏水非极性脂肪酸尾)十分吻合, 因此虾青素能够横跨、镶嵌于双分子层细胞膜上(图 4), 可从膜外、膜中间和膜内全方位捕获自由基, 对细胞膜脂质双分子层、膜蛋白和转运蛋白等发挥保护作用, 抑制脂质过氧化; 同样还可保护细胞及DNA免受氧化损伤, 保护细胞内的蛋白质和酶类, 使之更好地发挥功能, 维持细胞新陈代谢[18-19]。
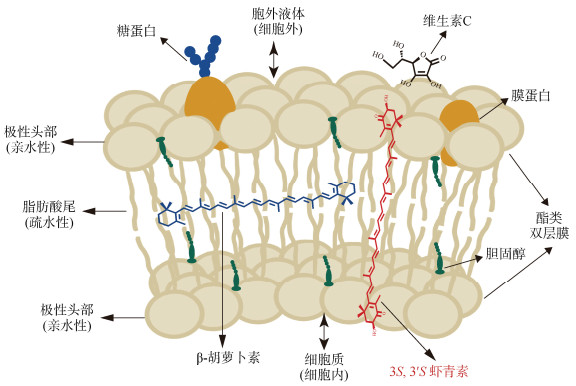 |
| 图 4 虾青素分子跨越细胞膜的镶嵌模型 Fig. 4 Mosaic model of the transmembrane orientation of the astaxanthin molecule |
从图 4还可看出, 其他抗氧化物质与细胞膜双分子层并不能完全吻合, 如脂溶性β-胡萝卜素只能嵌埋于膜中间脂质层中发挥保护作用, 而对膜两侧极性的亲水头部很难发挥保护作用; 同样, 水溶性的维生素C只浮于膜表面对极性亲水层和表面蛋白发挥保护作用, 而对膜中间的非极性疏水尾难以发挥保护功效。
综上可见, 虾青素的特殊分子结构、抗氧化活性以及镶嵌在细胞膜上等理化特性, 使其无论从微观电子、原子和分子, 还是细胞膜系统与亚细胞器, 到不同细胞、组织和器官与系统, 在各个不同层面都能发挥特殊的抗氧化与保护作用, 达到固本清源维持生命活动的各种代谢的协调平衡。
2 虾青素在水产生物中的分布与结构特征虾青素广泛分布于水生生物体内, 主要包括甲壳动物(虾、蟹、裸腹溞及卤虫等)、鲑鳟鱼类和珊瑚礁观赏鱼类、藻类以及其他微型浮游动物和微生物。其中, 藻类和真菌、细菌等微生物能够自身合成虾青素, 而水生动物并不能自主从头合成虾青素, 其体内的虾青素主要依靠从摄食的食物中直接获取, 或间接地从食物中获得β-胡萝卜素等虾青素合成前体, 经消化吸收富集与再加工修饰(如羟基化、酮基化)产生, 期间还可能发生异构化和酯化等系列反应[7]。
2.1 虾类全球分布极广、种类繁多的虾类, 包括中华锦绣龙虾(俗称龙虾, Panulirus ornatus)、斑节对虾(Penaeus monodon)、中国明对虾(Fenneropenaeus chinensis)、南美白对虾(Litopenaeus vannamei)、脊尾白虾(Exopalaemon carinicauda)、鹰爪虾(俗称蛎虾, Trachysalambria curvirostris)、克氏原螯虾(俗称小龙虾, Procambarus clarkii)、虾蛄(俗称皮皮虾, Oratosquilla oratoria)和南极磷虾(Euphausia superba)等, 几乎所有虾类体内或多或少都含有虾青素, 这也是虾类独具多彩斑斓体色的重要原因[1]。
分析主要野生海产虾的虾青素发现不同虾以及各部位的虾青素在浓度和组成上存在显著差异[10]。其中, 虾青素在南美白对虾中主要集中于头部(最高达295.20 mg/kg), 其腹部肌肉中浓度最低(只有2.12 mg/kg); 虾青素在中国明对虾的头部中浓度较高, 壳次之; 斑节对虾以壳中虾青素浓度较高, 头次之; 脊尾白虾身体通透, 虾青素浓度最低[10, 13]。分析还发现: 虾青素以游离和酯化二种方式存在于虾体内, 且酯化态虾青素(47.69%~95.56%)高于游离态(4.44%~52.31%); 就顺反异构而言, 以全反式异构体为主, 约占65%~93%, 其余为9-顺式、13-顺式、15-顺式和双顺式异构体; 就旋光异构而言, 以更适宜于人体吸收利用和生物活性强的左旋体为主, 在脊尾白虾中虾青素左旋比例高达96%[10, 13]。
在另一重要经济虾种鹰爪虾中, 虾青素是最主要的类胡萝卜素, 占75.18%~88.86%; 而β-胡萝卜素次之, 占2.86%~16.83%; 还检测到少量海胆酮、角黄素和虾红素。在鹰爪虾虾青素中, 85.18%~90.59%是酯化态的, 其余为游离态。全反式虾青素是主要的几何异构体类型, 其次为13-顺式、9-顺式、双顺式和15-顺式异构体。就旋光异构体而言, 各部位的虾青素都是3种旋光异构体的混合物, 其中左旋和内消旋虾青素的比例显著高于右旋异构体。在剥虾仁过程所产生的虾头虾壳等废弃物中, 含类胡萝卜素80.28 mg/kg干质量, 几乎是虾肉的2倍。在干燥加工中, 另有近一半的类胡萝卜素发生丢失, 尤其虾青素丢失最严重[20]。
从脊尾白虾中选育出的红色突变体—科苏红1号新品种, 其色素组成特征是以虾青素为主的类胡萝卜素浓度明显增加, 尤其在可食用虾肉中的虾青素浓度比普通脊尾白虾高出8.5倍。这也是该品种独具特色的最重要经济性状[10, 14]。虾青素在血淋巴中浓度最高, 达6.53 mg/kg鲜质量; β-胡萝卜素以表皮中浓度最高。各组织中海胆酮浓度较低(最高也只有0.84 mg/kg鲜质量), 角黄素在血淋巴中浓度最高, 叶黄素和玉米黄质在血淋巴中浓度最高, 分别为0.421 mg/kg鲜质量和1.245 mg/kg鲜质量。在普通脊尾白虾中, 表皮的虾青素和β-胡萝卜素浓度最高, 分别有2.464 mg/kg鲜质量和1.018 mg/kg鲜质量, 同时只有微量的海胆酮和角黄素, 无叶黄素和玉米黄质[10, 14]。
2.2 蟹类蟹类在全球分布也极其广泛、种类繁多, 经济物种包括帝王蟹(Paralithodes camtschaticus)、三疣梭子蟹(Portunus trituberculatus)、锯缘青蟹(Scylla serrata)、中华绒螯蟹(俗称大闸蟹, Eriocheir sinensis)、远海梭子蟹(俗称花蟹, Portunus pelagicus)等, 蟹体内都含有虾青素等类胡萝卜素[1, 21]。
虾青素等类胡萝卜素的组成和浓度通常与蟹类的外观色泽密切相关, 也是权衡蟹类产品质量和决定其市场价格的重要指标[22-23]。比如中华绒螯蟹多为墨绿色, 少量为紫壳个体, 紫壳中华绒螯蟹的市场价格远高于绿壳中华绒螯蟹。为探究原因, 对比影响外观色泽最大的虾青素等类胡萝卜素组成发现: 紫壳雌蟹的外壳、肝胰腺和卵巢的红度均显著高于绿壳蟹, 紫壳雄蟹的蟹黄和肝胰腺的黄度也均显著高于绿壳蟹。就蟹壳中虾青素的组成和浓度而言, 紫壳蟹中总虾青素、游离虾青素和酯化虾青素的浓度都明显高于绿壳蟹。但是无论雌、雄紫壳蟹与其绿壳蟹中虾青素的酯化率相差并不大, 通常游离虾青素稍低(43%~51%), 而酯化虾青素略高(49%~57%)。就其肝胰腺而言, 无论雌蟹还是雄蟹, 紫壳蟹肝胰腺中总类胡萝卜素和β-胡萝卜素的浓度也显著高于绿壳个体, 并且紫壳蟹雄蟹中总虾青素和酯化虾青素的浓度显著高于绿壳蟹, 其中酯化虾青素高于游离虾青素, 二者分别占总虾青素的54%~60%和40%~ 46%。在紫壳雌蟹的卵巢中, 总类胡萝卜素、总虾青素、酯化虾青素和叶黄素的浓度均显著高于绿壳蟹, 其虾青素酯化率在紫壳蟹中占61%, 略高于绿壳蟹(57%)[24]。上述结果表明, 虾青素等类胡萝卜素的浓度与组成明显决定着中华绒螯蟹的色泽, 进而对中华绒螯蟹的上市价格产生重要影响。
蟹类主要通过吸收、转运、代谢和沉积等一系列过程, 将摄取的虾青素转化为自身虾青素, 其体内虾青素有游离和酯化态, 其亚分子结构包括左旋、右旋和消旋3种旋光异构体, 以及全反式、9-顺式、13-顺式和15-顺式等主要几何异构体。与鱼类和虾类相似, 蟹类体内的虾青素组成与其食物源虾青素异构体有关, 但并不完全一致[7]。在不同物种或同一物种的不同部位存在一定差异, 表明虾青素在蟹类的吸收转化和沉积较为复杂, 可能存在选择性吸收机制与异构化过程[25]。
2.3 其他小型甲壳动物在水产重要饵料生物卤虫(Artemia)、裸腹溞(Moina macrocopa)等枝角类以及桡足类动物中也有虾青素的广泛分布和积累, 由此导致个体发红而常被誉为“红色小虫”[26-28]。卤虫也称盐水丰年虫, 通常分布在天然咸水湖泊中, 有的湖泊常年处于寒冷地带, 含盐量极高。为了生存, 卤虫演化出抗强光、耐高盐碱、耐严寒的特殊适应能力以及其他抗逆应激等能力。有研究表明, 卤虫体内富集的类胡萝卜素对改善其体色、生长和健康状况有着重要作用, 饲喂富含虾青素的红球藻能明显提高卤虫的存活率、体长、抗氧化能力、免疫力和抗病能力[26]。
在饵料生物轮虫(Brachionus plicatilis)培养过程中, 添加富含虾青素的红球藻藻渣(125 mg/L), 可明显提高轮虫的种群密度、怀卵轮虫个数和轮虫卵总个数, 说明红球藻藻渣可提高轮虫的繁殖能力; 另外, 饲喂后, 轮虫个体中类胡萝卜素和虾青素的积累量均明显增加, 虾红素占比降低, 而全反式虾青素占比增加, 说明红球藻藻渣显著提高了轮虫的营养品质[27]。同样, 在饵料生物裸腹溞的培养过程中, 添加红球藻藻渣可提高其体内总类胡萝卜素和虾青素的浓度, 体色由绿色变为橙色或橙红色; 同时饲喂红球藻藻渣不仅提高了裸腹溞个体大小, 还提高了其个体数量(养殖密度), 表明红球藻藻渣可促进裸腹溞生长繁殖。添加藻渣尤其62.5 mg/L浓度时, 裸腹溞总类胡萝卜素和虾青素的浓度分别提高1.24和1.54倍, 明显强化了饵料生物裸腹溞的营养品质[28]。
2.4 鱼类鱼类尤其鲑鳟鱼类和珊瑚礁观赏鱼类含有天然虾青素。观赏鱼体内含虾青素越多, 其体色越红、鳞片光亮鲜艳。而在鲑鳟鱼体内, 虾青素主要分布于其肌肉组织中, 其浓度多寡与肉质营养和色价以及上市价格存在密切关系。一般而言, 虾青素浓度越高、营养和色价越高, 市场价格越贵[29]。鱼类体内虾青素浓度高低还与抗病能力有关, 研究表明雌性鲑鱼体内虾青素浓度越高, 所产的鱼卵含虾青素就越多、色泽也越红, 可孵化出健康仔稚鱼, 并能够正常生长发育; 相反, 雌性鲑鱼体内虾青素浓度低, 所产鱼卵含虾青素就少、外观乏色, 孵化的仔稚鱼极易发生M74病症而死亡, 这也是1974—1998年长期导致人工孵育的三文鱼鱼苗极易发病死亡的根本原因[30-31]。随着在亲鱼培育中饲喂虾青素饲料, 不仅亲鱼健康、鱼卵更红, 孵化的仔稚鱼也不再发病并能够健康生长发育。虾青素还影响着鱼类肌肉的耐受力和爆发力, 三文鱼从海洋洄游到江河上游淡水产卵过程中, 体内含虾青素更多的个体具更强的爆发力和耐受力, 可保障其长途跋涉、逆流而上并顺利繁衍[32]。
特别指出, 尽管虾青素在上述水生动物体内有广泛分布, 但其积累量通常很低。这些动物没有自主合成虾青素的能力, 受到摄取虾青素或其合成前体β-胡萝卜素等浓度限制, 最终能够富集在体内的虾青素很少, 浓度通常不足万分之一, 这也极大地降低了单纯利用水生动物开发天然虾青素的可行性, 该途径提取和再利用虾青素无疑将导致产品成本极高、价格昂贵、缺乏市场竞争力。为此, 有必要从可自主合成虾青素的其他生物中寻求潜在来源。
2.5 藻类在占地球面积71%的海洋湖泊等水生态系统中, 存在数以万计的光合自养生物藻类。目前已发现多种单细胞微型藻类(微藻)尤其处于特定胁迫条件下可大量累积虾青素, 如雨生红球藻、丝状的枝鞘藻(Oedocladium sp.)、斜生栅藻(Seenedesinus obliquus)、佐夫小球藻(Chromochloris zofingiensis)、绿球藻(Chlorococcum sp.)等, 这些微藻细胞内的虾青素都是活性高的左旋体结构[7, 33]。就几何异构体而言, 微藻细胞内的虾青素绝大多数为全反式结构, 只有少量的顺式异构体[7, 34]。此外, 在微藻细胞内的虾青素大多以酯化态形式存在, 少量虾青素为游离态。目前, 相对于其他微藻, 雨生红球藻可累积的虾青素浓度最高, 也是实现产业化生产的重要经济微藻[12]。
雨生红球藻: 简称红球藻, 隶属于绿藻门(Chlorophyta)、团藻目(Volvocales)、红球藻属(Haematococcus)的一种单细胞淡水绿藻。通常情况下, 红球藻细胞呈绿色具有2条鞭毛、能够游动, 但在特殊条件下因胁迫而大量积累虾青素, 细胞失去鞭毛逐渐变为圆球状, 并由绿色转变为褐红色甚至鲜红色, 故称作红球藻。在自然界, 红球藻一般只存在于环境潮湿的岩石上的小水洼中, 可在雨后实现快速繁殖生长[35-37]。
红球藻不仅是含虾青素最高的微藻, 也是所有已知能合成虾青素的生物体中积累量最高的物种, 虾青素浓度一般可维持在1%~4%, 最高可达6%左右。利用红球藻胁迫积累生产虾青素具有如下优势: 首先, 所得虾青素为左旋结构(3S, 3'S), 是目前所知生物活性最强的虾青素构型; 其二, 红球藻中所含游离虾青素及其酯类的组成配比(单酯70%、双酯25%及游离态5%)与水产养殖动物自身配比极为相似, 最接近天然虾青素食物链, 生物利用度最高; 其三, 红球藻所含虾青素远高于其他微藻至少10倍以上, 积累速率和生产总量远比其他微藻更高, 为目前公认生产天然虾青素最好的生物来源, 通过人工培养红球藻生产虾青素具有巨大的经济价值[12]。另外, 2010年《中华人民共和国食品安全法》和《新资源食品管理办法》批准红球藻为新资源食品。美国欧洲很多国家已经批复允许在水产等很多领域应用。中国培养雨生红球藻主要通过调控细胞周期的二步串联培养和强光缺氮诱导的技术, 借助大型平行管道光生物反应器进行规模化生产天然虾青素[38-42]。目前中国从事红球藻养殖企业已经超过20家, 主要集中在云南高原地区, 总养殖面积超过106 m2, 年产雨生红球藻粉800 t左右, 年产值超过10亿元, 生产规模占全国95%以上, 约占世界红球藻虾青素产量的50%[43]。
枝鞘藻: 近年来, 丝状枝鞘藻在虾青素和油脂积累能力方面日益受到重视。该藻在正常培养条件下, 虾青素可达干质量的1.6%, 油脂占藻体干质量的51%。环境胁迫诱导下虾青素增加十分明显(图 5), 其中单纯缺氮胁迫诱导, 虾青素可提高到2.0%左右, 缺氮联合氯化钠双胁迫诱导, 虾青素可进一步提高到3.9%[33, 44]。因此, 枝鞘藻积累虾青素的能力并不亚于已经成功商业开发的雨生红球藻。同时, 考虑到丝状藻养殖过程中更有利于控制敌害生物污染, 加之更容易收获和加工提取的优势, 枝鞘藻将是继红球藻之后开发天然虾青素的另一潜力藻株。
除上述微藻外, 斜生栅藻、佐夫小球藻、绿球藻等细胞生长速度较快, 可积累普遍高于动物体内的天然虾青素, 可作为潜在的营养强化饵料直接应用于多种水产动物养殖中。
2.6 微生物近年来, 虾青素也发现分布在某些细菌、真菌等微生物细胞内。尽管与含虾青素最高的雨生红球藻相比, 微生物细胞所含虾青素相对较低, 但在虾青素资源开发上也有其优势, 主要体现在细胞生长速度快、培养时间短、能够实现高密度培养、发酵工艺成熟等。
真菌: 在合成虾青素的真菌中, 红发夫酵母(Xanthophyllomyces dendrorhous/Phaffia rhodozyma)是目前市场上除了雨生红球藻以外天然虾青素的另一主要来源, 其野生株系中虾青素浓度约为200~ 500 μg/g (0.02%~0.05%), 而通过基因工程改造的某些突变株系中虾青素浓度可达到3 000~8 000 μg/g (0.3%~0.8%)[45]。红发夫酵母合成的虾青素以游离态形式存在, 且全部为右旋构型, 其几何异构体主要以全反式为主(约占70%~80%), 其次为13-顺式、15-顺式和9-顺式[46]。胶红酵母(Rhodotorula mucilaginosa)、圆红冬孢酵母(Rhodosporidium toruloides)等真菌也可以合成虾青素, 但有关其虾青素的异构体组成及是否酯合等未见报道。
细菌: 产类胡萝卜素副球菌(Paracoccus carotinifaciens)是最为常见、研究最广泛的可以合成虾青素的细菌种类, 其合成的虾青素为左旋构型, 以游离态形式存在, 几何异构体组成为全反式异构体占95.5%、顺式异构体(包括9-顺式和13-顺式)占4.5%。干燥后的副球菌菌粉含虾青素约为2.2%, 目前已商品化应用于水产养殖中[47]。此外, 一些海洋细菌, 如Agrobacterium aurantiacum、Brevundimonas sp.等也可以合成虾青素, 且都为左旋(3S, 3′S)构型[7]。研究分析表明, 在一株分离得到的短波单胞菌属(Brevundimonas)N-5中, 虾青素以游离态形式存在, 浓度为364.6 μg/g(0.036%)[48]。
目前, 上述细菌、真菌等微生物来源的虾青素主要作为饲料添加剂应用于水产养殖行业, 以提高鲑鳟鱼类、对虾等水产动物的着色和品质。
3 虾青素在水产养殖中的应用虾青素是虾、蟹、三文鱼等水产动物体内分布最广、最主要的类胡萝卜素, 缺乏会导致水产动物的体色、肉质、免疫和抗病能力减弱, 严重影响水产品品质[4, 49]。目前, 虾青素已作为新型、安全、高效的饲料添加剂在水产养殖中广泛应用, 不仅可以增强水产经济动物的着色, 在促进生长繁殖、增强抗氧化能力及免疫力、提高存活率及增强抗应激抗病能力等方面也具有明显的作用效果。
3.1 虾青素在水产中的主要作用 3.1.1 增强着色水产品的色泽是影响消费者购买欲、感知质量和市场价格的重要因素。许多水产动物的体色或肉色主要来自于虾青素, 但由于缺乏相关合成酶系不能自主从头合成, 只能从食物中摄取、吸收、转化、积累。虾青素添加在水产饲料中作为主要的色素来源, 可以增加水产品中色素的沉积量, 改善水产品的色泽。大量研究表明[50-53], 在南美白对虾、斑节对虾、日本囊对虾(Marsupenaeus japonicus)等经济虾类的饲料中添加适量的虾青素或富含虾青素的红球藻粉饲喂一段时间后, 对虾中虾青素及总类胡萝卜素的浓度明显增加, 体表色泽加深。中华绒螯蟹在饲喂红球藻虾青素饲料(20~80 mg/kg)后, 蟹壳、性腺和肝胰腺中虾青素及β-胡萝卜素等类胡萝卜素的沉积量显著增加, 甲壳的红度值和肝胰腺的亮度值明显提高[22-23, 54]。Rahman等[55]研究表明, 饲料中添加50 mg/kg的虾青素饲喂10周可以有效增强虹鳟(Oncorhynchus mykiss)肌肉的着色, 肌肉中类胡萝卜素的浓度以及肌肉的红度值和黄度值均显著高于对照组。
3.1.2 促进生长、发育及繁殖虾青素虽然不是水产动物生长代谢所必需的结构物质和能量物质, 但在提高营养利用、改善生长状况方面发挥着非常重要的作用。多项研究表明, 饲料中添加虾青素可以促进南美白对虾、克氏原螯虾、斑节对虾、虹鳟等重要经济水产动物的生长, 有效提高生长速度和增重率[50, 55-57]。Lim等[58]研究发现, 饲料中添加50~150 mg/kg虾青素可以促进鲈鱼(Lates calcarifer)的生长, 鲈鱼的体重、特定生长率(SGR)和饲料利用率随着虾青素添加量的增加呈线性增加。此外, 虾青素也能够促进水产动物的性腺发育, 提高繁殖性能。吴亚顺等[59]探究了不同虾青素(0~ 120 mg/kg)添加量对南美白对虾雌虾卵巢发育的影响, 结果表明饲料中添加80 mg/kg虾青素显著提高了雌虾性腺指数和平均产卵量。Sühnel等[60]研究发现, 饲喂添加红球藻虾青素的饲料能够使扇贝(Nodipecten nodosus)雌性个体的性腺中积累更多虾青素, 促进性腺成熟。大黄鱼亲鱼饲喂研究结果表明, 随着饲料中虾青素添加水平的提高(50~100 mg/kg), 大黄鱼的受精率显著提高[61]。也有研究报道在虹鳟雌性个体的生殖阶段, 饲料中添加红球藻虾青素有助于提高其卵子的质量[62]。
3.1.3 增强抗氧化能力及免疫力生物机体具有自身的抗氧化防御系统, 主要包括酶促(超氧化物歧化酶、过氧化氢酶等抗氧化酶)和非酶促(抗坏血酸、类胡萝卜素等抗氧化物质)两类体系。虾青素除了作为超强抗氧化物直接清除活性氧自由基外, 还可以激活生物体内源性抗氧化酶的活性, 从而全面增强机体的抗氧化能力。Sheikhzadeh等[63]研究发现, 饲料中添加红球藻虾青素使虹鳟脂质过氧化物丙二醛的浓度显著降低, 抗氧化能力和生化参数明显增强。南美白对虾在饲喂添加红球藻虾青素的饲料15 d后, 肝胰腺中总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、谷胱甘肽硫转移酶(GST)的活性以及免疫相关基因Toll、MyD88、IMD、Crustin、PO、Lysozyme的表达量显著增加, 表明饲喂虾青素提高了对虾的抗氧化能力和免疫力[51]。通过饲喂90 d虾青素复合饲料(含虾青素50~150 mg/kg), 鲈鱼血清中胆固醇和甘油三酯的浓度明显下降, 溶菌酶活性、吞噬活性、血清总免疫球蛋白等免疫参数显著提高, 表明虾青素对鲈鱼的血液生化和免疫能力具有明显的促进效果[64]。
3.1.4 提高存活率及抗应激抗病能力随着水产养殖从粗放式逐渐向集约化、规模化发展, 高密度养殖伴随而来的水质恶化、营养不足等问题导致各类疾病频发。虾青素可以增强水产动物抵抗应激和各类疾病的能力, 明显提高水产动物在高密度养殖中的存活率。Chuchird等[65]通过对南美白对虾进行60 d的饲喂实验发现: 饲料中添加50 mg/kg虾青素和0.6%甲酸组幼虾的存活率显著高于对照组, 虾青素明显提高了幼虾抵抗副溶血弧菌的能力。饲料中添加虾青素(80 mg/kg)也能够增强对虾对白斑综合征病毒(WSSV)的抗性[66]。斑节对虾幼体在分别饲喂不含虾青素和含80 mg/kg虾青素两种饲料8周以后进行低温和渗透胁迫实验, 结果表明虾青素可以明显改善对虾幼体耐低温和抗渗透压胁迫的能力[67]。王吉桥等[68]发现, 饲料中添加虾青素(60 mg/kg)和维生素E能够明显提高仿刺参(Apostichopus japonicas Selenka)对盐度和氨应激的抵抗能力, 使幼参在两种胁迫应激条件下的存活率显著提高。
3.2 人工合成与天然虾青素在水产中的应用效果对比目前, 水产养殖中应用的虾青素主要分为天然和人工合成两类来源, 不同来源的虾青素在亚分子结构和组成上存在明显差异, 其生物学活性和功效也显著不同。在几何异构上, 人工合成的虾青素几乎全部为全反式结构, 不同于生物体内主要以全反式为主、几种顺式结构为辅的结构组成。在旋光异构上, 不同于动植物体内和细菌细胞内的虾青素基本以左旋为主, 也不同于真菌微生物虾青素的右旋结构, 合成虾青素存在左旋、内消旋、右旋3种旋光异构体的混合物, 其中左旋∶内消旋∶右旋的比率大约为1∶2∶1。此外, 合成虾青素全部为游离态, 并不像在生物体内大部分以酯化态为主的形式存在[8-9]。
合成虾青素的着色能力与天然虾青素差别并不显著, 但在对紫外线吸收能力上差异明显, 没有天然虾青素顺式(尤其双顺式)异构体的特殊顺式吸收峰。同时, 合成虾青素的抗氧化活性相对较低, 只有红发夫酵母产右旋虾青素的1/2、雨生红球藻产左旋虾青素的1/3。尽管合成虾青素抗氧化性低, 却没有天然虾青素的稳定性好, 尤其在水产饲料加工、储藏和运输过程中, 合成虾青素丢失严重, 这可能与游离状态存在的合成虾青素相对更容易氧化有关[69]。我们分析饲料加工过程中虾青素浓度的变化, 发现同样添加300 mg/kg的虾青素, 仅在传统饲料加工的制粒、挤压膨化、冷却和干燥过程中, 合成虾青素饲料损失高达72.7%, 红球藻虾青素饲料损失61%, 表明红球藻虾青素比合成虾青素更稳定。在常温下避光保存30 d, 合成虾青素饲料虾青素浓度再降39%, 而红球藻虾青素饲料降低8%, 即常温下储存销售与运输等环节合成虾青素饲料损失率至少是红球藻饲料的5倍[69]。基于水产饲料从加工到使用周期通常在3~6个月, 尽管红球藻水产饲料加工投入成本高, 但实际使用成本却远低于合成虾青素饲料。
在生物吸收特别是活性功效上, 天然虾青素比合成虾青素更好。对比红球藻源虾青素与合成虾青素对育苗期南美白对虾的影响, 发现二者对后期幼体作用效果显著不同。红球藻虾青素显著提高后期幼体生长性能和虾青素浓度, 且同等效果的用量比合成虾青素要低很多, 饲喂70~140 mg/kg藻源虾青素的对虾幼体死亡率显著低于对照组。其中, 饲喂90 mg/kg藻源虾青素组的顺/反异构体比值和抗氧化酶(SOD和GPx)活性最高, 应激条件下虾的抗氧化酶(cMnSOD和GPx)mRNA表达水平明显增加。同时, 尽管合成虾青素与红球藻虾青素的旋光异构体结构组成比例不同, 但幼虾中的旋光异构体的积累量却十分相似, 表明对虾体内可能存在差向异构酶[70]。
以不同来源的虾青素强化饲料饲喂中华绒螯蟹, 结果发现: 饲料中添加红球藻粉和合成虾青素都明显增加蟹体内虾青素浓度, 其浓度随着虾青素添加量的增加而增加。在饲喂60 d后, 蟹体内不同部位中虾青素浓度从高到低依次是: 卵巢(45.19~343.37 mg/kg)、表皮(14.98~37.74 mg/kg)、甲壳(12.86~21.71 mg/kg)和肝胰腺(0.49~8.75 mg/kg)。表皮中虾青素以酯化形式存在, 而其他部位的虾青素并未酯化。卵巢、表皮和甲壳中最主要的虾青素几何异构体为全反式, 占总虾青素的59.74%~76.94%。左旋虾青素主要富集于饲喂红球藻粉的雌蟹卵巢中, 占总虾青素的85.18%~96.27%, 且随着饲料中虾青素添加量增加而增加。饲料中与蟹体内的虾青素异构体组成存在差异, 表明虾青素在蟹体内可能具有选择性沉积和异构化[25]。与天然红球藻虾青素相比, 需要添加更多合成虾青素才能达到使中华绒螯蟹相同的增色效果, 即红球藻粉比合成虾青素对促进蟹体内积累与增色的效果更好。
此外, 用人工虾青素强化饲料(含40 mg/kg合成虾青素)和红球藻藻渣强化饲料(含40 mg/kg天然虾青素)分别饲喂成年虹鳟, 结果发现: 饲喂天然虾青素组的虹鳟背肌中虾青素及总类胡萝卜素的积累量显著高于饲喂合成虾青素组, 说明红球藻藻渣中的天然虾青素相较合成虾青素更易在虹鳟肌肉中积累。同时, 饲喂天然虾青素对于虹鳟抗氧化能力的提升效果更为明显, 显著优于合成虾青素[29]。
可见, 合成虾青素在结构、功能、应用、安全性等方面都逊色于天然提取虾青素。另外, 美国等国家考虑到化学合成虾青素过程可能存在对人体健康不利的未知因素, 已禁止在食用水产品着色上使用合成虾青素。
4 结语综上所述, 虾青素作为一种天然色素广泛分布于藻类、甲壳类、鱼类、微生物等水生生物体内, 其亚分子结构包括几何异构、旋光异构、是否酯合等特征在不同生物体内不尽相同, 活性和功效也具有明显差异。虾青素因具有卓越的抗氧化性和着色力, 被视作天然、高效的饲料添加剂在水产养殖中广泛应用, 不仅可以增强鱼、虾、蟹等水产经济动物的体色或肉色, 在提高存活率、促进生长发育、增强繁殖性能、改善生理功能、提高抗氧化能力和免疫力以及增强抗应激抗病能力等方面发挥着重要作用。与合成虾青素相比, 天然虾青素具有安全性高、稳定不易降解、活性功效强、市场接受度高等明显优势, 有助于生产开发系列优质水产品, 具有更广阔的应用前景。
| [1] |
WADE N M, GABAUDAN J, GLENCROSS B D. A review of carotenoid utilisation and function in crustacean aquaculture[J]. Reviews in Aquaculture, 2017, 9(2): 141-156. DOI:10.1111/raq.12109 |
| [2] |
CHAYEN N E, CIANCI M, GROSSMANN J G, et al. Unravelling the structural chemistry of the colouration mechanism in lobster shell[J]. Acta Crystallographica Section D-Biological Crystallography, 2003, D59: 2072-2082. |
| [3] |
SEABRA L M J, PEDROSA L F C. Astaxanthin: structural and functional aspects[J]. Revista de Nutricao-Brazilian Journal of Nutrition, 2010, 23(6): 1041-1050. DOI:10.1590/S1415-52732010000600010 |
| [4] |
LIM K C, YUSOFF F M, SHARIFF M, et al. Astaxanthin as feed supplement in aquatic animals[J]. Reviews in Aquaculture, 2018, 10(3): 738-773. DOI:10.1111/raq.12200 |
| [5] |
LIU X J, LUO Q X, RAKARIYATHAM K, et al. Antioxidation and anti-ageing activities of different stereoisomeric astaxanthin in vitro and in vivo[J]. Journal of Functional Foods, 2016, 25: 50-61. DOI:10.1016/j.jff.2016.05.009 |
| [6] |
刘建国, 李虎, 张孟洁, 等. 红球藻虾青素与炎症反应和肺部疾病的研究进展[J]. 生物学杂志, 2021, 38(2): 8-12. LIU Jianguo, LI Hu, ZHANG Mengjie, et al. Research progress of the astaxanthin from Haematococcus pluvialis in inflammation and lung diseases[J]. Journal of Biology, 2021, 38(2): 8-12. |
| [7] |
YU W J, LIU J G. Astaxanthin isomers: Selective distribution and isomerization in aquatic animals[J]. Aquaculture, 2020, 520: 734915. DOI:10.1016/j.aquaculture.2019.734915 |
| [8] |
CAPELLI B, BAGCHI D, CYSEWSKI G R. Synthetic astaxanthin is significantly inferior to algal-based astaxanthin as an antioxidant and may not be suitable as a human nutraceutical supplement[J]. Nutrafoods, 2013, 12: 145-152. DOI:10.1007/s13749-013-0051-5 |
| [9] |
HIGUERA-CIAPARA I, FELIX-VALENZUELA L, GOYCOOLEA F M. Astaxanthin: a review of its chemistry and applications[J]. Critical Reviews in Food Science and Nutrition, 2006, 46(2): 185-196. DOI:10.1080/10408690590957188 |
| [10] |
苏芳. 类胡萝卜素在藻虾蟹鱼中的结构分布特征及虾青素异构化研究[D]. 青岛: 中国科学院海洋研究所, 2018. SU Fang. A study on the structure distribution of carotenoids in algae, shrimps, crabs and fishes and the isomerization of astaxanthin[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2018. |
| [11] |
AMBATI R R, PHANG S M, RAVI S, et al. Astaxanthin: sources, extraction, stability, biological activities and its commercial applications: a review[J]. Marine Drugs, 2014, 12(1): 128-152. DOI:10.3390/md12010128 |
| [12] |
LORENZ R T, CYSEWSKI G R. Commercial potential for Haematococcus microalgae as a natural source of astaxanthin[J]. Trends in Biotechnology, 2000, 18(4): 160-167. DOI:10.1016/S0167-7799(00)01433-5 |
| [13] |
SU F, HUANG B, LIU J G. The carotenoids of shrimps (Decapoda: Caridea and Dendrobranchiata) cultured in China[J]. Journal of Crustacean Biology, 2018, 38(5): 523-530. DOI:10.1093/jcbiol/ruy049 |
| [14] |
ZHANG C S, SU F, LI S H, et al. Isolation and identification of the main carotenoid pigment from a new variety of the ridgetail white prawn Exopalaemon carinicauda[J]. Food Chemistry, 2018, 269: 450-454. DOI:10.1016/j.foodchem.2018.06.143 |
| [15] |
YUAN J P, PENG J, YIN K, et al. Potential health-promoting effects of astaxanthin: a high-value carotenoid mostly from microalgae[J]. Molecular Nutrition & Food Research, 2011, 55(1): 150-165. |
| [16] |
HUSSEIN G, SANKAWA U, GOTO H, et al. 2006. Astaxanthin, a carotenoid with potential in human health and nutrition[J]. Journal of Natural Products, 2006, 69(3): 443-449. DOI:10.1021/np050354+ |
| [17] |
张晓丽, 刘建国. 虾青素的抗氧化性及其在营养和医药应用方面的研究[J]. 食品科学, 2006, 27(1): 258-262. ZHANG Xiaoli, LIU Jianguo. Review on antioxidant effects of astaxanthin and its application in nutriology and pharmacology[J]. Food Science, 2006, 27(1): 258-262. |
| [18] |
PASHKOW F J, WATUMULL D G, CAMPBELL C L. Astaxanthin: a novel potential treatment for oxidative stress and inflammation in cardiovascular disease[J]. American Journal of Cardiology, 2008, 101(10A): 58-68. |
| [19] |
GOTO S, KOGURE K, ABE K, et al. Efficient radical trapping at the surface and inside the phospholipid membrane is responsible for highly potent antiperoxidative activity of the carotenoid astaxanthin[J]. Biochimica et Biophysica Acta, 2001, 1512(2): 251-258. DOI:10.1016/S0005-2736(01)00326-1 |
| [20] |
SU F, LIU J G. The carotenoid characteristics of the important wild shrimp Trachysalambria curvirostris (Stimpson, 1860) in China[J]. Journal of Oceanology and Limnology, 2018, 37(2): 706-712. |
| [21] |
ZADOROZHNY P A, BORISOVETS E E, YAKUSH E V, et al. Change of carotenoid composition in crabs during embryogenesis[J]. Journal of Evolutionary Biochemistry and Physiology, 2008, 44(4): 450-461. DOI:10.1134/S0022093008040054 |
| [22] |
LONG X W, WU X G, ZHAO L, et al. Effects of dietary supplementation with Haematococcus pluvialis cell powder on coloration, ovarian development and antioxidation capacity of adult female Chinese mitten crab, Eriocheir sinensis[J]. Aquaculture, 2017, 473: 545-553. DOI:10.1016/j.aquaculture.2017.03.010 |
| [23] |
MA N, LONG X W, LIU J G, et al. Defatted Haematococcus pluvialis meal can enhance the coloration of adult Chinese mitten crab Eriocheir sinensis[J]. Aquaculture, 2019, 510: 371-379. DOI:10.1016/j.aquaculture.2019.05.063 |
| [24] |
LI Q Q, ZU L, CHENG Y X, et al. Carapace color affects carotenoid composition and nutritional quality of the Chinese mitten crab, Eriochier sinensis[J]. LWT-Food Science and Technology, 2020, 126: 109286. DOI:10.1016/j.lwt.2020.109286 |
| [25] |
SU F, YU W J, LIU J G. Comparison of effect of dietary supplementation with Haematococcus pluvialis powder and synthetic astaxanthin on carotenoid composition, concentration, esterification degree and astaxanthin isomers in ovaries, hepatopancreas, carapace, epithelium of adult female Chinese mitten crab (Eriocheir sinensis)[J]. Aquaculture, 2020, 523: 735146. DOI:10.1016/j.aquaculture.2020.735146 |
| [26] |
GUI L, XU L, LIU Z Y, et al. Carotenoid-rich microalgae promote growth and health conditions of Artemia nauplii[J]. Aquaculture, 2022, 546: 737289. DOI:10.1016/j.aquaculture.2021.737289 |
| [27] |
LI H, LIU J G. Effects of defatted Haematococcus pluvialis meal (DHPM) supplementation on the growth performance, and the carotenoid content and composition in the rotifer (Brachionus plicatilis)[J]. Aquaculture, 2019, 505: 34-40. DOI:10.1016/j.aquaculture.2019.02.027 |
| [28] |
LI H, LIU J G. Supplementation of Moina macrocopa with defatted Haematococcus pluvialis meal improved its growth performance and nutritional quality[J]. Aquaculture, 2021, 534: 736164. DOI:10.1016/j.aquaculture.2020.736164 |
| [29] |
石焜, 苏芳, 郭文, 等. 雨生红球藻藻渣在成年虹鳟饲养中的应用[J]. 江苏农业科学, 2017, 45(6): 153-157. SHI Kun, SU Fang, GUO Wen, et al. Application of defatted Haematococcus pluvialis meal in the feeding of adult rainbow trout (Oncorhynchus mykiss)[J]. Jiangsu Agricultural Science, 2017, 45(6): 153-157. |
| [30] |
PETTERSSON A, LIGNELL Å. Astaxanthin deficiency in eggs and fry of Baltic salmon (Salmo salar) with the M74 syndrome[J]. AMBIO, 1999, 28(1): 43-47. |
| [31] |
PICKOVA J, KIESSLING A, PETTERSSON A, et al. Comparison of fatty acid composition and astaxanthin content in healthy and by M74 affected salmon eggs from three Swedish river stocks[J]. Comparative Biochemistry and Physiology B-biochemistry & Molecular Biology, 1998, 120(2): 265-271. |
| [32] |
KITAHARA T. Behaviour of carotenoids in the chum salmon (Oncorhynchus keta) during development[J]. Comparative Biochemistry and Physiology B-biochemistry & Molecular Biology, 1983, 76(1): 97-101. |
| [33] |
黄妙琴, 高保燕, 刘国祥, 等. 不同培养条件对枝鞘藻生长、虾青素和油脂积累的影响[J]. 植物科学学报, 2020, 38(3): 418-427. HUANG Miaoqin, GAO Baoyan, LIU Guoxiang, et al. Effects of different culture conditions on growth and astaxanthin and lipid accumulation in Oedocladium sp.[J]. Plant Science Journal, 2020, 38(3): 418-427. |
| [34] |
GONG F Y, ZHANG C H, ZHANG L T, et al. Changes of carotenoids contents and analysis of astaxanthin geometrical isomerization in Haematococcus pluvialis under outdoor high light conditions[J]. Aquaculture Research, 2020, 51(2): 770-778. |
| [35] |
ZHANG C H, ZHANG L T, LIU J G. Cell cycles and proliferation patterns in Haematococcus pluvialis[J]. Chinese Journal of Oceanology and Limnology, 2017, 35(5): 1205-1211. |
| [36] |
LI Q Q, ZHANG L T, LIU J G. Examination of carbohydrate and lipid metabolic changes during Haematococcus pluvialis non-motile cell germination using transcriptome analysis[J]. Journal of Applied Phycology, 2019, 31: 145-156. |
| [37] |
LI Q Q, ZHANG L T, LIU J G. Comparative transcriptome analysis at seven time points during Haematococcus pluvialis motile cell growth and astaxanthin accumulation[J]. Aquaculture, 2019, 503: 304-311. |
| [38] |
ZHANG L T, SU F, ZHANG C H, et al. Changes of photosynthetic behaviors and photoprotection during cell transformation and astaxanthin accumulation in Haematococcus pluvialis grown outdoors in tubular photobioreactors[J]. International Journal of Molecular Sciences, 2017, 18(1): 33. |
| [39] |
ZHANG L T, ZHANG C H, LIU J G. A strategy for stimulating astaxanthin and lipid production in Haematococcus pluvialis by exogenous glycerol application under low light[J]. Algal Research, 2020, 46: 101779. |
| [40] |
YU W J, ZHANG L T, ZHAO J, et al. Exogenous sodium fumarate enhances astaxanthin accumulation in Haematococcus pluvialis by enhancing the respiratory metabolic pathway[J]. Bioresource Technology, 2021, 341: 125788. |
| [41] |
YU W J, ZHANG L T, ZHAO J, et al. Enhancement of astaxanthin accumulation in Haematococcus pluvialis by exogenous oxaloacetate combined with nitrogen deficiency[J]. Bioresource Technology, 2022, 345: 126484. |
| [42] |
ZHANG C H, ZHANG L T, LIU J G. Exogenous sodium acetate enhances astaxanthin accumulation and photoprotection in Haematococcus pluvialis at the non-motile stage[J]. Journal of Applied Phycology, 2019, 31(2): 1001-1008. |
| [43] |
刘建国. 红球藻虾青素资源开发历程与趋势展望[J]. 海洋科学, 2020, 44(8): 130-145. LIU Jianguo. Development history and future prospects of culturing Haematococcus pluvialis for natural astaxanthin[J]. Marine Sciences, 2020, 44(8): 130-145. |
| [44] |
WANG Y, JIA J, CHI Q L, et al. Critical assessment of the filamentous green microalga Oedocladium carolinianum for astaxanthin and oil production[J]. Algal Research, 2022, 61: 102599. |
| [45] |
SCHMIDT I, SCHEWE H, GASSEL S, et al. Biotechnological production of astaxanthin with Phaffia rhodozyma/Xanthophyllomyces dendrorhous[J]. Applied Microbiology and Biotechnology, 2010, 89(3): 555-571. |
| [46] |
STOREBAKKEN T, SORENSEN M, BJERKENGB B, et al. Stability of astaxanthin from red yeast, Xanthophyllomyces dendrorhous, during feed processing: effects of enzymatic cell wall disruption and extrusion temperature[J]. Aquaculture, 2004, 231(1/4): 489-500. |
| [47] |
BORIES G, BRANTOM P, DE BARBERA J B, et al. Safety and efficacy of Panaferd-AX (red carotenoidrich bacterium Paracoccus carotinifaciens) as feed additive for salmon and trout: Scientific opinion of the panel on additives and products or substances used in animal Feed[J]. EFSA Journal, 2007, 546: 1-30. |
| [48] |
ASKER D. Isolation and characterization of a novel, highly selective astaxanthin-producing marine bacterium[J]. Journal of Agriculture and Food Chemistry, 2017, 65(41): 9101-9109. |
| [49] |
MENASVETA P, WORAWATTANAMATEEKUL W, LATSCHA T, et al. Correction of black tiger prawn (Penaeus monodon fabricius) coloration by astaxanthin[J]. Aquacultural Engineering, 1993, 12(4): 203-213. |
| [50] |
WADE N M, CHEERS S, BOURNE N, et al. Dietary astaxanthin levels affect colour, growth, carotenoid digestibility and the accumulation of specific carotenoid esters in the Giant Tiger Shrimp, Penaeus monodon[J]. Aquaculture Research, 2017, 48(2): 395-406. |
| [51] |
YU W J, ZHANG M J, WANG B J, et al. Dietary Haematococcus pluvialis powder supplementation affect carotenoid content, astaxanthin isomer, antioxidant capacity and immune-related gene expression in Pacific white shrimp, Litopenaeus vannamei[J]. Aquaculture Research, 2021, 52(6): 2403-2414. |
| [52] |
WANG W L, ISHIKAWA M, KOSHIO S, et al. Effects of dietary astaxanthin supplementation on juvenile kuruma shrimp, Marsupenaeus japonicas[J]. Aquaculture, 2018, 491: 197-204. |
| [53] |
PARISENTI J, BEIRAO L H, MARASCHIN M, et al. Pigmentation and carotenoid content of shrimp fed with Haematococcus pluvialis and soy lecithin[J]. Aquaculture Nutrition, 2010, 17(2): e530-e535. |
| [54] |
WU X G, ZHAO L, LONG X W, et al. Effects of dietary supplementation of Haematococcus pluvialis powder on gonadal development, coloration and antioxidant capacity of adult male Chinese mitten crab (Eriocheir sinensis)[J]. Aquaculture Research, 2017, 48(10): 5214-5223. |
| [55] |
RAHMAN M M, KHOSRAVI S, CHANG K H, et al. Effects of dietary inclusion of astaxanthin on growth, muscle pigmentation and antioxidant capacity of juvenile rainbow trout (Oncorhynchus mykiss)[J]. Preventive Nutrition and Food Science, 2016, 21(3): 281-288. |
| [56] |
CHENG Y X, WU S J. Effect of dietary astaxanthin on the growth performance and nonspecific immunity of red swamp crayfish Procambarus clarkia[J]. Aquaculture, 2019, 512: 734341. |
| [57] |
ZHANG J, LIU Y J, TIAN L X, et al. Effects of dietary astaxanthin on growth, antioxidant capacity and gene expression in Pacific white shrimp Litopenaeus vannamei[J]. Aquaculture Nutrition, 2013, 19(6): 917-927. |
| [58] |
LIM K C, YUSOFF F M, SHARIFF M, et al. Dietary administration of astaxanthin improves feed utilization, growth performance and survival of Asian seabass, Lates calcarifer (Bloch, 1790)[J]. Aquaculture Nutrition, 2019, 25(6): 1410-1421. |
| [59] |
吴亚顺, 徐斌, 刘嘉欣, 等. 饲料中虾青素对凡纳滨对虾雌虾肝胰腺脂代谢和卵巢发育的影响[J]. 水生生物学报, 2024, 48(1): 99-108. WU Yashun, XU Bin, LIU Jiaxin, et al. Dietary astaxanthin on hepatopancreas lipid metabolism and ovarian development of female Litopenaeus vannamei[J]. Acta Hydrobiologica Sinica, 2024, 48(1): 99-108. |
| [60] |
SUHNEL S, LAGREZE F, PEREIRA A, et al. Effects of astaxanthin on reproductive success in the tropical scallop Nodipecten nodosus (Linnaeus, 1758)[J]. Journal of Shellfish, 2014, 33(1): 89-98. |
| [61] |
席峰. 饲料中n-3高不饱和脂肪酸、降药残添加剂和虾青素添加水平对大黄鱼亲鱼繁殖性能的影响[J]. 饲料研究, 2018, 41(1): 66-70. XI Feng. Effects of dietary levels of n-3 highly unsaturated fatty acids, drug-residue-reducing additives and astaxanthin on the reproductive performance of the large yellow croaker[J]. Feed Research, 2018, 41(1): 66-70. |
| [62] |
SHEIKHZADEH N, PANCHAH I K, ASADPOUR R, et al. Effects of Haematococcus pluvialis in maternal diet on reproductive performance and egg quality in rainbow trout (Oncorhynchus mykiss)[J]. Animal Reproduction Science, 2012, 130: 119-123. |
| [63] |
SHEIKHZADEH N, TAYEFI-NASRABADI H, OUSHANI A K, et al. Effects of Haematococcus pluvialis supplementation on antioxidant system and metabolism in rainbow trout (Oncorhynchus mykiss)[J]. Fish Physiology and Biochemistry, 2012, 38(2): 413-419. |
| [64] |
LIM K C, YUSOFF F M, SHARIFF M, et al. Dietary supplementation of astaxanthin enhances hematobiochemistry and innate immunity of Asian seabass, Lates calcarifer (Bloch, 1790)[J]. Aquaculture, 2019, 512: 734339. |
| [65] |
CHUCHIRD N, RORKWIREE P, RAIRAT T. Effect of dietary formic acid and astaxanthin on the survival and growth of Pacific white shrimp (Litopenaeus vannamei) and their resistance to Vibrio parahaemolyticus[J]. SpringerPlus, 2015, 4: 440. |
| [66] |
WANG H, DAI A, LIU F, et al. Effects of dietary astaxanthin on the immune response, resistance to white spot syndrome virus and transcription of antioxidant enzyme genes in Pacific white shrimp Litopenaeus vannamei[J]. Iranian Journal of Fisheries Sciences, 2015, 14(3): 699-718. |
| [67] |
CHIEN Y H, PAN C H, HUNTER B. The resistance to physical stresses by Penaeus monodon juveniles fed diets supplemented with astaxanthin[J]. Aquaculture, 2003, 216: 177-191. |
| [68] |
王吉桥, 樊莹莹, 姜玉声, 等. 在含等量维生素E饲料中添加β-胡萝卜素和虾青素对仿刺参幼参抗应激能力的影响[J]. 水产学杂志, 2013, 26(2): 29-34. WANG Jiqiao, FAN Yingying, JIANG Yusheng, et al. Effects of addition of β-carotene and astaxanthin into diet containing equal vitamin E on resistance to stresses in juvenile sea cucumber[J]. Chinese Journal of Fisheries, 2013, 26(2): 29-34. |
| [69] |
刘晓慧. 不同来源的虾青素对凡纳滨对虾幼虾的影响及作用机制[D]. 青岛: 中国科学院海洋研究所, 2018. LIU Xiaohui. Effects of natural and synthetic astaxanthin on Litopenaeus vannamei, in the nursery phase[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2018. |
| [70] |
LIU X H, WANG B J, LI Y F, et al. Effects of dietary botanical and synthetic astaxanthin on E/Z and R/S isomer composition, growth performance, and antioxidant capacity of white shrimp, Litopenaeus vannamei, in the nursery phase[J]. ISJ-Invertebrate Survival Journal, 2018, 15: 131-140. |
 2024, Vol. 48
2024, Vol. 48



