
文章信息
- 刘田, 李硕, 汪铭书, 赵立宁, 黄锦炉, 吴艺琳, 贾爱卿. 2024.
- LIU Tian, LI Shuo, WANG Mingshu, ZHAO Lining, HUANG Jinlu, WU Yilin, JIA Aiqing. 2024.
- 口服卵黄抗体对杂交鳢弹状病毒(HSHRV)感染的免疫保护效果
- Immunoprotective effect of oral yolk antibody against hybrid snakehead rhabdovirus
- 海洋科学, 48(8): 10-16
- Marine Sciences, 48(8): 10-16.
- http://dx.doi.org/10.11759/hykx20230627002
-
文章历史
- 收稿日期:2023-06-27
- 修回日期:2023-07-26
2. 广东海大集团股份有限公司畜牧水产研究中心, 广东 广州 511400;
3. 四川农业大学预防兽医研究所, 四川 成都 611100
2. Animal Husbandry and Fisheries Research Center of Guangdong Haid Group Co., Ltd., Guangzhou 511400, China;
3. Institute of Preventive Veterinary Medicine, Sichuan Agricultural University, Chengdu 611100, China
杂交鳢(Channa argus×C. maculate)属于硬骨鱼纲(Osteichthyes)、鲈形目(Perciformes)鱼类, 其分布广、繁殖力强, 具有极高的食用营养和药用保健价值。杂交鳢弹状病毒(hybrid snakehead rhabdovirus, HSHRV)流行于广东广州、佛山、中山等地, 属于水泡性病毒属, 为单股负链线性RNA病毒, 呈典型子弹状, 病毒粒子大小为60 nm×160 nm[1-2]。发病鱼肝、脾、肾肿大且表面有出血点, 鱼鳔表面血管肿胀、出血严重[3]。HSHRV易感染杂交鳢鱼苗, 高峰期日死亡率高达80%以上, 对养殖业危害极大, 目前尚无预防和治疗该病的特效药物[4]。
卵黄抗体(immunoglobulin of egg yolk, IgY)经由特定抗原免疫蛋鸡后产生并于蛋黄内富集。特异性卵黄抗体可对鱼、虾等细菌和病毒性疾病产生较好的保护效果。Qin等[5]发现特异性卵黄抗体可较好保护嗜水气单胞菌感染的鲷鱼并显著提高其存活率。Xu等[6]发现卵黄抗体可破坏迟缓爱德华氏菌细胞壁结构、降低其表面疏水性, 导致细菌凝集性增强、流动性降低。Lu等[7]经研究发现用抗白斑综合症卵黄抗体拌料饲喂对虾可降低死亡率。袁雪梅等[8]发现大口黑鲈弹状病毒卵黄抗体在体外可降低病毒拷贝数, 中和作用率达38.29%。
HSHRV主要危害0.2 g至50 g杂交鳢鱼苗, 这一阶段鱼苗免疫系统尚不成熟, 依靠鱼苗主动免疫系统预防该疾病较为困难。IgY常作为母源抗体的替代品用以治疗和预防幼龄动物疾病, 因此经卵黄抗体为杂交鳢鱼苗提供被动免疫保护更具有生产和实践意义。本研究将杂交鳢弹状病毒经佐剂乳化后免疫蛋鸡, 获得高免蛋黄经喷雾干燥喷成蛋粉。评估蛋粉中和效价后制备成免疫料饲喂20 g规格杂交鳢, 经杂交鳢弹状病毒发病模型评价卵黄抗体免疫保护效果。
1 材料与方法 1.1 毒株、细胞及实验动物杂交鳢弹状病毒江门I株(HSHRV-JMI)、鳜鱼脑细胞(Mandarin fish Brain Cell, MBC)由广东海大研究院保存。200 d龄海兰灰蛋鸡300只由广东海大研究院提供。
1.2 主要试剂L-15培养基(biosharp, 中国, BL313A)、胎牛血清(Excell, 中国, FSP500)、双抗(新赛美, 中国, C100C5)、吐温–80 (Diamond, 中国, A100442-0500)、Marcol 52白油(埃克森美孚, 美国, 70133758)、生物藻胶(远大海洋, 中国)。
1.3 试验方法 1.3.1 病毒培养MBC细胞经L-15完全培养基(含10%FBS)在无CO2条件下28 ℃培养24 h, 待细胞密度长至90%时, 接种1000 TCID50的HSHRV-JMI病毒, 28 ℃孵育2 h后, 弃上清, PBS清洗细胞3次后加入含2% FBS的L-15培养基, 在无CO2条件下28 ℃培养72 h, 至90%以上病变时收集病毒。病毒反复冻融2次, 离心、过滤除菌后分装, –80 ℃保存备用。
1.3.2 病毒滴度检测制备MBC细胞并接种96孔细胞板, 无CO2条件下28 ℃培养24 h至细胞密度长至90%, 备用。病毒经10倍倍比稀释后接种细胞, 稀释度为10–1至10–9, 每个稀释度接种8孔。28 ℃孵育2 h后弃上清, PBS清洗细胞3次后加入含2%FBS的L-15培养基, 28 ℃无CO2培养7 d, 观察并记录细胞病变孔数, 经Reed-Mench法计算病毒滴度。
1.3.3 疫苗制备取96份HSHRV-JMI加入4份吐温–80, 7 000 r/min乳化5 min。取3份混合样品加入7份Marcol52白油, 12 000 r/min乳化15 min, 乳化3次。乳化后样品3 500 r/min离心10 min后不分层, 4 ℃保存备用。
1.3.4 蛋鸡免疫将300只蛋鸡随机分为2组, 分别为疫苗组和对照组。其中疫苗组蛋鸡200只, 对照组蛋鸡100只。蛋鸡免疫四次, 每次每只蛋鸡胸肌多点注射剂量为1 mL。首免和四免疫苗病毒含量为1×106 TCID50/0.1 mL, 二免和三免疫苗病毒含量为1×107 TCID50/0.1 mL。对照组均注射1 mL L-15培养基。首免、二免、三免间隔为14 d; 三免后, 每隔20 d采集高免蛋检测中和效价, 中和效价低于1∶44时进行四免。
1.3.5 蛋黄喷雾干燥收集四免后30~40 d高免蛋, 共计1 803枚。收集同一时间段对照组鸡蛋, 共计915枚。蛋壳经75%酒精充分擦拭消毒后, 晾干。在无菌条件下, 分离蛋黄和蛋清, 收集蛋黄并称重。蛋黄中加入3倍蛋黄质量的无菌水, 充分混匀后用无菌过滤布过滤除去杂质, 获得蛋黄混合液。蛋黄混合液在37 ℃条件下, 经磁力搅拌器搅拌, 转速为600 r/min。喷雾干燥机设置进风温度为120 ℃、进风量为75%、进料速度为40%, 控制出风温度约为60~65 ℃。
1.3.6 中和效价检测在无菌条件下, 称量5 g蛋粉, 加入10 mL无菌水后充分混匀, 获得蛋粉混合液。取500 μL蛋粉混合液于56 ℃水浴作用40 min以灭活补体。100 μL蛋粉混合液4倍倍比稀释后与等体积、滴度为200 TCID50的HSHRV-JMI病毒充分混匀, 在28 ℃、85 r/min条件下中和3 h。取中和后混合液加入96孔细胞板中, 28 ℃、无CO2孵育3 h。弃上清, PBS清洗细胞3次, 加入10% FBS L-15完全培养基在28 ℃、无CO2条件下培养7 d后观察细胞病变情况。经Reed-Mench法计算中和效价。每个稀释度重复4次, 同时设置病毒对照、空白对照。
1.3.7 制作免疫料按照饲料质量1%称量生物藻胶黏合剂; 按照饲料质量10%量取无菌水; 按照每kg鱼饲喂0.25 g、0.4 g、0.6 g的标准称量高免蛋粉。一定质量的黏合剂与蛋粉充分混匀后加入无菌水, 充分搅拌至无结块, 得黏合剂混合物。黏合剂混合物中加入饲料后充分抓拌直至容器底部无黏合剂颗粒附着。随后将饲料平铺、晾干。4 ℃保存备用。
1.3.8 安全性评估对蛋鸡免疫各个阶段蛋黄中弹状病毒残留进行实时定量PCR(Real-time Quantitative PCR, QPCR)检测, 具体操作、引物和探针设计参考文献[9]。详细操作如下: 提取样品总RNA, 经Nanodrop2000测定RNA浓度, 经反转录试剂盒将总RNA反转录为cDNA, 反转录程序为50 ℃, 15 min。扩增程序为预变性95 ℃, 30 s; 95 ℃, 10 s; 60 ℃, 30 s扩增45个循环, 60 ℃退火后读取Ct数值[9], 其中Ct值大于35则判定结果为阴性。引物和探针序列见表 1。
| 引物、探针名称 | 引物、探针序列(5′-3′) | 长度/bp |
| F | TCCCGTGGGTTGGTTTAC | 159 |
| R | GCCGCCAGCAGTTTAATC | |
| Probe | ROX-CAGCCAAGAGTTGAGCACATAGTCGCC-BQ2 |
按照每kg鱼饲喂1.2 g的标准称量高免蛋粉, 按照1.3.7操作制备免疫料。按照每kg鱼饲喂1.2 g的标准称量对照组鸡蛋蛋粉, 按照1.3.7操作制备非特异性卵黄抗体对照组投喂料。按照投喂饲料质量的1%称量生物藻胶黏合剂, 按照1.3.7操作制备黏合剂组投喂料。杂交鳢规格为20 g, 共计360尾, 分为免疫料投喂组、非特异性卵黄抗体对照组、黏合剂组, 每组各120尾。杂交鳢于循环水系统中饲养3 d以适应环境, 期间监测水体中亚硝酸盐含量、氨氮含量, 调控水质以达到饲养标准。随后按照单次投喂量1%投喂率, 分别投喂对应饲料, 共计投喂15 d, 每日投喂2次。15 d后统计杂交鳢存活数量。
1.3.9 免疫保护效果评估按照1.3.7制作免疫料和投喂料。杂交鳢规格为20 g, 共计780尾, 分为低剂量免疫组、中剂量免疫组、高剂量免疫组、非特异性卵黄抗体对照组、空白对照组。免疫组和非特异性卵黄抗体对照组各设置三组重复, 每组各60尾; 空白对照组60尾。低剂量免疫组每kg鱼投喂0.25 g蛋粉、中剂量免疫组每kg鱼投喂0.4 g蛋粉、高剂量免疫组每kg鱼投喂0.6 g蛋粉、非特异性卵黄抗体对照组每kg鱼投喂0.6 g蛋粉、空白对照组投喂未拌蛋粉的饲料。
杂交鳢于循环水系统中饲养3 d以适应环境, 期间监测水体中亚硝酸盐含量、氨氮含量, 调控水质以达到饲养标准。随后按照1%投喂率, 分别投喂对应免疫料和投喂料, 共计投喂10 d, 每日投喂2次。口服免疫料第4日, 经腹腔注射104 TCID50/0.1 mL HSHRV-JMI, 每尾鱼注射0.1 mL。记录杂交鳢每日死亡情况, 并于免疫料投喂第7日进行统计分析和相对保护率的测定(relative percentage of survival, RPS, 记为Prs)。
| P_{\rm rs}=(1–处理组死亡率/对照组死亡率)×100\%. | (1) |
采用Graphpad 8.0对试验数据处理, 以Student t-test进行不同处理间的显著性分析, P < 0.05作为差异显著, P < 0.001作为极显著。
2 结果 2.1 病毒扩繁病毒接种MBC细胞后, 24 h内开始出现细胞病变, 24 h后20%~30%细胞出现收缩变圆、内部空洞、聚集成团的现象, 并形成明显的空斑。48 h后40%~60%的细胞出现病变, 72 h后90%以上的细胞出现病变(图 1)。72 h后收集病毒, 测定滴度为107.8 TCID50/0.1 mL。
 |
| 图 1 杂交鳢弹状病毒在鳜鱼脑细胞(MBC)的病变情况 Fig. 1 Lesions of hybrid snakehead rhabdovirus (HSHRV)-JMI in mandarin fish brain cell (MBC) |
杂交鳢弹状病毒经4次免疫蛋鸡后可获得高水平中和抗体效价, 具有较强中和病毒能力。由图 2可知, 第1次免疫后14 d可检测到中和抗体, 第3次免疫后20 d中和效价升高至44.8并于三免后60 d降低至42.4。第4次免疫后20 d抗体效价升高至46.8, 达到高峰, 随即缓慢下降至四免后80 d。四免后20~80 d期间均可维持高中和效价水平。收集四免后30~40 d高免蛋制备蛋粉, 经检测蛋粉效价为45.8。
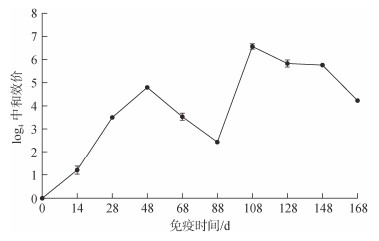 |
| 图 2 中和抗体效价消长规律 Fig. 2 Neutralizing antibody titer |
QPCR检测试验结果证明, 在各个免疫阶段的蛋黄中弹状病毒检出为阴性(图 3)。超剂量免疫条件下, 连续投喂抗杂交鳢弹状病毒卵黄抗体10 d, 无杂交鳢死亡, 说明制备的卵黄抗体安全性较好。
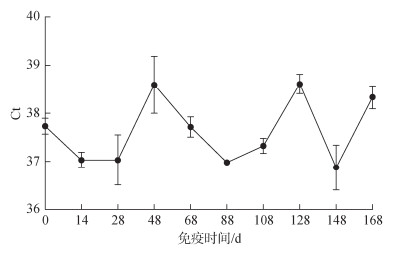 |
| 图 3 蛋鸡免疫各个阶段蛋黄中弹状病毒检测Ct值 Fig. 3 Ct values of HSHRV in egg yolks at each stage of immunity |
试验结果表明, 人工感染条件下, 连续投喂抗杂交鳢弹状病毒卵黄抗体, 可显著提高杂交鳢对弹状病毒的抗病力。投喂抗杂交鳢弹状病毒卵黄抗体的试验组存活率和相对保护率要显著高于非特异性抗体对照组和空白组(P < 0.05)。感染后第2天, 非特异性蛋粉组杂交鳢开始大量死亡, 存活率为44.1%, 各免疫组存活率接近, 为96.6%~99.4% (图 4)。感染后3~7 d, 非特异性蛋粉组杂交鳢持续死亡, 免疫组杂交鳢死亡数量较非特异性蛋粉组显著减少(图 4)。感染第7天统计存活杂交鳢总数, 其中非特异性蛋粉组杂交鳢存活率为8.5%, 此时低剂量免疫组、中剂量免疫组、高剂量免疫组存活率分别为78.5%、70.6%、64.4%, 免疫组与非特异性抗体对照组相比差异极显著(P < 0.001) (图 5)。低、中、高各组别相对保护率分别为76.5%、67.9%、61.1% (图 6)。低剂量免疫组存活率显著高于高剂量免疫组(P < 0.05), 低剂量免疫组存活率与中剂量免疫组无显著差异(P > 0.05)。
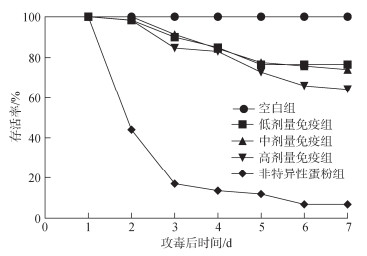 |
| 图 4 人工感染条件下不同时间点不同处理组存活率 Fig. 4 Survival rates of different treatment groups at different time points under artificial infection |
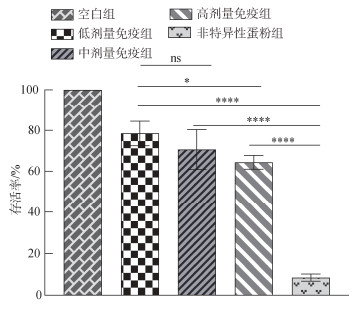 |
| 图 5 人工感染条件下不同处理组存活率 Fig. 5 Survival rates of different treatment groups under artificial infection 注: ****代表P < 0.001; *代表P < 0.05; ns代表P > 0.05; 下图同 |
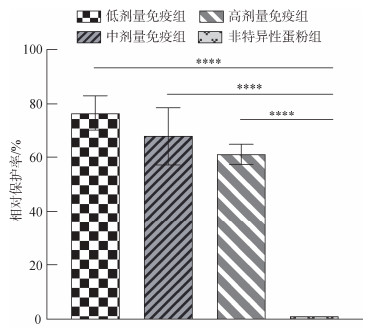 |
| 图 6 人工感染条件下不同处理组相对保护率 Fig. 6 Relative percentage of survival of different treatment groups under artificial infection |
杂交鳢弹状病毒是引起杂交鳢暴发性、高致死性死亡的病原, 极易感染免疫系统不完善的苗期杂交鳢, 高峰期死亡率在80%以上, 目前无有效治疗和预防该病的技术手段[10]。针对鳜鱼源弹状病毒病、大口黑鲈源弹状病毒病的预防和治疗方法已有文献报道。Cheng等[11]构建了鳜鱼源弹状病毒G蛋白DNA疫苗, 免疫保护率为77.5%; Zhang等[12]筛选到一支鳜鱼源弹状病毒弱毒苗, 浸泡和注射免疫均可提供100%免疫保护; 罗霞等[13]研制鳜鱼传染性脾肾坏死病和弹状病毒病二联灭活疫苗, 其中弹状病毒病保护率为84%以上。杭小英等[14]发现黄芪多糖等中草药在体外有较好的中和大口黑鲈弹状病毒的效果, 同时抗大口黑鲈弹状病毒卵黄抗体在体外也可以中和一定量的弹状病毒[8]。目前尚无预防杂交鳢弹状病毒病疫苗和治疗杂交鳢弹状病毒病药物的研究。鉴于杂交鳢弹状病毒对杂交鳢养殖的危害, 急需开发一款针对杂交鳢弹状病毒病的生物制品以验证预防和治疗该病的可能性。
本文将杂交鳢弹状病毒经白油乳化制备疫苗, 免疫蛋鸡获得卵黄抗体, 采用喷雾干燥方法制备成卵黄抗体粉, 经中和抗体效价检测测定卵黄抗体水平。按照每kg鱼饲喂卵黄抗体0.25 g、0.4 g、0.6 g的条件投喂免疫料, 经人工感染试验确定抗杂交鳢弹状病毒卵黄抗体免疫保护效果。中和效价检测结果显示, 蛋鸡经4次免疫后可获得高中和抗体滴度的抗杂交鳢弹状病毒卵黄抗体, 说明卵黄抗体有较强的中和病毒能力。人工感染试验结果显示, 每kg鱼投喂0.25 g抗杂交鳢弹状病毒卵黄抗体对杂交鳢的相对保护率为76.5%, 适量添加卵黄抗体可显著提高杂交鳢抗弹状病毒感染能力, 有效防控杂交鳢弹状病毒病。同时, 与每kg鱼投喂0.6 g特异性蛋粉相比, 投喂0.25 g特异性蛋粉免疫组在感染期内具有更高的杂交鳢存活率和相对保护率。王仁宝等[15]在使用卵黄抗体抗致急性肝胰腺坏死病副溶血性弧菌(vibrioparahaemolyticus associated with acute hepatopancreatic necrosis disease, VPAHPND)感染的试验中, 发现投喂0.2%VPAHPND卵黄抗体对凡纳滨对虾的相对免疫保护率高于0.5%卵黄抗体添加组, 同时具有更高的存活率和更高的肝胰腺SOD活性及抗菌肽基因表达水平。韦蒿等[16]使用抗白斑综合症病毒(white spot syndrome virus, WSSV)卵黄抗体免疫凡纳滨对虾后发现, 低抗体浓度免疫组感染WSSV后的存活率和免疫酶活性均高于高浓度免疫组。上述研究结果与本试验一致: 在一定范围内, 口服卵黄抗体添加剂量与抗病效果呈负相关, 添加剂量越高抗病效果未必越好。这现象可能与卵黄抗体抗病机制相关, 需要进一步探究。
此外, 本研究发现, 使用抗杂交鳢弹状病毒卵黄抗体免疫杂交鳢, 可以保护其度过死亡高峰期, 在一定程度上延缓弹状病毒病的发病进程和死亡时间, 与非特异性免疫组相比, 提高同一时间的存活率。证明尽管卵黄抗体经过鱼胃肠道高酸碱、强消化酶的环境, 但是其仍旧具有抵抗、中和特定病毒病原的能力。这可能与卵黄抗体具有耐酸、耐碱、耐消化酶特性相关[17-18]。同时, 卵黄抗体在卵磷脂包裹下也可抵抗酸碱和消化酶环境[19]。卵黄抗体经胃肠道消化进入血液的过程和口服卵黄抗体的抗病机制目前尚不清楚, 仍需进一步探究。
本研究在制备杂交鳢弹状病毒特异性卵黄抗体的基础上, 经过人工感染模型明确抗杂交鳢弹状病毒卵黄抗体具有抗病效果, 证明卵黄抗体可有效地用于杂交鳢的被动免疫, 在弹状病毒病的控制方面具有极大的开发潜力。
| [1] |
EINER-JENSEN K. Evolution of the fish rhabdovirus viral haemorrhagic septicaemia virus[J]. Journal of General Virology, 2004, 85(5): 1167-1179. DOI:10.1099/vir.0.79820-0 |
| [2] |
TENG Y, LIU H, LV J Q, et al. Characterization of complete genome sequence of the spring viremia of carp virus isolated from common carp (Cyprinus carpio) in China[J]. Arch Virol, 2007, 152(8): 1457-1465. DOI:10.1007/s00705-007-0971-8 |
| [3] |
曾伟伟, 王庆, 王英英, 等. 一株鳢科鱼源弹状病毒的分离及鉴定[J]. 水产学报, 2013, 37(9): 1416-1424. ZENG Weiwei, WANG Qing, WANG Yingying, et al. Isolation and characterization of a rhabdovirus from snakehead fish (Ophicephalus striatus)[J]. Journal of Fisheries of China, 2013, 37(9): 1416-1424. |
| [4] |
HOFFMANN B, BEER M, SCHÜTZE H, et al. Fish rhabdoviruses: molecular epidemiology and evolution[J]. Current Topics in Microbiology and Immunology, 2005, 292: 81-117. |
| [5] |
QIN Z D, BABU S V, LI N Q, et al. Protective effects of chicken egg yolk immunoglobulins (IgY) against experimental Aeromonas hydrophila infection in blunt snout bream (Megalobrama amblycephala)[J]. Fish and Shellfish Immunology, 2018, 78: 26-34. DOI:10.1016/j.fsi.2018.04.001 |
| [6] |
XU L, CHE J, XU Y P, et al. Oral administration of microencapsulated egg yolk immunoglobulin (IgY) in turbot (Scophthalmus maximus) to combat against Edwardsiella tarda 2CDM001 infections[J]. Fish and Shellfish Immunology, 2020, 106: 609-620. DOI:10.1016/j.fsi.2020.08.024 |
| [7] |
LU Y N, LIU J J, JIN L J, et al. Passive protection of shrimp against white spot syndrome virus (WSSV) using specific antibody from egg yolk of chickens immunized with inactivated virus or a WSSV-DNA vaccine[J]. Fish and Shellfish Immunology, 2008, 25(5): 604-610. DOI:10.1016/j.fsi.2008.08.010 |
| [8] |
袁雪梅, 吕孙建, 施伟达, 等. 大口黑鲈弹状病毒的分离培养及其卵黄抗体的制备[J]. 渔业科学进展, 2020, 41(3): 151-157. YUAN Xuemei, LV Sunjian, SHI Weida, et al. Isolation and egg-yolk antibody preparation of Micropterus salmonides Rhabdovirus[J]. Progress in Fishery Sciences, 2020, 41(3): 151-157. |
| [9] |
广东海大畜牧兽医研究院有限公司. 传染性脾肾坏死病毒、大口黑鲈鱼病毒和鳜弹状病毒的三重荧光PCR检测试剂盒: CN202010351189.4[P]. 2021-07-06. Guangdong Haid Animal Husbandry and Veterinary Research Institute Co. LTD. Triple fluorescent PCR detection kit for infectious spleen and kidney necrosis virus, largemouth black bass virus, and siniperca virus: CN202010351189.4[P]. 2021-07-06. |
| [10] |
雷燕. 杂交鳢弹状病毒病综合防控技术[J]. 海洋与渔业水产前沿, 2015(4): 87-88. LEI Yan. The Comprehensive prevention and control technology of Hybrid snakehead rhabdovirus[J]. Fisheries Advance Magazine, 2015(4): 87-88. |
| [11] |
CHEN Z Y, LEI X Y, ZHANG Q Y. The antiviral defense mechanisms in mandarin fish induced by DNA vaccination against a rhabdovirus[J]. Veterinary Microbiology, 2012, 157(3/4): 264-275. |
| [12] |
ZHANG L J, LI N Q, LIN Q, et al. An avirulent Micropterus salmoides rhabdovirus vaccine candidate protects Chinese perch against rhabdovirus infection[J]. Fish and Shellfish Immunology, 2018, 77: 474-480. DOI:10.1016/j.fsi.2018.03.047 |
| [13] |
罗霞, 付小哲, 林强, 等. 鳜鱼传染性脾肾坏死病和弹状病毒病二联灭活疫苗毒种及种子批的研究[J]. 西北农林科技大学学报(自然科学版), 2022(1): 1-9. LUO Xia, FU Xiaozhe, LIN Qiang, et al. Virus seed and seed batches of mandarin fish ISKNV and SCRV bivalent inactivated vaccine[J]. Journal of Northwest A & F University(Natural Science Edition), 2022(1): 1-9. |
| [14] |
杭小英, 袁雪梅, 吕孙建, 等. 抗大口黑鲈弹状病毒中草药的筛选及抗病毒效果[J]. 江苏农业科学, 2021(14): 155-159. HANG Xiaoying, YUAN Xuemei, LV Sunjian, et al. Against micropterus salmoides rhabdovirus screening of Chinese herbal medicine and antiviral effect[J]. Jiangsu Agricultural Sciences, 2021(14): 155-159. |
| [15] |
王仁宝, 史成银, 宋晓玲, 等. 卵黄抗体对凡纳滨对虾生长、免疫及抗VpAHPND感染的影响[J]. 水产学报, 2022, 46(12): 2409-2420. WANG Renbao, SHI Chengyin, SONG Xiaoling, et al. Effects of IgY on growth, immunity, and resistance to VpAHPND infection in Litopenaeus vannarensis[J]. Journal of Fisheries of China, 2022, 46(12): 2409-2420. |
| [16] |
WEI Song, SONG Xiaoling, LI Haibing, et al. Effects of lgG-Guard(shrimp) on immunity-related enzyme activities and WSSV resistance of Litopenaeus vannamei[J]. Journal of Fisheries of China, 2009, 33(1): 112-118. |
| [17] |
PEREIRA E P V, TILBURG M F V, FLOREAN E O P T, et al. Egg yolk antibodies (IgY) and their applications in human and veterinary health: A review[J]. International Immunopharmacology, 2019, 73: 293-303. |
| [18] |
LEE K A, CHANG S K, LEE Y J, et al. Acid stability of anti-Helicobacter pyroli IgY in aqueous polyol solution[J]. Journal of Biochemistry and Molecular Biology, 2002, 35(5): 488-493. |
| [19] |
RAHMAN S, VANNGUYEN S, ICATLOJR F C, et al. Oral passive IgY-based immunotherapeutics: A novel solution for prevention and treatment of alimentary tract diseases[J]. Human Vaccines & Immunotherapeutics, 2013, 9(5): 1039-1048. |
 2024, Vol. 48
2024, Vol. 48

