
文章信息
- 杨颖, 杨幸幸, 周红宏, 贾俊鹤, 蔡嫣然, 王腾, 纪焕红, 江灿. 2024.
- YANG Ying, YANG Xingxing, ZHOU Honghong, JIA Junhe, CAI Yanran, WANG Teng, JI Huanhong, JIANG Can. 2024.
- 长江口不同盐沼生境中大型底栖动物的分布特征
- Distribution characteristics of the macrobenthos in different vegetation salt marshes of the Changjiang River estuary
- 海洋科学, 48(8): 29-41
- Marine Sciences, 48(8): 29-41.
- http://dx.doi.org/10.11759/hykx20240123002
-
文章历史
- 收稿日期:2024-01-23
- 修回日期:2024-04-16
2. 自然资源部海洋生态监测与修复技术重点实验室, 上海 201206;
3. 辽宁石油化工大学, 辽宁 抚顺 113005
2. Key Laboratory of Marine Ecological Monitoring and Restoration Technologies, Ministry of Natural Resources, Shanghai 201206, China;
3. Liaoning Petrochemical University, Fushun 113005, China
长江口盐沼湿地具有复杂的生态结构和独特的生态功能, 含有丰富的生源要素和饵料资源, 成为众多水生生物育幼、索饵的重要场所, 是河口水生生物的关键栖息地[1], 且长江口盐沼湿地位于东亚—澳大利亚候鸟迁徙路线的中点, 是重要的候鸟驿站和越冬栖息地, 对维护长江口区域生物多样性发挥了重要作用。长江口盐沼植物中分布面积最大的3类植物分别是互花米草Spartina alterniflora、芦苇Phragmites australis和海三棱藨草Scirpus mariqueter, 还有少量糙叶薹草Carex scabrifolia、菰Zizania latifolia、水莎草Juncellus serotinus、水葱Scirpus tabernaemontani等植物。盐沼植物群落可能会导致底栖动物分布产生明显差异[2], 尤其是植株高度、地下部分生物量与底栖动物密度、多样性指数、物种丰度的相关性显著, 且盐沼植被影响底栖动物群落, 植物的地上部分和地下部分结构导致盐沼生境结构复杂, 增加了沉积物表层环境的结构异质性, 从而使大型底栖动物的生境多样化[3]。近20年以来, 针对长江口湿地生境与大型底栖动物开展了大量研究[3-13], 主要集中在盐沼主要分布区如九段沙[4-5]、崇明东滩[6-7]等区域的大型底栖动物群落生态特征, 互花米草入侵对长江口盐沼湿地大型底栖动物群落的影响[8-9], 以及盐沼植物对大型底栖动物群落的影响[10-13]等方面。已有研究大多基于长江口典型区域(如崇明东滩、九段沙等), 而基于长江口主要盐沼分布区全覆盖、各种植被生境类型全覆盖的调查结果并不多见。本文在对长江口盐沼湿地7种植被生境下大型底栖动物进行系统调查基础上, 分析大型底栖动物生态学特征, 探讨不同盐沼生境与大型底栖动物分布的关联性, 为长江口盐沼生态系统保护修复提供支撑。
1 材料与方法 1.1 区域概况长江口盐沼湿地是我国海岸带区域最大的盐沼湿地之一, 2020年调查结果显示, 约占全国海岸带盐沼面积的1/4, 总面积约2.8×104 hm2①, 主要植被类型有芦苇、互花米草、海三棱藨草、糙叶薹草、水葱、水莎草和菰等。其中互花米草分布面积最大, 为1.4×104 hm2, 约占长江口盐沼总面积的50%, 主要分布在崇明北滩、九段沙和南汇边滩; 其次为芦苇盐沼约0.7×104 hm2, 主要分布在九段沙、崇明东滩和西滩; 海三棱藨草面积约0.4×104 hm2, 南汇边滩、九段沙和崇明东滩分布较多; 其他盐沼分布面积相对较小。芦苇主要分布于高潮滩, 互花米草在高、中潮滩均有分布, 海三棱藨草主要分布于中潮滩。
① 资料来源于《 2020年东海区盐沼生态系统现状调查与评估报告》, 自然资源部东海生态中心, 2020
1.2 资料来源本文数据资料来源于自然资源部东海生态中心2020年7月在长江口盐沼湿地开展的调查。共设置了19条断面(图 1), 因盐沼植被主要分布在高、中潮带, 每条断面分别在高、中潮带按盐沼植被种类分布情况布设采样站位, 共布设45个站位, 涉及植被种类7种。根据各类植被分布区域和面积大小, 分别设置互花米草滩站位11个、芦苇滩站位14个、海三棱藨草滩站位9个、水葱滩站位5个、菰滩站位3个、糙叶薹草滩2个和水莎草滩1个。按区域划分, 崇明北滩2条断面4个站位、东滩4条断面8个站位, 横沙边滩3条断面10个站位, 九段沙4条断面9个站位, 南汇边滩4条断面11个站位, 奉贤金山边滩2条断面3个站位。
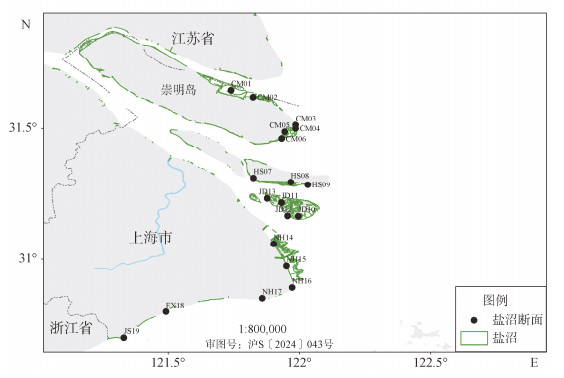 |
| 图 1 长江口盐沼调查断面分布示意图 Fig. 1 Monitoring sections in the salt marsh of the Changjiang River estuary 注: 底图来源于自然资源部标准地图, 审图号: 沪S(2024)043号; 图中●为断面位置, 字母为区域缩写, 数字为断面编号 |
植被调查依据文献[14]开展, 在每个站位各设置一个正方形样方, 边长为10 m, 四边均有10 m缓冲区, 缓冲区内主要植被种类与样方内植被种类相同。在每个样方四角和中间位置设置了5个1 m×1 m的正方形样格, 开展盐沼植被特征测量, 包括植株高度、密度和盖度等。同步依据文献[15]测量植物群落样方中心的高程。
在每个样方内各采集1个大型底栖动物定量样品, 采用0.25 m×0.25 m×0.30 m的样框采集4次, 合成一个样品。样品置入孔径1 mm的网筛现场直接淘洗装瓶, 样品加5%甲醛溶液固定带回实验室鉴定, 方法按照海洋监测规范[16]执行。
在每个样方采集1个沉积物样品, 以100 cm3的环刀, 采集0 ~15 cm的沉积物; 检测粒度、pH、全盐含量、有机碳、总氮和总磷等指标, 样品采集与保存按照文献[17]执行。粒度、pH检测分别采用文献[18]中的激光粒度仪法和电位法, 总氮和总磷检测分别采用文献[17]中的凯氏滴定法和分光光度法, 全盐含量检测采用文献[19]的方法。
1.3 数理统计方法 1.3.1 生物多样性指数采用种类多样性指数H′(Shannon-Weaver index)、种类丰富度指数d (Margalef’S index)、均匀度指数J′(Pielou index)[20]和相对重要性指数(IRI)对海洋生物多样性进行评价。计算公式分别为: H′=–∑Pilog2Pi, d=(S–1)/log2N, J′= H′/log2S, IRI= (Pi +Wi)×fi。式中: S—种类数; N—所有种的个体总数; Pi—样品中第i种个体数占总个体数的比例; fi—第i种在各样品中的出现频率; Wi—样品中第i种生物量占总生物量的比例; 取IRI > 500为优势种。
1.3.2 多元统计分析采用SPSS 22进行单因素方差分析(One-way ANOVA)进行显著性分析。应用PRIMER 5软件, 绘制等级聚类(Cluster)多变量图[20], 分析大型底栖动物群落的空间格局; 采用CANOCO 5绘制典范对应分析图(CCA图)[21], 分析大型底栖动物分布与环境因子的关系。
2 结果与分析 2.1 大型底栖动物特征 2.1.1 种类组成长江口盐沼调查共鉴定出大型底栖动物39种(表 1), 其中软体动物16种, 占41.0%; 甲壳类13种, 占33.3%; 多毛类7种, 占17.9%; 扁形动物、纽形动物和鱼类各1种。软体动物、甲壳类、多毛类是长江口盐沼大型底栖动物的优势类群, 主要优势种为中国绿螂Glauconome chinensis、丝异须虫Heteromastus filiformis、谭氏泥蟹Llyoplax deschmpsi、绯拟沼螺Assiminea latericea和疣吻沙蚕Tylorrhynchus等。不同植被生境中, 海三棱藨草盐沼鉴定出的大型底栖动物种类数最多, 达31种, 占总种数的79.5%; 其次为互花米草盐沼, 鉴定出21种, 占53.8%; 芦苇盐沼鉴定出17种, 糙叶薹草、菰、水葱、水莎草盐沼分别鉴定出6种、8种、10种和3种, 各种植被生境均出现的物种为谭氏泥蟹和无齿螳臂相手蟹Chiromantes dehanni; 互花米草盐沼优势种有5种, 为丝异须虫、无齿螳臂相手蟹Chiromantes dehaani、绯拟沼螺、天津厚蟹Helice tientsinensis和尖锥拟蟹守螺Cerithidea largillierli; 芦苇盐沼的优势种5种为绯拟沼螺、谭氏泥蟹、堇拟沼螺Assiminea violacea、疣吻沙蚕和尖锥拟蟹守螺; 海三棱藨草盐沼优势种有2种, 为中国绿螂和丝异须虫, 优势种数少于互花米草和芦苇, 是因为海三棱藨草中个别站位密度极大的中国绿螂降低了其他物种的密度占比。不同植被盐沼出现的具体大型底栖动物种类详见表 1。
| 类群及物种 | 各种植被盐沼区域 | ||||||
| 海三棱藨草Scirpus mariqueter | 互花米草Spartina alterniflora | 芦苇Phragmitesaustralias | 糙叶薹草Carex scabrifolia | 菰Zizania latifolia | 水葱Scirpustabernaem-ontani | 水莎草Juncellus serotinus | |
| 节肢动物门Arthropoda | |||||||
| 甲壳纲Crustacea | |||||||
| 谭氏泥蟹Llyoplax deschmpsi | ++ | ++ | ++ | + | ++ | ++ | + |
| 无齿螳臂相手蟹Chiromantes dehaani | + | + | + | + | + | + | + |
| 天津厚蟹Helice tientsinensis | + | + | + | ||||
| 褶痕相手蟹Sesarma plicata | + | + | |||||
| 弧边招潮Uca arcuata | + | ||||||
| 日本旋卷蜾蠃蜚Corophium volutator | + | + | + | + | |||
| 微小圆柱水虱Cirolana minuta | + | + | |||||
| 锯齿铲钩虾Listriella serra | + | ||||||
| 板跳钩虾Orchestia platensis | + | + | |||||
| 窄异跳钩虾Allorchestes angustus | + | ||||||
| 中国亮钩虾Photis sinensis | + | ||||||
| 赫氏细身钩虾Maera hirondellei | + | ||||||
| 日本大螯蜚Grandidierella japonica | + | + | |||||
| 软体动物门Granulifusus kiranus | |||||||
| 腹足纲Gastropoda | |||||||
| 绯拟沼螺Assiminea latericea | ++ | ++ | ++ | + | |||
| 光滑狭口螺Stenthyra glabar | ++ | + | ++ | ||||
| 尖锥拟蟹守螺Cerithidea largillierli | ++ | ++ | + | ||||
| 堇拟沼螺Assiminea violacea | + | + | ++ | + | |||
| 泥螺Bullacta exarata | + | ||||||
| 拟沼螺Assiminea sp. | ++ | ++ | +++ | ++ | |||
| 微小螺Elachisina sp. | ++ | + | + | ||||
| 中国耳螺Ellobium chinensis | + | + | |||||
| 中华拟蟹守螺Cerithidea sinensis | + | ||||||
| 紫游螺Neripteron violaceum | + | + | |||||
| 双壳纲Bivalvia | |||||||
| 薄云母蛤Yoldia similis | + | ||||||
| 河蚬Corbicula flaminca | ++ | + | ++ | ||||
| 江户明樱蛤Moerella jedoensis | + | ||||||
| 焦河篮蛤Potamocorbucata ustulata | ++ | ||||||
| 中国绿螂Glauconome chinensis | +++ | + | |||||
| 缢蛏Sinonovacula constricta | + | ||||||
| 环节动物门Annelida | |||||||
| 多毛纲Polychaeta | |||||||
| 日本刺沙蚕Neanthes japonica | + | ||||||
| 双管阔沙蚕Platynereis bicanaliculata | + | + | + | ||||
| 疣吻沙蚕Tylorrhynchus heterochaetus | + | ++ | ++ | ++ | ++ | ||
| 圆锯齿吻沙蚕Dentinephtys glabra | + | + | + | ||||
| 渤海格鳞虫Gattyana pohaiensis | + | ||||||
| 丝异须虫Heteromastus filiformis | ++ | ++ | + | + | |||
| 鳞腹沟虫Scolelepis squamata | + | ||||||
| 扁形动物门Platyhelminthes | |||||||
| 平角涡虫Paraplanocera reticulate | + | ||||||
| 纽形动物门Nemertea | |||||||
| 纽虫Nemertinea sp. | + | + | + | + | + | + | |
| 脊索动物门Chordata | |||||||
| 拉氏狼牙虾虎鱼Odontamblyopus lacepedii | + | ||||||
| 注: 表格中“+”代表生物密度 < 100 ind./m2; “++”代表100 ind./m2≤生物密度 < 1 000 ind./m2; “+++”代表生物密度≥1 000 ind./m2 | |||||||
按站位统计, 每个站位平均种类数为6.4种(范围为2~20种), 其中海三棱藨草盐沼每站平均种类数8.2种(范围为5~20种), 芦苇盐沼每站平均种类数6.2种(范围为2~10种), 互花米草盐沼每站平均种类数5.8种(范围为3~11种)。采用单因素方差分析, 3种盐沼生境各站位种类数无显著性差异(P > 0.05)。
2.1.2 生物密度与生物量长江口盐沼湿地大型底栖动物平均密度为379 ind./m2, 范围为12~4 484 ind./m2。不同植被盐沼生物密度差异较大(表 2), 平均生物密度大小顺序为海三棱藨草盐沼> 菰 > 水葱 > 糙叶薹草 > 互花米草 > 芦苇 > 水莎草。其中海三棱藨草盐沼平均生物密度最高, 达933 ind./m2 (站位变幅为232~4 484 ind./m2), 软体动物密度居于首位, 多毛类居于第二; 菰盐沼中平均生物密度居于第二, 为709 ind./m2(站位变幅为164~1 732 ind./m2); 其他盐沼中生物密度均较低。采用单因素方差分析对站位数较多的海三棱藨草、互花米草、芦苇3种盐沼生境大型底栖动物密度进行差异性分析, 结果表明, 3种盐沼生境各站位生物密度具有显著性差异(P < 0.05), 其中, 互花米草与芦苇盐沼差异不显著, 海三棱藨草与芦苇、海三棱藨草与互花米草差异显著(P < 0.05)。
| 植被种类 | 生物密度/(ind.·m–2) | 生物量/(g·m–2) | |||
| 范围 | 均值±标准误 | 范围 | 均值±标准误 | ||
| 芦苇 | 68~328 | 150 ± 24 | 8.45~100.5 | 32.56 ± 6.89 | |
| 互花米草 | 12~520 | 190 ± 48 | 0.40~76.97 | 25.71 ± 7.61 | |
| 海三棱藨草 | 232~4 484 | 933 ± 424 | 1.34~278.18 | 59.96 ± 30.46 | |
| 菰 | 164~1 732 | 709 ± 512 | 45.46~76.97 | 13.43 ± 3.12 | |
| 糙叶薹草 | 120~312 | 216 ± 96 | 68.35~100.5 | 46.27 ± 36.29 | |
| 水葱 | 72~652 | 372 ± 145 | 21.53~278.18 | 25.08 ± 11.23 | |
| 水莎草 | — | 64 | — | 124.46 | |
| 总平均 | 379 ± 103 | 36.92 ± 7.22 | |||
| 注: “—”表示无数据 | |||||
大型底栖动物平均生物量为36.92 g/m2, 范围为0.40~278.18 g/m2。不同植被盐沼生物量差异较大, 平均生物量大小顺序为水莎草盐沼> 海三棱藨草 > 糙叶薹草 > 芦苇 > 互花米草 > 水葱 > 菰(表 2)。海三棱藨草盐沼中平均生物量59.96 g/m2(站位变幅为1.34~278.18 g/m2), 软体动物生物量居于首位, 甲壳类居于第二; 芦苇盐沼平均生物量32.56 g/m2(站位变幅为8.45~100.5 g/m2), 软体动物生物量居于首位, 甲壳类居于第二; 互花米草盐沼平均生物量25.71 g/m2(站位变幅为0.40~76.97 g/m2), 甲壳类生物量居于首位, 软体动物居于第二。采用单因素方差分析对站位数较多海三棱藨草、互花米草、芦苇3种盐沼生境大型底栖动物量进行差异性分析, 3种盐沼生境各站位生物量无显著性差异(P > 0.05)。
2.1.3 生物多样性长江口盐沼大型底栖动物多样性指数H′平均为1.39, 范围为0.24~2.99。均匀度指数J′平均为0.61, 范围为0.1~1.0。丰富度指数d平均为0.55, 范围为0.14~ 1.75。不同植被盐沼中(表 3), 糙叶薹草、芦苇和互花米草盐沼大型底栖动物多样性指数较高, 海三棱藨草和水葱一般, 菰和水莎草较低; 海三棱藨草、互花米草和芦苇盐沼大型底栖动物丰富度较高, 其余均较低; 糙叶薹草、芦苇和互花米草盐沼大型底栖动物均匀度指数较高。综合来看, 糙叶薹草、互花米草、芦苇的大型底栖动物多样性好于其他植被盐沼。各区域盐沼大型底栖动物多样性差异较大, 综合多样性指数、丰富度指数和均匀度指数情况, 崇明北滩的芦苇盐沼、崇明东滩和横沙边滩的糙叶薹草盐沼、九段沙的芦苇盐沼、南汇边滩和奉贤金山的互花米草盐沼生物多样性相对较好。
| 区域 | 多样性指数 | 丰富度指数 | 均匀度指数 | |||||
| 均值 | 范围 | 均值 | 范围 | 均值 | 范围 | |||
| 芦苇 | 1.62 | 0.61~2.29 | 0.59 | 0.16~1.02 | 0.68 | 0.38~0.91 | ||
| 互花米草 | 1.61 | 0.83~2.32 | 0.61 | 0.42~0.94 | 0.71 | 0.32~1.00 | ||
| 海三棱藨草 | 1.10 | 0.24~2.99 | 0.65 | 0.34~1.75 | 0.40 | 0.10~0.73 | ||
| 菰 | 0.73 | 0.31~1.27 | 0.40 | 0.28~0.51 | 0.34 | 0.15~0.55 | ||
| 糙叶薹草 | 1.70 | 1.65~1.74 | 0.45 | 0.43~0.48 | 0.78 | 0.75~0.82 | ||
| 水葱 | 1.13 | 0.94~1.37 | 0.34 | 0.14~0.51 | 0.65 | 0.51~0.94 | ||
| 水莎草 | 0.87 | 0.33 | 0.55 | |||||
各类盐沼植被长势良好, 芦苇平均高度最高, 均值为2.36 m, 其次为互花米草, 平均高度1.79 m, 菰平均高度1.51 m, 海三棱藨草平均高度0.53 m, 糙叶薹草、水葱和水莎草等与海三棱藨草高度相近。海三棱藨草的植株密度最高, 平均密度为1 942株/m2, 其次为水葱, 平均密度为830株/m2, 互花米草平均密度为82株/m2, 芦苇平均密度为48株/m2。不同植物种类盖度差异较大, 平均盖度互花米草 > 芦苇 > 海三棱藨草 > 菰 > 水葱 > 糙叶薹草 > 水莎草(表 4)。
| 指标 | 芦苇 | 互花米草 | 海三棱藨草 | 菰 | 糙叶薹草 | 水葱 | 水莎草 |
| 高度/m | 2.36 ± 0.09 | 1.79 ± 0.02 | 0.53 ± 0.02 | 1.51 ± 0.09 | 0.59 ± 0.02 | 0.60 ± 0.04 | 0.60 ± 0.03 |
| 密度/(株·m–2) | 48 ± 3.1 | 82 ± 3.5 | 1 942 ± 180 | 43.1 ± 3.7 | 442 ± 77.1 | 830 ± 108 | 142 ± 65.8 |
| 盖度/% | 79.3 ± 2.3 | 83.5 ± 1.7 | 62.6 ± 4.1 | 62.5 ± 7.2 | 36.5 ± 8.1 | 44.5 ± 4.1 | 28.7 ± 9.4 |
| 物候期 | 幼苗期 | 幼苗期 | 开花期 | 开花期 | 幼苗期 | 开花期 | 开花期 |
调查了盐沼湿地沉积物粒度、pH、全盐含量、有机碳、总氮和总磷等指标(表 5), 其中平均中值粒径为5.98 φ(范围为3.73~7.22 φ), pH介于6.46~7.68, 全盐含量平均为3.50 g/kg(范围为0.27~11.45 g/kg), 有机碳含量平均为0.49%(范围为0.10%~1.42%), 总氮含量平均为766 mg/kg(范围为122~1 854 mg/kg), 总磷含量平均为127 mg/kg(范围为9.31~349 mg/kg)。不同植被盐沼生境沉积物理化特征不同, 海三棱藨草、水葱、糙叶薹草盐沼沉积物粒度中值粒径低于芦苇、互花米草和菰; 海三棱藨草和菰盐沼沉积物全盐含量高于其他植被; 菰和芦苇盐沼沉积物有机碳含量高于其他植被; 糙叶薹草、芦苇和菰盐沼沉积物中总氮、总磷含量较高。
| 指标 | 芦苇 | 互花米草 | 海三棱藨草 | 菰 | 糙叶薹草 | 水葱 | 水莎草 |
| 中值粒径/φ | 6.38 | 6.24 | 5.57 | 6.14 | 5.69 | 5.29 | 4.90 |
| pH | 6.97 | 7.01 | 7.00 | 6.75 | 6.75 | 6.85 | 6.55 |
| 全盐含量/(g·kg–1) | 3.59 | 3.30 | 4.00 | 2.74 | 4.42 | 3.46 | 0.73 |
| 有机碳/% | 0.60 | 0.40 | 0.42 | 0.72 | 0.54 | 0.39 | 0.05 |
| 总氮/(mg·kg–1) | 883 | 752 | 672 | 856 | 979 | 612 | 226 |
| 总磷/(mg·kg–1) | 139 | 87.2 | 90.1 | 193 | 156 | 185 | 181 |
| 高程/m | 2.773 | 2.828 | 2.205 | 2.249 | 2.204 | 1.990 | — |
沉积物中值粒径和大型底栖动物密度相关性分析, 多毛类主要在中值粒径6~7(φ值)之间, 甲壳动物主要分布在中值粒径4.5~5.5 φ, 软体动物在4~7 φ均有分布, 软体动物在不同沉积物环境的生存能力更强; 从主要优势种来看, 疣吻沙蚕更适合生存于中值粒径6~7之间, 丝异须虫和绯拟沼螺更适合于中值粒径7 φ左右, 谭氏泥蟹更适合生存于中值粒径5 φ左右(图 2)。
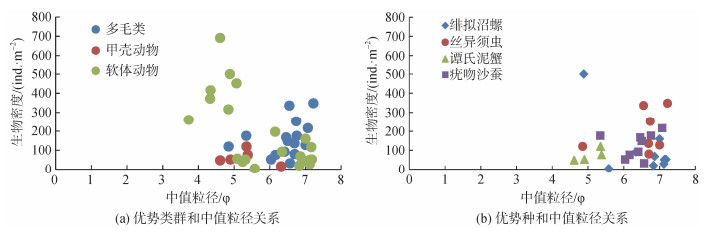 |
| 图 2 沉积物中值粒径与优势类群和优势种分布的关系 Fig. 2 Relationship between the median grain size of sediments and distribution of dominant groups |
统计了各个站位总氮总磷含量和主要大型底栖动物类群的分布情况, 发现沉积环境要素中总氮和总磷2个营养要素和大型底栖动物类群之间相关性较为密切(图 3), 其中多毛类更适合于总氮和总磷含量水平较高的区域, 软体动物生存空间总氮和总磷含量明显低于多毛类。
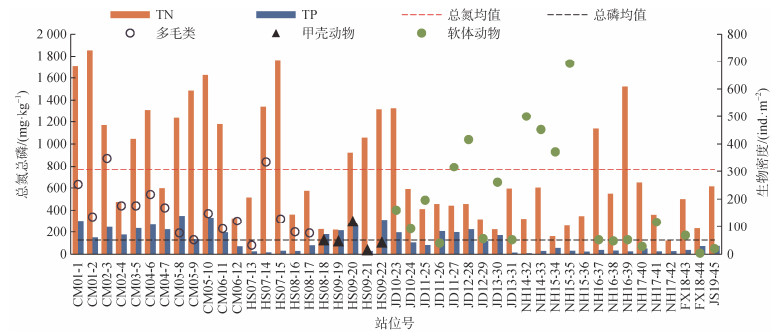 |
| 图 3 沉积物中总氮总磷含量与优势类群分布的关系 Fig. 3 Relationship between the total nitrogen and phosphorus content in sediments and the distribution of dominant groups |
对35个测定了高程的站位大型底栖动物群落结构, 采用Bray-Curtis相似系数绘制聚类谱系图(图 4)。所有站位在20%相似度以上可分为4个大群组, 影响大型底栖动物分布的因素为高程和盐沼植物种类, 高程相近的站位组成大群组, 组群内植物种类相同或相近的总体上相似度越高。从左至右第1组群为中低位高程的2个海三棱藨草和1个水葱站位组成, 均为莎草科植被; 第2组群以中位高程的5个芦苇、3个菰、3个水葱和1个水莎草站位组成; 第3组群为4个中位高程的海三棱藨草站位和1个互花米草站位组成; 第4组群为中高位高程的7个互花米草和6个芦苇站位组成。
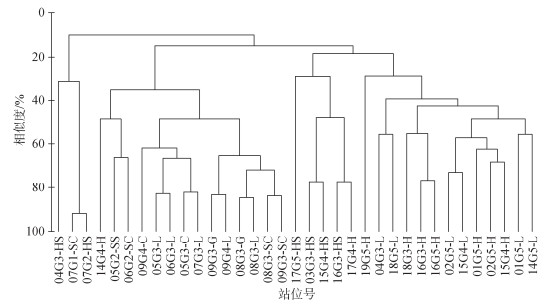 |
| 图 4 各站位大型底栖动物聚类分析图 Fig. 4 Cluster analysis of macrobenthos communities in the salt marsh of the Changjiang estuary 注: 图中编号, 数字01—17为调查断面号; G1—G5为高程, G1: < 1.5 m, G2: 1.5~2.0 m, G3: 2.0~2.5 m, G4: 2.5~3.0 m, G5: > 3 m; 字母代表植被种类的缩写, HS: 海三棱藨草, SC: 水葱, H: 互花米草, C: 糙叶薹草, L: 芦苇, G: 菰, SS: 水莎草 |
选择14个优势种与沉积物和植被生境指标做CCA分析(图 5), 发现样方高程和沉积物粒度是影响大型底栖动物分布的最主要的因素, 其中样方高程对生物分布的贡献度约为30%, 显示为极显著相关(P < 0.01); 粒度为显著相关(P < 0.05)。沉积物总磷和pH对部分物种分布有一定影响, 贡献度约为12%, 全盐含量、有机碳和总氮则无明显相关关系。植被分布中, 海三棱藨草与大型底栖动物分布极显著相关(P < 0.01), 焦河蓝蛤仅在海三棱藨草中发现, 中国绿螂在海三棱藨草中密度极大, 丝异须虫在海三棱藨草和互花米草中均为优势种。谭氏泥蟹、疣吻沙蚕、绯拟沼螺和尖锥拟蟹守螺等分布较广泛。
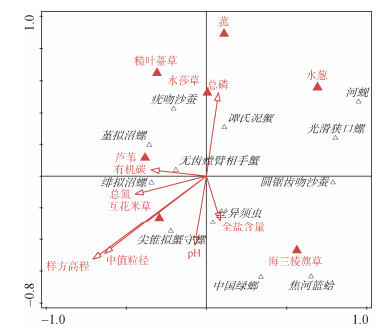 |
| 图 5 盐沼底栖动物主要种类与环境因子CCA排序图 Fig. 5 Canonical correspondence analysis (CCA) ordination diagram between major macrobenthic species and environmental factors in salt marsh in the Changjiang estuary |
盐沼植被作为滨海湿地盐沼生态系统的生产者, 对盐沼底栖生物的组成、结构与分布具有重要影响[12, 22]。本研究表明, 海三棱藨草、互花米草和芦苇盐沼平均生物密度分别为933 ind./m2、190 ind./m2和150 ind./m2, 平均生物量分别为59.96 g/m2、25.71 g/m2和32.56 g/m2。其中, 海三棱藨草与芦苇和互花米草盐沼中大型底栖动物密度均差异显著(P < 0.05), 海三棱藨草中的大型底栖动物平均密度和平均生物量均远高于互花米草和芦苇生境, 但是三种盐沼生境各站位生物量无显著性差异(P > 0.05)。
盐沼植被带中高程、盐沼类型、沉积环境、盐度等因素对其底栖生物分布均有不同程度的影响[3, 23-24]。本文研究结果表明, 影响底栖生物分布的主要因素为高程、沉积环境和盐沼植被, 其中, 高程贡献率最大。袁兴中等[3]研究同样表明不同高程的海三棱藨草中底栖生物群落具有显著差异。为深入分析盐沼植被对底栖生物分布的影响, 本文选择了高程相近的芦苇、海三棱藨和互花米草草样方的结果进行统计分析, 结果表明(表 6): (1)高位盐沼带区域(高程3.0~3.5 m), 就生物密度而言, 多毛类主要分布于互花米草群落; 软体动物和甲壳类主要分布在海三棱藨草群落。就生物量而言, 多毛类和甲壳类主要分布于互花米草群落, 软体动物主要分布于海三棱藨草群落。(2)中位盐沼带区域(高程2.5~3.0 m), 就生物密度而言, 多毛类主要分布于海三棱藨草群落, 软体动物主要分布于互花米草群落, 甲壳类在芦苇群落分布最少。就生物量而言, 多毛类主要分布于海三棱藨草群落, 软体动物主要分布于芦苇群落, 甲壳类主要分布于互花米草群落。(3)低位盐沼带区域(高程2.0~2.5 m), 多毛类、软体动物和甲壳类的生物密度和生物量在海三棱藨草群落最多。此外, 互花米草、海三棱藨草和芦苇群落中, 高、中、低位盐沼分别检出底栖生物19种、14种和29种。高、中位盐沼中互花米草底栖生物种类数高于芦苇和海三棱藨草, 低位盐沼中海三棱藨草中底栖生物种类数高于互花米草和芦苇。
| 高程/m | 植被 | 多毛类 | 软体动物 | 甲壳类 | |||
| 生物密度/(ind.·m–2) | 生物量/(g·m–2) | 生物密度/(ind.·m–2) | 生物量/(g·m–2) | 生物密度/(ind.·m–2) | 生物量/(g·m–2) | ||
| 3.0~3.5 | 互花米草 | 100 | 4.10 | 47 | 11.70 | 13 | 27.98 |
| 芦苇 | 29 | 1.07 | 69 | 38.68 | 6 | 12.15 | |
| 海三棱藨草 | 22 | 3.55 | 4 286 | 273.19 | 32 | 1.44 | |
| 2.5~3.0 | 互花米草 | 40 | 2.11 | 71 | 9.77 | 15 | 15.99 |
| 芦苇 | 52 | 2.53 | 46 | 17.47 | 7 | 8.06 | |
| 海三棱藨草 | 336 | 6.53 | 16 | 3.52 | 12 | 0.81 | |
| 2.0~2.5 | 互花米草 | 0 | 0.00 | 24 | 4.89 | 16 | 21.20 |
| 芦苇 | 60 | 0.96 | 60 | 12.31 | 29 | 12.37 | |
| 海三棱藨草 | 167 | 9.23 | 112 | 16.10 | 39 | 33.43 | |
互花米草在我国东部海岸定植并不断扩散以来, 对本土盐沼植被及其底栖生物多样性的影响成为研究重点[6, 8-9, 22], 研究表明, 互花米草入侵崇明东滩海三棱藨草群落后, 通过竞争取代土著植物, 显著降低了大型底栖无脊椎动物的物种多样性, 同时也显著改变了营养类群的结构[9]; 此外, 互花米草入侵长江口盐沼湿地后, 对环节动物影响较小, 而对软体动物产生了负面影响, 但对蟹类甲壳动物产生了一定的有利影响[8], 这与本文的研究结果总体一致, 即在高、中、低位盐沼中互花米草中的软体动物的生物量均为最低。进一步比较不同高程的盐沼底栖生物分布发现, 在高、中位盐沼中, 互花米草底栖生物多样性与本土植被相比无明显差异; 然而在低位盐沼中, 互花米草的生物多样性明显低于海三棱藨草。因此, 针对互花米草的治理应优先考虑控制其向低位盐沼的扩张, 以保护低位盐沼区的生物多样性。
3.2 沉积环境与大型底栖动物的相关性分析生境间的差异对底栖动物物种多样性具有重要影响, 其中盐沼湿地沉积环境(如盐度、有机碳、中值粒径、营养元素含量等)影响着底栖动物的生长和分布[23]。有研究表明, 沉积物中总有机碳和pH是通明海红树林大型底栖动物优势种的最大影响因子[24]; 沉积物粒度和总有机碳含量对东地中海土耳其海岸的多毛类的种类组成和丰度具有显著影响[25]; 表层沉积物中的有机质、总氮和总磷等因子影响着三门湾大型底栖动物群落[26]; 沉积物总氮、盐度等影响着崇明东滩盐沼湿地中植食性功能群底栖生物的多度, 而沉积物中值粒径、碳氮磷等与肉食性功能群之间具有一定的相关性[27]。
本研究结果显示, 长江口盐沼沉积物粒度、氮磷含量与底栖生物分布具有相关性(图 2、图 3)。沉积物粒度与底栖生物分布为显著相关(P < 0.05), 软体动物和甲壳动物是长江口盐沼的主要生物类群, 其中, 软体动物在中值粒径4~7 φ之间均有分布, 甲壳动物主要分布在中值粒径4.5~5.5 φ之间, 多毛类主要在中值粒径6~7 φ之间。此外, 沉积物粒度与沉积物氮磷等含量具有一定相关性, 进而影响着盐沼底栖生物的分布(图 3)。长江口盐沼中沉积物中值粒径与有机质、总氮等呈正相关关系, 相关系数R分别为0.60和0.63。颗粒较细的沉积物中, 多毛类为优势类群, 这与它们能够直接利用沉积物中的有机质以及在总氮和总磷含量较高区域的分布特征相符。与碎屑食性的部分多毛类底栖生物相比, 多为杂食性的软体动物与沉积环境的相关性相对弱些。通过深入研究盐沼沉积物特性与底栖动物分布之间的关系, 可以更好地理解生境差异对底栖动物多样性的影响, 有助于未来保护恢复滨海盐沼湿地生态系统。
3.3 长江口大型底栖动物群落变化及驱动因素分析本文收集了1999年以来崇明东滩盐沼中大型底栖动物的研究数据(表 7), 不同年份种类数差异较大。与历史数据相比, 底栖动物密度有明显下降, 生物量则波动较大, 优势种也有所不同。从短期看, 长江口盐沼生境特征对大型底栖动物群落组成变化及分布格局具有重要影响, 盐沼植被类型、生物量、沉积物特征(营养盐和粒径等)对长江口盐沼大型植物的组成和分布具有重要影响[11, 28]。从长期看, 影响长江口盐沼大型底栖动物分布的影响因素有: (1)互花米草入侵。互花米草自20世纪90年代在长江口引种后快速蔓延, 至2020年, 长江口潮间带互花米草面积约占盐沼总面积的50%。互花米草入侵后会逐渐形成单一群落的优势种, 对原有盐沼生境与生物群落具有重要影响, 在改变底栖动物群落组成和分布的同时, 也改变了底栖动物的营养类群[28]。互花米草群落的大型底栖动物种类、平均密度均高于其他盐沼植物群落[29], 米草属的植株性状(如密度)能够减小大型底栖动物被捕食概率, 与大型底栖动物多样性与密度等存在正相关性[30]。(2)人为活动。近30 a以来, 长江口崇明东滩、南汇东滩和横沙东滩等区域由于促淤围垦, 不断扩张, 盐沼湿地增生能力受限。1985—2020年崇明东滩湿地累计圈围整治129.5 km2[31], 圈围活动引起盐沼生态系统结构不稳定, 影响了盐沼大型底栖动物多样性[29]。此外, 互花米草治理采用的刈割、水位控制等活动也会间接影响长江口盐沼大型底栖动物类群[32]。(3)自然因素。在全球变暖背景下, 长江口面临着来水、来沙减少、入海污染物增多等多重胁迫, 其盐沼生态系统存在着盐沼湿地面积减少、岸线侵蚀、水体富营养化、盐度波动较大等生态问题, 湿地生态格局发生显著变化。如崇明东滩盐沼植被由1985年的110.23 km2减少至2020年的25.2 km2 [31], 进而对大型底栖动物群落组成产生了重要影响。
| 盐沼植被 | 物种数 | 生物密度/(ind.·m–2) | 生物量/(g·m–2) | 优势种 | 监测时间 | 资料来源 |
| 海三棱藨草 | 19 | 730.00 | 13.78 | 谭氏泥蟹、光滑狭口螺 | 1999年5—11月 | [3] |
| 海三棱藨草 | 4 591 | 堇拟沼螺、丝异须虫、光滑狭口螺 | 2003年7月 | [9] | ||
| 互花米草 | 2 432 | 堇拟沼螺、丝异须虫 | ||||
| 海三棱藨草 | 7 | 2 842(春) | 170.8 | 彩虹明樱蛤、谭氏泥蟹 | 2005年7月 | [6] |
| 芦苇 | 6 | 894 | 208.3 | 绯拟沼螺、无齿相手蟹、弧边招潮 | ||
| 互花米草 | 4 | 956(秋) | 122.1 | 排拟沼螺和珠带拟蟹守螺 | ||
| 海三棱藨草 | 21 | 335 | 59.02 | 丝异须虫、焦河蓝蛤、中国绿螂 | 2020年8月 | 本研究 |
| 芦苇 | 8 | 119 | 27.75 | 绯拟沼螺、谭氏泥蟹 |
由于盐沼湿地生态系统中的环境因子相互关联、相互制约, 共同对底栖动物组成与分布起重要作用[28]。因此, 要完整揭示盐沼大型底栖动物群落的分布特征及影响因子的作用机理, 需要综合考虑多种生境因子的综合作用, 在关注盐沼生境(水文、植被、沉积物)与大型底栖动物之间的协同作用的同时, 特别需要关注长时间尺度下人为因素、自然因素等多重影响因子的叠加效应, 开展系统、综合的研究。
| [1] |
SHEAVES M, BAKER R, NAGELKERKEN I, et al. True value of estuarine and coastal nurseries for fish: incorporating complexity and dynamics[J]. Estuaries and Coasts, 2015, 38: 401-414. DOI:10.1007/s12237-014-9846-x |
| [2] |
LANA P D C, GUISS C. Influence of Spartina alterniflora on structure and temporal variability of macrobenthos associations in a tidal flat of Paranagua Bay (southeastern Brazil)[J]. Marine Ecology Progress Series, 1991, 73: 231-244. DOI:10.3354/meps073231 |
| [3] |
袁兴中, 陆健健, 刘红. 河口盐沼植物对大型底栖动物群落的影响[J]. 生态学报, 2002, 22(3): 326-333. YUAN Xingzhong, LU Jianjian, LIU Hong. Influence of characteristics of Scirpus mariqueter community on the benthic macro-invertebrate in a salt marsh of the Changjiang estuary[J]. Acta Ecologica Sinica, 2002, 22(3): 326-333. |
| [4] |
张玉平. 九段沙底栖动物群落生态学研究[D]. 上海: 华东师范大学, 2005. ZHANG Yuping. Ecology of zoobenthic community in Jiuduansha Shoal[D]. Shanghai: East China Normal University, 2005. |
| [5] |
赵成建, 童春富. 九段沙湿地大型底栖动物分布特征及其影响因子[J]. 海洋学报, 2020, 42(2): 65-74. ZHAO Chengjian, TONG Chunfu. Distribution characteristics of the benthic macroinvertebrates and corresponding influencing factors in Jiuduansha shoals[J]. Haiyang Xuebao, 2020, 42(2): 65-74. |
| [6] |
徐晓军, 王华, 由文辉, 等. 崇明东滩互花米草群落中底栖动物群落动态的初步研究[J]. 海洋湖沼通报, 2006(2): 89-95. XU Xiaojun, WANG Hua, YOU Wenhui, et al. A study on the fluctuation of zoobenthic community in Chongming dongtan's Spartina alterniflora loisel[J]. Transactions of Oceanology and Limnology, 2006(2): 89-95. |
| [7] |
徐晓军. 崇明东滩大型底栖动物群落的生态学研究[D]. 上海: 华东师范大学, 2005. XU Xiaojun. The ecology study of macrobenthos community in Dongtan of Chongming Island[D]. Shanghai: East China Normal University, 2005. |
| [8] |
陈中兵. 互花米草入侵对长江口盐沼湿地大型底栖动物群落的影响[D]. 上海: 同济大学, 2009. CHEN Zhongbing. Effects of Spartina alterniflora invasions on the macrobenthos community at salt marsh of the Yangtze River estuary[D]. Shanghai: Tongji University, 2009. |
| [9] |
陈中义, 付萃长, 王海毅, 等. 互花米草入侵东滩盐沼对大型底栖无脊椎动物群落的影响[J]. 湿地科学, 2005, 3(1): 1-7. CHEN Zhongyi, FU Cuichang, WANG Haiyi, et al. Effects of Spartina alterniflora invasions on the benthic macroonvertebrates community at Dongtan of Chongming salt marsh, the Yangtze River estuary[J]. Wetland Science, 2005, 3(1): 1-7. |
| [10] |
钟胜财, 于克锋, 厉成伟, 等. 生态修复后海三棱藨草湿地底栖生物多样性的年度变化及影响因子[J]. 长江流域资源与环境, 2020, 29(4): 889-899. ZHONG Shengcai, YU Kefeng, LI Chengwei, et al. Variation and the associated affecting factors of benthic biodiversity in wetlands of Scirpus mariqueter on remediated Nanhui Coasts[J]. Resources and Environment in the Yangtze Basin, 2020, 29(4): 889-899. |
| [11] |
杨泽华, 童春富, 陆健健. 盐沼植物对大型底栖动物群落的影响[J]. 生态学报, 2007, 27(11): 4387-4397. YANG Zehua, TONG Chunfu, LU Jianjian. Effects of saltmarsh on the benthic macroinvertebrate community in Yangtze Estuary[J]. Acta Ecologica Sinica, 2007, 27(11): 4387-4397. |
| [12] |
张婷婷, 高宇, 王思凯, 等. 河口湿地景观格局与大型底栖生物群落的尺度效应研究[J]. 海洋渔业, 2018, 40(6): 679-690. ZHANG Tingting, GAO Yu, WANG Sikai, et al. Landscape pattern of estuarine wetland and its multi-scale effects on macrobenthos diversity[J]. Marine Fisheries, 2018, 40(6): 679-690. |
| [13] |
张衡, 张瑛瑛, 刁山洲, 等. 长江口盐沼湿地不同亚生境的大型底栖动物群落组成和多样性差异[J]. 生态学杂志, 2019, 38(10): 3102-3109. ZHANG Heng, ZHANG Yingying, DIAO Shanzhou, et al. Difference of macrobenthos community composition and diversity in different sub-habitats in salt marsh wetland of the Yangtze River Estuary[J]. Chinese Journal of Ecology, 2019, 38(10): 3102-3109. |
| [14] |
中国海洋工程咨询协会. 海岸带生态系统现状调查与评估技术导则第4部分: 盐沼: T/CAOE 20.4—2020[S]. 北京: 中国海洋工程咨询协会, 2020. China Association of Oceanic Engineering. Technical guideline for investigation and assessment of coastal ecosystem—Part 4: Remote sensing identification and results verification of the coastal ecosystem: T/CAOE 20.4—2020[S]. Beijing: China Association of Oceanic Engineering, 2020. |
| [15] |
国家测绘局. 全球定位系统实时动态测量(RTK)技术规范: CH/T 2009—2010[S]. 北京: 测绘出版社, 2010. The State Bureau of Surveying and Mapping. Specifications for global position system real-time kinematic (RTK)sunveys: CH/T 2009—2010[S]. Beijing: Surveying and Mapping Publishing House, 2010. |
| [16] |
中华人民共和国国家质量监督检验检疫总局, 国家标准化管理委员会. 海洋监测规范第7部分: 近海污染生态调查和生物监测: GB17378.7—2007[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of China. The specification for marine monitoring-Part 7: Ecological survey for offshore pollution and biological monitoring: GB17378.7—2007[S]. Beijing: Standards Press of China, 2007 |
| [17] |
中华人民共和国国家质量监督检验检疫总局, 国家标准化管理委员会. 海洋监测规范第5部分: 沉积物分析: GB17378.5—2007[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of China. The specification for marine monitoring-Part 5: Sediment analysis: GB17378.5—2007[S]. Beijing: Standards Press of China, 2007. |
| [18] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 海洋调查规范第8部分: 海洋地质地球物理调查: GB/T 12763.8—2007[S]. 北京: 中国标准出版社, 2008. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of China. Specifications for oceanographic survey-Part 8: Marine geology and geophysics survey: GB/T 12763.8—2007[S]. Beijing: Standards Press of China, 2008. |
| [19] |
中华人民共和国农业部. 土壤检测第16部分: 土壤水溶性盐总量的测定: NY/T 1121.16—2006[S]. 北京: 中国农业出版社, 2006. Ministry of Agriculture of the People's Republic of China. Soil testing part 16: Method for determination of total water-soluble sal: NY/T 1121.16—2006t[S]. Beijing: China Agriculture Press Co., Ltd, 2006. |
| [20] |
中华人民共和国国家质量监督检验检疫总局, 国家标准化管理委员会. 海洋调查规范第9部分: 海洋生态调查指南: GB/T 12763.9—2007[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of China. Specifications for oceanographic survey-Part 9: Guidelines for marine ecological survey: GB/T 12763.9—2007[S]. Beijing: Standards Press of China, 2007. |
| [21] |
赖江山. 生态学多元数据排序分析软件Canoco5介绍[J]. 生物多样性, 2013, 21(6): 765-768. LAI Jiangshan. Canoco 5: a new version of an ecological multivariate data ordination program[J]. Biodiversity Science, 2013, 21(6): 765-768. |
| [22] |
纪莹璐, 蒲思潮, 陶卉卉, 等. 丁字湾盐沼湿地不同植被生境大型底栖动物群落结构研究[J]. 山东农业大学学报(自然科学版), 2022, 53(3): 412-420. JI Yinglu, PU Sichao, TAO Huihui, et al. Study on the structure of microbenthic communities in coastal wetlands with different vegetation types in Dingzi Bay[J]. Journal of Shandong Agricultural University (Natural Science Edition), 2022, 53(3): 412-420. |
| [23] |
SILVESTRI S, DEFINA A, MARANI M. Tidal regime, salinity and salt marsh plant zonation[J]. Estuarine, Coastal and Shelf Science, 2005, 62: 119-130. DOI:10.1016/j.ecss.2004.08.010 |
| [24] |
姚昕. 基于稳定同位素初探通明海红树林夏冬两季大型底栖动物食物网与营养级[D]. 湛江: 广东海洋大学, 2023. YAO Xin. Using stable isotopes to preliminary study the food web and trophic level of macrozoobenthos in Tongminghai mangroves during summer and winter[D]. Zhanjiang: Guangdong Ocean University, 2023. |
| [25] |
MUTLU E, CINAR M E, ERGEV M B. Distribution of soft-bottom polychaetes of the Levantine coast of Turkey, eastern Mediterranean Sea[J]. Journal of Marine Systems, 2010, 79: 23-35. DOI:10.1016/j.jmarsys.2009.06.003 |
| [26] |
廖一波, 寿鹿, 曾江宁, 等. 三门湾大型底栖动物时空分布及其与环境因子的关系[J]. 应用生态学报, 2011, 22(9): 2424-2430. LIAO Yibo, SHOU Lu, ZENG Jiangning, et al. Spatiotemporal distribution of macrobenthic communities and its relationships with environmental factors in Sanmen Bay[J]. Chinese Journal of Applied Ecology, 2011, 22(9): 2424-2430. |
| [27] |
王琰, 童春富, 汤琳, 等. 崇明东滩盐沼湿地大型底栖动物功能群分布特征及其影响因子[J]. 生态学杂志, 2020, 39(3): 880-892. WANG Yan, TONG Chunfu, TANG Lin, et al. Distribution characteristics and influencing factors of the benthic macroinvertebrate functional groups in the salt marshes of Chongming Dongtan[J]. Chinese Joumal of Ecology, 2020, 39(3): 880-892. |
| [28] |
CHEN H L, BO L, HU J B, et al. Effects of Spartina alternifora invasion on benthic nematode communities in the Yangtze estuary[J]. Marine Ecology Progress Series, 2007, 336: 99-110. DOI:10.3354/meps336099 |
| [29] |
杨颖, 陈思思, 周红宏, 等. 长江口潮间带底栖生物生态及变化趋势[J]. 生态学报, 2022, 42(4): 1606-1618. YANG Ying, CHEN Sisi, ZHOU Honghong, et al. Ecological evaluation and variation trend analysis of macrobenthos in intertidal zone of Changjiang Estuary[J]. Acta Ecologica Sinica, 2022, 42(4): 1606-1618. |
| [30] |
BRAGA C F, BEASLEY C R, ISAAC V. Effects of plant cover on the macrofauna of Spartina marshes in northern Brazil[J]. Archives of Biology and Technology, 2009, 52: 1409-1420. DOI:10.1590/S1516-89132009000600013 |
| [31] |
胡正云. 长江口重要湿地生态系统格局变化研究[D]. 上海: 华东师范大学, 2022. HU Zhengyun. Study on the change of the wetland ecosystem pattern in the Yangtze Estuary[D]. Shanghai: East China Normal University, 2022. |
| [32] |
盛强, 黄铭垚, 汤臣栋, 等. 不同互花米草治理措施对植物与大型底栖动物的影响[J]. 水生生物学报, 2014, 38(2): 279-290. SHENG Qiang, HUANG Mingyao, TANG Chendong, et al. Effects of different eradication measures for controlling Spartina alterniflora on plants and macrobenthic invertebrates[J]. Acta Hydrobiologica Sinica, 2014, 38(2): 279-290. |
 2024, Vol. 48
2024, Vol. 48


