
文章信息
- 刘顺, 许星鸿, 史安心, 薛寒璐, 王思婕, 李百玉, 朱龙, 徐国成. 2024.
- LIU Shun, XU Xinghong, SHI Anxin, XUE Hanlu, WANG Sijie, LI Baiyu, ZHU Long, XU Guocheng. 2024.
- 单环刺螠对六价铬暴露响应的转录组学分析
- Transcriptomics analysis of the response of marine worm (Urechis unicinctus) to Cr(Ⅵ) exposure
- 海洋科学, 48(8): 74-84
- Marine Sciences, 48(8): 74-84.
- http://dx.doi.org/10.11759/hykx20231026002
-
文章历史
- 收稿日期:2023-10-26
- 修回日期:2024-01-05
2. 江苏海洋大学 江苏省海洋生物资源与环境重点实验室, 江苏 连云港 222005
2. Jiangsu Key Laboratory of Marine Biotechnology, Jiangsu Ocean University, Lianyungang 222005, China
水环境中重金属来源广泛且难以降解, 重金属污染具有较强的积累性、隐蔽性和不可逆性等特征, 可通过食物链产生放大效应, 对水生动物有一定的致癌、致畸等毒性[1]。重金属污染物被生物体吸收后能与蛋白质等大分子物质结合, 在细胞内产生活性氧、引发氧化应激, 导致肝肾等器官损伤、心血管疾病和炎症等[2]。水产品中的重金属亦可通过富集作用在人体中积累, 对健康构成一定威胁[3]。因此, 重金属污染已成为环境污染研究领域的一个重要问题, 引起了越来越多的关注。六价铬[hexavalent chromium, Cr(Ⅵ)]为低浓度下具有高毒性的重金属元素, 在水环境中主要以Cr(Ⅵ)和Cr(Ⅲ)形式存在, 并可在特定条件下相互转化[4]。现已证实, Cr(Ⅵ)在水中的溶解度远高于Cr(Ⅲ), 并且Cr(Ⅵ)的毒性是Cr(Ⅲ)的数百倍, Cr(Ⅵ)可经细胞膜上非特异性硫酸根阴离子通道直接进入细胞内, 因此Cr对生物体的毒性主要源自Cr(Ⅵ), 具有免疫、生殖和遗传等方面的毒性[5]。已有学者在水生动物机体中检测到一定程度的Cr(Ⅵ)存在[6], 但关于Cr(Ⅵ)对海洋底栖动物毒性效应的研究较少。
单环刺螠(Urechis unicinctus)为中国黄渤海以及韩国、日本海域等常见的底栖无脊椎动物, 主要分布在近岸潮间带和潮下带浅水区域。其富含多种必需氨基酸、蛋白质以及微量元素, 为具有较高开发价值的海洋水产资源[7]。近年来, 由于污染物排放量的增加, 沿海和底栖生态系统面临着重金属污染所带来的巨大压力。已有研究表明, 沉积物中的Cr含量远超过海水[8]。单环刺螠栖息于海底泥沙中, 行动缓慢, 因此受到Cr暴露的风险较高。相对于浮游生物, 底栖动物更容易积累重金属等污染物, 并通过食物链的生物放大作用, 其体内富集的重金属污染物可传递至高营养级生物和人类体内。单环刺螠主要依靠先天免疫系统来抵御外源性污染物的入侵。体腔液是其中最为重要的防御组织, 由多种体腔细胞、免疫酶、补体因子和凝集素等成分构成, 这些成分协同作用, 形成了高效的免疫防御机制[9]。
转录组学在筛选和发掘生理功能关键基因、差异表达基因(differentially expressed genes, DEGs)以及深入研究代谢调控机制等方面具有重要意义。本研究利用Illumina Hiseq 2500高通量测序平台对Cr(Ⅵ)暴露前后的单环刺螠体腔细胞进行转录组测序对比, 分析Cr(Ⅵ)暴露对单环刺螠的基因表达和信号转导通路的影响, 为探究重金属Cr(Ⅵ)对海洋底栖动物的毒性作用机制和水环境监测提供数据参考。
1 材料和方法 1.1 材料实验用单环刺螠购于连云港市海宁路水产品市场, 挑选体表完好、活力强的个体作为实验对象, 体长(13.5±3.2) cm, 体质量(16.8±2.5) g。
1.2 方法 1.2.1 实验设计单环刺螠于实验室中暂养14 d, 暂养条件为: 温度(15±1) ℃, 盐度25, pH 8, 连续充气, 每日换水1次并投喂2次小球藻(Chlorella pacifica)。根据急性毒性实验结果和环境污染浓度[10-11], 设置对照组(0 mg/L)和Cr(Ⅵ)暴露组(2.5 mg/L), 每组设3个平行, 每个平行随机投放20条单环刺螠于8 L的塑料箱中, 养殖密度为3只/L。实验期间不投喂, 以避免饵料对实验的影响, 其他养殖条件与暂养相同。每日换水1次并保持Cr(Ⅵ)浓度。暴露15 d后, 从对照组和暴露组随机挑选9条单环刺螠, 用1 mL注射器吸取体腔液(预先加入抗凝剂, 抗凝剂与体腔液比1∶1), 于4 ℃、10 000 r/min离心5 min后弃上清, 将体腔液细胞沉淀保存于液氮中备用。
1.2.2 RNA提取与转录组文库构建利用Trizol(生工, 中国)分别提取对照组和Cr(Ⅵ)暴露组的单环刺螠总RNA, 使用DNase I去除基因组DNA。通过琼脂糖凝胶电泳和核酸分析仪Agilent2100 (Agilent Technologie, 美国)检测RNA的浓度和质量。将经过筛选合格的总RNA送至百迈克生物科技有限公司进行测序, cDNA文库由Illumina Hiseq 2500构建。
在去除原始序列中质量较低、带接头和N比例超过10%的序列之后, 利用Trinity软件对测序数据进行组装, 得到单环刺螠的单基因序列(unigene)库。用BLAST软件将unigene分别与NCBI NR、eggNOG、KOG、GO、COG、Pfam、Swiss-Prot和KEGG等数据库进行比对。差异表达基因采用DESeq2进行筛选, 筛选标准为差异倍数∣log2(fold change, FC)∣≥1和错误发现率(false discovery rate, FDR) < 0.01。差异表达基因GO和KEGG富集分别利用GOseq R和KOBAS软件进行分析。
1.2.3 qRT-PCR为验证测序结果准确性, 随机选取4个上调基因与4个下调基因进行qRT-PCR检测。在cDNA第一链合成和qPCR过程中, 采用了TaKaRa反转录试剂盒和实时荧光定量试剂盒。qPCR体系包括SYBR Premix Ex Taq (Tli RnaseH Plus)10 μL、Rox Reference Dye(50×) 0.4 μL、cDNA模板2 μL、正反向特异性引物(20 μmol/L)各0.8 μL、ddH2O 6 μL, 共20 μL。反应程序为: 95 ℃预变性30 s; 95 ℃ 30 s、60 ℃ 34 s, 40个循环; 溶解曲线分析: 95 ℃ 15 s、60 ℃ 1 min。qPCR检测结果采用2–∆∆CT法计算, SPSS26.0进行数据统计分析。利用Primer 6.0设计特异性引物, 以β-actin、18S rRNA作内参基因(表 1)。
| 基因 | 引物序列(5'→3') |
| 内参基因(β-actin) | F: CTCAACCCCAAGGCTAAC R: GAAACACCATCTCCGGAA |
| 内参基因(18S rRNA) | F: ACCACCCACAGAATCGAGAAA R: GCCTGCGGCTTAATTTGACT |
| 钙调蛋白(CaM) | F: CGGCTGAGTGACTGTCTTCT R: ACTGGATCGCTGGAGTATTGT |
| 羧酸酯酶(CES) | F: TGTTGGCTTGAAGGTATGATGG R: GTCAGTGCGGAGTGTCAGT |
| 碱性磷酸酶(ALP) | F: ATTGAGTGCGGTGCGGTAG R: TGGTGGTTCTTCGTGGACATAT |
| 谷胱甘肽S-转移酶(GST) | F: CAGCATCAGGAATCTTAGGTA R: CTCACATCGTACAGACAACT |
| 蛋白酪氨酸磷酸酶(PTP) | F: AGCAGCAGAAGGTGAGAT R: GCAGCCAGTTGTTGAATAC |
| ABC转运蛋白(ABC transporter) | F: GCTCGCCATCTTCTTCAT R: CGCTGTTCTTGTCGGTAT |
| 脂肪酸酰胺水解酶(FAAH) | F: CGATTCCACTCCATTCAGA R: CAGACGCACTTACAACCT |
| 硫酸酯酶(SULF) | F: ATCCTACCAGAAGCCTTATG R: GTTGTTGCCGCCTCTATA |
对Cr(Ⅵ)暴露前后体腔细胞分别进行转录组测序, 原始数据经去除未知碱基序列、接头序列和低质量序列后, 共获得13.36 Gb高质量数据, 平均GC含量为46.13%, 质量值≥30的碱基数量所占的百分比(Q30)≥93.20%, 表明测序数据完整性较好。
2.2 DEGs分析Cr(Ⅵ)暴露下单环刺螠共产生1 352个DEGs, 其中有729个基因表达上调, 623个基因表达下调, 差异表达基因分布见图 1。共有978个DEGs得到注释, 其中NR953个, eggNOG826个, KOG613个, GO373个, COG333个, Pfam782个, Swiss-Prot544个, KEGG451个。
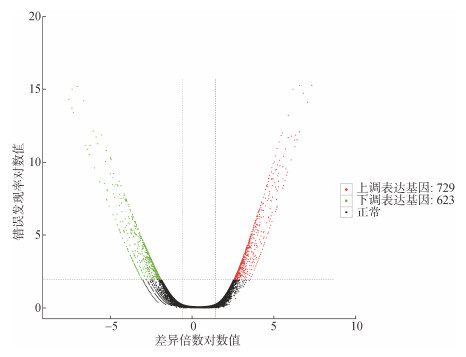 |
| 图 1 单环刺螠Cr(Ⅵ)暴露组和对照组差异表达基因火山图 Fig. 1 Volcano plot of the differentially expressed genes between the Cr(Ⅵ) exposure group and control of Urechis unicinctus |
根据GO功能分类结果显示, 共有373个DEGs在GO二级功能中被注释(图 2)。将GO数据库各二级节点归类到细胞组分(cellular component, CC)、生物学过程(biological process, BP)和分子功能(molecular function, MF)三大类中。其中, 在CC中富集最显著的是细胞膜(123)、细胞(111)和细胞组分(110); 在BP中主要富集在细胞过程(175)、代谢过程(160)和单个有机体细胞过程(131); 在MF中主要富集于催化活性(168)和结合(158), 其他还主要涉及转运体活性、信号转导和抗氧化活性等功能。
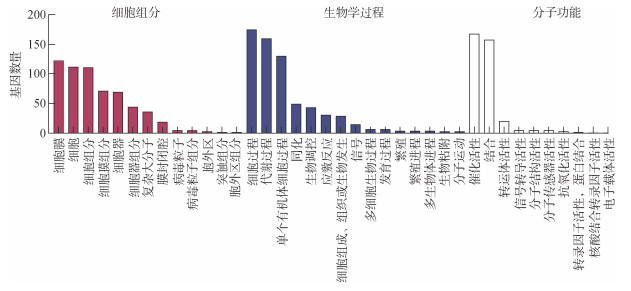 |
| 图 2 单环刺螠Cr(Ⅵ)暴露组和对照组差异表达基因GO富集分析 Fig. 2 GO enrichment analysis of differentially expressed genes between the Cr(Ⅵ) exposure group and control of Urechis unicinctus |
利用COG数据库对单环刺螠对照组和Cr(Ⅵ)暴露组DEGs序列进行直系同源分类, 富集DEGs数量较多的功能主要有: 信号转导机制、翻译后修饰、蛋白质转换和分子伴侣、碳水化合物运输与代谢、翻译、核糖体结构和生物合成、氨基酸运输与代谢、次级代谢物的合成、转运与分解、防御机制、脂类转运与代谢及细胞壁/膜/外被生物合成等(图 3)。
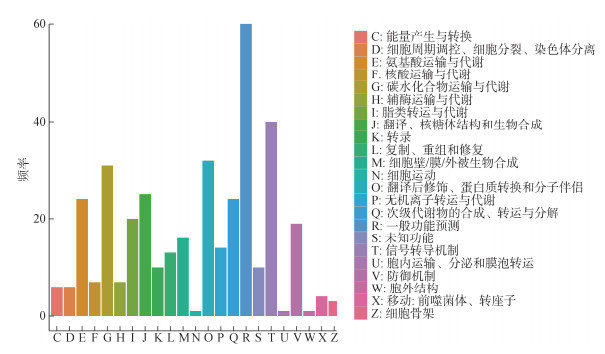 |
| 图 3 单环刺螠Cr(Ⅵ)暴露组和对照组DEGs COG注释分类 Fig. 3 Classification of COG annotations for differentially expressed genes between the Cr(Ⅵ)exposure group and control of Urechis unicinctus |
DEGs KEGG分析结果显示(图 4), 共有451个DEGs被注释到172个KEGG信号通路中, 可分为细胞过程、环境信息处理、遗传信息处理、代谢和有机系统5大类通路。富集DEGs较多的通路有真核生物核糖体生物合成(11)、内质网中蛋白质加工(9)、剪接体(8)、溶酶体(8)、碳代谢(7)、泛素介导的蛋白质水解(6)和谷胱甘肽代谢(5)等。
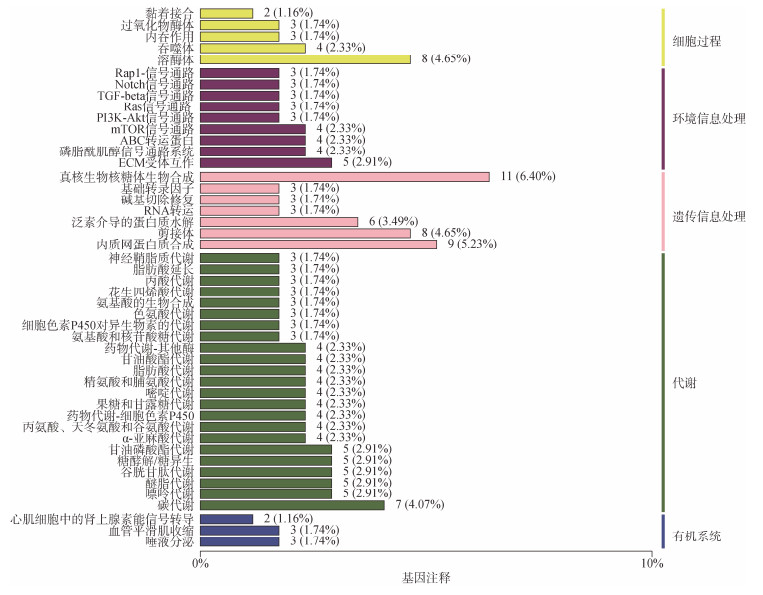 |
| 图 4 单环刺螠Cr(Ⅵ)暴露组和对照组DEGs KEGG分类 Fig. 4 KEGG classification map of differentially expressed genes between the Cr(Ⅵ) exposure group and control of Urechis unicinctus |
选取前20个显著富集的通路进行KEGG富集分析, 结果见图 5。富集程度最显著的通路是真核生物核糖体生物合成、醚脂代谢、高级糖基化终末产物-受体(AGE-RAGE)信号通路和谷胱甘肽代谢。与解毒和免疫相关的通路有谷胱甘肽代谢、溶酶体、吞噬体和ABC转运蛋白等; 与代谢相关的通路主要有真核生物核糖体生物合成、醚脂代谢、谷胱甘肽代谢、AGE-RAGE信号通路、甘油磷脂代谢、碳代谢和糖酵解/糖异生通路等; 与细胞信号转导相关的通路有谷胱甘肽代谢、细胞外基质受体互作、磷脂酰肌醇信号系统、mTOR信号通路等; 与细胞凋亡有关通路有谷胱甘肽代谢、醚脂代谢通路等。
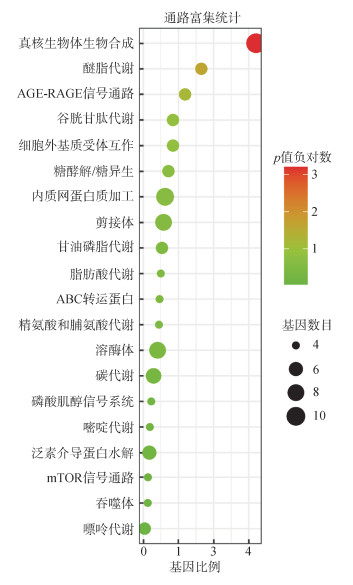 |
| 图 5 单环刺螠Cr(Ⅵ)暴露组和对照组DEGs KEGG通路富集分析 Fig. 5 KEGG pathway enrichment analysis of differentially expressed genes between the Cr(Ⅵ) exposure group and control of Urechis unicinctus |
Cr(Ⅵ)暴露下单环刺螠主要DEGs筛选结果见表 2。表达上调的DEGs主要有钙调蛋白、羧酸酯酶、碱性磷酸酶、谷胱甘肽-S转移酶、细胞色素P450和N-乙酰基转移酶等基因; 表达下调的DEGs主要有蛋白酪氨酸磷酸酶、ABC转运蛋白、脂肪酰胺水解酶、硫酸酯酶、天冬酰胺酶、氨基酸通透酶和Ahpc/TSA家族等基因。
| 基因编号 | 基因 | COG分类注释 | KOG分类注释 | 差异倍数对数值 |
| c32316.graph-c0 | 钙调蛋白 | 信号转导机制 | 信号转导机制 | 6.38 |
| c43307.graph-c0 | 羧酸酯酶 | 脂质运输与代谢 | 信号转导机制 | 5.75 |
| c36888.graph-c1 | 碱性磷酸酶 | 离子转运和代谢 | 离子转运和代谢 | 4.93 |
| c30652.graph-c0 | 谷胱甘肽S-转移酶 | 翻译后修饰、蛋白质周转、分子伴侣 | 翻译后修饰、蛋白质周转、分子伴侣 | 4.25 |
| c35877.graph-c0 | 细胞色素P450 | 次级代谢物生物合成、转运和代谢 | 次级代谢物生物合成、转运和代谢 | 4.18 |
| c34230.graph-c0 | N-乙酰基转移酶 | 翻译、核糖体结构和生物合成 | — | 3.75 |
| c41646.graph-c0 | 烯酰脂酰载体蛋白还原酶 | 脂质运输与代谢 | 一般功能预测 | 3.37 |
| c35100.graph-c1 | 热激蛋白A5 | 翻译后修饰、蛋白质周转、分子伴侣 | 翻译后修饰、蛋白质周转、分子伴侣 | 3.36 |
| c40697.graph-c0 | 磷酸甘油脂酶 | 碳水化合物运输和代谢 | 碳水化合物运输和代谢 | 2.43 |
| c37100.graph-c1 | 谷氨酰胺酶 | 氨基酸转运与代谢 | 氨基酸转运与代谢 | 2.20 |
| c42152.graph-c0 | 蛋白酪氨酸磷酸酶 | 信号转导机制 | 信号转导机制 | −4.57 |
| c42774.graph-c0 | ABC转运蛋白 | 防御机制 | 次级代谢物生物合成、转运和代谢 | −4.51 |
| c35186.graph-c0 | 脂肪酸酰胺水解酶 | 翻译、核糖体结构和生物合成 | — | −4.37 |
| c35599.graph-c0 | 硫酸酯酶 | 离子转运和代谢 | 一般功能预测 | −3.97 |
| c27654.graph-c0 | 天冬酰胺酶 | 氨基酸转运与代谢 | 氨基酸转运与代谢 | −3.83 |
| c34678.graph-c0 | 氨基酸通透酶 | 细胞壁/膜/外被生物合成 | 离子转运与代谢 | −3.73 |
| c18335.graph-c0 | 过氧化物还原蛋白6 | 防御机制 | 翻译后修饰、蛋白质周转、分子伴侣 | −3.15 |
| c35128.graph-c0 | DEAD/H解旋酶 | 复制、重组和修复 | RNA加工和修饰 | −3.14 |
| 注: “—”: 基因在该数据库中没有注释 | ||||
用qRT-PCR对随机挑选的8个DEGs进行表达水平的测定, 并与转录组测序结果进行比较, 结果如图 6所示。单环刺螠经15 d Cr(Ⅵ)暴露后, 各基因相对表达量与转录组测序结果呈现一致趋势, 表明该转录组测序结果可靠。
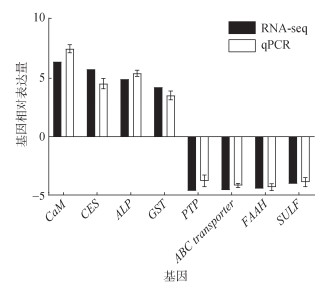 |
| 图 6 单环刺螠Cr(Ⅵ)暴露后DEGs qRT-PCR验证 Fig. 6 qRT-PCR validation of DEGs of Urechis unicinctus exposure to Cr(Ⅵ) 注: CaM为钙调蛋白基因; CES为羧酸脂酶基因; ALP为碱性磷酸酶基因; GST为谷胱甘肽-S-转移酶基因; PTP为蛋白酪氨酸磷酸酶基因; ABC transporter为ABC转运蛋白基因; FAAH为脂肪酸酰胺水解酶基因; SULF为硫酸酯酶基因 |
单环刺螠在Cr(Ⅵ)暴露后, 其谷胱甘肽代谢通路相关的基因表达发生显著变化(图 7)。谷胱甘肽(glutathione, GSH)是整个谷胱甘肽代谢通路的核心, 由谷氨酸、半胱氨酸和甘氨酸组成, 是一种含γ-酰胺键和巯基的三肽。GSH有还原性(G-SH)和氧化性(GSSG)两种形式, 正常情况下, GSH以还原性形式存在, 而暴露于重金属Cr(Ⅵ)后可能导致其转变为氧化性形式。图 7显示, γ-谷氨酰转肽酶(gamma-glutamyltranspeptidase, γ-GT)和过氧化物还原蛋白6(peroxiredoxin 6, PRDX6)基因表达显著下调, 而GSH、GST和核糖核苷二磷酸还原酶亚基M1(ribonucleoside-diphosphate reductase subunit M1, RRM1)等基因表达上调。
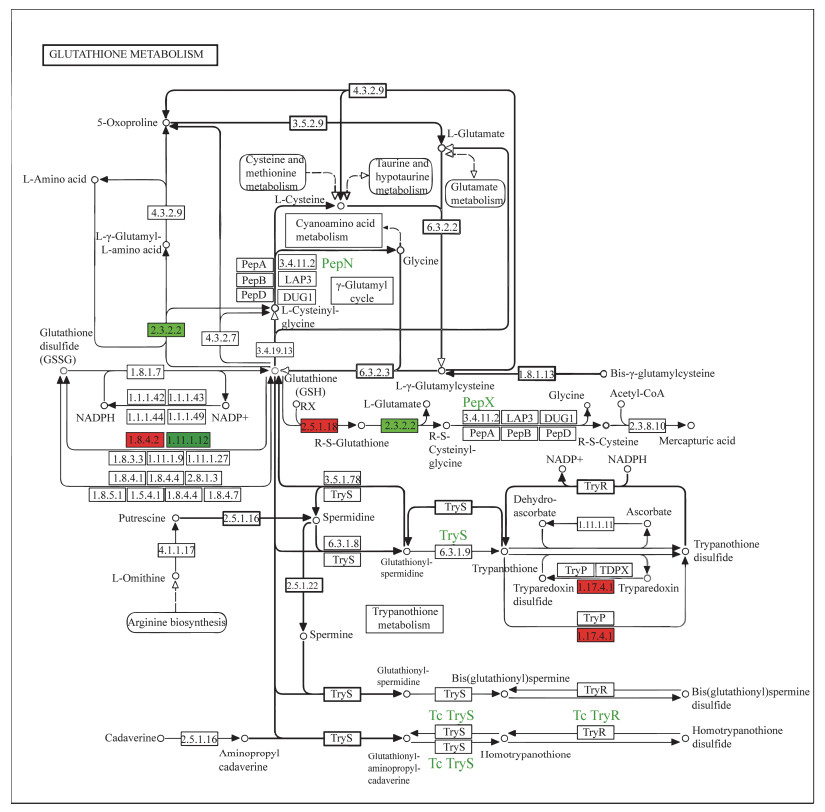 |
| 图 7 Cr(Ⅵ)暴露15 d对GSH代谢通路的影响 Fig. 7 Effect of Cr(Ⅵ) exposure for 15 d on GSH metabolism pathway 注: 红色代表基因表达上调; 绿色代表基因表达下调。2.3.2.2: γ-GT; 1.8.4.2: GSH; 2.5.1.18: GST; 1.17.4.1: RRM1; 1.11.1.12: PRDX6 |
Cr(Ⅵ)暴露下单环刺螠体腔细胞产生1 352个DEGs, 包括729个基因表达上调, 623个基因表达下调。GO功能分类结果显示, DEGs主要富集于细胞过程、催化活性、代谢过程和结合等方面, 涉及免疫和代谢等重要功能。COG功能注释结果表明, DEGs富集数量较多的功能有信号转导机制、翻译后修饰、蛋白质转换和分子伴侣、碳水化合物运输与代谢, 主要涉及免疫、防御和代谢等方面。KEGG富集分析显示, DEGs富集程度最显著的通路为真核生物核糖体生物合成、醚脂代谢、AGE-RAGE信号通路和谷胱甘肽代谢通路等, 其中与解毒和免疫相关的通路有谷胱甘肽代谢、溶酶体、吞噬体和ABC转运蛋白等。通过对各个数据库注释结果进行综合分析, 筛选出注释到的典型DEGs主要有HSPA5、SULF、CaM、ABC transporter、GST、PRDX6、γ-GT、GSH和RRM1等, 其中GST、PRDX6、γ-GT、GSH和RRM1等基因均与谷胱甘肽代谢通路有关。
3.2 单环刺螠对Cr(Ⅵ)暴露的免疫与代谢响应HSP(Heatshockprotein, HSP)70是生物体内含量最丰富的热休克蛋白家族, 其亦是伴侣蛋白, 在应激反应中调节受损蛋白质的聚集、折叠和降解。陈晔等[12]发现Cd能够显著诱导褐菖鲉(Sebastiscus marmoratus)体内的HSP70基因的表达。本研究中观察到了类似结果, 单环刺螠体腔细胞HSPA5在Cr(Ⅵ)暴露后显著上调。HSPA5是HSP70家族的一员, 通过内质网应激途径代偿性高表达, 促进未折叠或错误折叠蛋白在内质网中的恢复, 从而维持内质网稳态并保护肠上皮细胞[13-14]。硫酸酯酶(sulfatase, SULF)家族是一类催化剂, 能够催化硫代葡萄糖苷等底物与硫代乙基结合, 生成相应的硫代产物[15]。其中, 类固醇硫酸酯酶是作为一种抗原, 在机体中能激发特异性免疫应答, 并与免疫应答产生的抗体和致敏淋巴细胞发生特异性反应以引起免疫效应[16]。本研究推测Cr(Ⅵ)的高价正电荷能与巯基结合形成配位键, 阻碍SULF与底物进行结合, 从而抑制SULF活性。
钙调蛋白(calmodulin, CaM)是一类重要的胞内蛋白质, 在维持细胞内Ca2+平衡和调节许多生物过程中起着关键作用[17]。CaM能通过与靶蛋白的结合来调节靶蛋白的活性, 一旦CaM与靶蛋白结合后可引起细胞增殖、迁移和凋亡等反应。CaM可以与Pb、Cd等重金属结合, 从而减少其在体内的吸收和转运, 这种络合作用可以降低重金属对机体组织的损伤[18-19]。CaM基因的表达还能激活酶系统, 可促进重金属的解毒代谢[20]。本研究推测Cr(Ⅵ)进入单环刺螠细胞后会干扰正常的Ca2+平衡, CaM能够感知该变化并通过特定途径传递给谷胱甘肽巯基转移酶(gutathione S-transferase, GST)系统, 激活GST家族成员, 从而促使其对Cr(Ⅵ)引起的氧化损伤进行清除和修复。ABC转运蛋白是一类跨细胞膜的蛋白家族, 在维持细胞内外环境平衡以及药物、毒素等物质的代谢中发挥重要作用。由于ABC转运蛋白含有一种关键的结构域, 被称为“金属结合域”, 能与多种金属结合(包括Cu、Zn、Fe等), 然而某些重金属(如Hg、Cd、Pb、Cr等)也可以与ABC转运蛋白结合, 造成ABC转运蛋白结构和功能的损害[21]。Guo等[22]报道重金属离子能阻碍ABC转运蛋白与底物的结合、干扰ATP的结合并抑制能量传递, 此过程可能会导致重金属在细胞内的积累并对细胞产生毒性影响。此外, ABC transporter基因表达水平显著影响细胞的耐药性[23], 该特性在癌症治疗中得到广泛应用。本研究中, 在Cr(Ⅵ)暴露后, ABC transporter基因的转录水平显著下调, 表明Cr(Ⅵ)能干扰单环刺螠的转运系统, 导致Cr(Ⅵ)在机体积累, 并诱导产生大量活性氧(ROS), 破坏细胞的抗氧化系统, 从而造成细胞凋亡或癌变。
3.3 Cr(Ⅵ)暴露对单环刺螠谷胱甘肽代谢通路的影响GSH是一种重要的抗氧化剂, 在维持细胞和组织的氧化还原平衡、调控氧化还原信号通路、解毒外源物质、抗氧化防御及信号转导等方面起重要作用。在生物体内, GSH的生物合成和代谢受到谷胱甘肽代谢通路的调控。该通路涉及谷胱甘肽还原酶(gluathione reductase, GR)、谷胱甘肽过氧化物酶(gutathione peroxidase, GPx)和GST等关键酶[24]。重金属暴露会引发机体产生大量自由基, 细胞内的GSH在GST催化下, 与胞外产生的自由基、有机氢过氧化物(x)结合生成GSH-S-复合物, 经过一系列反应产生N-乙酰-Cys-(x)后被运输到体外。GSH在清除自由基和过氧化物的同时, 2分子的GSH在GPx作用下转变为GSSG。GSSG在被NADPH还原为GSH过程中需要GR的参与, 同时NADPH转化为NADP+, 整个反应过程被称为r-谷氨酰循环。在GSH上调过程中, Cr(Ⅵ)的暴露同样显著诱导GST基因的表达, 进而刺激免疫细胞的增殖和活化, 促进对Cr(Ⅵ)的清除。因此, GSH上调可能有助于机体减轻氧化应激、增强清除自由基和抗氧化的能力。当重金属引起的氧化应激水平超过细胞的自我修复能力, 则会导致GSH代谢紊乱。GSH代谢紊乱会导致神经性疾病、囊状纤维症及肝脏疾病等[25]。EROGLU等[26]报道重金属暴露对不同物种的GSH mRNA水平的影响存在差异性。Cr(Ⅵ)能够通过特异性阴离子通道进入细胞中发挥毒性作用, 随后被抗坏血酸和GSH还原为Cr(Ⅴ), 最终在其他还原剂的作用下转化为Cr(Ⅲ), 在此过程中, GSH的还原会产生H2O2和其他自由基, 引发高水平的氧化应激反应[27]。已有研究表明, 血清中的γ-GT活性的升高是氧化应激早期敏感标志物[28]。其主要作用是代谢细胞外的GSH, 从而使前体氨基酸被重新用于细胞内的GSH合成。Kim等[29]证实了重金属Pb、Hg和Cd能够引起人体血清γ-GT活性的上升。但在本研究中γ-GT转录水平显著下调, 可能是Cr(Ⅵ)能够抑制特定的信号通路从而抑制γ-GT的表达, 或者Cr(Ⅵ)与DNA结合形成Cr-DNA复合物, 阻碍了RNA聚合酶在γ-GT基因上进行正常转录过程。PRDX6是过氧化物酶家族的一员, 可保护细胞免受氧化应激损伤。Darren等[30]认为线粒体是Cd诱导氧化应激的靶结构, 而PRDX能防止线粒体发生氧化。目前的研究仅表明Cr(Ⅵ)能扰乱线粒体动力学平衡诱导细胞的凋亡和自噬, 尚不能确定线粒体是Cr(Ⅵ)诱导氧化应激的靶结构[31]。本研究结果显示Cr(Ⅵ)能够抑制PRDX6的表达, 但具体机制尚需要进一步研究。RRM1在细胞周期S期的DNA复制及多个DNA修复过程中起重要作用[32]。Cr(Ⅵ)引发的高水平氧化应激对细胞内脂质、蛋白质和DNA等生物大分子造成了损伤, 而在这一过程中, 上调RRM1基因表达起到了修复DNA损伤的关键作用。
总体而言, 单环刺螠GSH代谢通路在Cr(Ⅵ)暴露后发生显著变化, 可能是Cr(Ⅵ)诱导GSH代谢功能提高从而促进了机体对Cr(Ⅵ)的代谢, 以实现解毒和维持机体内环境稳定。在人体研究中也发现类似Cr(Ⅵ)诱导的情况, 如在Cr(Ⅵ)胁迫下人体红细胞和淋巴细胞中的GSH水平增加[33-34]; 生活在含Cr较高地区的人群血清中GPx活性升高[35]。目前关于重金属暴露对该通路的影响研究仍较少, 推测不同物种对Cr(Ⅵ)的GSH代谢通路响应可能涉及多种分子机制。由于基因数据库中单环刺螠基因信息有限, 本实验转录组测序结果中有超过半数的unigene未能得到注释, 需要今后结合基因组学、蛋白组学及代谢组学等多种研究手段, 进一步阐明Cr(Ⅵ)的毒性效应以及机体对Cr(Ⅵ)解毒代谢的分子机制。
4 结论通过分析Cr(Ⅵ)暴露前后单环刺螠体腔细胞的转录组差异, 发现Cr(Ⅵ)暴露后, 单环刺螠体腔细胞DEGs主要涉及信号转导、代谢和防御等功能, 真核生物核糖体生物合成、醚脂代谢、高级糖基化终末产物-受体(AGE-RAGE)信号通路和谷胱甘肽代谢通路显著响应, 其中谷胱甘肽代谢可能在Cr(Ⅵ)暴露的解毒与代谢过程中起到重要作用。Cr(Ⅵ)暴露可抑制PRDX6、ABC transporter、SULF、γ-GT等基因的表达, 促进HSPA5、GSH、CaM、GST、RRM1等基因表达, 推测这些基因可能与单环刺螠对Cr(Ⅵ)的解毒功能有关。本实验结果为解析单环刺螠对Cr(Ⅵ)暴露响应的分子机制提供了基础资料。
| [1] |
ZHU S F, SHU H X. The effects of heavy metals on human metabolism[J]. Toxicology Mechanisms & Methods, 2020, 30(3): 167-176. |
| [2] |
ZAYNAB M, AL-YAHYAI R, AMEEN A, et al. Health and environmental effects of heavy metals[J]. Journal of King Saud University-Science, 2022, 34(1): 101653. DOI:10.1016/j.jksus.2021.101653 |
| [3] |
朱瑞瑞, 李宁宁, 贾光, 等. 六价铬致肺癌作用机制研究进展[J]. 中国公共卫生, 2023, 39(2): 181-185. ZHU Ruirui, LI Ningning, JIA Guang, et al. Progress in researches on pulmonary carcinogenicity of hexavalent chromium and its mechanism: a review[J]. Chinese Journal of Public Health, 2023, 39(2): 181-185. |
| [4] |
PAITHANKAR J G, SAINI S, DWIVEDI S, et al. Heavy metal associated health hazards: An interplay of oxidative stress and signal transduction[J]. Chemosphere, 2021, 262: 128350. DOI:10.1016/j.chemosphere.2020.128350 |
| [5] |
BALALI-MOOD M, NASERI K, TAHERGORABI Z, et al. Toxic mechanisms of five heavy metals: mercury, lead, chromium, cadmium, and arsenic[J]. Frontiers in Pharmacology, 2021, 12: 227. |
| [6] |
BOUDOU A, RIBEYRE F. Fish as 'biological model' for experimental studies in ecotoxicology[J]. Aquatic Ecotoxicology Fundamental Concepts & Methodologies, 2018, 8: 127-150. |
| [7] |
刘海梅, 王苗苗, 赵芹. 单环刺螠体壁肌酶解产物的营养评价及溶解性分析[J]. 食品与机械, 2016, 32(5): 20-23. LIU Haimei, WANG Miaomiao, ZHAO Qin. Nutrition evaluation and solubility analysis of hydrolysate from Urechis unicinctus body wall muscle[J]. Food & Machinery, 2016, 32(5): 20-23. |
| [8] |
许星鸿, 姚海洋, 孟霄, 等. 连云港附近海域海水、表层沉积物和水产品的重金属污染及生态风险评价[J]. 海洋湖沼通报, 2019(5): 110-116. XU Xinghong, YAO Haiyang, MENG Xiao, et al. Evaluation on heavy metals pollution and potential ecological risk in seawater, surface sediment and marine organisms in Lianyungang Sea areas[J]. Transactions of Oceanology and Limnology, 2019(5): 110-116. |
| [9] |
ZHU L, WANG S J, CAO S Y, et al. Biochemical and cytological evaluation of the coelomic fluid of Urechis unicinctus: Its responses under pathogenic exposure and potential phagocytic activities[J]. Aquaculture, 2023, 577(15): 739985. |
| [10] |
许星鸿, 刘统昊, 朱晓莹, 等. 铅、镉、铬和锌盐对单环刺螠急性毒性效应的研究[J]. 水产科学, 2022, 41(6): 1029-1035. XU Xinghong, LIU Tonghao, ZHU Xiaoying, et al. Acute toxicity of Pb, Cd, Cr, and Zn heavy metal salts to echiuran worm Urechis unicinctus[J]. Fisheries science, 2022, 41(6): 1029-1035. |
| [11] |
KE P, WANG W X. Trace metal contamination in estuarine and coastal environments in China[J]. Science of the Total Environment, 2012, 421/422: 3-16. |
| [12] |
陈晔, 陈荣, 莫正平. 重金属Cd、Pb对褐菖鲉肝脏组织中HSPs基因表达的影响[J]. 生态毒理学报, 2016, 11(3): 124-130. CHEN Ye, CHEN Rong, MO Zhengping. The Effects of Cd and Pb on the levels of hepatic HSPs mRNA in Sebastiscus marmoratus[J]. Asian Journal of Ecotoxicology, 2016, 11(3): 124-130. |
| [13] |
高菲, 范恒. 热休克蛋白5与炎症性肠病研究进展[J]. 世界华人消化杂志, 2020, 28(16): 802-806. GAO Fei, FAN Heng. Heat shock protein 5 and inflammatory bowel disease[J]. World Chinese Journal of Digestology, 2020, 28(16): 802-806. |
| [14] |
YANG H, WANG Z, WANG J, et al. Cadmium-induced oxidative stress and transcriptome changes in the wolf spider Pirata subpiraticus[J]. Science of the Total Environment, 2021, 785: 147364. |
| [15] |
STAM M, LELIEVRE P, HOEBEKE M, et al. SulfAtlas, the sulfatase database: state of the art and new developments[J]. Nucleic Acids Research, 2023, 51(D1): D647-D653. |
| [16] |
BARATHI B, SELCER W K. The Phytochemical curcumin inhibits steroid sulfatase activity in rat liver tissue and NIH-3T3 mouse fibroblast cells[J]. Steroids, 2022, 191: 109163. |
| [17] |
PERSECHINI A, MONCRIEF N D, KRETSINGER R H. The EF-hand family of calcium-modulated proteins[J]. Trends in Neurosciences, 1989, 12(11): 462-467. |
| [18] |
FLORA S J, PACHAURI V. Chelation in metal intoxication[J]. Biological Trace Element Research, 2010, 7(7): 2745-2788. |
| [19] |
SUZUKI Y, CHAO S H, ZYSK J R, et al. Stimulation of calmodulin by cadmium ion[J]. Archives of Toxicology, 1985, 57: 205-211. |
| [20] |
VILLALOBO A, BERCHTOLD M W. The role of calmodulin in tumor cell migration, invasiveness, and metastasis[J]. International Journal of Molecular Sciences, 2020, 21(3): 765. |
| [21] |
HU J, TIAN J, ZHANG F, et al. Pxr-and Nrf2-mediated induction of ABC transporters by heavy metal ions in zebrafish embryos[J]. Environmental Pollution, 2019, 255(2): 113329. |
| [22] |
GUO Z, YUAN X, LI L, et al. Genome-wide analysis of the ATP-binding cassette (ABC) transporter family in Zea mays L. and its response to heavy metal stresses[J]. International Journal of Molecular Sciences, 2022, 23(4): 2109. |
| [23] |
WANG J, LI X, WANG F F, et al. Placing steroid hormones within the human ABCC3 transporter reveals a compatible amphiphilic substrate‐binding pocket[J]. The Embo Journal, 2023, 42(17): e113415. |
| [24] |
HOSSEN S, HANIF M A, KHO K H. Glutathione reductase, a biomarker of pollutant and stress in Pacific abalone[J]. Marine Pollution Bulletin, 2023, 192: 115139. |
| [25] |
MARTA K K, SURA P, MARIA W. Multidirectional changes in parameters related to sulfur metabolism in frog tissues exposed to heavy metal-related stress[J]. Biomolecules, 2020, 10(4): 574. |
| [26] |
EROGLU A, DOGAN Z, KANAK E G, et al. Effects of heavy metals (Cd, Cu, Cr, Pb, Zn) on fish glutathione metabolism[J]. Environmental Science & Pollution Research, 2015, 22(5): 3229-3237. |
| [27] |
DAS D, MONIRUZZAMAN M, SARBAJNA A, et al. Effect of heavy metals on tissue-specific antioxidant response in Indian major carps[J]. Environmental Science & Pollution Research, 2017, 24: 18010-18024. |
| [28] |
EMDIN M, POMPELL A, PAOLICCHI A. Gamma-glutamyltransferase, atherosclerosis, and cardiovascular disease: triggering oxidative stress within the plaque[J]. Circulation, 2005, 112(14): 2078-2080. |
| [29] |
KIM S J, HAN S W, LEE D J, et al. Higher serum heavy metal may be related with higher serum gamma-glutamyltransferase concentration in Koreans: analysis of the fifth korea national health and nutrition examination survey (KNHANES V-1, 2, 2010, 2011)[J]. Korean Journal of Family Medicine, 2014, 35(2): 74. |
| [30] |
DARREN G, CHRIS M G. Antioxidant activity of the yeast mitochondrial one-cys peroxiredoxin is dependent on thioredoxin reductase and glutathione in vivo[J]. Molecular and Cellular Biology, 2009, 29(11): 3229-3240. |
| [31] |
ZHENG X, LI S, LI J, et al. Hexavalent chromium induces renal apoptosis and autophagy via disordering the balance of mitochondrial dynamics in rats[J]. Ecotoxicology and Environmental Safety, 2020, 204: 111061. |
| [32] |
WEN D, HUANG Z, LI Z, et al. LINC02535 co‐functions with PCBP2 to regulate DNA damage repair in cervical cancer by stabilizing RRM1 mRNA[J]. Journal of Cellular Physiology, 2020, 235(10): 7592-7603. |
| [33] |
HUSAIN N, MAHMOOD R. Hexavalent chromium induces reactive oxygen species and impairs the antioxidant power of human erythrocytes and lymphocytes: Decreased metal reducing and free radical quenching ability of the cells[J]. Toxicology & Industrial Health, 2017, 33(8): 623-635. |
| [34] |
ADEOYE O, OLAWUMI J, ADELEKE O, et al. Review on the role of glutathione on oxidative stress and infertility[J]. Journal of Assisted Reproduction & Genetics, 2018, 22(1): 61-66. |
| [35] |
XU J, ZHAO M, PEI L, et al. Oxidative stress and DNA damage in a long-term hexavalent chromium-exposed population in North China: A cross-sectional study[J]. BMJ Open, 2018, 8(6): e021470. |
 2024, Vol. 48
2024, Vol. 48


