
中国科学院海洋研究所主办。
文章信息
- 于仁成, 罗璇. 2016.
- YU Ren-Cheng, LUO Xuan. 2016.
- 我国近海有毒藻和藻毒素的研究现状与展望
- Status and Research Perspectives on Toxic Algae and Phycotoxins in the Coastal Waters of China
- 海洋科学集刊, 51: 155-166
- Studia Marina Sinica, 51: 155-166.
- http://dx.doi.org/10.12036/hykxjk201607126001
-
文章历史
- 收稿日期:2016-07-30
- 收修改稿日期:2016-07-04
2. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室, 青岛 266071;
3. 中国科学院海洋研究所 文献信息中心, 青岛 266071
2. Laboratory of Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China;
3. Literature Information Center, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China
近40年来, 全球有害藻华的发生频率和规模明显增加, 对人类健康、渔业资源和海洋生态系统构成了严重威胁(Anderson et al., 2012)。有害藻华是海洋中部分有毒、有害藻类通过增殖或聚集造成的藻类生物量短期内迅速增加的现象, 会导致养殖动物死亡、海产品污染、景观破坏和生态系统受损等危害效应。有害藻华的肇事种大致可以分为两类, 一类是可以产生毒素的有毒藻; 另一类可以形成很高的生物量, 通过改变水体理化环境造成各类危害效应(Glibert and Pitcher, 2001)。
有毒藻类产生的藻毒素结构复杂, 种类繁多, 一些藻毒素可以在滤食性贝类或植食性鱼类体内积累, 人类食用后会中毒甚至死亡, 因而备受关注。常见的藻毒素包括麻痹性贝毒毒素(paralytic shellfish toxins, PSTs)、腹泻性贝毒毒素(diarrhetic shellfish toxins, DSTs)、记忆缺失性贝毒毒素(amnesic shellfish toxins, ASTs)、神经性贝毒毒素(neurotoxic shellfish toxins, NST)和西加鱼毒素(ciguatoxins, CTXs)等(FAO, 2004)。近年来, 还发现了环亚胺类毒素(cyclic imines)和氮杂螺环酸类毒素(azaspiracid)等一些新的毒素成分。除上述毒素外, 一些鞭毛藻类, 如甲藻类中的米氏凯伦藻(Karenia mikimotoi)、定鞭藻类中的球形棕囊藻(Phaeocystis globosa)、针胞藻类中的卡盾藻(Chattonella spp.)和赤潮异弯藻(Heterosigma akashiwo)等, 也能产生高生物活性的毒素, 对鱼、贝类造成危害。但这些毒素成分通常不会对人类健康造成显著威胁, 因此本文综述时未将这些毒素考虑在内。
在我国, 随着人类活动对海洋影响的不断加剧, 近海富营养化问题日益突出, 有害藻华问题也更为严峻。对于我国近海的有害藻华问题, 许多学者已进行过系统的总结和讨论(周名江等, 2001; 齐雨藻, 2003; 邹景忠, 2004)。但是, 自2000年以来, 我国近海有害藻华的情况发生了显著变化, 大规模有害藻华问题不断出现, 由东海原甲藻(Prorocentrum donghaiense)、米氏凯伦藻等甲藻形成的大规模赤潮在长江口邻近海域连年暴发, 对海域生态系统、海水养殖业发展和人类健康造成显著影响(周名江和朱明远, 2006)。2007年以来, 由浒苔(Ulva prolifera)形成的大规模绿潮每年夏季都在南黄海暴发, 对山东省和江苏省沿海海域的水产养殖业及旅游业构成严重威胁。更为严峻的是, 伴随着有害藻华规模的不断扩大, 藻华肇事种也出现了明显变化, 由甲藻等有毒有害藻类形成的有害藻华越来越多, 有可能进一步加剧我国近海藻毒素污染问题。因此, 有必要针对我国近海有毒藻和藻毒素的状况进行总结和分析, 本文对此进行了综述。
1 中国近海海域的麻痹性贝毒与产毒藻麻痹性贝毒毒素是一类具四氢嘌呤环结构的化合物[图 1(a)], 包括石房蛤毒素(saxitoxin, STX)及衍生物, 目前已确认化学结构的麻痹性贝毒毒素至少有57种(Wiese et al., 2010)。麻痹性贝毒毒素能够与电压门控钠离子通道结合, 抑制通道的通透性, 阻断神经冲动, 产生肢端麻木、嘴唇和皮肤刺痛、共济失调及发烧等症状, 严重时会导致肌肉麻痹、呼吸受阻, 甚至引发死亡。在海洋环境中, 麻痹性贝毒毒素主要由亚历山大藻属(Alexandrium)中的部分有毒藻种, 以及链状裸甲藻(Gymnodinium catenatum)和Pyrodinium behamense var. compressum等产生。
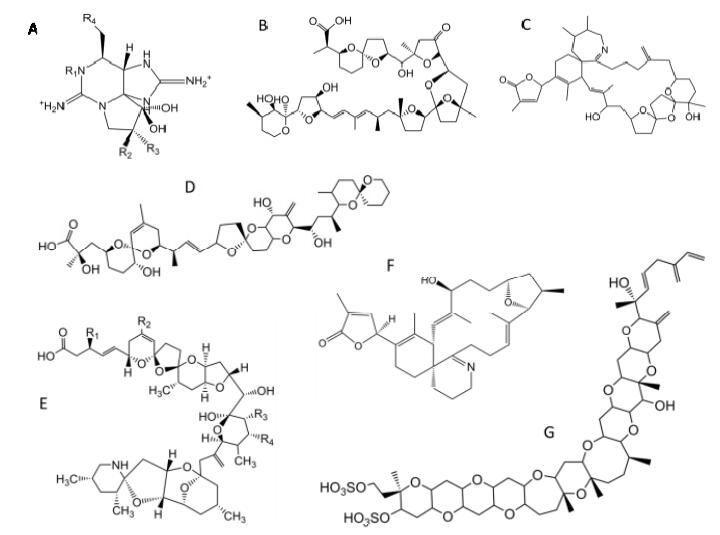
|
| 图 1 几类常见藻毒素的基本化学结构 Fig. 1 The basic chemical structure of some species of common phycotoxins (a)麻痹性贝毒毒素; (b)大田软海绵酸和鳍藻毒素; (c)SPX类毒素; (d)PTX类毒素; (e)AZA类毒素; (f)GYM类毒素; (g)YTX类毒素 |
在我国沿海地区, 许多食用海产品导致的中毒事件被怀疑与麻痹性贝毒有关。但是, 对于麻痹性贝毒和其他藻毒素造成的中毒事件并未进行过系统的梳理和总结。这一方面是由于资料所限, 难以获得食用海产品中毒事件的完整信息; 另一方面, 也无法完全确定这些中毒事件是否由麻痹性贝毒等藻毒素引起。表 1总结了部分藻毒素引起的中毒事件, 可以看出, 很多事件中未能确定贝类样品中的毒素成分, 对于导致中毒事件的有毒藻种更是缺乏准确的认识。需要特别指出的是, 在以往的统计中, 曾记录过许多因食用织纹螺导致的中毒事件, 因其中毒症状与麻痹性贝毒的中毒症状非常相似, 这些事件曾被怀疑与麻痹性贝毒毒素有关。但近年来的研究表明, 在我国沿海地区的织纹螺中, 河豚毒素及其衍生物是最为常见的毒素成分, 即使存在麻痹性贝毒, 其含量也非常低, 不是主要的毒素成分(罗璇, 2011; 胡颢琰等, 2008)。由于河豚毒素和麻痹性贝毒的致毒机理均为阻断钠离子通道, 两者引起的中毒症状难以区分, 需要依赖化学分析手段才能区分和确认。
| 时间 | 地点 | 中毒人数 | 中毒类型 | 染毒贝类 | 原因种 | 参考文献 |
| 1986年 | 福建省东山镇 | 136人中毒, 其中1人死亡 | 麻痹性贝毒中毒 | 菲律宾蛤仔 (Ruditapes phillippinarum) |
裸甲藻(?) | 林燕棠等, 1999 |
| 1993年3月 | 南海大亚湾附近 | 4人中毒, 其中2人死亡 | 麻痹性贝毒中毒 | 未定 | 未定 | 林燕棠等, 1999 |
| 1999年6月 | 莱州 | 58人中毒 | 麻痹性贝毒中毒 | 海蛤和竹蛏 | 未定 | 张正波和吴福金, 2000 |
| 2008年8月 | 连云港市赣榆县 | 6人中毒, 1人死亡 | 麻痹性贝毒中毒 | 菲律宾蛤仔 | A. minutum | 于仁成等, 未发表资料 |
| 2016 | 秦皇岛 | 麻痹性贝毒中毒 | 贻贝 | 未定 | 媒体报道 | |
| 2011年5月 | 浙江宁波/福建福鼎 | > 100 | 腹泻性贝毒中毒 | 贻贝 | Dinophysis caudata |
在我国沿海, 贝类中麻痹性贝毒毒素的沾染问题并不鲜见(Zhou et al., 1999; 林燕棠等, 1999), 通过小鼠生物测试法和高效液相色谱法, 对我国沿海地区贝类样品进行分析, 经常能够检测到麻痹性贝毒毒素(图 2)。但是, 贝类样品的毒性通常较低, 不会对海产品食品安全造成显著影响。广东沿海、福建沿海、长江口邻近海域、海州湾、北黄海和渤海秦皇岛近岸海域贝类样品的麻痹性贝毒毒性相对较高, 存在一定程度的海产品食品安全风险。在不同贝类中, 麻痹性贝毒毒性水平或毒素含量也有明显差异。在南海近岸海域, 扇贝、贻贝和蛤仔染毒几率相对较高(林燕棠等, 1994; 江天久等, 2003; 吴施卫等, 2008); 在福建沿海, 扇贝沾染麻痹性贝毒毒性的概率很大(王雪虹和宋振荣, 2006; 王雪虹和黄世玉, 2007); 在长江口邻近海域, 毛蚶和贻贝容易沾染麻痹性贝毒毒素(胡颢琰等, 2008); 在海州湾区域, 菲律宾蛤仔和毛蚶中都曾检测到较高含量的麻痹性贝毒毒素(Yu et al., 1998; 于仁成, 未发表资料); 在北黄海海域, 扇贝最容易沾染麻痹性贝毒毒素(江天久和江涛, 2007; 夏远征等, 2010; 孔凡洲等, 2007); 在渤海秦皇岛近岸海域, 贻贝和毛蚶等样品中可以检测到较高含量的麻痹性贝毒毒素。在不同地区采集的贝类样品毒性峰值也有明显差异。研究发现, 南海大亚湾海域贝类样品毒性峰值通常出现在冬季和早春(2~3月), 与海水中有毒亚历山大藻细胞丰度和孢囊沉降通量的峰值出现时间基本一致(江天久等, 2000a, 2000b); 在东海海域, 贝类的毒性峰值通常出现在春、夏交替的季节(5~6月); 在北黄海海域, 贝类毒性通常存在春、秋两个毒性峰值, 秋季(8~9月)贝类的毒性水平往往较高; 在渤海秦皇岛近岸海域, 春季(3~5月)贝类中的毒素含量往往最高。由于贝类对毒素的选择性排出和代谢转化, 不同贝类中毒素组成状况差异很大。在最容易沾染藻毒素的扇贝中, 累积的麻痹性贝毒毒素多以N-磺酰氨甲酰基类毒素C1、C2为主, 此外还有一定含量的氨甲酰基类毒素(主要为GTX类毒素和STX类毒素), 这与我国近海有毒亚历山大藻的产毒状况基本吻合, 表明有毒亚历山大藻可能是我国近海麻痹性贝毒毒素的主要来源。

|
| 图 2 我国沿海采集贝类样品中麻痹性贝毒检出情况 Fig. 2 Detection results of PSP toxins in shellfish samples collected from the coastal areas of China 以小鼠法测试贝类样品结果呈阳性;以化学分析方法检测贝类样品检出麻痹性贝毒毒素 |
到目前为止, 我国近海已经发现多种亚历山大藻(Gu et al., 2013c), 也多次记录到由亚历山大藻形成的赤潮现象(表 2)。在这些藻种中, 已经确认能够产生麻痹性贝毒毒素的有塔玛亚历山大藻(A. tamarense)、链状亚历山大藻(A. catenella)、微小亚历山大藻(A. minutum)和A. ostenfeldii 4种, 其中塔玛亚历山大藻/链状亚历山大藻属于塔玛亚历山大藻复合种, 是分布最为广泛、研究也最为透彻的麻痹性贝毒产毒藻。除以上两个藻种外, 塔玛亚历山大藻复合种还包括常见于北美的Alexandrium fundyense。这3种有毒藻可以通过微弱的形态学差异进行区分。在我国近海, 吕颂辉和齐雨藻(1992)最早报道了南海的塔玛亚历山大藻和链状亚历山大藻, 之后齐雨藻和钱锋(1994)进一步描述了两种藻的形态特征。近年来的研究发现, 仅以形态学特征对塔玛亚历山大藻复合种进行区分非常困难, 而通过核糖体RNA(rRNA)基因序列可以将塔玛亚历山大藻复合种分成5个不同的核糖体型, 它们不仅与藻类地理分布状况有关, 也与藻类产毒特征直接关联。因此, 有专家建议将塔玛亚历山大藻复合种的5个核糖体型作为独立的藻种(John et al., 2014; Wang et al., 2014)。在我国近海, 已建立的塔玛亚历山大藻复合种培养系有Ⅳ型核糖体型(陈月琴等, 1999; 唐祥海等, 2006; Wang et al., 2008)和I型核糖体型(Gu et al., 2013c)两种, 这两个核糖体型目前分别被定名为A. pacificum和A. fundyense。针对以上两个藻种, 可以通过分子生物学方法, 如荧光原位杂交和qPCR等进行鉴定和计数(于仁成等, 2006; 高岩等, 2013)。应用qPCR方法对渤、黄海两种藻类的分析结果表明, 两种微藻能够形成相对独立的种群, 其中A. fundyense主要分布在渤海和黄海34°N以北海域, 而A. pacificum则主要分布在34°N以南海区(Gao et al., 2015a)。通过对比5月藻华高发期间有毒藻、产毒基因和藻毒素的分布状况可以看出, 两种有毒藻是春季黄海海域麻痹性贝毒毒素的主要来源(Gao et al., 2015b)。此外, 在我国近海还分离培养到了能够产生毒素的Gymnodinium catenatum (Gu et al., 2015)。
| 时间 | 地点 | 赤潮原因种 | 参考文献 |
| 1994年 | 福建虾塘 | 塔玛亚历山大藻 | 林元烧, 1996 |
| 2001年 | 南海深圳湾 | 亚历山大藻, 未定种 | 江天久等, 2003 |
| 南海大亚湾 | 塔玛亚历山大藻 | Wang et al., 2004, 2011 | |
| 2002年至今(5~6月) | 长江口邻近海域 | 链状亚历山大藻 | 王金辉等, 2006, 2007 |
| 时间不明 | 渤海 | 亚历山大藻, 未定种 | 林风翱等, 2008 |
| 2004年(8~9月) | 大连湾 | 亚历山大藻, 未定种 | 杜如垠, 2004 |
| 2006年(8~9月) | 南隍城岛附近海域 | 塔玛亚历山大藻 | 宋秀凯等, 2009 |
大多数麻痹性贝毒产毒藻具有复杂的生活史, 能够产生休眠孢囊应对不利环境条件。Qi等(1996)通过1991~1993年对广东、福建、浙江沿海等14个河口及海湾表层沉积物的调查, 首次发现亚历山大藻孢囊。王朝晖(2007)也在南海、东海和黄海部分沿海地区表层沉积物中发现了亚历山大藻和链状裸甲藻孢囊。之后的研究发现, 在长江口邻近海域存在高丰度的亚历山大藻孢囊, 可能是该海域亚历山大藻赤潮的种床(王朝晖和齐雨藻, 2003; 顾海峰等, 2004; 王艳和腾琳, 2006; 黄海燕等, 2009)。而在南黄海中心区和北黄海海域, 亚历山大孢囊的丰度也非常高(Cho and Matsuoka, 2001; 石雅君等, 2011; 邵魁双等, 2011), 有可能作为黄海海域亚历山大藻的种床。链状裸甲藻孢囊在我国沿海的分布非常广泛, 但其丰度通常较低; 另外, 在大鹏湾中曾发现有P. bahamense的孢囊(郑磊等, 1995; 付永虎等, 2011), 在香港海域也曾报道水体中观察到Pyrodinium behamense var. compressum的藻细胞(Dickman et al., 2002)。
随着毒素分析方法的不断发展和完善, 对我国近海有毒藻类产毒特征的认识也在不断深入(表 3)。根据以往的分析结果, 我国近海的塔玛亚历山大藻复合种依照其产毒状况可以大致分成三类, 第一类以低毒性的C1和C2为主, 可占毒素总量的90%以上, 其他毒素偶有检出, 但含量极低(Anderson et al., 1996; Yu et al., 1998; Wang et al., 2008; Wang and Hsieh, 2005)。第二类同样以C1和C2为主, 但膝沟藻毒素GTX1~4所占比例也较高, 因此具有相对较高的毒性(Yu et al., 1998)。第三类则不产生C毒素, 所产毒素主要为GTX1~4 (Gu et al., 2013c)。通过孢囊萌发实验, 在黄海海域分离培养的链状裸甲藻也能够产生麻痹性贝毒毒素, 除常见的C类和GTX类毒素之外, 还能够产生以苯甲酸基团为取代基的脂溶性麻痹性贝毒毒素成分(Gu et al., 2013a)。到目前为止, 对我国近海的P. behamense var. compressum还没有实现室内培养, 对其产毒状况仍不了解。
| 藻种名 | 藻种来源 | 毒素成分 | 毒素含量(fmol/cell) | 参考文献 |
| Alexandrium tamarense | 大亚湾 | C1/2, GTX1/4, GTX2/3, GTX5(B1), dcGTX3, NEO | 7.2~12.7 | Anderson et al., 1996 |
| Alexandrium tamarense | 香港海域 | C1/2, GTX1/4, GTX2/3, GTX5(B1), GTX6(B2), NEO, STX | 19.7 | Yu et al., 1998 |
| Alexandrium tamarense | 大亚湾 | C1/2, GTX2/3, GTX5(B1), GTX6(B2) | 3.2 | Yu et al., 1998 |
| Alexandrium tamarense | 香港海域 | C1/C2, C3/C4, GTX1/4, GTX5(B1) | 97 | Wang and Hsieh, 2005 |
| Alexandrium tamarense | 南海/东海 | C1/C2, GTX1/4, GTX3, GTX5(B1), NEO | 11.9~64 | Wang et al., 2006 |
| Alexandrium tamarense species complex (Ⅰ)** | 渤海/黄海 | C1/C2, GTX2/3, GTX5, | 1~5 | Gu et al., 2013c |
| Alexandrium tamarense species complex (Ⅰ)** | 黄海 | GTX1/4, GTX2/3 | / | Gu et al., 2013 |
| Alexandrium tamarense species complex (Ⅰ & Ⅳ)** | 中国近海 | C1/2, GTX1/4, GTX2/3, dcGTX2/3, NEO, STX | 0.02~31.33 | Zou et al., 2015 |
| Alexandrium minutum | 黄海 | GTX1/4, GTX2/3 | / | 于仁成, 未发表资料 |
| Alexandrium minutum | 台湾 | GTX1/4, GTX2/3 | 12 | Wang et al., 2006, |
| Alexandrium ostenfeldii | 渤海 | NEO, STX | 1~5 | Gu et al., 2013b |
| Gymnodinium catenatum | 黄海 | C1/2, C3/4, GTX2/3, GTX6(B2), dcGTX2/3, STX, dcSTX, GCs-GTX, GCs-sulfo, GCs-STX | / | Gu et al., 2013a |
| *根据藻种形态命名, 修订后应命名为Alexandrium pacificum; **包括Alexandrium fundyense和Alexandrum pacificum两种; /表明低于检出限 | ||||
我国沿海贝类沾染腹泻性贝毒的问题也比较常见(图 3)。但是, 这些认识大多是基于小鼠生物测试法对贝类样品的分析结果, 因此对贝类中的毒素成分仍缺乏科学的认识。另外, 小鼠法得到的结果往往存在假阳性问题。欧盟从2011年起, 已不再通过小鼠法对腹泻性贝毒进行测试, 而是采用更加先进、准确的液-质联用方法作为标准方法。随着液-质联用技术在我国的普遍使用和毒素分析方法的快速发展, 对于我国沿海贝类中腹泻性贝毒毒素的认识也在不断深入。

|
| 图 3 我国沿海采集贝类样品中腹泻性贝毒测试结果及各类脂溶性藻毒素的检出情况 Fig. 3 Results of DSP mouse bioassay and detection of lipophilic phycotoxins in shellfish samples collected along the coast of China 小鼠法测试腹泻型贝毒结果与化学分析法检测结果, 具体如图例说明 |
贝类中的腹泻性贝毒毒素成分通常是指大田软海绵酸(okadaic acid, OA)和鳍藻毒素(dinophysis toxins, DTXs), 主要由鳍藻属(Dinophysis)和原甲藻属(Prorocentrum)中的有毒藻种产生。除OA和DTXs之外, 扇贝毒素(pectenotoxins, PTXs)和虾夷扇贝毒素(yessotoxins, YTXs)也曾被作为DSP毒素中的主要成分。但是, 由于以上3类毒素化学结构和毒性作用机理迥异, 现在更倾向于将其作为独立的毒素进行研究。考虑到OA、DTXs和PTXs都是由鳍藻产生的, 在本节中仍将它们放在一起讨论。各类毒素的基本化学结构如图 1(b)、1(d)所示。
鳍藻广泛分布于我国近海。从渤海到南海, 鳍藻的物种多样性明显增加, 在南海已记录了超过10种鳍藻(林永水和周近明, 1993)。在我国近海的鳍藻中, 有可能产生腹泻性贝毒毒素的藻种包括渐尖鳍藻(Dinophysis acuminata)、倒卵形鳍藻(D. fortii)、具尾鳍藻(D. caudata)和圆形鳍藻(D. rotundata)等。通常情况下, 鳍藻属藻种在浮游植物群落中不会占据绝对优势, 但能够和其他藻种共同形成赤潮。1991年8月, 在大连发生过一次中肋骨条藻(Skeletonema costatum)和倒卵形鳍藻、叉状角藻共同形成的赤潮, 导致网箱养殖的贻贝和扇贝大量死亡。1998年, 渤海发生叉状角藻(Ceratium furca)和倒卵形鳍藻共同形成的赤潮, 赤潮消退后从贝类体内检测到了OA毒素。在东海的长江口及其邻近海域, 从春季的大规模甲藻赤潮中也常常同时发现渐尖鳍藻、具尾鳍藻和倒卵形鳍藻。南海海域也多次观察到由具尾鳍藻和其他甲藻共同形成的赤潮。
由于鳍藻培养困难, 目前对我国近海鳍藻的产毒状况仍知之甚少。已有的研究主要是基于对手工挑取的野外鳍藻细胞的分析结果(表 4)。通过这些方法, 对黄海胶州湾和东海浙江近海的鳍藻进行分析, 检测到OA、DTX1和PTX2等毒素成分。在胶州湾的3种鳍藻中均可以检测到PTX2毒素, 其中倒卵形鳍藻毒素含量最高, 其次是渐尖鳍藻, 圆形鳍藻中毒素含量最低(罗璇, 2011; 罗璇等, 2014)。对胶州湾网采浮游植物样品中的毒素进行分析发现, 浮游植物中PTX2含量在6~8月最高, 与浓缩浮游植物样品中渐尖鳍藻的丰度显著相关, 表明渐尖鳍藻是水体中PTX2的主要生产者, 而OA和DTX1的含量很低, 且没有明显变化规律。2006年8月, 通过固相吸附毒素示踪技术对胶州湾的调查也发现了高含量的PTX2毒素(Li et al., 2010)。Li(2015)等利用液-质联用方法对浙江近海挑取的具尾鳍藻进行了分析, 发现PTX2是主要的毒素成分。
| 藻种名 | 藻种来源 | 毒素成分 | 毒素含量 | 参考文献 |
| Dinophysis acumuminata | 胶州湾 | OA, DTX1, PTX2 | 2.54 pg/cell, 4.04 pg/cell和1.73 pg/cell | 罗璇等, 2014 |
| Dinophysis rotundata | 胶州湾 | PTX2 | Nd~0.3 pg/cell | 罗璇, 2011 |
| Dinophysis fortii | 胶州湾 | PTX2 | 42 pg/cell | 罗璇, 2011 |
| Dinophysis caudata | 东海 | PTX2, 微量OA和DTX1 | 0.58~2.8 pg/cell (PTX2) | Li et al., 2015 |
| Azadinium poporum | 渤海, 东海, 南海 | AZA-2及其他AZA衍生物 | 1.8~23fg/cell | Gu et al., 2013b |
| 注: Nd表示低于检出限 | ||||
除麻痹性贝毒和腹泻性贝毒之外, 记忆缺失性贝毒(ASP)和神经性贝毒(NSP)也是常见的藻毒素。ASP毒素成分是由拟菱形藻属(Pseudo-nitzschia spp.)中的有毒种类产生的软骨藻酸(domoic acid, DA)。拟菱形藻是中国近海常见的赤潮藻种(陈菊芳等, 2002; 高亚辉等, 2003), 在大亚湾等海域曾报道过拟菱形藻赤潮现象。中国近海拟菱形藻有很高的物种多样性(李扬等, 2010), 目前已分离培养了多种拟菱形藻, 但尚未从这些培养的藻种中检测到DA毒素(Li et al., 2005; 邢小丽等, 2007)。NSP毒素包括短裸甲藻毒素(brevetoxins)及其同系物, 主要由短凯伦藻(Karenia brevis)产生。短裸甲藻毒素可以和电压门控钠离子通道结合, 导致通道持续激活, 造成恶心、刺痛、麻木、运动能力丧失等症状。如果吸入了短裸甲藻毒素的气溶胶, 会导致咳嗽和类似哮喘的症状。中国尚未发生过NSP导致的中毒事件。
随着高效液相色谱和质谱技术的快速发展(Gerssen et al., 2010), 在中国沿海地区采集的贝类样品中多次检测到新的毒素成分(图 3)。在2006~2007年的一次贝类样品调查中, 首次从南海缘齿牡蛎(Dendostrea crenulifrea)中检测到GYM(gymnodimine)毒素(刘仁沿等, 2008), 这是由甲藻Karenia selliformis等产生的一种环亚胺类毒素。在同一次调查中, 还从黄海北部海域的贝类样品中检测到了YTXs (yessotoxins)毒素(高春蕾等, 2010), YTXs主要由Protoceratium reticulatum、Lingulodinium polyedrum和Gonyaulax spinifera等甲藻产生, 这些微藻或其孢囊在中国沿海都曾被检测到。运用一种针对AZA(azaspiroacids)及其衍生物建立的LC-MS方法, 姚建华等(2010)从广州和大连的贝类样品中检测到AZA类毒素, 这是由Azadinium属中的有毒甲藻产生的毒素成分。
目前, 从我国近海采集的孢囊中分离培养得到的多株Azadinium poporum藻种中都可以检测到AZA类毒素成分(Gu et al., 2013b) (表 4)。之后的多次调查中, 在我国近海采集的贝类样品中都检测到了上述毒素(Wu et al., 2014; Wang et al., 2016)。这些研究表明, 应尽快将液-质联用等先进的毒素分析技术纳入业务化监测工作。
4 结论与展望从已有研究工作可以看出, 麻痹性贝毒和腹泻性贝毒仍是影响我国近海贝类卫生质量的主要藻毒素, 广东沿海、福建沿海、长江口邻近海域、海州湾、北黄海和渤海秦皇岛近岸海域, 是受藻毒素影响较大的海区。贝类中的麻痹性贝毒主要来自有毒亚历山大藻, 腹泻性贝毒毒素主要来自有毒鳍藻。此外, 在我国近海还检测到YTXs、AZAs、GYMs和SPXs等毒素成分。目前, 有关我国近海记忆缺失性贝毒和神经性贝毒的相关报道很少。为防止有毒藻和藻毒素带来的食品安全问题, 应加强对有毒藻和贝类中藻毒素的监测。
可以看出, 研究技术与手段的发展和完善对我国近海有毒藻和藻毒素研究起到了积极的推动作用。通过qPCR等分子生物学手段和方法, 可以实现对特定有毒藻种的快速鉴定和定量分析, 这在我国近海有毒亚历山大藻研究中已经得到充分验证; 通过孢囊萌发实验获得了大量的有毒藻株, 丰富了对我国近海有毒藻类多样性状况和产毒情况的认识; 通过高效液相色谱和液-质联用等化学分析技术, 进一步深化了对我国近海贝类沾染藻毒素成分的认识。在后续研究中, 应当进一步加强新技术、新方法的应用, 探明我国近海藻毒素组成及其来源, 深入剖析我国近海有毒藻分布、种群动态和长期变化状况, 为维护水产品食品安全、保障海水养殖业持续发展提供支撑。
| 陈菊芳, 徐宁, 王朝晖, 等. 2002. 大亚湾拟菱形藻(Pseudo-nitzschia spp. )种群的季节变化与环境因子的关系.环境科学学报, 22 (6) : 743–748 |
| 陈月琴, 屈良鹄, 曾陇梅, 等. 1999. 南海赤潮有毒甲藻链状-塔玛亚历山大藻的分子鉴定. 海洋学报, 21 (3) : 106–112 |
| 杜佳垠. 2004. 大连黄海沿海海域涡鞭毛藻类有毒有害赤潮生物. 北京水产, 6 : 9–10 |
| 付永虎, 王朝晖, 康伟, 等. 2011. 大亚湾大鹏澳海域表层沉积物中浮游植物休眠体集群的季节变化. 台湾海峡, 30 (1) : 27–35 |
| 高春蕾, 刘仁沿, 梁玉波, 等. 2010. 虾夷扇贝毒素yessotoxins(YTXs), 中国沿海贝类中首次发现的一组贝类生物毒素. 海洋学报, 32 (3) : 129–137 |
| 高亚辉, 虞秋波, 齐雨藻, 等. 2003. 长江口附近海域春季浮游硅藻的种类组成和生态分布. 应用生态学报, 14 (7) : 1044–1048 |
| 高岩, 于仁成, 张清春, 等. 2013. 应用qPCR方法检测中国近海塔玛亚历山大藻复合种的研究. 环境科学学报, 33 (8) : 2256–2263 |
| 顾海峰, 方琦, 李瑞香, 等. 2004. 长江口甲藻孢囊的初步研究. 海洋与湖沼, 35 (5) : 413–423 |
| 胡颢琰, 唐静亮, 黄备, 等. 2008.舟山渔场及其相邻赤潮高发区麻痹性贝类毒素研究, 25(4): 475-481 |
| 黄海燕, 陆斗定, 夏平, 等. 2009. 2006年冬季长江口海域表层沉积物中甲藻孢囊的分类学研究, 29(11): 5902-5911 |
| 江天久, 陈菊芳, 邹迎麟, 等. 2003.中国东海和南海有害赤潮高发区麻痹性贝毒素研究, 14(7): 1156-1160 |
| 江天久, 江涛. 2007. 中国沿海部分海域麻痹性贝毒研究. 海洋与湖沼, 38 (1) : 36–41 |
| 江天久, 尹伊伟, 骆育敏, 等. 2000a. 大亚湾和大鹏湾麻痹性贝类毒素动态分析. 海洋环境科学, 19 (2) : 1–5 |
| 江天久, 尹伊伟, 骆育敏, 等. 2000b. 大亚湾麻痹性贝类毒素HPLC分析. 海洋环境科学, 19 (3) : 16–19 |
| 孔凡洲, 徐子钧, 于仁成, 等. 2007. 黄渤海海域贝类麻痹性贝毒的检测与分析. 中国海洋大学学报, 37 (2) : 305–309 |
| 李扬, 何利娜, 马艳艳, 等. 2010. 伪柔弱拟菱形藻复合群的形态分类学研究. 水生生物学报, 34 (2) : 302–311 |
| 林风翱, 卢兴旺, 洛昊, 等. 2008. 渤海赤潮的历史、现状及其特点. 海洋环境科学, 27 (S2) : 1–5 |
| 林燕棠, 贾晓平, 杨美兰, 等. 1999. 中国沿岸染毒贝类的麻痹性毒素. 热带海洋, 18 (1) : 90–96 |
| 林燕棠, 杨美兰, 陈瑞雯, 等. 1994. 广东沿海麻痹性贝类毒素的研究. 海洋与湖沼, 25 (2) : 221–225 |
| 林永水, 周近明. 1993. 南海甲藻(一). 北京: 科学出版社, |
| 林元烧. 1996. 有毒甲藻-塔玛亚历山大藻在厦门地区虾塘引起赤潮. 台湾海峡, 15 (1) : 16–18 |
| 刘仁沿, 高春蕾, 梁玉波, 等. 2008. Gymnodimine, 首次在我国北海缘齿牡蛎中发现的一种腹泻性贝毒组分. 海洋学报, 30 (6) : 171–176 |
| 吕颂辉, 齐雨藻. 1992. 南海大鹏湾的主要赤潮生物. 暨南大学学报(自然科学), 13 (3) : 130–133 |
| 罗璇, 于仁成, 王晓杰, 等. 2008. 福建沿海部分地区织纹螺毒性消长及毒素成分分析. 水产学报, 32 (4) : 636–643 |
| 罗璇, 于仁成, 周名江, 等. 2014. 应用LC-MS联用方法分析青岛近海渐尖鳍藻(Dinophysis acuminata)细胞中的毒素成分. 海洋环境科学, 33 (5) : 781–787 |
| 罗璇. 2011.青岛近海鳍藻种群动态与产毒特征研究.北京:中国科学院(海洋研究所)博士学位论文 |
| 齐雨藻, 钱锋. 1994. 大鹏湾几种赤潮甲藻的分类学研究. 海洋与湖沼, 25 (2) : 206–210 |
| 齐雨藻. 2003. 中国沿海赤潮. 北京: 科学出版社, |
| 邵魁双, 巩宁, 杨青, 等. 2011. 甲藻孢囊在长山群岛海域表层沉积物中的分布. 生态学报, 31 (10) : 320–327 |
| 石雅君, 刘东艳, 邵红兵, 等. 2011. 北黄海表层沉积物中甲藻孢囊的分布特征. 海洋通报, 30 (3) : 320–327 |
| 宋秀凯, 马建新, 刘义豪, 等. 2009. 隍城岛海域塔玛亚历山大藻赤潮发展过程及其成因. 海洋湖沼通报, (4) : 93–98 |
| 唐祥海, 于仁成, 颜天, 等. 2006. 中国沿海亚历山大藻(Alexandrium)核糖体rDNA部分序列分析及该藻属分子系统进化研究. 海洋与湖沼, 37 (6) : 529–535 |
| 王朝晖, 齐雨藻. 2003. 甲藻孢囊在长江口海域表层沉积物中的分布. 应用生态学报, 14 (7) : 1039–1043 |
| 王朝晖. 2007. 中国沿海甲藻孢囊与赤潮研究. 北京: 海洋出版社, |
| 王金辉, 秦玉涛, 刘材材, 等. 2006. 长江口赤潮多发区潜在有毒藻类和赤潮毒素的初步调查. 海洋环境科学, 25 (S1) : 15–19 |
| 王金辉, 秦玉涛, 刘材材, 等. 2007. 长江口及邻近海域有毒藻类和赤潮毒素的本底调查. 海洋湖沼通报, (1) : 52–61 |
| 王雪虹, 黄世玉. 2007. 厦门海域养殖区麻痹性贝毒污染的研究. 集美大学学报(自然科学), 12 (2) : 114–117 |
| 王雪虹, 宋振荣. 2006. 福建漳州海域麻痹性贝毒的污染状况调查. 台湾海峡, 25 (4) : 478–483 |
| 王艳, 腾琳. 2006. 2004年春季长江口海域甲藻孢囊的分布研究. 生态科学, 25 (2) : 131–134 |
| 吴施卫, 曾淼, 卢大鹏, 等. 2008. 2005年春季广东近岸海域麻痹性贝毒素的特征分析. 海洋学研究, 26 (4) : 49–54 |
| 夏远征, 王双双, 辛丘岩, 等. 2010. 大连海域贝类麻痹性贝毒的污染状况调查与分析. 食品与机械, 26 (2) : 54–56 |
| 邢小丽, 杨军霞, 康燕玉, 等. 2007. 大亚湾水域两种拟菱形藻的形态学鉴定及毒素分析. 台湾海峡, 26 (4) : 576–582 |
| 姚建华, 谭志军, 周德庆, 等. 2010. 液相色谱-串联质谱法检测贝类产品中的原多甲藻酸贝类毒素. 色谱, 28 (4) : 363–367 |
| 于仁成, 唐祥海, 张清春, 等. 2006. 应用荧光原位杂交方法检测中国沿海塔玛/链状亚历山大藻复合种(亚洲温带基因型). 环境科学学报, 26 (4) : 646–651 |
| 张正波, 吴福金. 2000. 一起海蛤、竹蛏引起的麻痹性贝类中毒的调查. 预防医学文献信息, 6 (4) : 374 |
| 郑磊, 齐雨藻, 骆育敏. 1995.大鹏湾有毒赤潮生物孢囊研究, 16(1): 121-126 |
| 周名江, 朱明远, 张经. 2001. 中国赤潮的发生趋势和研究进展. 生命科学, 13 (2) : 54–59 |
| 周名江, 朱明远. 2006. "我国近海有害赤潮发生的生态学、海洋学机制及预测防治"研究进展. 地球科学进展, 21 (7) : 673–679 |
| 邹景忠. 2004. 海洋环境科学. 济南: 山东教育出版社, |
| Anderson D M, Cembella A D, Hallegraeff G M. 2012. Progress in understanding harmful algal blooms: paradigm shifts and new technologies for research, monitoring, and management. Annual Review of Marine Sciences, 4 : 143–176 DOI:10.1146/annurev-marine-120308-081121 |
| Anderson D M, Kulis D M, Qi Y Z, et al. 1996. Paralytic shellfish poisoning in Southern China. Toxicon, 14 : 579–590 |
| Cho H J, Matsuoka K. 2001. Distribution of dinoflagellate cysts in surface sediments from the Yellow Sea and East China Sea. Marine Micropaleontology, 42 (3-4) : 103–123 DOI:10.1016/S0377-8398(01)00016-0 |
| Dickman M, Tang S M, Lai J. 2002. A comparison of eastern and western Hong Kong Phytoplankton from weekly samples (1997-1999). Chinese Journal of Oceanology and Limnology, 20 (1) : 52–61 DOI:10.1007/BF02846611 |
| FAO. 2004. Marine Biotoxins. FAO Food and Nutrition Paper 80. Rome: Food and Agriculture Organization of the United Nations |
| Gao Y, Yu R C, Chen J H, et al. 2015a. Distribution of Alexandrium fundyense and A. pacificum (Dinophyceae) in the Yellow Sea and Bohai Sea. Marine Pollution Bulletin, 96 : 210–219 DOI:10.1016/j.marpolbul.2015.05.025 |
| Gao Y, Yu R C, Murray S A, et al. 2015b. High specificity of a quantitative PCR assay targeting a saxitoxin gene for monitoring toxic algae associated with paralytic shellfish toxins in the Yellow Sea. Applied and Environmental Microbiology, 81 (20) : 6973–6981 DOI:10.1128/AEM.00417-15 |
| Glibert P M, Pitcher G. 2001. Global Ecology and Oceanography of Harmful Algal Blooms: Science Plan. Baltimore and Paris: SCOR and IOC |
| Gu H F, Liu T T, Vale P, et al. 2013a. Morphology, phylogeny and toxin profiles of Gymnodinium inusitatum sp. nov., Gymnodinium catenatum and Gymnodinium microreticulatum (Dinophyceae) from the Yellow Sea, China. Harmful Algae, 28 : 97–107 |
| Gu H F, Luo Z H, Krock B, et al. 2013b. Morphology, phylogeny and azaspiracid profile of Azadinium poporum (Dinophyceae) from the China Sea. Harmful Algae, 21-22 : 64–75 DOI:10.1016/j.hal.2012.11.009 |
| Gu H F, Zeng N, Liu T T, et al. 2013c. Morphology, toxicity, and phylogeny of Alexandrium (Dinophyceae) species along the coast of China. Harmful Algae, 27 : 68–81 DOI:10.1016/j.hal.2013.05.008 |
| John U, Litaker W, Montresor M, et al. 2014a. Proposal to reject the name Alexandrium catenella (Dinophyceae). Taxon, 63 : 932–933 DOI:10.12705/634.21 |
| John U, Litaker W, Montresor M, et al. 2014b. Formal revision of the Alexandrium tamarense species complex (Dinophyceae) taxonomy: the introduction of five species with emphasis on molecular-based (rDNA) classification. Protist, 165 : 779–804 DOI:10.1016/j.protis.2014.10.001 |
| Li A F, Ma J G, Cao J J, et al. 2012. Toxins in mussels (Mytilus galloprovincialis) associated with diarrhetic shellfish poisoning episodes in China. Toxicon, 20 : 420–425 |
| Li A F, Sun G, Qiu J B, et al. 2015. Lipophilic shellfish toxins in Dinophysis caudata picked cells and in shellfish from the East China Sea. Environmental Science and Pollution Research, 22 : 3116–3126 DOI:10.1007/s11356-014-3595-z |
| Li A F, Yu R C, Wang Y F, et al. 2005. Morphological and toxicity characteristics of Pseudo-nitzschia pungens strain PP0201-01 isolated from the East China Sea. Chinese Journal of Oceanology and Limnology, 23 (4) : 418–426 DOI:10.1007/BF02842686 |
| Li Z X, Guo M M, Yang S G, et al. 2010. Investigation of pectenotoxin profiles in the Yellow Sea (China) using a passive sampling technique. Marine Drugs, 8 (4) : 1263–1272 DOI:10.3390/md8041263 |
| Qi Y Z, Hong Y, Zheng L, et al. 1996. Dinoflagellate cysts from recent marine sediments of the South and East China Seas. Asian Marine Biology, 13 : 87–103 |
| Wang D Z, Hsieh D P H. 2005. Growth and toxin production in batch cultures of a marine dinoflagellate Alexandrium tamarense HK9301 isolated from the South China Sea. Harmful Algae, 4 (2) : 401–410 DOI:10.1016/j.hal.2004.07.002 |
| Wang D Z, Lin L, Gu H F, et al. 2008. Comparative studies on morphology, ITS sequence and protein profile of Alexandrium tamarense and A. catenella isolated from the China Sea. Harmful Algae, 7 : 106–113 DOI:10.1016/j.hal.2007.06.002 |
| Wang L, Zhuang Y Y, Zhang H, et al. 2014. DNA barcoding species in Alexandrium tamarense complex using ITS and proposing designation of five species. Harmful Algae, 31 : 100–113 DOI:10.1016/j.hal.2013.10.013 |
| Wang X Z, Cheng Y, Li N, et al. 2016. Occurrence and seasonal variations of lipophilic marine toxins in commercial clam species along the coast of Jiangsu, China. Toxins, 8 |
| Wang Z H, Matsuoka K, Qi Y Z, et al. 2004. Dinoflagellate cysts in recent sediments from Chinese coastal waters. Marine Ecology, 25 (4) : 289–311 DOI:10.1111/mae.2004.25.issue-4 |
| Wang Z H, Nie X P, Jiang S J, et al. 2011. Source and profile of paralytic shellfish poisoning toxins in shellfish in Daya Bay, South China Sea. Marine Environmental Research, 72 (1-2) : 53–59 DOI:10.1016/j.marenvres.2011.04.007 |
| Wiese M, D'Agostino P M, Mihali T K, et al. 2010. Neurotoxic alkaloids: saxitoxin and its analogs. Marine Drugs, 8 : 2185–2211 DOI:10.3390/md8072185 |
| Wu H Y, Guo M M, Tan Z J, et al. 2014. Liquid chromatography quadrupole linear ion trap mass spectrometryfor multiclass screening and identification of lipophilic marinebiotoxins in bivalve mollusks. Journal of Chromatography A, 1358 : 172–180 DOI:10.1016/j.chroma.2014.06.105 |
| Yu R C, Hummert C, Luckas B, et al. 1998. Analysis of PSP toxins in algae and shellfish samples from China using a modified HPLC method. Chromatographia, 48 (9) : 671–677 |
| Zhou M J, Li J, Luckas B, et al. 1999. A recent shellfish toxin investigation in China. Marine Pollution Bulletin, 39 : 331–334 DOI:10.1016/S0025-326X(99)00026-0 |
 2016, Vol. 51
2016, Vol. 51


