
中国科学院海洋研究所主办。
文章信息
- 马林, 李新正. 2017.
- MA Lin, LI Xin-Zheng. 2017.
- 胶州湾海域5种粗毛猛水蚤的形态记述
- Five Species of the Family Miraciidae (Copepoda) from the Jiaozhou Bay
- 海洋科学集刊(52): 11-21
- Studia Marina Sinica(52): 11-21.
- http://dx.doi.org/10.12036/hykxjk20170822003
-
文章历史
- 收稿日期:2017-08-22
- 收修改稿日期:2017-09-04
2. 中国科学院大学, 北京 100049;
3. 青岛海洋科学与技术国家实验室 海洋生物学与生物技术功能实验室, 青岛 266071
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Laboratory of Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China
粗毛猛水蚤科(Miraciidae Dana, 1846)是猛水蚤目(Harpacticoida Sars, 1903)数量居于第二的科, 主要在海洋中营底栖生活(Boxshall and Halsey, 2004), 世界上已记录55属376种。粗毛猛水蚤的栖息环境多样, 分布很广, 各大洋均有分布(Lang, 1965; Wells and Rao, 1987; Garlitska et al., 2012); 可生活在各种类型的生境中, 红树林、珊瑚礁、海草床、热液口和冷泉中均有分布; 垂直分布从潮间带到超过5000m的深海(Somerfield et al., 1998; Willen, 2003; Rose et al., 2005)。猛水蚤营养价值高, 可作为仔稚鱼和贝类等的食物, 在底栖生态系统小食物网中具有重要的作用(Lee et al., 2012); 另外, 猛水蚤繁殖周期短, 对污染非常敏感, 是监测环境污染的潜在指示种(Moreno et al., 2008; Araújo-Castro et al., 2009)。
粗毛猛水蚤科的分类学研究开始于19世纪40年代, Dana于1846年建立粗毛猛水蚤科, 但没有对种进行描述, 直到1849年报道了粗毛猛水蚤科2种, 此科的分类学研究才陆续开展。早期粗毛猛水蚤科的分类学研究主要集中在欧美国家沿岸, 我国邻近海域粗毛猛水蚤科的分类学研究开始较晚, 直到20世纪70年代日本才有粗毛猛水蚤的报道(Itô, 1972)。我国对海洋底栖粗毛猛水蚤科的分类学研究相对薄弱, 开始于21世纪, Mu和Gee(2000)首先描述了渤海的3种粗毛猛水蚤; 而对胶州湾海域底栖猛水蚤的物种形态描述研究更少, 仅有零星报道(Ma and Li, 2011)。
胶州湾位于山东半岛南岸的西部, 是一个半封闭的浅海内湾, 周围海域环境和地理位置优越, 底栖生物种类丰富。本文通过对胶州湾粗毛猛水蚤的鉴定, 为进一步明确胶州湾底栖猛水蚤的物种组成提供基础, 研究成果对于我国海洋生态学研究和环境监测具有重要意义。
1 材料与方法刮取沉积物表层, 用10%甲醛固定, 带回实验室后, 染色, 以38µm孔径的网筛分选后用比重为1.15的胶态氧化硅溶液(Ludox-TM, 美国sigma公司)进行提取, 显微镜下挑选, 标本保存在75%的酒精中。解剖前将标本在乳酸中透明20min左右, 制片后显微镜下观察鉴定。
2 结果和讨论(1)羽球疑囊猛水蚤 Bulbamphiascus plumosus Mu & Gee, 2000 (图 1)
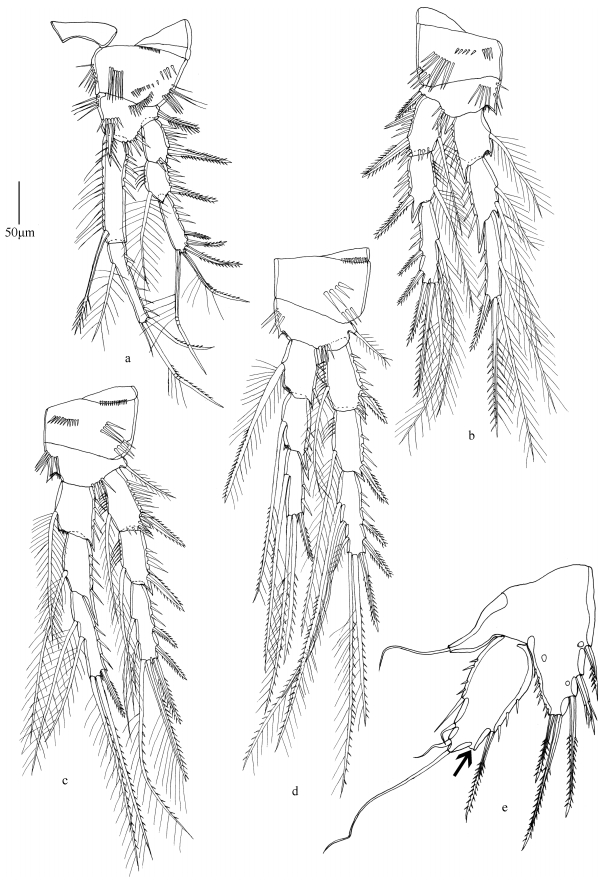
|
| 图 1 羽球疑囊猛水蚤(雌性) Fig. 1 Bulbamphiascus plumosus Mu & Gee, 2000 (♀; a. first swimming leg; b. second swimming leg; c. third swimming leg; d. fourth swimming leg; e. fifth swimming leg, arrow points to a missing seta; Scale bar is 50µm) 注: a.第1胸足; b.第2胸足; c.第3胸足; d.第4胸足; e.第5胸足(箭头处表示缺失一根刚毛); 比例尺长度为50µm。 |
Bulbamphiascus plumosus Mu & Gee, 2000: p. 105, figs. 1~8.
标本信息 2♀♀(MBM189103), 35°59.000′N, 120°25.500′E, 水深16.5m, 底质粗砂, 2008年5月14日李宝泉、周进、马林采自胶州湾。
形态特征 雌体体长约1mm。身体近圆柱形。额角三角形。尾节背面中部具一小的角质状的肛板。尾叉长宽几乎等长; 具7根尾毛, 第1尾毛细小。前体部无刺的分布; 后体部生殖节腹面和侧面具刺; 第4节腹面和侧面具小刺; 尾节侧面以及尾叉的侧面和腹面具刺。第1触角分8节; 第4节和末节各具一感觉毛。第2触角外肢分3节; 内肢边缘具2根刺和2根刚毛, 末端具2根羽状刺, 4根膝状弯曲的刚毛和1根羽状刚毛。大颚颚基具8齿和2根刚毛; 外肢分2节; 内肢1节。第1小颚内外肢均分1节。第2小颚底节具3个内叶, 刚毛分布为3:3:2;内肢1节, 具5根刚毛。颚足内肢1节具5根刚毛和刺。第1胸足内肢第1节延伸到外肢第3节的中部。第1~4胸足各节刚毛和刺的分布如表 1所示。
| 外肢 | 内肢 | |
| 第1胸足 | 0:1:023 | 1:1:021 |
| 第2胸足 | 1:1:223 | 1:2:121 |
| 第3胸足 | 1:1:223 | 1:1:221 |
| 第4胸足 | 1:1:323 | 1:1:121 |
第5胸足外肢长是宽的两倍, 具6根刚毛; 内肢突起末端延伸到外肢的1/2处。
讨论 Mu和Gee(2000)在对渤海湾软泥底质的沉积物进行分析时, 报道此种, 分布水深11~70m。胶州湾采集的标本个体比渤海湾采集的个体大, 身体外部形态、附肢各节刚毛和刺的分布情况与Mu和Gee(2000)描述的个体形态基本一致, 除1~3胸足底节刺的分布略有差别。
(2)颂歌伊藤狭腹猛水蚤 Itostenhelia polyhymnia Karanovic & Kim K., 2014 (图 2~3)
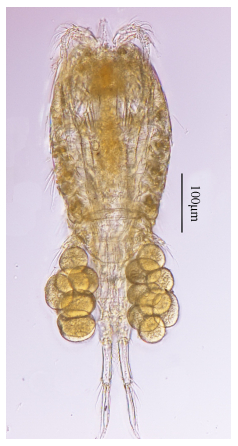
|
| 图 2 颂歌伊藤狭腹猛水蚤(雌性)整体图 Fig. 2 Itostenhelia polyhymnia Karanovic & Kim K., 2014 Female habitus, dorsal view |
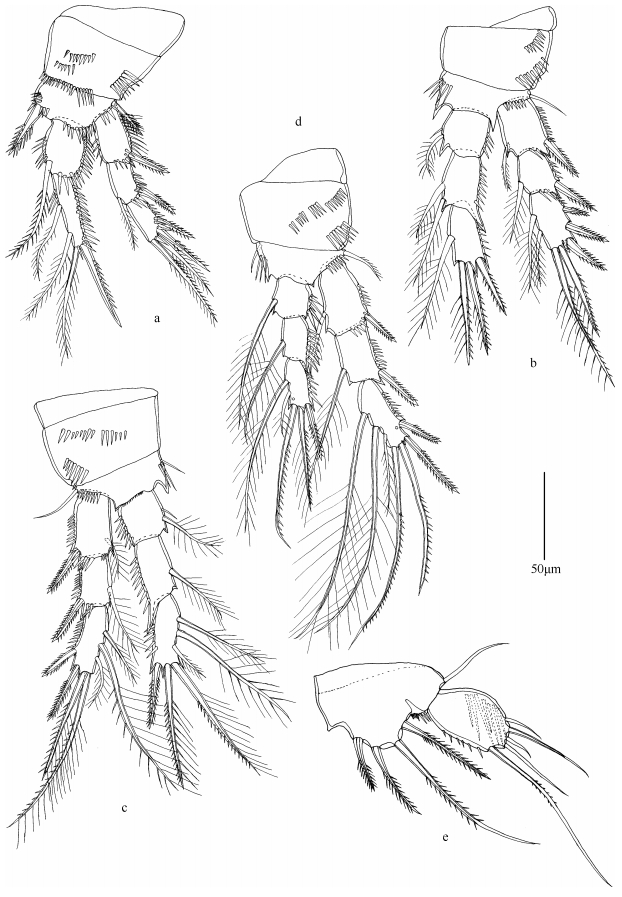
|
| 图 3 颂歌伊藤狭腹猛水蚤(雌性) Fig. 3 Itostenhelia polyhymnia Karanovic & Kim K., 2014 (♀; a. first swimming leg; b. second swimming leg; c. third swimming leg; d. fourth swimming leg; e. fifth swimming leg; Scale bar is 50µm) 注: a.第1胸足; b.第2胸足; c.第3胸足; d.第4胸足; e.第5胸足; 比例尺长度为50µm。 |
Itostenhelia polyhymnia Karanovic & Kim K., 2014: p. 54, figs. 34~42.
标本信息 3♀♀(MBM189106~189108), 1♂(MBM189109), 36° 08.000′N, 120°11.167′E, 水深2.8m, 底质软泥, 2008年5月14日李宝泉、周进、马林采自胶州湾。
形态特征 雌体体长约560~646µm, 雄体体长约546µm。体前体部宽于后体部, 前体部体节表面无刺的分布。尾叉长是宽的约3.5倍, 具肛板。第1触角分不明显的8节, 第4节和末节各具1感觉毛。第2触角外肢分3节; 内肢末端具7根刚毛。大颚颚基内侧具2齿; 内肢向外肢弯曲。第1小颚内外肢均分1节。第2小颚内肢具4根刚毛。颚足底节外侧顶端具钝的凸起。第1胸足内肢第1节粗短。第1~4胸足各节刚毛和刺的分布如表 2所示。
| 外肢 | 内肢 | |
| 第1胸足 | 0:1:022 | 1:211 |
| 第2胸足 | 1:1:223 | 1:2:121 |
| 第3胸足 | 1:1:322 | 1:1:321 |
| 第4胸足 | 1:1:322 | 1:1:221 |
雌性第5胸足内肢突起具4根刚毛, 近外肢处具细刺; 外肢外侧具细刺, 具5根刚毛。雄性外肢具4根刚毛。
讨论 Karanovic和Kim(2014)对韩国海域采集的小个体标本和大个体标本进行过详细的描述。胶州湾采集的标本个体属于大个体标本, 与韩国报道的个体身体外部形态、附肢刚毛和刺的分布情况基本一致, 除雌性第5胸足内肢近外肢处的刺更密集。目前此种仅在韩国海域和胶州湾有记录。
(3)双刺爪狭腹猛水蚤 Onychostenhelia bispinosa Huys & Mu, 2008 (图 4~5)
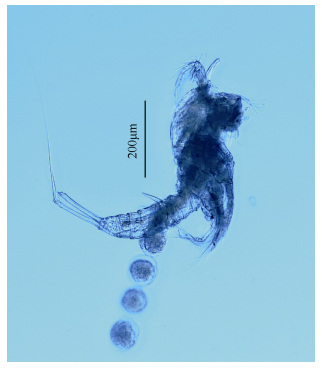
|
| 图 4 双刺爪狭腹猛水蚤(雌性)整体图 Fig. 4 Onychostenhelia bispinosa Huys & Mu, 2008 Female habitus, dorsal view |
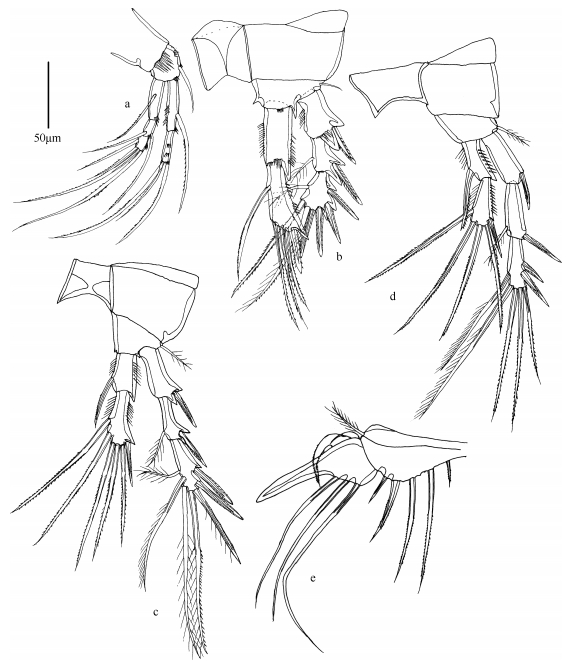
|
| 图 5 双刺爪狭腹猛水蚤(雌性) Fig. 5 Onychostenhelia bispinosa Huys & Mu, 2008 (♀; a. first swimming leg; b. second swimming leg; c. third swimming leg; d. fourth swimming leg; e. fifth swimming leg; Scale bar is 50µm) 注: a.第1胸足; b.第2胸足; c.第3胸足; d.第4胸足; e.第5胸足; 比例尺为50µm。 |
Onychostenhelia bispinosa Huys & Mu, 2008: p. 53, figs. 1~7; Kim et al., 2011, p. 56, figs. 1~6; Lee et al., 2012, p. 118, figs. 78~83; Song et al., 2012, p. 1403.
标本信息 5♀♀, 2♂♂(MBM189116), 35° 59′N, 120°25.5′E, 水深16.5m, 底质粗砂, 2008年5月14日李宝泉、周进、马林采自胶州湾。
形态特征 雌体体长530~650µm。雄体体长450~580µm。头胸甲比其他体节宽。额角三角形, 侧面凹陷, 顶端两半。尾叉圆柱形, 长约为基部宽的8倍, 具尾毛7根。第1触角7节, 第1节和第2节具凸起, 第4节和末节均具感觉毛。第2触角内肢侧缘具2根刺和2根刚毛, 末端具6个附属物; 外肢分3节。大颚外肢内侧具3根刚毛, 末端具3根刚毛; 内肢内侧具2根刚毛, 末端具6根刚毛。第1小颚内外肢基部愈合。第2小颚内肢具5根刚毛。颚足内肢分2节。第1胸足底节长大于宽, 基节短。第1~4胸足刚毛和刺的分布如表 3所示。
| 外肢 | 内肢 | |
| 第1胸足 | 0:1:121 | 1:120 |
| 第2胸足 | 0:1:223 | 0:221 |
| 第3胸足 | 0:1:322 | 1:321 |
| 第4胸足 | 0:1:322 | 1:221 |
第5胸足外肢末端具一刺状突起, 外侧具2根窄刺, 内侧具3根长的刚毛。内肢与基节愈合, 具5个附属物, 外侧第2根刚毛稍呈羽状, 中间的刚毛一侧具细刺, 一侧具小羽片, 内侧第2根刚毛与中间刚毛等长。雄性第5胸足不连续, 背面中部向外弯曲, 内侧刺靠近顶端处更粗壮。
讨论 本种与Huys和Mu(2008)的描述的个体身体外部形态和附肢上刚毛和刺的分布情况基本一致, 此种在中国渤海和黄海以及韩国海域均有分布。
(4)显著华疑囊猛水蚤 Sinamphiascus dominatus Mu & Gee, 2000 (图 6)
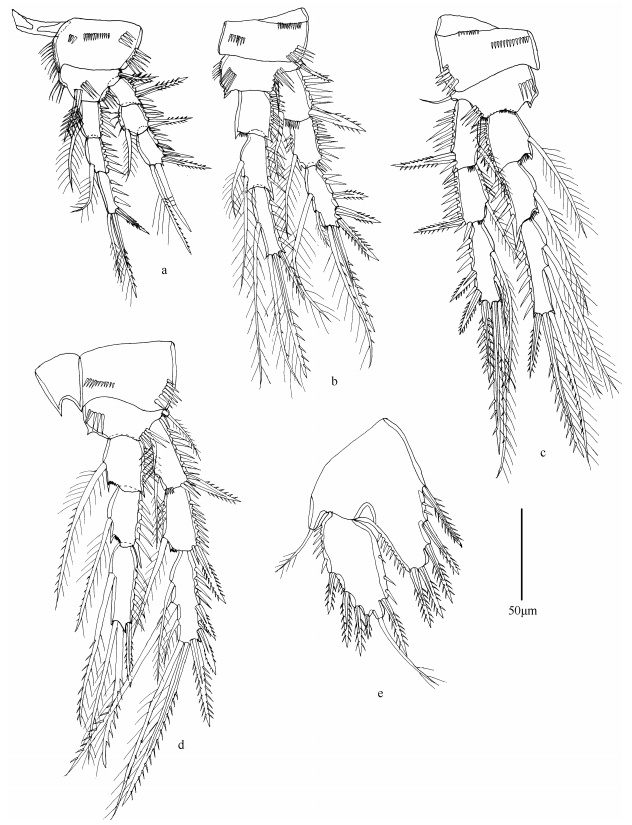
|
| 图 6 显著华疑囊猛水蚤(雌性) Fig. 6 Sinamphiascus dominatus Mu & Gee, 2000 (♀; a. first swimming leg; b. second swimming leg; c. third swimming leg; d. fourth swimming leg; e. fifth swimming leg; Scale bar is 50µm) 注: a.第1胸足; b.第2胸足; c.第3胸足; d.第4胸足; e.第5胸足; 比例尺为50µm。 |
Sinamphiascus dominatus Mu & Gee, 2000: p. 119, figs. 15~21; Nam & Lee, 2012, p. 46, figs. 1~8; Lee et al., 2012, p. 126, figs. 84~91; Song et al., 2012, p. 1403.
标本信息 34♀♀, 7♂♂(MBM189119), 35°59′N, 120°25.5′E, 水深16.5m, 底质粗砂; 23♀♀, 5♂♂(MBM189120), 36°09.000′N, 120°15.000′E, 水深5.0m, 底质软泥; 2008年5月14日李宝泉、周进、马林采自胶州湾。
形态特征 雌性个体最长达900µm, 雄性个体最长达825µm。近圆柱形。前体部各体节无刺的分布。后体部第4体节背面和腹面具刺, 尾节中部具半圆形的肛板。尾叉近方形。额角长, 呈三角形。第1触角分8节, 第4节和末节具感觉毛。第2触角外肢分3节; 内肢分2节, 末节侧面具2根刺和1根刚毛, 末端具1根刺和6根刚毛。大颚外肢分不明显的2节; 内肢1节, 具8根刚毛。第1小颚内外肢均分1节。第2小颚内肢1节, 具6根刚毛。颚足内肢1节, 具1爪和3根刚毛。第1~4胸足各节刚毛和刺的分布如表 4所示。
| 外肢 | 内肢 | |
| 第1胸足 | 0:1:023 | 1:1:021 |
| 第2胸足 | 1:1:223 | 1:2:121 |
| 第3胸足 | 1:1:223 | 1:1:221 |
| 第4胸足 | 1:1:323 | 1:1:121 |
第5胸足具5根羽状刺, 几乎等长。外肢长约为宽的两倍, 内侧具1根刺, 末端具2根刚毛, 外侧具3根羽状刺。第5胸足外肢长是宽的约1.5倍, 具6根刚毛和刺; 内肢具2根羽状刚毛。
讨论 本文记录的显著华疑囊猛水蚤与Mu和Gee(2000)描述的个体身体外部形态、附肢刚毛和刺的分布情况基本相同, 除雌性后体部倒数第2体节后缘刺的数量更多, 分布更连续。这种变化可能是生境变化造成的。
(5)田园威伦狭腹猛水蚤 Willenstenhelia thalia Karanovic & Kim K., 2014 (图 7~8)
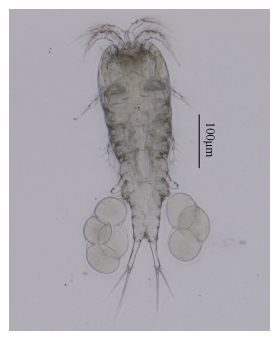
|
| 图 7 田园威伦狭腹猛水蚤(雌性)整体图 Fig. 7 Willenstenhelia thalia Karanovic & Kim K., 2014 Female habitus, dorsal view |
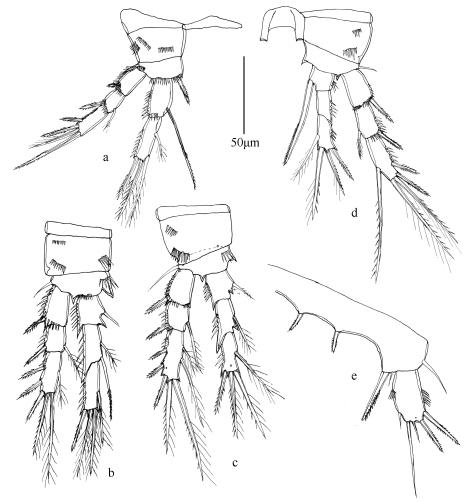
|
| 图 8 田园威伦狭腹猛水蚤(雌性) Fig. 8 Willenstenhelia thalia Karanovic & Kim, 2014 (♀; a. first swimming leg; b. third swimming leg; c. second swimming leg; d. fourth swimming leg; e. fifth swimming leg; Scale bar is 50µm) 注: a.第1胸足; b.第3胸足; c.第2胸足; d.第4胸足; e.第5胸足; 比例尺为50µm。 |
Willenstenhelia thalia Karanovic & Kim K., 2014: p. 74, figs 48~54.
标本信息 3♀♀, 36° 08.000′N, 120°11.167′E, MBM189240, 水深2.8m, 底质软泥, 2008年5月15日李宝泉、周进、马林采自胶州湾。
形态特征 雌体体长约380~400µm。体前体部宽于后体部, 前体部体节表面无刺的分布。尾叉长是宽的约4.6倍, 具肛板。第1触角分不明显的8节, 第4节具1感觉毛。第2触角外肢分3节; 内肢末端具7根刚毛。大颚颚基表面不具刚毛; 内肢向外肢弯曲。第1小颚内外肢均分1节。第2小颚内肢具4根刚毛, 外肢具2根刚毛。颚足底节外侧顶端具钝的凸起。第1~4胸足各节刚毛和刺的分布如表 5所示。
| 外肢 | 内肢 | |
| 第1胸足 | 0:1:022 | 1:211 |
| 第2胸足 | 0:1:123 | 1:2:121 |
| 第3胸足 | 0:1:223 | 1:1:121 |
| 第4胸足 | 0:1:122 | 1:0:121 |
雌性第5胸足内外肢愈合, 基节具3根刚毛, 内侧两根刚毛与外侧刚毛之间具有较大的空隙; 外肢具5根刚毛。
讨论 本种为中国海域首次记录, 身体外部形态、附肢刚毛和刺的分布情况与Karanovic和Kim(2014)对韩国海域标本的描述一致, 无明显变化。目前此种仅在韩国海域和胶州湾有记录。
3 结论本文通过对胶州湾采集的沉积物进行分析, 鉴定粗毛猛水蚤科5属5种, 发现1新记录种田园威伦狭腹猛水蚤(Willenstenhelia thalia Karanovic & Kim K., 2014)。目前, 胶州湾海域已鉴定到种水平的粗毛猛水蚤有6种。本文通过对已知种的形态特征分析, 制定了胶州湾粗毛猛水蚤科的种的检索表(见文末附表), 为以后的鉴定工作提供了便利条件。胶州湾海域的猛水蚤物种组成研究还不充分, 一些种因为样品量不足, 无法准确鉴定, 还需要进一步补充采集。
致谢: 感谢课题组的各位同事在标本采集中提供的帮助。| Araújo-Castro C M V, Souza-Santos L P, Torreiro A G, et al. 2009. Sensitivity of the marine benthic copepod Tisbe biminiensis (Copepoda, Harpacticoida) to potassium dichromate and sediment particle size. Brazilian Journal of Oceanography, 57 (1) : 33–41 DOI:10.1590/S1679-87592009000100004 |
| Boxshall G A, Halsey S H, 2004. An Introduction to Copepod Diversity. London: Ray Society, 966 |
| Garlitska L, Neretina T, Schepetov D, et al. 2012. Cryptic diversity of the 'cosmopolitan' harpacticoid copepod Nannopus palustris: genetic and morphological evidence. Molecular Ecology, 21 (21) : 5336–5347 DOI:10.1111/mec.2012.21.issue-21 |
| Huys R, Mu F H. 2008. Description of a new species of Onychostenhelia Itô (Copepoda, Harpacticoida, Miraciidae) from the Bohai Sea, China. Zootaxa, 1706 : 51–68 |
| Itô T. 1972. Descriptions and records of marine harpacticoid copepods from Hokkaido, Ⅳ. Journal of the Faculty of Science, Hokkaido University, Series Ⅵ, Zoology, 18 (2) : 305–336 |
| Karanovic T, Kim K. 2014. New insights into polyphyly of the harpacticoid genus Delavalia (Crustacea, Copepoda) through morphological and molecular study of an unprecedented diversity of sympatric species in a small South Korean bay. Zootaxa, 3783 (1) : 1–96 DOI:10.11646/zootaxa.3783.1 |
| Kim K, Park E, Lee W. 2011. First record of Onychostenhelia bispinosa (Copepoda: Harpacticoida: Miraciidae) from Korea. Bull. Nat. Inst. Biol. Resour., 2 (2) : 55–65 |
| Lang K. 1965. Copepoda Harpacticoidea from the Californian pacific coast. Kungl. Svenska Vetenskapsakademiens Handlingar, 10 (2) : 1–566 |
| Lee W, Park E, Song S J, 2012. Invertebrate Fauna of Korea, 21 (11), Marine Harpacticoida. South Korea: National Institute of Biological Resources, Ministry of Environment, 276 |
| Ma L, Li X Z. 2011. Delavalia qingdaoensis sp. nov. (Harpacticoida, Miraciidae), a new copepod species from Jiaozhou Bay, Yellow Sea. Crustaceana, 84 (9) : 1085–1097 DOI:10.1163/001121611X584334 |
| Moreno M, Vezzulli L, Marin V, et al. 2008. The use of meiofauna diversity as an indicator of pollution in harbours. ICES Journal of Marine Science, 65 : 1428–1435 DOI:10.1093/icesjms/fsn116 |
| Mu F H, Gee J M. 2000. Two new species of Bulbamphiascus (Copepoda: Harpacticoida: Diosaccidae) and a related new genus, from the Bohai Sea, China. Cahiers de Biologie Marine, 41 (2) : 103–135 |
| Rose A, Seifried S, Willen E, et al. 2005. A method for comparing within-core alpha diversity values from repeated multicorer samplings, shown for abyssal Harpacticoida (Crustacea: Copepoda) from the Angola Basin. Organisms, Diversity & Evolution, 5 (S1) : 3–17 |
| Somerfield P J, Gee J M, Aryuthaka C. 1998. Meiofaunal communities in a Malaysian mangrove forest. Journal of the Marine Biological Association of the United Kingdom, 78 (3) : 717–732 DOI:10.1017/S0025315400044738 |
| Song S J, Park J, Kwon B O, et al. 2012. Ecological checklist of the marine and brackish-water harpacticoid copepod fauna in korean waters. Zoological Studies, 51 (8) : 1397–1410 |
| Wells J B J, Rao G C. 1987. Littoral Harpacticoida (Crustacea: Copepoda) from Andaman and Nicobar islands. Memoirs of the Zoological Survey of India, 16 (4) : 1–385 |
| Willen E. 2003. A new species of Stenhelia (Copepoda, Harpacticoida) from a hydrothermal, active, submarine volcano in the New Ireland Fore-Arc system (Papua New Guinea) with notes on deep sea colonisation within the Stenheliinae. Journal of Natural History, 37 (14) : 1691–1711 DOI:10.1080/00222930110114437 |
 2017, Vol.
2017, Vol. 


