
中国科学院海洋研究所主办。
文章信息
- 赵苑, 赵丽, 董逸, 李海波, 张武昌, 肖天. 2017.
- ZHAO Yuan, ZHAO Li, DONG Yi, LI Hai-Bo, ZHANG Wu-Chang, XIAO Tian. 2017.
- 海洋浮游微食物网生物在海洋颗粒形成和沉降中的作用
- The Function of Marine Pelagic Microbial Food Web Organisms in Marine Particle Formation and Sedimentation
- 海洋科学集刊(52): 22-34
- Studia Marina Sinica(52): 22-34.
- http://dx.doi.org/10.12036/hykxjk20170822002
-
文章历史
- 收稿日期:2017-08-22
- 收修改稿日期:2017-08-27
2. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室, 青岛 266071
2. Laboratory of Marine Ecology and Environmental Sciences, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China
海水中除了生物之外, 还有一些颗粒是没有生命的碎屑(detritus), 包括有机碎屑和无机碎屑。在海洋浮游生态学研究中, 如果没有特别指出, 颗粒(particles)是指有机碎屑。科学家最初认为海水中的颗粒来自动物的粪便和浮游生物的尸体碎片, 它们最终都会溶解到海水中, 随水深的增加颗粒会减少(Riley, 1963)。20世纪50年代, 日本科学家在日本北部海域的深海发现大量雪花状漂浮物, 并将它们命名为海雪(marine snow)(Suzuki and Kato, 1953)。在深海中存在海雪这一现象, 与浮游生物粪便等随水深减少的现象不一致, 使人们意识到除了生物粪便和尸体碎片外, 还有其他的颗粒存在。
在20世纪90年代, 随着新技术和染料的应用, 人们发现了不同粒径和染色特性的颗粒。Isao等(1990)使用颗粒计数器(elzone monitor particle counter 80 XY)发现了粒级为0.3~1.3µm的亚微米颗粒(sub-micrometer-sized particles); Alldredge等(1993)发现了粒级为从3µm到 > 100µm的透明胞外聚合颗粒物(transparent exopolymer particles, TEP); Long和Azam(1996)发现了考马斯亮蓝染色颗粒(Coomassie blue-stained particles, CSP); Mostajir等(1995)发现了4', 6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole, DAPI)染色颗粒(DAPI yellow particles, DYP)。由于不能重复染色, 目前还不能确定一个颗粒是否同时是TEP, CSP和DYP。这些新发现的颗粒被统称为新颗粒(new particles)(Azam et al., 1993; Simon et al., 2002), 过去了解的颗粒(如生物尸体、粪便、海雪等)则被称为传统颗粒(classical particles)。由于新颗粒大多为透明状, 也被称为海洋中的“暗物质”(dark matter) (Azam, 1998)。
海雪和新颗粒都是高分子聚合物(polymer)聚合而成的颗粒物, 其表面有细菌繁殖, 并黏附了无机颗粒和浮游生物, 因此被统称为有机聚合颗粒(organic aggregates), 或简称为聚合颗粒(aggregates)(Simon et al., 2002)。这些聚合物与粪便颗粒和动物尸体有明显区别:粪便颗粒和动物尸体有明显的边界, 细菌等不能进入, 过滤到滤膜上后, 能够保持其内的液体, 从而保持原来的形态; 而聚合颗粒中的高分子聚合物形成不同体积、不同孔径、不同结构的框架, 海水充斥其中, 细菌等生物可以进入, 一旦过滤到滤膜上, 聚合颗粒中的海水流出, 框架就会塌缩, 不能保持原来的形态, 因此聚合颗粒也可被视为一种胶状物(gel)(Verdugo et al., 2004)。
根据是否能够被滤膜截留, 海洋中的有机碳可以分为溶解有机碳(dissolved organic matter, DOC)和颗粒有机碳(particulate organic carbon, POC)。DOC又可以划分为溶解组分(free DOC, < 1nm)和胶质组分(assembled DOC, 1~1000nm)(Benner et al., 1992), 海洋水体中的DOC保持可逆的组装/分散平衡, 生成胶状颗粒(self-assembled microgels, SAGs), 这些SAGs是海洋DOC和POC之间的桥梁(Verdugo et al., 2004; Verdugo, 2012)。
按照粒径, 聚合颗粒分为大型聚合颗粒(macroaggregate)、小型聚合颗粒(microaggregate)和亚微米颗粒(submicron particle) (图 1)(Simon et al., 2002)。大型聚合颗粒粒径 > 500µm, 主要是海雪; 小型聚合颗粒粒径为1~500µm, 包括TEP、CSP和DYP; 亚微米颗粒粒径 < 1µm。颗粒粒级越小, 丰度就越大(Yamasaki et al., 1998), 这些颗粒粒径从小到大形成了颗粒的连续谱(Zetsche and Ploug, 2015)。
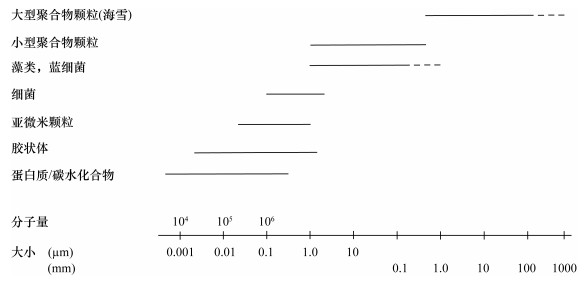
|
| 图 1 海洋主要颗粒及溶解有机成分粒径谱(引自Simon et al., 2002) Fig. 1 Size spectra of the major particulate and dissolved organic constituents in aquatic systems |
海洋中的微生境是一个连续存在的谱, 颗粒之外的海水是这个谱的一端, 而聚合颗粒中的空间是这个谱的另一端。颗粒在海水中营造了不同于纯海水的小生境, 里面生活着与自然海水中不同的生物。对颗粒黏附生物研究主要关注的问题有三个: (1)颗粒黏附生物和自由生生物在海水中所占的比例; (2)颗粒黏附生物和自由生生物在各自小生境中的丰度比较; (3)颗粒黏附生物和自由生生物类群组成和生理功能的不同。近年来, 学者们从不同角度对异养细菌、蓝细菌、真核藻类、鞭毛虫、纤毛虫等颗粒黏附生物进行了深入研究, 本文将简要介绍以上这些微食物网生物在颗粒形成和沉降作用中的重要作用。
1 海洋颗粒有机碳中的微食物网生物比例海洋中的POC的测量方法是用滤膜过滤海水, 测定截留在滤膜上的有机碳即为POC。在膜过滤的过程中, 海洋微食物网生物(如异养细菌、蓝细菌、真核藻类和鞭毛虫等)也被过滤到滤膜上, 因此, 颗粒有机碳中包括无生命的碎屑(detritus)和浮游生物。
由于微食物网生物个体微小, 无法将生物和碎屑分离开来, 因此估计颗粒有机碳中生物所占的比例难度较大。Pomeroy(1980)估算颗粒有机碳中碎屑, 认为生物的比例约为10:1, 这一比例被后人引用(Kirchman et al., 1993; Verity et al., 2000), 但是一直没有人认真测定过这个数值。通过计数马尾藻海(Sargasso Sea)表层至175m水层的水体内微食物网各个类群的丰度, 利用体积和生物量转换系数将生物转换成生物量, 估算结果表明微食物网生物占POC的比例在3~4月为55%, 在8月为24%(Caron et al., 1995; Roman et al., 1995)。
有些研究没有估计所有微食物网生物的比例, 而是估计一部分微食物网生物的比例, 有研究估算大洋中细菌有机碳(bacterial organic carbon, BOC)占POC的比例为43%~ 70% (Cho and Azam, 1988); 在北太平洋ALOHA站表层0~80m, 细菌(自养和异养)及细菌碎屑在总POC中的比例为20%~30% (Kawasaki et al., 2011); 在百慕大的BATS站位表层65m水体中, 浮游植物和异养生物在总POC中的比例分别为32%和15% (Gundersen et al., 2001)。
2 微食物网生物促进海洋颗粒的形成 2.1 细菌促进聚合颗粒形成20世纪50~60年代, 科学家对聚合物颗粒产生的原因开始进行研究。实验证明, 在用滤膜过滤的海水中充气产生气泡, 就会产生聚合物, 即DOC在界面(固体表面、气泡、海洋表面)通过物理、化学作用生成聚合物颗粒(Barber, 1966)。随着研究的深入, 人们发现海洋微食物网生物在DOC转变为聚合物颗粒的过程中非常重要。在实验模拟中, 只有活的微生物存在的条件下大型聚合颗粒才能生成; 如果用氯化汞固定海水, 或者用过滤的方法去除细菌, DOC不能产生聚合物颗粒(Biddanda, 1985)。假交替单胞菌属(Pseudoalteromonas)的细菌可以促进小聚合颗粒(直径0.01cm)聚集生成大聚合物颗粒(直径0.1~1cm)(Yamada et al., 2016)。
细菌可以通过三种途径促进聚合颗粒的形成: (1)DOC高分子聚合物可以通过物理作用和化学作用自组织成小型聚合物, 这些小型聚合物处于聚合-解聚的动态平衡中, 而细菌产生的双亲胞外物质(amphiphilic exopolymer substances, EPS)在低浓度下即可诱导高分子聚合物的聚合作用, 从而帮助水体中的DOC形成小型聚合物(Ding et al., 2008); (2)细菌生长释放的胞外高分子聚合物中有细胞膜的组分, 黏度较高, 有利于形成聚合颗粒(Stoderegger and Herndl, 1998, 1999), 当加入细菌抑制剂后, 海水中形成的TEP浓度则很低(Sugimoto et al., 2007); (3)细菌刺激藻类分泌胞外高分子聚合物。针对威氏海链藻(Thalassiosira weissflogii)的实验研究表明, 黏附在硅藻上的细菌能刺激硅藻分泌胞外高分子聚合物, 从而形成聚合颗粒(Gärdes et al., 2011, 2012)。
2.2 微型浮游动物产生颗粒微型浮游动物产生的粪便排出体外后可直接成为海洋颗粒。在自然海水中可以观察到一些小型(< 150µm)粪便颗粒, 例如在赤道东太平洋水体中存在粒级为3~50µm的粪便颗粒, Gowing和Silver(1985)将其称为“迷你粪球”(Minipellets)。在南大洋罗斯海(Ross Sea)也观察到这类迷你粪球, 其直径为20~100µm, 它们中有些有自发荧光, 有些则没有(Gowing et al.. 2001)。Nöthig和Von Bodungen(1989)在南极威德尔海发现了一些球形、椭球形和三角锥形的粪便颗粒, 粒级为30~150µm, Pasternak等(2000)在亚北极区Baisfjorden海域发现的迷你粪球的直径平均为80µm, 并怀疑它们的来源之一可能是浮游动物的粪便颗粒, 由于迷你粪球的直径相对原生动物来说太大, 推测它们可能是由桡足类幼体产生的。
通过培养实验, 有学者发现几种微型浮游动物排出的粪便颗粒也属于迷你粪球的粒径范围。砂壳纤毛虫Favella sp.和无壳纤毛虫Balanion sp.产生的粪便颗粒的大小和它们的甲藻饵料(16µm×22µm)相近, Favella sp.的粪便颗粒约为19µm×32µm, Balanion sp.产生的粪便颗粒约为18µm×24µm, 并包含1个或多个饵料细胞的残留(Stoecker, 1984)。鞭毛虫Pteridomonas danica的粪便颗粒的大小为0.2~1µm(Pelegri et al., 1999)。
在南极海冰中的甲藻产生的粪便颗粒可以集聚在海冰中, 这些粪便颗粒呈球形或椭球形, 平均直径为30µm(Buck et al., 1990)。在美国华盛顿州Dabob湾的一次硅藻水华过程中, 从布设的沉积物捕获器中可观察到甲藻的粪便颗粒, 其尺寸为83µm×69µm, 甲藻粪便对所有粪便(来自甲藻、桡足类、磷虾和海鞘)的贡献为29%(Buck and Newton, 1995)。通过分析现场的迷你粪球的丰度与微型浮游动物丰度的相关性, 可以证明这些迷你粪球是微型浮游动物产生的(Beaumont et al., 2002; Buck et al., 2005)。
2.3 微型浮游动物摄食的水流导致颗粒融合黏附在颗粒上的微型浮游动物摄食产生水流, 使得海水中颗粒之间的接触机会增加, 从而促使小颗粒融合形成更大的颗粒。附着在乳胶荧光微球上的纤毛虫Paraphysomonas imperforata可以促使水中的亚微米颗粒(submicron particles, SMP, 0.3~1µm)更快、更高效地生成微悬浮颗粒(micro-suspended particles, 5~20µm)。实验表明, 与物理过程导致的亚微米颗粒融合生成微悬浮颗粒的过程相比, 生物过程的效率更高。在近岸高生产力的水体中, 由于存在更丰富的附着生鞭毛虫和亚微米颗粒, 生物过程是导致微悬浮颗粒生成的关键机制(Fukudaand Koike, 2000, 2004)。
3 颗粒上的微食物网生物 3.1 颗粒上的细菌在表面荧光显微镜计数细菌的方法发明之后, 科学家就发现海水中的细菌有的自由生活, 有的黏附在颗粒上。用孔径为0.22µm的滤膜过滤海水, DAPI染色后在荧光显微镜下计数, 观察到在颗粒上的细菌即为黏附细菌(attached bacteria), 而在滤膜上的细菌为自由生细菌(free bacteria)(Goulder, 1976)。由于计数颗粒上的细菌时, 只能计数没有被滤膜覆盖的一面, 所以只能以颗粒两面的细菌有相同的数目为假设。Goulder还使用3µm孔径的滤膜过滤获得过滤海水(screened sample), 没有过滤的海水被称为全海水(whole water sample), 再使用0.22µm的滤膜过滤和DAPI染色法观察, 计数全海水中和过滤海水中黏附细菌和自由生细菌的丰度, 结果发现过滤海水中几乎没有黏附细菌, 即黏附细菌都在大于3µm的颗粒上, 而过滤海水中的细菌丰度会比全海水中稍高, 可能是因为在计数全海水时, 颗粒覆盖处的自由生细菌没有被计数造成的(Goulder, 1977)。用离心的方法也可以获得没有颗粒的海水, 同样发现无颗粒海水中的自由生细菌浓度比全海水中要高(Bent and Goulder, 1981)。细菌能探测到化学物质的浓度梯度, 并以每秒钟几百微米(体长的几百倍)的速度被吸引到颗粒上来, 海水中细菌丰度的数量级只有106indi./mL, 而颗粒上细菌丰度可达109indi./mL(Kiørboe and Jackson, 2001)。
颗粒黏附细菌一般比自由生细菌大, 也比自由生细菌有较高的活性。但是颗粒细菌和自由生细菌的名称只是为了区别它们的生活环境, 从类群上看, 颗粒黏附细菌和自由生细菌之间经常交换, 即颗粒上的细菌进入到水体中, 而水体中的细菌黏附到颗粒上。有些细菌可能进化出了复杂的生活方式, 既能够在颗粒上生活, 也能在水体上生活(Grossart, 2010)。颗粒黏附细菌在总细菌中的比例与颗粒物的多少、水流冲刷、颗粒物沉积和浮游动物的摄食情况有关。总的来讲, 淡水、河口和盐沼中颗粒黏附细菌所占的比例较大; 近岸和大洋海域颗粒黏附细菌所占的比例较低, 而自由生细菌所占的比例为90%以上(Unanue et al., 1992)。
细菌具体黏附在哪些颗粒上, 也是人们关心的一个重要问题。证据表明SMP上面没有细菌(Leppard, 1992; Wells and Goldberg, 1993; Schuster and Herndl, 1995)。小型聚合颗粒中, 只在TEP上发现有细菌黏附。TEP的粒级较小, 其形成的内部空间有限, 因此细菌仅能够黏附在TEP的表面。黏附在TEP表面的细菌的丰度N(indi./µm2)与TEP的球体直径d(µm)的关系表示为N=α·d-β, 其中α和β是常数, 已有研究中α和β以及细菌丰度的数值见表 1。TEP越小, 细菌的密度越高, 可能由于: (1)TEP越小, 存在的时间就越长, 因而有更多的时间让细菌黏附; (2)个体小的TEP密度较大, 有较多的营养物质供养细菌。不同海区TEP上的细菌丰度相差10倍, 例如等效球直径(equivalent spherical diameter,ESD)为5µm的TEP的细菌密度可以从0.08到0.7indi./ µm2不等。海水中TEP上黏附的细菌的总丰度占水体细菌的比例为0.5%~25%, 最大可达89%(Passow, 2002)。此外, 大型聚合颗粒(海雪)上的黏附细菌丰度(Alldredge et al., 1986; Turley and Mackie, 1994; Silver et al., 1998)、多样性(Grossart et al., 2006)也有研究, 海雪上的黏附细菌丰度通常为每个颗粒105~ 108cells, 其丰度比自由细菌高出1~2个数量级, 菌体大小也超过自由细菌, 这可能是由于颗粒提供了更适宜细菌生长的营养环境(Simon et al., 2002)。
| (单位: indi./µm2) | ||||||
| 序号 | 研究海区 | α | β | 颗粒上的细菌丰度(indi./µm2) | 文献 | |
| 5µm TEP颗粒 | 100µm TEP颗粒 | |||||
| 1 | 太平洋沿岸 | 1.36 | 0.78 | 0.39 | 0.04 | Passow and Alldredge, 1994 |
| 2 | 亚得里亚海 | 0.28 | 0.70 | 0.09 | 0.01 | Schuster and Herndl, 1995 |
| 3 | 亚得里亚海 | 0.30 | 0.82 | 0.08 | 0.007 | |
| 4 | 卡特加特海峡 时间序列 | 0.25~1.68 | 0.35~1.00 | Mari and Kiørboe, 1996 | ||
| 卡特加特海峡 水华前 | 0.26 | 0.38 | 0.14 | 0.05 | ||
| 卡特加特海峡 水华后 | 1.53 | 0.72 | 0.48 | 0.06 | ||
| 5 | 多瑙河 | 未调查 | 未调查 | 0.70 | 未调查 | Berger et al., 1996 |
| 6 | 亚得里亚海培养实验 | 0.58 | 1.06 | 0.10 | 0.004 | Schuster and Herndl, 1995 |
已有研究在聚合颗粒上观察到大量的蓝细菌(Silver and Alldredge, 1981; Silver et al., 1986; Lochte and Turley, 1988; Thiel et al., 1989; Waite et al., 2000)。其中在大西洋东北海区4500m水深处采集的聚合颗粒上, 聚球藻属蓝细菌(Synechococcus)丰度为8×106~20×106indi./mL, 大大高于表层海水(5×105indi./mL)和4500m海水(3×102indi./mL)中的数值(Lochte and Turley, 1988; Thiel et al., 1989)。在新西兰东部海区120m水深处采集的聚合颗粒上, 聚球藻蓝细菌丰度为8×108~20×108indi./mL, 在550m水深聚合颗粒上聚球藻蓝细菌为7.5×106indi./mL, 比水体中丰度高出3~5个数量级, 在下降过程中聚合颗粒上蓝细菌丰度的降低可能是由于原生动物的摄食所导致(Waite et al., 2000)。
因为微微型自养浮游生物(picophytoplankton)个体微小, 其单个个体沉降速度很低(Pedrós-Alió et al., 1989), 因此只有形成颗粒才能大量沉降。微微型自养浮游生物形成颗粒的途径有两个, 第一是被摄食后形成粪便, 第二是被有机颗粒黏着合并到有机颗粒上。Waite等(2000)利用激光共聚焦显微镜研究聚球藻属蓝细菌在聚合颗粒中的分布, 发现蓝细菌分布在颗粒的内部, 说明其主要是通过被摄食而进入到聚合颗粒中, 而不是通过颗粒黏着合并的途径。摄食蓝细菌并生成粪便颗粒的摄食者主要有4类, 包括樽海鞘(Salp)、尾海鞘(Appendiculariae)、海樽(Doliolid)和翼足类(Pteropod)等(Fortier et al., 1994)。
3.3 颗粒上的原生动物1975年, Paerl(1975)首次报道了海洋颗粒上存在原生动物。随后Caron等(1982)对颗粒上原生动物的类群和丰度展开研究, 在马尾藻海0~25m捕获的颗粒中, 鞭毛虫的丰度(3~70000cells/mL)是周围海水的1~4倍, 变形虫和纤毛虫的丰度为3~23cells/mL, 也高于周围海水。
在加利福尼亚东边界流中, 从沉积物捕获器采集到的颗粒上发现了纤毛虫, 纤毛虫可以随着下沉的颗粒沉降到2000m, 颗粒上纤毛虫的生物量远大于细菌的生物量。在真光层以下, 纤毛虫在颗粒上的丰度减少程度很低。在不同的深度有不同的类群, 表明纤毛虫并不是从表面沉降下来的, 而是本地种(Silver et al., 1984)。学者认为原生动物会探测并寻找下沉的颗粒, 然后在颗粒上附着, 在跟随颗粒下沉的同时也在颗粒上摄食和繁殖。当颗粒沉降出它们的生境时, 它们会离开颗粒, 并上升到自己生境的上层。在上升的过程中, 它们可能会搭上上升颗粒的便车(Smith et al., 1989; Toggweiler, 1989)。
变形虫的摄食主要依靠伪足的吞噬作用, 所以它们必须附着在物体表面运动和摄食, 在近岸海区, 90%以上的变形虫是附着在颗粒上的(Rogerson et al., 2003)。在 < 200µm和 > 200µm的颗粒上, 变形虫的丰度变化范围都很大, 二者丰度之间并没有显著的差异(Anderson, 2015)。
Artolozaga等(1997)利用自然海水在实验室内制造海雪, 观察原生动物在海雪上的附着和繁殖过程。海雪形成后4天, 异养鞭毛虫开始附着繁殖, 再过1天, 纤毛虫才开始繁殖。鞭毛虫的主要类群是Bodo designis和Rhynchomonas nasuta, 纤毛虫的主要类群是Uronema marinum、Euplotes vannus和Aspidisca slein (Artolozaga et al., 1997)。
进一步的研究发现, 颗粒造成了海洋小生境的多样化, 可以分为颗粒外水体、颗粒表面和颗粒内部。有些原生动物仅在颗粒外水体, 可以认为是真正自由游泳型, 例如变形虫Amoeba radiosa、鞭毛虫Paraphysomonas sp.、纤毛虫Cohnilembus punctatus、Uropedalium opisthosoma等; 有的原生动物倾向于在颗粒表面生活, 常见类群有鞭毛虫Cafeteria sp.和Bicosoeca maris, 它们从不在颗粒内部和外部水体出现; 有的原生动物类群虽然倾向于在颗粒表面生活, 但是偶尔也会出现在颗粒内部(如鞭毛虫Bodo designis、Rynchomonas nasuta、纤毛虫Euplotes vannus、Aspidisca steini)或水体中(如鞭毛虫Oxyrrhis sp.、Pseudobodo tremulans、Salpingoeca sp.和纤毛虫Uronema maridum)(Artolozaga et al., 2000)。
4 微食物网生物对颗粒的转化 4.1 细菌改造颗粒除了帮助产生颗粒, 细菌还可以对颗粒进行改造, 将颗粒有机物质转化成溶解物质, 将大颗粒分解成小颗粒。传统认识中, 黏附细菌在将颗粒降解成溶解有机碳、减少有机质的沉降通量中起主要作用, 但Cho和Azam(1988)发现自由生细菌才是颗粒降解的主要作用者, 它们消耗了沉降颗粒中的有机物, 把大的颗粒转化成小颗粒。细菌只能利用溶解态的有机碳, 因此, 颗粒中的物质首先要转化成溶解有机碳才能被细菌利用。细菌产生大量的胞外酶, 将颗粒中的多糖和蛋白等降解为溶解的小分子物质, 从而将可以沉降的颗粒转化为不沉降的溶解有机物。其中黏附细菌只使用了释放的溶解有机碳的一小部分, 大部分的溶解有机碳释放到水体中被自由生细菌利用(Kiørboe and Jackson, 2001)。
细菌还可以影响颗粒的沉降速度。聚合颗粒被细菌黏附后, 细菌在颗粒表面和内部繁殖, 消耗颗粒物质使得颗粒变小, 细菌也可以通过分泌黏性物质, 填充颗粒内部的空隙, 促进颗粒变大。随着细菌利用颗粒物质, 颗粒的骨架逐渐被细菌细胞替代, 颗粒的沉降速度也受到影响。细菌使得颗粒多孔, 从而降低了颗粒的下沉速度(Yamada et al., 2013)。
4.2 微型浮游动物摄食颗粒为了研究微型浮游动物能否摄食碎屑颗粒, 人们进行了实验室内的喂食实验。将硅藻、绿藻、桡足类和大型藻类的样品制造成不同粒级的碎屑, 并用荧光染料5-(4, 6-二氯三嗪基)氨基荧光素[5-(4, 6-dichlorotriazin-2-yl) aminofluorescein, DTAF]染色, 将荧光染色的碎屑喂食纤毛虫, 使用荧光显微镜观察到了纤毛虫体内的荧光, 进而可以确定纤毛虫摄食了碎屑颗粒(Posch and Arndt, 1996)。在实验室中用淡水鞭毛虫和纤毛虫摄食灭菌的碎屑颗粒, 所被摄食的碎屑颗粒的粒径与细菌的粒径范围相同, 实验发现碎屑颗粒能被微型浮游动物摄食, 其支撑的生长率与细菌为饵料所支撑的生长率相同, 这说明微型浮游动物可以摄食碎屑并满足其一定的营养需求(Scherwass et al., 2005)。
4.3 微型浮游动物摄食颗粒上的细菌Fenchel等在20世纪70~80年代首次提出微型浮游动物可能摄食黏附细菌(Fenchel and Jørgensen, 1977; Fenchel, 1986), 此后人们开展了多项实验(Albright et al., 1987; Caron, 1987; Artolozaga et al., 2002; Kiørboe et al., 2003, 2004; Tang et al., 2006), 证明微型浮游动物确实会摄食颗粒上的细菌。
Albright等(1987)向海藻酸钙微球上喷洒海藻酸等化学物质, 使其具备黏性, 将这些微球放入细菌培养液中, 这样细菌就在微球上生长, 将这些黏附了细菌的微球用荧光染料DTAF染色并投喂给纤毛虫, 并使用荧光显微镜观察纤毛虫体内食物泡中的细菌及荧光信号, 发现纤毛虫可以摄食黏附细菌, 对自由细菌和黏附细菌的偏好性随纤毛虫的种类而不同(Albright et al., 1987)。
Caron(1987)则将几丁质磨碎制成20~ 40µm的碎屑颗粒, 与细菌混合在一起用摇床培养6天后, 有一些细菌黏附在几丁质上成为黏附细菌。向这些培养液加入不同的鞭毛虫进行实验, 根据培养液中自由生细菌和黏附细菌的丰度的变化研究摄食情况, 发现有的鞭毛虫喜欢摄食黏附细菌, 有的偏好自由生细菌, 其偏好性与鞭毛虫的种类有关。
Artolozaga等(2002)将荧光标记细菌(fluorescently labeled bacteria, FLB)放入自然海水在滚筒(rolling tanks)中培养, FLB被包裹在大型聚合物颗粒中, 用以进行原生动物摄食实验。实验发现原生动物能够摄食黏附在颗粒上的细菌, 但其摄食率与海水中细菌的摄食率大体相当。该结果表明虽然颗粒上的细菌丰度很大, 但是由于原生动物需要花费额外努力将细菌从颗粒上分离下来, 所以无法达到高摄食率。尽管如此, 颗粒上的原生动物的丰度却比海水中高出2~4个数量级, 说明原生动物在颗粒上生活有其他的获益, 这些获益可能包括: (1)因为颗粒上的细菌丰度大大高于海水中的丰度, 所以即便原生动物从颗粒上分离细菌需要花费能量, 但是在海水中它们需要花费更多能量来寻找细菌, 两者对比, 在颗粒上摄食可能更为有利; (2)因为颗粒上的细菌非常活跃, 它们分解出超出自己使用量的溶解物质, 使颗粒周围溶解有机碳比较富集, 从而导致颗粒周围的细菌丰度进一步增大, 给在颗粒上生活的原生动物带来了额外福利(Artolozaga et al., 2002)。
5 微食物网生物的碳通量及其贡献微食物网生物的碳通量及其在碳通量中的贡献的研究方法和本文第2部分颗粒有机碳中生物的比例的研究方法类似, 不同之处在于样品来自沉积物捕获器。Taylor(1989)研究了北太平洋环流沉积物捕获器中的微食物网生物, 发现微型生物的碳通量约占6%~8%的颗粒有机碳通量, 其中硅藻和甲藻等浮游植物占的比例小于20%, 寡毛类纤毛虫占的比例(45%~79%)最大, 而细菌的比例为2.7%~ 28.6%。在真光层底部, 生命体对颗粒有机碳通量的贡献为36%, 其中微食物网生物占的比例通常大于10%, 这一比例在真光层以下逐渐减小, 在海洋中层(mesopelagic zone)为22%, 在深海(bathypelagic zone)为11%, 沉积物捕获器获得的生命体中的优势类群在不同的站位和层次也不相同(Silver and Gowing, 1991)。
微型生物造成的碳沉降有两种途径:第一是被浮游动物滤食; 第二是结合成颗粒, 自己沉降, 或被浮游动物摄食, 成为粪便沉降。传统认识中微型浮游生物个体微小, 其自身的沉降较慢, 而摄食者微型浮游动物产生的粪便也很小, 沉降也较慢, 故微型浮游动物的粪便和微型生物本身在没有沉降到底前就会被细菌等分解掉, 不能形成有效的沉降。但是Richardson和Jackson(2007)通过研究估算出小型浮游植物对生物泵的贡献和大型植物相当, 随后其他研究发现微微型浮游植物对碳通量的贡献和它们对初级生产力的贡献成正比, 与生物量的贡献没有关系(Stukel and Landry, 2010), 中型浮游动物摄食聚合颗粒才是微微型浮游植物初级生产输出的重要途径(Wilson and Steinberg, 2010; Lomas and Moran, 2011; Stukel et al., 2013)。
6 结语迄今为止, 对海洋颗粒的研究已经历了约半个世纪, 近年来随着研究手段的进步, 学者们从多角度对海洋微食物网生物与颗粒的关系开展了研究, “不同类型颗粒上的微食物网生物类群和丰度”、“微食物网生物促进颗粒的生成和转化”以及“颗粒对微食物网生物碳通量的影响”是研究热点。海洋浮游微食物网生物在海洋颗粒上丰度很高, 并能够促进颗粒的形成和沉降, 在海洋碳通量中有着重要的作用。我国在这些方面的研究才刚刚起步, 随着我国海洋浮游微食物网研究的深入, 相信这个方向的研究会迅速开展起来。
| Albright L J, Sherr E B, Sherr B F, et al. 1987. Grazing of ciliated protozoa on free and particle-attached bacteria. Marine Ecology Progress Series, 38 : 125–129 DOI:10.3354/meps038125 |
| Alldredge A L, Cole J J, Caron D A. 1986. Production of heterotrophic bacteria inhabiting macroscopic organic aggregates(marine snow) from surface waters. Limnology and Oceanography, 31 (1) : 68–78 DOI:10.4319/lo.1986.31.1.0068 |
| Alldredge A L, Passow U, Logan B E. 1993. The abundance and significance of a class of large, transparent organic particles in the ocean. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 40 (6) : 1131–1140 DOI:10.1016/0967-0637(93)90129-Q |
| Anderson O R. 2015. Particle-associated planktonic naked amoebae in the Hudson Estuary: size-fraction related densities, cell sizes and estimated carbon content. Acta Protozoologica, 50 (1) : 15–22 |
| Artolozaga I, Ayo B, Latatu A, et al. 2000. Spatial distribution of protists in the presence of macroaggregates in a marine system. FEMS Microbiology Ecology, 33 (3) : 191–196 DOI:10.1111/fem.2000.33.issue-3 |
| Artolozaga I, Santamaría E, López A, et al. 1997. Succession of bacterivorous protists on laboratory-made marine snow. Journal of Plankton Research, 19 (10) : 1429–1440 DOI:10.1093/plankt/19.10.1429 |
| Artolozaga I, Valcárcel M, Ayo B, et al. 2002. Grazing rates of bacterivorous protists inhabiting diverse marine planktonic microenvironments. Limnology and Oceanography, 47 (1) : 142–150 DOI:10.4319/lo.2002.47.1.0142 |
| Azam F, Smith D C, Steward G F, et al. 1993. Bacteria-organic matter coupling and its significance for oceanic carbon cycling. Microbial Ecology, 28 (2) : 167–179 |
| Azam F. 1998. Microbial control of oceanic carbon flux: the plot thickens. Science, 280 (5364) : 694–696 DOI:10.1126/science.280.5364.694 |
| Barber R T. 1966. Interaction of bubbles and bacteria in the formation of organic aggregates in sea-water. Nature, 211 (5046) : 257–258 DOI:10.1038/211257a0 |
| Beaumont K L, Nash G V, Davidson A T. 2002. Ultrastructure, morphology and flux of microzooplankton faecal pellets in an east Antarctic fjord. Marine Ecology Progress Series, 245 : 133–148 DOI:10.3354/meps245133 |
| Benner R, Pakulski J D, McCarthy M, et al. 1992. Bulk chemical characteristics of dissolved organic matter in the ocean. Science, 255 (5051) : 1561–1564 DOI:10.1126/science.255.5051.1561 |
| Bent E J, Goulder R. 1981. Planktonic bacteria in the Humber Estuary; seasonal variation in population density and heterotrophic activity. Marine Biology, 62 (1) : 35–45 DOI:10.1007/BF00396949 |
| Berger B, Hoch B, Kavka G, et al. 1996. Bacterial colonization of suspended solids in the River Danube. Aquatic Microbial Ecology, 10 (1) : 37–44 |
| Biddanda B A. 1985. Microbial synthesis of macroparticulate matter. Marine Ecology Progress Series, 20 (3) : 241–251 |
| Buck K R, Bolt P A, Garrison D L. 1990. Phagotrophy and fecal pellet production by an athecate dinoflagellate in Antarctic sea ice. Marine Ecology Progress Series, 60 : 75–84 DOI:10.3354/meps060075 |
| Buck K R, Newton J. 1995. Fecal pellet flux in Dabob Bay during a diatom bloom: contribution of microzooplankton. Limnology and Oceanography, 40 (2) : 306–315 DOI:10.4319/lo.1995.40.2.0306 |
| Buck K, Marin R, Chavez F. 2005. Heterotrophic dinoflagellate fecal pellet production: grazing of large, chain-forming diatoms during upwelling events in Monterey Bay, California. Aquatic Microbial Ecology, 40 (3) : 293–298 |
| Caron D A. 1987. Grazing of attached bacteria by heterotrophic microflagellates. Microbial Ecology, 13 (3) : 203–218 DOI:10.1007/BF02024998 |
| Caron D A, Dam H G, Kremer P, et al. 1995. The contribution of microorganisms to particulate carbon and nitrogen in surface waters of the Sargasso Sea near Bermuda. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 42 (6) : 943–972 DOI:10.1016/0967-0637(95)00027-4 |
| Caron D A, Davis P G, Madin L P, et al. 1982. Heterotrophic bacteria and bacterivorous protozoa in oceanic macroaggregates. Science, 218 (4574) : 795–797 DOI:10.1126/science.218.4574.795 |
| Cho B C, Azam F. 1988. Major role of bacteria in biogeochemical fluxes in the ocean's interior. Nature, 332 (6163) : 441–443 DOI:10.1038/332441a0 |
| Ding Y X, Chin W C, Rodriguez A, et al. 2008. Amphiphilic exopolymers from Sagittula stellata induce DOM self-assembly and formation of marine microgels. Marine Chemistry, 112 (1-2) : 11–19 DOI:10.1016/j.marchem.2008.05.003 |
| Fenchel T M, Jørgensen B B, 1977. Detritus food chains of aquatic ecosystems: the role of bacteria. In: Marshall K C, ed. Advances in Microbial Ecology. Boston, MA: Springer, 1-58 |
| Fenchel T, 1986. The ecology of heterotrophic microflagellates. In: Marshall K C, ed. Advances in Microbial Ecology. Boston, MA: Springer, 57-97 |
| Fortier L, Le Fèvre J, Legendre L. 1994. Export of biogenic carbon to fish and to the deep ocean: the role of large planktonic microphages. Journal of Plankton Research, 16 (7) : 809–839 DOI:10.1093/plankt/16.7.809 |
| Fukuda H, Koike I. 2000. Feeding currents of particle-attached nanoflagellates-a novel mechanism for aggregation of submicron particles. Marine Ecology Progress Series, 202 : 101–112 DOI:10.3354/meps202101 |
| Fukuda H, Koike I. 2004. Microbial stimulation of the aggregation process between submicron-sized particles and suspended particles in coastal waters. Aquatic Microbial Ecology, 37 (1) : 63–73 |
| Gärdes A, Iversen M H, Grossart H P, et al. 2011. Diatom-associated bacteria are required for aggregation of Thalassiosira weissflogii. The ISME Journal, 5 (3) : 436–445 DOI:10.1038/ismej.2010.145 |
| Gärdes A, Ramaye Y, Grossart H P, et al. 2012. Effects of Marinobacter adhaerens HP15 on polymer exudation by Thalassiosira weissflogii at different N: P ratios. Marine Ecology Progress Series, 461 : 1–14 DOI:10.3354/meps09894 |
| Goulder R. 1976. Relationships between suspended solids and standing crops and activities of bacteria in an estuary during a neap-spring-neap tidal cycle. Oecologia, 24 (1) : 83–90 DOI:10.1007/BF00545489 |
| Goulder R. 1977. Attached and free bacteria in an estuary with abundant suspended solids. Journal of Applied Microbiology, 43 (3) : 399–405 |
| Gowing M M, Garrison D L, Kunze H B, et al. 2001. Biological components of Ross Sea short-term particle fluxes in the austral summer of 1995-1996. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 48 (12) : 2645–2671 DOI:10.1016/S0967-0637(01)00034-6 |
| Gowing M M, Silver M W. 1985. Minipellets: a new and abundant size class of marine fecal pellets. Journal of Marine Research, 43 (2) : 395–418 DOI:10.1357/002224085788438676 |
| Grossart H P. 2010. Ecological consequences of bacterioplankton lifestyles: changes in concepts are needed. Environmental Microbiology Reports, 2 (6) : 706–714 DOI:10.1111/emi4.2010.2.issue-6 |
| Grossart H P, Kiørboe T, Tang K W, et al. 2006. Interactions between marine snow and heterotrophic bacteria: aggregate formation and microbial dynamics. Aquatic Microbial Ecology, 42 : 19–26 DOI:10.3354/ame042019 |
| Gundersen K, Orcutt K M, Purdie D A, et al. 2001. Particulate organic carbon mass distribution at the Bermuda Atlantic Time-series Study(BATS) site. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 48 (8-9) : 1697–1718 DOI:10.1016/S0967-0645(00)00156-9 |
| Isao K, Hara S, Terauchi K, et al. 1990. Role of sub-micrometre particles in the ocean. Nature, 345 (6272) : 242–244 DOI:10.1038/345242a0 |
| Kawasaki N, Sohrin R, Ogawa H, et al. 2011. Bacterial carbon content and the living and detrital bacterial contributions to suspended particulate organic carbon in the North Pacific Ocean. Aquatic Microbial Ecology, 62 (2) : 165–176 DOI:10.3354/ame01462 |
| Kiørboe T, Grossart H P, Ploug H, et al. 2004. Particle-associated flagellates: swimming patterns, colonization rates, and grazing on attached bacteria. Aquatic Microbial Ecology, 35 : 141–152 DOI:10.3354/ame035141 |
| Kiørboe T, Jackson G A. 2001. Marine snow, organic solute plumes, and optimal chemosensory behavior of bacteria. Limnology and Oceanography, 46 (6) : 1309–1318 DOI:10.4319/lo.2001.46.6.1309 |
| Kiørboe T, Tang K, Grossart H P, et al. 2003. Dynamics of microbial communities on marine snow aggregates: colonization, growth, detachment, and grazing mortality of attached bacteria. Applied and Environmental Microbiology, 69 (6) : 3036–3047 DOI:10.1128/AEM.69.6.3036-3047.2003 |
| Kirchman D L, Keel R G, Simon M, et al. 1993. Biomass and production of heterotrophic bacterioplankton in the oceanic subarctic Pacific. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 40 (5) : 967–988 DOI:10.1016/0967-0637(93)90084-G |
| Kwon E Y, Primeau F, Sarmiento J L. 2009. The impact of remineralization depth on the air-sea carbon balance. Nature Geoscience, 2 (9) : 630–635 DOI:10.1038/ngeo612 |
| Leppard G G. 1992. Size, morphology and composition of particulates in aquatic ecosystems: solving speciation problems by correlative electron microscopy. Analyst, 117 (3) : 595–603 DOI:10.1039/an9921700595 |
| Lochte K, Turley C M. 1988. Bacteria and cyanobacteria associated with phytodetritus in the deep sea. Nature, 333 (6168) : 67–69 DOI:10.1038/333067a0 |
| Lomas M W, Moran S B. 2011. Evidence for aggregation and export of cyanobacteria and nano-eukaryotes from the Sargasso Sea euphotic zone. Biogeosciences, 8 (1) : 203–216 DOI:10.5194/bg-8-203-2011 |
| Long R A, Azam F. 1996. Abundant protein-containing particles in the sea. Aquatic Microbial Ecology, 10 : 213–221 DOI:10.3354/ame010213 |
| Mari X, Kiørboe T. 1996. Abundance, size distribution and bacterial colonization of transparent exopolymeric particles (TEP) during spring in the Kattegat. Journal of Plankton Research, 18 (6) : 969–986 DOI:10.1093/plankt/18.6.969 |
| Mostajir B, Dolan J R, Rassoulzadegan F. 1995. Seasonal variations of pico-and nano-detrital particles (DAPI Yellow Particles, DYP) in the Ligurian Sea (NW Mediterranean). Aquatic Microbial Ecology, 9 (3) : 267–277 |
| Nöthig E M, Von Bodungen B. 1989. Occurrence and vertical flux of faecal pellets of probably protozoan origin in the southeastern Weddell Sea(Antarctica). Marine Ecology Progress Series, 56 : 281–289 DOI:10.3354/meps056281 |
| Paerl H W. 1975. Microbial attachment to particles in marine and freshwater ecosystems. Microbial Ecology, 2 (1) : 73–83 DOI:10.1007/BF02010382 |
| Passow U. 2002. Transparent exopolymer particles (TEP) in aquatic environments. Progress in Oceanography, 55 (3-4) : 287–333 DOI:10.1016/S0079-6611(02)00138-6 |
| Passow U, Alldredge A. 1994. Distribution, size and bacterial colonization of transparent exopolymer particles (TEP) in the ocean. Marine Ecology Progress Series, 113 : 185–198 DOI:10.3354/meps113185 |
| Pasternak A, Arashkevich E, Riser C W, et al. 2000. Seasonal variation in Zooplankton and suspended faecal pellets in the subarctic Norwegian Baisfjorden, in 1996. Sarsia, 85 (5-6) : 439–452 DOI:10.1080/00364827.2000.10414593 |
| Pedrós-Alió C, Mas J, Gasol J M, et al. 1989. Sinking speeds of free-living phototrophic bacteria determined with covered and uncovered traps. Journal of Plankton Research, 11 (5) : 887–905 DOI:10.1093/plankt/11.5.887 |
| Pelegri S, Christaki U, Dolan J, et al. 1999. Particulate and dissolved organic carbon production by the heterotrophic nanoflagellate Pteridomonas danica Patterson and Fenchel. Microbial Ecology, 37 (4) : 276–284 DOI:10.1007/s002489900150 |
| Pomeroy L R, 1980. Detritus and its role as a food source. In: Barnes R, Mann K, eds. Fundamentals of Aquatic Ecosystems. London: Blackwell Scientific Publications, 84-102 |
| Posch T, Arndt H. 1996. Uptake of sub-micrometre-and micrometre-sized detrital particles by bacterivorous and omnivorous ciliates. Aquatic Microbial Ecology, 10 (1) : 45–53 |
| Richardson T L, Jackson G A. 2007. Small phytoplankton and carbon export from the surface ocean. Science, 315 (5813) : 838–840 DOI:10.1126/science.1133471 |
| Riley G A. 1963. Organic aggregates in seawater and the dynamics of their formation and utilization. Limnology and Oceanography, 8 (4) : 372–381 DOI:10.4319/lo.1963.8.4.0372 |
| Rogerson A, Anderson O R, Vogel C. 2003. Are planktonic naked amoebae predominately floc associated or free in the water column?. Journal of Plankton Research, 25 (11) : 1359–1365 DOI:10.1093/plankt/fbg102 |
| Roman M R, Caron D A, Kremer P, et al. 1995. Spatial and temporal changes in the partitioning of organic carbon in the plankton community of the Sargasso Sea off Bermuda. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 42 (6) : 973–992 DOI:10.1016/0967-0637(95)00028-5 |
| Scherwass A, Fischer Y, Arndt H. 2005. Detritus as a potential food source for protozoans: utilization of fine particulate plant detritus by a heterotrophic flagellate, Chilomonas paramecium, and a ciliate, Tetrahymena pyriformis. Aquatic Ecology, 39 (4) : 439–445 DOI:10.1007/s10452-005-9012-4 |
| Schuster S, Herndl G J. 1995. Formation and significance of transparent exopolymeric particles in the northern Adriatic Sea. Marine Ecology Progress Series, 124 : 227–236 DOI:10.3354/meps124227 |
| Schuster S, Herndl G J. 1995. Formation and significance of transparent exopolymeric particles in the northern Adriatic Sea. Marine Ecology Progress Series, 124 : 227–236 DOI:10.3354/meps124227 |
| Schuster S, Herndl G J. 1995. Formation and significance of transparent exopolymeric particles in the northern Adriatic Sea. Marine Ecology Progress Series, 124 : 227–236 DOI:10.3354/meps124227 |
| Silver M W, Alldredge A L. 1981. Bathypelagic marine snow: deep-sea algal and detrital community. Journal of Marine Research, 39 : 501–530 |
| Silver M W, Coale S L, Pilskaln C H, et al. 1998. Giant aggregates: Importance as microbial centers and agents of material flux in the mesopelagic zone. Limnology and Oceanography, 43 (3) : 498–507 DOI:10.4319/lo.1998.43.3.0498 |
| Silver M W, Gowing M M. 1991. The "particle" flux: origins and biological components. Progress in Oceanography, 26 (1) : 75–113 DOI:10.1016/0079-6611(91)90007-9 |
| Silver M W, Gowing M M, Brownlee D C, et al. 1984. Ciliated protozoa associated with oceanic sinking detritus. Nature, 309 (5965) : 246–248 DOI:10.1038/309246a0 |
| Silver M W, Gowing M M, Davoll P J. 1986. The association of photosynthetic picoplankton and ultraplankton with pelagic detritus through the water column (0-2000 m). Canadian Bulletin of Fisheries and Aquatic Sciences, 214 : 311–341 |
| Simon M, Grossart H P, Schweitzer B, et al. 2002. Microbial ecology of organic aggregates in aquatic ecosystems. Aquatic Microbial Ecology, 28 (2) : 175–211 |
| Smith K L, Williams P M, Druffel E R M. 1989. Upward fluxes of particulate organic matter in the deep North Pacific. Nature, 337 (6209) : 724–726 DOI:10.1038/337724a0 |
| Stoderegger K E, Herndl G J. 1998. Production and release of bacterial capsular material and its subsequent utilization by marine bacterioplankton. Limnology and Oceanography, 43 (5) : 877–884 DOI:10.4319/lo.1998.43.5.0877 |
| Stoderegger K E, Herndl G J. 1999. Production of exopolymer particles by marine bacterioplankton under contrasting turbulence conditions. Marine Ecology Progress Series, 189 : 9–16 DOI:10.3354/meps189009 |
| Stoecker D K. 1984. Particle production by planktonic ciliates. Limnology and Oceanography, 29 (5) : 930–940 DOI:10.4319/lo.1984.29.5.0930 |
| Stukel M R, Décima M, Selph K E, et al. 2013. The role of Synechococcus in vertical flux in the Costa Rica upwelling dome. Progress in Oceanography, 112-113 : 49–59 DOI:10.1016/j.pocean.2013.04.003 |
| Stukel M R, Landry M R. 2010. Contribution of picophytoplankton to carbon export in the equatorial Pacific: A reassessment of food web flux inferences from inverse models. Limnology and Oceanography, 55 (6) : 2669–2685 DOI:10.4319/lo.2010.55.6.2669 |
| Sugimoto K, Fukuda H, Baki M A, et al. 2007. Bacterial contributions to formation of transparent exopolymer particles(TEP) and seasonal trends in coastal waters of Sagami Bay, Japan. Aquatic Microbial Ecology, 46 : 31–41 DOI:10.3354/ame046031 |
| Suzuki N, Kato K. 1953. Studies on suspended materials marine snow in the sea: Part Ⅰ. sources of marine snow. Bulletin of The Faculty of Fisheries Hokkaido University, 4 (2) : 132–137 |
| Tang K W, Grossart H P, Yam E M, et al. 2006. Mesocosm study of particle dynamics and control of particle-associated bacteria by flagellate grazing. Marine Ecology Progress Series, 325 : 15–27 DOI:10.3354/meps325015 |
| Taylor G T. 1989. Variability in the vertical flux of microorganisms and biogenic material in the epipelagic zone of a North Pacific central gyre station. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 36 (9) : 1287–1308 DOI:10.1016/0198-0149(89)90084-8 |
| Thiel H, Pfannkuche O, Schriever G, et al. 1989. Phytodetritus on the deep-sea floor in a central oceanic region of the Northeast Atlantic. Biological Oceanography, 6 (2) : 203–239 |
| Toggweiler J R. 1989. Are rising and falling particles microbial elevators?. Nature, 337 (6209) : 691–692 |
| Turley C M, Mackie P J. 1994. Biogeochemical significance of attached and free-living bacteria and the flux of particles in the NE Atlantic Ocean. Marine Ecology Progress Series, 115 : 191–203 DOI:10.3354/meps115191 |
| Unanue M, Ayo B, Azúa I, et al. 1992. Temporal variability of attached and free-living bacteria in coastal waters. Microbial Ecology, 23 (1) : 27–39 DOI:10.1007/BF00165905 |
| Verdugo P. 2012. Marine microgels. Annual Review of Marine Science, 4 (1) : 375–400 DOI:10.1146/annurev-marine-120709-142759 |
| Verdugo P, Alldredge A L, Azam F, et al. 2004. The oceanic gel phase: a bridge in the DOM-POM continuum. Marine Chemistry, 92 (1-4) : 67–85 DOI:10.1016/j.marchem.2004.06.017 |
| Verity P G, Williams S C, Hong Y. 2000. Formation, degradation, and mass: volume ratios of detritus derived from decaying phytoplankton. Marine Ecology Progress Series, 207 : 53–68 DOI:10.3354/meps207053 |
| Waite A M, Safi K A, Hall J A, et al. 2000. Mass sedimentation of picoplankton embedded in organic aggregates. Limnology and Oceanography, 45 (1) : 87–97 DOI:10.4319/lo.2000.45.1.0087 |
| Wells M L, Goldberg E D. 1993. Colloid aggregation in seawater. Marine Chemistry, 41 (4) : 353–358 DOI:10.1016/0304-4203(93)90267-R |
| Wilson S E, Steinberg D K. 2010. Autotrophic picoplankton in mesozooplankton guts: evidence of aggregate feeding in the mesopelagic zone and export of small phytoplankton. Marine Ecology Progress Series, 412 : 11–27 DOI:10.3354/meps08648 |
| Yamada Y, Fukuda H, Inoue K, et al. 2013. Effects of attached bacteria on organic aggregate settling velocity in seawater. Aquatic Microbial Ecology, 70 (3) : 261–272 DOI:10.3354/ame01658 |
| Yamada Y, Fukuda H, Tada Y, et al. 2016. Bacterial enhancement of gel particle coagulation in seawater. Aquatic Microbial Ecology, 77 (1) : 11–22 DOI:10.3354/ame01784 |
| Yamasaki A, Fukuda H, Fukuda R, et al. 1998. Submicrometer particles in northwest Pacific coastal environments: Abundance, size distribution, and biological origins. Limnology and Oceanography, 43 (3) : 536–542 DOI:10.4319/lo.1998.43.3.0536 |
| Zetsche E M, Ploug H. 2015. Marine chemistry special issue: Particles in aquatic environments: From invisible exopolymers to sinking aggregates. Marine Chemistry, 175 : 1–4 DOI:10.1016/j.marchem.2015.04.008 |
 2017, Vol.
2017, Vol. 


