
中国科学院海洋研究所主办。
文章信息
- 郑珊, 孙晓霞. 2017.
- ZHENG Shan, SUN Xiao-Xia. 2017.
- 沙海蜇(Nemopilema nomurai)代谢及分解过程对水环境理化因子及浮游植物影响的研究
- Studies on Phytoplankton Dynamics during Metabolism and Decomposition of Jellyfish Nemopilema nomurai
- 海洋科学集刊(52): 35-46
- Studia Marina Sinica(52): 35-46.
- http://dx.doi.org/10.12036/hykxjk20170804001
-
文章历史
- 收稿日期:2017-08-04
- 收修改稿日期:2017-08-21
2. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室, 青岛 266071;
3. 中国科学院大学, 北京 100049
2. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
近年来, 在全球变化和人类活动的影响下, 全球海域水母数量剧增, 水母暴发的现象越来越严重(Purcell et al., 2007)。自20世纪90年代起, 我国东海北部和黄海海域连年在夏季发生大型水母暴发的现象, 形成暴发的水母种类主要有沙海蜇(Nemopilema nomurai)、白色霞水母(Cyanea nozakii)、海月水母(Aurelia aurita)和多管水母(Aequorea sp.)等(程家骅等, 2005; 丁峰元和程家骅, 2005; 王世伟等, 2011; zhang et al., 2012)。其中, 以沙海蜇暴发次数最多, 影响范围也最为广泛(程家骅等, 2005)。
沙海蜇属于刺胞动物门(Cnidari)、钵水母纲(Scyphozoa)、根口水母目(Rhizostomeae)、根口水母科(Rhizostomidae)、Nemopilema属(Kishinouye, 1922), 广泛分布于西北太平洋沿岸海域。沙海蜇是水母类个体最大的种类之一, 成体最大伞径接近2m, 湿重高达300kg(Omori and Kitamura, 2004)。沙海蜇的暴发性增殖能够改变近海生态系统的结构和功能, 对渔业生产活动以及渔业资源的可持续发展有重大影响(Lynam et al., 2005; Uye, 2008; Pauly et al., 2009; 董婧等, 2012)。一方面, 沙海蜇摄食浮游动物, 是与鱼类争夺食物来源的有利竞争对手, 还能直接摄食鱼卵仔鱼, 从而对海洋生态系统中的浮游生物群落结构和鱼类的数量存在调控作用(Båmstedt et al., 1994, 1999; Purcell, 1997)。另一方面, 沙海蜇暴发形成大规模种群的同时也积累了大量的生物量, 因此也积累了大量的有机物。通过沙海蜇自身的代谢活动, 代谢产物会源源不断地释放到水体中。当沙海蜇种群消亡时, 积累的有机物通过分解作用在短时间内被释放入生态系统进行再循环(Titelman et al., 2006; West et al., 2009; 宋金明等, 2012; 李学刚等, 2012)。
沙海蜇可以通过摄食浮游动物从而调控浮游动物对浮游植物的摄食压力(下行控制), 最终影响与调控浮游植物生物量和群落结构, 对生态系统造成重要的影响(Sun et al., 2011)。当沙海蜇大量出现甚至暴发时, 沙海蜇通过摄食浮游动物减轻了浮游动物对浮游植物的摄食压力, 因此可能导致浮游植物数量增加, 在短期形成藻华。Lindahl等(1983)认为, 在瑞典西海岸, 水母类的迅速增加导致整个生态系统中的食物网结构发生了变化, 可能是引起该海区赤潮形成的一个重要原因。
另外, 水母在新陈代谢过程中能释放大量营养盐, 刺激浮游植物生长甚至引起藻华的发生。更为严重的是, 水母暴发后, 大量水母死亡并分解, 释放出大量有机物和无机物, 极大程度上刺激了浮游植物的增殖和暴发。藻华发生也为生态系统带来了严重的影响。同时, 大量的营养盐释放改变了原有的营养盐结构, 营养盐限制情况被加剧或彻底改变。营养盐结构的变化则会导致浮游植物的群落结构和组成发生变化。水母在分解过程中氮(nitrogen, N)和磷(phosphorus, P)的大量释放, 可以使海水中的硅氮比(Si/N)和硅磷比(Si/P)下降, 可能限制了硅藻的生长而有助于有害鞭毛藻的生长, 从而使近岸水体的富营养化加剧(Officer, 1980)。
Kremer(1977)对栉水母(Mnemiopsis leidyi)的代谢产物的比例研究表明, 在其代谢产物中, 溶解有机碳(dissolved organic carbon, DOC)占了含碳代谢产物的38%, 溶解有机氮(dissolved organic nitrogen, DON)占含氮代谢产物的46%, 溶解有机磷(dissolved organic phosphorus, DOP)占含磷代谢产物的28%。水螅水母(Cladonema californicum)的含氮代谢产物中, DON的比例大约为50%(Costello, 1991)。但是实验处理过程可能导致水母分泌黏液增加, 因此会人为地增加有机成分比例(Kremer, 1977)。Shimauchi和Uye(2007)并未在海月水母的代谢产物中检测到有机N和P的存在。
常见的无机代谢产物主要为铵盐和尿素。其中, 尿素是甲壳类等浮游动物的主要代谢产物(Miller and Glibert, 1998), 但是在水母的代谢产物中, 尿素的含量可以忽略不计(Kremer, 1975); 铵盐是主要无机氮产物(Kremer, 1982; Matsakis, 1992; Nemazie et al., 1993)。水母的铵盐代谢速率为77~2639μmol NH4+g/C·d(Schneider, 1990)。除了铵之外, 水母也释放出少量氮氧化物(NOx), 大约占所有释放的DIN的2%以下(Welsh and Castadelli, 2004; Southwell et al., 2008)。
P相比于N占水母元素相对构成比例较低, 其代谢量相对较少, 但是磷酸盐仍是重要的无机代谢产物, 对于水体中的磷循环有重要的补充作用。根据发表的数据, 海月水母代谢产物N:P摩尔比为6.9~11.4(Schneider, 1989; Shimauchi and Uye, 2007), 马赛克水母(Catostylus mosaicus)为8.7(Pitt et al., 2009), 栉水母为7.4(Kremer, 1975)。可见, 在水母的代谢产物中, N:P摩尔比均低于Redfield值16:1(Redfield et al., 1963)。
由于沙海蜇体型巨大, 常常分布于次表层水体, 不易于捕捉活体, 因此对沙海蜇的活体代谢特征研究尚无报道。关于沙海蜇消亡的研究多集中于实验室内模拟沙海蜇消亡过程环境参数的变化(宋金明等, 2012; 李学刚等, 2012; 马清霞等, 2012; 曲长凤等, 2016), 缺乏现场围隔实验的报道, 特别是针对沙海蜇消亡对浮游植物变化影响的研究。本文以沙海蜇为研究对象, 依托于水母973航次, 进行了沙海蜇代谢与分解现场实验, 探讨了沙海蜇代谢与死亡分解过程中水体pH、DO、营养盐的动态变化以及对浮游植物的影响。这对探讨水母暴发及消亡过程机制以及生态效应有重要的参考价值。
1 材料与方法 1.1 采样站位依托国家973计划“中国近海水母暴发的关键过程、机理及生态环境效应”, 于2012年6月搭载“北斗号”调查船, 在黄、东海海域进行了大面调查观测, 调查站位如图 1所示。以往调查结果显示, Ⅰ断面为沙海蜇高发断面, 因此在Ⅰ断面选取沙海蜇生物量高的站位Ⅰ3(23.00°N, 123.00°E)进行现场实验。
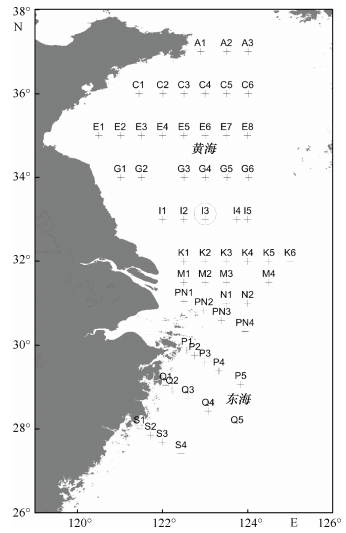
|
| 图 1 调查站位图(圈注Ⅰ3站为现场实验站位) Fig. 1 Sampling stations in the study area |
现场实验用的沙海蜇选自Ⅰ3站位手抄网(网口直径500mm, 网孔径10mm)获得的体型完整、大小接近且活动状态良好的个体, 平均伞径和湿重分别为(250.0±10.0)mm和(0.72±0.11)kg。实验所用的海水取自Ⅰ3站位的表层, 在实验开始之前用200μm筛绢过滤去除掉大型浮游动物。
1.3 实验方法 1.3.1 沙海蜇的代谢实验采用容积65L的白色塑料圆桶(直径480mm, 高480mm), 每个圆桶中加入50L处理过的海水和沙海蜇。为了保证正常的光照, 所有圆桶均不做遮挡处理。
实验共设置2个处理: (1)空白对照组, 不加沙海蜇); (2)实验组, 所加沙海蜇湿重为(0.720±0.110)kg。每个处理设置3个重复。实验持续24h, 培养过程中以流动海水控制水温, 平均温度为(22±1)℃。
从培养开始计时, 分别于0、4、8、12和24h测定水体中的溶解氧(dissolved oxygen, DO)和pH。叶绿素a(chlorophyll a, chl a)和营养盐的采集、保存及测定均依照海洋调查规范(GB12763.6-2007)(国家技术监督局)进行。另取出150mL水样以鲁格氏碘液固定后用于浮游植物镜检。
沙海蜇代谢过程中DIN和DIP的平均释放速率根据以下公式计算:
式中, Ct为采样时水体中DIN(或DIP)的浓度(μmol/L), C0为实验开始时DIN(或DIP)的初始浓度(μmol/L), V为采样时的水体体积(L), G为水母的质量(kg), t为实验时间(h)。
1.3.2 沙海蜇的分解实验将体型大小接近状态良好的沙海蜇进行死亡处理后, 用于实验。实验共设置3个处理: (1)空白对照组, 不加沙海蜇; (2)实验组A, 所加入沙海蜇湿重为(0.320±0.050)kg; (3)实验组B, 所加入沙海蜇湿重为(0.605±0.105)kg。每个处理设置3个重复。实验持续12天, 培养过程中温度为(22±1)℃。
从培养开始计时, 分别于0、4、8、12、24、48、72、96、120、168和360h测定水体中的溶解氧DO和pH。温度、DO和pH采用手提式多参数测试仪(Multi 340i, WTW公司, 德国)现场测定。chl a和营养盐的采集、保存及测定均依照海洋调查规范(GB12763.6-2007) (国家技术监督局)进行。另取出150mL水样以鲁格氏碘液固定后用于浮游植物镜检。
2 结果 2.1 沙海蜇代谢对理化因子与浮游植物的影响 2.1.1 对海水中DO和pH的影响如图 2所示, 整个实验过程中, 对照组的DO和pH几乎无变化。统计检验结果表明, 实验组的DO变化与对照组有极显著差异(P < 0.01), 实验组的pH变化与对照组有显著差异(P < 0.05)。实验组的DO从开始就出现明显的下降, 24h后下降至1.43mg/L; 实验组的pH从开始就出现明显的下降, 24h后下降至7.88, 比实验开始时下降了0.61。这说明沙海蜇在代谢过程中大量消耗海水中的溶解氧, 使水体出现低氧现象。通过计算得出沙海蜇的耗氧率(oxygen consumption rate, OCR)为9.64mgO2/ (kgWW·h), 其中WW代表湿重(wet weight)。另外, 沙海蜇代谢使海水出现酸化现象。计算得出, 24h内DIN的平均释放速率为683.07μmol/(kg·h), NH4+-N占DIN的86.5%以上, DIP的平均释放速率为49.06μmol/ (kgWW·h)。
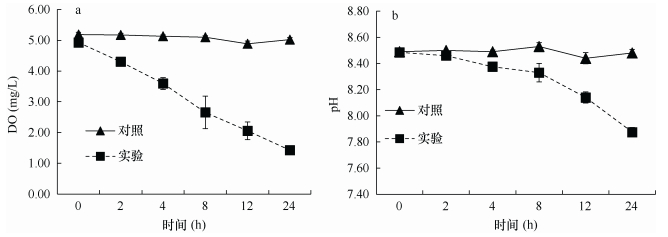
|
| 图 2 沙海蜇代谢中海水中溶解氧(DO, mg/L)(a)和pH(b)的变化 Fig. 2 Variations of DO (mg/L) (a) and pH (b) in seawater during the metabolism of Nemopilema nomurai |
从图 3可以看出, 沙海蜇在代谢过程中释放出大量DIN(NH4+-N与NOx-N的总和)和DIP (PO43–-P), 对水体有显著的富营养化作用。实验进行到24h时, 实验组的DIN浓度高达251.13μmol/L, DIP浓度也达到16.89μmol/L。
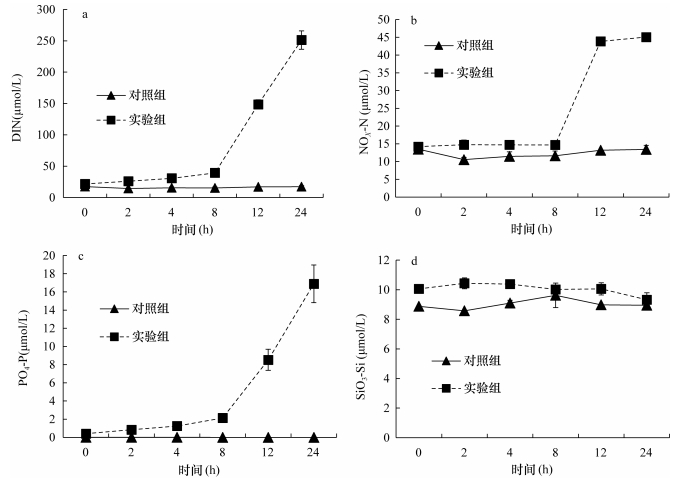
|
| 图 3 沙海蜇代谢过程海水中DIN、DIP和SiO3-Si的变化(单位: μmol/L) Fig. 3 Variations of DIN, DIP and SiO3-Si in seawater during the metabolism of N. nomurai (unit: μmol/L) 注: a. NH4-N, b. NOx-N, c. PO4-P, d. SiO3-Si |
由于海水中的磷酸盐含量很低, 整个实验过程中空白对照组的N/P比大于100, 远大于Redfield值16:1, Si/N比约为0.5, 小于1:1, 营养盐结构比例失衡, 水体处于严重的磷限制。由图 4可见, 沙海蜇代谢释放出大量N和P, 使海水中的营养盐结构发生了显著的变化。N/P比由最初的56.2:1逐渐下降至14.93:1。由于水体中DIN的含量显著增加, 硅酸盐并未发生明显变化, 因此Si/N比显著下降, 表现为硅限制加剧。
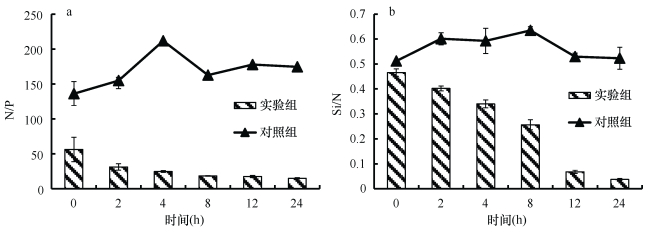
|
| 图 4 沙海蜇代谢过程海水中N/P比(a)和Si/N比(b)的变化 Fig. 4 Variations of N/P ratio (a) and Si/N ratio (b) in seawater during the metabolism of N. nomurai |
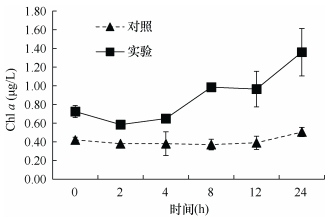
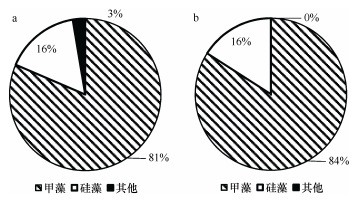
如图 5所示, 水体中的chl a浓度表现为上升, 由实验开始的0.73μg/L升至1.36μg/L。浮游植物水样的镜检结果显示(图 6), 甲藻丰度较高(占80%以上), 优势种为东海原甲藻(Prorocentrum donghaiense)、亚历山大藻(Alexandrium sp.)和锥状斯氏藻(Scrippsiella trochoidea)等。但在实验前后, 甲藻和硅藻的丰度和比例并没有明显变化(P > 0.05)。
|
| 图 5 沙海蜇代谢过程海水中chl a浓度(μg/L)的变化 Fig. 5 Variations of chl a (μg/L) in seawater during the metabolism of N. nomurai |
|
| 图 6 沙海蜇代谢过程中甲藻和硅藻的丰度(×103cell/L)变化 Fig. 6 The abundance of dinoflagellates and diatoms (×103cell/L) during the metabolism of N. nomurai |
实验开始后的2天内, 沙海蜇并无明显变化, 水体逐渐变浑浊。2天后, 沙海蜇的个体开始破碎, 水体中出现沙海蜇碎片, 且水体越来越浑浊, 颜色逐渐变成棕色并散发出恶臭。实验组A中沙海蜇量相对较少, 5天以后观察不到沙海蜇碎片, 表示沙海蜇完全分解, 此时恶臭减弱, 水体颜色变浅; 到第7天时水体变绿, 圆桶内壁上也覆盖了一层绿色。实验组B放入的沙海蜇量相对较多, 完全分解的时间比A组长, 在第7天时分解完全, 第12天时水体也变为绿色。
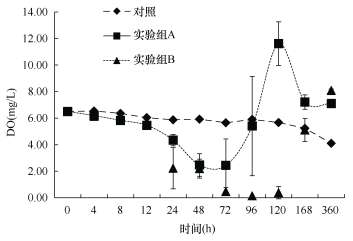
2.2.2 海水DO的变化实验过程中, 沙海蜇的分解使海水中DO出现剧烈变化。实验开始时海水的DO为6.50mg/L。从图 7可知, 对照组的DO变化较小, 尤其是在96h之前, 水体中DO仅下降了0.60mg/L。96~360h才发生了程度相对较大的变化。对于两个实验组, 沙海蜇在分解后的0~12h内, 水体的DO并未发生很显著的变化。直到24h后, 两组的DO才出现了较为明显的下降, 而且下降的程度越来越剧烈。实验组A加入沙海蜇的量相对较少, 在72h时, 其DO达到最低值2.44mg/L, 相比初始值下降了4.06mg/L, 随后出现回升, 并于96h达到与对照组持平, 之后继续上升并在120h达到最高值11.62mg/L, 之后又出现了下降, 直至360h实验结束, A组DO值仍高于对照组; 而实验组B由于沙海蜇的量较多, 分解时间较长, DO一直下降, 直到120h达到最低值0.14mg/L, 相比初始值下降了6.36mg/L, 之后出现回升, 在168h恢复到对照组水平后继续升高, 直到360h实验结束时高于对照组。通过计算得到, 沙海蜇在分解过程中对DO的消耗速率为9.92~12.57mgO2/(kgWW·h)
|
| 图 7 沙海蜇分解过程中溶解氧(DO, mg/L)的变化 Fig. 7 Variations of DO (mg/L) in seawater during the decomposition of N. nomurai |
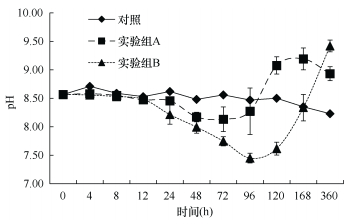
整个实验过程中, 沙海蜇的分解使水体中的pH显著下降, 说明对水体有显著的酸化作用。实验开始时海水的pH为8.57。从图 8可知, 对照组的pH变化较小, 在0~120h水体中pH一直维持在8.50左右, 120~360h出现一定程度的下降, 360h降至8.23。两个实验组的实验结果显示, 在沙海蜇分解后的0~12h内, 水体pH有轻微下降, 直到12h后, 两组的pH才出现了较为明显的下降, 且下降的程度越来越剧烈。实验组A在72h时pH达到最低值8.13, 相比初始值下降了0.44, 随后出现回升, 在96h达到与对照组接近水平, 之后继续上升并在168h达到最高值9.19, 随后又出现了下降, 直至360h实验结束, 实验组A的pH仍高于对照组。而实验组B由于添加沙海蜇的量较多, 分解时间较长, pH一直下降直到96h达到最低值7.45, 相比初始值下降了1.12, 之后出现回升, 在168h恢复到对照组水平后继续升高, 直到360h实验结束时高于对照组, 此时pH为9.42。
|
| 图 8 沙海蜇分解过程中pH的变化 Fig. 8 Variations of pH in seawater during decomposition of N. nomurai |
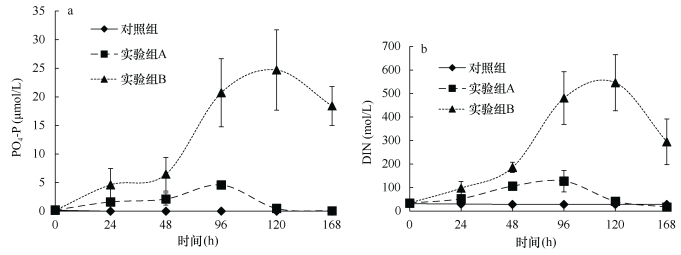
整个实验过程中, 沙海蜇的分解释放出大量营养盐, 使水体中DIN和DIP出现了显著的变化。从图 9可知, 对照组DIN和DIP浓度水平很低, 在整个实验周期内都未有明显变化, 而两个实验组水体中的DIN和DIP浓度持续增加。实验组A中DIN和DIP的浓度均在96h达到最高值, 分别为初始浓度的3.7倍和21.4倍, 随后两者浓度均逐渐降低, 到实验结束时低于对照组水平; 而实验组B中的DIN和DIP浓度的最高值则出现于120h, 分别达到初始值的15.7倍和3.8倍, 之后逐渐降低, 到实验结束时仍高于对照组水平。DIN的释放速率为156.31~ 354.02μmol/(kgWW·h), NH4-N占DIN的73.09%~99.60%; PO4-P的释放速率为7.31~ 17.01μmol/(kgWW·h)。
|
| 图 9 沙海蜇分解过程中DIP(a)和DIN(b)的变化(单位: μmol/L) Fig. 9 Variations of DIP (a) and DIN (b) in seawater during the decomposition of N. nomurai (unit: μmol/L) |
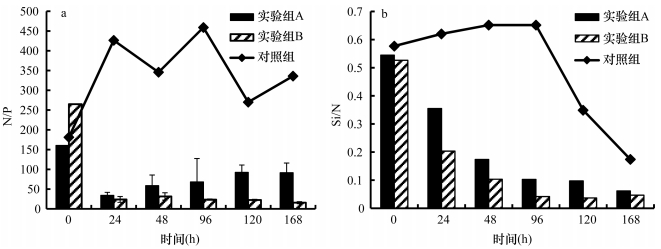
沙海蜇分解过程中释放出大量营养盐, 使水体中的营养盐结构比例发生了明显改变(图 10)。海水中的磷酸盐含量很低, N/P比极高, 远远超过16:1, 水体处于极度磷限制。Si/N比约为0.6, 小于1:1。实验组A的N/P比在实验开始的24h内由最初的160:1降至33:1, 随后逐渐升至90:1;实验组B的N/P比变化程度更显著, 由最初的264:1骤降至24:1, 以后缓慢下降至16:1。两个实验组的Si/N比则显示出较为一致的变化, 从最初的0.5:1降至0.05:1。这说明沙海蜇分解过程中大量营养盐的释放严重影响了水体的营养盐结构比例, 可以加剧营养盐失衡或者缓解营养盐失衡的状况。
|
| 图 10 沙海蜇分解过程海水中N/P比(a)和Si/N比(b)的变化 Fig. 10 Variations of N/P ratio (a) and Si/N ratio (b) in seawater during the decomposition of N. nomurai |
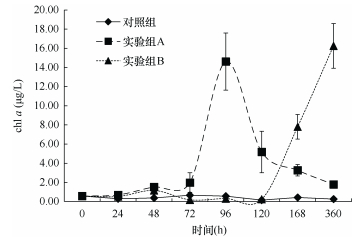
整个实验过程中, 沙海蜇的分解使水体中的chl a浓度显著增加。实验开始时海水中的chl a浓度为0.57μg/L。从图 11可知, 对照组的chl a浓度变化较小; 实验组A在实验开始的0~72h后, 水体中的chl a浓度由初始值0.57μg/L开始逐渐缓慢增加, 在72~96h内出现剧增, 从1.98μg/L陡增至14.61μg/L, 随后逐渐下降, 直到360h降至1.78μg/L; 而实验组B的chl a浓度变化与实验组A不同, 在0~120h出现一定程度的下降, 至120h时降至0.23μg/L, 之后又出现大幅度增加, 至实验结束达到16.25μg/L。
|
| 图 11 沙海蜇分解过程中叶绿素a浓度(μg/L)的变化 Fig. 11 Variations of chl a (μg/L) in seawater during the decomposition of N. nomurai |
从代谢实验结果看, 水体中DO、pH和营养盐的动态变化出现在8h后, 说明沙海蜇的代谢能够使水体出现低氧和酸化现象, 但是存在时滞效应。
沙海蜇在代谢过程中消耗海水中的氧气, 使水体表现出低氧和酸化现象。实验结果显示沙海蜇在24小时内消耗了实验水体中DO的80%, 使水体表现为缺氧状态。当沙海蜇大量出现时, 其正常代谢消耗对水体中的DO影响很大, 可能会导致与DO相关的海洋生物发生变化, 甚至影响整个生态系统的稳定(Song, 2010)。
由于原来水体中的营养盐浓度较低, 沙海蜇在代谢过程中释放的营养盐大大提高了水体中营养盐的浓度, 其释放出的大量DIN和DIP, 对水体有显著的促富营养化作用。沙海蜇的代谢活动能使水体中的DIN浓度在24h内增加为原来的12倍, DIP浓度增加40多倍。
沙海蜇的代谢过程不但能增加海水中营养盐的浓度, 还可能从很大程度上改变原有的营养盐结构。在本研究中, 实验水体原本处于营养盐结构严重失衡的状态, N/P比远远高于Redfield值16:1, Si/N比也小于1:1, 处于极端磷限制状况。沙海蜇代谢释放出大量N和P, 使海水中的N/P比由最初的56.2:1逐渐下降至14.93:1, 而DIN含量的显著增加则导致Si/N比显著下降, 表现为明显的硅限制。原本失衡的N/P比逐渐下降趋于平衡, 使水体的磷限制状况得到了很大缓解。
营养盐的浓度的增加导致了chl a浓度的明显增加, 但小型浮游植物的数量并没有明显增加, 我们推测导致chl a浓度增加的主要是微型浮游植物和微微型浮游植物。
3.2 沙海蜇分解过程对浮游植物的影响沙海蜇在细菌的作用下初步分解, DO逐渐被消耗, 致使水体出现低氧或者缺氧的现象(Titelman et al., 2006; Pitt et al., 2009)。同时细菌的分解作用使大量酸性有机物被释放到水体中, 导致pH降低, 水体酸化程度加剧。随后, 释放出来的大量酸性有机物被细菌分解为中性的无机物(如NH4+等)以及CO2气体逸出, 从而使pH逐渐上升(Pitt et al., 2009; West et al., 2009)。而随着pH的上升, 水体中的溶解CO2也相应增加。这有利于浮游植物光合作用的进行, 进而增加了O2的释放量, 对水体中DO的回升有一定贡献。除了溶解CO2之外, 分解作用产生的大量无机营养盐也刺激了浮游植物生长, 使浮游植物数量显著增加, 甚至引发藻华, 进一步加速了O2的释放。此时, 水体中的DO和pH都远远高于正常水平。
最后, 由于营养盐的大量消耗, 浮游植物的生长速度得到控制, 浮游植物数量逐渐减少, 水体中的DO和pH都逐渐恢复到正常水平。
3.3 沙海蜇的生物量对分解时间以及过程的影响本研究表明, 沙海蜇的生物量越大, 分解时间越长, 对水体DO、pH、营养盐的影响程度越大, 各项指标恢复到之前的水平需要的时间也越长。
实验组A的沙海蜇完全分解时间为5天, 实验组B中添加沙海蜇的量约为实验组A的两倍, 其完全分解时间为7天。
在所有指标中, DO与pH的变化与恢复较为同步。在实验结束之前, 两个实验组的DO和pH都完成了从下降到恢复至对照组水平这一变化周期, 其中实验组A完成这一变化周期历时4天, 而实验组B则历时7天。
营养盐的变化周期略长。实验组A的DIN和DIP浓度从最初的剧增到恢复至对照组水平一共用了5天, 而实验组B直至实验结束仍未降至初始水平。
Chl a的浓度变化周期更长。实验组A的chl a浓度在历经峰值后下降, 直到实验结束仍未降至原有水平; 而实验组B直到实验结束时仍未进入下降期。
因此, 我们认为当沙海蜇大量出现并死亡, 其暴发时的种群和生物量的大小对分解过程的持续时间和对环境的改变程度有重要的影响。种群越大, 生物量越大, 其分解历时越久, 对水体的缺氧程度和酸化程度改变越明显, 对生态系统中的浮游动物和底栖生物等危害越大。
3.4 沙海蜇分解的上行控制效应水母在暴发及消亡过程中, 通过释放大量营养盐改变了海水原有的营养盐浓度及结构, 致使浮游植物群落结构发生变化, 甚至可能引发藻华。
沙海蜇在分解过程中释放出大量营养盐, 不但大大增加了海水中营养盐的浓度, 而且从很大程度上改变了原有的营养盐结构。曲长凤等(2016)的实验结果表明, 沙海蜇死亡分解的溶解态氮主要以NH4+-N为主, 溶解态磷主要以PO43–-P为主。沙海蜇分解过程中释放出的DIN和DIP, 使得水体中的N/P比和Si/N比发生了显著变化。实验水体原本处于极端磷限制的营养盐结构失衡状态, 而由于沙海蜇分解导致无机磷的大量释放, 原本失衡的N/P比逐渐下降趋于平衡, 使水体的磷限制状况得到了很大改善, 刺激了东海原甲藻(Prorocentrum Donghaiense)和波吉卵囊藻(Oocystis borgei)的大量增殖并引发藻华。岑竞仪等(2012)发现在海南清澜港的水母暴发区由于NH4+-N和PO43–-P的含量显著高于非暴发区, 导致热带骨条藻(Skeletonema tropicum)的赤潮发生。
此外, 藻华的发生可以为微型浮游动物提供充足的食物。水母在分解过程中释放的溶解有机物(dissolved organic matter, DOM)可以被细菌吸收利用(Pitt et al., 2009), 细菌的繁殖可以为异养微型鞭毛虫提供食物, 进而使其被纤毛虫摄食(Uye, 2011)。鞭毛虫和纤毛虫等微型浮游动物是联系微食物环和经典食物链的纽带, 可以直接被水母捕食利用(Morais et al., 2015)。相比于其他大型浮游动物, 以微型浮游生物为基础的食物网更适合水母类的繁殖(张芳等, 2009; Zheng et al., 2015)。
4 结论通过沙海蜇代谢与分解的现场实验, 分析了沙海蜇的代谢及分解过程中水体pH、DO变化, 营养盐的动态变化以及叶绿素a浓度和浮游植物的变化。
(1) 沙海蜇的代谢过程在短时间内大量消耗水体中的DO, 使水体表现出明显的低氧现象。其代谢过程使水体表现出轻度酸化现象。沙海蜇代谢过程释放出大量的营养盐并改变原有的营养盐结构, 使水体中的DIN浓度在24h内增加为原来的12倍, DIP浓度增加了40多倍, 引起水体中chl a浓度的增加。
(2) 沙海蜇的分解过程使水体表现出明显的低氧(缺氧)和酸化现象。其分解过程的动态变化与生物量有关。生物量越大, 分解时间越长, 对水体的改变程度越明显。沙海蜇分解过程还释放出大量的营养盐并改变原有的营养盐结构, 可以刺激水体中浮游植物的生长, 甚至引发藻华。浮游植物的增殖暴发为纤毛虫的丰度增加提供了充足的食物基础。
致谢: 本研究中开展现场实验和样品采集与分析得到了中国科学院海洋研究所胶州湾海洋生态系统研究站和浮游动物研究组的各位老师、同学以及“北斗号”考察船全体工作人员的支持, 谨致谢忱。| 岑竞仪, 欧林坚, 吕淑果, 等. 2012. 海南清澜港水母暴发期间浮游生物生态特征研究. 海洋与湖沼, 43 (3) : 595–601 DOI:10.11693/hyhz201203029029 |
| 程家骅, 丁峰元, 李圣法, 等. 2005. 东海区大型水母数量分布特征及其与温盐度的关系. 生态学报, 25 (3) : 440–445 |
| 丁峰元, 程家骅. 2005. 东海区夏、秋季大型水母分布区渔业资源特征分析. 海洋渔业, 27 (2) : 120–128 |
| 董婧, 孙明, 赵云, 等. 2012. 中国北部海域灾害水母沙蜇(Nemopilema nomurai)及其它钵水母繁殖生物学特征与形态比较. 海洋与湖沼, 43 (3) : 550–555 DOI:10.11693/hyhz201203022022 |
| 李学刚, 李宁, 马清霞, 等. 2012. 沙海蜇(Nemopilema nomurai)模拟消亡过程中. 海洋与湖沼, 43 (3) : 507–512 DOI:10.11693/hyhz201203016016 |
| 马清霞, 李宁, 李学刚, 等. 2012. 模拟研究沙海蜇消亡过程中海水pH变化及对海水酸化的影响. 海洋科学, 36 (12) : 12–18 |
| 曲长凤, 宋金明, 李宁, 等. 2016. 海水中沙海蜇消亡对水体碳、氮、磷的释放与补充. 应用生态学报, 27 (1) : 299–306 |
| 宋金明, 马清霞, 李宁, 等. 2012. 沙海蜇(Nemopilema nomurai)消亡过程中海水溶解氧变化的模拟研究. 海洋与湖沼, 43 (3) : 502–506 DOI:10.11693/hyhz201203015015 |
| 王世伟, 张光涛, 孙松, 等. 2012. 2011年夏季胶州湾三种大型水母的种群动态研究. 海洋与湖沼, 43 (3) : 471–479 DOI:10.11693/hyhz201203011011 |
| 张芳, 孙松, 李超伦. 2009. 海洋水母类生态学研究进展. 自然科学进展, : 121–130 DOI:10.3321/j.issn:1002-008X.2009.02.001 |
| Båmsted U, Martinussen M B, Matsakis S. 1994. Trophodynamics of the two scyphozoan jellyfishes, Aurelia aurita and Cyanea capillata, in western Norway. ICES Journal of Marine Science, 51 (4) : 369–382 DOI:10.1006/jmsc.1994.1039 |
| Båmstedt U, Nejstgaard J C, Solberg P T, et al. 1999. Utilisation of small-sized food algae by Calanus finmarchicus (Copepoda, Calanoida) and the significance of feeding history. Sarsia, 84 (1) : 19–38 DOI:10.1080/00364827.1999.10420449 |
| Costello J. 1991. Complete carbon and nitrogen budgets for the hydromedusa Cladonema californicum (Anthomedusa: Cladonemidae). Marine Biology, 108 : 119–128 DOI:10.1007/BF01313479 |
| Kishinouye K. 1922. Echizen Kuarge (Nemopilema nomurai). Dobutsugaku Zasshi, 34 : 343–346 |
| Kremer P, 1975. Excretion and body composition of the ctenophore Mnemiopsis leidyi (A. Agassiz): comparisons and consequences. In 10th European Symposium on Marine Biology, Ostend: Belgium, 351-362 |
| Kremer P. 1977. Respiration and excretion by the ctenophore Mnepiopsis leidyi. Marine Biology, 44 (1) : 43–50 DOI:10.1007/BF00386903 |
| Kremer P. 1982. Effect of food availability on the metabolism of the ctenophore Mnemiopsis mccradyi. Marine Biology, 71 (2) : 149–156 DOI:10.1007/BF00394623 |
| Lindahl O. 1983. On the development of a Gyrodinium aureolum, occurrence on the Swedish west coast in 1982. Marine Biology, 77 (2) : 143–150 DOI:10.1007/BF00396311 |
| Lynam C P, Heath M R, Hay S J, et al. 2005. Evidence for impacts by jellyfish on North Sea herring recruitment. Marine Ecology Progress Series, 298 : 157–167 DOI:10.3354/meps298157 |
| Matsakis S. 1992. Ammonia excretion rate of Clytia spp. hydromedusae (Cnidaria, Thecata): effects of individual dry weight, temperature and food availability. Marine Ecology Progress Series, 87 : 55–63 DOI:10.3354/meps087055 |
| Miller C, Glibert P. 1998. Nitrogen excretion by the calanoid copepod Acartia tonsa: results of mesocosm experiments. Journal of Plankton Research, 20 : 1767–1780 DOI:10.1093/plankt/20.9.1767 |
| Morais P, Para M P, Marques R, et al. 2015. What are jellyfish really eating to support high ecophysiological condition?. Journal of Plankton Research, 37 (5) : 1036–1041 DOI:10.1093/plankt/fbv044 |
| Nemazie D A, Purcell J E, Glibert P M. 1993. Ammonium excretion by gelationous zooplankton and their contribution to the ammonium requirements of microplankton in Chesapeake Bay. Marine Biology, 116 (3) : 451–458 DOI:10.1007/BF00350062 |
| Officer C B, Ryther J H. 1980. The possible importance of silicon in marine eutrophication. Marine Ecology Progress Series, 3 (1) : 83–91 |
| Pauly D, Graham W M, Libralato S, et al. 2009. Jellyfish in ecosystems, online databases, and ecosystem models. Hydrobiologia, 616 (1) : 67–85 DOI:10.1007/s10750-008-9583-x |
| Pitt K A, Welsh D T, Condon R H. 2009. Influence of jellyfish blooms on carbon, nitrogen and phosphorus cycling and plankton production. Hydrobiologia, 616 (1) : 133–149 DOI:10.1007/s10750-008-9584-9 |
| Purcell J E. 1997. Pelagic cnidarians and ctenophores as predators: selective predation, feeding rates and effects on prey populations. Annales De Linstitute Oceanographique, 73 (2) : 125–137 |
| Purcell J E, Uye S, Lo W T. 2007. Anthropogenic causes of jellyfish blooms and their direct consequences for humans: a review. Marine Ecology Progress Series, 350 : 153–174 DOI:10.3354/meps07093 |
| Redfield A C, Ketchum B H, Richards F A, 1963.The influence of organisms on the composition of seawater. In Hill, M. N. (ed.), The Sea, Vol. 2. Interscience, NewYork: 26-77 |
| Schneider G. 1989. The common jellyfish Aurelia aurita: standing stock, excretion and nutrient regeneration in the Kiel Bight, Western Baltic. Marine Biology, 100 (4) : 507–514 DOI:10.1007/BF00394827 |
| Schneider G. 1990. A comparison of carbon based ammonia excretion rates between gelatinous and non-gelatinous zooplankton: implications and consequences. Marine Biology, 106 (2) : 219–225 DOI:10.1007/BF01314803 |
| Shimauchi H, Uye S I. 2007. Excretion and respiration rates of the scyphomedusa Aurelia aurita from the Inland Sea of Japan. Journal of Oceanography, 63 (1) : 27–34 DOI:10.1007/s10872-007-0003-z |
| Southwell M W, Popp B N, Martens C S. 2008. Nitrification controls on fluxes and isotopic composition of nitrate from Florida Keys sponges. Marine Chemistry, 108 (1-2) : 96–108 DOI:10.1016/j.marchem.2007.10.005 |
| Sun X X, Wang S W, Sun S. 2011. Introduction to the China jellyfish project. Chinese Journal of Oceanology and Limnology, 29 (2) : 491–492 DOI:10.1007/s00343-011-0491-y |
| Titelman J, Riemann L, Sørnes T A, et al. 2006. Turnover of dead jellyfish: stimulation and retardation of microbial activity. Marine Ecology Progress Series, 325 : 43–58 DOI:10.3354/meps325043 |
| Uye S I. 2011. Human forcing of the copepod-fish-jellyfish triangular trophic relationship. Hydrobiologia, 666 (1) : 71–83 DOI:10.1007/s10750-010-0208-9 |
| Uye S. 2008. Blooms of the giant jellyfish Nemopilema nomurai: a threat to the fisheries sustainability of the East Asian Marginal Seas. Plankton and Benthos Research, 3 (S1) : 125–131 |
| Welsh D T, Castadelli G. 2004. Bacterial nitrification activity directly associated with isolated benthic marine animals. Marine Biology, 144 (5) : 1029–1037 DOI:10.1007/s00227-003-1252-z |
| West E J, Welsh D T, Pitt K A. 2009. Influence of decomposing jellyfish on sediment oxygen demand and nutrient dynamics. Hydrobiologia, 616 (1) : 151–160 DOI:10.1007/s10750-008-9586-7 |
| Zhang F, Sun S, Jin X, et al. 2012. Associations of large jellyfish distributions with temperature and salinity in the Yellow Sea and East China Sea. Hydrobiologia, 690 (1) : 81–96 DOI:10.1007/s10750-012-1057-5 |
| Zheng S, Sun X X, Wang Y T, et al. 2015. Significance of different microalgal species for growth of moon jellyfish ephyrae, Aurelia sp.1. Journal of Ocean University of China, 14 (5) : 823–828 DOI:10.1007/s11802-015-2775-x |
 2017, Vol.
2017, Vol. 


