
中国科学院海洋研究所主办。
文章信息
- 于士翔, 王文静, 刘峰, 刘芳华. 2017.
- YU Shi-Xiang, WANG Wen-Jing, LIU Feng, LIU Fang-Hua. 2017.
- 具产电性能光合细菌DH-3的分离及其对多种底物污水处理能力的评价
- Isolation and Application Potential of Photosynthetic Bacterium Strain DH -3 with Electricity Production in the Wastewater Treatment
- 海洋科学集刊(52): 59-67
- Studia Marina Sinica(52): 59-67.
- http://dx.doi.org/10.12036/hykxjk20170705001
-
文章历史
- 收稿日期:2017-07-05
- 收修改稿日期:2017-08-01
2. 中国农业大学烟台研究院 海洋学院水产养殖学系, 烟台 264670
2. China Agriculture University, School of Ocean, Yantai 264670, China
光合细菌(photosynthetic bacteria, PSB)是地球上出现最早, 自然界中普遍存在并具有原始光能合成体系, 以光为能源、二氧化碳和有机物作为光合作用供氢体兼底物的不产氧兼性厌氧原核微生物(宋志文等, 2003; 李福枝等, 2008)。光合细菌菌体能够提供环境生物体所必需的营养, 含有氨基酸、生物必需维生素、抗病毒活性因子、辅酶Q及多种生理活性物质; 还可通过光合作用, 维持物质循环, 降解废弃有毒物质, 净化水质和改善环境(Nath and Das, 2009; Chitapornpan et al., 2012)。光照厌氧条件下, 绝大多数光合细菌可利用硫化物、单质硫、硫代硫化物、分子氢或有机物作为电子供体(谢磊等, 2000; Li et al., 2016), 通过光合磷酸化过程获得能量。光合细菌能耐受高浓度有机物, 具有去除和分解有机物的能力(何萍等, 2002; 何剑丹, 2005), 如红螺菌科(Rhodospirillaceae)的菌株能够在厌氧光照、好氧黑暗条件下迅速利用小分子有机物(毛雪慧, 2009)。同时, 有大量研究表明, 部分光合细菌在进行代谢的同时伴随着产电现象, 通过光合细菌在光微生物燃料电池领域中的应用与发展, 可实现其在降解污水的同时产生大量的电能, 这极大程度地提升了电能的利用。因此光合细菌在水产养殖业、环境治理、新能源开发利用、医药开发等领域均具有广阔的应用前景(周佳等, 2006)。
双室微生物燃料电池是一种利用产电微生物的代谢生长产生电能的装置。该装置由阳极室、阴极室和离子交换膜组成。光合细菌可在阳极通过自身的光合作用或者呼吸作用产生电子或质子, 电子通过导线传递给阴极受体, 质子则是通过离子交换膜进入阴极室内, 这样就形成了一个可以产电的闭合回路。通过将光合细菌与双室微生物燃料电池相结合, 可以使污水资源化, 但是常见的光合细菌只能高效降解污水污染物而无法产电, 或者是能产电但降解污水污染物的能力很弱。本文研究的一株光合细菌可以两者兼具, 在降解污水污染物的同时产生电能, 在应用于可持续发展的新技术研发中具有可行性。并且, 目前在光合细菌处理污水的多数相关研究中, 污水是单一底物, 而实际生活中污水含有多种可供给光合细菌利用的底物, 本文就多种底物进行了相应的研究, 发现该株光合细菌在同时处理多种底物污水方面同样具有很大潜力。
1 材料与方法 1.1 实验材料对Kim等(1999)所报道的研究中光合细菌分离方法进行改良优化后, 本实验采用先富集后分离的方法对光合细菌进行分离。富集培养基: NH4Cl 1g/L, K2HPO4 0.2g/L, CH3COONa 4g/L, MgSO4•7H2O 0.2g/L, NaCl 0.1g/L, NaHCO3 0.01mg/L, 维生素B1 0.001mg/L, 乙尼克丁酸0.1mg/L, 对氨基苯甲酸0.1mg/L, 生物素0.001mg/L, FeCl3•6H2O 5μg/L, CuSO4• 5H2O 0.05μg/L, H3BO40.05μg/L, MnCl2•4H2O 0.05μg/L, ZnSO4•7H2O 1mg, Co(NO3)2•6H2O 0.5μg/L; pH为7.0;高压灭菌锅(型号LDZX-50KBS, 上海申安医疗器械厂)进行高温高压灭菌(1×105Pa, 30min)。
分离培养基: NH4Cl 1g/L, MgCl2 0.2g/L, K2HPO4 0.5g/L, NaCl 2g/L, NaHCO3 0.1g/L, Na2S•9H2O 0.01g/L, 酵母膏0.1g/L, 琼脂20g/L。高压灭菌后, 倒入无菌的培养皿中。
取武汉东湖表层底泥沉积物接入装有100mL无菌富集培养基的带玻璃塞的厌氧磨口瓶中, 置于30℃、2000lux的全光照培养箱(型号GPX-250B, 上海百典仪器厂)中培养。富集后的微生物采用液体培养法和琼脂平板涂布法相结合, 在厌氧操作箱(G4350A, Coy Laboratory, 美国)内反复挑取琼脂固体培养上生长的单菌落进行培养, 多次纯化后获得纯菌株, 命名为DH-3。
1.2 光合细菌的分子生物学鉴定 1.2.1 菌体DNA的提取挑取琼脂平板上的单个菌落DH-3, 放入37℃摇床中, 在自然光照条件下进行过夜培养, 利用细菌提取试剂盒(DP302, 北京天根生化科技有限公司)提取菌株DH-3的总基因组。
1.2.2 16S rRNA基因的PCR扩增及基因序列分析以1.2.1中提取的细菌总DNA为模板, 进行16S rDNA扩增, 引物为16S rDNA通用引物(27F: 5′-AGAGTTTGATCCTGGCTC AG-3′和1492R: 5′-TACGGCTACCTTGTTAC GACTT-3′), 由上海英潍捷基生物公司合成。PCR反应体系(25μL): 10×PCR Buffer 2.5μL, MgCl2 1.5μL, dNTP 2μL, 模板DNA 2~5μL, 引物27F/1492R各0.5μL, Taq酶(1U/μL)0.5μL, 无菌水15.5μL。PCR反应条件: 95℃预变性6min; 94℃变性1min, 56℃退火1min, 72℃延伸2min, 扩增30个循环; 最后72℃延伸10min。PCR产物的回收:对PCR产物进行1.5%的琼脂糖凝胶电泳, 将目的条带切下, 利用琼脂糖凝胶回收试剂盒(DP209, 北京天根生化科技有限公司)纯化回收。测序:将回收的目的产物送至上海英潍捷基生物公司完成测序。将菌株DH-3的16S rDNA序列在RDP(Ribosomal Database Project-Ⅱ; http://rdp.cme.msu.edu/seqmatch/seqmatch_intro.jsp)数据库中进行同源性检索, 利用MEGA 5.0软件的unweighted pair-group method with arithmetic方法对收集序列进行聚类分析。
1.3 光合细菌在污水培养基中的生长 1.3.1 人工污水培养基人工污水培养基配方参照(Feng et al., 2011), 包括Glucose 4.125g/L, NH4Cl 0.78g/L, KH2PO4 0.18g/L, MgSO4•7H2O 0.13g/L, CaCl2•2H2O 0.43g/L, FeSO4•7H2O 0.05g/L, A5 solution 1mL/L (A5 solution: H3BO32.86g/L, MnCl2•4H2O 1.86g/L, ZnSO4•7H2O 0.22g/L, Na2MoO4•2H2O 0.39g/L, CuSO4•5H2O 0.08g/L, Co(NO3)2•6H2O 0.05g/L)。
其他多种底物的培养基是在人工污水培养基的基础上, 分别采用乙酸(acetic acid)、苹果酸(malic acid)、丙三醇(glycerin)、乙醇(ethanol)等替换人工污水培养中的葡萄糖(glucose)。将西林瓶中的污水培养基进行厌氧无菌处理后, 在无菌操作台内用无菌的一次性注射器转接种光合细菌DH-3, 每个处理组设5个重复, 每日取样测定光密度(optical density, OD)、化学需氧量(chemical oxygen demand, COD)、底物和总氮(total nitrogen, TN)的变化, 取样后至测定前保存至–80℃。
1.3.2 不同指标的检测方法在采用人工污水培养基培养光合细菌DH-3过程中, 同时检测以下与污水处理有关的指标及DH-3产电活性研究:
① OD值的测定:紫外可见分光光度计(北京普析通用仪器有限责任公司, TU-1810)在600nm波长下测定光合细菌的OD值。
② COD的测定:使用杭州陆恒生物科技有限公司生产的COD快速测定检测试剂盒测定COD, 通过与试剂盒内比色卡比对颜色, 得出COD值的大致范围。所测的值越大, 表明液体中的COD浓度越高。将菌株DH-3培养于以乙酸为底物的污水培养基中, 每隔8小时取样测定。
③ 有机底物的测定:取0.3mL培养液在10000r/min下离心2min, 用移液枪吸取20μL上清液置于1.5mL离心管中, 加入980μL无菌水稀释50倍。稀释后的液体经0.22μm纤维素微孔径滤膜(GSWP04700, Millipore, 美国)过滤到进样瓶中, 利用高效液相色谱(Agilent 1260 Infinity, 美国)检测。
④ TN和TP的测定:取人工污水培养基的菌液用0.22μm纤维素微孔滤膜(GSWP04700, Millipore, 美国)过滤后, 分别取10mL菌液, 利用国标测定法测定培养基中的TN和TP(Jin and Tu, 1990; Niu et al., 2011)。
⑤ 光合细菌的电化学活性研究:采用玻璃材质的双室微生物燃料电池检测光合细菌DH-3的产电能力。培养条件为温度30℃, 光照周期12h:12h, 光照强度2000lux。阳极室与阴极室均为100mL。两室之间采用阳离子交换膜(CMI7000, 美国)为隔膜, 石墨电极。石墨电极表面积为20.22cm2, 外加1000Ω电阻, 采用钛丝连接外电路及电池。阳极室进行高温消毒无菌处理, 在无菌操作台组装充气, 加入菌落并确保是单菌落及厌氧环境, 阴极室为50mmol/L的铁氰化钾溶液(100mmol/L PBS配制, pH7.0), 接入电化学工作站, 利用数据采集系统(Model 2700, 购自美国吉时利仪器公司)采集数据。记录输出电压, 根据外加电阻及电阻表面积, 计算电流密度, 利用origin 8.0分析数据并作图。
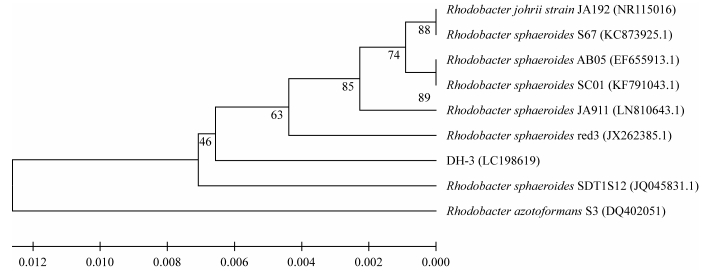
2 结果与讨论 2.1 光合细菌的鉴定菌株DH-3在形态学上为红色菌落, 菌落表面有光泽、不透明、有突起, 菌落边缘整齐, 光学显微镜下细菌形态为杆状, 革兰氏染色为阴性, 所得光学显微镜照片如图 1所示。16S rDNA序列分析表明, DH-3与类球红细菌(Rhodobacter sphaeroides)的相似度达到97%。从GenBank基因数据库下载与DH-3相似性较高菌株的16S rDNA序列并进行的聚类分析得图 2。从图 2中可看出DH-3与类球红细菌的系统发生地位最为接近。将DH-3的16S rDNA序列提交至DDBJ(DNA Data Bank of Japan)数据库, 序列号为LC198619。

|
| 图 1 DH-3菌落的光学显微镜照片(放大倍数为10*100) Fig. 1 Microscope of DH-3 (10*100) |
|
| 图 2 基于16S rDNA的菌株DH-3和其他菌株的非加权组平均法基因序列聚类分析 Fig. 2 Unweighted pair-group method with arithmetic means based on 16S rDNA of strain DH-3 and other related strains |
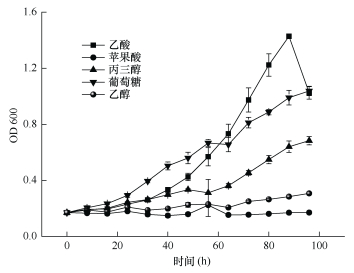
在污水培养基的基础上, 改变原有乙酸底物, 加入不同单一种类的底物后, 观察DH-3对不同底物的利用情况, 其结果如图 3所示。在生长方面, 其生长分为四个时期, 分别为延滞期(数量维持接种时数量或略有下降)、指数生长期(数量呈现指数形式的增长)、稳定期(增长速度减慢数目基本维持不变)和衰退期(数量大幅度减少)。在对不同底物的利用方面, 底物种类对DH-3的生长具有显著的影响:在以乙酸为底物的培养基中, DH-3的生长状况最好, 在实验最初生长速度一直呈指数上升, 后期底物含量减少, DH-3生长速度减缓; 在葡萄糖和丙三醇培养基中, DH-3生长速度比较稳定, 表明它可快速利用以葡萄糖为底物的培养基; DH-3在以乙醇和苹果酸为底物的培养基中同样可以生长, 但是生长较为缓慢。通过光合细菌处理不同底物的污水培养基, 发现DH-3对不同的底物具有不同的利用效果, 它可以更好地利用以乙酸、葡萄糖和丙三醇为底物的培养基。DH-3将添加的乙酸等多种底物通过三羧酸循环进行代谢, 从中获取能量和碳源是其去除废水中有机污染物的基础。
|
| 图 3 光合细菌在不同底物培养基中的生长曲线 Fig. 3 Growth curves of photosynthetic bacteria DH-3 in various mediums |
表 1为接种96h之后所测得的底物浓度。结果表明, 培养基中的底物在DH-3生长过程中逐渐减少。目前大多有关光合细菌处理污水的研究集中于单一的底物污水(李瑞杰, 2004)。郑伟华(2009)利用光合细菌法去除高浓度淀粉废水COD时, COD的去除率能达到90%以上。张昊等(2014)研究光合细菌处理马铃薯淀粉废水实验也表明光合细菌对于COD具有很好的去除效果。与之前研究相比, 菌株DH-3可降解利用表 1中所示的多种底物。综上表明:底物种类对光合细菌DH-3的生长具有显著的影响, DH-3可降解利用多种底物, 对以乙酸为底物的污水培养基利用效率最高。针对光合细菌降解多种底物能力的研究对细菌处理复杂污水是非常必要的。
| (单位: mg/L) | |||||
| 乙酸 | 苹果酸 | 葡萄糖 | 丙三醇 | 乙醇 | |
| 起始浓度 | 4.125 | 4.125 | 4.125 | 4.125 | 4.125 |
| 最终浓度 | 1.034 | 3.728 | 2.034 | 1.935 | 3.492 |
如表 2所示, COD快速测定试剂盒的检测结果表明, 随着菌株DH-3在培养基中生长时间的增加, COD值变小, 最终污水培养基的COD去除率达到90%以上, 表明DH-3在实验中具有明显去除污水培养基中COD的作用。
| (单位: mg/L) | ||||||||||||
| 时间(h) | 8 | 16 | 24 | 32 | 40 | 48 | 56 | 64 | 72 | 80 | 88 | 96 |
| 处理组1 | 250 | 250 | 200 | 120~200 | 120~200 | 120 | 60~120 | 60 | 30~60 | 30 | 0~30 | 0 |
| 处理组2 | 250 | 250 | 200 | 120~200 | 120~200 | 60~120 | 60 | 60 | 30~60 | 30~60 | 30 | 0~30 |
| 处理组3 | 250 | 250 | 200 | 120~200 | 120 | 60~120 | 60 | 30~60 | 30~60 | 0~30 | 0~30 | 0 |
| 注: 三个处理组1, 2, 3为三个平行样品。 | ||||||||||||
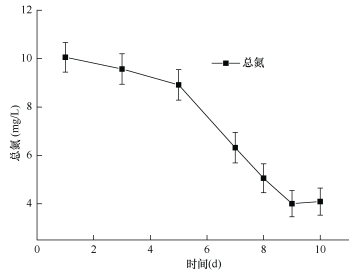
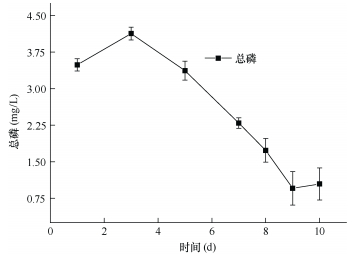
DH-3对人工污水培养中氮磷的消耗利用如图 4和图 5所示, 培养基内TN、TP的初始浓度分别为10.6mg和3.5mg。在加入DH-3后, 第1天TN含量在10.2mg左右, 10天后TN降低至约4mg。污水培养基中的磷也由接入DH-3后第2天的3.75mg降低至0.75mg(第9天)。实验证实, DH-3对氮磷具有一定的利用和去除作用, 在以乙酸为底物的污水培养基中, DH-3对氮的去除率达到60.7%, 对磷的去除率达到80%。我们推测菌株DH-3在厌氧条件下, 通过反硝化作用将硝酸氮还原为气态氮, 同时可直接吸收磷, 在菌体细胞内形成聚磷酸盐内含物, 达到脱氮脱磷的效果。大多数光合细菌具有固氮、产氢的功能特点, 本实验中利用气相色谱仪并没有检测到DH-3培养管中氢气的产生, 但该菌株是否可以利用其他底物产生氢气, 有待进一步研究。
|
| 图 4 污水培养基中总氮随时间的变化 Fig. 4 Change of total nitrogen in the sewage |
|
| 图 5 污水培养基中总磷随时间的变化 Fig. 5 Change of total phosphorus in the sewage |
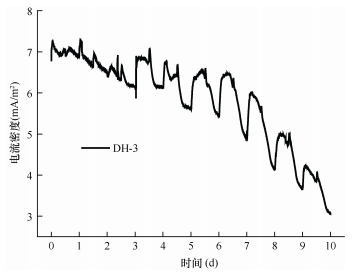
菌株DH-3的产电能力如图 6所示:接入微生物燃料电池后第1~3天, DH-3由于刚进入新环境, 需要一定的适应期, 所以电流变化相对紊乱, 但是逐渐趋于稳定, 最终电流输出达到7.2mA/m2; 第4~5天, DH-3的电流稳定输出, 并且呈现出与光照有关的电流输出变化, 在光照期间, 电流输出能达到7.4mA/m2, 黑暗期间, 电流逐渐下降到5.9mA/m2; 第6天后, 由于培养基内的有机物已经消耗殆尽, DH-3的细菌浓度有所下降, 因而其电流输出开始下降; 培养至第10天, 光合细菌最低电流输出为3.1mA/m2。菌株DH-3在处理以乙酸为底物的污水培养基的同时, 可产生电流, 因此可以推断菌株DH-3实现了资源的循环再利用。
|
| 图 6 乙酸培养基中DH-3的电流密度随时间的变化 Fig. 6 Current density over time along with DH-3 growth in acetic acid medium |
(1) 从武汉东湖分离到一株光合细菌DH-3, 通过菌落形态学和16S rDNA序列分析, 菌株DH-3与类球红细菌的相似性最高, 可达到97%。
(2) 菌株DH-3在处理污水时不但可高效降解污水, 降低污水培养基中的氮磷浓度, 还可利用多种有机底物, 说明该菌株在高效降解多种有机底物的污水时具有较大的潜力。
(3) 本研究分离的菌株DH-3表现出罕见并且良好的产电特性, 可以实现在降解污水的同时提供电能, 实现污染物资源化。所以菌株DH-3在未来污水处理实现资源回收再利用方面具有重要的应用潜力。
4 展望光合细菌在环境中具有很强的适应性、兼性厌氧的特性。一方面, 光合细菌能以不同的醇类和有机酸等作为光合作用中所需的供氢体和底物(Inui et al., 1995; 宋志文等, 2003), 光合细菌如红假单胞菌(Rhodopseudomonas)能将产氢、光能利用和有机物的去除三者有机地耦合在一起(Kobayashi and Tchan, 1973; Hülsen et al., 2016), 实现高效的能量利用过程。另一方面, 光合细菌可利用自身较强的去除和分解有机物的生理特性, 使其在污水发酵处理过程中占据重要角色(崔宝臣等, 2010)。光合细菌能够承受高浓度的有机废水并进行高效率处理(张全国等, 2012), 在处理过程中无有害物质的产生, 还产生如胡萝卜素和蛋白等其他营养价值的副产物, 光合细菌进行水处理是一种更为环保节能的生物方法。除此之外, 已有研究表明, 光合细菌可实现CO2捕捉和光电转换等多重功能(徐金球等, 2013)。
对于光合细菌在污水处理中的应用效果, 还存在着很多重要的影响因素, 如光照在污水处理中对光合细菌的生长、光能转化成化学能的过程具有非常重要的作用(Schagerl and Müller, 2006; Zhou et al., 2014)。在特定的培养条件下, 光合细菌处理污水的效率及能量回收能力往往会受到光照强度的影响(Qu et al., 2011; Zhang et al., 2014)。其次, 高效处理污水的光合细菌菌株的培养和驯化, 在研究光合细菌处理污水过程中十分重要。目前虽然已有部分报道已分离到高效降解污水的光合细菌(周佳等, 2006; 周洪波等, 2006), 但是光合细菌在处理污水过程中如何适应复杂的污水环境, 在处理污水后如何将菌体进行有效安全的分离及光合细菌代谢产物的获取提纯, 实现污水的能量回收, 都将是未来研究的重点。
| 崔宝臣, 张国欣, 侯博, 等. 2010. 碳氮源对光合细菌混合菌群产氢性能的影响. 环境科学与技术, 33 (12) : 5–7, 13 |
| 何萍, 陈育如, 杨启银. 2002. 光合细菌处理有机污水的方法. 南京师范大学学报, 2 (1) : 56–59 |
| 何剑丹, 2005. 光合细菌处理生活污水和垃圾渗滤液的研究. 成都: 四川师范大学硕士毕业论文 http://d.wanfangdata.com.cn/Thesis/Y718681 |
| 李福枝, 刘飞, 曾晓希, 等. 2008. 光合细菌(PSB)应用的研究进展. 食品与机械, 24 (1) : 152–158 |
| 李瑞杰, 2004. 光合细菌在水处理中的应用研究. 南京: 南京理工大学博士毕业论文 http://d.wanfangdata.com.cn/Thesis/Y624700 |
| 毛雪慧, 2009. 光合红螺菌(Rhodos Pirillaceae)固定化及其对废水处理的研究. 南京: 暨南大学硕士毕业论文 |
| 宋志文, 郭本华, 曹军. 2003. PSB在有机废水处理方面的应用与发展. 重庆环境科学, 25 (11) : 187–189 DOI:10.3969/j.issn.1674-2842.2003.11.066 |
| 谢磊, 杨润昌, 胡勇有. 2000. PSB在有机废水处理中的应用与发展. 环境污染与防治, 22 (4) : 36–38 |
| 徐金球, 梁波, 王利军, 等. 2013. 葡萄糖在微生物燃料电池中的应用研究进展. 上海第二工业大学学报, 29 (4) : 257–265 |
| 张昊, 王三反, 李广, 等. 2014. 马铃薯淀粉废水处理及资源化利用研究进展. 工业用水与废水, 45 (6) : 4–7 |
| 张全国, 张相锋, 王毅, 等. 2012. 光合产氢混合菌群的底物代谢实验研究. 太阳能学报, 33 (2) : 253–257 |
| 郑伟华, 2009. 光合细菌(PSB)膜法工艺处理高浓度淀粉废水. 兰州: 兰州理工大学硕士学位论文 http://d.wanfangdata.com.cn/Thesis/Y1464356 |
| 周佳, 刘文睿, 黄遵锡. 2006. 高原湖泊光合细菌处理水产养殖污水的初步研究. 水利渔业, 26 (2) : 70–72 |
| 周洪波, 刘飞飞, 邱冠周. 2006. 一株光合细菌的分离鉴定及污水处理能力研究. 生态环境, 15 (5) : 901–904 |
| Chitapornpan S, Chiemchaisri C, Chiemchaisri W, et al. 2012. Photosynthetic bacteria production from food processing wastewater in sequencing batch and membrane photo-bioreactors. Water Science and Technology, 65 (3) : 504–512 DOI:10.2166/wst.2012.740 |
| Feng Y J, Li C, Zhang D W. 2011. Lipid production of Chlorella vulgaris cultured in artificial wastewater medium. Bioresource Technology, 102 (1) : 101–105 DOI:10.1016/j.biortech.2010.06.016 |
| Hülsen T, Barry E M, Lu Y, et al. 2016. Domestic wastewater treatment with purple phototrophic bacteria using a novel continuous photo anaerobic membrane bioreactor. Water Research, 100 : 486–495 DOI:10.1016/j.watres.2016.04.061 |
| Inui M, Momma K, Matoba R, et al. 1995. Characterization of alcohol-assimilating photosynthetic purple non-sulfur bacteria and cloning of molecular chaperones from a purple non-sulfur bacterium. Energy Conversion and Management, 36 (6-9) : 767–770 DOI:10.1016/0196-8904(95)00117-V |
| Jin X C, Tu Q Y, 1990. The Standard Methods for Observation and Analysis of Lake Eutrophication (second ed.), China Environmental Science Press, Beijing, China |
| Kim J K, Lee B K, Kim S H, et al. 1999. Characterization of denitrifying photosynthetic bacteria isolated from photosynthetic sludge. Aquacultural engineering, 19 (3) : 179–193 DOI:10.1016/S0144-8609(98)00050-8 |
| Kobayashi M, Tchan Y T. 1973. Treatment of industrial waste solutions and production of useful by-products using a photosynthetic bacterial method. Water Research, 7 (8) : 1219–1224 DOI:10.1016/0043-1354(73)90075-4 |
| Li X M, Peng W H, Jia Y Y, et al. 2016. Bioremediation of lead contaminated soil with Rhodobacter sphaeroides. Chemosphere, 156 : 228–235 DOI:10.1016/j.chemosphere.2016.04.098 |
| Nath K, Das D. 2009. Effect of light intensity and initial pH during hydrogen production by an integrated dark and photo-fermentation process. International Journal of Hydrogen Energy, 34 (17) : 7497–7501 DOI:10.1016/j.ijhydene.2008.11.065 |
| Niu Y, Shen H, Chen J, et al. 2011. Phytoplankton community succession shaping bacterioplankton community composition in Lake Taihu, China. Water research, 45 (14) : 4169–4182 DOI:10.1016/j.watres.2011.05.022 |
| Qu X F, Wang Y Z, Zhu X, et al. 2011. Bubble behavior and photo-hydrogen production performance of photosynthetic bacteria in microchannel photobioreactor. International Journal of Hydrogen Energy, 36 (21) : 14111–14119 DOI:10.1016/j.ijhydene.2011.04.189 |
| Schagerl M, Müller B. 2006. Acclimation of chlorophyll a and carotenoid levels to different irradiances in four freshwater cyanobacteria. Journal of Plant Physiology, 163 (7) : 709–716 DOI:10.1016/j.jplph.2005.09.015 |
| Zhang C, Zhang H, Zhang Z P, et al. 2014. Effects of mass transfer and light intensity on substrate biological degradation by immobilized photosynthetic bacteria within an annular fiber-illuminating biofilm reactor. Journal of Photochemistry and Photobiology B: Biology, 131 : 113–119 DOI:10.1016/j.jphotobiol.2014.01.015 |
| Zhou Q, Zhang P Y, Zhang G M. 2014. Biomass and carotenoid production in photosynthetic bacteria wastewater treatment: Effects of light intensity. Bioresource Technology, 171 : 330–335 DOI:10.1016/j.biortech.2014.08.088 |
 2017, Vol.
2017, Vol. 


