
中国科学院海洋研究所主办。
文章信息
- 刘琪, 吴中英, 焦绪栋, 刘冰, 李文军. 2017.
- LIU Qi, WU Zhong-Ying, JIAO Xu-Dong, LIU Bing, LI Wen-Jun. 2017.
- 藻蓝蛋白皮肤毒性实验研究
- Experimental Study of Dermal Toxicity of Phycocyanin
- 海洋科学集刊(52): 97-103
- Studia Marina Sinica(52): 97-103.
- http://dx.doi.org/10.12036/hykxjk20170317001
-
文章历史
- 收稿日期:2017-03-17
- 收修改稿日期:2017-06-21
2. 山东群英医学有限公司, 烟台 264005
2. Shandong Qunying Medicine Co. Ltd., Yantai 264005, China
作为海洋中一种重要的天然资源, 海藻植物近几年得到国内外众多研究者的青睐。通过对其化学组成成分开展研究, 发现藻类中含有丰富的生物活性物质和营养物质, 包括多糖类、蛋白类、多酚类、甾醇类等(韩玲等, 2013)。藻蓝蛋白(phycocyanin, PC)也称为藻蓝素, 主要存在于蓝藻中, 是一种天然的营养素。它属于捕光色素蛋白藻胆蛋白的一种, 分子量一般为30kD左右, 由两个亚基构成, 其载体蛋白以共价键形式连接开链吡咯发色团, 因此能够高效捕获光能, 吸收光谱为615~ 640nm, 为藻类的光合作用提供能源(Eriksen, 2008)。藻蓝蛋白可以从螺旋藻(Arthrospira spp.)中提取, 通过磷酸盐缓冲液冻融和超声破碎、硫酸铵沉淀获得藻蓝蛋白粗提液, 再经过两次羟基磷灰石柱(hydroxyapatite, HA)层析得到纯度较高的藻蓝蛋白。据研究, 藻蓝蛋白具有多种生物功能, 包括抗凝血(Sheih et al., 2009)、抑制炎症、调节免疫抗氧化、抗过敏以及抗肿瘤等(Sheih et al., 2010; Liu et al., 2015; Ravi et al., 2015; Wu et al., 2016)。同时, 因具有水溶性强、无毒、着色好且含大量易于吸收的氨基酸等优势特性, 藻蓝蛋白已被广泛应用于食品着色剂、保健品以及动物饲料中(Martelli, et al., 2014; El Baky et al., 2015)。
由于海藻天然无毒, 富含多种营养成分, 近几年已逐步被应用于化妆品领域。同样作为天然色素的藻红蛋白也被作为化妆品的配方应用于天然粉色和紫色的口红、眼线的着色剂研发(夏亚穆等, 2014)。然而, 将藻蓝蛋白应用于化妆品领域的研究很少。国内外相关研究发现, 天然的藻蓝蛋白具有清除羟基和H2O2等自由基的能力, 显示出抗衰老的功效(Lissi et al., 2000; Chen and Huang, 2006; Chu et al., 2010; Li et al., 2016)。在众多衰老理论中, 自由基促进衰老已成为大多数研究者所公认的事实(Junjaud et al., 2006)。自由基和活性氧是有氧代谢过程中生化反应产生的高活性分子, 具有很强的反应活性。当细胞内缺乏有效的抗氧化防御机制时, 氧化剂便会破坏细胞膜或细胞内分子, 如DNA、蛋白质等, 最终造成机体损伤和衰老(Cooke et al., 2003)。由于合成抗氧化剂具有一些毒性副作用, 因此天然来源的抗氧化剂藻蓝蛋白, 作为化妆品抗衰老活性成分将具有十分广阔的应用前景。
本文基于新西兰白兔模型, 将藻蓝蛋白作为化妆品应用于皮肤表面, 通过光毒性、急性经皮毒性以及皮肤变态反应的实验, 测定藻蓝蛋白对皮肤的毒性作用, 旨在探讨天然抗氧化剂——藻蓝蛋白用于化妆品研发的可行性, 为进一步开发新型的专一型或复合型无毒性抗衰老的化妆美容产品提供理论依据。
1 材料和方法 1.1 动物和试剂健康合格新西兰白兔66只, 雌雄各半, 体重为2.6~2.8kg(购于烟台拉斐尔生物科技有限公司)。实验动物采用常规饲料喂养, 自由饮水, 室温20~26℃, 日温差≤4℃, 相对湿度40%~70%, 采用时控开关自动控制照度, 明暗交替时间为12h:12h, 每日更换托盘。动物饲养于不锈钢笼具中, 每笼1只。实验前, 在此条件下饲养5天以适应环境, 实验期间给药剂量为2000mg/kg, 实验结束后将动物进行安乐死处理。
藻蓝蛋白(购自新大泽螺旋藻有限公司, 纯度为3.2, 用A620/A280表示), 纯净水(购自杭州娃哈哈集团有限公司), 肉桂醛(购自广东翁江化学试剂有限公司)。
1.2 仪器与设备飞利浦褪毛器、艾科UV辐照仪用于动物模型制备; 德国徕卡EG1150组织包埋机用于组织包埋; 德国徕卡rm2235切片机用于切片; 日本VIP6樱花组织脱水机用于组织脱水; 日本奥林巴斯显微镜CCD成像系统(DP21)用于观察并拍摄病理切片图片。
1.3 实验方法及测试 1.3.1 光毒性试验取新西兰白兔6只, 雌雄各半, 在进行光毒性测试之前的18~24h, 将动物脊柱两侧皮肤去毛, 试验部位皮肤需完好, 无损伤及异常。备4块去毛区(见图 1), 每块去毛面积约为2cm×2cm。将动物固定, 在动物去毛区1和2涂敷0.2mL受试物。单次给药, 经皮涂敷, 30min后, 左侧(去毛区1和3)用铝箔覆盖, 用胶带固定, 右侧使用UV进行辐照。分别于辐照后1、24、48和72h观察皮肤反应, 根据表 1判定每只动物皮肤反应评分(林静吟, 2010)。
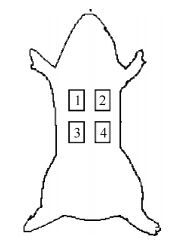
|
| 图 1 动物皮肤去毛区位置示意图 Fig. 1 Sketch map of the location of hair removal area of animal skin 注: 1.涂受试物、无照射; 2.涂受试物、照射; 3.不涂受试物、不照射; 4.不涂受试物、照射。 |
| 皮肤反应 | 积分 |
| 红斑和焦痂形成 | |
| 无红斑 | 0 |
| 轻微红斑(勉强可见) | 1 |
| 明显红斑 | 2 |
| 中度-重度红斑 | 3 |
| 严重红斑(紫红色)至轻微焦痂形成 | 4 |
| 水肿形成 | |
| 无水肿 | 0 |
| 轻微水肿(勉强可见) | 1 |
| 轻度水肿(皮肤隆起轮廓清晰) | 2 |
| 中度水肿(皮肤隆起约1mm) | 3 |
| 重度水肿(皮肤隆起超过1mm, 范围扩大) | 4 |
| 最高积分 | 8 |
取30只新西兰白兔, 按体重随机分为3组(每组10只个体), 设为空白对照组、溶媒对照组、藻蓝蛋白组。在试验期间, 记录各组动物的日观察指标及饮水量、进食量, 体重和增长率、死亡率。试验开始前24h剔除背部被毛, 暴露出约10cm× 16cm的皮肤拟染毒区。空白对照组仅做褪毛处理, 溶媒对照组喷涂纯净水, 藻蓝蛋白组以剂量2000mg/kg均匀涂敷受试物。将藻蓝蛋白与纯净水配制成可涂敷的胶状, 将受试物均匀涂敷于背部皮肤染毒区, 用薄胶片覆盖并用无刺激胶布固定, 24h后染毒结束, 用纯净水清除残留受试物, 观察14天并记录。观察期结束后进行剖检, 对涂抹部位的皮肤进行病理组织学分析。
1.3.3 皮肤变态反应试验取30只新西兰白兔, 按体重随机分为3组(每组10只个体), 设为空白对照组、肉桂醛对照组、藻蓝蛋白组。同上剔除背部左侧被毛, 暴露出约10cm× 8cm的皮肤拟左侧染毒区, 肉桂醛对照组喷涂1%肉桂醛。藻蓝蛋白组以剂量2000mg/kg均匀涂敷。
(1) 诱导接触阶段:将受试物均匀涂敷于背部皮肤左侧染毒区后用薄胶片覆盖, 无刺激胶布固定6小时、第7天和第14天以同样方法重复一次, 空白对照组在此阶段仅以纯净水涂敷。
(2) 激发接触阶段:末次诱导后14d, 同样暴露出约10cm×8cm的皮肤拟右侧染毒区, 将约0.2mL的受试物涂于皮肤右侧染毒区, 用一层薄胶片覆盖, 固定6h, 空白对照组在此阶段涂以受试物。激发接触后24h和48h使用纯净水清除残留受试物。观察皮肤反应, 按化妆品标准进行评分。若出现皮肤反应积分≥2时, 判为该动物出现皮肤变态反应阳性, 按化妆品标准判定受试物的致敏强度。
1.3.4 数据统计处理采用SPSS软件比较各组间的差异, 利用t检验判断差异是否显著。结果用平均数±标准差表示, 以P<0.05表示差异有统计学意义。
2 结果与分析 2.1 光毒性当单纯涂受试物且非照射区域未出现皮肤反应, 而涂受试物后经照射的区域出现皮肤反应分值之和≥2的动物数≥1只时, 判为受试物具有光毒性。统计结果显示, 藻蓝蛋白在2000mg/kg剂量下, 未观察到对新西兰白兔有明显的光毒毒性反应, 说明藻蓝蛋白作为化妆品外涂时不具有光毒性。
2.2 急性经皮毒性在整个试验期间, 各组动物均未出现死亡情况, 并且每次观察指标及饮水量、进食量也没有明显异常。与对照组比较, 藻蓝蛋白组白兔的体重和体重增长率未见有统计学差异, 见表 2。实验结束后, 对白兔进行剖检, 通过肉眼观察未发现各器官有组织异常现象。进一步对各组给药部位作切片染色, 进行病理学检查, 均未发现明显的异常状态(图 2)。
| 分组 | 实验前 | 给药第1天 | 给药第7天 | 给药第14天 |
| 空白对照组 | 2.7±0.1 | 2.7±0.1 | 2.8±0.2 | 2.9±0.2 |
| 溶媒对照组 | 2.7±0.1 | 2.8±0.2 | 2.9±0.1 | 3.0±0.2 |
| 藻蓝蛋白组 | 2.7±0.1 | 2.7±0.1 | 2.8±0.2 | 3.0±0.2 |
| 注:单位kg(平均值±标准偏差)。 | ||||
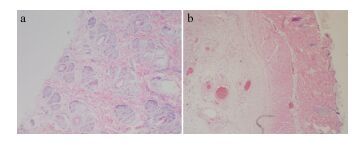
|
| 图 2 对照组(a)和藻蓝蛋白组(b)的皮肤组织病理切片对比 Fig. 2 Comparison of tissue pathological sections between control group (a) and phycocyanin group (b) of the skin tissue pathological sections |
在皮肤变态反应试验期间, 各组动物体重和体重增长率与对照组相比也未见有明显的统计学差异(表 3)。在藻蓝蛋白为2000mg/kg的给药剂量下, 新西兰白兔的皮肤未见变态反应(图 3)。而肉桂醛对照组能显著引起新西兰白兔变态反应, 皮肤变态反应积分≥2的动物有4只, 占实验组动物数的40%, 中等致敏强度; 藻蓝蛋白组和空白对照组均未见变态反应, 皮肤变态反应积分<2, 与肉桂醛对照组相比差异显著(P<0.05)(表 4)。实验结果表明, 反复接触藻蓝蛋白不会引起新西兰白兔皮肤出现红斑和水肿等过敏反应。将对空白组、肉桂醛对照组和藻蓝蛋白组给药部位作切片染色, 进行病理学检测, 结果表明相对于肉桂醛对照组, 藻蓝蛋白组未见明显异常(图 4)。
| 分组 | 实验前 | 实验结束 |
| 空白对照组 | 2.7±0.1 | 3.0±0.1 |
| 肉桂醛对照组 | 2.7±0.1 | 2.9±0.2 |
| 藻蓝蛋白组 | 2.7±0.1 | 3.0±0.1 |
| 注:单位kg(平均值±标准偏差)。 | ||
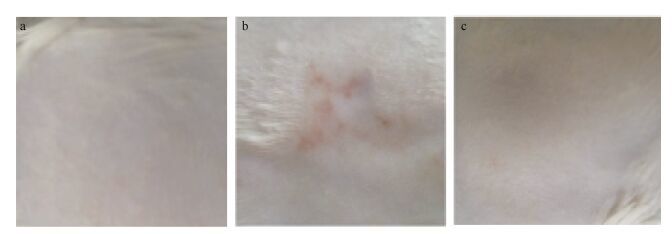
|
| 图 3 空白组(a), 肉桂醛组(b)和藻蓝蛋白组(c)的新西兰白兔皮肤对比 Fig. 3 The control group (a), cinnamaldehyde group (b) and phycocyanin (c) group of New Zealand white rabbits were compared in skin |
| 组别 | 数量(只) | 诱导剂量 | 激发剂量 | 观察时间(h) | 皮肤反应强度 | ≥2数量占比(%) | ||||||||
| 红斑 | 水肿 | |||||||||||||
| 0 | 1 | 2 | 3 | 4 | 0 | 1 | 2 | 3 | ||||||
| 空白对照组 | 10 | - | 2000 | 24 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 48 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |||||
| 肉桂醛对照组 | 10 | 1% | 1% | 24 | 0 | 0 | 2 | 0 | 0 | 0 | 1 | 1 | 0 | 40% |
| 48 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 1 | 1 | |||||
| 藻蓝蛋白组 | 10 | 2000 mg/kg | 2000 mg/kg | 24 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 48 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |||||
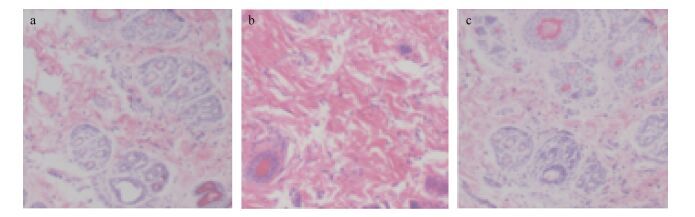
|
| 图 4 空白组(a)、肉桂醛组(b)和藻蓝蛋白组(c)的皮肤组织病理切片 Fig. 4 The control group (a), the cinnamaldehyde group (b) and the phycocyanin group (c) were organized for pathological sections of the skin |
本实验对藻蓝蛋白用作化妆品的可行性进行了初步探究, 测试了其对动物模型的毒性作用。研究发现, 当藻蓝蛋白在2000mg/kg剂量下涂抹于新西兰白兔的皮肤表面时, 对新西兰白兔均未观察到明显的光毒性、急性经皮毒性以及皮肤变态反应等毒副作用。但其结果是否能够外推到人类化妆品的有效性, 仍需与其他毒性试验结果相结合分析, 进行综合评价。目前, 已有很多研究证实了藻蓝蛋白的抗氧化活性以及清除自由基能力使其具有较强的抗衰老作用。正常人体内存在着超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSHPX)等氧化防御体系, 可以对抗氧化应激反应, 清除体内产生的高活性自由基, 从而起到抗衰老的作用, 但是随着老龄化, 免疫器官不断萎缩, 机体免疫抗衰老功能便会逐渐减弱。而藻蓝蛋白拥有良好的抗氧化能力, 它的出现或许将会成为新一代的抗衰老产品。Chu等(2010)从螺旋藻类中提取了包含藻蓝蛋白的水溶物, 利用小鼠细胞研究其清除自由基的抗氧化能力, 结果表明藻蓝蛋白对自由基诱导的细胞凋亡有保护作用, 而Niraj课题组则选择了线虫模型来测试藻蓝蛋白对线虫的抗衰老作用以及对内稳态蛋白质的抑制作用(Singh et al., 2015)。Harishkumar等人还研究了藻蓝蛋白在伤口愈合过程中对生长因子和细胞迁移的影响(Li et al., 2016)。最近, Castangia等(2016)克服了生物利用度问题, 将藻蓝蛋白成功封装入胶囊, 体外渗透实验发现这样更有利于藻蓝蛋白沉积在皮肤的深层, 从而改进了藻蓝蛋白对人类角质细胞的抗氧化活性, 这些研究都表明藻蓝蛋白具有在体内外作为抗氧化剂抵抗衰老的潜力。
4 结论与展望总而言之, 藻蓝蛋白能否大规模地用于美容驻颜以及化妆品行业, 取决于其是否具备良好的品质控制。我国对藻类蛋白质的开发利用时间较短, 大多还处于实验室研究阶段, 应用开发正在起步。因此, 藻种的选育、分离、提取、纯化工艺的改善, 活性成分的稳定, 涂面、口服和注射等给药途径的优化, 以及确定藻蓝蛋白的有效成分是其整体还是其代谢产物, 是我们未来需要进一步研究的重点内容。基于以上的研究, 藻蓝蛋白在化妆品领域亦具有广阔的应用前景。
| 韩玲, 张淑平, 刘晓慧. 2012. 海藻生物活性物质应用研究进展. 化工进展, 31 (8) : 1794–1800 |
| 林静吟, 冯小映, 陈玉兴. 2010. 跌打消肿贴的过敏性及急性毒性试验研究. 中药材, 33 (6) : 967–969 |
| 夏亚穆, 张振国, 林姣. 2014. 海洋藻类蛋白质生物功能的研究. 农产品加工, (12) : 60–63 DOI:10.3969/j.issn.1671-9646(s).2014.12.019 |
| Castangia I, Manca M L, Catalán-Latorre A, et al. 2016. Phycocyanin-encapsulating hyalurosomes as carrier for skin delivery and protection from oxidative stress damage. J Mater Sci Mater Med, 27 (4) : 75 DOI:10.1007/s10856-016-5687-4 |
| Chen T F, Huang Y C. 2006. Antioxidant and anticancer activities of selenium-containing phycocanin purified from Spirulina Platensis. Academic Periodical of Farm Products Processing, (8) : 55–58 |
| Chu W L, Lim Y W, Radhakrishnan A K, et al. 2010. Protective effect of aqueous extract from Spirulina platensis against cell death induced by free radicals. BMC Complement Altern Med, 10 : 53 DOI:10.1186/1472-6882-10-53 |
| Cooke M S, Evans M D, Dizdaroglu M, et al. 2003. Oxidative DNA damage: mechanisms, mutation, and disease. FASEB J, 17 (10) : 1195–1214 DOI:10.1096/fj.02-0752rev |
| El Baky H H A, El Baroty G S, Ibrahem E A. 2015. Functional characters evaluation of biscuits sublimated with pure phycocyanin isolated from Spirulina and Spirulina biomass. Nutr Hosp, 32 (1) : 231–241 |
| Eriksen N T. 2008. Production of phycocyanin-a pigment with applications in biology, biotechnology, foods and medicine. Appl Microbiol Biotechnol, 80 (1) : 1–14 DOI:10.1007/s00253-008-1542-y |
| Junjaud G, Rouaud E, Turpin F, et al. 2006. Age-related effects of the neuromodulator D-serine on neurotransmission and synaptic potentiation in the CA1 hippocampal area of the rat. J Neurochem, 98 (4) : 1159–1166 DOI:10.1111/jnc.2006.98.issue-4 |
| Li Y J, Han Z, Ge L, et al. 2016. C-phycocyanin protects against low fertility by inhibiting reactive oxygen species in aging mice. Oncotarget, 7 (14) : 17393–17409 DOI:10.18632/oncotarget.v7i14 |
| Lissi E A, Pizarro M, Aspee A, et al. 2000. Kinetics of phycocyanine bilin groups destruction by peroxyl radicals. Free Rad Biol Med, 28 (7) : 1051–1055 DOI:10.1016/S0891-5849(00)00193-3 |
| Liu Q M, Wang Y Z, Cao M J, et al. 2015. Anti-allergic activity of R-phycocyanin from Porphyra haitanensis in antigen-sensitized mice and mast cells. Int Immunopharmacol, 25 (2) : 465–473 DOI:10.1016/j.intimp.2015.02.032 |
| Martelli G, Folli C, Visai L, et al. 2014. Thermal stability improvement of blue colorant C-Phycocyanin from Spirulina platensis for food industry applications. Process Biochem, 49 (1) : 154–159 DOI:10.1016/j.procbio.2013.10.008 |
| Ravi M, Tentu S, Baskar G, et al. 2015. Molecular mechanism of anti-cancer activity of phycocyanin in triple-negative breast cancer cells. BMC Cancer, 15 : 768 DOI:10.1186/s12885-015-1784-x |
| Sheih I C, Fang T J, Wu T K. 2009. Isolation and characterisation of a novel angiotensin I-converting enzyme (ACE) inhibitory peptide from the algae protein waste. Food Chem, 115 (1) : 279–284 DOI:10.1016/j.foodchem.2008.12.019 |
| Sheih I C, Fang T J, Wu T K, et al. 2010. Anticancer and antioxidant activities of the peptide fraction from algae protein waste. J Agric Food Chem, 58 (2) : 1202–1207 DOI:10.1021/jf903089m |
| Singh N K, Sonani R R, Awasthi A, et al. 2015. Phycocyanin moderates aging and proteotoxicity in Caenorhabditis elegans. J Appl Phycol, 28 (4) : 2407–2417 |
| Wu Q H, Liu L, Miron A, et al. 2016. The antioxidant, immunomodulatory, and anti-inflammatory activities of Spirulina: an overview. Arch Toxicol, 90 (8) : 1817–1840 DOI:10.1007/s00204-016-1744-5 |
 2017, Vol.
2017, Vol. 


