文章信息
- 高祥兴, 高伟, 崔志松, 李馨子, 李倩, 韩彬, 周涛, 郑立. 2015.
- GAO Xiang-Xing, GAO Wei, CUI Zhi-Song, LI Xin-Zi, LI Qian, HAN Bin, ZHOU Tao, ZHENG Li. 2015.
- 海洋石油降解菌群的固定化及石油降解特性
- IMMOBILIZATION OF MARINE OIL-DEGRADATING BACTERIAL CONSORTIUN AND ITS DEGRADATION CHARACTERISTICS
- 海洋与湖沼, 46(4): 732-740
- Oceanologia et Limnologia Sinica, 46(4): 732-740.
- http://dx.doi.org/10.11693/hyhz20141000270
-
文章历史
- 收稿日期:2014-10-13
- 改回日期:2015-03-10
2. 青岛科技大学化工学院 青岛 266000
2. College of Chemistry and Chemical Engineering, Qingdao University of Science & Technology, Qingdao 266000, China
近年来由于各种自然或人为原因,海洋溢油事故频发。溢油污染大大超出并严重破坏了海洋生态环境的自净能力,从而直接或间接对人们的生产和生活产生影响(徐卫东等,1999; 陈尧,2003)。寻求环境友好且低成本的溢油清除策略是当前海洋环境治理急需解决的问题。目前,已有众多用于缓解和治理原油污染的方法(Obuekwe et al,2001)。其中传统的物理化学方法能够快速地消除溢油,但实际应用中往往只在溢油初期发挥较好的效果,且成本较高,并能造成二次污染(Obuekwe et al,2001)。此外,有研究表明(Dave et al,2006; Xia et al,2010),1989年美国阿拉斯加溢油产生的残存油污在20年后仍沉积于初始溢油岸滩区域,因而物理化学方法并不能完全清除溢油污染。
溢油生物修复方法是利用石油降解微生物的矿化作用使原油转化为CO2、H2O和自身生物量(Röling et al,2004;Chandran et al,2011)来清除污染海域的石油污物,与其它修复方式相比具有清洁、高效和低廉的优点(Ojo,2006),已成为最具发展潜力的溢油处理策略(Vogel,1996; Jansson et al,2000; Cunningham et al,2004)。然而,在实际生物修复应用中,很多问题需要克服解决,如添加微生物活性的维系(Mishra et al,2001)、开放海域的冲刷稀释(Tagger et al,1983; Macnaughton et al,1999)及土著微生物较弱的溢油生物修复能力等。面对以上问题,越来越多学者认为,微生物固定化技术是最好的解决途径。与施加游离微生物相比,微生物固定化技术具有以下优势:(1)因降解微生物高密度聚集,降解率提高;(2)生物降解稳定性及对各种稀释、捕食复杂环境的耐受性增强;(3)刺激微生物的生长繁殖及重复利用(Van Veen et al,1997; Wang et al,1997; Wang et al,2012)。
目前,利用固定化细菌进行降解多种污染物的研究已取得一定进展,并获得较好效果(Liang et al,2009; Tan et al,2014)。就固定化载体而言,应具有制备简易、易获得、低廉、物理性能可靠(Elliott et al,2007)(能抵御环境压迫和支撑起足够的微生物空间)等特点,如海藻酸钠、聚乙烯醇(PVA)(段晓琛等,2013; Surkatti et al,2014)、棉花纤维、壳聚糖等(Gentili et al,2006; Hou et al,2013; Lin et al,2014)。其中PVA因机械强度高、无毒等特性被认为是酶及微生物的有效包埋载体之一(Wang et al,2006),同时PVA亦具有一定的生物降解特性(Suzuki et al,1973; 王银善等,1991; Matsumura et al,1999; Chiellini,2003; 董丽娟等,2005)。此外,海藻酸钠作为固定化载体和菌体保护剂(郑立等,2012)同样受到关注。考虑到实际溢油生物修复过程的复杂性(微生物的环境兼容性、菌体活性维系等),本研究以实验室自主构建并获得国家发明专利保护(ZL201010223463.6)的海洋石油专性解烃菌群DC10作为目标菌株,利用高机械性能的PVA作为主要包埋载体,构建固定化微球骨架,辅以海 藻酸钠和活性炭作为菌体保护剂和细菌固定化微球网络疏松剂,进行固定化研究。通过考察细菌固定化微球物理化学性能确定固定化材料最佳浓度配比,为之后开展海洋溢油生物修复工作提供技术支持。
1 材料与方法 1.1 材料 1.1.1 降解菌群及培养基本文所涉及的降解菌群DC10包括2种(3株)海洋专性解烃菌,其中1株菌(PY97S)属于海杆菌(Marinobacter sp.),2株菌(97CO-6和97CO-5)属于食烷菌(Alcanivorax sp.)。上述3株菌已保藏至中国普通微生物菌种保藏中心,保藏号分别为CGMCC No.3735、CGMCC No.3736和CGMCC No.3244;
M8培养基(Cui et al,2008): 用于菌种活化及扩大培养;
ONR7a培养基(Dyksterhouse et al,1995): 模拟海水,用于石油培养基配制及细菌固定化微球机械性能测试;
石油培养基: 100mL ONR7a中添加1g原油(1%)。
1.1.2 主要仪器气相色谱质谱仪(GC/MS): 6890N-5973N型,Agilent公司; 大容量高速冷冻离心机: CR22GⅡ型,日本日立公司; 蠕动泵: BT00-300M型,保定兰格恒流泵公司; 悬臂式搅拌器: RW20DZM.n型,德国IKA公司; 恒温培养摇床: THZ-100型,上海一恒科学仪器公司; 电子天平: BSA224S-CW,Sartorius公司; 扫描电镜: Hitachi S-4800场发射扫描电镜,日本株式会社日立制作所。
1.2 试验方法 1.2.1 菌群培养及构建取-80°C甘油管藏的上述三种菌株分别于M8培养基中活化并扩大培养至OD630≈1.2 [(1.2—2.3)×109CFU/mL]; 分别通过高速离心(7500r/min,8min)获得菌体,无菌海水洗涤三次,按1︰10(W/V)比例无菌海水重悬; 将三种菌悬液按1︰1︰1比例(体积比)均匀混合构建石油降解菌群DC10,4°C保存待用。
1.2.2 细菌固定化微球制备材料组成研究采用蠕动泵滴落法(曹晖等,1997),将不同浓度PVA和海藻酸钠及活性炭按正交实验设计表(表 1)置于250mL三角瓶内,灭菌(121°C 15min)处理; 80°C恒温水浴中无菌海水溶解,后冷却至40°C将上述所构建菌群悬液与载体凝胶按照(V/V)1: 10的比例均匀混合,经蠕动泵滴入饱和硼酸和4% CaCl2的混合溶液(交联剂)中,悬臂式搅拌器(转速100r/min)搅拌,交联24 h,分离凝胶小球,无菌海水洗涤3次后4°C保存待用。
| 编号 | PVA(g/L) | 海藻酸钠(g/L) | 活性炭(g/L) |
| S1 | 20 | 10 | 5 |
| S2 | 20 | 20 | 10 |
| S3 | 20 | 30 | 15 |
| S4 | 40 | 10 | 10 |
| S5 | 40 | 20 | 15 |
| S6 | 40 | 30 | 5 |
| S7 | 60 | 10 | 15 |
| S8 | 60 | 20 | 5 |
| S9 | 60 | 30 | 10 |
随机挑取2—3个细菌固定化微球,用戊二醛对其进行固定处理,PBS缓冲液洗涤,乙醇梯度脱水; 二氧化碳临界点干燥,离子溅镀金,Hitachi S-4800场发射扫描电镜观察(李馨子等,2014)。
1.2.4 细菌固定化微球物理性能评价机械强度: 取2g上述4°C保存的细菌固定化微球放入含有等量沙石的50mL无菌海水中,28°C,125r/min摇床振荡,12d后记录破碎颗数并按公式(1)计算破碎率(毛书端等,2012),同时测定重量变化,按照公式(2)计算固定化微球磨损率,每种处理设3个平行。
| 破碎率=$\frac{{{d_1} - {d_2}}}{{{d_1}}} \times 100\% $ | (1) |
| 磨损率=$\frac{{{n_1} - {n_2}}}{{{n_1}}} \times 100\% $ | (2) |
式中,d1为实验初始时细菌固定化微球数,d2为实验结束时细菌固定化微球数; n1为实验初始时细菌固定化微球重量,n2为实验结束时细菌固定化微球重量。
传质性能: 挑选2g上述4°C保存的细菌固定化微球放入30mL含2滴蓝黑墨水的无菌水中,28°C,125r/min摇床振荡,每种处理设3个平行。测定溶液A406以间接表示固定化微球的传质性能。传质性能与溶液406nm吸光度呈反比(康春莉等,2007)。
粒径: 随机选取制备好的细菌固定化微球(n>20)紧密排成一排,游标卡尺测量微球总直径,重复3次,求其平均值作为每粒粒径,同时观察和记录固定化小球的外观特点。
菌含量: 于超净工作台内随机挑选30粒(≈1.7g)细菌固定化微球,无菌海水洗涤2—3次,后用无菌镊子扯碎并用6mL无菌海水浸泡,窝旋震荡使菌体充分析出。然后通过10倍梯度稀释平板计测菌体含量,每种处理设3个平行(Quek et al,2006)。
石油吸附性能测试: 取10g无菌固定化微球放入1.1.1所述的石油培养基内,以未添加固定化微球和菌液的石油培养基为阴性对照,28°C,125r/min摇床振荡12d,后按照1.2.5所述方法测定固定化微球石油吸附性能,每种处理设3个平行。
1.2.5 细菌固定化微球石油降解性能分析通过上述细菌固定化微球物理性能评价,选取最适组合进行石油降解性能测试。取10g细菌固定化微球进行石油降解分析,以添加含等量菌体的菌液为阳性对照,以未添加细菌固定化微球和菌液的石油培养基为阴性对照,条件为28°C,125r/min,12d; 观察石油乳化和降解情况,上述每种处理设3个平行。此外,为检测细菌固定化微球可持续性利用效果,在实验结束后收集细菌固定化微球并再次进行上述相同的降解实验(Pannier et al,2010)。
样品处理、石油降解率测定、石油烃分析方法如下: 降解12d后,离心(8000r/min,10min)除去固定化微球和菌体,50mL CH2Cl2分三次洗涤三角瓶并倒入分液漏斗内萃取其中的残余油污。取20 mL CH2Cl2相萃取液转移到尖底烧瓶中,40°C减压浓缩,氮气吹干,按照公式(3)计算降解率。
| 石油自然风华量(A)= m0-2.5m1 石油微球吸附量(B)= m0-2.5m2-A 石油菌剂降解量(C)= m0-2.5m3-A-B |
(3) |
石油降解(吸附/风化)率(D)= [(m0-T)/m0]×100% 式中,m0为最初加入培养基中的石油重量; m1为对照组萃取后残留油污重量; m2为固定化微球石油吸附后残留油污重量; m3为固定化菌剂石油降解后残留油污重量; T为石油自然风化量(A)或石油微球吸附量(B)或石油降解量(C)。另从CH2Cl2相准确量取2mL溶液,用无水Na2SO4脱水,过0.22μm耐有机溶剂滤膜。氮气吹干,以1mL正己烷重新溶解,加入内标氘代三联苯和5α-雄甾烷,用GC-FID,GC-MS对石油降解后残留的烷烃、芳香烃组分进行分析测定(郑立等,2012)。
2 结果与分析 2.1 细菌固定化微球物理性能测试按照既定的方案制备各组细菌固定化微球,实验中发现组S1、S4无法成球,在交联剂表面形成漂浮的泛白水膜,而组S7虽然有部分下沉但仍然漂浮于交联剂表面,呈T形且拖尾严重。除组S1、S4、S7外,其它各组均可以成球。
实验结果表明细菌固定化微球机械性能受PVA浓度的影响(图 1)。低浓度PVA细菌固定化微球的机械性能较差,例如组S2、S3细菌固定化微球磨损率和破碎率达50%以上,不适于海浪冲刷的岸滩环境; 当PVA浓度为40—60g/L时满足以最少的耗材获得相对较佳的固定化效果,例如组S5、S6细菌固定化微球磨损率在10%左右,而组S8、S9细菌固定化微球磨损率仅5%左右,具有较好的机械性能。此外,实验发现,在PVA-海藻酸钠-硼酸-CaCl2交联制备细菌固定化微球过程中,只有微球完全浸没于交联剂,且进行适度搅拌,才可避免细菌固定化微球接触凝聚成团,获得圆整的细菌固定化微球。
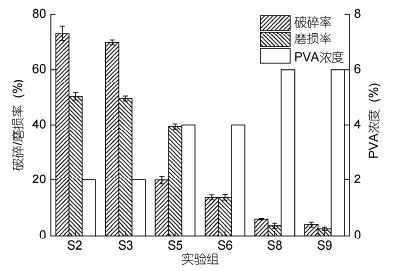 |
| 图 1 细菌固定化微球机械性能 Fig. 1 Mechanical properties of immobilized bacterial microspheres Sn: 试样分组 |
研究发现(表 2)各细菌固定化微球的粒径均在5mm左右,且随PVA浓度增大,粒径变化不大,但微球的传质性能和所固定的菌体含量差别较大。其原因可能是在给定蠕动泵流速下,PVA含量增高,固定化微球内部网络交联致密,致使空间减小,因而菌体含量降低、传质阻力增大。因此制备固定化微球时,在满足机械性能和成球性条件下,可采用较低的PVA、海藻酸钠及活性炭浓度。
| 编号 | 粒径(mm) | 菌含量(×109CFU/g) | 传质性能(×10 A406) |
| S2 | 4.55±0.49 | 2.00±0.14 | 1.62±0.07 |
| S3 | 5.93±0.25 | 4.70±0.28 | 1.34±0.31 |
| S5 | 5.15±0.21 | 7.13±0.18 | 1.72±0.04 |
| S6 | 5.50±0.28 | 4.66±0.23 | 2.04±0.03 |
| S8 | 5.45±0.35 | 7.71±0.30 | 1.00±0.07 |
| S9 | 6.05±0.07 | 2.70±0.28 | 2.04±0.04 |
| Sn: 试样分组 | |||
通过综合分析细菌固定化微球各物理性能参数,实验选取最适材料组合S5、S6和S8进行石油降解菌群DC10固定化,研究其石油降解特性。
2.2.1 固定化菌群DC10的石油降解率经过12d的降解实验,通过重量法测定各组石油降解率和固定化颗粒石油吸附性能。固定化微球石油吸附性能测试发现,石油培养基内固定化微球沉于液体底部,而石油浮于表层,微球表面仅少许油滴。经重量法测定,与阴性石油培养基(7.9%)相比,固定化微球石油吸附率4.5%,差异不显著。而菌群DC10固定化微球石油降解率均在25%以上,且优于游离菌体(FB)(图 2)。其中组S8相对于组S5和S6更具优势,石油降解率提高近7%。这说明微生物固定化技术可减弱外界复杂环境对菌体的干扰,保持其较高活性,且使得石油降解能力明显提高(P<0.05)。
 |
| 图 2 细菌固定化微球石油降解率 Fig. 2 Percentage of oil degradation by immobilized bacterial microspheres Sn: 试样分组; FB: 游离菌液; OA: 石油吸附性能; NC: 未添加细菌的自然风化; 柱形图上方不同字母之间表示差异显著P<0.05 |
通过GC-MS分析各组石油烃降解状况,结果显示游离菌群和各细菌固定化微球对石油烷烃芳烃都具有较好的降解效果,降解率在30%—45%之间。值得注意的是,相对于游离菌群,固定化菌群DC10对烷烃和芳烃具有更好的分解能力,其中S8微球石油烃降解率分别提高了7%和8%(图 3a和图 3b)。
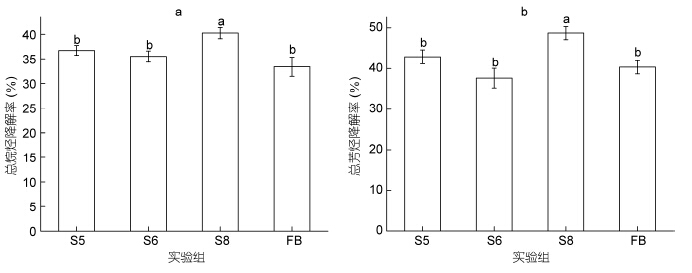 |
| 图 3 细菌固定化微球石油烃降解率Fig. 3 Percentage of biodegradation on oil hydrocarbons by immobilized bacterial microspheres a. 石油烷烃(C16-C32)降解率; b. 石油多环芳烃降解率 |
从烷烃组分来看(图 4),游离菌群和各固定化微球对C16—C32的烷烃具有很好的降解效果,C16、C17、C24、C27降解效果达到了50%。就烷烃而言,固
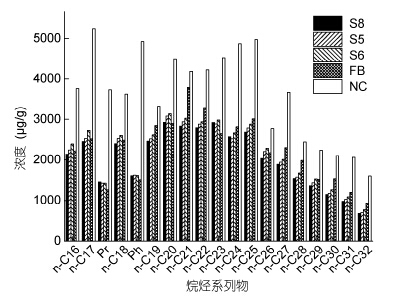 |
| 图 4 石油降解后烷烃含量 Fig. 4 Post-biodegradation alkane concentrations by immobilized bacterial microspheres n-Cm: m碳正构烷烃,如n-C16为十六碳正构烷烃; Sn: 表示试样分组; FB: 表示游离菌液; NC: 表示未添加细菌的自然风化 |
定化菌群DC10的降解特性没有发生变化,但是对高分子量烷烃的降解能力增强。特别是对C19、C22、C25—C32的分解能力。从芳烃降解情况来看(图 5),降解规律与烷烃基本一致,游离菌群DC10和固定化微球对石油中大部分芳烃(萘、芴、菲、誳)具有良好的生物降解能力,其中组S8优势更为显著。这说明微生物经过固定化处理后其生物活性得到提升。
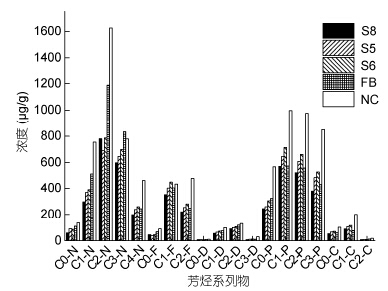 |
| 图 5 石油降解后芳烃含量 Fig. 5 The post-biodegradation concentrations of PAHs by immobilized bacterial microspheres C0-N、C0-F、C0-D、C0-P分别为萘、芴、二苯并噻吩、菲、誳; C1(C2,C3,C4)-萘表示在碳原子上修饰有1(2,3,4)个烷基; C1(C2,C3)-芴表示在碳原子上修饰有1(2,3)个烷基; C1(C2,C3)- 二苯并噻吩表示在碳原子上修饰有1(2,3)烷基; C1(C2,C3,C4)-菲表示在碳原子上修饰有1(2,3,4)个烷基; C1(2)誳表示在碳原子上修饰有1(2)个烷基)(Sn: 表示试样分组; FB: 表示游离菌液; NC: 未添加细菌的自然风化) |
为考察细菌固定化微球的二次利用性能,按照1.2.5中所述石油降解分析方法将细菌固定化微球回收后再次进行12d石油降解实验,发现石油降解率依然保持在20%左右(图 6),相对于首次降解石油降解率有所下降,这可能是在降解过程中有部分菌体溢出,菌体活性受到影响。但仍有部分菌体很好地固定在微球内部网络结构空间中,并在较长时间内保持了对石油的降解活性。
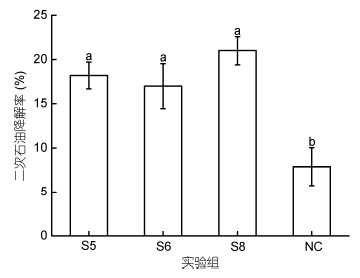 |
| 图 6 细菌固定化微球二次石油降解效果Fig. 6 Percentage post-biodegradation on oil by immobilized bacterial microspheres that recycled Sn: 表示试样分组; NC: 表示未添加细菌的自然风化 |
通过物理性能和石油降解性能分析,选取S8组细菌固定化微球经过相应处理于扫描电镜下观察(图 7a和b),发现微球内部凹凸有致,孔洞密集,呈蜂窝状相互连接,为菌体提供较大的寄居空间; 在具体结构方面,PVA构成微球的主力骨架,活性炭和海藻酸钠起分散疏松内部网络的辅助作用,菌体则吸附于微球的网络骨架中,形态完好,分布均匀。此外,石油降解12d后的固定化微球于扫描电镜下观察发现细菌具有分裂增殖现象(图 6c),说明细菌经过固定化包埋处理后不仅可以得到一定的保护,还可以在固定化网络空间中生长繁殖,从而可以保持细菌的生物活性并有利于提高对石油的降解能力。
3 讨论本文以聚乙烯醇(PVA)和海藻酸钠为主要材料对海洋石油降解菌群进行固定化研究,以期获得菌群固定化制剂所需最佳材料浓度及制备流程,并为实际应用作准备。研究发现海藻酸钠和PVA浓度在固 定化过程中起关键作用,实验选择合适配比的复合材料,既解决了PVA的粘连性又解决了海藻酸钠的脆弱性问题(Long et al,2004)。有文献(Wang et al,2006; 赖子尼等,2008; 茆云汉等,2013)报道,利用4%—12%浓度的PVA对细菌具有较好的固定化效果且传输性能良好。PVA浓度过高,固定化微球制备操作困难,交联时间延长,从而对微球内部菌体活性造成损伤(Kostka et al,2011); PVA浓度过低则会因PVA凝胶在同质溶液内弱小的分子间作用力无法抵抗凝胶的自由流动,导致固定化微球内部交联聚合程度降低,机械性能减弱,同时成球性较差(Wang et al,2006)。此外,研究发现低浓度海藻酸钠(<2%)无法促进固定化颗粒的形成(组S1、S4和S7凝胶无法成球),原因可能是海藻酸钠在PVA-海藻酸钠微球构建过程中,早于PVA迅速络合Ca2+形成微网络,进而减弱PVA凝胶的自由流动和减小凝胶分子间的距离,促进固定化微球的形成。Kobayashi等(1998)通过反复冻融降低分子间距离,促进分子内部氢键的形成的方式获得固定化微球。SEM扫描图片(图 7b)显示海藻酸钠以网络形式很好地分散于PVA骨架之间,从而证实以上分析。Pang等(2011)利用PVA对Pseudomonas aeruginosa固定化吸附重金属Cr的研究表明,选取6%浓度PVA进行固定化研究可获得较好的效果,这与本研究结果相一致。同时研究发现辅以适度搅拌(悬臂式搅拌器100r/min)可解决固定化微球制备交联成团的问题。
 |
| 图 7 固定化微球扫描电镜图析Fig. 7 Scanning electron micrograph of the bacterial immobilized microspheresa. 横截面结构; b. 内部结构;(1: 固定化的菌体,2: PVA骨架,3: 海藻酸钠和活性炭); c. 石油降解后固定化微球内部结构 |
海浪冲刷和稀释是海洋溢油生物修复过程中面临的主要问题。已有利用固定化微生物去除环境中污染物的报道(Cunningham et al,2004; Nuñal et al,2014)并取得良好的生态修复效果。Xu等(2010)利用土著石油降解菌群以花生壳为固定化载体修复被石油污染的土壤,固定化体系修复效果(61%)显著好于游离菌体(27%)。Díaz等(2002)以聚丙烯纤维为载体固定化极耐盐菌群MPD-M,发现随着盐度增高(0—180g/L)其生物降解效率提高。本研究发现固定化菌体系统较游离菌体亦具有明显的石油降解效果(P<0.05),并且降解特性没有变化,总烷烃和芳烃降解率均在50%左右,与相关研究结果一致。胡晓亮等(2011)发现细菌可以利用海藻酸钠作为生长的唯一碳源,因而研究中添加的部分海藻酸钠可以在一定程度上促进固定化微球内部菌体的繁殖(李馨子等,2014),从而使得固定化菌剂具有优于游离菌液的石油降解效果。另一方面Kim等(2006)发现细胞经固定化后细胞膜发生变化,增强了对环境的耐抗性,从而可以抵抗石油分解过程中产生的对微生物代谢具有抑制作用的化合物(环烷酸等)(Lu et al,2010)。本研究中固定化菌剂系统为菌体提供了良好的储存空间和保护环境,降低外部环境变化对菌体造成的影响。同时固定化菌剂石油降解后扫描电镜观察发现细菌可以在固定化网络结构中生长繁殖,可见研究获得的PVA固定化细菌体系对包埋其中的细菌具有一定的浓度和生物活性维系作用(Long et al,2004),以此减轻海水的冲刷及稀释,从而发挥石油降解菌群的长期修复作用。有研究(郑立等,2012; 崔志松等,2013)表明菌群DC10在海上突发溢油事故或者海洋原油污染区域的清油治理中取得较好效果,但菌体受海浪冲刷难以定植且菌体活性受到不利生境的影响,因此菌群DC10固定化微球可望为解决这个问题提供思路与方法。
利用固定化海洋石油降解菌群进行溢油生物修复的研究尚处于初级阶段,在以下几方面仍需加强研究,以发展实用的海洋溢油生物修复技术:(1)细菌固定化微球的常规保存方式,使固定化菌剂能够长期保存,可用于溢油的应急处置;(2)细菌固定化微球实际溢油修复的施用方法,如通过将固定化菌剂填于网袋、围栏条带等物理方式固定于受污染岸滩区域从而发挥长期修复作用;(3)细菌固定化微球的环境耐受性(温度、盐度、寡营养等因素)及对环境响应情况(微球内部菌群和环境生境变化等)的评估等。
4 结论本文通过包埋方式将具有良好石油降解性能的海洋石油降解菌群DC10进行固定化研究,确定了DC10固定化微球制备过程中PVA和海藻酸钠及活性炭作为载体的最优浓度。研究表明,以6% PVA,2%海藻酸钠及0.5%活性炭作为载体可以较快捷地制备细菌固定化微球,微球具有较好的机械性能、传质性能。石油降解性能分析表明固定化DC10菌群后,固定化菌剂相对于游离菌体(FB)不仅能提高石油降解率,并且具备连续石油降解能力,该技术展现出较高的岸滩石油污染生物修复应用潜力。
| 王银善, 庞学军, 方慈祺等, 1991. 共生细菌SB1降解聚乙烯醇的研究I. 共生细菌SB1的分离及某些性质. 环境科学学报, 11(2): 236—241 |
| 毛书端, 张小平, 牛 曼, 2012. 2种藻菌固定化改进方法的比较及优化研究. 中国环境科学, 32(5): 869—874 |
| 李馨子, 高 伟, 崔志松等, 2014. 海洋石油降解菌Alcanivorax Sp.97CO-5的固定化及其石油降解效果. 海洋环境科学, 33(3): 383—388 |
| 陈 尧, 2003. 中国近海石油污染现状及防治. 工业安全与环保, 29(11): 20—24 |
| 茆云汉, 王建龙, 2013. 聚乙烯醇固定化微生物新方法的研究. 环境科学学报, 33(2): 370—376 |
| 郑 立, 崔志松, 高 伟等, 2012. 海洋石油降解菌剂在大连溢油污染岸滩修复中的应用研究. 海洋学报, 34(3): 163—172 |
| 胡晓亮, 周国燕, 2011. 海藻酸钠和溶菌酶复合涂膜对马陆葡萄贮藏的保鲜效果. 食品科学, 32(20): 271—276 |
| 段晓琛, 盛 军, 徐甲坤等, 2013. 海洋脂肪酶ADM47601固定化方法的研究. 海洋与湖沼, 44(5): 1311—1317 |
| 徐卫东, 汪家骝, 1999. 海洋石油开发中含油污水处理与溢油防治技术. 油气田环境保护, 9(2): 26—29 |
| 曹 晖, 彭珍荣, 1997. 一种制备珠型固定化细胞颗粒的简易方法. 微生物学通报, 24(4): 254—254 |
| 崔志松, 李 倩, 高 伟等, 2013. 复合菌液在模拟溢油岸滩修复中的应用. 应用与环境生物学报, 19(2): 324—329 |
| 康春莉, 高红杰, 郭 平等, 2007. 吸附铅、镉固定化细菌胞壁多糖小球包埋条件的优化选择. 生态环境, 16(3): 825—829 |
| 董丽娟, 雷 武, 夏明珠等, 2005. 聚乙烯醇的生物降解. 中国生物工程杂志, 25(7): 28—33 |
| 赖子尼, 崔英德, 严兆强, 2008. PVA-海藻酸钠-活性炭共聚物水凝胶氧气渗透性能研究. 材料导报, 22(4): 152—155 |
| Chandran P, Das N, 2011. Degradation of diesel oil by immobilized Candida tropicalis and biofilm formed on gravels. Biodegradation, 22(6): 1181—1189 |
| Chiellini E, Corti A, D'antone S et al, 2003. Biodegradation of poly (vinyl alcohol) based materials. Progress in Polymer Science, 28(6): 963—1014 |
| Cui Z S, Lai Q L, Dong C M et al, 2008. Biodiversity of polycyclic aromatic hydrocarbon-degrading bacteria from deep sea sediments of the Middle Atlantic Ridge. Environmental Microbiology, 10(8): 2138—2149 |
| Cunningham C J, Ivshina I B, Lozinsky V I et al, 2004. Bioremediation of diesel-contaminated soil by microorganisms immobilised in polyvinyl alcohol. International Biodeterioration & Biodegradation, 54(2—3): 167—174 |
| Dave R, Madamwar D, 2006. Esterification in organic solvents by lipase immobilized in polymer of PVA-alginate-boric acid. Process Biochemistry, 41(4): 951—955 |
| Díaz M P, Boyd K G, Grigson S J W et al, 2002. Biodegradation of crude oil across a wide range of salinities by an extremely halotolerant bacterial consortium MPD-M, immobilized onto polypropylene fibers. Biotechnology and Bioengineering, 79(2): 145—153 |
| Dyksterhouse S E, Gray J P, Herwig R P et al, 1995. Cycloclasticus pugetii gen. nov., sp. nov., an aromatic hydrocarbon-degrading bacterium from marine sediments. International Journal of Systematic Bacteriology, 45(1): 116—123 |
| Elliott C, Ye Z, Mojumdar S C et al, 2007. A potential bacterial carrier for bioremediation. Journal of Thermal Analysis and Calorimetry, 90(3): 707—711 |
| Gentili A R, Cubitto M A, Ferrero M et al, 2006. Bioremediation of crude oil polluted seawater by a hydrocarbon-degrading bacterial strain immobilized on chitin and chitosan flakes. International Biodeterioration & Biodegradation, 57(4): 222—228 |
| Hou D Y, Shen X R, Luo Q et al, 2013. Enhancement of the diesel oil degradation ability of a marine bacterial strain by immobilization on a novel compound carrier material. Marine Pollution Bulletin, 67(1—2): 146—151 |
| Jansson J K, Bj?rkl?f K, Elvang A M et al, 2000. Biomarkers for monitoring efficacy of bioremediation by microbial inoculants. Environmental Pollution, 107(2): 217—223 |
| Kim M K, Singleton I, Yin C -R et al, 2006. Influence of phenol on the biodegradation of pyridine by freely suspended and immobilized Pseudomonas putida MK1. Letters in Applied Microbiology, 42(5): 495—500 |
| Kobayashi M, Kanekiyo M, Ando I, 1998. A study of molecular motion of PVA/water system by high-pressure 1H pulse-NMR method. Polymer Gels and Networks, 6(5): 347—354 |
| Kostka J E, Prakash O, Overholt W A et al, 2011. Hydrocarbon- degrading bacteria and the bacterial community response in gulf of mexico beach sands impacted by the deepwater horizon oil spill. Applied and Environmental Eicrobiology, 77(22): 7962—7974 |
| Liang Y T, Zhang X, Dai D J et al, 2009. Porous biocarrier- enhanced biodegradation of crude oil contaminated soil. International Biodeterioration & Biodegradation, 63(1): 80—87 |
| Lin M, Liu Y H, Chen W W et al, 2014. Use of bacteria- immobilized cotton fibers to absorb and degrade crude oil. International Biodeterioration & Biodegradation, 88: 8—12 |
| Long Z -E, Huang Y H, Cai Z L et al, 2004. Immobilization of Acidithiobacillus ferrooxidans by a PVA-boric acid method for ferrous sulphate oxidation. Process Biochemistry, 39(12): 2129—2133 |
| Lu M, Zhang Z Z, Qiao W et al, 2010. Remediation of petroleum-contaminated soil after composting by sequential treatment with fenton-like oxidation and biodegradation. Bioresource Technology, 101(7): 2106—2113 |
| Macnaughton S J, Stephen J R, Venosa A D et al, 1999. Microbial population changes during bioremediation of an experimental oil spill. Applied and Environmental Microbiology, 65(8): 3566—3574 |
| Matsumura S, Tomizawa N, Toki A et al, 1999. Novel poly (vinyl alcohol)-degrading enzyme and the degradation mechanism. Macromolecules, 32(23): 7753—7761 |
| Mishra S, Jyot J, Kuhad R C et al, 2001. Evaluation of inoculum addition to stimulate in situ bioremediation of oily-sludge- contaminated soil. Applied and Environmental Microbiology, 67(4): 1675—1681 |
| Nual S N, Santander-De Leon S M S, Bacolod E et al, 2014. Bioremediation of heavily oil-polluted seawater by a bacterial consortium immobilized in cocopeat and rice hull powder. Biocontrol Science, 19(1): 11—22 |
| Obuekwe C O, Al-Muttawa E M, 2001. Self-immobilized bacterial cultures with potential for application as ready-to-use seeds for petroleum bioremediation. Biotechnology Letters, 23(13): 1025—1032 |
| Ojo O A, 2006. Petroleum-hydrocarbon utilization by native bacterial population from a wastewater canal Southwest Nigeria. African Journal of Biotechnology, 5(4): 333—337 |
| Pang Y, Zeng G M, Tang L et al, 2011. Cr (VI) reduction by Pseudomonas aeruginosa immobilized in a polyvinyl alcohol/sodium alginate matrix containing multi-walled carbon nanotubes. Bioresource Technology, 102(22): 10733—10736 |
| Pannier A, Oehm C, Fischer A R et al, 2010. Biodegradation of fuel oxygenates by sol-gel immobilized bacteria Aquincola tertiaricarbonis L108. Enzyme and Microbial Technology, 47(6): 291—296 |
| Quek E, Ting Y P, Tan H M, 2006. Rhodococcus sp. F92 immobilized on polyurethane foam shows ability to degrade various petroleum products. Bioresource Technology, 97(1): 32—38 |
| R?ling W F M, Milner M G, Jones D M et al, 2004. Bacterial community dynamics and hydrocarbon degradation during a field-scale evaluation of bioremediation on a mudflat beach contaminated with buried oil. Applied and Environmental Microbiology, 70(5): 2603—2613 |
| Surkatti R, El-Naas M H, 2014. Biological treatment of wastewater contaminated with p-cresol using Pseudomonas putida immobilized in polyvinyl alcohol (PVA) gel. Journal of Water Process Engineering, 1: 84—90 |
| Suzuki T, Ichchara Y, Yamada M et al, 1973. Some characteristics of Pseudomonas 0-3 which utilizes polyvinyl alcohol. Agricultural and Biological Chemistry, 37(4): 747—756 |
| Tagger S, Bianchi A, Julliard M et al, 1983. Effect of microbial seeding of crude oil in seawater in a model system. Marine Biology, 78(1): 13—20 |
| Tan L, Li H, Ning S X et al, 2014. Aerobic decolorization and degradation of azo dyes by suspended growing cells and immobilized cells of a newly isolated yeast Magnusiomyces ingens LH-F1. Bioresource Technology, 158: 321—328 |
| Van Veen J A, Van Overbeek L S, Van Elsas J D et al, 1997. Fate and activity of microorganisms introduced into soil. Microbiology and Molecular Biology Reviews, 61(2): 121—135 |
| Vogel T M, 1996. Bioaugmentation as a soil bioremediation approach. Current Opinion in Biotechnology, 7(3): 311—316 |
| Wang J L, Liu P, Qian Y, 1997. Biodegradation of phthalic acid esters by immobilized microbial cells. Environment International, 23(6): 775—782 |
| Wang Y J, Yang X J, Li H Y et al, 2006. Immobilization of Acidithiobacillus ferrooxidans with complex of PVA and sodium alginate. Polymer Degradation and Stability, 91(10): 2408—2414 |
| Wang Z Y, Xu Y, Wang H Y et al, 2012. Biodegradation of crude oil in contaminated soils by free and immobilized microorganisms. Pedosphere, 22(5): 717—725 |
| Xia Y Q, Boufadel M C, 2010. The role of stratigraphy and geomorphology on the persistence of the exxon valdez oil spill in Alaska. Geological Society of America Abstracts with Programs, 42(1): 94 |
| Xu Y H, Lu M, 2010. Bioremediation of crude oil-contaminated soil: comparison of different biostimulation and bioaugmentation treatments. Journal of Hazardous Materials, 183(1—3): 395—401 |
 2015, Vol. 46
2015, Vol. 46


