文章信息
- 王金凤, 李才文, 李蒙, 宋书群. 2015.
- WANG Jin-Feng, LI Cai-Wen, LI Meng, SONG Shu-Qun. 2015.
- 血卵涡鞭虫感染三疣梭子蟹的病原形态学及组织病理学变化
- MORPHOLOGY AND HISTOPATHOLOGY OF PARASITIC DINOFLAGELLATE HEMATODINIUM SP. INFECTING PORTUNUS TRITUBERCULATUS
- 海洋与湖沼, 46(4): 748-757
- Oceanologia et Limnologia Sinica, 46(4): 748-757.
- http://dx.doi.org/10.11693/hyhz20141100309
-
文章历史
- 收稿日期:2014-11-10
- 改回日期:2014-12-30
2. 中国科学院大学 北京 100049
2. Graduate University of Chinese Academy of Sciences, Beijing 100049, China
三疣梭子蟹(Portunus trituberculatus),俗称梭子蟹,属于甲壳纲,十足目,梭子蟹科。因其养殖周期相对较短、食用价值高、养殖利润丰厚等优势,自1981年被列为海洋水产养殖对象,已经成为我国沿海地区重要的养殖品种(孙颖民等,1984)。2012年,我国三疣梭子蟹的养殖面积达到29036公顷,年产量约为99580吨; 山东半岛梭子蟹的养殖面积约9000公顷,占全国养殖规模的31%左右(中国农业部渔业局,2013)。然而,随着三疣梭子 蟹养殖规模的不断扩大,生产中养殖条件相对落后、养殖技术及疾病防控技术还不完善等问题日益显现。近年来病害问题,特别是“牛奶病”、“牙膏病”、“黄水病”等新近出现的流行性疾病,对三疣梭子蟹的人工养殖造成了严重的经济损失(许文军等,2007a,c; 刘淇等,2007; 施慧等,2008)。
血卵涡鞭虫(Hematodinium spp.)是一类感染海水甲壳类的寄生性甲藻(parasitic dinoflagellates),隶属于甲藻门(Sarcomastigophora),寄生藻目(Syndinida),寄生藻科(Syndiniceae),血卵涡鞭虫属(Hematodinium)(Stentiford et al,2005; 李才文等,2014)。该寄生性病原先后在多个国家和地区的野生甲壳动物群体中大范围流行,严重影响了挪威龙虾(Nephrops norvegicus)、美国兰蟹(Callinectes sapidus)、蛛雪蟹(Chionoecetes opilio)、白氏雪蟹(C. bairdi)等多种重要经济甲壳类的渔业生产(Stentiford et al,2005)。近年来,血卵涡鞭虫(Hematodinium sp.)先后在我国浙江舟山、广东汕头和山东半岛海域的主要经济甲壳类中发现和报道,并已确定该寄生性病原是近年来导致养殖三疣梭子蟹和汕头牛田洋养殖青蟹“牛奶病”主要病原之一(许文军等,2007b; Li et al,2008; 许文军等,2010; Li et al,2013)。
目前国内对于血卵涡鞭虫的相关研究较少,且主要集中于实地调查、病原确定、诊断技术等,尚缺乏血卵涡鞭虫的致病机制、生活史特征、病原-宿主相互作用及传播扩散机制等方面的研究,这些基础研究的缺失制约了在实际渔业生产中针对该寄生性病原的预防和控制。因此,本文对于自然感染和人工感染血卵涡鞭虫的养殖三疣梭子蟹的病原形态学和宿主组织病理变化进行了系统研究,以期更深入理解该寄生性病原的致病机理和染病宿主的发病机制,为在实际渔业生产中预防和控制血卵涡鞭虫流行病的发生提供理论依据。
1 材料与方法 1.1 材料来源本实验所用三疣梭子蟹(Portunus trituberculatus)(以下简称梭子蟹)于2013年9月至11月间采自青岛市黄岛区大场镇水产养殖基地的梭子蟹养殖池塘[盐度(28±1),温度(26±2)°C]中,样品置于泡沫塑料箱中,保持湿润并低温充氧,迅速运回实验室进行进一步研究。
1.2 病原检测根据Stentiford等(2005)的血涂片法对三疣梭子蟹是否感染血卵涡鞭虫(Hematodinium sp.)进行初步检测。具体步骤如下: 用75%酒精对梭子蟹游泳足基部擦拭消毒,用1mL无菌注射器于其关节膜处抽取约200μL血淋巴,滴1—2滴于载玻片上,混合大致等量的中性红溶液(中性红 : PBS = 0.02% W/V),制作血涂片,在显微镜(Olympus BX53)下进行观察并拍照记录。剩余血淋巴加入到盛有800μL无水乙醇的1.5mL离心管中固定,于-20°C下冷冻保存以用于DNA提取,并经特异性分子生物学检测(Small et al,2007)最终确定其感染状态。具体方法如下: 将用无水乙醇固定保存的梭子蟹血淋巴样品,按TIANGEN试剂盒说明书提取基因组总DNA用于PCR反应; 反应体系总体积为20μL,分别包括超纯水7.6μL,引物(正向HITS1F 5'-CATTCACCGTGAACCTTAGCC-3'; 反向HITS1R 5'-CTAGTCATACGTTTGAA GAAAGCC-3')各1.2μL,DNA模板1.2μL,PCR mix(1mmol/L KCl,0.2mmol/L Tris-HCl,0.03mmol/L MgCl2,4μm dNTPs,1U Taq DNA聚合酶)10μL; PCR反应条件为: 94°C预变性5min,94°C变性30s,56°C退火30s,72°C延伸30s; 共30个循环,最后72°C延伸10min,4°C保存。取3μL PCR扩增产物进行1.5%的琼脂糖凝胶电泳,于紫外光照条件下观察特征条带(约300bp)(如图 1所示)存在与否以辨别梭子蟹是否感染血卵涡鞭虫。经检测确定感染状态的梭子蟹个体分别暂养于实验室的循环水系统中,待进行下一步研究。本文参照Appleton 等(1998)对于感染程度的定义,将感染的第I阶段划分为感染早期,第II和第III阶段划分为感染中期,第IV阶段划分为感染晚期。
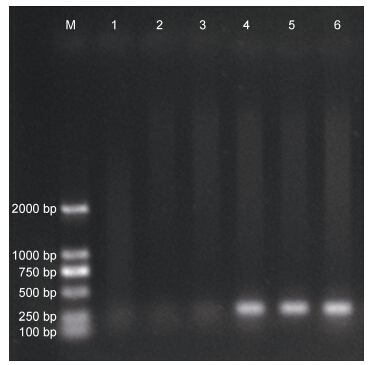 |
| 图 1 寄生虫甲藻血卵涡鞭虫的特异性PCR检测结果Fig. 1 Diagnosis of the parasitic dinoflagellate Hematodinium sp. using a specific PCR assay M: DNA标记; 1—3: 健康蟹; 4—6: 病蟹 |
共44只经血淋巴检测和PCR检测(方法见1.2)诊断没有血卵涡鞭虫感染的梭子蟹暂养在两个配有生物滤器和紫外消毒装置的300L玻璃缸中[盐度(28±1),温度(26±2)°C],用于人工感染实验。从感染血卵涡鞭虫的梭子蟹中抽取血淋巴,通过显微计数,估算血淋巴中血卵涡鞭虫细胞浓度,并用PBS缓冲液稀释终浓度至约106cells/mL作为注射液; 将受试梭子蟹第五步足和蟹体软组织结合处用酒精(75%)擦拭干净,小心注入100µL注射液(大约105个病原细胞)。实验期间(共20天),每天定时投喂蛤蜊肉一次,并观测评估已进行人工注射侵染梭子蟹的生活状况,及时取出濒死实验蟹进行组织病理样品采集(详细步骤见1.4)。注射感染后第20天,存活的实验梭子蟹经解剖、取样处理后用于组织病理学诊断(见1.4)。
1.4 病理组织样品制备及观察相关研究表明,血卵涡鞭虫对甲壳类动物的肝胰腺、心脏、鳃和步足肌肉等组织器官造成明显的影响或病变(Stentiford et al,2000,2005; Wheeler et al,2007)。因此,本实验中选取经检测确定已感染血卵涡鞭虫的注射感染的三疣梭子蟹进行解剖,取肝胰腺、心脏、鳃丝和步足肌肉等组织块于10%海水福尔马林固定,48h后转移到75%酒精中长期保存或进行下一步处理; 参考Wheeler等(2007)的样品处理和石蜡切片技术处理固定样品,而后经系列脱水后进行H & E(hematoxylin and eosin)染色,切片经盖片、封片后于显微镜(Olympus BX53)下观察实验三疣梭子蟹组织病理变化并拍摄数码照片,记录保存。
2 结果与分析 2.1 样品感染率和感染程度取样期间共采集了170只梭子蟹,其中25只梭子蟹经检测确定感染血卵涡鞭虫,感染率为14.7 %。其中13只处于感染早期,3只处于感染中期,9只处于感染晚期。
人工侵染实验的44只梭子蟹,除实验前5天死亡的5只梭子蟹(可能由于人为操作导致机械损伤或偶发细菌感染死亡)未进行检测之外,其余39只经检测均感染血卵涡鞭虫,可见随着时间推移,感染程度逐渐加重(具体见表 1),其中7只处于感染早期,8只处于感染中期,24只处于感染晚期,感染率≥88.6%(表 2)。
| 时间(d) | 死亡或垂死(只) | 感染状态(Y/N) | 感染程度(+/++/+++) |
| 1 | 1 | — | — |
| 2 | 3 | — | — |
| 3 | 1 | — | — |
| 4 | 0 | — | — |
| 5 | 0 | — | — |
| 6 | 1 | Y | + |
| 7 | 1 | Y | + |
| 8 | 2 | Y | + |
| 9 | 2 | Y | + |
| 10 | 1 | Y | + |
| 11 | 0 | — | — |
| 12 | 0 | — | — |
| 13 | 2 | Y | ++ |
| 14 | 1 | Y | ++ |
| 15 | 2 | Y | ++ |
| 16 | 2 | Y | ++ |
| 17 | 1 | Y | ++ |
| 18 | 0 | — | — |
| 19 | 0 | — | — |
| 20天及以后 | 24 | Y | +++ |
| Y: 感染; N: 未感染; —: 未处理; +: 轻度感染; ++: 中度感染; +++: 重度感染 | |||
| 样品总数(只) | 感染早期(只) | 感染中期(只) | 感染晚期(只) | 感染率(%) | ||
| 实地取样 | 170 | 13 | 3 | 9 | 14.7 | |
| 人工侵染 | 44 | 7 | 8 | 24 | 88.6 | |
感染血卵涡鞭虫的病蟹血淋巴由具有很强凝聚能力的青蓝色透明血液转变为白浊牛奶状或黄水状丧失凝聚能力的液体,因此也被称为“牛奶病”或“黄水病”(许文军等,2007c)。显微镜检法可观察到在感染早期病蟹的血淋巴中仍有大量的颗粒细胞、半颗粒细胞、血细胞等淋巴细胞,其中夹杂着少量的卵圆形或丝状的血卵涡鞭虫滋养体结构(图 2a); 感染中期病蟹的血液中淋巴细胞数量急剧减少,而被大量的卵圆形的滋养体结构(图 2b)或团聚体结构(图 2e)的血卵涡鞭虫所占据,其中常见到双核、三核以及多核的滋养体结构(图 2c、d); 感染晚期病蟹血淋巴中细胞完全被血卵涡鞭虫的孢子前细胞及孢子所取代(图 2f)。
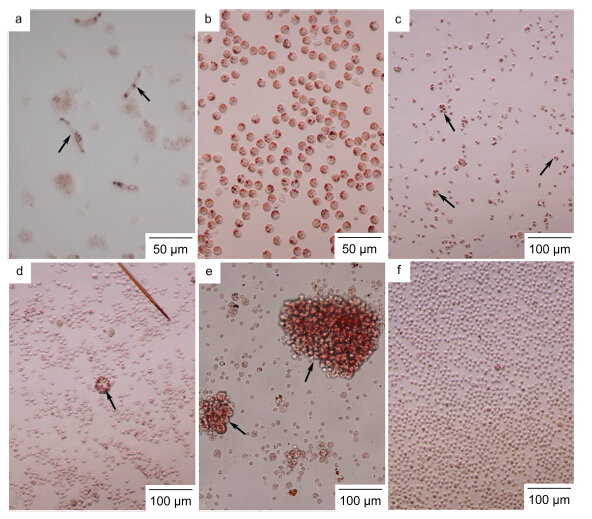 |
| 图 2 三疣梭子蟹血淋巴中血卵涡鞭虫生活史形态 Fig. 2 Representative life stages of Hematodinium sp. found in the hemopymph of the swimming crab P. trituberculatusa. 丝状滋养体(箭头); b. 变形虫状滋养体; c. 单核、双核、多核滋养体(箭头); d. 多核滋养体(箭头); e. 团聚体(箭头); f. 孢子前细胞 |
组织病理学检测发现血卵涡鞭虫在宿主的肝胰腺、心脏、肌肉、鳃等器官和组织中均存在不同程度的感染,寄生虫在各器官或组织中的存在形态和数量也有一定的差异。在轻度感染个体中,肝胰腺和心脏中能够发现血卵涡鞭虫的侵入和存在,但数量较少,多数为滋养体结构(图 2a); 而宿主肌肉、胃等组织则鲜有病原虫的存在,组织病理变化不明显。在感染中后期个体中,肝胰腺、心脏、鳃、肌肉、胃等组织中均能明显发现病原虫的侵入,心脏、肝胰腺病理变化尤为明显,心脏中常见血卵涡鞭虫蛛网状的滋养体结构(图 3d)和团聚体结构(图 3c)。
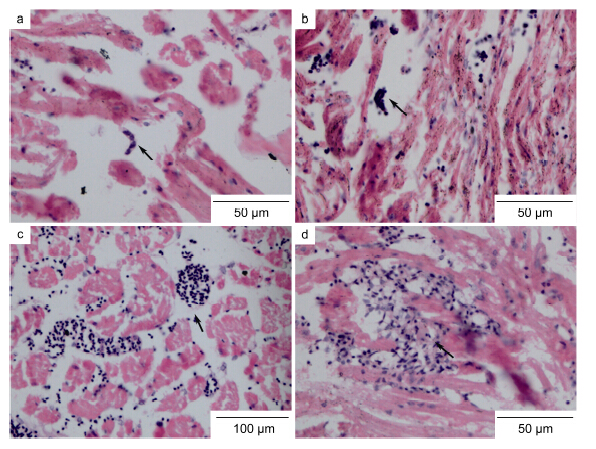 |
| 图 3 三疣梭子蟹心脏中血卵涡鞭虫形态Fig. 3 Representative life stages of Hematodinium sp. found in the heart tissue of the swimming crab P. trituberculatusa. 丝状滋养体(箭头); b. 多核滋养体(箭头); c. 团聚体(箭头); d. 蛛网状营养体(箭头) |
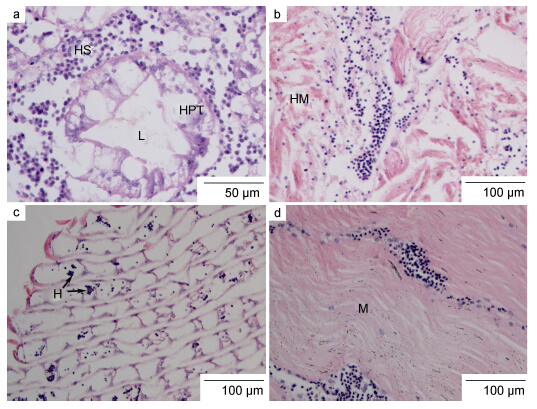
肝胰腺: 健康蟹的肝胰腺组织中肝小管排列紧密,肝小管间由疏松的结缔组织和血窦(hemal sinus)结构相连,肝小管(hepatopancreatic tubule)管腔较小。感染早期,组织切片显示可观察到完整的肝小管结构,肝小管上皮细胞细胞核清晰可见; 但随着血卵涡鞭虫的浸入,肝小管间隙距离扩大、管间结缔组织破损缺失,血窦结构受损、总血细胞数量减少,颗粒细胞数量相对增加且偶有聚集; 部分肝小管纤毛柱状上皮组织损坏,有些上皮细胞核溶解变性,但仍有较明显的界限(图 4a)。
心脏: 健康蟹心脏结构外层由结缔组织包裹,肌纤维间有结缔组织紧密相连,肌丝纤维呈现明显的带状结构。感染早期,少量血卵涡鞭虫侵入到心肌纤维间隙,导致肌丝间距扩大、部分肌丝纤维溶解性变性,但并未进入心肌纤维细胞内部,大部分肌丝纤维结构完整仍呈现明显的带状结构; 心肌间隙的血窦内血细胞数量明显下降,取而代之的是血卵涡鞭虫虫体; 心肌外围以及外层心肌纤维间的结缔组织有零散破损或缺失(图 4b)。
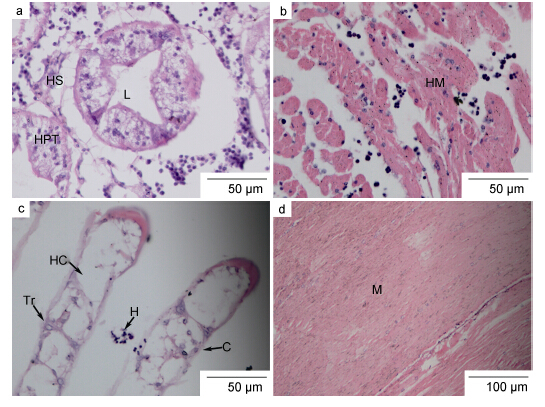 |
| 图 4 感染早期,血卵涡鞭虫病蟹组织病理变化 Fig. 4 Histopathological changes in the tissues of P. trituberculatus in early Hematodinium infection C: 表皮组织; H: 血卵涡鞭虫; HC: 鳃丝管腔; HM: 心肌; HPT: 肝小管; HS: 血窦; L: 肝小管管腔; M: 肌肉; Tr: 鳃小隔细胞。a. 感染早期,肝小管结构(HPT)清晰可见但上皮组织破损,管腔(L)增大,管间疏松结缔组织受损,血卵涡鞭虫分布其中; b. 心肌纤维带状结构明显,血细胞数量较少,肌束间有血卵涡鞭虫分布; c. 鳃丝结构完整,鳃小隔可见,鳃丝管腔中血细胞数量较少,鳃丝上皮组织变薄,鳃丝间现少量血卵涡鞭虫; d. 肌肉组织变化不明显可见清晰带状结构 |
鳃: 蟹类鳃为叶鳃型鳃,鳃叶由鳃丝(gill lamellaes)和鳃小片(tip of gill lamellaes)构成(李太武等,1995)。组织病理观察显示,轻度感染个体,鳃丝结构完整,鳃丝内可见由柱细胞特化形成的鳃小隔结构以及流动在其中的血细胞; 鳃丝的中央血窦中并未发现血卵涡鞭虫的存在,然而鳃丝间隙却分布着少量的血卵涡鞭虫虫体(图 4c)。
步足肌肉: 三疣梭子蟹步足肌属横纹肌,健康个体肌肉纤维排列紧密,呈现明显的带状结构(王国良等,2006)。感染早期个体,步足肌病理变化不明显,少数样品可见有极少量血卵涡鞭虫侵入,局部肌纤维出现断裂、分离,大部分样品步足肌肉仍呈现正常的带状结构(图 4d)。
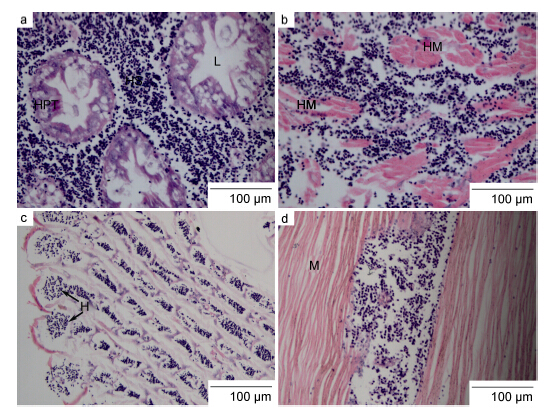
2.4.2 感染中期肝胰腺: 感染中期,大量血卵涡鞭虫进入肝小管间隙,肝小管间隙明显增大,结缔组织几乎完全缺失; 血细胞数量明显减少,颗粒细胞明显增多并聚集,未发现固定吞噬细胞(fixed phagocytes)的存在; 肝小管管腔进一步扩大,仍未发现血卵涡鞭虫侵入,然而肝小管纤毛柱状上皮结构明显溶解变性并呈空泡状(图 5a)。
 |
| 图 5 感染中期,血卵涡鞭虫病蟹组织病理变化 Fig. 5 Histopathological changes in the tissues of P. trituberculatus in middle Hematodinium infectiona. 感染中期,肝小管管腔扩大,肝管上皮组织呈空泡状变性,结缔组织基本完全消失被大量病原虫取代; b. 部分肌丝溶解变性,肌束相互分离,肌丝间隙现大量病原虫细胞; c. 感染中期,鳃丝管腔内现大量病原虫细胞,上皮组织及鳃丝末端受损变薄; d. 步足肌肌丝断裂溶解,相邻肌丝纤维互相分离,间隙中侵入大量的血卵涡鞭虫细胞 |
心肌: 感染中期,大量血卵涡鞭虫侵入心肌组织,心肌纤维溶解断裂,大部分心肌纤维带状结构消失,只有少数仍呈现; 血卵涡鞭虫的侵入导致心脏外层以及肌纤维间的结缔组织破损严重甚至完全缺失,肌束间隙增大,肌丝纤维互相分离; 血窦结构消失,血细胞数量明显下降,取而代之的是大量血卵涡鞭虫细胞,同时部分感染个体的心肌层间隙内颗粒细胞数量增加并集聚在血卵涡鞭虫周围(图 5b)。
鳃: 大量血卵涡鞭虫侵入鳃丝壁围成的中央管腔内,导致鳃丝中央管腔变粗以及末端鳃小片膨胀变大,鳃丝上皮组织变薄,上皮细胞破损变性。健康蟹的鳃丝中央管腔中分布着由柱细胞构成呈网状的横隔结构,血液由网孔中流过; 然而,由于血卵涡鞭虫的侵入,导致横隔结构部分破损或消失,大量血卵涡鞭虫虫体分布在鳃丝管腔及鳃小片腔内(图 5c)。步足肌肉: 患病梭子蟹肌丝纤维排列疏松,肌丝断裂溶解,相邻肌丝纤维互相分离,间隙中侵入大量的血卵涡鞭虫细胞或可见一些血细胞聚集,但其病理变化不如心肌病变显著(图 5d)。
2.4.3 感染后期肝胰腺: 重度感染个体,肝胰腺组织中充斥着大量血卵涡鞭虫虫体; 肝小管间隙严重扩大,肝小管间结缔组织完全缺失; 肝小管柱状上皮细胞由于挤压变性溶解呈现空泡状,上皮组织界限模糊,管腔扩大,但内部并未发现血卵涡鞭虫存在; 血细胞、颗粒细胞等几乎完全消失,代之以大量血卵涡鞭虫虫体(图 6a)。
 |
| 图 6 感染后期,血卵涡鞭虫病蟹组织病理变化 Fig. 6 Histopathological changes in the tissues of P. trituberculatus in late Hematodinium infectiona. 感染后期,肝小管结构严重破坏变性,管间距扩大,其间结缔组织完全被大量病原虫细胞取代; b. 心脏肌丝溶解变性呈岛状分布,带状结构消失,肌束间隙充满病原虫细胞; c. 感染后期,鳃丝管腔充满病原虫细胞,鳃小隔消失,鳃丝上皮组织变薄破损,鳃丝末端膨胀; d. 步足肌肌丝严重溶解断裂,肌丝间隙充斥着大量病原虫细胞 |
心脏: 大量血卵涡鞭虫细胞侵入心肌层间隙,导致心肌纤维弯曲、断裂、溶解坏死,肌丝纤维相互分离,丧失原本的条带结构; 血窦腔内血细胞等完全消失,心肌纤维间及外层结缔组织完全破损缺失(图 6b)。
鳃: 鳃丝腔内充斥着大量血卵涡鞭虫虫体; 可能由于物理挤压导致鳃丝表皮层坏死变薄,鳃丝管腔膨胀变形,柱细胞形成的鳃小隔(trabecular cells)完全缺失,血细胞数量下降,鳃丝末端的鳃小片膨胀变形,部分鳃丝末端表皮层破裂; 而且由于鳃丝膨胀变形,导致相邻鳃丝进一步靠近(图 6c)。
步足肌肉: 打开蟹盖,严重感染个体步足末端肌肉液化呈透明状,很难取出成块的肌肉。组织切片显示肌肉组织几乎全部变性坏死,肌丝排列紊乱且相互分离,大部分肌丝纤维弯曲、 断裂、溶解,丧失正常紧密的条带状结构,坏死部分充满血卵涡鞭虫细胞(图 6d)。
3 讨论2004年,血卵涡鞭虫首次在我国浙江沿海地区的养殖三疣梭子蟹感染中报道发现,此后又相继在该区域的养殖锯缘青蟹、脊尾白对虾,以及广东汕头地区的养殖锯缘青蟹等海产甲壳类动物体内检测到该寄生性病原(许文军等,2007a,b; 许文军等,2010; 吴清洋等,2010)。血卵涡鞭虫病的显著特征为宿主血淋巴呈现明显的白浊状态并丧失正常的凝聚能力,形态类似牛奶状,因此当地渔民也称这种血卵涡鞭虫病为“牛奶病”。近年来,养殖虾蟹类多种“牛奶病”频发,已对经济甲壳类的养殖造成严重的损失(许文军等,2007a; 王高学等,2007; 许文军等,2010),其中血卵涡鞭虫作为引发甲壳类“牛奶病”的主要病原,引起了广泛关注。近来,我们在山东半岛的养殖梭子蟹中也发现了血卵涡鞭虫感染,表明该寄生性病原在我国近海主要虾蟹类养殖区有广泛的分布(Li et al,2013)。
研究表明,血卵涡鞭虫能够侵入宿主血淋巴系统,随后在宿主器官的结缔组织间隙或血窦内增殖,引发一系列组织病变而致使宿主死亡。该寄生虫全身性的侵染可能与甲壳类血液的开腔循环相关; 然而,血卵涡鞭虫如何侵入宿主体内及如何在宿主群体内传播等有待进一步研究。甲壳类动物相对于脊椎动物缺乏特异性的免疫系统,主要依靠血淋巴细胞对外来异物及病原生物产生吞噬、凝聚、包裹等本体免疫反应(李长红等,2008)。健康三疣梭子蟹的血淋巴呈淡蓝色,具有很强的凝聚能力,可有效促进伤口的愈合。然而,感染血卵涡鞭虫的梭子蟹往往表现为血淋巴细胞明显减少,重度感染蟹的血淋巴中甚至完全被病原虫细胞占据,直接导致宿主机体部分免疫功能缺失,为该病原的快速增殖及其他病原生物的入侵创造了有利条件。进而推测宿主血淋巴细胞直接或间接参与针对血卵涡鞭虫的免疫反应是导致血淋巴细胞数量急剧变化的主要原因; 然而,其具体作用机制有待进一步研究。
血卵涡鞭虫在宿主体内的系统性感染增殖导致宿主的主要器官和组织均发生不同程度的病变,其中肝胰腺、心脏、鳃等组织变化尤为显著。感染前期,病原虫首先在肝胰腺中出现,而在心脏、鳃中鲜有病原虫细胞的存在; 在感染中后期,各组织中均现大量的病原虫体; 可见,肝胰腺可作为血卵涡鞭虫病早期诊断的指示性组织(Wheeler et al,2007)。梭子蟹的肝胰腺由泡状(B细胞)、纤维(F细胞)、吸收(R细胞)以及胚细胞(E细胞)四种细胞构成,承担了机体的消化吸收及储存营养物质的部分甚至全部功能(姚桂桂等,2008)。血卵涡鞭虫在肝小管间隙内大量增殖,可能会直接导致肝小管上皮细胞及结缔组织损伤甚至坏死,主要表现为细胞水肿变性、细胞核固缩、裂解等。肝胰腺的多少直接或间接影响到宿主的消化吸收,而且大量病原虫增殖还会直接消耗组织中储存的营养物质,直接导致组织发生生理饥饿现象,进而影响到宿主的蜕皮周期、营养物质的贮藏、糖类代谢等过程(Stentiford et al,1999; Stentiford et al,2000; Stentiford et al,2001)。在不同感染阶段,肝胰腺结构受到不同程度的损害,然而实验中并未发现血卵涡鞭虫进入肝小管的管腔。有研究表明,肝小管中常见食物残渣和脱落的B细胞顶泡及R细胞(姚桂桂等,2008),但其具体的功能和作用机制并没有明确的结论。因此,病原虫导致梭子蟹肝胰腺结构破损但未进入管腔内部的原因和机制尚待进一步研究。
感染血卵涡鞭虫梭子蟹的心脏、鳃和肌肉组织内均现大量病原虫体,并有明显病变。与其他种类宿主感染血卵鞭虫的病理变化类似,重度染病梭子蟹的心肌纤维断裂分离,带状结构消失(Meyers et al,1987; Hudson et al,1994; Messick,1994; Stentiford et al,2002)。心脏受到损伤可引起心律衰竭,血淋巴液循环、气体交换、能量传递等障碍,进而引起宿主个体死亡。鳃作为甲壳类动物的主要呼吸器官,兼具渗透调节功能。然而,重度感染个体的鳃管中常充斥大量病原细胞,造成鳃管阻塞,直接导致宿主呼吸功能受阻; 而且大量血卵涡鞭虫会消耗氧气,减弱血淋巴细胞的携氧功能(Taylor et al,1996)。因此,血卵涡鞭虫在宿主鳃内的寄生和增殖能够直接导致梭子蟹呼吸性功能障碍,进而影响机体正常的生理代谢。大量血卵涡鞭虫的侵入,会导致鳃丝上皮细胞坏死、上皮组织变薄甚至破损,不仅影响到机体渗透调节功能,而且便于水体中其他病原生物侵入而造成继发性感染。另外,Wheeler等(2007)研究表明,鳃可能是血卵涡鞭虫进入宿主的重要渠道。肌肉组织在感染前中期,并未发现明显的病理变化; 感染后期步足肌出现类似心肌的病理症状,肌丝断裂、变性、溶解,带状结构消失,肌丝间隙充斥着大量的病原虫体,重度感染个体的步足基部肌肉呈水样溶解状态; 血卵涡鞭虫感染导致的肌肉组织损伤会导致宿主活动力受阻、摄食能力减弱等。
通过血淋巴涂片及组织病理观察,在染病梭子蟹的血淋巴和主要组织器官中发现了不同形态或生活史阶段的血卵涡鞭虫虫体,包括单核、双核、多核滋养体结构,滋养体团聚体结构,蛛网状滋体结构以及孢子前细胞或孢子结构。本研究所观察到的血卵涡鞭虫形态与已有报道的血卵涡鞭虫形态相似,在不同宿主体内寄生或者在不同的体外条件下培养可能会导致血卵涡鞭虫的形态有一定差异(Messick,1994; Appleton et al,1998; Shields et al,2000; Pestal et al,2003; Li et al,2011)。患病梭子蟹体内的病原虫多数呈圆形或卵圆形,大小与血淋巴细胞相近; 然而,在病蟹的肝胰腺、心脏、肌肉等组织器官中除上述卵圆形形态结构之外,还存在蛛网状滋养体结构。血卵涡鞭虫的多种形态表明宿主处于不同的感染阶段,或者是处于血卵涡鞭虫不同的生活史阶段。血卵涡鞭虫不同形态结构所代表的生活史阶段,以及其不同生活史阶段对于宿主机能的影响尚需进一步研究。而且,关于血卵涡鞭虫完整的生活史的研究较少,目前仅有从挪威龙虾和美国兰蟹体内分离的血卵涡鞭虫具有完整的生活史研究(Appleton et al,1998; Li et al,2011),感染三疣梭子蟹的血卵涡鞭虫的完整生活史也有待进一步研究。
4 结论血卵涡鞭虫是一类主要寄生于甲壳类动物体内的致病性病原虫,该病原虫可对三疣梭子蟹进行系统性侵染,在感染过程中历经丝状滋养体,单核、双核以及多核滋养体结构,团聚体结构,蛛网状滋体结构以及孢子前细胞和孢子等不同的生活史阶段。
血卵涡鞭虫在宿主体内增殖导致梭子蟹机体发生不同程度的病理变化,血淋巴、心脏、肝胰腺、鳃、肌肉等主要的组织器官均会受到相应程度的破坏,主要表现为体细胞破损或坏死,细胞间隙模糊,组织中充斥着大量寄生虫。感染早期,血卵涡鞭虫多呈丝状或卵圆形的滋养体形态,病变主要表现为宿主颗粒、半颗粒细胞以及透明细胞等血细胞数量明显下降,少量病原虫体侵入肝胰腺和心脏组织。感染中后期,病原多呈现圆球状的孢子前细胞或孢子结构,心脏组织中可发现蛛网状滋养体的存在,血卵涡鞭虫大量增殖导致梭子蟹心脏、肝胰腺、肌肉、鳃等主要的组织器官结构发生明显的破损或坏死,病原虫细胞几乎完全取代血淋巴细胞,重度感染个体最终可能因主要组织器官功能破坏或丧失而死亡。
目前,对于血卵涡鞭虫的几种典型的生活史形态虽然有所认识,但其完整的生活史过程仍缺乏深入的了解,有待进一步的研究; 血卵涡鞭虫大量增殖对宿主组织器官结构功能的影响机制以及其不同生活史形态对该病原传播、扩散的作用仍需要进一步探索。
| 王国良, 金 珊, 李 政等, 2006. 三疣梭子蟹(Portunus trituberculatus)乳化病的组织病理和超微病理研究. 海洋与湖沼, 37(4): 297—303 |
| 王高学, 黄增荣, 袁 明, 2007. 三疣梭子蟹牛奶病病原的分离鉴定. 西北农林科技大学学报(自然科学版), 35(6): 29—33 |
| 中国农业部渔业局, 2013. 中国渔业统计年鉴2013. 北京: 中国农业出版社, 1—145 |
| 刘 淇, 李海燕, 王 群等, 2007. 梭子蟹牙膏病病原菌—溶藻弧菌的鉴定及其系统发育分析. 海洋水产研究, 28(4): 9—13 |
| 许文军, 施 慧, 徐汉祥等, 2007a. 养殖梭子蟹血卵涡鞭虫感染的初步研究. 水生生物学报, 31(5): 637—640 |
| 许文军, 绳秀珍, 徐汉祥等, 2007b. 血卵涡鞭虫在养殖锯缘青蟹中的寄生. 中国海洋大学学报, 37(6): 916—920 |
| 许文军, 徐汉祥, Shield J等, 2007c. 海产甲壳类血卵涡鞭虫病研究进展. 中国水产科学, 14(4): 695—702 |
| 许文军, 谢建军, 施 慧等, 2010. 池塘养殖脊尾白虾(Exopalaemon carinicauda)感染血卵涡鞭虫的研究. 海洋与湖沼, 41(3): 396—402 |
| 孙颖民, 闫 愚, 孙进杰, 1984. 三疣梭子蟹的幼体发育. 水产学报, 8(3): 219—226 |
| 李才文, 许文军, 2014. 海水甲壳类寄生性病原血卵涡鞭虫(Hematodinium spp.)研究进展. 海洋与湖沼, 45(1): 1—10 |
| 李长红, 金 珊, 2008. 三疣梭子蟹血淋巴免疫功能的初步研究. 水产科学, 27(4): 163—166 |
| 李太武, 张 峰, 苏秀榕, 1995. 三疣梭子蟹呼吸器管的组织学研究. 大连水产学院学报, 10(2): 18—24 |
| 吴清洋, 李远友, 夏小安等, 2010. 汕头牛田洋沿海围垦区锯缘青蟹病害爆发的环境因素. 生态学报, 30(8): 2043—2048 |
| 施 慧, 许文军, 李鹏飞等, 2008. 应用PCR方法检测患“黄水病”锯缘青蟹中的血卵涡鞭虫. 海洋渔业, 30(1): 74—79 |
| 姚桂桂, 吴旭干, 成永旭等, 2008. 东海三疣梭子蟹雌体不同生理阶段肝胰腺的生化组成与其组织学结构的关系. 海洋学报, 30(6): 122—131 |
| Appleton P L, Vickerman K, 1998. In vitro cultivation and developmental cycle in culture of a parasitic dinoflagellate (Hematodinium sp.) associated with mortality of the Norway lobster (Nephrops norvegicus) in British waters. Parasitology, 116(2): 115—130 |
| Hudson D A, Shields J D, 1994. Hematodinium australis n. sp., a parasitic dinoflagellate of the sand crab Portunus pelagicus from Moreton Bay, Australia. Diseases of Aquatic Organisms, 19(2): 109—119 |
| Li C W, Miller T L, Small H J et al, 2011. In vitro culture and developmental cycle of the parasitic dinoflagellate Hematodinium sp. from the blue crab Callinectes sapidus. Parasitology, 138(14): 1924—1934 |
| Li C W, Song S Q, Liu Y et al, 2013. Hematodinium infections in cultured Chinese swimming crab, Portunus trituberculatus, in northern China. Aquaculture, 396—399: 59—65 |
| Li Y Y, Xia X A, Wu Q Y et al, 2008. Infection with Hematodinium sp. in the mud crabs Scylla serrata cultured in low salinity water in southern China. Diseases of Aquatic Organisms, 82(2): 145–150 |
| Messick G A, 1994. Hematodinium perezi infections in adult and juvenile blue crabs Callinectes sapidus from coastal bays of Maryland and Virginia, USA. Diseases of Aquatic Organisms, 19(1): 77—82 |
| Meyers T R, Koeneman T M, Botelho C et al, 1987. Bitter crab disease: a fatal dinoflagellate infection and marketing problem for Alaskan Tanner crabs Chionoecetes bairdi. Diseases of Aquatic Organisms, 3(3): 195—216 |
| Pestal G P, Taylor D M, Hoenlg J M et al, 2003. Monitoring the prevalence of the parasitic dinoflagellate Hematodinium sp. in snow crabs Chionoecetes opilio from Conception Bay, Newfoundland. Diseases of Aquatic Organisms, 53(1): 67—75 |
| Shields J D, Squyars C M, 2000. Mortality and hematology of blue crabs, Callinectes sapidus, experimentally infected with the parasitic dinoflagellate Hematodinium perezi. Fishery Bulletin, 98(1): 139—152 |
| Small H J, Shields J D, Hudson K L et al, 2007. Molecular detection of Hematodinium sp. infecting the blue crab, Callinectes sapidus. Journal of Shellfish Research, 26(1): 131—139 |
| Stentiford G D, Chang E S, Chang S A et al, 2001. Carbohydrate dynamics and the Crustacean hyperglycemic hormone (CHH): effects of parasitic infection in Norway Lobsters (Nephrops norvegicus). General and Comparative Endocrinology, 121(1): 13—22 |
| Stentiford G D, Green M, Bateman K et al, 2002. Infection by a Hematodinium-like parasitic dinoflagellate causes Pink Crab Disease (PCD) in the edible crab Cancer pagurus. Journal of Invertebrate Pathology, 79(3): 179—191 |
| Stentiford G D, Neil D M, Coombs G H, 1999. Changes in the plasma free amino acid profile of the Norway lobster Nephrops norvegicus at different stages of infection by a parasitic dinoflagellate (genus Hematodinium). Diseases of Aquatic Organisms, 38(2): 151—157 |
| Stentiford G D, Neil D N, Coombs G H, 2000. Alterations in the biochemistry and ultrastructure of the deep abdominal flexor muscle of the Norway lobster Nephrops norvegicus during infection by a parasitic dinoflagellate of the genus Hematodinium. Diseases of Aquatic Organisms, 42(2): 133—141 |
| Stentiford G D, Shields J D, 2005. A review of the parasitic dinoflagellates Hematodinium species and Hematodinium- like infections in marine crustaceans. Diseases of Aquatic Organisms, 66(1): 47—70 |
| Taylor A C, Field R H, Parslow-Williams P J, 1996. The effects of Hematodinium sp. -infection on aspects of the respiratory physiology of the Norway lobster, Nephrops norvegicus (L.). Journal of Experimental Marine Biology and Ecology, 207(1—2): 217—228 |
| Wheeler K, Shields J D, Taylor D M, 2007. Pathology of Hematodinium infections in snow crabs (Chionoecetes opilio) from Newfoundland, Canada. Journal of Invertebrate Pathology, 95(2): 93—100 |
 2015, Vol. 46
2015, Vol. 46


