文章信息
- 宁加佳, 杜飞雁, 王雪辉, 谷阳光, 王亮根, 李亚芳. 2015.
- NING Jia-Jia, DU Fei-Yan, WANG Xue-Hui, GU Yang-Guang, WANG Liang-Gen, LI Ya-Fang. 2015.
- 基于稳定同位素的六指马鲅(Polynemus sextarius)食性特征
- FEEDING HABITS OF SIXFINGER THREADFIN POLYNEMUS SEXTARIUS REVEALED IN STABLE ISOTOPE ANALYSIS
- 海洋与湖沼, 46(4): 758-763
- Oceanologia et Limnologia Sinica, 46(4): 758-763.
- http://dx.doi.org/10.11693/hyhz20141100330
-
文章历史
- 收稿日期:2014-11-24
- 改回日期:2015-02-10
2. 农业部南海渔业资源开发利用重点实验室 广州 510300;
3. 中国水产科学研究院南海水产研究所 广州 510300
2. Key Laboratory of South China Sea Fishery Resources Development and Utilization, Ministry of Agriculture, Guangzhou 510300, China;
3. South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China
六指马鲅(Polynemus sextarius)隶属马鲅科(Polynemidae),马鲅属(Polydactylus),是常见的经济海产鱼类之一(陈丕茂,2005)。该鱼通常集结成群栖息于沿岸石礁和拍岸浪区(李加儿等,2002),常成群游向潮间带觅食。六指马鲅为底栖食性,主要以虾类、虾蛄、蟹类和桡足类为食(Rao,1964; 李加儿等,2002)。此外,六指马鲅又作为食物被其它鱼类摄食。因此,六指马鲅是连接海洋底层食物网和中上层食物网的重要环节,虽然不是重要的经济鱼类,但在海洋沿岸生态系统食物网结构和功能中具有重要的作用。定量研究其食性,有助于深入了解和掌握沿岸海洋生态系统的结构和功能。近年来,由于过度捕捞和环境污染,六指马鲅资源衰退明显(陈丕茂,2005),其经济价值也日益突出。因此,研究六指马鲅食性,对其渔业资源的保护和可持续开发利用也具有重要价值。
目前国内外对六指马鲅的相关研究很少,主要集中在该鱼的繁养殖、栖息地和食性的定性描述上,虽然已有研究结果表明六指马鲅的食物为虾类、虾蛄、桡足类和蟹类(Rao,1964; 葛国昌,1980; 李加儿等,2002),但对其食性仍然缺乏足够准确的理解。为此,本研究利用碳氮稳定同位素技术,以南海大鹏湾海域的六指马鲅及其上述四类生物为研究对象,对其食性进行定量研究,以期在丰富六指马鲅生态学研究内容的同时,为六指马鲅等渔业资源的保护管理和开发提供理论依据。
1 材料与方法 1.1 样品采集与处理样品采自2013年9月在南海大鹏湾海域(114°20′E—114°30′E,22°30′N—22°37′N)进行的定点底拖网及潮间带调查。样品带回实验室进行分类鉴定和个体体长测定后,进行稳定同位素样品取样。六指马鲅取其背部白色肌肉,近缘新对虾(Metapenaeus affinis)和口虾蛄(Oratosquilla oratoria)取腹部肌肉,三疣梭子蟹(Portunus trituberculatus)、平背蜞(Gaetice depressus)和锈斑蟳(Charybdis feriatus)取第一螯足肌肉,近江牡蛎(Crassostrea rivularis)取闭壳肌作为分析样品。浮游动物桡足类采用大型浮游生物网由水底至水表垂直采集,用玻璃纤维滤膜(Whatman GF/F)抽滤过的海水清养2h使其排除消化道含物,再用蒸馏水将其洗净后取整体作为分析样品。将以上稳定同位素样品在60°C下烘48h至恒重,用研钵将样品研磨成粉末,放入干燥器中保存待测。
1.2 稳定同位素测定所采样品的稳定同位素比值在中国农业科学院农业环境稳定同位素实验室进行测定。所用仪器为Vario PYRO Cube型元素分析仪和Isoprime-100型稳定同位素比值分析仪,获得的稳定同位素比值用δ表示(Fry,2006):
| δX(‰)=(Rsample/Rst and ard-1)×1000 |
其中,X=13C或15N; R=13C/12C或15N/14N。碳和氮同位素标准样品分别采用VPDB(拟箭石)和大气氮,为保证实验结果的准确性和仪器的稳定性,每测试12个样品穿插一个标样进行校正(Fry,2006)。样品δ13C和δ15N值分析精度为±0.2‰。
1.3 数据处理与分析六指马鲅及其食物的营养位置通过如下公式计算(Post,2002):
营养位置=λ+(δ15Nconsumer-δ15Nbaseline)/Δδ15N
式中,δ15Nbaseline为基线生物的δ15N值(即λ=1时,δ15Nbaseline为生产者δ15N,而λ=2时,δ15Nbaseline为初级消费者δ15N值),根据Post(2002)的建议,本研究用近江牡蛎的δ15N值为δ15Nbaseline。δ15Nconsumer为六指马鲅及其食物的δ15N值,Δδ15N为营养级传递过程中δ15N的富集值,每营养级的平均值约为3.4‰(Post,2002)。
本实验运用IsoSource模型计算不同食物对六指马鲅的相对贡献。IsoSource模型是在预先设置好的增量(1%)下检验每种食物贡献(0—100%)的所有可能组合,当这些可能组合的加权平均稳定同位素比值与消费者的稳定同位素比值的公差小于0.01‰时,才认为是合理的结果(Phillips et al,2003)。
此外,利用Pearson相关分析检验六指马鲅个体体长与其δ13C和δ15N值的相关关系(Green et al,2010)。
另外,根据李加儿等(2002)的研究结果将体长≥15.1cm的六指马鲅定义为成鱼,体长<15.1cm的六指马鲅定义为仔鱼。
2 结果 2.1 六指马鲅及其食物的同位素比值稳定同位素结果表明,六指马鲅的δ13C值在-16.9‰—-16.1‰间,均值为(-16.5±0.2)‰; δ15N值的范围为14.0‰—15.4‰,均值为(14.6±0.5)‰(图 1)。六指马鲅的体长范围为9.1—17.0cm,均值为12.2± 2.7cm,其中成鱼2尾,体长分别为16.0cm和17.0cm,仔鱼为7尾。Pearson相关分析结果显示,六指马鲅δ13C值与其个体体长间存在极其显著的正相关关系(R=0.787,P<0.01,n=9),δ15N值与其个体体长间也存在显著的正相关(R=0.921,P<0.05,n=9)(图 2)。在六指马鲅的4类食物当中,桡足类的δ13C均值最低,为(-19.3±0.1)‰; 其次为近缘新对虾及口虾蛄; 蟹类(三疣梭子蟹、平背蜞和锈斑蟳)的均值最高,为(-15.7±0.8)‰。δ15N值同样是桡足类的最低,为(9.5±0.3)‰; 其次为蟹类和近缘新对虾; 而口虾蛄的最高,它们的δ15N均值均比六指马鲅的低。
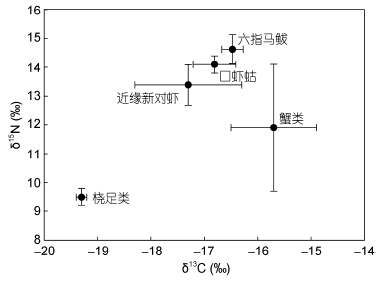 |
| 图 1 大鹏湾六指马鲅及其食物的δ13C和δ15N平均值和标准差 Fig. 1 Mean(±SE)δ13C and δ15N values in P. sextarius and their preys in Mirs Bay |
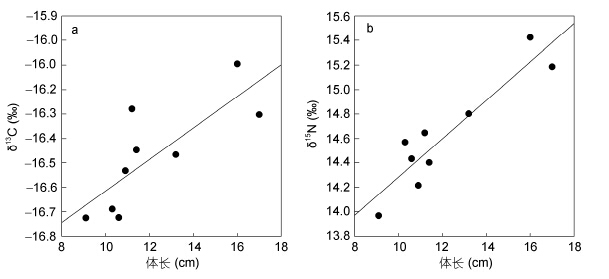 |
| 图 2 六指马鲅体长同δ13C和δ15N值的关系Fig. 2 Relationships of δ13C and δ15N values to body lengths of P. sextarius |
从IsoSource计算结果可知,六指马鲅的主要食物为蟹类,其贡献率范围为20%—81%,平均贡献率为50.8%; 其次为口虾蛄和近缘新对虾,它们的贡献率范围分别为0—82%和0—57%,平均贡献率分别为24.9%和17.0%; 桡足类的贡献率最低,范围为0—26%,平均贡献率仅为7.3%(图 3)。其中,蟹类、口虾蛄、近缘新对虾及桡足类对六指马鲅成鱼的贡献率范围分别为46%—88%、0—54%、0—37%及0—16%,平均贡献率分别为68.6%、16.1%、10.8%及4.5%; 它们对仔鱼的贡献率范围分别为9%—77%、0—91%、0—62%及0—27%,平均贡献率分别为44.8%、27.9%、19.1%及8.2%。
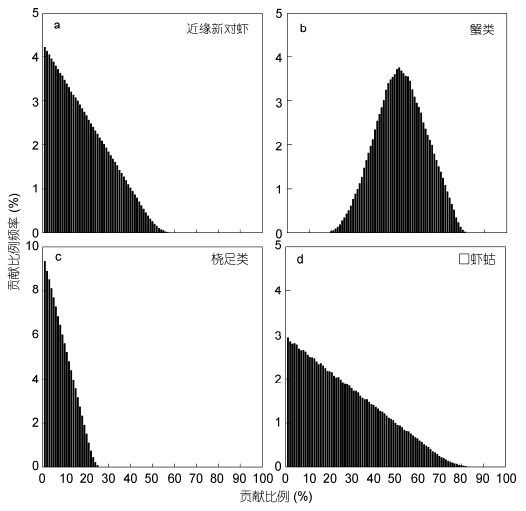 |
| 图 3 六指马鲅食物贡献比例频率 Fig. 3 The percent frequency of feasible contributions from preys of P. sextarius |
根据δ15N值及营养位置的计算公式计算得出,大鹏湾海域六指马鲅的营养位置为3.34±0.13。六指马鲅4类食物的营养位置均低于六指马鲅,其中以桡足类的营养位置最低,仅为1.82±0.08; 其次为蟹类和近缘新对虾,营养位置分别为2.53±0.66和2.97±0.21;口虾蛄的最高,为3.18±0.08。
3 讨论与分析 3.1 六指马鲅的食物组成本研究结果表明,六指马鲅的δ13C值在-16.1‰—-16.9‰之间,差值仅为0.8‰,δ15N值的范围为14.0‰—15.4‰,差值为1.4‰。δ13C和δ15N值的变化范围均较小,表明六指马鲅的摄食选择性较小,其食物种类较少,碳和氮的来源均较单一。六指马鲅的δ13C值在近缘新对虾、口虾蛄、桡足类和蟹类的δ13C值之间,而且六指马鲅的δ15N值均高于它们。由此可以判断,六指马鲅的食物组成来源于这4类生物,这与Rao(1964)及李加儿等(2002)定性分析胃含物的研究结果一致。虽然近缘新对虾、口虾蛄和蟹类的栖息环境较为隐蔽,常位于浅海的沙泥质底和石砾及礁石缝中(闵信爱,1987; 王波等,1998),但六指马鲅属于沿岸带底栖肉食性鱼类,喜栖在内湾、河口及沙泥底海床,以胸鳍游离的软鳍条探寻沙泥底下,并用吻端挖掘沙泥地中的口虾蛄、虾类和蟹类以觅食。桡足类则常常作为良好的开口饵料被六指马鲅的仔鱼摄食。
Rao(1964)通过胃含物分析法指出,口虾蛄和蟹类是六指马鲅的重要食物组成,李加儿等(2002)发现六指马鲅喜食虾类,而我们的研究表明,不论是成鱼还是仔鱼,蟹类均是六指马鲅的主要食物,其次为口虾蛄和近缘新对虾,桡足类对六指马鲅的贡献率最低。研究结果的差异可能与以下两方面原因有关。首先,从方法上看,胃含物分析法只是反映消费者短时间内所摄食的食物,而稳定同位素技术能反映生物长期的消化吸收史(Hesslein et al,1993),由于所有摄食的食物并不一定被消费者消化吸收,造成研究结果有差异; 其次,从大鹏湾海域蟹类、口虾蛄和虾类资源量来看,它们的资源密度分别为62.6kg/km2、37.9kg/km2和18.7kg/km2(未发表数据),其资源密度比例与它们对六指马鲅的食物平均贡献率较为相符,表明六指马鲅的食物贡献率主要与环境中食物的多寡有关,不同的研究地点由于食物资源量的不同从而影响六指马鲅的食物贡献比率。
本研究还发现,六指马鲅的δ13C和δ15N值与其个体体长间均存在显著的正相关关系,说明个体大小对六指马鲅的δ13C和δ15N值有影响。由于桡足类的δ13C和δ15N值均最低,表明桡足类主要被个体较小的六指马鲅,也就是仔鱼所摄食,它们对仔鱼的平均贡献率为8.2%,高于成鱼的4.5%。鱼类中食性转变现象很普遍(Polis et al,1996),仔鱼阶段由于口裂较小,大多数鱼类都以微小的浮游生物为食,随着年龄的增长,当鱼类口裂足够大时,转而摄食其它食物,继而同位素值随着食物的不同而发生改变(Fry et al,1984; Owens,1988),口裂较大的个体通常处于较高的营养层次(Keast et al,1966; Karpouzi et al,2003),也意味着它们的δ15N值较高。此外,研究结果表明,蟹类对六指马鲅成鱼的平均贡献率要远高于对仔鱼的,这可能与蟹类的防御水平较强、仔鱼不易摄食有关。
3.2 营养位置的确定传统动物的营养级是根据食性分析而定的,营养级这个概念和计算方法有两个缺陷: 第一,由于传统方法的不足,使得动物营养级划分不准确。第二,营养级概念是非连续性的(如生产者为1; 初级消费者为2; 次级消费者为3等),不能给杂食性动物定位。相对于营养级来说,营养位置就更加可靠。由于动物在消化吸收食物的过程中δ15N值会沿营养级向上传递产生富集(Minagawa et al,1984),应用δ15N值计算出的营养位置就能对动物在食物网中的位置进行准确定位和连续划分(邬建国等,2009)。
口虾蛄是小型凶猛的捕食性动物,食物组成包括小型甲壳类、双壳类、多毛类、小型鱼类及桡足类等,其中以小型虾类的出现频率最高(王春琳等,1996; 王波等,1998)。本研究结果表明,口虾蛄的营养位置为3.18,表明其食性为肉食性。近缘新对虾和蟹类的营养位置分别为2.97和2.53,介于初级消费者和次级消费者之间,表明近缘新对虾和蟹类均为杂食性。有报道指出,近缘新对虾的食物有多毛类、有孔虫、端足类、双壳类等,还包括藻类(闵信爱,1987; 林瑞才等,1992)。绝大部分蟹类是杂食性的(戴爱云,1986),它们的食物来源非常广泛,包括珊瑚虫、线虫、多毛类、毛颚类、棘皮动物、硅藻类、底栖藻类等(黄美珍,2004)。本研究结果显示六指马鲅的营养位置为3.34,与杨国欢等(2012)研究结果不同,他们计算得出六指马鲅的营养位置仅为2.98,为杂食性,研究结果的差异主要与计算营养位置时基线生物的选择有关。Post(2002)建议在水生食物网中利用长寿命初级消费者来代表食物网中的基线生物,杨国欢等(2012)在研究中采用浮游动物作为基线生物,而本研究则是采用近江牡蛎为基线生物。近江牡蛎与浮游动物相比,移动距离短,寿命更长,能更好地综合时空变化信息,反映生物长期生命活动的结果,因此近江牡蛎作为基线生物更加理想。
采样期间大鹏湾海域桡足类的优势种主要为锥形宽水蚤(Temora turbinata)和亚强次真哲水蚤(Subeucalanus subcrassus),作为杂食和草食滤食性种类(李开枝等,2012),一般来说它们的营养位置至少为2.0。但计算结果得出桡足类的营养位置仅为1.82,可能是因为桡足类生长速度快,生命周期短(郑重等,1992),它们的δ15N受其主要食物来源即浮游植物的影响,而浮游植物的δ15N值受光照、水温及溶解性无机氮等环境因子的影响(Gu,2009),使得浮游植物的15N最大周转率高,δ15N值变化快,导致桡足类的δ15N值变化幅度大,有时一年内能达8‰,跨越两个营养级(Grey et al,2001),从而造成桡足类的δ15N值比基线生物的低,类似的结果在Kürten等(2013)的研究中也有发现。此外,也有可能是它们滤食了水体中来自陆源的颗粒有机物,有研究表明陆源颗粒有机物的δ15N值远低于浮游植物的δ15N(Delong et al,2006),从而造成桡足类的δ15N值低于基线生物的δ15N值,营养位置随之也低于2.0。
| 王 波, 张熙烈, 孙丕喜, 1998. 口虾蛄的生物学特征及其人工苗种生产技术. 黄渤海海洋, 16(2): 64—73 |
| 王春琳, 徐善良, 梅文骧等, 1996. 口虾蛄的生物学基本特征. 浙江水产学院学报, 15(1): 60—62 |
| 邬建国, 杨 劼, 2009. 现代生态学讲座(IV)理论与实践. 北京: 高等教育出版社, 1—392 |
| 李开枝, 谭烨辉, 黄良民等, 2012. 珠江口浮游桡足类摄食研究. 热带海洋学报, 31(6): 90—96 |
| 李加儿, 区又君, 2002. 六指马鲅的繁养殖. 水产科技, (5): 15—17 |
| 杨国欢, 孙省利, 侯秀琼等, 2012. 基于稳定同位素方法的珊瑚礁鱼类营养层次研究. 中国水产科学, 19(1): 105—115 |
| 闵信爱, 1987. 南海北部的新对虾. 海洋渔业, (1): 6—9 |
| 陈丕茂, 2005. 广东人工鱼礁区增殖放流种类初探. 南方水产, 1(1): 11—20 |
| 林瑞才, 周莲贞, 张金标, 1992. 近缘新对虾幼体的饥饿、摄食和食性. 水产学报, 16(3): 189—201 |
| 郑 重, 李少菁, 连光山, 1992. 海洋桡足类生物学. 厦门: 厦门大学出版社, 1—312 |
| 黄美珍, 2004. 福建海区拥剑梭子蟹、红星梭子蟹和锈斑蟳的食性与营养级研究. 台湾海峡, 23(2): 159—166 |
| 葛国昌, 1980. 夏威夷的六指马鲅养殖. 水产科技情报, (4): 28 |
| 戴爱云, 杨思谅, 宋玉枝等, 1986. 中国海洋蟹类. 北京: 海洋出版社, 1—642 |
| Delong M D, Thorp J H, 2006. Significance of instream autotrophs in trophic dynamics of the Upper Mississippi River. Oceanologia, 147(1): 76—85 |
| Fry B, Sherr E B, 1984. δ13C measurements as indicators of carbon flow in marine and freshwater ecosystems. Contributions in Marine Sciences, 27: 13—47 |
| Fry B, 2006. Stable Isotope Ecology. New York, NY: Springer, 1—308 |
| Green S B, Salkind N J, 2010. Using SPSS for Windows and Macintosh: Analyzing and Understanding Data (6th edn). New Jersey, USA: Prentice Hall Press, 1—480 |
| Grey J, Jones R I, Sleep D, 2001. Seasonal changes in the importance of the source of organic matter to the diet of zooplankton in Loch Ness, as indicated by stable isotope analysis. Limnology and Oceanography, 46(3): 505—513 |
| Gu B, 2009. Variations and controls of nitrogen stable isotopes in particulate organic matter of lakes. Oecologia, 160(3): 421—431 |
| Hesslein R H, Hallard K A, Ramlal P, 1993. Replacement of sulfur, carbon, and nitrogen in tissue of growing broad whitefish (Coregonus nasus) in response to a change in diet traced by δ34S, δ13C, and δ15N. Canadian Journal of Fisheries and Aquatic Sciences, 50(10): 2071—2076 |
| Karpouzi V S, Stergiou K I, 2003. The relationships between mouth size and shape and body length for 18 species of marine fishes and their trophic implications. Journal of Fish Biology, 62(6): 1353—1365 |
| Keast A, Webb D, 1966. Mouth and body form relative to feeding ecology in the fish fauna of a small lake, Lake Opinicon, Ontario. Journal of the Fisheries Research Board of Canada, 23(12): 1845—1874 |
| Kürten B, Painting S J, Struck U et al, 2013. Tracking seasonal changes in North Sea zooplankton trophic dynamics using stable isotopes. Biogeochemistry, 113 (1—3): 167—187 |
| Minagawa M, Wada E, 1984. Stepwise enrichment of 15N along food chains: Further evidence and the relation between δ15N and animal age. Geochimica et Cosmochimica Acta, 48(5): 1135—1140 |
| Owens N J P, 1988. Natural variations in 15N in the marine environment. Advances in Marine Biology, 24: 389—451 |
| Phillips D L, Gregg J W, 2003. Source partitioning using stable isotopes: coping with too many sources. Oecologia, 136(2): 261—269 |
| Polis G A, Strong D R, 1996. Food web complexity and community dynamics. The American Naturalist, 147(5): 813—846 |
| Post D M, 2002. Using stable isotopes to estimate trophic position: models, methods, and assumptions. Ecology, 83(3): 703—718 |
| Rao K S, 1964. Food and feeding habits of fishes from trawl catches in the Bay of Bengal with observations on diurnal variation in the nature of the feed. Indian Journal of Fisheries, 11(1): 277—314 |
 2015, Vol. 46
2015, Vol. 46


