文章信息
- 张美, 刘萍, 李吉涛, 李健. 2015.
- ZHANG Mei, LIU Ping, LI Ji-Tao, LI Jian. 2015.
- 脊尾白虾蜕皮抑制激素基因全长cDNA的克隆及其对环境胁迫的响应
- CLONING AND EXPRESSION OF MOLT-INHIBITING HORMONE GENE FROM EXOPALAEMON CARINICAUDA UNDER ENVIRONMENTAL STRESSES
- 海洋与湖沼, 46(4): 764-775
- Oceanologia et Limnologia Sinica, 46(4): 764-775.
- http://dx.doi.org/10.11693/hyhz20141100332
-
文章历史
- 收稿日期:2014-11-26
- 改回日期:2015-02-08
2. 中国水产科学研究院黄海水产研究所 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China
脊尾白虾(Exopalaemon carinicauda)又名白虾、五须虾、小白虾、迎春虾等,隶属于节肢动物门(Arthropoda)、甲壳纲(Crustacea)、十足目(Decapoda)、游泳亚目(Natantia)、长臂虾科(Palaemonidae)、长臂虾属(Palaemon)、白虾亚属(Exopalaemon)(刘瑞玉,1995),产量仅次于中国毛虾(Acetes chinensis)和中国对虾(Fenneropenaeus chinensis)。脊尾白虾具有肉质细嫩、繁殖能力强、生长速度快、环境适应性广和经济价值高等优点,是我国特有的小型经济虾类之一。近年来,作为沿海滩涂地区重要的特色水产品,脊尾白虾繁育和养殖技术日渐成熟。梁俊平等(2012a)研究了脊尾白虾全人工繁育技术,明确了胚胎发育、幼体孵化的适宜温度和盐度范围; 栗治国等(2013)对胚胎发育、幼体发育及其主要环境影响因素也进行了探讨。在脊尾白虾疾病防治方面,许文军等(2010)对池塘养殖脊尾白虾感染血卵涡鞭虫进行了系统的病原学研究; 沈辉等(2013)研究了白斑综合征病毒对脊尾白虾的致病性。在脊尾白虾免疫等功能基因方面,段亚飞等(2013)首次构建了血细胞cDNA文库,克隆了组织蛋白酶L、谷胱甘肽过氧化物酶和组织蛋白酶D等基因,并分析了这些基因在机体免疫应答反应中的作用; 李美玉等(2012)克隆了铁蛋白基因,并分析了WSSV攻毒刺激后其在转录水平的表达变化。而关于环境胁迫方面的研究也有报道,韩俊英等(2011)克隆得到热休克蛋白HSP70基因,分析了其在温度、pH值和氨氮胁迫下的响应; 李洋等(2013,2014)克隆了酚氧化酶原基因和丝氨酸蛋白酶抑制剂基因,分析了盐度胁迫后其在肝胰腺和血细胞组织中的表达变化规律; 梁俊平等(2012b)确定了脊尾白虾的氨氮耐受范围,任海等(2014)研究了急性氨氮胁迫对脊尾白虾抗氧化系统酶活力及GPx基因表达的影响。
甲壳动物蜕皮抑制激素(molt-inhibiting hormone,MIH)属于高血糖激素家族基因,在甲壳动物的生长、繁殖、蜕皮和渗透压调节等一系列活动中发挥重要作用。MIH通过调控蜕皮激素的分泌来抑制蜕皮过程,蜕皮激素控制蜕皮过程的发生,由此可见蜕皮过程主要是由蜕皮抑制激素和蜕皮激素相互拮抗进行调控。目前MIH基因在鹰爪虾(Trachypenaeus curvirostris)(王在照等,2002)、刀额新对虾(Metapenaeus ensis)(Tiu et al,2007)、中国对虾(王在照等,2003)、凡纳滨对虾(Litopenaeus vannamei)(Sun,1994)、罗氏沼虾(Macrobrachium rosenbergii)(Lin et al,1998)、日本囊对虾(Penaeus japonicus)(Ohira et al,1997)等虾类中已见相关报道,且发现在蜕皮调控研究中发挥了重要作用。近年来,随着脊尾白虾养殖规模的迅速扩大及生态环境的不断恶化,由病毒和细菌引发的虾类疾病频繁发生,严重影响了虾类养殖业的可持续性发展,造成了严重的经济损失。甲壳动物有复杂的神经内分泌系统,能快速地启动调控因子,直接或间接地应对外部因素的刺激。这些外部因素包括温度、盐度、光照周期性、营养和压力等。Lorenzon等(2000)发现,重金属Hg、Cd胁迫下岩虾(Palaemon elegans)体内高血糖激素(hyperglycemic hormone,CHH)表达量在2h之内出现升高。Sedlmeier(1988)揭示,低盐度下CHH 能促使淡水螯虾的渗透压上升。Santos等(1993)发现,注射葡萄糖后CHH和乳酸的水平显著降低,注射乳酸后CHH和葡萄糖升高,注射任何氨基酸对蟹血淋巴中的CHH葡萄糖和乳酸无任何影响。Stentiford等(2001)研究发现,感染血卵涡鞭虫的挪威海螯虾(Nephrops norvegicus)血淋巴中CHH含量上升。Webster(1996)发现普通黄道蟹(Cancer pagurus)组织缺氧导致CHH表达量明显增加。而MIH的表达水平与外界环境胁迫的关系仅有少量报道,Chang等(1990)报道,MIH在美洲海螯虾(Homarus americanu)中具有显著的高血糖活性。Lago-Lestón等(2007)研究了温度和盐度对凡纳滨对虾幼虾CHH和MIH表达的影响。目前为止,EcMIH基因表达与pH、氨氮胁迫的关系尚未见报道。
本研究采用同源克隆方法获得脊尾白虾MIH-like基因全长cDNA序列,分析了脊尾白虾在pH、氨氮、盐度胁迫后其眼柄和腹神经节中该基因的表达变化规律,研究结果对于解释脊尾白虾的环境适应性及其健康养殖具有重要的参考价值。
1 材料与方法 1.1 材料 1.1.1 实验用虾本实验用健康脊尾白虾均为同一家系蜕皮间期,2013年9月取自山东昌邑海丰水产养殖有限责任公司,体长(4.10±0.30)cm,体重(1.10± 0.30)g。放在200L PVC桶中暂养一周,期间每日换水1/3。投喂消毒处理后的沙蚕。之后进行为期5天的环境胁迫实验,期间不投饵也不换水。
1.1.2 实验试剂及耗材TRIzol Reagent、FS Universal SYBR Green Master(ROX)购自Roche公司; LATaq试剂盒、PrimeScripTM RT reagent Kit with gDNA Eraser、PMD18-T载体均购自TaKaRa公司; SMARTTM RACE Amplification Kit购自Clontech公司; 大肠杆菌Top10感受态细胞购自北京天根生化科技有限公司; DNA胶回收试剂盒购自上海生工公司; 其它试剂均为国产分析纯。
1.2 脊尾白虾眼柄总RNA提取取4尾去眼球及眼球内黑色素的健康脊尾白虾眼柄,只留柄部供总RNA的提取。提取方法按照罗氏说明书进行。用快速核酸/蛋白分析仪对总RNA进行定性和定量检测。紫外分光光度计和1.0%的TAE琼脂糖凝胶电泳检测其质量和完整性。
1.3 脊尾白虾EcMIH基因cDNA中间片段克隆参考GenBank公布的中国对虾(AF312977.4)、罗氏沼虾(KC990939.1)、凡纳滨对虾(DQ412566.1)日本囊对虾(AB162448.1)、刀额新对虾(AB162448.1)、斑节对虾(Penaeus monodon)(AY496454.1)MIH基因的cDNA编码区,利用DNAMAN软件根据保守区设计一对简并引物FM1和RM1(表 1)。
以脊尾白虾眼柄cDNA为模板,利用设计好的简并引物克隆出脊尾白虾EcMIH基因的中间序列。PCR反应程序: 94°C 5min; 94°C 30s,57°C 30s,72°C 30s,30个循环; 72°C 10min。将PCR产物送上海桑尼生物科技有限公司测序,得到脊尾白虾MIH基因中间目的片段206bp。
1.4 脊尾白虾EcMIH基因全长cDNA的克隆根据已获得脊尾白虾EcMIH基因cDNA中间序列设计3'RACE和5'RACE特异性引物。MspF1、MspF2、MspR1和MspR2,然后再根据获得3'RACE和5'RACE部分序列设计特异性引物MspF3和MspR3(表 1)。用SMART™ RACE Amplification Kit试剂盒反转录合成cDNA第一链。
| 引物名称 | 序列 | 引物用途 |
| FM1 | AGGCGTVATGGGBAAYMGBGA | 中间片段扩增 |
| RM1 | TGGATSAGCATCCTVMRHGCCGG | 中间片段扩增 |
| MspF1 | AAGACTGTTTCTACAACGT | 3'RACE扩增 |
| MspF2 | ACTTCCTATGGTGCGTCTATGC | 3'RACE扩增 |
| MspF3 | CGTGGAACAACTCAACCG | 3'RACE扩增 |
| MspF4 | TGTGTGCGATGACTGCTCT | 荧光定量 |
| MspR1 | CCTTGTTGAGTTGGCCCACCT | 5'RACE扩增 |
| MspR2 | GCATAGACGCACCATAGGAAGT | 5'RACE扩增 |
| MspR3 | GACTTCCTATGGTGCGTCTATGC | 5'RACE扩增 |
| MspR4 | GCCTTTCCGTGGCATAGAC | 荧光定量 |
| UPM | CTAATACGACTCACTATAGGGCAAGC | 接头引物 |
| NUP | AAGCAGTGGTATCAACGCAGAGT | 接头引物 |
| β-actin-F | CCGAGACATCAAGGAGAAGC | 荧光定量内参 |
| β-actin-R | ATACCGCAAGATTCCATACCC | 荧光定量内参 |
以脊尾白虾眼柄第一链cDNA为模板,利用LA Taq(TaKaRa)试剂盒进行3'RACE、5'RACE扩增。第一次扩增反应体系为: 模板cDNA 0.2μL; TaKaRa LA Taq(5U/μL)0.1μL; 10×LA PCR Buffer 1μL; dNTP mixture(各2.5mm)1.6μL; 引物各0.2μL; 灭菌水6.7μL。第二次扩增反应体系为: 引物各0.2μL; TaKaRa LA Taq(5U/μL)0.1μL; 第一次PCR产物0.5μL; 10×LA PCR Buffer 1μL; dNTP mixture(各2.5mm)1.6μL; 灭菌水6.4μL。3'RACE第一次扩增用引物MspF1和通用引物UPM,第二次扩增用引物MspF2、MspF3和通用引物NUP。5'RACE第一次扩增用引物MspR1和通用引物UPM,第二次扩增用引物MspR2、MspR3和通用引物NUP。反应程序为: 94°C 4min; 94°C 30s,57°C 30s,72°C 2min,30个循环; 72°C 10min。
PCR扩增产物经1.0%的TAE琼脂糖凝胶电泳检测。使用DNA胶回收试剂盒切胶回收目的片段,纯化并检测。胶回收产物与PMD18-T载体相连接。5μL连接产物转化到50μL E.coli Top10感受态细胞。挑取阳性克隆进行菌落PCR鉴定。鉴定结果送与上海桑尼生物科技有限公司进行测序。
1.5 序列分析利用NCBI中的VecScreen去除载体序列,再用BLAST进行序列比对,用ContigExpress 软件将5'端序列、中间片段、3'端序列进行拼接。使用BLAST对获得的MIH基因序列以及推导出的氨基酸序列进行同源性比对。然后用EditSeq程序搜寻开放阅读框(ORF)并将其翻译成氨基酸。利用SMART软件进行功能域预测。用DNAMAN软件对脊尾白虾MIH-like基因与其它物种的MIH氨基酸序列进行多序列比对,采用MAGE4.0软件中的邻接法(Neighbour-Joining)构建系统进化树。
1.6 胁迫实验设计 1.6.1 pH根据于天基等(2014)报道的脊尾白虾半致死pH值的测定。设定本实验的pH值胁迫组3个,pH值分别为6.5(低pH值胁迫组)、8.0(对照组)、9.5(高pH值胁迫组)。胁迫组所用海水使用25%NaOH和盐酸调节养殖用水的pH值,实验期间各处理组pH值的变动幅度为±0.1。pH值每& lt; span lang="EN-US" xml:lang="EN-US">4h调整一次。每组设3个平行,每个平行36尾虾。实验期间分别于0、3、6、12、24、48、72、96h,从实验桶中随机挑选4尾虾,取其眼柄和腹神经节,保存于液氮中。实验期间海水温度为18°C,盐度为32。
1.6.2 盐度胁迫实验根据刘海(2005)报道的脊尾白虾在不同盐度水体中适应性试验。设计7个盐度梯度,分别为4、11、18、25、32、39、46,盐度32为自然海水对照组。其它盐度组用淡水和海盐调节,每组设3个平行,每个平行36尾虾。实验期间分别于0、3、6、12、24、48、72、96h,从实验桶中随机挑选4尾虾,取其眼柄和腹神经节,保存于液氮中。实验期间海水温度为18°C,pH值为7.8±0.2。
1.6.3 氨氮实验根据Chen等(1988)和钟硕良等(1997)测定的养殖池塘底层海水的氨氮浓度为0—46mg/L和0.01—29.3mg/L,以及梁俊平(2012b)报道的脊尾白虾成虾72h半致死质量氨氮浓度(140.28mg/L),设计本实验的5个氨氮梯度,分别为0mg/L(对照)、2mg/L(低浓度)、4mg/L(中浓度)、6mg/L(中高浓度)和8mg/L(高浓度),每个梯度设3个平行,每个平行36尾虾。使用20g/L的氯化铵调整不同实验组的氨氮浓度,每个时间点取样的同时采集水样,奈氏试剂法(陈佳蓉,1996)测定水体的总氨氮浓度并测定水体的pH值、温度和盐度。根据Bower and Bidwell方程计算水体中NH3的浓度。实验期间分别于0、3、6、12、24、48、72、96h,从实验桶中随机挑选4尾脊尾白虾,取其眼柄和腹神经节,保存于液氮中。实验期间海水温度为18°C,盐度为32,pH值为7.8±0.2。此外,为了检测脊尾白虾EcMIH基因在不同组织中的表达水平,另取12尾健康脊尾白虾的眼柄、腹神经节、心脏、血细胞、鳃、肝胰腺、肌肉、卵巢、肠、胃等组织,用于RNA的提取及反转录合成cDNA。
1.7 脊尾白虾EcMIH基因的表达分析Trizol试剂提取各实验组脊尾白虾眼柄和腹神经节等组织的总RNA,反转录合成cDNA,方法按韩俊英等(2011)进行。以EcMIH基因的cDNA序列为模板,设计荧光定量引物MspF4和MspR4(表 1),根据GenBank中脊尾白虾的β-actin基因序列设计一对内参引物β-actin-F、β-actin-R(表 1),并检测荧光定量引物及内参引物的特异性,结果显示良好。利用Real-time PCR检测pH、盐度、氨氮胁迫后的脊尾白虾眼柄和腹神经节中不同时间点MIH基因的相对表达量。反应体系和程序参考FS Universal SYBR Green Master(ROX)说明书,采用10μL反应体系,包括正反向引物各0.1μL; 5μL FS Universal SYBR Green Master(ROX); 1.0μL cDNA; 3.8μL DEPC水。反应程序为: 95°C 10min; 95°C 10s,60°C 34s,40个循环; 95°C 15s,60°C 1min,95°C 15s。实验中每4尾混合作为一个样品,数据为3个重复的平均值±标准差,采用2-△△CT法计算脊尾白虾EcMIH基因的相对表达量,用SPSS17.0软件进行One-Way ANOVA显著性分析。
2 结果 2.1 脊尾白虾EcMIH基因cDNA全长的克隆和序列特征分析采用RACE方法获得全长为1218bp,包括360bp的开放阅读框,394bp的3′端非编码区(UTR)以及420bp的5'端非编码区(UTR)的脊尾白虾EcMIH基因,序列比较分析确定此基因为脊尾白虾MIH-like基因,3′端非编码区没有典型的多聚腺苷酸加尾信号AATAAA,有明显的PolyA尾(GenBank登录号为KM103727)(图 1)。
 |
| 图 1 脊尾白虾MIH-like基因全长cDNA序列及开放阅读框推测的氨基酸序列 Fig. 1 The full-length MIH-like cDNA sequence and deduced amino acid sequence of E. carinicauda |
氨基酸序列分析发现EcMIH基因编码区序列编码120个氨基酸,预测的蛋白分子量为13.71kDa,理论等电点pI为8.02。脊尾白虾MIH由信号肽和成熟肽组成,其N端含有41个氨基酸组成的信号肽。成熟肽由79个氨基酸组成,其中成熟肽序列含6个非常保守的半胱氨酸残基分别为Cys7、Cys24、Cys27、Cys40、Cys44和Cys53,第12位及第72位氨基酸残基分别为Gly和Ile,其中Gly12是CHH家族基因中Ⅱ组的特征位点(Lee et al,1995),Ile72对EcMIH基因的活性有非常重要的作用(Katayama et al,2003)。
对应的核苷酸序列的氨基酸用单个大写字母表示。细线方框内的atg为起始密码子,粗下划线表示信号肽,信号肽和成熟肽之间用竖线(/)划分,引物序列用箭头表示。用*表示终止密码子。第12位及第72位氨基酸残基Gly和Ile为CHH家族基因中Ⅱ组的特征位点用阴影表示
2.2 脊尾白虾EcMIH基因同源性分析利用NCBI中的BLAST对脊尾白虾EcMIH基因进行同源性比较分析(图 2),发现脊尾白虾EcMIH基 因与日本沼虾(Macrobrachium nipponensis)和罗氏沼虾的同源性最高,分别为87%和86%。脊尾白虾MIH-like与其它虾蟹类如寄居蟹属(Cancer pagurus)、克氏原螯虾(Procambarus clarkii)、三疣梭子蟹(Portunus trituberculatus)、拟穴青蟹(Scylla paramamosain)、中华绒螯蟹(Eriocheir sinensis)等的MIH成熟肽同源性分别为58%、51%、49%、46%、47%。与挪威海螯虾、美洲海螯虾、斑节对虾和青虾等的性腺抑制激素(gonad-inhibiting hormone,GIH)成熟肽同源性分别为61%、70%、43%、54%,与黄道蟹大颚器抑制激素(m and ibular organ inhibiting hormone,MOIH)MOIH1和MOIH2成熟肽同源性为50%,与罗氏沼虾、云斑厚纹蟹(Pachygrapsus marmoratus)、普通滨蟹(Carcinus maenas)、凡纳滨对虾的CHH成熟肽同源性较低分别为46%、44%、31%、36%。MEGA 4 .0软件构建系统进化树,结果表明(图 3),脊尾白虾MIH-like与罗氏沼虾MIH和日本沼虾MIH聚为一支。MIH、MOIH和GIH聚为一类,CHH单独聚为一类,这符合高血糖激素家族基因的分类,分为CHH Ⅰ族和CHHⅡ族(De Kleijn et al,1995)。由图可见,所有游泳亚目(Natnatai)的CHH家族基因聚为一类,所有爬行亚目(Peptnatia)CHH家族基因聚为一类,这符合十足目的分类(魏崇德等,1991)。
 |
| 图 2 脊尾白虾MIH-like成熟肽氨基酸序列与其它甲壳动物CHH家族神经肽氨基酸序列的比对 Fig. 2 Multiple alignments of E. carinicauda MIH-like mature peptide with neuropeptide amino acid sequence alignment of other Crustaceans CHH families各物种MIH序列登录号为: 罗氏沼虾(AAL37948.1)、日本沼虾(AEJ54622.1)、寄居蟹属(P55846.1)、克氏原螯虾(P55848.1)、三疣梭子蟹(ABZ04547.1)、拟穴青蟹(AFM35653.1)、中华绒螯蟹(AAQ81640.1)、斑节对虾(AAR89517.1)、挪威海螯虾(AAK58133.2)、美洲海螯虾(P55320.1)、青虾(AEJ54623.1)、斑节对虾(ABG33898.1)、罗氏沼虾(AAL40916.1)、云斑厚纹蟹(AAO27806.1)、普通滨蟹(AAG29435.1)、凡纳滨对虾(BAM93361.1)、黄道蟹(P81034.1)、黄道蟹(P81035.1) |
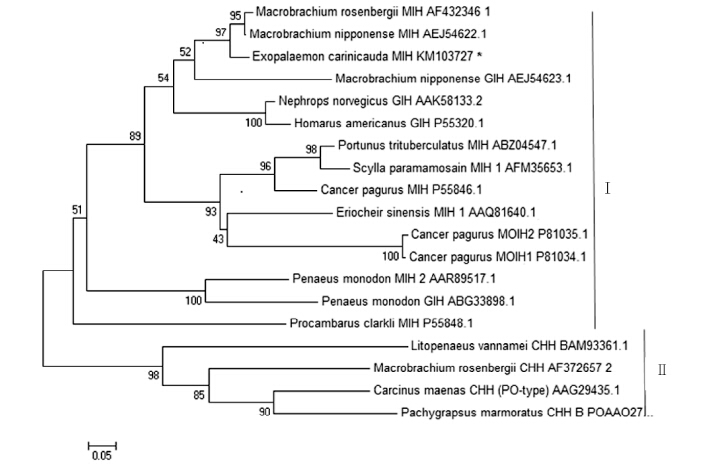 |
| 图 3 基于MIH-like成熟肽氨基酸序列的NJ进化树Fig. 3 NJ tree based on MIH-like mature peptide amino acid of different species |
采用Real-time PCR分析了脊尾白虾EcMIH基因在不同组织中的表达情况,发现EcMIH基因在眼柄(830.79±0.56)、腹神经节(297.34±0.47)、肠(6.02±0.44)、心脏(65.19±0.34)、胃(2.11±0.43)和卵巢(1.00±0.36)中均有表达。而在肝脏、肌肉、鳃和血中不表达。在眼柄中的表达量最高,在卵巢中的表达量最少(图 4)。
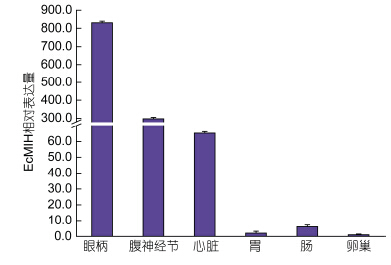 |
| 图 4 EcMIH基因在脊尾白虾不同组织中的表达分布 Fig. 4 Distribution of EcMIH gene in different tissues of E. carinicauda注: 数据是3个重复的平均值±标准差。各组织表达量均以卵巢为比较的倍数表达 |
Real-time PCR检测pH胁迫后不同时间脊尾白虾眼柄和腹神经节中EcMIH基因的表达情况如图 5所示。结果表明: 无论是低pH胁迫组(pH6.5)还是高pH胁迫组(pH9.5),EcMIH基因的表达量在胁迫3—72h期间都显著高于对照组(P<0.05)。pH胁迫后,眼柄和腹神经节中高浓度组(pH9.5)EcMIH基因表达均呈现先上升后下降至初始水平的趋势,但两者变化不完全一致,眼柄中EcMIH基因的表达量在3h达到最高(43.86±0.3 5),12h达到最低(0.81±0.15),而腹神经节在24h达到最高(14.58±0.18),低浓度组,眼柄中EcMIH基因的表达量在48h达到最高(15.38±0.21),72—96h趋于正常水平,而腹神经节中EcMIH基因的表达量在72h达到最高(3.13±0.25),96h趋于正常水平。
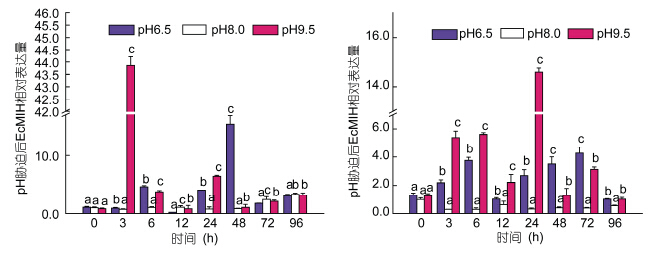 |
| 图 5 不同pH胁迫后EcMIH基因在眼柄(左)和腹神经节(右)中的表达 Fig. 5 The expression of EcMIH gene in eyestalk(left) and ventral ganglion(right)after different pH treatments at different time 同一时间点不同字母者表示差异显著(P<0.05),数据是3个重复的平均值±标准差,各组表达量均以与0h空白对照组相比较的倍数表达。下同 |
Real-time PCR检测盐度胁迫后不同时间脊尾白虾眼柄和腹神经节中EcMIH基因的表达情况如图 7所示。盐度胁迫后,低浓度组(盐度4、11、18)眼柄中EcMIH基因的表达呈现先升高后下降,而腹神经节为先升高后下降再升高,96h后腹神经节中无论高盐(盐度39、46)还是低盐(盐度4、11、18、25)EcMIH基因的表达量都显著高于对照组(P<0.05)。盐度4胁迫下,眼柄中EcMIH基因的表达量与对照组相比在3h显著升高,但6—96h均低于对照组; 盐度11组在3—96h均低于对照组; 而盐度18组除3h、24h外均低于对照组。在腹神经节中,低浓度组(盐度4、11、18、25)在3—96h(72h除外)EcMIH基因的表达量均高于对照组(P<0.05),但盐度4在3h达到最高(46.94± 0.41),盐度11、18在12h达到最高,分别为(5.93±0.32)、(4.12±0.22),盐度25在24h达到最高(8.37±0.31)。
 |
| 图 6 不同pH胁迫后β-actin基因在眼柄(左)和腹神经节(右)中的表达(P>0.05) Fig. 6 The expression of β-actin gene in eyestalk(left) and ventral ganglion(right)after different pH treatments at different time(P>0.05) |
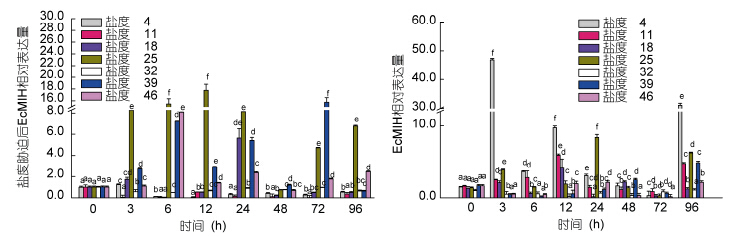 |
| 图 7 盐度胁迫后EcMIH基因在眼柄(左)和腹神经节(右)中的表达Fig. 7 The expression of EcMIH gene in eyestalk(left) and ventral ganglion(right)after salinity stress |
高盐(盐度39、46)胁迫下,眼柄中EcMIH基因的表达量在3—96h均高于对照组; 但盐度39的变化趋势为先升高后下降的趋势,而盐度46的变化趋势为先升高后下降再升高的趋势; 盐度39胁迫EcMIH基因的表达量在72h达到最高(15.75±0.36),96h趋于正常水平; 盐度46在6h达到最高(8.09±0.34),12h下降,24h升高,48h下降,72—96h再次显著升高,分别为(1.77± 0.24)、(2.47±0.21)。
 |
| 图 8 盐度胁迫后β-actin基因在眼柄(左)和腹神经节(右)中的表达(P>0.05)Fig. 8 The expression of β-actin gene in eyestalk(left) and ventral ganglion(right)after salinity stress(P>0.05) |
Real-time PCR检测氨氮胁迫后脊尾白虾眼柄和腹神经节中EcMIH基因的表达情况如图 9所示。氨氮胁迫后,眼柄中EcMIH基因的表达呈现先升高后下降再升高的趋势,而腹神经节呈现先下降再升高的趋势。腹神经节中低浓度组、中高浓度组和高浓度组EcMIH基因的表达量在96h均达到最高,分别为(11.07±0.32),(1.28±0.12),(5.10±0.31); 中浓度组在72h达到最高值(8.03±0.35),而眼柄中各氨氮组的变化不完全一致,低浓度组和中高浓度组在3h达到最高(1.88±0.22),(1.32±0.11); 中浓度组在24h达到最高(4.29±0.31),48—72h表达量下降,96h再次显著升高(2.26±0.15); 高浓度组在96 h达到最高(3.80± 0.21)。
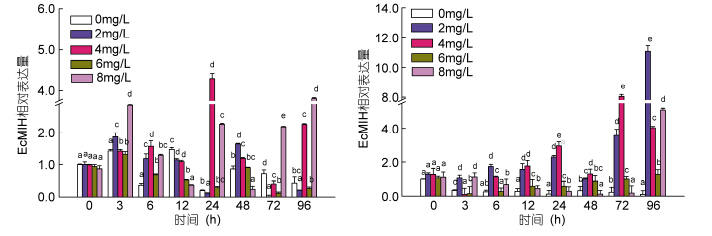 |
| 图 9 不同氨氮胁迫后EcMIH基因在眼柄(左)和腹神经节(右)中的表达 Fig. 9 The expression of EcMIH gene in eyestalk(left) and ventral ganglion(right)after different NH4Cl treatments at different time |
 |
| 图 10 不同氨氮胁迫后β-actin基因在眼柄(左)和腹神经节(右)中的表达(P>0.05)Fig. 10 The expression of β-actin gene in eyestalk(left) and ventral ganglion(right)after different NH4Cl treatments at different time(P>0.05) |
甲壳动物内分泌学中眼柄XO-SG系统的研究一直备受关注。MIH是甲壳动物所特有的家族神经肽类激素,抑制Y器蜕皮类固醇的合成、抑制蜕皮激素的分泌,对卵巢发育也有影响,只有当MIH分泌量减少或停止时才会导致蜕皮现象的发生。本研究根据已报道虾蟹MIH全长cDNA序列比较其同源性,设计简并引物,克隆得到脊尾白虾MIH-like基因全长cDNA序列,成熟肽的同源性比较发现,该基因与日本沼虾MIH-like、罗氏沼虾MIH-A和远海梭子蟹MIH同源性最高,由此可确定脊尾白虾MIH-like基因为脊尾白虾的MIH基因。脊尾白虾MIH成熟肽序列含6个非常保守的半胱氨酸残基,其N端含有41个氨基酸组成的信号肽,成熟肽与日本囊对虾(Ohira et al,2005)一致,由79个氨基酸组成; 通过比较虾蟹类MIH氨基酸序列信号肽和成熟肽的切割位点,发现蟹类前2位氨基酸残基为AA(Lee et al,2007; Stewart et al,2013)或TA(Lu et al,2001)而虾类为SA(Chen et al,2007; Toullec et al,2013); 比较成熟肽氨基酸组成,发现其由于近C-端缺失了几个氨基酸残基,C-末端氨基酸序列的保守性较差,具有 种 间多态性。短尾类(蟹类)为78个氨基酸。克氏原螯虾(Nagasawa et al,1996)和中国对虾(王在照等,2003)为75个氨基酸。刀额新对虾(Tiu et al,2007)为77个氨基酸,南美白对虾(Sun,1994)为72个氨基酸,鹰爪虾(王在照等,2002)为71个氨基酸,由此推测MIH在不同虾体内可能有多种不同构型。脊尾白虾MIH与GIH的同源性很高,与CHH的同源性很低,与其它虾蟹类CHH的同源性也很低,这符合CHH家族基因的分类,也说明I型肽和II型肽之间在种内和种间存在很大差异。
甲壳动物MIH的组织表达目前仅见少量报道。刀额新对虾胚胎期没有检测到MIH基因的表达(Gu et al,1998),锈斑蟳(Charybdis feriatus)孵化前的胚胎中检测到MIH基因的表达(Chan et al,1998),这可能由于物种差异所致; 而在成体侧向地蟹(Gecarcinus lateralis)(Lee et al,2007)、中华绒螯蟹(孙妍等,2011)、凡纳滨对虾(Sun,1994)、日本囊对虾(Ohira et al,1997)、可口美青蟹(Callinectes sapidus)(Lee et al,1995)、锯缘青蟹(Scylla serrata)(Qiu et al,2003)、刀额新对虾、锈斑蟳和日本蟳(Charybdis japonica)(沈建明等,2010)的眼柄中均检测到MIH的表达,表明眼柄X器官—窦腺复合体是甲壳动物的重要神经内分泌器官,通过合成和分泌多种神经多肽激素,调控甲壳动物的性腺发育、色素反应、蜕皮、代谢、渗透压调节等重要生理活动。而日本囊对虾、可口美青蟹、锯缘青蟹、刀额新对虾和锈斑蟳的MIH在脑、胸神经节、腹神经节中也有表达,日本蟳MIH在脑、胸神经节、精巢和卵巢中也有表达。本研究发现,脊尾白虾EcMIH基因在眼柄的表达量最高是卵巢的830倍; 脊尾白虾MIH-like除在眼柄表达外,在腹神经节、心脏、肠、胃和卵巢中也有表达,这表明MIH表达具有较强的组织特异性。而MIH在这些组织的表达与眼柄的表达在功能上是否相同有待进一步研究。
pH、盐度、氨氮是影响海水养殖虾蟹类生理生态的重要环境因子,可直接影响水生生物的存活、生长、蜕皮、繁殖和免疫活性(蔡生力等,1995)。本文分别研究了不同pH、盐度、氨氮胁迫对脊尾白虾EcMIH基因表达的影响。结果发现,在眼柄中高pH、高氨氮胁迫组(8mg/L)在胁迫3h后EcMIH基因的表达量均上升,高盐胁迫组(盐度39、46)在胁迫3—6h后表达量上升,根据这一应激反应,推测MIH具有高血糖活性。而在腹神经节中高氨氮(8mg/L)胁迫0—72h脊尾白虾MIH 的高血糖活性受到抑制,96h后MIH的表达量升高,高血糖活性抑制解除。由此推测在高氨氮(8mg/L)的环境下眼柄为MIH高血糖活性的主要调节器官; 在眼柄中,低盐胁迫下MIH的高血糖活性受到抑制,盐度4胁迫,眼柄中EcMIH基因的表达量与对照组相比在3h升高,但6—96h均低于对照组; 盐度11在3—96h均低于对照组; 而盐度18除3h、24h外均低于对照组 < span lang="EN-US" xml:lang="EN-US">,而腹神经节中,EcMIH基因的表达量在胁迫3h后开始上升,由此推测低盐环境下,腹神经节为MIH高血糖活性的主要调节器官。在眼柄中各氨氮胁迫组在胁迫3h后EcMIH基因的表达量均表现升高,而在腹神经节中胁迫3h后EcMIH基因的表达量均表现下降,由此推测氨氮胁迫环境下眼柄为MIH高血糖活性的主要调节器官。盐度胁迫72—96h脊尾白虾MIH基因表达量从低盐到高盐的变化趋势为先升高后降低在升高,此变化趋势与Lago-Lestón等(2007)用不同温度盐度胁迫凡纳滨对虾的结果一致: 他们研究了温度和盐度对凡纳滨对虾幼虾CHH和EcMIH基因的表达变化规律,发现在盐度(18、25、39、46)胁迫24h后,EcMIH基因表达量均显著增加(P<0.05); 温度对基因表达的影响高于盐度; 盐度(10,16,22,28,34和40)和温度(20°C,24°C,28°C和32°C)胁迫24h,在不同盐度胁迫下MIH-2基因的表达量明显低于MIH-1,且在盐度28表达量几乎为零; 温度为20°C和32°C时MIH基因在不同盐度胁迫下其表达量高于温度为24°C和28°C; 温度为28°C时,MIH基因的表达量在不同盐度胁迫24h后呈下降趋势,且在盐度40时MIH基因的表达量最低; 温度为20°C胁迫24h后,MIH基因的表达量在盐度16为最高,在盐度22,28,34表达量下降,在盐度40表达量上升; Liv-MIH神经肽除了受蜕皮抑制活动影响外还可能有其它多效性的影响(比如高血糖活性)。Chang等(1998)利用ELISA方法研究美洲螯龙虾,发现盐度的降低、升高均能导致CHH含量的增加。拟穴青蟹盐度骤变实验CHH2基因的表达量显著增加,与本研究的EcMIH基因表达趋势基本一致(舒妙安等,2012)。由此可推测出脊尾白虾EcMIH基因参与了环境胁迫后的机体应激反应。
4 结论本研究成功克隆了脊尾白虾MIH-like基因全长cDNA序列,初步揭示了pH、盐度、氨氮胁迫后该基因在眼柄和腹神经节中的表达变化规律,确定MIH基因的表达水平与环境胁迫密切相关,表明该基因参与了环境胁迫后的机体应激反应,为甲壳动物高血糖激素家族响应环境胁迫的机理研究提供了参考。
| 于天基, 李 健, 李吉涛等, 2014. 池养脊尾白虾的生长与繁殖特性. 中国渔业质量与标准, 4(2): 16—25 |
| 王在照, 相建海, 2002. 编码鹰爪虾蜕皮抑制激素基因的cDNA片段的克隆和序列分析. 水产学报, 26(6): 487—492 |
| 王在照, 焦传珍, 张晓军等, 2003. 中国对虾蜕皮抑制激素全长cDNA的克隆及序列分析. 遗传学报, 30(2): 128—134 |
| 任 海, 李 健, 李吉涛等, 2014. 急性氨氮胁迫对脊尾白虾(Exopalaemon carinicauda) 抗氧化系统酶活力及GPx基因表达的影响. 农业环境科学学报, 33(4): 647—655 |
| 刘 海, 2005. 脊尾白虾在不同盐度水体中适应性试验. 苏盐科技, (1): 20, 30 |
| 刘瑞玉, 1995. 中国北部的经济虾类. 北京: 科学出版社, 48—49 |
| 孙 妍, 张亦陈, 刘逸尘等, 2011. 中华绒螯蟹蜕皮抑制激素基因全长cDNA克隆和重组表达. 水生生物学报, 35(2): 210—217 |
| 许文军, 谢建军, 施 慧等, 2010. 池塘养殖脊尾白虾(Exopalaemon carinicauda)感染血卵涡鞭虫的研究. 海洋与湖沼, 41(3): 396—402 |
| 李 洋, 刘 萍, 李 健, 等, 2014. 脊尾白虾酚氧化酶原基因克隆及表达分析. 海洋与湖沼, 45(2): 299—306 |
| 李 洋, 刘 萍, 李 健等, 2013. 脊尾白虾丝氨酸蛋白酶抑制剂基因克隆及表达分析. 中国水产科学, 20(6): 1166—1174 |
| 李美玉, 李 健, 刘 萍等, 2012. 脊尾白虾(Exopalaemon carinicauda)ferritin基因克隆及表达分析. 海洋与湖沼, 43(2): 306—312 |
| 沈 辉, 万夕和, 王李宝等, 2013. 白斑综合征病毒对脊尾白虾的致病性研究. 海洋科学, 37(5): 55—60 |
| 沈建明, 朱冬发, 杨济芬等, 2010. 日本蟳蜕皮抑制激素基因的克隆及表达分析. 见: 经济发展方式转变与自主创新——第十二届中国科学技术协会年会(第三卷), 1—8 |
| 陈佳蓉, 1996. 水化学实验指导书. 北京: 中国农业出版社, 1996, 136—139 |
| 段亚飞, 刘 萍, 李吉涛等, 2013. 脊尾白虾血细胞全长cDNA文库的构建及EST序列分析. 中国水产科学, 20(2): 243—249 |
| 钟硕良, 陈月忠, 林克冰等, 1997. 虾池底质中NH4+-N、S2-和异养细菌含量的变化及其相关性研究. 台湾海峡, 16(4): 449—454 |
| 栗治国, 2013. 脊尾白虾繁殖生物学及人工苗种繁育技术的研究. 青岛: 中国科学院海洋研究所硕士学位论文 |
| 梁俊平, 李 健, 刘 萍等, 2012a. 脊尾白虾生物学特性与人工繁育的研究进展. 中国农学通报, 28(17): 109—116 |
| 梁俊平, 李 健, 李吉涛等, 2012b. 氨氮对脊尾白虾幼虾和成虾的毒性试验. 水产科学, 31(9): 526—529 |
| 舒妙安, 张龙韬, 周宇芳等, 2012. 拟穴青蟹(Scylla paramamosain)两种Ⅰ型高血糖激素基因全长cDNA的克隆及组织表达分析. 海洋与湖沼, 43(4): 695—701 |
| 韩俊英, 李 健, 李吉涛等, 2011. 脊尾白虾热休克蛋白HSP70基因的克隆及其表达分析. 水产学报, 35(8): 1130—1138 |
| 蔡生力, 王崇明, 许小幸, 1995. 1993年青岛流亭镇对虾爆发性流行病调查. 海洋科学, 6: 15—18 |
| Chan S-M, Chen X-G, Gu P-L, 1998. PCR cloning and expression of the molt-inhibiting hormone gene for the crab (Charybdis feriatus). Gene, 224(1—2): 23—33 |
| Chang E S, Keller R, Chang S A, 1998. Quantification of crustacean hyperglycemic hormone by ELISA in hemolymph of the lobster, Homarus americanus, following various stresses. General and Comparative Endocrinology, 111(3): 359—366 |
| Chang E S, Prestwich G D, Bruce M J, 1990. Amino acid sequence of a peptide with both molt-inhibiting and hyperglycemic activities in the lobster, Homarus americanus. Biochem Biophys Res Commun, 171: 818—826 |
| Chen H-Y, Watson R D, Chen J-C et al, 2007. Molecular characterization and gene expression pattern of two putative molt-inhibiting hormones from Litopenaeus vannamei. General and Comparative Endocrinology, 151(1): 72—81 |
| Chen J-C, Liu P-C, Lin Y-T et al, 1988. Super intensive culture of red-tailed shrimp Penaeus penicillatus. Journal of the World Aquaculture Society, 19(3): 127—131 |
| De Kleijn D P V, Van Herp F, 1995. Molecular biology of neurohormone precursors in the eyestalk of Crustacea. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 112(4): 573—579 |
| Gu P L, Chan S-M, 1998. Cloning of a cDNA encoding a putative molt-inhibiting hormone from the eyestalk of the sand shrimp, Metapenaeus ensis. Molecular Marine Biology and Biotechnology, 7(3): 214—220 |
| Katayama H, Nagata K, Ohira T et al, 2003. The solution structure of molt-inhibiting hormone from the Kuruma Prawn Marsupenaeus japonicus. The Journal of Biological Chemistry, 278(11): 9620—9623 |
| Lago-Lestón A, Ponce E, Muñoz M E et al, 2007. Cloning and expression of hyperglycemic (CHH) and molt-inhibiting (MIH) hormones mRNAs from the eyestalk of shrimps of Litopenaeus vannamei grown in different temperature and salinity conditions. Aquaculture, 270(1—4): 343—357 |
| Lee K J, Elton T S, Bej A K, et al, 1995. Molecular cloning of a cDNA encoding putative molt-inhibiting hormone from the blue crab, Callinectes sapidus. Biochemical and Biophysical Research Communications, 209(3): 1126—1131 |
| Lee K J, Kim H-W, Gomez A M et al, 2007. Molt-inhibiting hormone from the tropical land crab, Gecarcinus lateralis: Cloning, tissue expression, and expression of biologically active recombinant peptide in yeast. General and Comparative Endocrinology, 150(3): 505—513 |
| Lin C Y, Chen S H, Kou G H et al, 1998. Identification and characterization of a hyperglycemic hormone from freshwater giant prawn, Macrobrachium rosenbergii. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 121(4): 315—321 |
| Lorenzon S, Francese M, Ferrero E A, 2000. Heavy metal toxicity and differential effects on the hyperglycemic stress response in the shrimp Palaemon elegans. Archives of Environmental Contamination Toxicology, 39(2): 167—176 |
| Lu W Q, Wainwright G, Olohan L A et al, 2001. Characterization of cDNA encoding molt-inhibiting hormone of the crab, Cancerpagurus; expression of MIH in non-X-organ tissues. Gene, 278(1—2): 149—159 |
| Nagasawa H, Yang W-J, Shimizu H et al, 1996. Isolation and amino acid sequence of a molt-inhibiting hormone from the American crayfish, Procambarus clarkii. Bioscience, Biotechnology, and Biochemistry, 60(3): 554—556 |
| Ohira T, Watanabe T, Nagasawa H et al, 1997. Molecular cloning of a moil-inhibiting hormone cDNA from the kuruma prawn Penaeus japonicus. Zoological Science, 14(5): 785—789 |
| Ohira T, Katayama H, Tominaga S et al, 2005. Cloning and characterization of a molt-inhibiting hormone-like peptide from the prawn Marsupenaeus japonicus. Peptides, 26(2): 259—268 |
| Qiu G F, Zhang A P, Lou Y D, 2003. cDNA cloning and expression analysis of molt-inhibiting hormone in the mud crab Scylla serrata. Journal of Fisheries of China, 27(3): 207—212 |
| Santos E A, Keller R, 1993. Effect of exposure to atmospheric air on blood glucose and lactate concentrations in two crustacean species: A role of the Crustacean hyperglycemic hormone (CHH). Comparative Biochemistry and Physiology Part A: Physiology, 106(2): 343—347 |
| Sedlmeier D, 1988. The crustacean hyperglycemic hormone (CHH) releases amylase from the crayfish midgut gland. Regulatory Peptides, 20(2): 91—98 |
| Stentiford G D, Chang E S, Neil D M, 2001. Carbohydrate dynamics and the crustacean hyperglycemic hormone (CHH): Effects of parasitic infection in Norway lobsters (Nephrops norvegicus). General and Comparative Endocrinology, 121(1): 13—22 |
| Stewart M J, Stewart P, Sroyraya M et al, 2013. Cloning of the crustacean hyperglycemic hormone and evidence for molt-inhibiting hormone within the central nervous system of the blue crab Portunus pelagicus. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 164(2), 276—290 |
| Sun P S, 1994. Molecular cloning and sequence analysis of a cDNA encoding a molt-inhibiting hormone-like neuropeptide from the white shrimp Penaeus vannamei. Molecular Marine Biology and Biotechnology, 3(1): 1—6 |
| Tiu S H-K, Chan S-M, 2007. The use of recombinant protein and RNA interference approaches to study the reproductive functions of a gonad-stimulating hormone from the shrimp Metapenaeus ensis. FEBS Journal, 274(17): 4385—4395 |
| Toullec J-Y, Corre E, Bernay B et al, 2013. Transcriptome and peptidome characterisation of the main neuropeptides and peptidic hormones of a euphausiid: the ice krill, Euphausia crystallorophias. PLoS One, 8(8): e71609 |
| Webster S G, 1996. Measurement of crustacean hyperglycaemic hormone levels in the edible crab Cancer pagurus during emersion stress. The Journal of Experimental Biology, 199(Pt7): 1579—1585 |
 2015, Vol. 46
2015, Vol. 46


