文章信息
- 何杰, 吴旭干, 龙晓文, 刘青, 赵恒亮, 姜晓东, 成永旭. 2015.
- HE Jie, WU Xu-Gan, LONG Xiao-Wen, LIU Qing, ZHAO Heng-Liang, JIANG Xiao-Dong, CHENG Yong-Xu. 2015.
- 长江水系中华绒螯蟹野生和养殖群体选育子一代养殖性能和性腺发育的比较
- CULTURE PERFORMANCE AND GONADAL DEVELOPMENT OF THE FIRST GENERATION OF SELECTIVELY-BRED CHINESE MITTEN CRABS FROM WILD AND CULTURED POPULATIONS
- 海洋与湖沼, 46(4): 808-818
- Oceanologia et Limnologia Sinica, 46(4): 808-818.
- http://dx.doi.org/10.11693/hyhz20150100040
-
文章历史
- 收稿日期:2015-01-31
- 改回日期:2015-03-19
2. 上海海洋大学 上海高校知识服务平台水产动物遗传育种中心 上海 201306
2. Aquatic Animal Breeding Center of Shanghai University Knowledge Service Platform, Shanghai Ocean University, Shanghai 201306, China
中华绒螯蟹(Eriocheir sinensis)俗称河蟹、大闸蟹,随着20世纪80年代人工育苗技术取得突破以来,中华绒螯蟹养殖规模迅速扩大,全国绝大多数省份都已经开展人工增养殖,2012年全国养殖总产量达714400t(王武等,2013)。目前,我国中华绒螯蟹养殖主要集中于长江流域,因此长江水系中华绒螯蟹的种源质量对于中华绒螯蟹养殖产业具有极其重要的作用(Sui et al,2011; 张世勇等,2013)。但是,在中华绒螯蟹人工繁育过程中,许多育苗场为了降低亲本费用,通常采用小规格亲本(雌: 60—100 g/只,雄: 80—150 g/只)进行育苗,加上不同水系间盲目引种等原因,致使长江水系中华绒螯蟹养殖群体种质退化严重,一龄性早熟率越来越高,商品蟹规格越来越小(Sui et al,2011; 王武等,2013)。因此,开展长江水系中华绒螯蟹优异种质资源的挖掘利用和良种选育势在必行(朱清顺等,2012; 张世勇等,2013)。
近10年来,江苏淡水水产研究所通过群体选育的方法已选育出生长速度较快的长江水系中华绒螯蟹良种(朱清顺等,2012; 邓燕飞等,2013),这在一定程度上推动了中华绒螯蟹养殖产业的可持续发展,但迄今为止,中华绒螯蟹的良种培育尚缺乏对性腺成熟时间、抗病力和营养品质等经济性状的足够关注和研究。由于性腺和肝胰腺是中华绒螯蟹重要的可食部分,因此中华绒螯蟹商品蟹主要为性腺发育成熟或基本成熟的成蟹(Wu et al,2011),长江水系中华绒螯蟹性腺发育成熟或接近成熟的时间为10—12月,过早或过晚捕捞均会影响其食用价值,因此,其销售及食用时间主要集中于10月底至12月初(滕炜鸣等,2008)。中华绒螯蟹销售时间集中,使得商品蟹销售市场竞争过度,价格波动较大,这不仅使得中华绒螯蟹养殖的经济风险较大,且不利于其均衡上市,这给中华绒螯蟹养殖产业的健康发展带来了一定的负面影响。因此,不同性腺成熟时间的中华绒螯蟹品种培育显得十分重要和迫切。有研究表明,通过遗传育种可以培育动植物的早熟和晚熟品种,在一定程度上实现均衡上市,提高产品的市场竞争力(韦凤英等,2002; 李小红等,2009; 谢宗周等,2011; 冀晓昊等,2014),这为中华绒螯蟹的良种培育提供了思路和依据。
研究表明,长江水系野生扣蟹在池塘养成过程中不仅商品蟹规格大和成活率高,且具有晚熟特性; 而长江水系经过多代池塘养殖的人工繁殖群体通常具有二龄早熟特性(成蟹养殖过程中生殖蜕壳和性腺发育时间提前),这暗示有可能通过遗传育种手段培育中华绒螯蟹二龄早熟和晚熟品系(He et al,2014)。因此,有必要研究长江水系中华绒螯蟹野生和养殖群体选育子代是否仍然能保持二龄早熟和晚熟特性。鉴于此,本文系统研究了长江水系野生和养殖群体选育子一代(G1)及非选育群体在扣蟹和成蟹阶段的养殖性能和性腺发育情况,旨在评估两个选育群体子一代在池塘养殖条件下的综合养殖性能和选育进展,为进一步开展中华绒螯蟹种质资源评价和良种选育提供科学依据和实践参考。
1 材料与方法 1.1 选育群体幼体来源野生中华绒螯蟹成蟹于2010年11—12月捕自长江江苏扬中至丹徒河段(32°11′8.57′N,119°50′1.44′E至32°06′35.80′N,119°29′14.12′E),从中挑选规格较大、背甲额齿尖锐、疣突明显、体质健壮的成蟹作为野生群体选育亲本; 池塘养殖群体成蟹购自上海崇明雨池水产养殖合作社,从该合作社的4hm2池塘共产出的约30000只蟹中挑选2400余只(留种率为8%)规格相对较大,且背甲额齿尖锐、疣突明显的健康个体作为养殖群体选育亲本,对照组购自江苏兴化水产养殖个体户,挑选规格接近、体质健壮的个体作为亲本参与繁殖(三群体亲本数量及规格见表 1)。12月中旬将所有亲本运往辽宁盘锦光合蟹业有限公司如东育苗基地分池交配和育苗,分别获得野生选育G1代(野选G1)、养殖选育G1代(养选G1)和对照组幼体。5月中旬将培育出的三群体大眼幼体运往上海海洋大学崇明基地分池养殖至豆蟹,期间投喂配合饲料,待7月上旬,从三群体中分别挑选规格相近、十足健全的豆蟹备用于扣蟹阶段养殖性能比较[野选G1、养选G1、对照组豆蟹平均体重分别为(0.88±0.13)g、(0.86±0.11)g和(0.87±0.15)g]。
| 类别 | 性别 | 数量(只) | 体重(g) |
| 野生选育亲本 | 雄 | 722 | 208.3±15.4 |
| 雌 | 1703 | 156.9±13.6 | |
| 养殖选育亲本 | 雄 | 760 | 205.7±16.8 |
| 雌 | 1656 | 152.9±14.6 | |
| 对照组亲本 | 雄 | 704 | 150.3±11.3 |
| 雌 | 1537 | 102.4±8.5 |
扣蟹实验池塘为12个等大的养殖围隔,单个围隔呈“回”字形,总底面积约60m2(长×宽=7.8m×7.8m),围隔中间为一水坑,长×宽×深=6m×4m×0.7m供其高温期栖息,水坑四周为平台,平台上种植水稻,每围隔四周设置双层防逃网,防逃网上口设置25cm高的防逃塑料板,每个围隔分别放养对应的豆蟹5000只(雌雄各半),每群体各设4个重复围隔,各围隔之间水流相通,水质基本一致。各围隔内分别种植一定量的水花生供扣蟹隐蔽,同时有利于降低夏季围隔内的水温,围隔内水花生分布和数量基本相似。养殖期间每日下午5: 30投喂一次扣蟹配合饲料(由浙江欣欣饲料有限公司生产),投喂量约占蟹体重的1%—6%,具体根据水温和摄食情况灵活调整,每隔15d左右用聚维酮碘对池塘水体消毒一次,根据水质情况适当换水,确保水质良好。此外,定期梳理水花生,使水花生密度适中,防止疯长造成扣蟹缺氧和水质恶化。
1.3 成蟹实验池塘及养殖管理2012年2月,在同一基地选择两口池塘进行成蟹养殖实验。首先采用塑料网片将该池塘隔成12个面积相等的围隔(长×宽=35m×6m),每个围隔均采用双层网片防逃,围网底部采用石笼连接后埋入土下30cm左右,网顶部两侧缝上35cm高的塑料防逃板防止不同围隔间的河蟹混杂。2月中旬使用生石灰对实验池塘进行消毒和清塘,2周后在各围隔内种植伊乐藻供河蟹隐蔽,伊乐藻株距为1.5m,行距为2m。3月20日左右,从三群体扣蟹实验池塘中挑选规格相近的扣蟹[野生群体的雌雄平均体重分别为(7.86± 2.15)g和(7.39±1.90)g,养殖群体的雌雄平均体重分别为(7.68±1.66)g和(7.23±1.70)g,对照组群体的雌雄平均体重为(7.41±1.69)g和(7.25±1.85)g]。用30mg/L的聚维酮碘溶液浸泡消毒0.5h后,随机放养于12个围隔,每群体重复4个围隔,每围隔雌雄各放养100只扣蟹。整个养殖期间合理控制水位和水草数量,确保水草生长良好,密度适宜,当池塘水温升高至12°C以上时开始投喂人工配合饲料,每天一次,通过检查食台上的残饵情况调整投喂量; 6月下旬起在夜间对各围隔水体进行底部微孔增氧,定期检测水质,每周换水1—2次,保证水质维持在适宜中华绒螯蟹生长的正常范围内。
1.4 数据采集 1.4.1 扣蟹养殖阶段生长性能、存活率、产量和饲料系数2011年7月份起,每月15日前后采样测量蟹的生长情况,用操网随机从每个围隔中各采样150—200只个体,雌雄各占一半左右,用毛巾轻轻擦拭蟹体表水分后,采用电子天平精确称重(精确到0.01 g),据此计算增重率和特定生长率:
增重率WGR(%)= 100×(Wt-W(t-1))/W(t-1)
特定生长率SGR(%)= 100×(lnWt-lnW(t-1))/D
其中,Wt指第t月蟹的平均重量,W(t-1)指第t-1月蟹的平均重量,D为采样的间隔时间。扣蟹生长实验于11月15日停止,排水干塘后捕捉所有的蟹,雌雄分开,分别统计存活率、早熟率、产量以及总体饲料系数,其中饲料系数=消耗饲料总重/(最终产出蟹总重-最初放养扣蟹重)。
1.4.2 成蟹养殖阶段生长性能、性腺发育速度、存活率、产量和饲料系数自2012年4月份到10月份,每月20日左右从各养殖围隔内徒手或用地笼随机抓取30—40只个体,逐个测量体重,计算各月的增重率和特定生长率。为了比较三群体扣蟹在成蟹养殖阶段的性腺发育速度,在8—10月份的体重测量时,逐个记录完成生殖蜕壳完成情况,计算各月的生殖蜕壳完成率,并且从各围隔内随机取出6只蟹(雌雄各半),首先擦去蟹体表水分,精确称量后(精确到0.01 g)进行活体解剖,取出全部肝胰腺和性腺,称重(精确到0.001g)各组织后按照如下公式,分别计算肝胰腺指数(Hepatosomatic index,HSI,%)和性腺指数(Gonadosomatic index,GSI,%):
HSI(%)=WH/W×100%
GSI(%)=WG/W×100%
式中,WH指肝胰腺重,WG指性腺重,W指体重。10月20日起,在岸上徒手抓捕或用地笼捕捞,分别统计每个围隔的雌雄个体成活率、产量,同时计算成蟹养殖阶段的饲料系数,计算方法同上。
1.4.3 成蟹平均规格和规格分级根据最终每个围隔中捕捞的所有成蟹分别计算两群体雌雄成蟹的平均体重。参照He 等(2014)的方法,对最终捕获的所有成蟹按体重进行规格分级,雄蟹分为7级: ≥250g,225—249.9g,200—224.9g,175—199.9g,150—174.9g,125—149.9g和<125g; 雌蟹分为5级: ≥150g,125— 149.9g,100—124.9g和<75g,分别统计三群体养成的成蟹各规格等级所占比例。
1.5 数据分析所有数据采用平均值±标准差表示。采用SPSS13.0软件对实验数据进行统计分析,用Levene方法进行方差齐次性检测,当不满足使用齐性方差时进行反正弦或平方根处理,用T检验(Independent samples t-test)检查三群体各指标间的差异性,采用Sigmaplot10.0软件绘图,取P<0.05为差异显著。
2 结果 2.1 扣蟹阶段的养殖性能 2.1.1 生长性能野选G1、养选G1及对照组在扣蟹养殖阶段的体重增长趋势见图 1,8月份三群体的体重无显著差异,自9月份起野选G1的体重始终低于对照组,其中9月份显著低于对照组,而养选G1在10月份起的体重略高于对照组并显著高于野选G1(P<0.05); 随着养殖时间的延长,三群体扣蟹的增重率(WGR)整体上均呈下降趋势(图 2),仅在8—9月间,野选G1显著低于对照组,其它时间段内三群体间的WGR并无显著差异(P>0.05); 三群体的SGR变化与WGR的变化趋势类似(图 3),总体上,整个扣蟹养殖周期(7—11月)的SGR大小顺序为养选G1>对照组>野选G1。
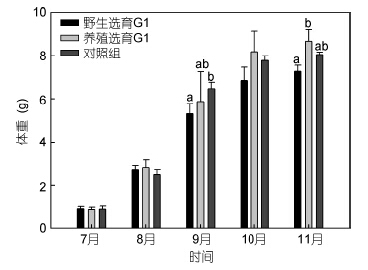 |
| 图 1 野选G1、养选G1在扣蟹阶段的体重变化 Fig. 1 The changes of monthly body weight(WG)of the first generation(G1)of selective-breeding based on wild and cultured E. sinensis populations during the juvenile culture stage |
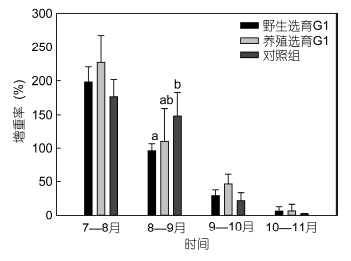 |
| 图 2 野选G1、养选G1在扣蟹阶段的月增重率Fig. 2 Mean monthly weight gain(WGR)of the first generation(G1)of selective-breeding based on wild and cultured E. sinensis populations during the juvenile culture stage |
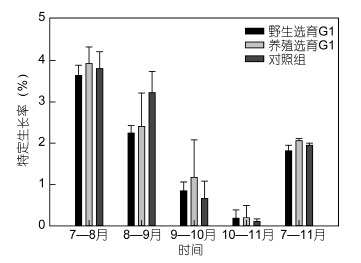 |
| 图 3 野选G1、养选G1在扣蟹阶段的月特定生长率Fig. 3 Mean monthly specific growth rate(SGR)of the first generation(G1)of selective-breeding based on wild and cultured E. sinensis populations during the juvenile culture stage |
由图 4可见,无论是雄体还是雌体,两选育群体G1的早熟率均低于对照组,其中,野选G1的雄体及总体早熟率均显著低于对照组(P<0.05); 与对照组相比,野选G1的雄体、雌体及总体早熟率分别降低36.64%、35.35%和36.89%,养选G1的早熟率分别降低14.31%、14.06%和15.25%; 另外,三群体的雌体早熟率(11.95%—18.86%)均明显高于雄体(5.01%— 7.75%),表现出明显的性别差异。
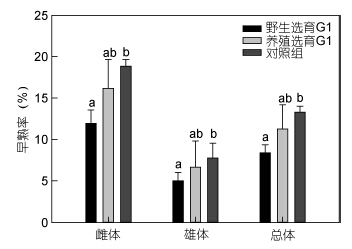 |
| 图 4 野选G1、养选G1在扣蟹阶段的早熟率 Fig. 4 The percentage of precocious of the first generation(G1)of selective-breeding based on wild and cultured E. sinensis populations during the juvenile culture stage |
从最终扣蟹规格看,三群体最终正常扣蟹与早熟蟹的平均体重均无显著差异(表 2,P>0.05); 但是,无论是雄体还是雌体,野选G1和养选G1的成活率均高于对照组(表 3),相比之下,野选G1雄体、雌体和总体成活率分别比对照组高出11.48%,12.47%和12.09%,养选G1雄体、雌体和总体分别高出对照组8.94%、8.05%和8.61%。由于上述提及的对照组早熟率较高,故对照组早熟蟹的产量显著高于野选G1,而正常扣蟹的产量显著低于两个选育群体(P<0.05),三群体的正常扣蟹和早熟蟹总产量差异不显著, 均在3200kg/hm2左右; 三群体在扣蟹养殖阶段的饲料系数顺序为: 野选G1(1.96)>对照组(1.83)>养选G1(1.67),但三者无显著差异(P>0.05)。
| 项目 | 平均体重(g) | ||
| 野选G1 | 养选G1 | 对照组 | |
| 正常扣蟹 | |||
| 雄体 | 5.34±0.43 | 5.09±0.40 | 5.00±0.51 |
| 雌体 | 4.95±0.23 | 4.85±0.16 | 4.89±0.26 |
| 总体 | 5.15±0.28 | 4.97±0.17 | 4.96±0.24 |
| 早熟蟹 | |||
| 雄体 | 21.32±1.98 | 20.00±1.67 | 20.06±1.95 |
| 雌体 | 19.70±0.96 | 19.79±1.68 | 18.76±1.27 |
| 总体 | 20.51±1.14 | 19.90±1.16 | 19.44±1.39 |
| 项目 | 野选G1 | 养选G1 | 对照组 |
| 成活率(%) | |||
| 雄体 | 57.00±8.45 | 55.70±7.59 | 51.13±4.34 |
| 雌体 | 55.21±8.16 | 53.04±8.55 | 49.09±5.62 |
| 总体 | 56.11±7.72 | 54.37±8.03 | 50.06±5.73 |
| 产量(kg/hm2) | |||
| 正常扣蟹 | 2251.80±324.45a | 2263.35±334.50a | 1852.80±92.15b |
| 早熟蟹 | 897.45±193.65a | 1150.65±394.05ab | 1261.65±362.55b |
| 总产量 | 3149.10±475.20 | 3414.15±625.80 | 3084.60±513.30 |
| 饲料系数 | 1.96±0.40 | 1.67±0.56 | 1.83±0.72 |
三群体中华绒螯蟹扣蟹在成蟹养殖阶段的体重变化见图 5,就雄体而言,9月份之前,养选G1生长较快,体重较高,自9月份起,野选G1体重迅速增加,在10月份,野选G1养成的雄蟹体重显著高于对照组(P<0.05),而养选G1介于野选G1与对照组之间; 就雌蟹而言,8月份之前,两选育群体体重均低于对照组,自9月份以后,两选育群体的体重均高于对照组,但差异不显著(P>0.05); 从最终养成成蟹的平均体重看,两选育群体均高于对照组,但仅有野选G1雌蟹显著高于对照组(P<0.05),野选G1的雄体、雌体、总体规格分别比对照组提高14.19%、10.56%和12.38%,养选G1分别比对照组提高10.59%、10.11%和10.40%; 随着养殖时间的延长,三群体雌雄蟹的WGR均持续降低(图 6),其中在9—10月期间增重率极低,仅4%左右,并且无论是雄体还是雌体,三群体的WGR仅在8—9月期间出现显著差异,即在8—9月野选G1的WGR显著高于对照组(P<0.05); 三群体的SGR与WGR均表现出相似的变化规律(图 7),但是无论是雄体还是雌体,整个养殖期间(3—10月)两选育群体的SGR与对照组相比均无显著差异(P>0.05)。
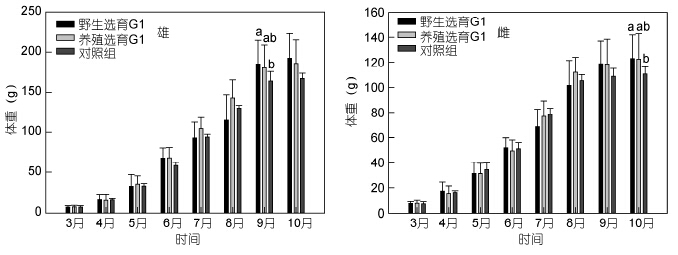 |
| 图 5 野选G1、养选G1在成蟹养殖阶段的体重变化 Fig. 5 The changes of monthly body weight of the first generation(G1)of selective-breeding based on wild and cultured E. sinensis populations during the adult culture stage |
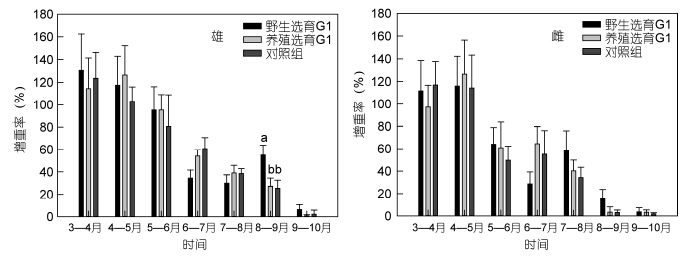 |
| 图 6 野选G1、养选G1在成蟹养殖阶段的月增重率Fig. 6 Mean monthly body weight gain rate(WGR)of the first generation(G1)of selective-breeding based on wild and cultured E. sinensis populations during the adult culture stage |
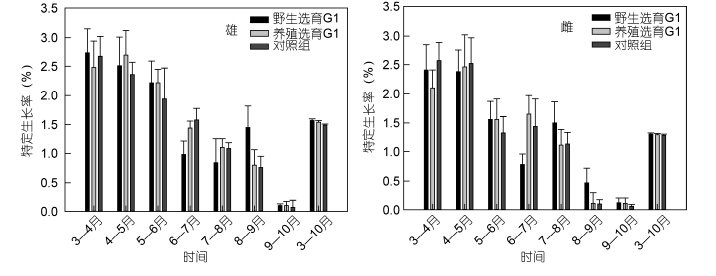 |
| 图 7 野选G1、养选G1在成蟹养殖阶段的月特定生长率 Fig. 7 Mean monthly specific growth rate(SGR)of the first generation(G1)of selective-breeding based on wild and cultured E. sinensis populations during the adult culture stage |
三群体在8月份起均陆续开始进行生殖蜕壳,图 8所示,在8月20日采样时发现,野选G1雌雄体的生殖蜕壳完成率均略低于对照组,而养选G1雌雄体生殖蜕壳完成率均略高于对照组,到9月20日左右,养选G1及对照组的雌雄体生殖蜕壳完成率已经达到100%,野选G1中仍有部分的雌体未完成生殖蜕壳,生殖蜕壳完成率为92%,整体上,野选G1的生殖蜕壳稍滞后于对照组,养选G1的生殖蜕壳稍提前于对照组,但差异不明显; 生殖蜕壳完成后雄体和雌体的性腺发育速度加快,性腺指数逐渐提高,肝胰腺指数逐渐下降(表 4),无论是雌体还是雄体,野选G1的性腺指数始终略低于对照组,养选G1始终略高于对照组,这说明养选G1性腺发育速度快于对照组,野选G1慢于对照组; 对同一群体的雌雄体而言,雄体性腺发育时间明显早于雌体,其在8月份性腺指数已在1%左右,而此时雌体仅为0.3%左右,此后雌体性腺指数增加速度显著快于雄体。
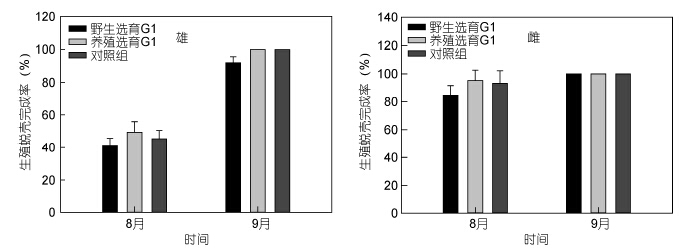 |
| 图 8 野选G1、养选G1在成蟹养殖阶段8、9月份生殖蜕壳完成率比较 Fig. 8 The percentage of crabs that finished puberty molting during the August and September samplings of the first generation(G1)of selective-breeding based on wild and cultured E. sinensis populations during the adult culture stage |
| 项目 | 时间(月.日) | 雄体 | 雌体 | ||||
| 野选G1 | 养选G1 | 对照组 | 野选G1 | 养选G1 | 对照组 | ||
| HSI(%) | 08.25 | 9.28±1.83 | 8.98±1.11 | 9.27±1.56 | 9.82±0.27 | 9.60±0.41 | 9.63±1.03 |
| 09.25 | 8.67±0.83 | 8.05±0.77 | 8.61±0.79 | 9.18±0.90 | 9.04±0.91 | 9.10±0.85 | |
| 10.25 | 7.42±0.79 | 6.77±0.84 | 7.20±0.93 | 7.42±0.79 | 7.07±1.11 | 7.29±0.96 | |
| GSI(%) | 08.25 | 0.78±0.17a | 1.11±0.12b | 0.85±0.20c | 0.27±0.08a | 0.41±0.05b | 0.30±0.08a |
| 09.25 | 1.15±0.29 | 1.35±0.21 | 1.24±0.34 | 2.25±0.56 | 2.68±0.56 | 2.38±0.64 | |
| 10.25 | 2.37±0.34 | 2.78±0.42 | 2.52±0.43 | 8.80±0.75 | 9.51±0.67 | 9.10±0.98 | |
从表 5可见,无论是雄体还是雌体,两选育群体在成蟹养殖阶段的成活率也均高于对照组5%左右(野选G1雄体、雌体提高及总体分别提高14.21%、12.77%和12.27%; 养选G1分别提高9.64%、8.41%和9.30%),再加上两选育群体的平均体重较高,以致两选育群体的雌雄体产量均高于对照组,其中雄体及总体产量显著高于对照组(P<0.05); 两选育群体的饲料系数与对照组较为接近,均无显著差异(P>0.05)。
| 项目 | 野选G1 | 养选G1 | 对照组 |
| 成活率(%) | |||
| 雄体 | 50.00±5.35 | 48.00±3.37 | 43.78±3.65 |
| 雌体 | 51.75±4.99 | 49.75±4.11 | 45.89±3.48 |
| 总体 | 50.33±4.01 | 49.00±3.67 | 44.83±3.54 |
| 产量(kg/hm2) | |||
| 雄体 | 454.95±49.95 a | 446.55±57 a | 365.55±43.95 b |
| 雌体 | 312.45±35.55 | 298.05±40.05 | 253.95±33.45 |
| 总体 | 767.55±81a | 745.05±57a | 619.5±48.45b |
| 饲料系数 | 2.87±0.32 | 2.89±0.37 | 2.92±0.45 |
最终野选G1、养选G1和对照组养成雄体的平均体重分别为(186.318±19.46)g、(191.37±22.84)g和(165.40±17.68)g; 雌体的平均体重分别为(122.45±15.73)g、(121.62± 13.47)g和(112.90±13.96)g。图 9显示,三群体最终养成成蟹的各规格百分比均呈正态分布,雄体主要集中于175—199.9g和150—174.9g两个体重范围,雌体主要集中于125—149.9g和100—124.9g。并且,无论是雄体还是雌体,两选育群体的大规格蟹(雄体>175g,雌体>125g)比例均高于对照组; 由于不同围隔间的差异较大,三群体间各种规格蟹的比例均无显著差异(P>0.05)。
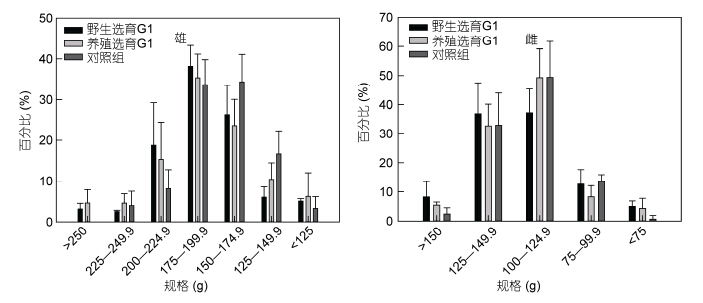 |
| 图 9 野选、养选G1最终养成成蟹的规格分布 Fig. 9 Harvest size distribution of different body weight ranges from the first generation(G1)of selective-breeding based on wild and cultured E. sinensis populations adult E. sinensis |
先前的研究表明,野生捕捞和池塘养殖中华绒螯蟹扣蟹在相同养殖环境下进行成蟹养殖时,最终 池塘养殖群体生殖蜕壳提前、性腺成熟时间较早,二龄早熟现象明显,而野生群体具有明显的二龄晚熟现象,但最终成蟹规格大(He et al,2014),这给选育二龄早熟和晚熟品系培育提供了基础材料,因此,本课题组以长江水系野生和池塘养殖群体为选育基础群,以降低一龄早熟率、提前或延后二龄成熟期、提高养成规格为主要选育目标,采用继代选育法组建保种性选育核心群,通过第一代的选育,进行定向对比养殖实验,结果显示,野选和养选G1代在扣蟹养殖阶段的一龄早熟率比对照组分别降低36.89%和15.25%,成活率分别提高12.09%和8.61%,在成蟹养殖阶段,两选育群体的成活率分别比对照组提高12.27%和9.30%,最终成蟹规格分别比对照组提高12.38%和10.40%,并且野选G1的生殖蜕壳和性成熟时间略有推迟,养选G1的生殖蜕壳时间略有提前; 中华绒螯蟹“长江1号”快速生长品系选育时,G1代的平均规格比未选育组提高6.64%(邓燕飞等,2013),这暗示不同的选育基础群体和不同选育策略均会影响其选育效果和遗传进展。此外,不同物种选育到同一世代的选育效果可能也会有较大差异,如三疣梭子蟹(Portunus trituberculatus)快速生长品系“黄选1号” 选育到G1代规格提高了2.91%,成活率提高8.66%(李健等 < span lang="EN-US" xml:lang="EN-US">,2013); 凡纳滨对虾(Litopenaeus vannamei)的生长和抗TSV(Taura syndrome virus)品系选育时G1代的生长速度提高21.2%,成活率提高了18.4%(Argue et al,2002)。此外,中华绒螯蟹的一龄早熟率与一龄扣蟹养殖期间的成活率直接相关,在相同的养殖条件下,成活率高的群体或家系,则早熟率低; 反之亦然(何正侃等,1999),因此,本研究中两选育群体一龄早熟率低是由遗传决定还是由于两选育群体在一龄扣蟹养殖期间的成活率高所致,这有待进一步研究。本研究中两选育群体G1代最终养成规格大于未选育组(对照组),这可能是由于采用大规格亲本蟹选育所达到的良好效果。总体上,本研究中野选和养选G1代在降低一龄早熟率、提高成活率和成蟹规格方面取得了较好的选育效果,但在二龄早熟和晚熟方面效果不够显著,这可能是由于本研究中的选育方法造成的。
早熟和晚熟可能是生物体的一种病理状态,也可能是农业生产中具有重要经济价值的数量性状,一些物种在进化或选育过程中形成了性早熟或晚熟的特性并能在群体中稳定遗传,从而改变其成熟期,这对优化农产品的品种结构、延长市场供应期具有重要的作用(储明星等,2009; 冯涛等,2009; 谢宗周等,2011; 冀晓昊等,2014)。性早熟和性晚熟在自然界许多鱼类和甲壳动物上广泛存在(Amano et al,1995; Basavaraju et al,2002; Begtashi et al,2004),可能有着较为复杂的原因,连续家养多代的鱼类养殖群体通常存在性早熟现象(Navarro-Martin et al,2011; Crespo et al,2013)。中华绒螯蟹的性早熟现象较为复杂,分为一龄扣蟹早熟和二龄成蟹早熟两种不同的早熟现象,一龄扣蟹早熟通常出现于9月下旬后,这些幼蟹养殖3—4个月便进行生殖蜕壳,从而启动性腺快速发育,一龄早熟蟹体重在15—35g,经济价值和食用价值较低,这严重危害一龄扣蟹养殖阶段的养殖性能和经济效益(Wu et al,2011); 二龄早熟通常出现在成蟹养殖阶段,一些成蟹在7—8月便完成生殖蜕壳和启动性腺发育,早于正常二龄蟹生殖蜕壳时间(8—9月),二龄早熟蟹体重通常小于二龄晚熟蟹,但其性腺成熟时间早于二龄正常成熟个体。由于部分二龄早熟蟹的出现,可以提前供应市场,有利于均衡上市,降低中华绒螯蟹上市时间过分集中的现象。因此,降低中华绒螯蟹一龄早熟率,提前或延迟二龄蟹成熟时间是今后中华绒螯蟹良种培育的重要目标,这有助于中华绒螯蟹养殖产业的健康可持续发展。
大量研究表明中华绒螯蟹性成熟时间由内因和外因共同决定,内因是其在长期进化过程中形成的自身遗传特点(李晨虹等,2002; 张世勇等,2013)、种质混杂(李应森等,2001)、性别(He et al,2014)等; 外因包括温度(张列士等,2001)、光照(Li et al,2011a)、盐度(魏薇等,2007)、营养(陈再忠等,2003; Wu et al,2011)和养殖密度(Li et al,2007)等。本研究中养选G1成熟时间提前、性腺发育提早,而野选G1的二龄成熟时间延后,性腺发育推迟,与野生、养殖扣蟹原代(G0)在池塘内养殖所得结果类似(He et al,2014),这说明,经过多年人工养殖的中华绒螯蟹养殖性状已经发生了一些变化; 同时也暗示通过遗传选育调控中华绒螯蟹性腺成熟及上市时间是可行的。经过多代家养的水产动物性腺成熟时间提前,从而生长时间变短和成体偏规格偏小,这可能与其表观遗传有关,特别是性腺发育相关功能基因的DNA甲基化(Navarro-Martin et al,2011; Crespo et al,2013),有关中华绒螯蟹一龄和二龄性早熟的分子机制有待进一步深入研究。本研究中两选育群体G1一龄早熟率较低,二龄早熟和晚熟效果不明显,其可能原因是:(1)本研究中选用大规格野生和池塘养殖亲本进行人工育苗,大规格亲本及祖先在扣蟹养殖过程中可能早熟较低,从而造成其子代在扣蟹养殖阶段的低早熟率(张德隆等,2001; Li et al,2011b);(2)本研究中的二龄早熟和晚熟亲本的选择方法有待进一步提高,如: 亲本选择过程中,未能将二龄早熟和晚熟性状与大规格亲本两类性状有效结合进行良种选育。鉴于此,本课题组在G1代选育的 基础上,进一步优化良种选育的技术路线,系统研究中华绒螯蟹性成熟的第二性征变化,筛选快速评价指标来有效判别中华绒螯蟹生殖蜕壳和性腺发育阶段,有利于良种选育过程为挑选个体较大的二龄早熟(7月下旬成熟)和晚熟(10月上旬成熟)个体进行定向选育,提高选育效果。
| 王 武, 王成辉, 马旭洲, 2013. 河蟹生态养殖. 北京: 中国农业出版社, 59—84 |
| 王成辉, 李思发, 李晨虹等, 2001. 池塘放养中华绒螯蟹长江种群与辽河种群性早熟出现差异的观察与分析. 湖泊科学, 13(1): 57—62 |
| 韦凤英, 廖玉英, 罗蒙和等, 2002. 银香麻鸡和霞烟鸡早熟品系选育与应用研究. 中国家禽, 24(18): 12—14 |
| 邓燕飞, 夏爱军, 潘建林等, 2013. 中华绒螯蟹“长江1号”的选育. 水产养殖, 34(4): 43—47 |
| 冯 涛, 狄 冉, 储明星等, 2009. 哺乳动物性晚熟相关基因的研究进展. 中国畜牧兽医, 36(2): 86—90 |
| 成永旭, 王 武, 吴嘉敏等, 2000. 虾蟹类幼体的脂类需求及脂类与发育的关系. 中国水产科学, 7(4): 104—107 |
| 朱清顺, 柏如发, 邓燕飞, 2012. 中华绒螯蟹‘长江一号’生长性能比较研究. 农学学报, 2(1): 53—57 |
| 刘 磊, 李 健, 刘 萍等, 2012. 三疣梭子蟹微卫星标记与生长相关性状的相关性分析. 水产学报, 36(7): 1034— 1041 |
| 李 莉, 许 飞, 张国范, 2011. 水产动物基因资源和分子育种的研究与应用. 中国农业科技导报, 13(5): 102—110 |
| 李 健, 刘 萍, 高保全等, 2013. 三疣梭子蟹新品种“黄选1号”的选育. 渔业科学进展, 34(5): 51—57 |
| 李小红, 王业建, 谢运河等, 2009. 极早熟优质高产春大豆湘春豆26的选育. 大豆科技, (5): 63, 65 |
| 李应森, 李思发, 王江玲等, 2001. 长江和辽河水系中华绒螯蟹湖泊放养生长性能的比较. 水产科学, 20(5): 1—3 |
| 李晓晖, 许志强, 潘建林等, 2010. 中华绒螯蟹人工选育群体的遗传多样性. 中国水产科学, 17(2): 236—242 |
| 李晨虹, 李思发, 邢益于等, 2002. 池养长江蟹、辽河蟹生长性能及其遗传环境交互作用分析. 水生生物学报, 26(4): 335—341 |
| 李鸿鸣, 孙效文, 2002. 应用大规模家系选育技术促进辽宁海水养殖业的可持续发展. 沈阳农业大学学报(社会科学版), 4(1): 7—10 |
| 吴 滟, 付春鹏, 蒋速飞等, 2011. 中华绒螯蟹微卫星标记与生长性状相关性的初步分析. 水生生物学报, 35(2): 197—202 |
| 何正侃, 印 骏, 朱雅珠, 1999. 密度、营养与河蟹蟹种生长及性早熟之间的相关关系. 水产科技情报, 26(2): 73—76 |
| 张世勇, 傅洪拓, 乔 慧等, 2013. 中华绒螯蟹遗传育种研究进展. 中国农学通报, 9(20): 39—45 |
| 张列士, 徐琴英, 2001. 自然及养殖水体河蟹性成熟和性早熟的研究. 水产科技情报, 28(3): 106—111 |
| 张德隆, 杜晓燕, 赵金利等, 2001. 河蟹性早熟成因及控制方法的研究. 淡水渔业, 31(4): 36—39 |
| 陈再忠, 成永旭, 王 武, 2003. 早熟期间中华绒螯蟹肝胰腺指数、肝脂含量及脂肪酸组成的变化. 水产学报, 27(1): 57—61 |
| 郭正霞, 辛秀娟, 肖君华, 2004. 性早熟相关基因的研究进展. 国外医学儿科学分册, 31(6): 300—302 |
| 盛志廉, 陈瑶生, 1999. 数量遗传学. 北京: 科学出版社, 191 |
| 傅洪拓, 万山青, 付春鹏等, 2010. 青虾生长性状相关的微卫星标记筛选, 水生生物学报, 34(5): 1043—1048 |
| 储明星, 冯 涛, 狄 冉等, 2009. 哺乳动物性早熟相关基因的研究进展. 遗传, 31(1): 13—28 |
| 谢宗周, 邓秀新, 伊华林等, 2011. 晚熟脐橙新品种——伦晚脐橙的选育. 果树学报, 28(4): 733—734 |
| 熊良伟, 2014. 中华绒螯蟹遗传连锁图谱构建及经济相关性状QTL定位. 上海: 上海海洋大学博士学位论文, 64—67 |
| 冀晓昊, 毛志泉, 张艳敏等, 2014. 晚熟苹果新品种‘山农红’. 园艺学报, 41(7): 1503—1504 |
| 魏 薇, 吴嘉敏, 魏 华, 2007. 盐度对中华绒螯蟹性早熟生理机制的影响. 中国水产科学, 14(2): 275—280 |
| Amano M, Hyodo S, Kitamura S et al, 1995. Short photoperiod accelerates preoptic and ventral telencephalic salmon GnRH synthesis and precocious maturation in underyearling male masu salmon. General and Comparative Endocrinology, 99(1): 22—27 |
| Argue B J, Aree S M, Lotz J M et al, 2002. Selective breeding of Pacific white shrimp (Litopenaeus vannamei) for grow th and resistance to Taura Syndrome Virus. Aquaculture, 204(3—4): 447— 460 |
| Basavaraju Y, Mair G C, Kumar H M M et al, 2002. An evaluation of triploidy as a potential solution to the problem of precocious sexual maturation in common carp, Cyprinus carpio, in Karnataka, India. Aquaculture, 204(3—4): 407—418 |
| Begtashi I, Rodríguez L, Moles G et al, 2004. Long-term exposure to continuous light inhibits precocity in juvenile male European sea bass (Dicentrarchus labrax, L.). I. Morphological aspects. Aquaculture, 241(1—4): 539—559 |
| Crespo B, Gómez A, Mazón M J et al, 2013. Isolation and characterization of Ff1 and Gsdf family genes in European sea bass and identification of early gonadal markers of precocious puberty in males. General and Comparative Endocrinology, 191: 155—167 |
| He J, Wu X G, Li J Y et al, 2014. Comparison of the culture performance and profitability of wild-caught and captive pond-reared Chinese mitten crab (Eriocheir sinensis) juveniles reared in grow-out ponds: Implications for seed selection and genetic selection programs. Aquaculture, 434: 48—56 |
| Hetzel D J S, Crocos P J, Davis G P et al, 2000. Response to selection and heritability for growth in the Kuruma prawn, Penaeus japonicus. Aquaculture, 181(3—4): 215— 223 |
| Li X D, Dong S L, Lei Y Z et al, 2007. The effect of stocking density Chinese mitten crab Eriocheir sinensis on rice and seed yields in rice-crab culture systems. Aquaculture, 273(4): 487—493 |
| Li X W, Li Z J, Liu J S et al, 2011a. Effects of light intensity on molting, growth, precocity, digestive enzyme activity, and chemical composition of juvenile Chinese mitten crab Eriocheir sinensis. Aquaculture International, 19(2): 301—311 |
| Li X, Li Z, Liu J et al, 2011b. Advances in precocity research of the Chinese mitten crab Eriocheir sinensis. Aquaculture Internation, 19(2): 251—267 |
| Navarro-Martin L, Viñas J, Ribas L et al, 2011. DNA methylation of the gonadal aromatase (cyp19a) promoter is involved in temperature-dependent sex ratio shifts in the European sea bass. PLoS Genetics, 7(12): e1002447 |
| Sui L Y, Wille M, Cheng Y X et al, 2011. Larviculture techniques of Chinese mitten crab Eriocheir sinensis. Aquaculture, 315(1—2): 16—19 |
| Wu X G, Wang Z K, Cheng Y X et al, 2011. Effects of dietary phospholipids and highly unsaturated fatty acids on the precocity, survival, growth and hepatic lipid composition of juvenile Chinese mitten crab, Eriocheir sinensis (H. Milne-Edwards). Aquaculture Research, 42(3): 457—468 |
 2015, Vol. 46
2015, Vol. 46


