文章信息
- 陈先锋, 周前进, 王瑞娜, 段维军, 苗亮, 陈炯. 2015.
- CHEN Xian-Feng, ZHOU Qian-Jin, WANG Rui-Na, DUAN Wei-Jun, MIAO Liang, CHEN Jiong. 2015.
- 环介导等温扩增联合横向流动试纸条快速检测扁浒苔(Ulva compressa)的研究
- RAPID DETECTION OF ULVA COMPRESSA BY LOOP-MEDIATED ISOTHERMAL AMPLIFICATION COMBINED WITH LATERAL FLOW DIPSTICK
- 海洋与湖沼, 46(4): 819-827
- Oceanologia et Limnologia Sinica, 46(4): 819-827.
- http://dx.doi.org/10.11693/hyhz20150200048
-
文章历史
- 收稿日期:2015-02-06
- 改回日期:2015-03-26
2. 宁波检验检疫科学技术研究院 宁波 315012
2. Academy of Inspection and Quarantine, Ningbo, 315012
扁浒苔(Ulva compressa)是属于绿藻门、绿藻纲、石莼目、石莼科、石莼属的一种大型藻类。石莼属(Ulva)藻类呈全球性分布,常见于海洋环境,半咸水或江河水中也有分布,多生长于潮间带的岩石上或石沼中,或泥沙滩的石砾上,在大型海藻的藻体和船舶外壳上也可附生。其中,扁浒苔(U. compressa)、浒苔(Ulva prolifera)、肠浒苔(Ulva intestinalis)等在我国的海洋野生植物中分布极为丰富,是重要的经济藻类,含有许多人体必需的营养成分,可食用,也具有重要的药用价值(Hiqashi-Okaj et al,1999; Raman et al,2004; Mamatha et al,2007)。同时,扁浒苔、浒苔等石莼属藻类也是引起绿潮灾害的主要生物种类(Duan et al,2012; Huo et al,2013; Liu et al,2013b; Smetacek et al,2013)。近几年,在黄海、东海等沿海水域由石莼属引发的绿潮灾害对当地的海洋生态系统及相关产业造成了巨大危害(Ye et al,2011; Huo et al,2013; Liu et al,2013a,b)。
目前,石莼属等绿潮藻类的鉴定仍以传统的藻类培养,形态学观察为主(Culverhouse et al,1996)。该方法不仅操作繁琐(需定期更换培养液)、培养周期过长(30d左右)、对培养条件(光照、温度、光周期)和培养设施有一定的要求,而且对操作人员的专业要求高,并不适用于藻类的快速诊断和绿潮灾害的及时防治。而且,石莼属藻类的形态、色泽,以及藻体大小等随环境变化而呈现出差异; 不同种的石莼属藻类也会因环境变化呈现出相似的形态特征(Reddy et al,1992; Hayden et al,2003)。这种种内和种间的形态特征的交错给依赖于形态学特征的物种鉴定和检测带来了很大的困难。正是由于基于形态学特征的鉴定方法的不足,直到2003年根据分子证据,才将原石莼属和原浒苔属合二为一,统一为石莼属(Ulva)(Hayden et al,2003)。日趋严重的绿潮灾害迫使石莼属藻类的相关检测技术向着快速、特异、准确的方向发展。
基于核酸扩增的分子检测技术具有灵敏度高、特异性好、检测时间短等优点,其中,以聚合酶链式反应(Polymerase Chain Reaction,PCR)或分子探针技术为主要反应原理的分子技术已应用于藻类物种鉴定,尤其是微藻的快速鉴定和检测(Coyne et al,2005; Goffredi et al,2006; Yuan et al,2012; Antonella et al,2013; Doll et al,2014)。但由于这些方法对仪器设备的要求较高,工作环境严格,仅限于实验室诊断。日本学者Notomi等(2000)研发了一种基于核酸扩增的新型检测技术——环介导等温扩增技术(loop- mediated isothermal amplification,LAMP),该技术在具链置换活性的Bst DNA聚合酶的作用下,利用6—8条特异性引物,在恒温条件下可使核酸扩增达到109—1010个数量级(Notomi et al,2000)。LAMP反应可在类似于水浴锅等恒温容器中完成,摆脱对于仪器和实验场地的苛刻要求。但是,LAMP产物的检测以琼脂糖凝胶电泳方法或浊度检测法为主,在此方面仍旧受到凝胶成像系统或浊度仪等设备的限制。而横向流动试纸条(lateral flow dipstick,LFD)检测结果可视,若将这两中技术联用,可极大程度上降低了检测过程对仪器的依赖性。LAMP-LFD技术是将LAMP产物进行生物素(biotin)标记,标记产物与异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的特异性探针杂交,杂交结果利用横向流动试纸条(lateral flow dipstick,LFD)检测。而且探针的引入可有效避免常规核酸扩增技术(PCR等)引起的污染问题,使得检测结果更加特异,在生物物种的实验室诊断和现场检测领域均体现出较好的应用潜力(Nimitphak et al,2008; Puthamibool et al,2009; Ding et al,2010; 王瑞娜等,2014)。
本研究根据扁浒苔的内转录间隔区(ITS1-5.8S- ITS2)的序列保守区设计3对引物和1条异硫氰酸荧光素标记的探针,经条件优化后,建立了扁浒苔LAMP-LFD检测方法。
1 材料与方法 1.1 藻种分离株及培养实验所用微藻分离株(塔玛亚历山大藻、无纹环沟藻、东海原甲藻、锥状斯克里普藻、赤潮异弯藻)由宁波大学海洋生物实验室藻种室提供。实验所用石莼属绿藻经由母藻细断法进行分离(Hiraoka et al,1998),按Duan等(2012)采用的方法于本实验室培养、保存。具体所用藻类见表 1,其中,扁浒苔分离株55用于LAMP条件优化、灵敏度分析等实验。
| 藻类名称 | 英文名称 | 分离株 | 来源 |
| 塔玛亚历山大藻 | Alex and rium tamarense | NMBjah048 | 周成旭博士惠赠(王金娜等,2010) |
| 无纹环沟藻 | Gyrodinium instriatum | NMBjah046 | 周成旭博士惠赠(王金娜等,2010) |
| 东海原甲藻 | Prorocentrum donghaiense | NMBjah045 | 周成旭博士惠赠(周成旭等,2006) |
| 锥状斯克里普藻 | Scrippsiella trochoidea | NMBjah044 | 周成旭博士惠赠(王金娜等,2010) |
| 赤潮异弯藻 | Heterosigma akashiwo | H1 | 周成旭博士惠赠(周成旭等,2006) |
| 扁浒苔 | Ulva compressa | SDF10 | 本实验室培养(Duan et al,2012) |
| 扁浒苔 | Ulva compressa | 55 | 本实验室培养(Duan et al,2012) |
| 曲浒苔 | Ulva flexuosa | SDF12 | 本实验室培养(孙东等,2011) |
| 缘管浒苔 | Ulva linza | HS42 | 本实验室培养 |
| - | Ulva ohnoi | FJ4 | 本实验室培养 |
| 孔石莼 | Ulva pertusa | SDF30 | 本实验室培养(Duan et al,2012) |
| 浒苔 | Ulva prolifera | XS5 | 本实验室培养(孙东等,2011) |
表
Tab.1
1.2 藻类DNA的制备各藻类分离株基因组DNA的提取参照植物组织基因组DNA提取试剂盒的步骤进行(Qiagen,Hilden,Germany)。获取的基因组DNA经Qubit 2.0 Fluorometer(Life Technologies,Carlsbad,USA)测定浓度后用作标准品,-30°C贮存备用。
1.3 LAMP-LFD引物及探针的设计针对NCBI上公布的扁浒苔ITS1-5.8-ITS2序列(GenBank登录号: AF013982)设计3对引物,包括上游外引物UcoITS-F3、上游内引物UcoITS-FIP、下游外引物UcoITS-B3、下游内引物UcoITS-BIP,以及环引物UcoITS-LF和UcoITS-LB,用于LAMP(表 2,图 1)。同时,基于该扩增区段设计1条DNA探针UcoITS-HP用于杂交实验(表 2,图 1)。其中,上游内引物UcoITS-FIP的5’端进行biotin标记,UcoITS-HP的5’端进行FITC标记。另外,外引物UcoITS-F3和UcoITS-B3作为引物应用于常规PCR扩增,扩增片段大小为333 bp。上述引物和探针由英维捷基(上海)贸易有限公司合成。
| 引物 | 长度(碱基数) | 序列(5’—3’) | 目的 |
| UcoITS-F3 | 19-mer | CTCTCGCAACGATGAAGAA | LAMP/PCR |
| UcoITS-B3 | 20-mer | CTCAGGTCGAATGGAAAGTT | LAMP/PCR |
| UcoITS-FIP | 37-mer(F1c+F2)a | CCGACGCTGAGGCAGATGGCAGAATTCCGTGAGTCAT | LAMP |
| UcoITS-BIP | 42-mer(B1c+B2) | CTGGCTGAAGTACAGAGGTTCGAGTATCCTTCGTGGCTCATA | LAMP |
| UcoITS-LF | 18-mer | TGGTCTCGTCCGAAGACT | LAMP |
| UcoITS-LB | 19-mer | GACTAGGTAGGTTGCTCGC | LAMP |
| UcoITS-HPb | 17-mer | GTCCTTGCGGCCGGGCT | LFD |
| a上游引物UcoITS-FIP的5’端进行biotin标记; bUcoITS-HP的5’端进行FITC标记 | |||
 |
| 图 1 扁浒苔rDNA ITS1-5.8S-ITS2基因序列的LAMP-LFD引物设计示意图 Fig. 1 Design of primers and DNA probe targeting ITS1-5.8S-ITS2 of U. compressa used in LAMP-LFD assay UcoITS-LFc、UcoITS-B1c、UcoITS-B2c和UcoITS-B3c分别是UcoITS-LF、UcoITS-B1、UcoITS-B2和UcoITS-B3的互补序列 |
LAMP的反应体系为25µL,具体组成参考Ding等(2010),主要包括20 mmol/L Tris-HCl(pH 8.8),6.5 mmol/L MgSO4,10 mmol/L KCl,10 mmol/L(NH4)2SO4,0.1% Triton X-100,1.6 mol/L甜菜碱,1.4 mmol/L dNTPs,外引物UcoITS-F3和UcoITS-B3各0.2µmol/L,内引物UcoITS-FIP和UcoITS-BIP各1.6µmol/L,环引物UcoITS-LF和UcoITS-LB各0.4µmol/L,Bst DNA
聚合酶(New Engl and BioLabs,美国)8 U,藻类基因组DNA标准品1µL。阴性对照不加任何DNA。选用扁浒苔分离株55的较高浓度的基因组DNA(1.0×103 pg/µL)作为模板,分别在61、63和65°C下进行LAMP反应,根据扩增效果筛选最佳反应温度。将DNA标准品已10倍浓度为单位进行倍比稀释,选取1.0×103、1.0×102、1.0×101、1.0×100、1.0×10-1和1.0×10-2 pg/µL等6个浓度的基因组DNA为模板,在确定的最适温度下进行LAMP扩增,根据起峰时间和扩增强度分析反应时间; 在此基础上,选择最低检测浓度的基因组DNA为模板分别选择20、30、40、50、60和70 min作为LAMP反应时间,在最适温度下扩增,扩增产物经2%琼脂糖凝胶电泳分析,确 定反应的最适时间。
1.5 利用LFD检测LAMP产物(LAMP-LFD)LFD试纸条购买自Milennia Biotec GmbH(Milenia GenLine HybriDetect by Milenia Biotec GmbH,Germany)。根据该试纸条的设计原理,检测时FITC标记的探针与biotin标记的LAMP产物特异性杂交,杂交产物与金标记的FITC抗体结合形成三元复合物,结合在具有biotin抗体的检测线上; 未杂交的探针与金标记的FTIC抗体形成两元复合物,经过检测线,结合在质控线上。经biotin标记的LAMP反应结束后,不进行终止反应,而是将20 pmol FITC标记的探针UcoITS-HP加入反应体系中,63°C杂交5 min。取5 µL杂交液加入80 µL Buffer混匀,将试纸条沿正确方向竖直放入该Buffer中反应3 min左右,肉眼判断结果。
1.6 LAMP-LFD的特异性验证选择扁浒苔(Ulva compressa)分离株SDF10、曲浒苔(Ulva flexuosa)SDF12、Ulva ohnoi FJ4、缘管浒苔(Ulva linza)HS42、孔石莼(Ulva pertusa)SDF30、浒苔(Ulva prolifera)XS5等常见石莼属绿藻,以及塔玛亚历山大藻(Alex and rium tamarense)NMBjah048、无纹环沟藻(Gyrodinium instriatum)NMBjah046、东海原甲藻(Prorocentrum donghaiense)NMBjah045、锥状斯克里普藻(Scrippsiella trochoidea)NMBjah044和赤潮异弯藻(Heterosigma akashiwo)H1等国内常见微藻种类共11株用于LAMP-LFD的特异性检验。上述藻类基因组DNA的提取方法按步骤1.2进行,将各基因组DNA的浓度调整到约1.0×103 pg/µL后用作LAMP反应的模板,反应体系和条件参考步骤1.4。扩增产物分别采用琼脂糖凝胶电泳和LFD进行检测。
1.7 LAMP-LFD的灵敏度分析如步骤1.4所述,选取扁浒苔分离株55的6个不同浓度(1.0×103,1.0×102,1.0×101,1.0×100,1.0×10-1和1.0×10-2 pg/µL)的基因组DNA为模板,采用优化后的反应条件进行LAMP反应,扩增产物分别采用2%琼脂糖凝胶电泳和LFD进行检测。
同时,以上述6个不同浓度的基因组DNA为模板,以外引物UcoITS-F3和UcoITS-B3为特异性引物,进行PCR扩增。PCR的反应体系为25 µL,包括: 10×PCR Buffer 2.50 μL,5 U/μL rTaq DNA聚合酶(TaKaRa,中国大连)0.25 μL,dNTPs(0.25mmol/L)2μL,0.20 μmol/L gyrB-F3 2 μL,0.20 μmol/L gyrB-B3 2 μL,模板1 μL,用无菌水补足反应体系。PCR反应程序是: 95°C预变性 2 min后; 94°C 30 s,55°C 30 s,72°C 30 s,扩增30个循环; 72 °C延伸10 min。扩增产物经2%琼脂糖凝胶电泳检测。
1.8 LAMP-LFD的重复性实验取3份新培养的扁浒苔分离株55,按照步骤1.2的方法进行基因组DNA的提取,浓度测定后,调整至最低检测浓度,采用优化后的反应条件进行LAMP反应,扩增产物分别采用琼脂糖凝胶电泳和LFD进行检测。
1.9 野外样品检测共收集海水样品12份。样品通过100目的筛绢网过滤后,取400 mL水样与500 mL的三角烧瓶中,按Duan等(2012)所述的方法进行培养,培养成熟的藻体用于显微观察。另取过滤后的水样250 mL直接用于基因组DNA的提取,具体方法参考1.2所述,用于LAMP-LFD和PCR鉴定。
2 结果 2.1 LAMP扩增条件的确立以较高浓度的扁浒苔基因组DNA(1.0×103 pg/µL)为模板,分别在61、63和65°C下进行LAMP。3个反应温度下均可获得特征性的梯形条带,而不添加任何DNA模板的反应管中未检测到扩增(图 2a)。但在63°C条件下,梯形条带间的间隔最为分明,条带最为清晰,故选择63°C作为最适反应温度(图 2a)。
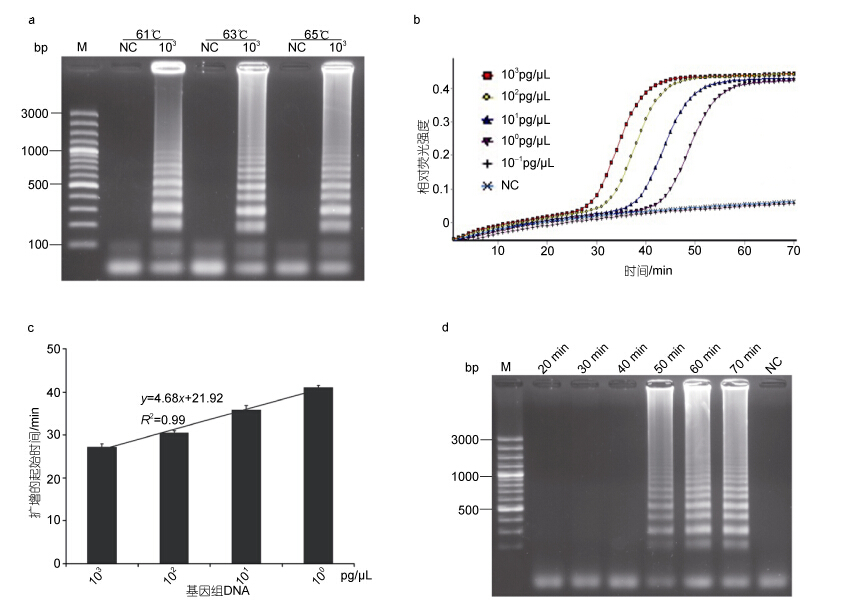 |
| 图 2 LAMP检测扁浒苔最适反应条件的确定 Fig. 2 The optimization of LAMP for detection of U. compressa a. 确定最佳反应温度: 1、3和5,以蒸馏水为模板; 2、4和6,以扁浒苔分离株55的较高浓度基因组DNA(1.0×103 pg/µL)为模板; M,GeneRuler 100 bp plus DNA Ladder; 下同。b. 不同浓度的基因组DNA作为模板的LAMP反应; NC,不加任何DNA模板。c. 扩增的起始时间(起峰时间)与基因组DNA浓度的关系,呈明显额线性相关。d. 以较低浓度(1.0×100 pg/ µL)基因组DNA为模板时,扩增时间对LAMP产物的影响; NC,不加任何DNA模板 |
在63°C条件下,模板浓度在1.0×103 pg/µL和1.0×100 pg/µL之间均可获得明显扩增(图 2b),起峰时间维持在27—41 min(图 2c),起峰时间随模板浓度降低而逐渐增加,呈明显的线性相关(图 2c),约60 min时,相对荧光强度达到平台期(图 2b)。当以较低的1.0×100 pg/µL的基因组DNA为模板时,发现反应到50 min时可以检测到明显的梯形条带,而70 min与60 min时的产物浓度并无明显增加(图 2d),与扩增曲线显示的结果(图 2c)一致。因此确定60 min为最适反应时间。
2.2 LAMP-LFD检测的特异性以11株常见石莼属绿藻和微藻的基因组DNA(1.0×103 pg/µL)为模板,按优化的LAMP反应体系63°C反应60 min。结果表明,浒苔分离株SDF10与55一样可获得明显的扩增(图 3a,3b),而曲浒苔、浒苔、缘管浒苔、孔石莼等石莼属绿藻的反应呈阴性(图 3a,3b),塔玛亚历山大藻、无纹环沟藻、东海原甲藻、锥状斯克里普藻和赤潮异弯藻等5株微藻的反应亦呈阴性(图 3a,3b)。LFD检测结果表明,以两株扁浒苔分离株的基因组DNA 为模板时,试纸条的检测线位置出现明显的阳性条带,而其它10株藻类分离株的反应产物在试纸条的检测线位置未能检测到条带(图 3c)。
2.3 LAMP-LFD检测的灵敏度结果表明,LAMP扩增过程中,通过凝胶电泳的方式可检测到的最低模板浓度是1.0×100 pg/µL(图 4a),而利用LFD可检测到的最低浓度是1.0×10-1 pg/µL(图 4b)。以外引物UcoITS-F3和UcoITS-B3为特异性引物的PCR方法能够检测到的最低模板浓度为1.0×101 pg/µL(图 4c)。 2.4 LAMP-LFD检测的重复性
将3份新培养的扁浒苔分离株55的基因组DNA进行倍比稀释,以1.0×100 pg/µL浓度的基因组DNA为模板进行LAMP反应,产物经琼脂糖凝胶电泳分析; 以1.0×10-1 pg/µL浓度的基因组DNA为模板进行LAMP反应,产物经LFD检测。实验表明,利用扁浒苔的基因组DNA为模板进行的LAMP或LAMP-LFD检测,结果均呈阳性; 而不加任何DNA为模板的检测,结果呈阴性,具有良好的重复性。
2.5 LAMP-LFD检测海水中藻类样品的适用性分析利用传统的藻类分离、培养、显微观察的方法对获得的12个海水样品进行了鉴定,发现江苏的JS-3-1、JS-10和JS-11为扁浒苔(表 3)。LAMP-LFD的结果表明江苏的JS-3-1、JS-10和JS-11检测结果为阳性,其余为阴性,检测结果与显微观察一致(表 3)。利用PCR的方法获得江苏的JS-3-1、JS-10和JS-11,以及青岛的S19检测结果均为阳性,其余为阴性(表 3)。针对ITS1-5.8S-ITS2区的测序结果表明藻类分离株JS-3-1、JS-10和JS-11为扁浒苔,而青岛的S19分离株为浒苔(表 3)。
| 样品编号 | 来源地 | 检测方法 | ITS1-5.8S-ITS2/(GenBank登录号) | ||
| 显微观察 | LAMP-LFD | PCR | |||
| BW30 | 宁波 | - | - | - | / |
| JS-3-1 | 江苏 | + | + | + | +/(GenBank: KR006936) |
| JS-10 | 江苏 | + | + | + | +/(GenBank: KR006937) |
| JS-11 | 江苏 | + | + | + | +/(GenBank: KR006938) |
| FJ-10 | 福建 | - | - | - | / |
| FJ-11 | 福建 | - | - | - | / |
| FJ-12 | 福建 | - | - | - | / |
| S19 | 青岛 | - | - | + | 浒苔/(GenBank: KR006939) |
| S76 | 青岛 | - | - | - | / |
| S77 | 青岛 | - | - | - | / |
| S78 | 青岛 | - | - | - | / |
| HS42 | 青岛 | - | - | - | / |
石莼属绿藻作为一类海洋经济藻类,具有重要的食用和药用价值(Hiqashi-Okaj et al,1999; Raman et al,2004; Mamatha et al,2007),其可能引发的绿潮灾害一直未引起足够的重视。但是,近年来,由石莼属绿藻引发的绿潮灾害在全球范围内呈现高发、频发态势,给当地生态环境以及海水养殖、旅游等产业产生了巨大影响(Smetacek et al,2013)。2008年,青岛附近黄海海域暴发了绿潮灾害,近万人参与了藻体清除工作,花费多达3亿美元(Liu et al,2013a),同时给近海的水产养殖造成的直接经济损失达10亿美元(Ye et al,2011)。因此,建立准确、快速的藻类鉴定技术实现对石莼属绿藻的有效监测、预防和控制具有重要意义。
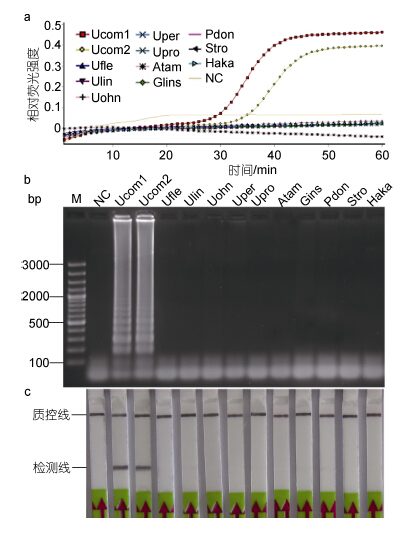 |
| 图 3 LAMP(a、b)和LAMP-LFD(c)的特异性实验结果 Fig. 3 Specificity test of LAMP(a,b) and LAMP-LFD(c)for detection of U. compressa Ucom1,扁浒苔55; Ucom2,扁浒苔SDF10; Ufle,曲浒苔SDF12; Ulin,缘管浒苔HS42; Uohn,曲浒苔FJ4; Uper,孔石莼SDF30; Upro,浒苔XS5; Atam,塔玛亚历山大藻NMBjah048; Gins,无纹环沟藻NMBjah046; Pdon,东海原甲藻NMBjah045; Stro,锥状斯克里普藻NMBjah044; Haka,赤潮异弯藻H1; NC,不加任何DNA模板 |
目前,绿潮藻检测技术的发展还相对滞后,传统的形态学观察仍是主要判断依据。石莼属种类多,形态特征复杂且易随环境改变而变化,形态学观察的方法常常使得石莼属藻类的鉴定出现混乱或难以判断(Blomster et al,1998; Malta et al,1999),这就要求检测人员必须具备较强的专业知识,即便如此,在实际操作中,也经常出现结果的误判。借助分子生物学的方法进行绿潮藻类的鉴定仍处于起步阶段。基于ITS、二磷酸核酮糖羧化酶大亚基基因(rbcL)等基因序列的系统进化分析较早应用于石莼属藻类的种属鉴定(Blomster et al,1998; Coat et al,1998),作为传统形态学观察的一种辅助手段,在藻类鉴定方面取得了较好的应用效果(Liu et al,2010; Wang et al,2010; Duan et al,2012)。Xiao等(2013)基于ITS建立了限制性片段长度多态性(RFLP)的分析方法,结合5S rDNA间隔区的PCR扩增技术,成功地应用于黄海海域常见石莼属和盘苔属藻类的种类鉴定。尽管如此,这些方法均未对自身的检测灵敏度等指标进行描述。
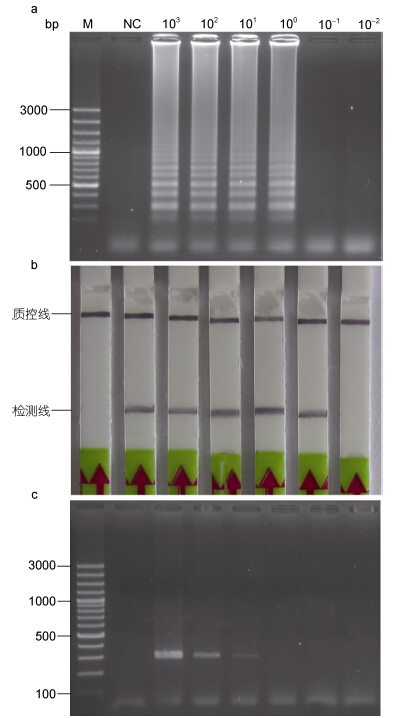 |
| 图 4 LAMP(a)、LAMP-LFD(b)和PCR(c)检测扁浒苔的灵敏度比较 Fig. 4 Comparison in detection limit to U. Compressa by LAMP(a),LAMP-LFD(b),and PCR(c)NC: 不加任何DNA模板。LAMP-LFD检测到的最低模板浓度为1.0×10-1 pg/µL; LAMP为1.0×100 pg/µL; PCR方法为1.0×101 pg/µL |
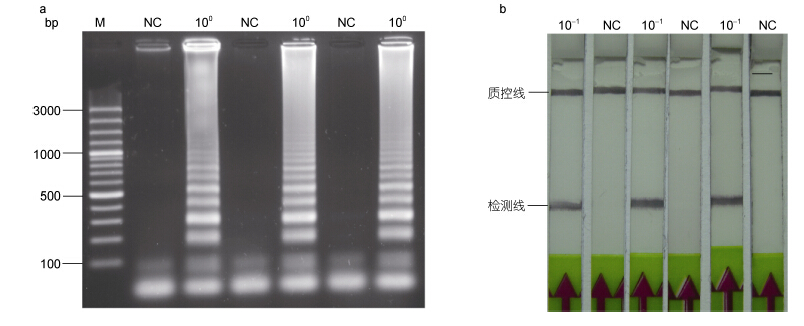 |
| 图 5 LAMP(a)和LAMP-LFD(b)的重复性实验 Fig. 5 Reproducibility of LAMP-LFD(a) and LAMP(b)for detection of U. compressaa. 以扁浒苔1.0×100 pg/µL浓度的基因组DNA为模板; NC,不加任何DNA模板。b. 以扁浒苔1.0×10-1 pg/µL浓度的基因组DNA为模 板; NC,不加任何DNA模板 |
段维军等(2012)通过比较分析石莼属不同种类的ITS序列,建立了可特异性检测扁浒苔的PCR方法,最低可检测到10 pg的扁浒苔基因组DNA。Zhang等(2014)以浒苔的5S rDNA间隔区为靶标建立了荧光原位杂交技术(FISH),利用该技术不仅可将浒苔与缘管浒苔、曲浒苔、扁浒苔、孔石莼,以及盘苔属藻类区分开来,同时也能对浒苔完成定量分析。本研究建立的LAMP-LFD技术,能够将扁浒苔与浒苔、曲浒苔、缘管浒苔和孔石莼等石莼属区分开来,而且针对塔玛亚历山大藻、无纹环沟藻、东海原甲藻、锥状斯克里普藻和赤潮异弯藻等引发赤潮的常见藻类也表现出良好的特异性。利用该LAMP-LFD方法,最低可检测到0 .1 pg的扁浒苔基因组DNA,是以UcoITS-F3和UcoITS-B3为特异性引物的PCR方法的100倍。12个的野外样本检测结果显示,LAMP-LFD技术的检测结果与传统的形态学观察、PCR方法取得的结果基本一致,表明该方法有潜力成为我国沿海扁浒苔快速检测的有效技术手段之一并加以推广。
基于PCR或核酸杂交的检测技术能够适用于多数生物样本的检测,尤其适用于设备齐全的实验室诊断领域。实时、便捷是分子生物学技术的重要指标,也是决定其能广泛应用于各领域现场检测的主要因素。目前针对石莼属藻类的检测技术均体现出一定的适用性,但作为一种快检技术应用于藻类的现场检测仍存在明显的不适性。依赖于核酸测序的系统进化分析与传统的形态学观察结合后能够准确的确定藻类物种(Liu et al,2010; Wang et al,2010; Duan et al,2012),但该方法依赖于PCR技术,序列测定受制于相关公司,而且该方法需工作人员具备专业的系统进化知识,诸多限制使得本方法多在石莼属藻类基础性研究的实验室使用。RFLP和常规PCR技术能够快速完成石莼属藻类的实验室诊断(Duan et al,2012; Xiao et al,2013),但需依赖于PCR仪、凝胶成像系统等仪器设备。本研究建立的LAMP-LFD技术在核酸扩增阶段摆脱了对PCR仪等昂贵仪器的依赖,在检测阶段也不再需要凝胶成像系统或浊度仪等设备,整个检测完全可在室外完成; 而且特异性探针的引入也可避免荧光染料法造成的假阳性问题(Schnetzinger et al,2013)。同时,本研究建立的LAMP-LFD方法能够在60 min内实现核酸的几何级数扩增,完成整个检测也仅需要不到70 min。因此,本研究建立的LAMP-LFD方法作为一种快检技术,可作为扁浒苔现场检测的重要工具并加以推广。
4 结论本研究根据扁浒苔的ITS1-5.8S-ITS2基因序列建立的LAMP-LFD方法可特异性检测扁浒苔。该方法检测灵敏度高,最低可检测到0.1 pg的扁浒苔基因组DNA; 检测时间短,从LAMP扩增到LFD结果判读仅需70 min,且无需对待检样品进行培养、分离。该技术摆脱了对实验室环境和仪器设备的依赖,对操作人员的技能要求较低,作为一种新型快检技术,有潜力成为扁浒苔现场检测的重要手段。
| 王金娜, 严小军, 周成旭等, 2010. 产油微藻的筛选及中性脂动态积累过程的检测. 生物物理学报, 26(6): 472—480 |
| 王瑞娜, 周前进, 陈 炯, 2014. 环介导等温扩增联合横向流动试纸条可视化检测海豚链球菌方法的建立. 农业生物技术学报, 22(12): 1584—1594 |
| 孙 东, 孙存华, 段维军等, 2011. 宁波地区石莼属绿藻形态学观察及分子生物学鉴定. 安徽农业科学, 39(12): 6936—6938 |
| 周成旭, 马 斌, 汪飞雄等, 2006. 海洋原甲藻与三角褐指藻混合培养条件下的种群生长与氮磷营养盐变化. 海洋科学, 30(12): 58—61 |
| 段维军, 郭立新, 陈先锋等, 2012. 扁浒苔PCR快速检测方法研究. 海洋科学, 36(1): 30—35 |
| Antonella P, Luca G, 2013. The quantitative real-time PCR applications in the monitoring of marine harmful algal bloom (HAB) species. Environmental Science and Pollution Research, 20(10): 6851—6862 |
| Blomster J, Maggs C A, Stanhope M J, 1998. Molecular and morphological analysis of Enteromorphaintestinalis and E. compressa (Chlorophyta) in the British Isles. Journal of Phycology, 34(2): 319—340 |
| Coat G, Dion P, Noailles M C et al, 1998. Ulva armoricana (Ulvales, Chlorophyta) from the coasts of Brittany (France). II. Nuclear rDNA ITS sequence analysis. European Journal of Phycology, 33(1): 81—86 |
| Coyne K J, Handy S M, Demir E et al, 2005. Improved quantitative real-time PCR assays for enumeration of harmful algal species in field samples using an exogenous DNA reference standard. Limnology and Oceanography: Methods, 3(9): 381—391 |
| Culverhouse P F, Simpson R G, Ellis R et al, 1996. Automatic classification of field-collected dinoflagellates by artificial neural network. Marine Ecology Progress Series. Oldendorf, 139(1): 281—287 |
| Ding W C, Chen J, Shi Y H et al, 2010. Rapid and sensitive detection of infectious spleen and kidney necrosis virus by loop-mediated isothermal amplification combined with a lateral flow dipstick. Archives of Virology, 155(3): 385—389 |
| Doll C, Main C R, Bianco C et al, 2014. Comparison of sandwich hybridization assay and quantitative PCR for the quantification of live and preserved cultures of Heterosigma akashiwo (Raphidophyceae). Limnology and Oceanography: Methods, 12: 232—234 |
| Duan W J, Guo L X, Sun D et al, 2012. Morphological and molecular characterization of free-floating and attached green macroalgae Ulva spp. in the Yellow Sea of China. Journal of Applied Phycology, 24(1): 97—108 |
| Goffredi S K, Jones W J, Scholin C A et al, 2006. Molecular detection of marine invertebrate larvae. Marine Biotechnology, 8(2): 149—160 |
| Hayden H S, Blomster J, Maggs C A et al, 2003. Linnaeus was right all along: Ulva and Enteromorpha are not distinct genera. European Journal of Phycology, 38(3): 277—294 |
| Hiraoka M, Enomoto S, 1998. The induction of reproductive cell formation of Ulva pertusa Kjellman (Ulvales, Ulvophyceae). Phycological Research, 46(3): 199—203 |
| Hiqashi-Okaj K, Otani S, Okai Y, 1999. Potent suppressive effect of a Japanese edible seaweed, Enteromorpha prolifera (Sujiao-nori) on initiation and promotion phases of chemically induced mouse skin tumorigenesis. Cancer Letters, 140(1—2): 21—25 |
| Huo Y Z, Zhang J H, Chen L P et al, 2013. Green algae blooms caused by Ulva prolifera in the southern Yellow Sea: Identification of the original bloom location and evaluation of biological processes occurring during the early northward floating period. Limnology and Oceanography, 58(6): 2206—2218 |
| Liu D Y, KeesingJ K, He P M et al, 2013a. The world’s largest macroalgal bloom in the Yellow Sea, China: Formation and implications. Estuarine Coastal and Shelf Science, 129: 2—10 |
| Liu F, Pang S J, Chopin T et al, 2013b. Understanding the recurrent large-scale green tide in the Yellow Sea: temporal and spatial correlations between multiple geographical, aquacultural and biological factors. Marine Environmental Research, 83: 38—47 |
| Liu F, Pang S J, Xu N et al, 2010. Ulva diversity in the Yellow Sea during the large-scale green algal blooms in 2008-2009. Phycological Research, 58(4): 270—279 |
| Malta E J, Draisma S, Kamermans P, 1999. Free-floating Ulva in the southwest Netherlands: species or morphotypes? A morphological, molecular and ecological comparison. European Journal of Phycology, 34(5): 443—454 |
| Mamatha B S, Namitha K K, Senthil A et al, 2007. Studies on use of Enteromorpha in snack food. Food Chemistry, 101(4): 1707—1713 |
| Nimitphak T, Kiatpathomchai W, Flegel T W, 2008. Shrimp hepatopancreatic parvovirus detection by combining loop-mediated isothermal amplification with a lateral flow dipstick. Journal of Virological Methods, 154(1—2): 56—60 |
| Notomi T, Okayama H, Masubuchi H et al, 2000. Loop-mediated isothermal amplification of DNA. Nucleic Acids Research, 28(12): e63 |
| Puthamibool T, Senapin S, Kiatpathomchai Wet al, 2009. Detection of shrimp infectious myonecrosis virus by reverse transcription loop-mediated isothermal amplification combined with a lateral flow dipstick. Journal of Virological Methods, 156(1—2): 27—31 |
| Raman B V, Rao D N, Radhakrishnan T M, 2004. Enteromorpha compressa (L.) Greville An edible green alga as a source of antiallergic principle (S). Indian Journal of Clinical Biochemistry, 19(1): 105—109 |
| Reddy C R K, Iima M, Fujita Y, 1992. Induction of fast growing and morphologically different strains through intergeneric |
| Schnetzinger F, Pan Y, Nocker A, 2013. Use of propidium monoazide and increased amplicon length reduce false-positive signals in quantitative PCR for bioburden analysis. Applied Microbiology and Biotechnology, 97(5): 2153—2162 |
| Smetacek V, Zingone A, 2013. Green and golden seaweed tides on the rise. Nature, 504(7478): 84—88 |
| Wang J F, Li N, Jiang P et al, 2010. Ulva and Enteromorpha (Ulvaceae, Chlorophyta) from two sides of the Yellow Sea: analysis of nuclear rDNA ITS and plastid rbcL sequence data. Chinese Journal of Oceanology and Limnology, 28(4): 762—768 |
| Xiao J, Li Y, Song W et al, 2013. Discrimination of the common macroalgae (Ulva and Blidingia) in coastal waters of Yellow Sea, northern China, based on restriction fragment-length polymorphism (RFLP) analysis. Harmful Algae, 27: 130—137 |
| Ye N H, Zhang X W, Mao Y Z et al, 2011. ‘Green tides’ are overwhelming the coastline of our blue planet: taking the world’s largest example. Ecological Research, 26(3): 477—485 |
| Yuan J, Mi T Z, Zhen Y et al, 2012. Development of a rapid detection and quantification method of Karenia mikimotoi by real-time quantitative PCR. Harmful Algae, 17: 83—91 |
| Yuan J, Mi T Z, Zhen Y et al, 2012. Development of a rapid detection and quantification method of Karenia mikimotoi by real-time quantitative PCR. Harmful Algae, 17: 83—91 |
| Zhang Q C, Liu Q, Kang Z J et al, 2014. Development of a fluorescence in situ hybridization (FISH) method for rapid detection of Ulva prolifera. Estuarine, Coastal and Shelf Science, doi:10.1016/j.ecss.2014.09.004 |
 2015, Vol. 46
2015, Vol. 46


