
文章信息
- 赵卫红, 陈立侨, 王资生, 张凤英, 齐志涛. 2015.
- ZHAO Wei-Hong, CHEN Li-Qiao, WANG Zi-Sheng, ZHANG Feng-Ying, QI Zhi-Tao. 2015.
- 日本沼虾(Macrobrachium nipponense)组蛋白酶B基因克隆及其在组织和卵巢发育过程中的表达
- GENE CLONE OF CATHEPSIN B IN MACROBRACHIUM NIPPONENSE AND GENE EXPRESSION IN TISSUES AND OVARY IN DIFFERENT DEVELOPMENT STAGES
- 海洋与湖沼, 46(4): 862-869
- Oceanologia et Limnologia Sinica, 46(4): 862-869.
- http://dx.doi.org/10.11693/hyhz20141000283
-
文章历史
- 收稿日期:2014-10-23
- 改回日期:2015-02-28
2. 华东师范大学生命科学学院 上海 200062;
3. 中国水产科学研究院东海水产研究所 上海 200090
2. College of Life Science, East China Normal University, Shanghai 200062, China;
3. East China Sea Fisheries Research Institute, Chinese Academy of Fishery Science, Shanghai 200090, China
溶酶体半胱氨酸组蛋白酶具有广谱的蛋白水解活性,能水解多种动物蛋白和植物蛋白(卢士英等,2004)。人体内目前发现了11种半胱氨酸组蛋白酶: 组蛋白酶B、C、F、H、K、L、O、S、V、X和W(Turk et al,2012)。由于组蛋白酶B(CB)和组蛋白酶L(CL)与哺乳动物和人类癌细胞转移过程有关,因此备受关注。CB和CL能直接溶解或者间接激活细胞外基质如胶原蛋白、层粘连蛋白、基底膜等成分的溶解,从而促进肿瘤细胞向深部组织浸润,为癌细胞的转移打开通道(卢士英等,2004)。CB和CL在鱼类卵黄蛋白的水解过程中的作用亦得到广泛的研究与认可(Sire et al,1994; Carnevali et al,1999; LaFleur et al,2005; Carnevali et al,2006)。甲壳动物等节肢动物的卵子与鱼类卵子一样,含有大量的卵黄蛋白,该蛋白在酶的水解作用后方可为后续胚胎的发育提供营养。越来越多的研究报道表明CB和CL同样参与节肢动物卵黄蛋白的水解,如桑蚕Bombyx mori(Kageyama et al,1990)和软蜱Orithodors moubata(Fagotto,1990a,b)卵巢中发现了对卵黄蛋白具有水解作用的CL类似蛋白的存在,同样蚊子Aedes aegypti体内的CB类似蛋白酶亦参与卵黄蛋白的降解(Cho et al,1999)。有关经济虾类CL基因克隆及其表达研究报道较多。目前CL及其类似物cDNA全长已经从美国龙虾Homarus americanus(Laycock et al,1992)、挪威龙虾Nephrops norvegicus(Le Boulay et al,1995)、凡 纳滨对虾Penaeus vannamei(Le Boulay et al,1996)、刀额新对虾Metapenaeus ensis(Hu et al,2004)、盐水虾Artemia franciscana(Warner et al,2004)和日本沼虾Macrobrachium nipponense(Zhao et al,2013)体内分离获得。但是经济虾类CB基因目前仅有北极甜虾P and alus borealis(Aoki et al,2003)和斑节对虾Penaeusmonodon(EF213113.1,未发表)的相关报道。日本沼虾(M. nipponense)肉味鲜嫩,营养丰富,分布广泛,是我国重要的经济淡水养殖虾。本研究首次克隆了日本沼虾CB(MnCB)基因cDNA全长,并分析其蛋白结构,寻找其活性位点,预测其具有催化活性的结构; 并对其蛋白序列进行同源性和系统进化树的分析,显示MnCB序列和其它物种的关系; 采用荧光定量PCR(qPCR)的方法测定其在各组织及卵巢发育过程中的表达量,初步探讨其在日本沼虾体内的作用及与卵巢发育的关系,为日本沼虾体内该基因的功能研究提供一些基础知识。
1 材料与方法 1.1 组织取样日本沼虾(1.3—2.1 g)购自上海市铜川路水产市场。试验虾从市场购回后,于实验室水族箱中充气暂养一周后解剖,分别取卵巢、肝胰腺、鳃、肌肉、胸神经节、心脏、肠和血细胞等组织和细胞液氮中速冻,-80°C保存用于后续RNA抽提。其中卵巢不同发育阶段分别取样,其它组织均取自卵巢发育Ⅱ期的雌虾。每个组织均取8—12尾虾。卵巢发育分期采用6期法(Wu et al,2009)。
1.2 RNA 的抽提和cDNA的反转RNA采用Unizol试剂按照试剂说明书抽提。取抽提获得的1μLRNA用于凝胶电泳,检测RNA的完整性。取1μLRNA进行紫外分光光度测定OD260/ OD280比值,检测RNA纯度。取0.5μg RNA采用cDNA TaKaRa PrimerScriptTM第一链cDNA合成试剂盒(大连宝生物)合成cDNA。
1.3 采用3'RACE和5'RACE获得基因全长用于5'RACE和3'RACE的cDNA分别采用Smart Race试剂盒(Clontech,Palo Alto,CA,USA)和3'-RACE合成试剂盒(Invitrogen,Carlsbad,CA,USA)按照说明书操作步骤合成。引物AP、AUAP、5'-CDS primer A、SMART II A Oligonucleotide和UPM均由RACE试剂盒提供。3'RACE和5’RACE特异性引物均按照日本沼虾卵巢EST文库中MnCB片段采用primer 5.0软件设计获得。MnCB 3'RACE特异性引物3'MnCBP1,3'RACE巢式引物3'MnCBP2。根据上述获得的3'端片断设定引物3’MnCBP3作为3'RACE特异性引物进行新了一轮3'RACE扩增,获得MnCB的polyA尾巴。MnCB 5'-RACE特异性引物为5'MnCBP1。上述所有特异性引物的序列及其Tm值见表 1。
| 引物 | 序列 | Tm值 |
| 3'MnCBP1 | 5'-ACTGCCCCACCATCAGTGA AAAG-3' | 61°C |
| 3'MnCBP2 | 5'-CCAGGTTTCCCAGGTGCTGCTAA-3' | 62°C |
| 3'MnCBP3 | 5'-GGCTTGGTGGACATGCCATTCCA-3' | 61°C |
| 5'MnCBP1 | 5'-CTAAGCCCCTCC AGATACGATAGG-3' | 62°C |
| qCBF | 5'-GTCAGCAACGGCACAAAGTT-3' | 60°C |
| qCBR | 5'-CTAAGCCCCTCCAGATACCT-3' |
核酸和蛋白序列相似性比较采用NCBI BLAST程序(http://www.ncbi.nlm.nih.gov/)分析,蛋白特性分析采用专业蛋白分析系统Expert Protein Analysis System(http://www.expasy.org/),信号肽和结构域分析分别采用SignalP 3.0程序(http://www.cbs.dtu.dk/ services/SignaIP/)和结构域扫描程序Motif scan program(http://hits.isb-sib.ch/cgi-bin/PFSCAN)分析,同源性分析采用ClusterW多序列比较软件(http:// www.ebi.ac.uk/Tools/clustalw2/index.html)和Boxshade软件(http://www.ch.embnet.org/software/BOX_form.html)进行阴影分析,系统进化树采用Mega软件包中的邻接法(NJ)构建。用于阴影分析和系统进化树构建的基因序列号见表 2。
1.5 实时荧光定量PCR(qPCR)MnCB qPCR引物序列为qCBF和qCBR(表 1),内参基因为β-actin,引物序列来自文献(Zhao et al,2011)。qPCR反应体系: SYBR Premix Ex Taq(2×)10.0 μL,ROX Reference Dye(50×)0.4 μL,cDNA 2.0 μL,10 μmol/L的引物各0.4 μL,ddH20 6.8 μL。反应程序: 95°C预变性1 min,95°C变性5 s,60°C退火40 s,40个循环。
1.6 数据分析MnCB和β-actin的表达量采用标准曲线法计算。标准曲线的制备: 将已知浓度的cDNA稀释成不同浓 度(10-1、10-2、10-3、10-4和10-5),测定不同浓度cDNA的CT值,横坐标为cDNA浓度对数,纵坐标为CT值作图,获得cDNA浓度对数与CT值之间的标准曲线。将未知样品的CT值代入标准曲线,计算出样品的cDNA浓度。MnCB的相对表达量采用MnCB和β-actin表达量的比值表示最终表示为平均值±标准差(Mean±SD)表示,采用One-way ANOVA对日本沼虾各组织中MnCB基因表达量进行统计分析,用Duncan氏多重比较法分析组间差异显著程度,显著水平为P<0.05。
| 物种 | 俗名 | 分类地位 | 登录号 |
| Schistosoma japonicum | 日本血吸虫 | 线虫动物门 | CAA50305.1 |
| P and alus borealis | 北极甜虾 | 节肢动物门 | BAC65419.1 |
| Penaeus monodon | 斑节对虾 | 节肢动物门 | ABQ10737.1 |
| Meretrix meretrix | 文蛤 | 软体动物门 | ACB38229.1 |
| Paralichthys olivaceus | 牙鲆 | 脊椎动物门鱼纲 | ABM47001.1 |
| Hippoglossus hippoglossus | 大西洋庸鲽 | 脊椎动物门鱼纲 | ABJ80691.1 |
| Danio rerio | 斑马鱼 | 脊椎动物门鱼纲 | AAQ97764.1 |
| Salmo salar | 鲑鱼 | 脊椎动物门鱼纲 | NP_001133994.1 |
3’RACE和5’RACE测序结果通过Bioedit软件拼接后获得全长为1643 bp的MnCB,cDNA序列和推导的氨基酸序列见图 1。该序列含有12 bp的5’-UTR,996 bp的ORF和702bp的3’-UTR(序列号: HM134079)。ORF区共编码331个氨基酸,此多肽包含16个氨基酸组成的信号肽、63氨基酸组成的前导肽和252个氨基酸组成的成熟肽三个部分,其理论pI为6.36,分子量为36.5 kDa。
 |
| 图 1 MnCB cDNA及翻译的氨基酸全长 Fig. 1 Complete cDNA sequence and deduced amino acid sequence of MnCB斜体表示信号肽序列,下划线为前导肽,波浪线为成熟肽,方框为活性位点,下划线加粗斜体为加尾信号,双下划线为polyA,星号(*)为终止密码子 |
经多重比较后发现,MnCB与其它不同甲壳动物组蛋白酶B(CB)一样都存在一些保守的结构域(图 2),且一般位于非信号肽序列部分。系统进化树的分析结果(图 3)显示: 牙鲆Paralichthys olivaceus、大西洋庸鲽Hippoglossus hippoglossus、斑马鱼Danio rerio和鲑鱼Salmo salar四种鱼类聚在一起,同为甲壳类的北极甜虾、斑节对虾和日本沼虾聚成一支,软体动物的文蛤Meretrix meretrix和环节动物的日本血吸虫Schistosoma japonicum分别自成一支。
 |
| 图 2 MnCB序列与其它物种组蛋白酶B序列的多重比较 Fig. 2 Alignment of MnCB with other aquatic organisms homologues 阴影部分表示相同的序列,灰色表示保守但不完全相同的序列,空心箭头为活性位点,实心箭头为S2亚位点 |
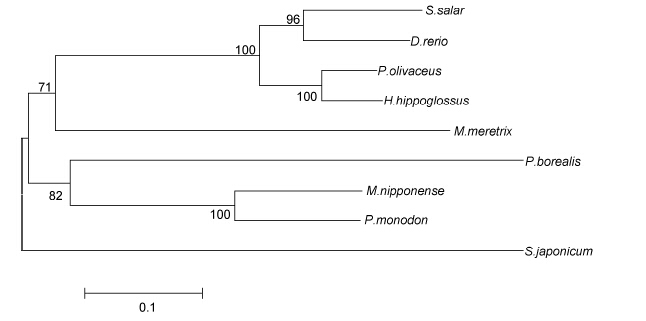 |
| 图 3 MnCB与其它物种的组蛋白酶B的N-J系统发育树 Fig. 3 Neighbor-joining phylogenetic tree of MnCB amino acid sequences from other animals |
内标基因β-actin在各组织的表达量较一致,MnCB基因在测定的各组织中也均有表达,其中在心脏中表达量最高,肌肉、肝胰腺和胸神经节中表达量中等,肠、鳃和血细胞中的表达量较低(图 4)。
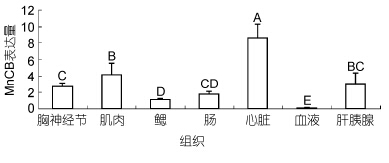 |
| 图 4 日本沼虾不同组织中MnCB基因的相对表达量 Fig. 4 Relative expression level of MnCB mRNA in different tissues of M. nipponense图中字母相同表示表达量差异不显著(P>0.05),不相同表示表达量差异显著(P<0.05),下同 |
不同发育阶段卵巢中MnCB基因表达变化过程见图 5。在卵巢的发育过程中,MnCB的表达量先增后降。从卵原细胞增殖期(Ⅰ期)发育至卵黄发生前期(Ⅱ期),MnCB表达量显著增加,增至Ⅰ期2倍左右,至初级卵黄发生期(Ⅲ期)MnCB的表达量急剧增加,分别为Ⅱ期和Ⅰ期表达量的5倍和10倍左右,差异显著(P<0.05),次级卵黄发生期(Ⅳ期)表达量继续增加,但是Ⅳ期和Ⅲ期的表达量差异不显著(P>0.05),成熟期(V期)下降。产卵后(VI期)、V期和Ⅱ期两两差异均不显著(P>0.05)。
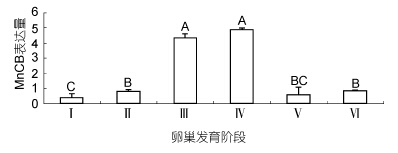 |
| 图 5 日本沼虾卵巢不同发育阶段MnCB mRNA的相对表达量 Fig. 5 Temporal expression profile of the MnCB transcript in the ovary of M. nipponense during ovarian development柱状图上字母相同表示差异不显著(P>0.05),不同表示差异显著(P<0.05) |
多重比较结果显示CB蛋白在进化过程中保守性较强,且这些保守序列主要位于非信号肽部位。通过CB保守序列建立的N-J系统树显示几种鱼类聚为一支、几种甲壳类聚为一支,该结果和传统的分类结果一致。
MnCB氨基酸序列中具有4个活性位点: Gln143、Cys149、Asn288和His309。CB属于C1 家族多肽酶,该家族酶的催化残基为Cys和His形成的二聚体。另外朝向His咪唑环的Asn和位于Cys残基前面的Gln在催化过程中也起非常重要的作用,Gln具有帮助Cys残基在催化过程中形成氧阴离子洞的作用。另外MnCB氨基酸序列中具有6个S2亚位点: Phe152、Pro153、Ala170、Gly274、Ala277和Glu322。S2亚位点是木瓜蛋白酶半胱氨酸蛋白酶的口袋结构,这一结构有利于与大疏水残基或芳香残基结合,而且CB基因口袋结构的底部还具有可以与Arg结合的Glu。
文献报道显示组蛋白酶通常由16—18个氨基酸的信号肽、62—100个氨基酸的前导肽和220—230个氨基酸的成熟肽组成(Berti et al,1995; Lecaille et al,2002)。本研究克隆得到的MnCB亦由信号肽、前导肽和成熟肽三个部分组成,其氨基酸数目分别为16、 63和252,信号肽和前导肽的数量介于上述报道范围之内,成熟肽超过上述范围。这一结果与北极甜虾P. borealis中的报道一致, 北极甜虾组CB的成熟肽为253个氨基酸(Aoki et al,2003)。组蛋白酶合成之初没有活性,以酶原的形式存在,随着pH值的改变,溶酶体减弱前导肽和催化位点之间的连接,改变酶原的构象,使之变成具有活性的酶,H+-ATP酶使卵巢中pH值降低,促进酶原的激活(Fagotto,1995; Kwon et al,2001; Selman et al,2001; Turk et al,2001; Raldúa et al,2006)。
本研究测定日本沼虾MnCB广泛存在于各组织中,其中心脏中表达量最高,胸神经节、肝胰腺和肌肉中的表达量均较高。MnCB在心脏和肌肉中的高表达可能与CB 能降解肌球蛋白、肌钙蛋白、原肌蛋白和肌动蛋白的作用有关(陈磊等,2008)。肝胰腺在甲壳动物体内扮演着极其重要的角色,不仅具有消化吸收的作用,而且具有重要的免疫功能,另外日本沼虾肝胰腺还是卵巢发育的重要营养来源(Zhao et al,2013)。所以肝胰腺中MnCB高表达可能与CB兼有胞内消化和抗原加工的功能有关(卢士英等,2004)。肝胰腺中CB高表达在北极甜虾中也有类似的研究报道(Aoki et al,2003)。另外,同样具有胞内消化作用的CL在美洲龙虾(Laycock et al,1992)和挪威龙虾(Le Boulay et al,1995)肝胰腺中亦高度表达。甲壳动物的胸神经节是重要的神经内分泌器官,可以分泌GSH等性腺刺激激素从而促进卵巢发育(穆淑梅等,2004),而CB具有激素活化的作用(卢士英等,2004),所以日本沼虾胸神经节中MnCB的高表达可能与MnCB活跃激素分泌的功能有关。
甲壳动物的卵黄蛋白原(Vg)按照合成来源可以分为内源性和外源性。卵巢自身合成的为内源性,卵巢以外的组织,如肝胰腺、脂肪体或滤泡细胞中合成的为外源性。外源合成的Vg,通过血液循环运送至卵母细胞,通过膜受体结合后进入卵母细胞中(张士璀等,2002)。Vg在卵母细胞的成熟过程中被分解为脂磷蛋白、高磷蛋白和β’组分等卵黄蛋白(Vn),储存于卵黄颗粒中,Vn进一步水解为氨基酸为胚胎发育提供营养(Finn,2007)。Vg水解为Vn进而水解为氨基酸均需要水解酶的参与。有研究表明CB和CL在甲壳动物该水解过程中发挥着重要的作用(Fagotto,1990a,b; Kageyama et al,1990; Cho et al,1999)。本试验qPCR测定结果显示日本沼虾卵巢中MnCB的表达量与卵巢的发育程度有关,随着卵巢的发育,MnCB表达量逐渐增加,卵巢发育至初级卵黄发生期表达量急剧增加,次级卵黄发生期表达量继续增加,并达到最大值,成熟期下降。这表明MnCB与日本沼虾的Vg或者Vn的水解有关。有研究表明组蛋白酶D(CD)和CB蛋白活性在海鲷Sparus aurata卵黄发生早期最高,且进一步的研究表明CD可以水解Vg,而CB对Vg没有水解作用,另外CL在卵黄发生后期活性最高,为Vn的水解酶(Carnevali et al,1999)。本课题组发现
日本沼虾组蛋白酶L(MnCL)在卵巢发育至次级卵黄发生期,表达量急剧增加并达到最大值(Zhao et al,2013),也就是说,在卵巢发育过程中MnCB基因表达量增加比MnCL早,这和海鲷的研究结果一致(Carnevali et al,1999)。斑马鱼中CB不仅可以直接水解Vn,而且还可以激活CL的活性,促进CL对Vn进行水解(Carnevali et al,2006)。日本沼虾卵巢发育至Ⅲ期MnCB基因表达急剧增加,Ⅳ期MnCL基因急剧增加, 这种先后关系也许暗示着MnCB和MnCL之间的某种关联,也许如斑马鱼中MnCB可以激活MnCL的活性具有某种的激活作用。
| 卢士英, 任洪林, 柳增善等, 2004. 组织蛋白酶B研究进展. 河北师范大学学报(自然科学版), 28(3): 306—309 |
| 张士璀, 孙旭彤, 李红岩, 2002. 卵黄蛋白原研究及其进展. 海洋科学, 26(7): 32—35 |
| 陈 磊, 李学伟, 朱 砺等, 2008. 猪Cathepsin B基因cDNA 分子克隆、序列分析及遗传多态性分析. 畜牧兽医学报, 39(4): 385—392 |
| 穆淑梅, 康现江, 牛建章等, 2004. 甲壳动物卵黄发生及其激素调控研究进展. 海洋科学, 28(6): 66—70 |
| Aoki H, Ahsan M N, Watabe S, 2003. Molecular cloning and characterization of cathepsin B from the hepatopancreas of northern shrimp Pandalus borealis. Comp Biochem Physiol B: Biochem Mol Biol, 134(4): 681—694 |
| Berti P J, Storer A C, 1995. Alignment/phylogeny of the papain superfamily of cysteine proteases. J Mol Biol, 246(2): 273—283 |
| Carnevali O, Carletta R, Cambi A et al, 1999. Yolk formation and degradation during oocyte maturation in seabream Sparus aurata: involvement of two lysosomal proteinases. Biol Reprod, 60(1): 140—146 |
| Carnevali O, Cionna C, Tosti L et al, 2006. Role of cathepsins in ovarian follicle growth and maturation. Gen Comp Endocr, 146(3): 195—203 |
| Carnevali O, Sabbieti M G, Mosconi G et al, 1995. Multihormonal control of vitellogenin mRNA expression in the liver of frog, Rana esculenta. Mol Cell Endocrinol, 114(1—2), 19—25 |
| Cho W-L, Tsao S-S, Hays A R et al, 1999. Mosquito cathepsin B-like protease involved in embryonic degradation of vitellin is produced as a latent extraovarian precursor. J Bio Chem, 274(19): 13311—13321 |
| Fagotto F, 1990a. Yolk degradation in tick eggs: I. Occurrence of a cathepsin L-like acid proteinase in yolk spheres. Arch Insect Biochem Physiol, 14(4): 217—235 |
| Fagotto F, 1990b. Yolk degradation in tick eggs: II. Evidence that cathepsin L-like proteinase is stored as a latent, acid-activable proenzyme. Arch Insect Biochem Physiol, 14(4): 237—252 |
| Fagotto F, 1995. Regulation of yolk degradation, or how to make sleepy lysosomes. J Cell Sci, 108: 3645—3647 |
| Finn R N, 2007. Vertebrate yolk complexes and the functional implications of phosvitins and other subdomains in vitellogenins. Biol Reprod, 76(6): 926—935 |
| Hu K J, Leung P-C, 2004. Shrimp cathepsin L encoded by an intronless gene has predominant expression in hepatopancreas, and occurs in the nucleus of oocyte. Comp Biochem Physiol B: Biochem Mol Biol, 137(1): 21—33 |
| Kageyama T, Takahashi S Y, 1990. Purification and characterization of a cysteine proteinase from silkworm eggs. Eur J Biochem, 193(1): 203—210 |
| Kwon J Y, Prat F, Randall C et al, 2001. Molecular characterization of putative yolk processing enzymes and their expression during oogenesis and embryogenesis in rainbow trout (Oncorhynchus mykiss). Biol Reprod, 65(6): 1701—1709 |
| LaFleur G J Jr, Raldúa D, Fabra M et al, 2005. Derivation of major yolk proteins from parental vitellogenins and alternative processing during oocyte maturation in Fundulus heteroclitus. Biol Reprod, 73(4): 815—824 |
| Laycock M V, Mackay R M, Di Fruscio M et al, 1992. Molecular cloning of three cDNAs that encode cysteine proteinases in the digestive gland of the American lobster (Homarus americanus). FEBS Lett, 292(1—2): 115—120 |
| Le Boulay C, Van Wormhoudt A, Sellos D, 1995. Molecular cloning and sequencing of two cDNAs encoding cathepsin L-related cysteine proteinases in the nervous system and in the stomach of the Norway lobster (Nephrops norvegicus). Comp Biochem Physiol B: Biochem Mol Biol, 111(3): 353—359 |
| Le Boulay C, Van Wormhoudt A, Sellos D, 1996. Cloning and expression of cathepsin L-like proteinases in the hepatopancreas of the shrimp Penaeus vannamei during the intermolt cycle. J Comp Physiol B, 166(5): 310—318 |
| Lecaille F, Kaleta J, Br?mme D, 2002. Human and parasitic papain—like cysteine proteases: their role in physiology and pathology and recent developments in inhibitor design. Chem Rev, 102(12): 4459—4488 |
| Raldúa D, Fabra M, Bozzo M G et al, 2006. Cathepsin B-mediated yolk protein degradation during killifish oocyte maturation is blocked by an H+-ATPase inhibitor: effects on the hydration mechanism. Am J Physiol, Regul Integr Comp Physiol, 290(2): R456—R466 |
| Selman K, Wallace R A, Cerdà J, 2001. Bafilomycin A1 inhibits proteolytic cleavage and hydration but not yolk crystal disassembly or meiosis during maturation of sea bass oocytes. J Exp Zool, 290(3): 265—278 |
| Sire M-F, Babin P J, Vernier J-M, 1994. Involvement of the lysosomal system in yolk protein deposit and degradation during vitellogenesis and embryonic development in trout. J Exp Zool, 269(1): 69—83 |
| Turk V, Stoka V, Vasiljeva O et al, 2012. Cysteine cathepsins: From structure, function and regulation to new frontiers. BBA-Proteins Proteom, 1824(1): 68—88 |
| Turk V, Turk B, Turk D, 2001. Lysosomal cysteine proteases: facts and opportunities. Embo J, 20(17): 4629—4633 |
| Warner A H, Pullumbi E, Amons R et al, 2004. Characterization of a cathepsin L-associated protein in Artemia and its relationship to the FAS-I family of cell adhesion proteins. Eur J Biochem, 271(20): 4014—4025 |
| Wu P, Qi D, Chen L Q et al, 2009. Gene discovery from an ovary cDNA library of oriental river prawn Macrobrachium nipponense by ESTs annotation. Comp Biochem Physiol D, 4(2): 111—120 |
| Zhao W H, Chen L Q, Qin J G et al, 2011. MnHSP90 cDNA characterization and its expression during the ovary development in oriental river prawn, Macrobrachium nipponense. Mol Bio Rep, 38(2): 1399—1406 |
| Zhao W, Chen L, Zhang F et al, 2013. Molecular characterization of cathepsin L cDNA and its expression during oogenesis and embryogenesis in the oriental river prawn Macrobrachium nipponense (Palaemonidae). Genet Mol Res, 12(4): 5215—5225 |
 2015, Vol. 46
2015, Vol. 46


