
文章信息
- 施欧文, 李荣华, 母昌考, 宋微微, 刘长军, 王春琳. 2015.
- SHI Ou-Wen, LI Rong-Hua, MU Chang-Kao, SONG Wei-Wei, LIU Chang-Jun, WANG Chun-Lin. 2015.
- 不同环境因素对三疣梭子蟹“科甬1号”(Portunus trituberculatus)仔蟹蜕壳的影响
- OPTIMAL CONDITIONS FOR PORTUNUS TRITUBERCULATUS “KEYONG 1” MOLTING
- 海洋与湖沼, 46(4): 870-878
- Oceanologia et Limnologia Sinica, 46(4): 870-878.
- http://dx.doi.org/10.11693/hyhz20150200055
-
文章历史
- 收稿日期:2015-02-12
- 改回日期:2015-03-17
2. 浙江海洋高效健康养殖协同创新中心 宁波 315211;
3. 象山县水产养殖技术推广站 象山 315700
2. Collaborative Innovation Center for Zhejiang Marine High-efficiency and Healthy Aquaculture, Ningbo 315211, China;
3. Xiangshan Aquaculture Technology Extension Service, Xiangshan 315700, China
三疣梭子蟹(Portunus trituberculatus)隶属于甲壳纲(Crustacea)、十足目(Decapoda)、梭子蟹科(Portunidae)、梭子蟹属(Portunus),广泛分布于中国、朝鲜、日本等海域(戴爱云等,1986)。因其营养价值高,肉质鲜美,深受人们的喜爱。在我国江苏、山东、浙江等沿海地区都已形成较大的养殖规模。然而,近年来爆发的三疣梭子蟹“溶藻弧菌病”,使其产量遭受巨大损失,严重制约梭子蟹产业健康发展。三疣梭子蟹“科甬1号”是中国科学院海洋研究所与宁波大学共同研发,以生长速度和耐溶藻弧菌存活率为选育目标,通过多年人工选育获得的新品种(崔朝霞等,2014)。因此“科甬1号”的推广研究对梭子蟹产业发展具有重要意义。
蜕壳是三疣梭子蟹得以生长的必经过程,从仔蟹到成蟹,需要历经多次蜕壳。蜕壳过程除了与梭子蟹本身的个体状况有关外,还取决于多方面因素。目前,对蜕壳过程的研究主要从形态学观察、基因水平、饲料营养和环境因素等方面展开: 如对三疣梭子蟹蜕壳周期进行分期(沈洁等,2011),对三疣梭子蟹相关基因在蜕壳周期内的表达量变化进行研究(汪春建等,2013; 邱锡尔等,2014),对三疣梭子蟹仔蟹饲料组分的研究(韩涛等,2013a,b),研究比较野生蟹与养殖蟹在蜕壳过程的差异(Shinozaki-Mendes et al,2014),研究环境因素中盐度对梭子蟹生理变化的影响(路允良,2012)。本论文以环境因素为研究对象,通过模拟不同条件梯度来研究盐度、温度、光照时长、pH和底质五种环境因素对三疣梭子蟹“科甬1号”仔蟹蜕壳的影响,但由于环境条件是一系列复杂因素互作的结果,因此选择温度、盐度和底质三个主要影响因素进行正交实验,并构建仔蟹日存活率和日蜕壳率多元线性回归模型,旨在探究“科甬1号”仔蟹最适环境条件,为新品种提供更多理论依据。
1 材料与方法 1.1 实验材料本实验在浙江宁波鑫亿鲜活水产有限公司进行。所用材料为同一批出苗的三疣梭子蟹“科甬1号”Ⅰ期仔蟹。实验所用的容器为35cm×25cm×20cm的方形塑料盒。实验期间海区平均盐度26.0±0.5,pH8.0±0.5,温度(25±0.5)°C。
1.2 实验预处理实验前,先将“科甬1号”Ⅰ期仔蟹放于苗桶(1m3水体)内暂养24h,充氧,投喂大卤虫(投喂量为体重的100%—200%)。
1.3 单因素实验将“科甬1号”Ⅰ期仔蟹放入方形塑料盒(1L水体)内养殖。采用手持便携式水质分析仪(YSI Professional plus)监测水体各项理化因子。每组实验盒内放入30只健康无伤残的仔蟹,24h充氧,每天换水一次,投喂大卤虫一次。观察各组仔蟹蜕壳所需时间并记录死亡及蜕壳数,实验设置3个重复和对照组(表 1)。
| 因素 | 温度(°C) | 盐度 | 光照(h) | pH | 底质 | |
| 梯度 | 17±0.2 20±0.2 23±0.2 26±0.2 | 10±0.1 15±0.1 25±0.1 35±0.1 | 0 12 24 | 6.0±0.1 7.5±0.1 8.0±0.1 8.5±0.1 10.0±0.1 | 有沙 无沙 | |
| 对照组 | 25±0.5 | 26±0.5 | 12 | 8.0±0.5 | 无沙 |
各单因素实验梯度设置见表 1,其它环境因素同对照组。温度实验在17°C空调房内进行,用吉印100W石英玻璃加热棒加温水体。盐度实验中盐度35海水由海区海水添加海水素配置而成,低盐度海水由海水添加曝气自来水配置而成。光照实验在三个相同避光房间内同步进行,以0L : 24D(0h光照,24h黑暗)模拟黑暗,12L : 12D模拟12h光照,24L : 0D模拟24h光照,光源为30W白炽灯,光照强度200 lx。pH调节采用1mol/L的盐酸溶液和氢氧化钠晶体。底质实验有沙组沙层厚2cm。
1.4 多因素正交实验在单因素实验结果的基础上,选取影响最显著的温度、盐度、底质3个因素进行多因素交互实验。
实验依照正交设计助手II V3.1软件设计的L9(3水平3因素)设计表进行,见表 2。每组实验盒内放入30只健康无伤残的“科甬1号”Ⅰ期仔蟹,24h充氧,每天换水一次,投喂大卤虫一次。观察各组仔蟹蜕壳所需时间并记录死亡及蜕壳数,实验设置3个重复和正常环境对照组(同单因素实验)。其中底质因素设置的半沙实验组为有沙实验组铺沙面积的一半。
| 因素 | 温度(°C) | 盐度 | 底质 |
| 1 2 3 | 20 23 26 | 35 25 15 | 有沙 半沙 无沙 |
观察并记录各单因素、多因素实验组和对照组中三疣梭子蟹“科甬1号”仔蟹存活及蜕壳情况。实验期间,每日8点观察记录存活率(S,%)、蜕壳率(M,%)、蜕壳时间(t,d)(申玉春等,2012),计算方法见表 3。
| 参数 | Ⅰ—Ⅱ期 | Ⅱ—Ⅲ期 | Ⅰ—Ⅲ期 |
| 存活率(S,%) | 100×(N1/N0) | 100×(N2/N1) | 100×(N2/N0) |
| 蜕壳率(M,%) | 100×(N3/N0) | 100×(N4/N3) | |
| 蜕壳时间(t,d) | ∑t1/N3 | ∑t2/N4 | ∑t3/N4 |
N0为实验初始时仔蟹总数(个),N1为到Ⅱ期时仔蟹存活数(个),N2为到Ⅲ期时仔蟹存活数(个),N3为Ⅰ—Ⅱ期内蜕壳总数(个),N4为Ⅱ—Ⅲ期内蜕壳总数(个),t1为Ⅰ期仔蟹蜕壳到Ⅱ期所需时间(d),t2为Ⅱ期仔蟹蜕壳到Ⅲ期所需时间(d),t3为Ⅰ期仔蟹蜕壳到Ⅲ期所需时间(d)。采用SPSS17.0、正交设计助手II V3.1软件进行单因素方差分析及多因素互作分析,以P<0.05作为差异显著水平,描述性统计采用平均值±标准误差表示。
多元线性回归模型是将多个影响因素作为自变量来解释因变量的变化,其模型为:
Yi=β0+β1X1+β2X2+…+βkXk+μ
其中,β0是常数项,β1,β2…βk是回归系数,μ是随机观察误差。根据多因素正交实验数据分析仔蟹日存活率(Yi)与各因素(X1, X2…Xk)之间的关系,构建“科甬1号”仔蟹日存活率多元线性回归模型; 根据实验数据分析仔蟹日蜕壳率(Yi)与各因素(X1, X2…Xk)之间的关系,构建其日蜕壳率多元线性回归模型。多元线性回归模型用MATLAB编程软件完成,显著性水平P<0.05。
2 结果 2.1 单因素实验结果温度影响“科甬1号”仔蟹实验结果见表 4,各组存活仔蟹均蜕壳至Ⅲ期。图 1a是不同温度组仔蟹日存活情况。由图 1a可见仔蟹存活数随实验的进行逐渐减少,其中温度20°C、23°C组的减少趋势较为缓慢,温度17°C组在第3—6天内死亡个数较多,而温度26°C组在整个实验过程中存活率均低于其它各组。图 1b是不同温度组仔蟹日蜕壳情况,其中前半部分为Ⅰ—Ⅱ期,后半部分为Ⅱ—Ⅲ期。由 图 1b可知,Ⅰ—Ⅱ期各组蜕壳起始时间大致相同,都集中在第2—4天,而Ⅱ—Ⅲ期蜕壳起始时间差异明显,26°C组第5天开始蜕壳,而17°C组第10天开始蜕壳。从表 4结果发现,Ⅰ—Ⅱ期,各组存活率与蜕壳率差异均不显著,而蜕壳时间差异显著,温度26°C组所需的蜕壳时间最短,为(2.86±0.09)d; Ⅱ—Ⅲ期,各组存活率和蜕壳率差异不显著,而蜕壳时间存在显著差异,蜕壳时间最短的26°C组为(3.51±0.38)d; 在Ⅰ—Ⅲ期,各组存活率没有显著差异,而蜕壳时间存在显著差异,温度26°C组所需的蜕壳时间最短,为(6.36± 0.55)d,总的蜕壳时间为: 26°C组<23 °C组<20 °C组<17°C组。
| 因素 | 梯度 | Ⅰ—Ⅱ期 | Ⅱ—Ⅲ期 | Ⅰ—Ⅲ期 | |||||
| 存活率(S,%) | 蜕壳率(M,%) | 蜕壳时间(t,d) | 存活率(S,%) | 蜕壳率(M,%) | 蜕壳时间(t,d) | 存活率(S,%) | 蜕壳时间(t,d) | ||
| 温度 | 17°C | 35.55±27.96 | 62.22±9.62 | 3.45±0.07b* | 78.19±23.48 | 37.34±27.90 | 8.36±0.08d* | 24.44±20.09 | 11.81±0.27d* |
| 20°C | 73.33±5.77 | 73.33±5.77 | 4.25±0.42c* | 74.60±7.27 | 77.38±3.15 | 6.38±0.05c* | 54.44±1.93 | 10.62±0.44c* | |
| 23°C | 54.45±13.47 | 54.45±13.47 | 3.65±0.41b* | 62.38±6.60 | 62.38±6.60 | 5.06±0.10b* | 34.44±11.71 | 8.71±0.48b* | |
| 26°C | 54.44±8.39 | 62.22±1.92 | 2.86±0.09a* | 54.39±7.60 | 58.77±7.60 | 3.51±0.38a* | 30.00±8.82 | 6.36±0.55a* | |
| 盐度 | 35 | 47.78±9.62a* | 52.22±1.92a* | 3.17±0.34 | 51.33±18.80 | 44.86±7.97a* | 4.14±0.05 | 23.33±3.34a* | 7.30±0.31a* |
| 25 | 60.00±8.82a* | 61.11±8.39a* | 3.07±0.22 | 59.24±10.45 | 60.02±5.78b* | 4.07±0.21 | 35.56±7.70b* | 7.14±0.17a* | |
| 15 | 58.89±6.94a* | 58.89±6.94a* | 3.52±0.22 | 62.82±7.07 | 64.49±4.38b* | 4.12±0.11 | 36.67±0.00b* | 7.63±0.51a* | |
| 10 | 13.33±8.82b* | 17.78±10.72b* | 3.08±0.14 | 42.06±8.36 | 30.55±4.81c* | 5.03±0.05 | 5.55±3.85c* | 8.11±0.19b* | |
| 光照 | 0h | 61.11±6.94 | 62.22±5.09 | 2.98±0.11 | 59.47±9.22 | 62.12±8.13 | 4.63±0.12 | 36.67±8.82 | 7.61±0.16 |
| 12h | 61.11±5.09 | 61.11±5.09 | 3.07±0.13 | 63.31±5.9 | 64.98±8.75 | 4.01±0.15 | 38.89±6.94 | 7.08±0.19 | |
| 24h | 58.89±3.85 | 61.11±3.85 | 2.93±0.06 | 64.19±5.95 | 63.67±0.89 | 4.54±0.25 | 37.78±3.85 | 7.47±0.49 | |
| pH | 6.0 | 41.11±5.09a* | 52.22±1.92a* | 3.00±0.00 | 54.29±4.17 | 44.72±1.69a* | 3.95±0.19a* | 22.22±1.92a* | 6.95±0.22a* |
| 7.5 | 61.11±5.09a* | 62.22±3.85a* | 2.91±0.08 | 67.82±12.60 | 66.30±9.96b* | 4.64±0.13b* | 41.11±5.09b* | 7.55±0.18b* | |
| 8.0 | 61.11±18.96a* | 61.11±18.96a* | 2.91±0.08 | 69.18±9.81 | 69.18±9.81b* | 4.73±0.07b* | 42.22±13.88b* | 7.64±0.31b* | |
| 8.5 | 72.22±5.09a* | 74.44±8.39a* | 2.91±0.01 | 54.28±9.35 | 53.00±10.82ab* | 4.42±0.04ab* | 38.89±3.85b* | 7.33±0.29ab* | |
| 10.0 | 2.22±1.92b* | 2.22±1.92b* | 3.00±0.00 | 0 | 0 | 0 | 0 | 0 | |
| 底质 | 有沙 | 80.00±3.33a* | 80.00±3.33 | 3.30±0.05a* | 63.74±13.06 | 63.74±13.06 | 4.03±0.06 | 51.11±11.71a* | 7.33±0.12 |
| 无沙 | 54.44±5.09b* | 76.67±5.77 | 2.87±0.04b* | 59.72±8.67 | 43.65±3.44 | 4.13±0.14 | 32.22±1.92b* | 7.00±0.20 | |
| 对照组 | 62.21±2.01 | 62.21±2.01 | 2.99±0.11 | 65.31±5.1 | 66.97±4.75 | 4.04±0.21 | 40.21±0.33 | 7.21±0.05 | |
| 同一列中标有相同字母的表示没有显著性差异(P>0.05) | |||||||||
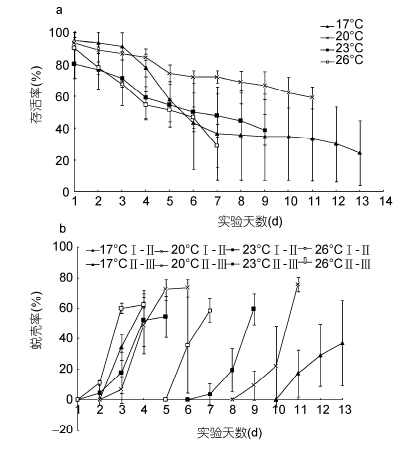 |
| 图 1 不同温度“科甬1号”仔蟹日存活率、日蜕壳率的比较Fig. 1 Comparison in daily survival rate and the daily molting rate for “Keyong 1” in different temperatures a. 日存活率; b. 日蜕壳率 |
盐度影响“科甬1号”仔蟹实验结果见表 4,各组存活仔蟹均蜕壳至Ⅲ期。图 2a是不同盐度组仔蟹日存活情况。由图 2a可知,仔蟹存活数随实验的进行逐渐减少,盐度25组与盐度15组的曲线较为相近,差异不明显,而盐度35组在第一次蜕壳前后个体开始大量死亡,盐度10组在实验前期就已开始大量死亡。图 2b是不同盐度组仔蟹日蜕壳情况,从图 2b可见,Ⅰ—Ⅱ期,盐度10组日蜕壳数远远低于其它组,Ⅱ—Ⅲ期也呈现类似规律。从表 4盐度结果得,Ⅰ—Ⅱ期,盐度35、25、15各组的存活率、蜕壳率及蜕壳时间不存在显著差异,而盐度10组的存活率、蜕壳率显著低于其它各组和对照组,但蜕壳时间差异不明显; Ⅱ—Ⅲ期,蜕壳率存在显著差异,盐度15组高于其它各组,而存活率与蜕壳时间差异不显著; Ⅰ—Ⅲ期,各组存活率和蜕壳时间均存在显著差异,盐度10组存活率远低于其它组,蜕壳时间则长于其它组。
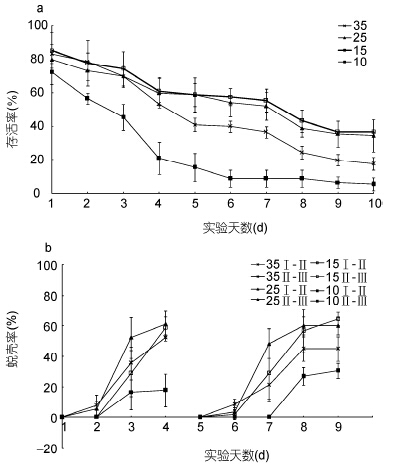 |
| 图 2 不同盐度“科甬1号”仔蟹日存活率、日蜕壳率的比较Fig. 2 Comparison in daily survival rate and the daily molting rate for “Keyong 1” in different salinitiesa. 日存活率; b. 日蜕壳率 |
光照时长影响“科甬1号”仔蟹实验结果见表 4,各组存活仔蟹均蜕壳至Ⅲ期。图 3a是不同光照组仔蟹日存活情况。由图 3a可见,各组日存活曲线相近,随着实验的进行,仔蟹存活数逐渐减少,其中第2—4天和第6—8天最为明显。图 3b是不同光照组仔蟹日蜕壳情况,由图 3b可见,各组蜕壳起始时间和所需的蜕壳时间基本相同。表 4光照实验结果显示,不同时长光照对仔蟹存活率、蜕壳率以及蜕壳时间均无显著影响,各阶段实验组数值较为接近。
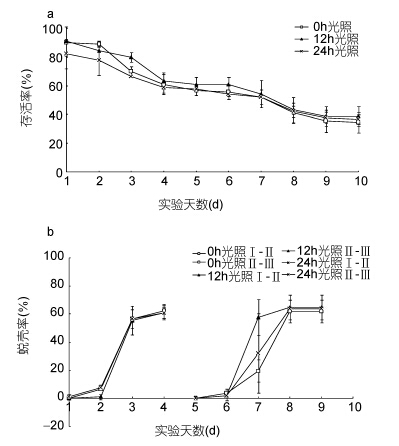 |
| 图 3 不同光照时长的“科甬1号”仔蟹日存活率、日蜕壳率的比较Fig. 3 Comparison in daily survival rate and the daily molting rate for “Keyong 1” in different length of lightinga. 日存活率; b. 日蜕壳率 |
pH影响“科甬1号”仔蟹实验结果见表 4,除pH 10组全部死亡外,各组均有仔蟹蜕壳至Ⅲ期。图 4a是不同pH组仔蟹日存活情况。由图 4a可知,仔蟹存活数随着实验进行逐渐减少。其中pH 7.5、8.0、8.5各组的日存活率曲线接近,而pH 6组在第3天后开始大量死亡,pH 10组在实验初始阶段存活数就大幅度减少,在第3天全部死亡。图 4b是不同pH组仔蟹日蜕壳情况,由图 4b可见,pH 7.5、8.0和8.5各组的日蜕壳曲线相近,蜕壳起始时间和所需的蜕壳时间差异不显著,而pH 6组的蜕壳率则稍低。表 4结果显示,Ⅰ—Ⅱ期,除pH 10组仔蟹全部死亡外,各组的存活率、蜕壳率和蜕壳时间差异不显著; Ⅱ—Ⅲ期,除pH 10组已无存活外,各组的存活率差异不显著,而蜕壳率和蜕壳时间均呈现显著差异,pH 6组蜕壳率低于其它实验组和对照组,蜕壳时间则短于其它组; Ⅰ—Ⅲ期,各组的存活率和蜕壳时间存在显著差异,pH 6组存活率显著低于其它组和对照组,蜕壳时间短于其它组,而pH 7.5、8.0、8.5三个组之间各数据差异不明显,与对照组相近。
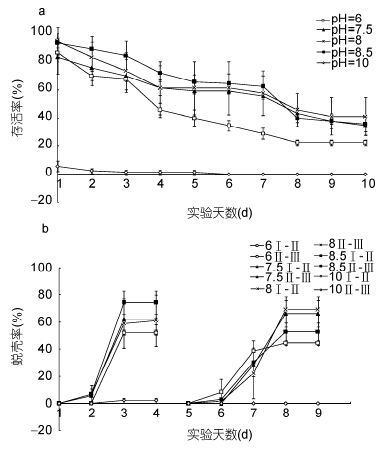 |
| 图 4 不同pH条件下“科甬1号”仔蟹日存活率、日蜕壳率的比较 Fig. 4 Comparison in daily survival rate and daily molting rate for “Keyong 1”in different pH values a. 日存活率; b. 日蜕壳率 |
底质影响“科甬1号”仔蟹实验结果见表 4,各实验组存活仔蟹均蜕壳至Ⅲ期。图 5a是不同底质组仔蟹日存活情况。由图 5a可知,随着实验的进行,仔蟹存活数逐渐减少,但有沙组的减少量明显低于无沙组。图 5b是不同底质组仔蟹日蜕壳情况,由图 5b可见,无沙组在Ⅱ—Ⅲ期的蜕壳率低于有沙组。表 4结果显示,Ⅰ—Ⅱ期,有沙组存活率显著高于无沙组,而无沙组的蜕壳时间显著短于有沙组,蜕壳率差异不显著; Ⅱ—Ⅲ期,各组存活率、蜕壳率及蜕壳时间差异不显著; Ⅰ—Ⅲ期有沙组存活率显著高于无沙组,而蜕壳时间差异不显著。
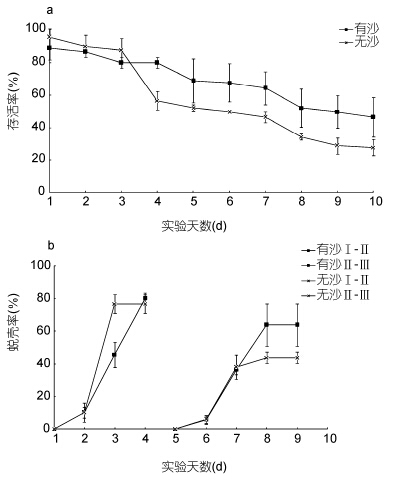 |
| 图 5 不同底质条件下“科甬1号”仔蟹日存活率、日蜕壳率的比较 Fig. 5 Comparison in daily survival rate and the daily molting of “Keyong 1” in different sediment a. 日存活率; b. 日蜕壳率 |
从表 5存活率结果看,温度26°C、盐度25、有沙环境条件下存活率最高。表 6是仔蟹Ⅰ—Ⅲ期存活率方差分析,表 7是仔蟹Ⅰ—Ⅲ期存活率上因素与水平互作分析。实验结果表明,“科甬1号”仔蟹存活率在Ⅰ—Ⅱ、Ⅱ—Ⅲ期各因素均无显著性差异。而在整个实验Ⅰ—Ⅲ期,从表 6得出,温度、盐度因素的影响都达到显著性水平,而底质因素未达到显著性水平。数据结果显示,温度和盐度的极差值(测量值内最大值与最小值之差,用来衡量测量值的波动)相对较高,因此温度和盐度的变化是影响仔蟹存活的重要因素。从表 7中发现,温度与盐度交互,温度26°C条件下的各组存活率高于其它温度组,盐度35条件下的各组存活率低于其它盐度组。底质与温度交互,温度26°C条件下的各组存活率高于其它温度组。底质与盐度交互,盐度35条件下的各组存活率低于其它盐度组。
| 梯度 | Ⅰ—Ⅱ期 | Ⅱ—Ⅲ期 | Ⅰ—Ⅲ期 | |||||
| 存活率(S,%) | 蜕壳率(M,%) | 蜕壳时间(t,d) | 存活率(S,%) | 蜕壳率(M,%) | 蜕壳时间(t,d) | 存活率(S,%) | 蜕壳时间(t,d) | |
| 20°C,35,有沙 | 1.11±1.92 | 27.78±10.72 | 3.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 18.00±0.00 |
| 20°C,25,半沙 | 43.33±5.77 | 74.44±10.18 | 3.06±0.10 | 40.26±24.78 | 26.00±8.68 | 10.33±0.03 | 16.67±8.82 | 13.39±0.13 |
| 20°C,15,无沙 | 17.78±5.09 | 48.89±13.88 | 3.15±0.08 | 36.19±40.54 | 17.04±20.65 | 12.48±0.45 | 6.67±6.67 | 15.63±0.53 |
| 23°C,35,半沙 | 7.78±7.7 | 30.00±11.55 | 3.27±0.03 | 26.67±46.19 | 19.05±32.99 | 6.48±0.00 | 4.44±7.7 | 9.75±0.00 |
| 23°C,25,无沙 | 27.78±12.62 | 38.89±16.44 | 3.25±0.24 | 72.88±8.39 | 53.49±3.57 | 6.33±0.27 | 20.00±8.82 | 9.58±0.51 |
| 23°C,15,有沙 | 42.22±28.35 | 67.78±13.88 | 3.36±0.26 | 62.58±13.13 | 39.29±26.23 | 6.10±0.07 | 28.89±23.41 | 9.46±0.19 |
| 26°C,35,无沙 | 15.56±18.36 | 32.22±18.95 | 3.00±0.00 | 40.91±37.21 | 20.83±26.02 | 4.38±0.53 | 10.00±14.53 | 7.38±0.53 |
| 26°C,25,有沙 | 54.44±10.72 | 77.78±8.39 | 3.00±0.00 | 68.41±9.41 | 47.20±0.91 | 3.97±0.05 | 36.67±3.33 | 6.97±0.05 |
| 26°C,15,半沙 | 52.22±6.94 | 60.00±6.67 | 3.02±0.04 | 64.44±17.11 | 56.71±18.06 | 4.26±0.12 | 34.44±13.88 | 7.28±0.15 |
| 因素 | 偏差平方和 | 自由度 | F比 | F临界值 | 显著性 |
| 温度 | 0.054 | 2 | 54 | 19 | * |
| 盐度 | 0.075 | 2 | 75 | 19 | * |
| 底质 | 0.014 | 2 | 14 | 19 | |
| 误差 | 0 | 2 |
| 盐度 | 温度(°C) | 底质 | 温度°C | 底质 | 盐度 | ||||||
| 20 | 23 | 26 | 20 | 23 | 26 | 35 | 25 | 15 | |||
| 35 | 0.00 | 4.44 | 10.00 | 有沙 | 0 | 28.89 | 36.67 | 有沙 | 0.00 | 36.67 | 28.89 |
| 25 | 16.67 | 20.00 | 36.67 | 半沙 | 16.67 | 4.44 | 34.44 | 半沙 | 4.44 | 16.67 | 34.44 |
| 15 | 6.67 | 28.89 | 34.44 | 无沙 | 6.67 | 20.00 | 10.00 | 无沙 | 10.00 | 20.00 | 6.67 |
实验结果表明,“科甬1号”仔蟹蜕壳率在Ⅰ—Ⅱ、Ⅱ—Ⅲ期各因素均无显著性差异,温度、盐度和底质因素的影响均未达到显著性水平。
2.2.3 多因素对蜕壳时间的影响表 5结果显示,温度26°C、盐度25、有沙环境实验组蜕壳所需时间最短。表 8是仔蟹Ⅰ—Ⅲ期蜕壳时间的方差分析,表 9是仔蟹Ⅰ—Ⅲ期蜕壳时间上因素与水平互作分析。在实验过程中,由于实验组一(20°C,35,有沙)在整个实验周期18d内已无存活仔蟹,因此,该组蜕壳时间数据以整个实验周期天数计量。实验结果显示,在整个实验过程Ⅰ—Ⅲ期,温度极差值最高,因此温度的变化是影响“科甬1号”仔蟹蜕壳所需时间最重要因素。从表 8可知,< span style='font-family:方正书宋简体; letter-spacing:.1pt'>在蜕壳时间上,温度因素的影响达到了显著性水平,而盐度与底质因素均未达到显著性水平。从表 9可知,温度与盐度互作,温度26°C条件下各组的蜕壳时间显著短于其它温度组,盐度35条件下的各组蜕壳时间略微长于其它盐度组。温度与底质互作,温度26°C条件下各组的蜕壳时间显著短于其它温度组。盐度与底质互作,各组所需的蜕壳时间趋势不明显。
| 因素 | 偏差平方和 | 自由度 | F比 | F临界值 | 显著性 |
| 温度 | 114.25 | 2 | 31.9 | 19 | * |
| 盐度 | 4.495 | 2 | 1.26 | 19 | |
| 底质 | 2.686 | 2 | 0.75 | 19 | |
| 误差 | 3.58 | 2 |
| 盐度 | 温度(°C) | 底质 | 温度(°C) | 底质 | 盐度 | ||||||
| 20 | 23 | 26 | 20 | 23 | 26 | 35 | 25 | 15 | |||
| 35 | 18 | 9.75 | 7.38 | 有沙 | 18 | 9.46 | 6.97 | 有沙 | 18 | 6.97 | 9.46 |
| 25 | 13.39 | 9.58 | 6.97 | 半沙 | 13.39 | 9.75 | 7.28 | 半沙 | 9.75 | 13.39 | 7.28 |
| 15 | 15.63 | 9.46 | 7.28 | 无沙 | 15.63 | 9.58 | 7.38 | 无沙 | 7.38 | 9.58 | 15.63 |
通过多因素正交实验数据构建三疣梭子蟹“科甬1号”仔蟹日存活率多元线性回归模型,利用MATLAB的regress命令进行线性回归,得到各系数回归值和置信区间(表 10)。
| 系数 | 回归值 | 置信下限 | 置信上限 |
| a | -10.8369 | -40.2082 | 18.53437 |
| b | 0.217564 | -0.42216 | 0.857289 |
| c | 6.202238 | 3.448987 | 8.955489 |
| d | -0.14814 | -0.20307 | -0.09322 |
| e | 8.199776 | 1.67173 | 14.72782 |
| f | -5.84602 | -6.53124 | -5.16081 |
| g | 155.811 | -180.03 | 491.6516 |
存活率(S)受到温度(T)、盐度(S1)、底质(S2)和时间(D)的影响:
S=-10.8369T+0.217564T2+6.202238S1-0.14814S12+
8.199776S2-5.84602D+155.811
通过检验得到拟合系数R2为0.78,显著性P=0.00。说明此模型符合仔蟹日存活实验结果。
通过实验数据构建“科甬1号”仔蟹日蜕壳率多元线性回归模型,利用MATLAB的regress命令进行线性回归,得到各系数回归值和置信区间(表 11):
| 系数 | 回归值 | 置信下限 | 置信上限 |
| a1 | -35.5655 | -81.6316 | 10.50062 |
| b1 | 0.873932 | -0.12406 | 1.871928 |
| c1 | 11.91126 | 7.299646 | 16.52288 |
| d1 | -0.26569 | -0.35883 | -0.17254 |
| e1 | 28.29724 | 16.80759 | 39.78689 |
| f1 | 3.664283 | 2.504242 | 4.824325 |
| g1 | 260.2703 | -270.449 | 790.9896 |
蜕壳率(M)受到温度(T1)、盐度(S3)、底质(S4)和时间(D1)的影响:
M=-35.5655T1+0.873932T12+11.91126S3-0.26569S32+28.29724S4+3.664283D1+260.2703
通过检验得到拟合系数R2为0.80,显著性P=0.00。说明此模型符合仔蟹日蜕壳实验结果。
3 讨论三疣梭子蟹仔蟹对温度的耐受性范围较广,在5—35°C之间均能正常存活,而0°C和40°C为其存活的极限(廖永岩等,2008),同时温度对其蜕壳具有重要影响(戴超,2013)。本研究表明,当温度在一定范围内变化时,低温更有利于三疣梭子蟹“科甬1号”仔蟹的存活。戴爱云等(1977)曾报道三疣梭子蟹特别集中于渤海湾,薛俊增等(1997)报道的渤海地区梭子蟹分布于渤海湾与莱州湾、东海地区梭子蟹分布北至黄海、南至闽中地区。这些地区属于暖温带和亚热带,说明其适宜在温带海域生活。而温度越高(本实验所设置的温度范围17—26°C),蜕壳起始时间越早,所需的蜕壳时间越短。这可能是由于高温条件下,仔蟹活动频繁,摄食量增多,能量代谢旺盛所致,这与戴超等(2013)的实验结果相同,高温条件下的能量代谢酶活力明显高于低温条件。很多研究也表明,在虾蟹类生存环境中,高温促进其摄食量增多,耗氧量和排氨率增加(Zou et al,1995),而低温则会降低其耗氧量和排氨率(董双林等,1994a,b)。与此同时,在实验过程中,发现高温组仔蟹存在断肢断腿现象,这可能是由于温度升高导致活动加剧,仔蟹为争夺食物、生境而进行竞争的结果。因此,综合分析得到三疣梭子蟹“科甬1号”仔蟹适宜的存活温度20—23°C。
三疣梭子蟹也是一类广盐性品种,低盐和高盐环境均能存活,其盐度的适应范围在15—35(路允良等,2012)。本研究中,日存活曲线在蜕壳前后下降明显,说明蜕壳成功与否是决定“科甬1号”仔蟹存活率的关键因素之一。而各组中,盐度10组存活率和蜕壳率都远低于其它组,说明盐度10已是其耐受极限,这也与王冲等(2010)研究报道的适宜盐度较为一致。而高盐度35组的存活率低于25和15实验组,说明盐度35已不适合仔蟹存活。这一现象可能与甲壳动物渗透压调节机制有关(吕慧明等,2009)。不同盐度环境下,梭子蟹用于渗透压调节的能量代谢存在差异。结果表明,“科甬1号”仔蟹适宜的存活盐度应控制在15—25。
光照对甲壳动物的生长和蜕壳具有重要作用。通过改变光照强度,南美白对虾增重明显(Guo et al,2012); 不同光照周期对青蟹溞状幼体蜕壳和生长的影响显著(张胜负,2011)。本研究表明,不同光照周期对三疣梭子蟹“科甬1号”仔蟹存活和蜕壳的影响不显著(P>0.05)。这与其它研究结果不一致,可能是由于实验仔蟹仍处于一定发育阶段,对光照敏感程度较低,也可能是由于新品种差异造成,有待进一步研究。
pH主要通过影响甲壳类体液中的离子平衡,进而影响甲壳类蜕壳发育(董双林等,1994a,b)。本研究显示,三疣梭子蟹“科甬1号”仔蟹适宜的pH为7.5—8.5。该结果与赵晓红等(2001)报道的中华绒螯蟹适宜的pH范围相似。当pH为10时,仔蟹在第3天全部死亡; 而当pH降低到6时,仔蟹存活率和蜕壳率显著高于pH为10的实验组。说明pH为10已是“科甬1号”仔蟹耐受上限,而下限应低于6。
底质环境的作用主要是蟹类蜕壳后用作躲避同类残杀的屏障,这能大大提高其存活率(徐建荣等,2006)。本研究表明,在有沙条件下,仔蟹的存活率明显高于无沙条件。因此,底质铺沙对提高“科甬1号”仔蟹的存活具有重要作用。
综上所述,得到单因素条件下三疣梭子蟹“科甬1号”仔蟹最佳环境条件: 盐度15—25、温度20— 23°C、正常周期光照、pH 7.5—8.5,有沙环境中。
正交设计实验可以用较少的实验次数观察更多实验因素及水平对实验结果的影响(王钦德等,2003)。同时通过正交实验构建多元线性回归模型(兰军等,2008),更能深入分析环境因素对“科甬1号”仔蟹存活及蜕壳的影响。实验结果表明,在仔蟹Ⅰ—Ⅱ期、Ⅱ—Ⅲ期,无论是存活率、蜕壳率还是蜕壳时间,各因素都没有显著性差异(P>0.05)。而整个实验过程Ⅰ—Ⅲ期内,存活率结果表明,温度越高,存活率越高。这一结果与“科甬1号”仔蟹单因素实验结果存在差异。这可能是&l t;/ span>其它环境因素互作造成: 多因素实验中,高温组铺沙; 而在单因素中,高温环境未铺沙。虽然方差分析显示底质因素未达到显著性水平,但从结果来看,在相对较高的温度条件下,铺沙能提高仔蟹的存活率。比较各阶段存活率、蜕壳率及蜕壳时间数据结果发现,适宜的温度和盐度对仔蟹存活生长至关重要。因此,得到三疣梭子蟹“科甬1号”仔蟹最适蜕壳生长环境为: 温度26°C、盐度25、有沙环境条件。此外,通过构建的日存活率和日蜕壳率多元线性回归模型也再次证明,“科甬1< /span>号”的培育既要注意各环境因素的影响,也要考虑其协同作用,从而选择符合其生长的环境条件。
| 王 冲, 姜令绪, 王仁杰等, 2010. 盐度骤变和渐变对三疣梭子蟹幼蟹发育和摄食的影响. 水产科学, 29(9): 510—514 |
| 王钦德, 杨 坚, 2003. 食品试验设计与统计分析. 北京: 中国农业大学出版社 |
| 申玉春, 陈作洲, 刘 丽等, 2012. 盐度和营养对凡纳滨对虾蜕壳和生长的影响. 水产学报, 36(2): 290—299 |
| 兰 军, 吴贤熙, 周 梅等, 2008. 赤泥沉降分离数据模型建立的新方法——多元正交回归法. 化学工程与装备, (6): 1—7 |
| 吕慧明, 徐善良, 2009. 虾蟹能量收支的特点及其影响因素. 水产科学, 28(10): 604—608 |
| 邱锡尔, 朱冬发, 崔晓雨等, 2014. 三疣梭子蟹HMGR基因的克隆及其在蜕皮中的表达分析. 海洋与湖沼, 45(6): 1192—1201 |
| 汪春建, 朱冬发, 亓一舟等, 2013. 三疣梭子蟹蜕皮周期中MIH基因mRNA水平与蜕皮激素浓度变化. 水生生物学报, 37(1): 22—28 |
| 沈 洁, 朱冬发, 胡则辉等, 2011. 三疣梭子蟹蜕皮周期的分期. 水产学报, 35(10): 1481—1487 |
| 张胜负, 2011. 光照对拟穴青蟹幼体生长发育的影响. 上海: 上海海洋大学硕士学位论文 |
| 赵晓红, 金送笛, 2001. 低温、降盐度及pH对中华绒螯蟹幼体变态的影响. 大连水产学院学报, 16(4): 249—256 |
| 徐建荣, 沈颂东, 张加梅等, 2006. 环境条件对中华绒螯蟹大眼幼体蜕壳生长的影响. 水产科学, 25(10): 505—508 |
| 崔朝霞, 王春琳, 刘 媛等, 2014. 三疣梭子蟹“科甬1号”. 中国水产, (7): 43—48 |
| 董双林, 堵南山, 1994a. 日本沼虾生理生态学研究Ⅰ. 温度和体重对其代谢的影响. 海洋与湖沼, 25(3): 233—237 |
| 董双林, 堵南山, 1994b. pH值和Ca2+浓度对日本沼虾生长和能量收支的影响. 水产学报, 18(2): 118—123 |
| 韩 涛, 王骥腾, 胡水鑫等, 2013a. 饲料脂肪水平对三疣梭子蟹(Portunus trituberculatus)幼蟹生长及体组成的影响. 海洋与湖沼, 44(5): 1276—1281 |
| 韩 涛, 王骥腾, 胡水鑫等, 2013b. 三疣梭子蟹(Portunus trituberculatus)幼蟹饲料中胆固醇的适宜添加量研究. 海洋与湖沼, 44(6): 1524—1529 |
| 路允良, 2012. 盐度对三疣梭子蟹(Portunus trituberculatus)生理生态学特征影响的初步研究. 青岛: 中国海洋大学硕士学位论文 |
| 路允良, 王 芳, 赵卓英等, 2012. 盐度对三疣梭子蟹生长、蜕壳及能量利用的影响. 中国水产科学, 19(2): 237—245 |
| 廖永岩, 肖展鹏, 袁耀阳, 2008. 三疣梭子蟹幼体和幼蟹的温度适应性. 水生生物学报, 32(4): 534—543 |
| 薛俊增, 堵南山, 赖 伟等, 1997. 中国三疣梭子蟹Portunus trituberculatus Miers的研究. 东海海洋, 15(4): 60—65 |
| 戴 超, 2013. 温度对三疣梭子蟹蜕壳、钙化生理及呼吸代谢的影响. 青岛: 中国海洋大学硕士学位论文 |
| 戴 超, 王 芳, 房子恒等, 2013. 温度对蜕壳后期三疣梭子蟹能量代谢酶活力的影响. 水产学报, 37(9): 1334—1341 |
| 戴爱云, 冯钟琪, 宋玉枝等, 1977. 三疣梭子蟹渔业生物学的初步调查. 动物学杂志, (2): 30—33 |
| 戴爱云, 杨思琼, 宋玉枝等, 1986. 中国海洋蟹类. 北京: 海洋出版社 |
| Guo B, Mu Y C, Wang F et al, 2012. Effect of periodic light color change on the molting frequency and growth of Litopenaeus vannamei. Aquaculture, 362—363: 67—71 |
| Shinozaki-Mendes R A, Manghi R F, Lessa R, 2014. Comparative study of the molting cycle of wild and reared swimming crabs Callinectes danae (Crustacea: Portunidae). Journal of Applied Ichthyology, 30(3): 502—506 |
| Zou E M, Du N S, Lai W, 1995. The effects of mass temperature and thermal acclimation on the respiration rate of the Chinese freshwater crab Eriocheir sinensis (Crustacea: Decapod). Zoological Research, 16(1): 49—58 |
 2015, Vol. 46
2015, Vol. 46


