中国海洋湖沼学会主办。
文章信息
- 于文超, 何成, 武长路, 王娇, 李壮, 郭婷, 李永川, 王晓通. 2015.
- YU Wen-Chao, HE Cheng, WU Chang-Lu, WANG Jiao, LI Zhuang, GUO Ting, LI Yong-Chuan, WANG Xiao-Tong. 2015.
- 长牡蛎(Crassostrea gigas)贝壳与外套膜中黑色素的提取和鉴定
- EXTRACTION AND IDENTIFICATION OF MELANIN IN SHELL AND MANTLE OF PACIFIC OYSTER CRASSOSTREA GIGAS
- 海洋与湖沼, 46(4): 909-914
- Oceanologia et Limnologia Sinica, 46(4): 909-914.
- http://dx.doi.org/10.11693/hyhz20150300065
-
文章历史
- 收稿日期:2015-03-02
- 改回日期:2015-04-10
黑色素(melanin)是一种生物多聚体,是生物色素中分布范围最广的色素之一(Kollosa et al,1991),一般呈黑色或棕褐色,广泛存在于动植物中,是一种难溶于水、酸及有机溶剂的生物大分子(Bassam et al,2002)。随着对天然黑色素的深入研究,人们发现,黑色素有广泛的生物活性,包括延缓衰老、调节免疫力、保护光照损伤、抗氧化,清除自由基、保护心血管功能等,在食品加工、化妆品开发、疾病预防治疗等方面都具有广阔的应用前景,天然黑色素资源开发是当前研究的一大热点。目前人们对细菌(Aghajanyan et al,2005; Yuan et al,2007)、海绵(Araujo et al,2012)、乌鸡(Gallus gallus)肉(Chen et al,2008; Tu et al,2009)、鸟类羽毛中(Swan,1974)的黑色素都有一定程度的研究与开发。酪氨酸酶是一种75kDa含铜酶,广泛存在于微生物、动植物及人体中,是黑色素合成的关键酶(Chang,2009),作者曾发现牡蛎基因组中的酪氨酸酶基因在外套膜的表达量远远高于其它器官,说明外套膜在黑色素形成的过程中发挥着重要作用(Zhang et al,2012),而根据作者观察,发现牡蛎外套膜边缘着色而皮质部不着色,色素在软体部的沉积主要集中在外套膜边缘。
目前,国际上对贝类黑色素的研究尚未见报道,但对贝类其它色素的研究已有一定成果,如闭壳肌中高胡萝卜素含量的扇贝新品种的培育(Li et al,2010; Zheng et al,2010)已有报道,黑色素具有与胡萝卜素类似的抗氧化、抗衰老作用(Lu et al,2014; Vrolijk et al,2015),黑色素含量高的牡蛎新品种也是好的研究方向。牡蛎黑色素虽然没有见到正式报道,但对牡蛎壳色的研究已经有了一些进展。有学者发现长牡蛎左壳黑壳组、左壳白壳组和对照组在不同生长阶段存活率的差异均不显著,并推测左壳的白色对黑色具有显性效应(王庆志,2011)。近来,韩国学者Kang等(2013)研究了长牡蛎贝壳颜色与外套膜颜色之间的关系,发现在F0代、F1代、F2代,贝壳颜色与外套膜边缘颜色之间的相关系数分别为0.25、0.74、0.92,他们认为长牡蛎的贝壳和外套膜边缘颜色是可以遗传的,并且长牡蛎贝壳着色与外套膜边缘着色可能是同一个生理学过程(Kang et al,2013)。壳色育种可以在提高贝类保健功能的同时兼顾美观,从而增加经济贝类的附加值,产业需求迫切。黑壳牡蛎是本课题组经过多年选育而得到的左右壳和左右外套膜颜色均是黑色的长牡蛎新品系,但在牡蛎研究领域,还没有实验来证明黑壳牡蛎贝壳和外套膜中的黑色物质就是黑色素。本实验计划提取黑壳牡蛎贝壳和外套膜中的黑色物质并进行鉴定,希望可以确定黑色素的存在与否,从而为黑壳牡蛎是否具有保健价值提供基本依据。
1 材料与方法 1.1 实验样品
本实验所用长牡蛎,来源于本课题组自行选育的黑壳牡蛎群体,养殖于蓬莱宗哲养殖有限公司,壳高为10cm左右,总数60只。
1.2 实验仪器与试剂=紫外分光光度计、电子密度天平、电热恒温水浴锅、电热恒温鼓风干燥箱、索氏提取器、研钵、烧杯、三角烧瓶、玻璃棒等。所用实验试剂包括盐酸、氢氧化钠、乙醚、蒸馏水等。
1.3 长牡蛎贝壳中黑色素的提取 1.3.1 原料的处理用牡蛎刀将鲜活的牡蛎撬开,将牡蛎肉剥离下来作为其它实验备用。将牡蛎壳上的杂质以及牡蛎肉清理干净,贝类清洗干净后烘干,以方便研磨和提取。
1.3.2 粉碎先用锤子将牡蛎壳敲成为碎片,再用研钵研磨成精细的粉状,减小与盐酸混合时的损失和方便提取。
1.3.3 溶解称量牡蛎壳粉末50 g置于1000 mL的三角烧瓶中,将200 mL的盐酸(6 mol/L)缓慢倒入烧瓶中,边倒边用玻璃棒搅拌,以防盐酸与碳酸钙发生反应后溶液溢出,减小损失。
1.3.4 水浴将浸泡过壳粉200 mL盐酸溶液弃去,将残渣放入500 mL圆底烧瓶中再加6 mol/L盐酸溶液400 mL,装上冷凝管于100°C的水浴中加热1 h。水浴的作用是使反应受热均匀,防止溶液沸腾。盐酸属于易挥发的液体,因此使用冷凝管可以避免反应物损耗和充分利用原料。
1.3.5 抽滤加热完毕后,待冷却后,将圆底烧瓶内的牡蛎壳用布氏漏斗抽滤,弃去滤液,保留滤渣,得到黑色素的粗制品。
1.3.6 脱脂将滤渣用滤纸包好,置于索氏脂肪提取器中,用乙醚在42°C左右的水浴中脱脂,待索氏管中乙醚呈现出澄清状态后,脱脂结束,再将滤纸包取出,在抽滤装置上用蒸馏水反复洗涤多次。
1.3.7 干燥最后在80°C恒温干燥箱中烘干,取出黑色固体物质。
1.4 牡蛎外套膜中黑色素的提取 1.4.1 组织匀浆的制备用牡蛎刀将牡蛎撬开,用剪刀剪取外套膜边缘颜色较深的部分,然后放在碾钵中捣碎。
1.4.2 水解称量处理好的牡蛎外套膜大约10 g置于三角烧瓶中,用6 mol/L盐酸溶液200 mL浸泡12 h。
1.4.3 水浴将浸泡过牡蛎外套膜的200 mL盐酸溶液弃去,将残渣放入500 mL圆底烧瓶中再加6 mol/L盐酸溶液400 mL,装上冷凝管于100°C的水浴中加热1h。
1.4.4 抽滤加热完毕后,将圆底烧瓶内的牡蛎外套膜用布氏漏斗抽滤,弃去滤液,保留滤渣。
1.4.5 去脂将滤渣用滤纸包好,置于索氏脂肪提取器中,用乙醚在42°C左右的水浴中脱脂,待索氏管中乙醚呈现出澄清状态后,脱脂结束,再将滤纸包取出,在抽滤装置上用蒸馏水反复洗涤多次。
1.4.6 干燥最后在80°C恒温干燥箱中烘干,取出黑色固体物质。
1.5 长牡蛎黑色素的鉴定将贝壳和外套膜中提取的6份黑色固体物质各取0.1 g,溶解在1 mL的0.01 mL/L氢氧化钠水溶液中,并用同样的氢氧化钠水溶液作为对照,在150— 500nm的范围内进行紫外光谱扫描,吸收曲线使用Origin软件制作。
2 结果 2.1 长牡蛎贝壳中和外套膜中黑色物质的外部形态从贝壳和外套膜中提取的黑色固体物质均为褐黑色,呈粉末状,偶有颗粒状,外部形态十分相似,但可以看出从外套膜中提取到的黑色固体物质的颜色要比从贝壳中提取到的深一些(图 1)。
 |
| 图 1 从牡蛎贝壳和外套膜中提取的黑色素 Fig. 1 The melanin samples extracted from the shell and mantle of Pacific oyster 左边是从贝壳中提取的黑色素,右边是从外套膜中提取的黑色素 |
如图 2中所示,s1、s2、s3分别表示3份贝壳中提取的黑色物质样品,经过150—500 nm的紫外光谱扫描,这3份样品最大的吸收峰分别在212 nm、211 nm、211 nm处(吸光值分别为0.625,0.774,0.839),与报道的不同来源的黑色素的最大吸收波长在210 nm左右一致(付湘晋,2005),从最大吸收波长开始,随着波长逐渐增加,吸光度呈逐渐下降的趋势,是典型的黑色素紫外吸收图谱(Selvakumar et al,2008)。
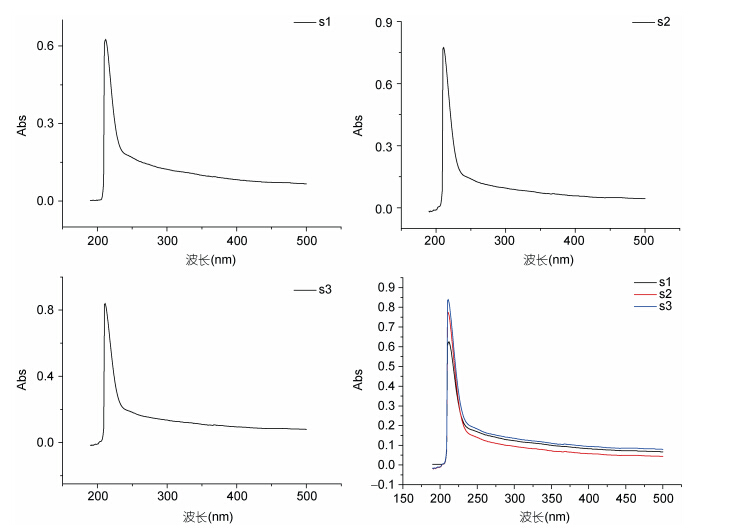 |
| 图 2 牡蛎贝壳中黑色素的紫外扫描图 Fig. 2 UV absorption spectra: black pigment in the shell of oysters Abs表示紫外吸收值,Wav表示波长,s1、s2、s3分别表示3份贝壳中提取的黑色物质样品 |
如图 3中所示,m1、m2、m3分别表示3份外套膜中提取的黑色物质样品,经过150—500 nm的紫外光谱扫描,这3份样品最大的吸收峰均在210 nm处(吸光值分别为1.586、0.74、1.867),与报道的不同来源的黑色素最大吸收波长在210 nm左右一致(付湘晋,2005),从最大吸收波长开始,随着波长逐渐增加,吸光度呈现逐渐下降的趋势,是典型的黑色素紫外吸收图谱(Selvakumar et al,2008)。
 |
| 图 3 牡蛎外套膜中黑色素的紫外扫描图 Fig. 3 UV absorption spectra: black pigment in the coat film of oysters Abs表示紫外吸收值,Wav表示波长,m1、m2、m3分别表示3份外套膜中提取的黑色物质样品 |
从图 4可以看出,贝壳中(s1,s2,s3)与外套膜中(m1,m2,m3)黑色物质的紫外吸收光谱非常相似,最大紫外吸收波长都位于210 nm左右,最大吸收波长之前和之后的紫外吸收值的变化趋势也基本一致,均具有黑色素紫外吸收光谱的特征。值得注意的是,贝壳中黑色物质的紫外吸收值普遍小于外套膜中黑色物质的紫外吸收值。
 |
| 图 4 牡蛎贝壳和外套膜中黑色素的紫外扫描图 Fig. 4 UV absorption spectra: black pigment in the shell and the coat film of oysters Abs表示紫外吸收值,Wav表示波长,s1、s2、s3分别表示3份贝壳中提取的黑色物质样品,m1、m2、m3分别表示3份外套膜中提取的黑色物质样品 |
天然黑色素在贝壳内或外套膜内会与蛋白质、多糖紧密结合,不易分离,同时黑色素不溶于酸性溶液,牡蛎壳中含有大量的碳酸钙和少量的有机物质。盐酸可以与贝壳中的碳酸钙发生化学反应生成氯化钙、水和大量气体二氧化碳,盐酸的水解作用也可以去除与黑色素结合的蛋白质、碳水化合物以及脂类物质,效果优于其它种类的酸(Kimura et al,2014),所以本实验利用盐酸既可以溶解贝壳又可以水解其它有机物质,将黑色素从贝壳或者外套膜中分离出来,实验结果也证明这样做的效果良好。由于黑色素不溶于水、酸溶液、盐溶液和大部分有机溶剂(Bassam et al,2002; de Cássia et al,2005; Selvakumar et al,2008),故将黑色素溶解在0.01mL/L氢氧化钠溶液中进行紫外光谱扫描,发现0.01mL/L氢氧化钠溶液可以很好地溶解牡蛎黑色素固体。
虽然未见到对贝类黑色素提取和鉴定的报道,但贝类其它色素的提取和利用已有一定的研究成果,如扇贝贝壳和闭壳肌中类胡萝卜素的提取和鉴定已有报道(Li et al,2010; Zheng et al,2010,2014),并且育成了贝壳、外套膜、闭壳肌色泽金黄的虾夷扇贝和华贵栉孔扇贝新品(种)系。黑色素具有抗氧化、抗衰老的作用(Lu et al,2014),与胡萝卜素的生理作用(Vrolijk et al,2015)相似,本研究对牡蛎黑色素成功的进行了提取、鉴定,为贝类色素的研究和具保健价值贝类新品种的选育开拓了新的思路。通过对长牡蛎中黑色素的研究,拓宽了黑色素研究的物种范围,也可以为不同物种黑色素形成机制比较(Sharma et al,2002; Dubey et al,2014; Mustapha et al,2015)等理论研究提供资料。
贝壳与外套膜中黑色物质紫外光谱的变化趋势基本相同并都符合黑色素紫外吸收光谱特征,说明贝壳与外套膜中的黑色物质均为黑色素。此外,作者发现贝壳中的吸收值普遍小于外套膜中的吸收值,说明外套膜中提取的黑色素纯度比牡蛎贝壳中的黑色素纯度要高,提示贝壳中黑色素提取的工艺有待进一步改进。另外,黑色素可分为真黑素和褐黑素,而真黑素又可分为黑真黑素和棕真黑素(李华等,2002; 李文等,2007),本研究暂未鉴定出长牡蛎中的黑色素属于哪种黑色素,这是本实验的不足之处,有待深入研究。虽然牡蛎黑色素形成的机制尚未研究清楚,但已经确定为黑色素,因此目前可以按照边研究边开发的策略,针对海外市场特别是韩国市场对黑色外套膜牡蛎的青睐,结合单体牡蛎生产技术,生产出壳形规整、外套膜边缘深黑的高端牡蛎以供出口,提高我国海洋贝类的国际竞争力。
4 结论本研究成功提取并鉴定了长牡蛎贝壳和外套膜中的黑色素,是牡蛎黑色素提取方法的首次报道和牡蛎中存在黑色素的第一次确定,为高黑素含量长牡蛎新品种的选育奠定了基础,同时也为黑色素相关领域的研究提供了参考。
| 王庆志, 2011.长牡蛎品种选育与生长性状的遗传参数估计.青岛: 中国海洋大学博士学位论文 |
| 付湘晋, 2005.我国天然黑色素资源研究概况.粮食与油脂, (12): 42-45 |
| 李 文, 邓卫东, 毛华明, 2007.乌骨绵羊和黑色素的研究进展.家畜生态学报, 28(3): 1-5 |
| 李 华, 邱祥聘, 龙继蓉, 2002.乌骨鸡黑色素的研究进展.畜牧与兽医, 34(8): 33-35 |
| Aghajanyan A E, Hambardzumyan A A, Hovsepyan A S et al, 2005.Isolation, purification and physicochemical characterization of water-soluble Bacillus thuringiensis melanin.Pigment Cell Research, 18(2): 130-135 |
| Araujo M, Xavier J R, Nunes C D et al, 2012.Marine sponge melanin: a new source of an old biopolymer.Structural Chemistry, 23(1): 115-122 |
| Bassam S E, Benhamou N, Carisse O, 2002.The role of melanin in the antagonistic interaction between the apple scab pathogen Venturia inaequalis and Microsphaeropsis ochracea.Canadian Journal of Microbiology, 48(4): 349-358 |
| Chang T S, 2009.An updated review of tyrosinase inhibitors.International Journal of Molecular Sciences, 10(6): 2440-2475 |
| Chen S R, Jiang B, Zheng J X et al, 2008.Isolation and characterization of natural melanin derived from silky fowl (Gallus gallus domesticus Brisson).Food Chemistry, 111(3): 745-749 |
| de Cássia R G R, Pombeiro-Sponchiado S R, 2005.Antioxidant activity of the melanin pigment extracted from Aspergillus nidulans.Biological and Pharmaceutical Bulletin, 28(6): 1129-1131 |
| Dubey S, Roulin A, 2014.Evolutionary and biomedical consequences of internal melanins.Pigment Cell & Melanoma Research, 27(3): 327-338 |
| Kang J-H, Kang H-S, Lee J-M et al, 2013.Characterizations of shell and mantle edge pigmentation of a pacific oyster, Crassostrea gigas, in Korean Peninsula.Asian-Australasian Journal of Animal Sciences, 26(12): 1659-1664 |
| Kimura T, Fukuda W, Sanada T et al, 2014.Characterization of water-soluble dark-brown pigment from Antarctic bacterium, Lysobacter oligotrophicus.Journal of Bioscience and Bioengineering, doi: S1389-1723(14)00459-9 |
| Kollosa N, Sayre R M, Zeise L et al, 1991.New trends in photobiology: photoprotection by melanin.Journal of Photochemistry and Photobiology B: Biology, 9(2): 135-160 |
| Li N, Hu J J, Wang S et al, 2010.Isolation and identification of the main carotenoid pigment from the rare orange muscle of the Yesso scallop.Food Chemistry, 118(3): 616-619 |
| Lu Y, Ye M, Song S et al, 2014.Isolation, Purification, and Anti-Aging Activity of Melanin from Lachnum singerianum.Applied Biochemistry and Biotechnology, 174(2): 762-771 |
| Mustapha N, Bzéouich I M, Ghedira K et al, 2015.Compounds isolated from the aerial part of Crataegus azarolus inhibit growth of B16F10 melanoma cells and exert a potent inhibition of the melanin synthesis.Biomedicine & Pharmacotherapy, 69: 139-144 |
| Selvakumar P, Rajsekar S, Periasamy K et al, 2008.Isolation and characterization of melanin pigment from Pleurotus cystidiosus (telomorph of Antromycopsis macrocarpa).World Journal of Microbiology and Biotechnology, 24(10): 2125-2131 |
| Sharma S, Wagh S, Govindarajan R, 2002.Melanosomal proteins——role in melanin polymerization.Pigment Cell Research, 15(2): 127-133 |
| Swan G A, 1974.Structure, chemistry, and biosynthesis of the melanins.In: Andersen N H, Brady S F, Harris C M eds.Fortschritte der Chemie Organischer Naturstoffe/Progress in the Chemistry of Organic Natural Products.Vienna: Springer, 521-582 |
| Tu Y G, Sun Y Z, Tian Y G et al, 2009.Physicochemical characterisation and antioxidant activity of melanin from the muscles of Taihe Black-bone silky fowl (Gallus gallus domesticus Brisson).Food Chemistry, 114(4): 1345-1350 |
| Vrolijk M F, Opperhuizen A, Jansen E H J M et al, 2015.The shifting perception on antioxidants: The case of vitamin E and β-carotene.Redox Biology, 4: 272-278 |
| Yuan W L, Burleigh S H, Dawson J O, 2007.Melanin biosynthesis by Frankia strain CeI5.Physiologia Plantarum, 131(2): 180-190 |
| Zhang G F, Fang X D, Guo X M et al, 2012.The oyster genome reveals stress adaptation and complexity of shell formation.Nature, 490(7418): 49-54 |
| Zhang Y Y, Zhang L L, Sun J et al, 2014.Proteomic analysis identifies proteins related to carotenoid accumulation in Yesso scallop (Patinopecten yessoensis).Food Chemistry, 147: 111-116 |
| Zheng H P, Liu H L, Zhang T et al, 2010.Total carotenoid differences in scallop tissues of Chlamys nobilis (Bivalve: Pectinidae) with regard to gender and shell colour.Food Chemistry, 122(4): 1164-1167 |
 2015, Vol. 46
2015, Vol. 46


