中国海洋湖沼学会主办。
文章信息
- 李海波, 谢超, 丁晨, 黄菊, 裘晓华, 林琳. 2015.
- LI Hai-Bo, XIE Chao, DING Chen, HUANG Ju, QIU Xiao-Hua, LIN Lin. 2015.
- 海藻胶低聚寡糖的化学氧化制备纯化技术及保水理化性质分析
- ALGINATE OLIGOSACCHARIDES CHEMICAL OXIDATION PREPARATION AND PURIFICATION TECHNOLOGY AND THE PHYSICAL AND CHEMICAL PROPERTIES ANALYSIS
- 海洋与湖沼, 46(4): 915-921
- Oceanologia et Limnologia Sinica, 46(4): 915-921.
- http://dx.doi.org/10.11693/hyhz20150500153
-
文章历史
- 收稿日期:2015-05-21
- 改回日期:2015-06-09
2. 浙江省海产品健康危害因素关键技术研究重点实验室 浙江海洋学院食品与医药学院 舟山 316022
2. Key Laboratory of Health Risk Factors for Seafood of Zhejiang Province, College of Food and Medicine, Zhejiang Ocean University, Zhoushan 316022, China
海藻胶低聚寡糖具有多种生物功能,在药物、食品等方面都具有广泛用途,且与褐藻胶相比,海藻胶低聚寡糖在水溶性和生物抗原性等方面具有更加明显的优点(纪明侯等,1962)。目前海藻胶低聚寡糖的市场价格非常高,主要原因在其制备技术研究不够深入,制备生产成本高昂,影响了海藻胶低聚寡糖的广泛应用。经过对前人的研究总结和文献查新,在氧化降解技术方面,选用双氧水作为氧化剂对海藻胶进行氧化降解(陈正霖等,1989; Caswell et al,1989; 纪明侯等,1997),此方法与NaNO2化学降解海藻胶相比,无毒、无副作用、产品较专一。在膜分离提取方面,国内外对海藻胶低聚寡糖的分离、分析方法的研究报道较少。国内学者通过一系列正交实验对海藻胶低聚寡糖进行酶降解,采用层析柱分离膜对1000—8000Da聚合度的海藻胶低聚寡糖进行分离提取(赵齐川等,1991; 张晨,1992)确定了最佳工艺条件。而理化性质方面的研究能够有助于进一步理解海藻胶低聚寡糖的结构(Schaeffer et al,2000),进而为提高海藻胶低聚寡糖的生产工艺和筛选条件起到一定的指导作用,以期为海藻胶低聚寡糖的开发利用提供理论依据。
1 材料与方法 1.1 材料与仪器仪器和设备: TZL-98型恒温振荡器(浙江省宁波市医疗器械厂); Heto公司L-000型真空冷冻干燥; PRO-R双级反渗透超纯水机(江苏锁顶); 基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS,岛津); 旋转蒸发仪RE64-B(上海荣威); 集热式恒温磁力搅拌器(北京长城科技); LTQ-XL型质谱仪(ThermoFisher)。
材料和试剂: 海藻酸钠、褐藻胶裂解酶(青岛百成海洋生物资源有限公司)、酒石酸钾钠、H2O2 35%— 37%(分析纯)、苯酚、磷酸氢二钾、硫酸镁等(国药化学试剂有限公司)。强阴离子交换柱(Dowex,1×4400目); 正丁醇、醋酸、甲酸为分析纯; 甲醇为fisher色谱纯。
1.2 实验内容及方法1.2.1 旋光度测定(杨钊等,2004)
准确称取0.5g盐酸氨基化铁溶解于碳酸氢钠中,加入待测溶液静置于室温下,每隔20min用旋光仪测定旋光度。通过[a]C20=a/LC计算出比旋光度(其中: a为旋光度; L为样品管长度dm; C为样品溶液浓度g/mL)。
1.2.2 端基分析法测分子量(何芸等,2007)精确称取氯化铁氰钾0.5g,溶解于NaCl溶液 1L中,于棕色试剂瓶中密封保存。将氨基磷酸盐配成1g/500mL溶液,定容至20mL,加盖后于30°C水浴锅中加热20min,冷却后取2mL样液,用紫外分光光度计在波长为628nm处,测定各管吸光度A,以A对相应的浓度绘制标准曲线。求出分子量Mn。
1.2.3 分子量测定将低聚糖溶液分别加入到4组不同的粘度计中,放置在恒温水浴中,调节水浴锅温度为35°C,在依次加入比列为30%、50%、70%的碳酸铵基镁求出各样品的特性粘度[η],用Mark- Houwink方程算出粘度平均分子量(Higgins et al,1996)。
1.2.4 强阴离子交换柱分离采用Kitamikado等(1990)的分离技术进行。
1.2.5 硅胶柱分离采用冯蕾等(2006)的技术进行分离。
2 结果与讨论2.1 化学氧化降解法对海藻胶低聚寡糖制备的优化研究
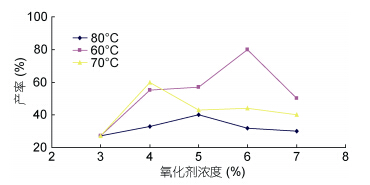
2.1.1 氧化剂浓度对海藻胶低聚寡糖产率的影响
图 1为氧化剂 H2O2的浓度对海藻胶低聚寡糖产率的影响,由图 1可知在一定温度条件下,海藻胶低聚产率与H2O2浓度变化趋势不一致。结果显示,H2O2添加量在一定范围内即可。而且添加过多还会使其与氧化副产物C3氨基发生反应,导致产物不纯,通过化学等温式ΔG = -RTInKC + RTInQC(Cabrera et al,2005)可知,式中:
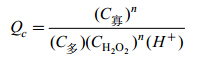
 |
| 图 1 H2O2浓度对海藻胶低聚寡糖产率的影响 Fig. 1 Low concentration of H2O2 seaweed gel together effect of oligosaccharide production rate |
在温度条件一定时,反应达平衡,而加大反应物H2O2浓度,会使反应向正反应方向进行。因此,在一定温度条件下,反应物和其浓度的增加会使反应向正方向进行,并增加反应速率。
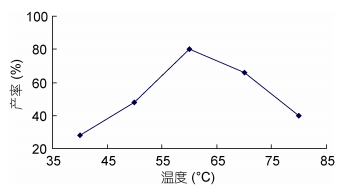
2.1.2 反应温度对海藻胶低聚寡糖产率的影响图 2为反应温度对海藻胶低聚寡糖产率的影响,从图可以看出,伴随温度升高,产率增加,随后伴随温度进一步升高,产率反而降低,说明不仅影响了产量也影响了质量,也表明了反应温度升高到一定极限后,反而不利于大分子海藻胶低聚寡糖的制备,因此,要制得作用大且质地上层的大分子低聚寡糖,温度不宜过高,由图 2可知在温度为60°C左右时进行最佳,因为随着相对分子量的减少,空间结构的变化,海藻胶低聚寡糖上的副产物氨基活性会增加(刘斌等,2004),更易发生羰氨副反应,从而使产品质量下降。因此,温度对反应的平衡和产率产生了重大影响,由反应式1的体系可得:
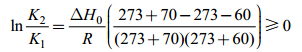
 |
| 图 2 温度对海藻胶低聚寡糖产率的影响 Fig. 2 Low concentration of temperature effect of oligosaccharide production rate |
K1、K2分别是在温度为T1=273+60、T2=273+70时,海藻胶低聚寡糖降解反应时产物的平衡常数,根据化学反应平衡原理,当实验温度70°C >60°C时,有: K2/K1>1即K2>K1,使得产率减小了。
2.1.3 时间对海藻胶低聚寡糖产率的影响由图 3可知,在温度为60°C时,延长海藻胶氧化裂解时间,其生成的海藻胶低聚寡糖产量会持续增加; 当反应在70°C温度条件下时,随着时间增加,产量会不断减少; 在80°C时,增长时间,其反应产物则出现先增加后减少的趋势,因此,时间对反应产物的影响会根据温度的不同而不同,总的来说,60°C为反应最佳温度。当温度为60°C时,由图 3可知: 8h是最佳的反应时间,原因可能是随着时间的延长,反应正向进行,分子量减少,结构改变。有关时间对海藻胶降解产物影响的研究并不多见,此实验为其产率的影响研究提供了宝贵的参考依据。
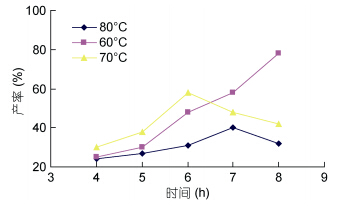 |
| 图 3 反应时间对海藻胶低聚寡糖产率的影响 Fig. 3 Low concentration of time effect of oligosaccharide production rate |
硅胶柱一次分离: 将样品按照TLC的检测结果共分为四个组分,取四个组分样品各200mL,稀释100倍,进行Malde-Tof-Ms分析。从图 4得出,组分一是以分子量为1000—2000Da海藻胶低聚寡糖为主的组分,含有少量的2000—4000Da的低聚寡糖; 组分二是以分子量为2000—4000Da海藻胶低聚寡糖为主的组分,含有少量的4000—6000Da低聚寡糖; 组分三是以分子量为4000—6000Da海藻胶低聚寡糖为主的组分,也含有2000—4000Da和6000—8000Da的低聚寡糖; 组分四是以分子量为6000—8000Da海藻胶低聚寡糖为主的组分,同时也含有少量4000—6000Da的低聚寡糖。因此样品中的低聚部分已被分为两种寡糖或三种寡糖的混合物。
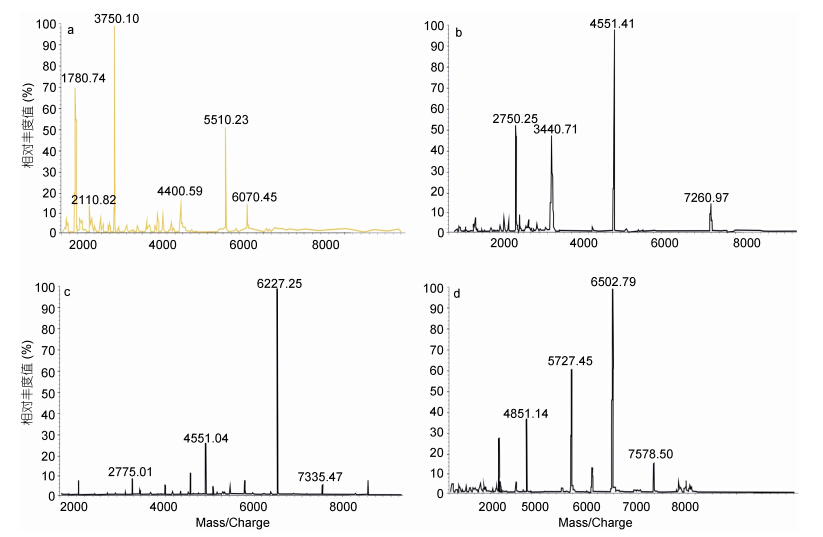 |
| 图 4 硅胶柱一次分离后各组分对应的MALDI-TOF-MS图谱 Fig. 4 Silica column after a separation of the corresponding component of Maldi-Tof-Ms spectrum |
硅胶柱二次分离: 取四个组分样品各200mL稀释100倍,进行Malde-Tof-Ms分析,从Malde-Tof-Ms图谱(图 5)可以看出,在硅胶柱二次分离所得的四个组分中,组分一以1000—2000Da海藻胶低聚寡糖为主,含有极少量的2000—4000Da的低聚寡糖; 组分二为2000—4000Da的海藻胶低聚寡糖,几乎不含其它聚合度的寡糖; 组分三以分子量为4000—6000Da海藻胶低聚寡糖为主,几乎不含其它聚合度的寡糖; 组分四以分子量为6000—8000Da的海藻胶低聚寡糖为主,几乎不含其它聚合度的寡糖。因此1000—8000Da分子量的海藻胶低聚寡糖基本得到分离,其中4000— 6000Da、6000—8000Da的低聚寡糖纯度相对比较大。
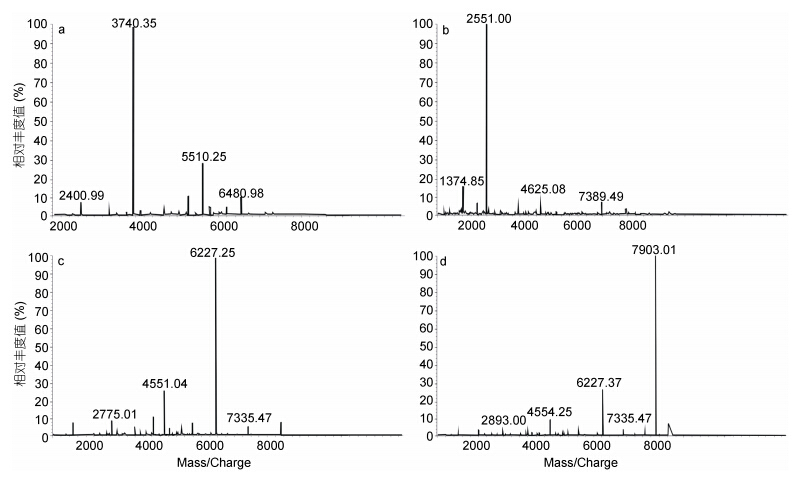 |
| 图 5 硅胶柱二次分离后各组分对应的MALDI-TOF-MS图谱 Fig. 5 Second silica gel column separation after the corresponding components of Maldi-Tof-Ms spectrum |
DE值代表产品分离程度高低。由图 6可知,当在起始的4h分离时间内,4000—6000Da和6000—8000Da的两种海藻胶低聚糖在超滤过程中,DE值要明显好于其它两组,且下降趋势较平缓,当到达过滤的最终时间段时,6000—8000Da和4000— 6000Da的DE值相近且都略低于另外两组。且在超滤膜过滤4h后,6000—8000Da和4000—6000Da两组截留液海藻胶低聚寡糖的DE值下降都不再明显,说明此时过滤已基本终止,所以,超滤膜分离的最适时间应为4h。且这一过程,操作可控,安全无杂,可根据实际所需自主调控,直到产品达到所需的要求(康平等,2007)。
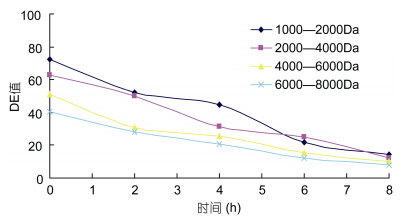 |
| 图 6 四种海藻胶低聚糖超滤截留液DE值随时间的变化 Fig. 6 Four liquid seaweed gel oligosaccharides ultrafiltration intercept DE values change over time |
如图 7所示,随着超滤膜分离温度的不断升高,截留液DE值均呈上升趋势,说明还原糖没有被过滤出去,渗透通量呈不断下降趋势。运行初期,渗透通量下降较慢,但随着运行温度的增长,超滤膜发生变性,流动性及粘性等变差。当温度达到30°C以前时,膜表面会形成大量的凝胶层,导致膜破坏(蔡俊鹏等,2006)。由图 7可见,在超滤分离运行的温度应控制在27°C左右为最宜,方能得到较适DE值的海藻胶低聚寡糖产品。
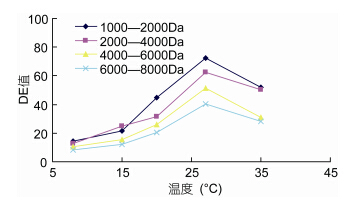 |
| 图 7 四种海藻胶低聚糖超滤截留液DE值随温度的变化 Fig. 7 Four liquid seaweed gel oligosaccharides ultrafiltration intercept DE value along with the change of temperature |
2.3.1 溶解性分析比较
不同分子量海藻胶低聚寡糖的水溶性测定结果如表 1所示,分级前后海藻胶低聚寡糖的水溶性存在较大的差异。在27°C温水中,分子量6000—8000Da的低聚寡糖水溶性最高,达到91.03%,而1000—2000Da的最差,而在70°C热水中,各海藻胶低聚寡糖的水溶性都比较高,尤其是分子量为6000—8000Da的,水溶性达到了99%。原因在水溶性伴随温度的变化而变化(包华芳等,2010),其中,1000—2000Da的低聚寡糖水溶性增幅最大,但在热水中的溶解性却依然最小,可能是与其分子间聚合度较低有关。
| 样品 | 水溶性(%) | ||
| DE值 | 27°C | 70°C | |
| 1000—2000Da | 2.78 | 58.53 | 92.37 |
| 2000—4000Da | 4.68 | 72. 86 | 95.36 |
| 4000—6000Da | 5.16 | 87.49 | 97.58 |
| 6000—8000Da | 7.96 | 91.03 | 98.56 |
不同相对湿度条件下不同分子量海藻胶低聚寡糖样品的吸水性如图 8所示。由图 8可以看出,随着环境湿度的增加,海藻胶低聚寡糖的吸水性都呈现增加的趋势。当相对湿度为 99%时,各分子量海藻胶低聚寡糖的吸水强弱是: 6000—8000Da > 4000—6000Da > 2000—4000Da > 1000—2000Da,可以看出,各种海藻胶低聚寡糖在吸水性上的差异,在高湿度条件下才体现出来(刘岩等,2001),经过分级后,1000—2000Da的吸水性最弱,6000—8000Da分子量的海藻胶低聚寡糖最强。
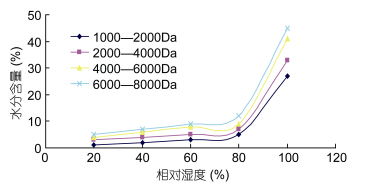 |
| 图 8 不同分子量海藻胶低聚寡糖的吸水性 Fig. 8 Different sugars from seaweed gel low molecular weight poly water imbibition |
不同分子量海藻胶低聚寡糖的冻融稳定性测定结果如表 2所示。冻融稳定性代表了物质的持水能力,用析水率表示。由表 2可以看到,冻融4次,1000—2000Da、2000—4000Da和4000—6000Da都有水析出,析水率随冻融次数的增加呈上升趋势,且1000—2000Da的最大。6000— 8000Da的没有水析出,冻融稳定性最好(Higgins et al ,1996)。可见,分子量为6000—8000Da的海藻胶低聚寡糖的冻融稳定性最好。
| 冻融次数 | 析水率(%) | |||
| 1000—2000 | Da2000—4000Da | 4000—6000Da | 6000—8000Da | |
| 1 | 39.26 | 15.67 | 8.56 | 0 |
| 2 | 42.78 | 17.78 | 11.52 | 0 |
| 3 | 45.46 | 21.03 | 15.87 | 0 |
| 4 | 47.13 | 25.62 | 19.39 | 0 |
在对海藻胶低聚寡糖的溶解性、吸水性、稳定性上述3种保水指标的测量中发现,四种不同分子量海藻胶低聚寡糖中,6000—8000Da的低聚寡糖无论是在溶解性、吸水性还是在稳定性方面均最好。可能是因为: 分子量越大,分子间聚合程度越高,结晶性越强,相互作用性也越强,且含有更多的水溶性大分子物质造成的(Jeanmougin et al ,1998)。可见,随着分子量增大,海藻胶低聚寡糖的持水性,冻融稳定性都显著提高,而6000—8000Da分子量的海藻胶低聚糖因其更加稳定且致密的网状聚合结构,和更多的亲水基团,大大的增强了其吸附和持水能力,因而使其吸水性、稳定性更好。大分子海藻胶低聚寡糖的制备与分级筛选,为后期其对鱿鱼、虾及肉制品的抗冻保水应用提供了理论基础和原料保障。
3 结论在利用化学氧化法制备海藻胶低聚糖工艺过程中,当H2O2添加浓度控制在6%左右,温度控制在60°C,时间控制在8h时,获得了分子量为1000— 8000Da的海藻胶低聚糖,且降解产率最好,能达到60%左右;当采用硅胶柱二次层析法提取分离不同分子量低聚寡糖的过程中,温度控制在27°C,时间在2h以内时,分离提取率是最高的,达到70%左右。且低聚糖分子量多为6000—8000Da范围内。该制备技术工艺操作简单,方便进行,成本低,是利用海藻胶降解制备海藻胶低聚寡糖方法的发展方向之一。
| 包华芳, 刘 磷, 丁玉庭, 2010.酶解制备褐藻胶寡糖及其抗氧化活性研究.中国酿造, (4): 82-84 |
| 冯 蕾, 唐学玺, 王艳玲等, 2006.褐藻酸降解酶特性的初步研究.海洋科学, 30(2): 30-33 |
| 刘 岩, 江晓路, 管华诗, 2001.褐藻胶裂解酶研究进展.中国水产科学, 7(4): 99-103 |
| 刘 斌, 王长云, 张洪荣等, 2004.海藻多糖褐藻胶生物活性及其应用研究新进展.中国海洋药物杂志, 23(6): 36-41 |
| 纪明侯, 1997.海藻化学.北京: 科学出版社, 231-244 |
| 纪明侯, 张燕霞, 1962.我国经济褐藻的化学成分研究Ⅰ.各种经济褐藻的主要化学成分.海洋与湖沼, 4(3-4): 161-168 |
| 杨 钊, Li J P, 张真庆等, 2004.一种新的褐藻胶寡糖制备方法——氧化降解法.海洋科学, 28(7): 19-22 |
| 何 芸, 姚 开, 贾冬英等, 2007.抗鱼肉蛋白冷冻变性机理的研究进展.氨基酸和生物资源, 29(2): 36-39 |
| 张 晨, 1992.藻酸双酯钠对血清高密度脂蛋白亚组分含量影响的观察.中国海洋药物, 4(1): 23-25 |
| 陈正霖, 高金城, 1989.海藻胶.青岛: 青岛海洋大学出版社, 235-241 |
| 赵齐川, 张万群, 1991.褐藻胶的性质、用途及在人体中的作用.四川工业科技, 10(1): 52-56 |
| 康 平, 汪秋宽, 宋琳琳等, 2007.皱纹盘鲍内脏酶的酶学性质及褐藻胶裂解酶的分离纯化.水产学报, 31(1): 15-22 |
| 蔡俊鹏, 程 璐, 2006.褐藻胶裂解酶及其裂解产物的研究进展.食品研究与开发, 27(11): 219-222 |
| Cabrera J C, Van Cutsem P, 2005.Preparation of chitooligosaccharides with degree of polymerization higher than 6 by acid or enzymatic degradation of chitosan.Biochemical Engineering Journal, 25(2): 165-172 |
| Caswell R C, Gacesa P, Lutrell K E et al, 1989.Molecular cloning and heterologous expression of a Klebsiella pneumoniae gene encoding alginate lyase.Gene, 75(1): 127-134 |
| Higgins D G, Thompson J D, Gibson T J, 1996.Using CLUSTAL for multiple sequence alignments.Methods Enzymology, 266: 383-402 |
| Jeanmougin F, Thompson J D, Gouy M et al, 1998.Multiple sequence alignment with Clustal X.Trends in Biochemical Sciences, 23(10): 403-405 |
| Kitamikado M, Yamaguchi K, Tseng C-H et al, 1990.Method designed to detect alginate-degrading bacteria.Applied and Environmental Microbiology, 56(9): 2939-2940 |
| Schaeffer D J, Krylov V S, 2000.Anti-HIV activity of extracts and compounds from algae and cyanobacteria.Ecotoxicology and Environmental Safety, 45(3): 208-227 |
 2015, Vol. 46
2015, Vol. 46


