中国海洋湖沼学会主办。
文章信息
- 段翠兰, 胡志新, 邹勇, 陈光芸, 陈静, 王一鸣, 张永江. 2015.
- DUAN Cui-Lan, HU Zhi-Xin, ZOU Yong, CHEN Guang-Yun, CHEN Jing, WANG Yi-Ming, ZHANG Yong-Jiang. 2015.
- 大型浅水湖泊太湖中浮游病毒的时空分布特征及其与环境因子的相关性分析
- SPATIAL-TEMPORAL DISTRIBUTION OF VIRIOPLANKTON AND THEIR RELATIONSHIP WITH ENVIRONMENTAL FACTORS IN TAIHU LAKE
- 海洋与湖沼, 46(4): 937-941
- Oceanologia et Limnologia Sinica, 46(4): 937-941.
- http://dx.doi.org/10.11693/hyhz20150300071
-
文章历史
- 收稿日期:2015-03-09
- 改回日期:2015-04-27
2. 南京工程学院环境工程学院 南京 211167
2. School of Environmental Engineering, Nanjing Institute of Technology, Nanjing 211167, China
浮游病毒是湖泊生态系统中的重要组成部分(张全国,2014),在微食物环中起着重要的作用(Bratbak et al,1994)。水体中的浮游病毒数量巨大,主要为噬菌体(张奇亚,2014)和浮游藻类病毒(赵以军等,1996),它们通常会感染水体中的浮游细菌和浮游藻类,导致浮游细菌和浮游藻类的死亡、裂解,从而对水体中浮游细菌和浮游藻类的丰度和种群产生重要影响(Liu et al,2006)。
对浮游病毒的研究始于20世纪60年代,后随着电子显微镜的广泛应用(Torrella et al,1979),浮游病毒成为生态学的研究热点。浮游病毒的类群、丰度、生态作用以及差异性进行了一系列研究(Wilhelm et al,2008)。有学者对全球的浮游病毒总量进行估算,发现浮游病毒可能是仅次于原核生物的第二大生物量群(孙辉,2014)。目前,国内对海洋浮游病毒的生态分布的认识已较为全面(李洪波等,2012; 王艳等,2013),湖泊淡水浮游病毒的研究还较为薄弱,仅见对武汉东湖(刘艳鸣等,2005)、长江口(白晓歌等,2007)、湖北湿地(孙小磊等,2009)等的初步探索。太湖是我国第三大淡水湖泊,空间异质性高,具有草、藻型两个截然不同的生态系统,风浪对水体扰动作用明显,无温跃层,四季温差大,是一个典型的大型浅水湖泊(秦伯强等,2004); 太湖又是国家重点治理的富营养水体之一。为了揭示太湖水体中浮游病毒的分布规律,了解其在微食物环中的生态功能,本实验采用表面荧光计数法,研究了太湖水体中浮游病毒丰度的时空分布特征,探讨了影响太湖水体中病毒丰度的主要环境因子,为进一步揭示太湖水体中浮游病毒的生态位提供基础。
1 材料与方法 1.1 采样点设置与样品采集为研究太湖水体中病毒的时空分布,在太湖不同功能区域中共设置19个采样点位,位置见图 1。于2013年9月和2014年5月,在上述采样点位用5 L的Niskin采水器,采集水样。将50 mL的水样,放入事先清洗干净、灭菌的玻璃瓶中,加入戊二醛固定(终浓度为0.5%),4°C低温保存,用于细菌、病毒的分析,样品在1个月内分析完毕。另将2.5 L的水样放入事先清洗干净的塑料瓶中,用于叶绿素a及其它相关水质参数的分析。
 |
| 图 1 太湖采样点位图 Fig. 1 Sampling sites in Taihu Lake |
固定后的样品,经SYBR Green I染色后,利用荧光显微镜(Nikon 80i,蓝光,油镜100×)测定浮游细菌、浮游病毒的丰度(Patel et al,2007; Suttle et al,2010)。
1.2.2 叶绿素a的分析取200 mL的水样,用直径25 mm的GF/F滤膜过滤后,将滤膜剪碎、用90%的丙酮,-20°C黑暗条件下萃取24 h,离心后,用Thermo scientific LUMINA Fluorescence Spectrometer测定其荧光强度,换算为叶绿素a浓度(梁玉波等,2006)。过滤后的滤膜,如不能立即测定,可用铝箔包装后,-20°C保存。
1.3 数据分析与绘图数据分析和统计使用SPSS16.0软件,绘图使用MapInfo7.0和Excel软件。
2 结果 2.1 太湖水体中浮游病毒的空间分布特征在太湖水体中,浮游病毒的丰度呈现出显著的空间差异。在不同样点间,其丰度变动于(0.91— 74.61)×106 ind./mL之间,均值为(16.38±1.17)×106 ind./mL(图 2)。
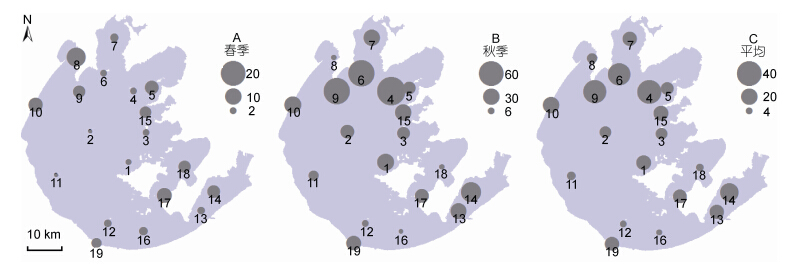 |
| 图 2 太湖浮游病毒丰度的水平分布(×106 ind./mL) Fig. 2 The horizontal distribution of virioplankton abundance in Taihu Lake |
根据采样点位,将采样区域划分为四个类型,分别为敞水区(点位1—12)、网围养殖区(点位13—14)、保护区(点位15—18)、入湖河道(点位19)。太湖水体中浮病毒的丰度具有显著的空间差异,网围养殖区的病毒丰度较高,为(3.52±0.28)×107 ind./mL,敞水区的病毒丰度较低,为(4.06±0.90)×106 ind./mL(图 3)。
2.2 太湖水体中浮游病毒丰度的季节变动从季节变化来看,春季的浮游病毒丰度变化范围是(0.91—13.22)×106ind./mL(表 1),均值为4.64× 106ind./mL,秋季的浮游病毒丰度变化范围是(3.55— 74.61)×106ind./mL,均值为28.31×106ind./mL,浮游病毒的丰度呈现出显著的时间差异(图 3),秋季水体中浮游病毒的丰度(2.83±0.74)×107 ind./mL,显著大于春季(3.11±0.67)×106 ind./mL(图 4)。
| 项目 | 春季 | 秋季 |
| 病毒(×106ind./mL) | 0.91—13.22(4.64) | 3.55—74.61(28.31) |
| 细菌(×105ind./mL) | 3.22—14.61(6.98) | 6.23—34.41(13.68) |
| 叶绿素a(µg/L) | 2.79—76.04(15.61) | 6.91—404.71(82.30) |
| VBR | 1.01—13.34(6.68) | 5.27—100.28(27.17) |
| 括号中数值为全湖各测点的平均值 | ||
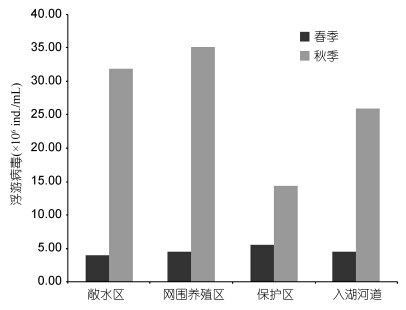 |
| 图 3 太湖浮游病毒丰度的区域分布 Fig. 3 The spatialvirioplankton distribution in Taihu Lake |
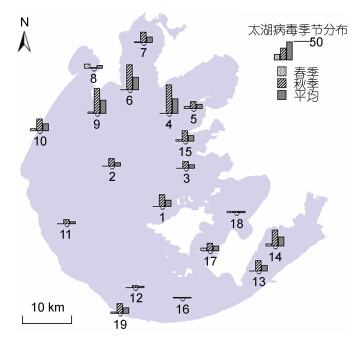 |
| 图 4 太湖浮游病毒丰度的季节分布(×106 ind./mL) Fig. 4 The seasonal distribution of virioplankton in Taihu Lake |
病毒与细菌比率(virus-to-bacteria ratio,VBR)一般用来分析原核生物与病毒之间的关系(Wommack et al,2000)。在此次太湖研究中,VBR变化范围很广,最大值为100.28,出现在秋季敞水区乌龟山测点附近; 最小值为1.01,出现在春季敞水区平台山测点附近; 太湖VBR平均值为16.93。VBR的季节变化表现为秋季>春季(表 1)。VBR与异养细菌丰度在春、秋两个季节中均无显著的相关性。
2.4 病毒与叶绿素a、细菌的关系浮游植物和细菌作为浮游病毒的宿主,与其有较强的相关性。而在不同季节,它们之间的相关性存在一些差异(表 2)。春季浮游病毒与叶绿素a之间有显著正相关(r=0.645,P<0.05),秋季浮游病毒与叶绿素a之间有极显著正相关(r=0.756,P<0.01)。春、秋季浮游病毒与异养细菌之间无显著相关性。
| 相关系数 | 春季 | 秋季 |
| Virus/Chla | 0.645(P<0.05) | 0.756(P<0.01) |
| Virus/bacteria | 0.339 | 0.354 |
根据现有文献资料报道(表 3),我国淡水浮游病毒丰度范围较广,最小值出现在2014年春季太湖大雷山区域,为0.91×106 ind./mL,而最大值出现在2003年武汉东湖,为2.44×109 ind./mL。这表明浮游病毒丰度在不同季节、不同区域变化较大。太湖的病毒丰度在(0.91—47.91)×106 ind./mL,而东湖的病毒丰度高达(2.40±0.04)×109 ind./mL。在太湖中,可能因其水体面积大,浮游病毒的丰度较低,明显不同于中小型淡水水体的分布情况,其分布状况和江苏近岸海域中的情况类似(段翠兰等,2012)。
Cochran等(1998)研究发现,一般浮游病毒丰度最低值出现于冬季,而最高值出现于秋季。本研究结果表明太湖浮游病毒丰度秋季大于春季,秋季的浮游病毒丰度远远超过春季,差异极为显著。
Vrede等(2003)研究认为细菌丰度与叶绿素a浓度在特定情况下可预测浮游病毒的丰度。干净水体中,浮游病毒丰度与叶绿素a浓度的相关性较高,说明浮游藻类病毒比重较大(Peduzzi et al,2004)。在太湖以藻型湖与草型湖为主体的大型水体中,春季浮游病毒丰度与叶绿素a浓度之间呈显著正相关; 秋季浮游病毒丰度与叶绿素a浓度之间呈极显著正相关; 春、秋季浮游病毒与异养细菌之间无显著相关性,这说明浮游藻类病毒在太湖水体中所占比重较大,是太湖的优势种类。而孙小磊等(2009)对湖北湿地研究结果显示,浮游病毒与活菌数的相关性高于与叶绿素a浓度的相关性,认为噬菌体是湿地水体中浮游病毒的优势种类。
一般情况,VBR介于3到10; 在初级生产力高,营养盐丰富的区域,VBR值会提高(Wommack et al,2000)。本研究中,VBR范围为1.01—100.28,平均值为16.93。武汉东湖水体浮游病毒的研究中,VBR范围为49—56(刘艳鸣等,2005)。从VBR值可看出,太湖VBR值范围比较广,而东湖VBR值范围相对集中,这可能与太湖不同水域的富营养化程度不同,而东湖整个湖区的富营养化程度比较相似的状况有关。这进一步表明太湖有些湖区(如东太湖水草区),营养化程度低于东湖,水质状况优于东湖,而有些湖区(如梅梁湾),营养化程度远远超过东湖,富营养化现象严重。
有研究报道在高浮游植物丰度情况下会产生较高的VBR(Paul et al,1991)。在太湖研究中,发现春季浮游病毒与叶绿素a呈显著正相关(r=0.645,P<0.05),秋季浮游病毒与叶绿素a之间呈极显著正相关(r=0.756,P<0.01)。这说明在春季42%(r2=0.42)的浮游病毒与浮游植物有关,秋季56%的浮游病毒与浮游植物有关,太湖水体浮游病毒的主要宿主是浮游植物。
Wommack等(2000)年研究发现浮游细菌丰度与VBR间的相关性可作为宿主菌种群多样性指标。在宿主种群较单一时,异养细菌丰度与VBR呈现负相关性; 而宿主菌种群较多样时,异养细菌丰度与VBR无相关性(赵苑等,2010)。通过相关性分析发现,在太湖春季和秋季水体中,异养细菌与VBR之间无显著相关性。由此可以认为太湖水域中,噬菌体的宿主菌种群多样性较高。这可能与太湖的地理特征有关,浮游病毒各种类间竞争激烈,优势种不明显。
4 结论太湖水体中浮游病毒的时空分布主要有五个特点。(1)太湖因其独特的地理特征,浮游病毒的丰度较低,分布不均衡,明显不同于中小型淡水水体中的分布。(2)太湖水体中浮游病毒的丰度,具有显著的季节差异,秋季水体中浮游病毒的丰度远高于春季。(3)浮游病毒丰度与叶绿素a浓度具有显著正相关性。浮游藻类病毒是太湖水体的优势种类,噬菌体所占比重较小。(4)春季42%的浮游病毒是由浮游植物决定的,秋季56%的浮游病毒是由浮游植物决定的,浮游病毒的主要宿主是浮游植物。(5)太湖水域中,VBR与异养细菌之间无显著相关性。噬菌体的宿主菌种群多样性较高,优势种不明显。
| 王 艳, 汪 岷, 杨 琳等, 2013.南黄海秋季浮游病毒丰度分布及其与宿主和环境因子的相关性研究.海洋与湖沼, 44(1): 198-204 |
| 白晓歌, 汪 岷, 马晶晶等, 2007.冬季和春季长江口及其近海水域浮游病毒丰度的分析.海洋与湖沼, 38(4): 368-372 |
| 刘艳鸣, 张奇亚, 袁秀平, 2005.武汉东湖浮游病毒的丰度及多样性.水生生物学报, 29(1): 1-6 |
| 孙 辉, 2014.秦皇岛扇贝养殖区浮游病毒丰度及多样性的研究.青岛: 中国海洋大学硕士学位论文, 13 |
| 孙小磊, 赵以军, 刘 妮等, 2009.淡水湿地浮游病毒的空间分布.生态学报, 29(2): 1048-1054 |
| 李洪波, 杨 青, 周 峰, 2012.海洋微食物环研究新进展.海洋环境科学, 31(6): 927-932 |
| 张全国, 2014.病毒及其生态功能.生命科学, 26(2): 107-111 |
| 张奇亚, 2014.噬藻体生物多样性的研究动态.微生物学通报, 41(3): 545-559 |
| 赵 苑, 武洪庆, 李洪波等, 2010.胶州湾浮游病毒的分布研究.海洋科学, 34(7): 86-92 |
| 赵以军, 石正丽, 1996.真核藻类的病毒和病毒类粒子(VLPs).中国病毒学, 11(2): 93-102 |
| 段翠兰, 李洪波, 邹 勇等, 2012.江苏沿岸海域浮游病毒的时空分布.水生生物学报, 36(5): 971-977 |
| 秦伯强, 胡维平, 陈伟民等, 2004.太湖水环境演化过程与机理.北京: 科学出版社, 1-2 |
| 梁玉波, 宁修仁, 王长云等, 2006.海洋生物生态调查技术规程.北京: 海洋出版社, 13-19 |
| Bratbak J, Thingstad F, Heldal M, 1994.Viruses and the microbial loop.Microbial Ecology, 28(2): 209-221 |
| Cochran P K, Paul J H, 1998.Seasonal abundance of lysogenic bacteria in a subtropical estuary.Applied and Environmental Microbiology, 64(6): 2308-2312 |
| Liu Y M, Zhang Q Y, Yuan X P et al, 2006.Seasonal variation of virioplankton in a eutrophic shallow lake.Hydrobiologia, 560(1): 323-334 |
| Patel A, Noble R T, Steele J A et al, 2007.Virus and prokaryote enumeration from planktonic aquatic environments by epifluorescence microscopy with SYBR Green I.Nature Protocols, 2(2): 269-276 |
| Paul J H, Cazares L H, David A W et al, 1991.The distribution of dissolved DNA in an oligotrophic and a eutrophic river of Southwest Florida.Hydrobiologia, 218(1): 53-63 |
| Peduzzi P, Schiemer F, 2004.Bacteria and viruses in the water column of tropical freshwater reservoirs.Environmental Microbiology, 6(7): 707-715 |
| Suttle C A, Fuhrman J A, 2010.Enumeration of virus particles in aquatic or sediment samples by epifluorescence microscopy.In: Wilhelm S W, Weinbauer M G, Suttle C A eds.Manual of Aquatic Viral Ecology.Waco TX: American Society of Limnology and Oceanography, 145-153 |
| Torrella F, Morita R Y, 1979.Evidence by electron micrographs for a high incidence of bacteriophage particles in the waters of Yaquina Bay, oregon: ecological and taxonomical implications.Applied and Environmental Microbiology, 37(4): 774-778 |
| Vrede K, Stensdotter U, Lindström E S, 2003.Viral and bacterioplankton dynamics in two lakes with different humic contents.Microbial Ecology, 46(4): 406-415 |
| Wilhelm S W, Matteson A R, 2008.Freshwater and marine virioplankton: a brief overview of commonalities and differences.Freshwater Biology, 53(6): 1076:LINK |
| Wommack K E, Colwell R R, 2000.Virioplankton: viruses in aquatic ecosystems.Microbiology and Molecular Biology Reviews, 64(1): 69-114 |
 2015, Vol. 46
2015, Vol. 46


