中国海洋湖沼学会主办。
文章信息
- 蒋经伟, 程雨卉, 周遵春, 董颖, 陈仲, 姜北, 高杉. 2015.
- JIANG Jing-Wei, CHENG Yu-Hui, ZHOU Zun-Chun, DONG Ying, CHEN Zhong, JIANG Bei, GAO Shan. 2015.
- 光棘球海胆(Strongylocentrotus nudus)酚氧化酶氧化产物的抗菌特性研究*
- ANTIBACTERIAL CHARACTERIZATION OF OXIDATION PRODUCTS GENERATED BY PHENOLOXIDASES FROM THE SEA URCHIN STRONGYLOCENTROTUS NUDUS
- 海洋与湖沼, 46(4): 969-975
- Oceanologia et Limnologia Sinica, 46(4): 969-975.
- http://dx.doi.org/10.11693/hyhz20141200352
-
文章历史
- 收稿日期:2014-12-17
- 改回日期:2015-02-14
2. 大连海洋大学 大连 116023
2. Dalian Ocean University, Dalian 116023, China
酚氧化酶(PO)是无脊椎动物非特异性免疫应答过程中的关键免疫因子,紧密参与抗菌、抑菌、病原清除等多种免疫应答过程(Muñoz et al,2006; Cerenius et al,2008; 吴曙等,2009)。PO自身不具有任何的抗菌、抑菌活性,其免疫功能是通过氧化底物反应来实现的(Söderhäll et al,1998; Aladaileh et al,2007)。在O2存在的条件下,PO将酚类底物(如多巴胺、左旋多巴等)氧化成醌,醌通过非酶促反应最终转化成黑色素,非酶促反应中生成的活性中间代谢产物和黑色素不仅具有显著的抗菌、抑菌活性,还参与血细胞迁移、结节和包囊形成、损伤修复等其他免疫应答活动(Bai et al,1997; Ballarin et al,1998; Cerenius et al,2004)。
关于酚氧化酶氧化产物的抗菌特性研究在一些无脊椎动物物种已有报道。在烟草天蛾M and uca sexta中,纯化的PO与多巴胺的反应产物对受试的革兰氏阴性(G-)细菌(大肠杆菌Escherichia coli,肺炎克雷伯氏菌Klebsiella pneumonia,绿脓假单胞菌Pseudomonas aeruginosa,鼠伤寒沙门氏菌Salmonella typhimurium)和革兰氏阳性(G+)细菌(蜡样芽胞杆菌Bacillus cereus,枯草杆菌Bacillus subtilis,藤黄微球菌Micrococcus luteus,金黄色葡萄球菌Staphylococcus aureus)的生长均有强烈抑制作用,而PO与左旋多巴的反应产物对上述细菌的生长几乎无明显影响(Zhao et al,2007)。除具有抗菌活性外,烟草天蛾PO与多巴胺的反应产物还对纹夜蛾核多角体病毒(AcMNPV)、噬菌体和寄生黄蜂Microplitis demolitor的卵有显著抑制作用(Zhao et al,2011)。淡水龙虾Pacifastacus leniusculus血细胞破碎液上清(HLS)与多巴胺的混合物对受试的G-细菌(嗜水气单胞菌Aeromonas hydrophila、大肠杆菌、绿脓假单胞菌)和G+细菌(蜡样芽胞杆菌、金黄色葡萄球菌、肺炎链球菌Streptococcus pneumoniae)也有强烈抑制作用,此外,与烟草天蛾中的结果相似,淡水龙虾HLS与左旋多巴的混合物对上述细菌的抑制作用较弱,甚至无抑制作用(Cerenius et al,2010)。PO与多巴胺反应产物的抗菌活性高于PO与左旋多巴反应产物这一现象在海洋无脊椎动物栉孔扇贝Chlamys farreri和仿刺参Apostichopus japonicus中也有发现,然而,在上述两个物种中,PO氧化产物仅对受试细菌中的部分细菌表现出抗菌活性(Xing et al,2012; Jiang et al,2014)。纯化的栉孔扇贝PO与多巴胺的反应产物仅对溶藻胶弧菌Vibrio alginolyticus、副溶血弧菌Vibrio parahaemolyticus和杀鲑气单胞菌Aeromonas salmonicida有显著抑制作用,而对停乳链球菌Streptococcus dysgalactiae、海豚链球菌Streptococcus iniae、溶壁微球菌Micrococcus lysodeikticus和爱德华氏菌Edwardsiella tarda的生长无明显影响(Xing et al,2012)。在仿刺参中,纯化出3种PO(AjPO1,AjPO2,AjPO3),其中AjPO1、AjPO3与多巴胺反应产物均可抑制灿烂弧菌Vibrio splendidus和哈维氏弧菌Vibrio harveyi的生长,3种PO与多巴胺的反应产物对希瓦氏菌Shewanella baltica、假交替单胞菌Pseudoalteromonas nigrifaciens、溶壁微球菌、金黄色葡萄球菌、拟诺卡式菌Nocardiopsis sp.的生长无明显影响(Jiang et al,2014)。此外,在太平洋牡蛎Crassostrea gigas中,血细胞破碎液上清与左旋多巴的混合物对灿烂弧菌和河口弧菌Vibrio aestuarianus有显著抑制作用(Luna-Acosta et al,2011)。上述研究表明,PO氧化产物的抗菌活性除了取决于底物种类外,还与PO所属物种或PO种类有关。
光棘球海胆Strongylocentrotus nudus属于棘皮动物门,又称大连紫海胆,是中国北方近海重要的增养殖经济物种(湛垚垚等,2013)。近年来,随着海胆养殖规模的扩大,养殖过程中出现一系列病害问题,影响了海胆养殖的发展(王斌等,2006; 周玮等,2008)。了解光棘球海胆的免疫特性对预防和控制海胆病害具有重要意义,而目前关于海胆PO的研究主要是体腔液中的PO活力分析(王轶南等,2011),尚缺乏PO纯化和PO氧化产物抗菌特性研究的报道。因此本文分离纯化了光棘球海胆体腔液中的PO,并分析了光棘球海胆PO氧化产物对不同细菌的抗菌活性,以期为海胆免疫机制的研究积累数据。
1 材料与方法 1.1 实验动物光棘球海胆(Strongylocentrotus nudus)(23.6±4.4)5只,取自辽宁省海洋水产科学研究院引育种中心,于实验室暂养(水温17—18°C,pH 8.6—8.8,盐度29),备用。
1.2 实验菌株以灿烂弧菌、哈维氏弧菌、假交替单胞菌、希瓦氏菌、金黄色葡萄球菌、停乳链球菌、溶壁微球菌和拟诺卡式菌为受试细菌(菌株信息见表 1),测定光棘球海胆PO氧化产物的抗菌谱和抗菌活力。上述细菌在28°C、150 r/min条件下培养至对数生长期,取细菌培养悬液于4°C、6000×g离心20 min,弃上清,用生理盐水重悬细菌沉淀至终浓度为A600=1.0。
| 细菌种类 | 革兰氏染色属性 | 细菌来源 | 培养条件 | 培养基 |
| 灿烂弧菌 | G- | 仿刺参 | 28°C,150 r/min | 2216E |
| 哈维氏弧菌 | G- | 仿刺参 | ||
| 假交替单胞菌 | G- | 仿刺参 | ||
| 希瓦氏菌 | G- | 仿刺参 | ||
| 金黄色葡萄球菌 | G+ | ATCC 55804 | ||
| 停乳链球菌 | G+ | ATCC 4698 | ||
| 溶壁微球菌 | G+ | ATCC 51499 | ||
| 拟诺卡式菌 | G+ | 海绵 Hymeniacidon perleve |
用灭菌注射器穿透光棘球海胆(5只)的围口膜抽取体腔液。将5只海胆的体腔液混匀后,离心(4°C,3500 r/min,10 min),取上清作为体腔液上清(CFS),冻存于-20°C备用。
1.4 光棘球海胆PO的分离纯化采用Jiang等(2014)报道的线性连续梯度非变性电泳结合邻苯二酚发色法分离光棘球海胆体腔液上清中的PO。具体步骤如下: 以CFS为样品,在浓度范围为6%—27%的线性连续梯度聚丙烯酰胺凝胶中电泳8 h(4°C,恒流20 mA),使用分子量范围为21—720 kDa的非变性电泳Marker(SERVA)作为标准蛋白; 电泳结束后,将凝胶中的一条泳道切下,浸于1%邻苯二酚溶液中发色5 min,定位PO条带; 根据邻苯二酚发色结果,将未发色凝胶中的PO条带切下,浸于生理盐水中高速匀浆1 min,然后于4°C、14000 r/min离心30 min,取上清作为部分纯化的光棘球海胆PO溶液,冻存于-20°C备用。
1.5 光棘球海胆PO活力测定采用多巴络合物生成法(Söderhäll,1981)测定PO活力。使用左旋多巴或多巴胺(Sigma)作为底物,100 μL PO溶液与2.0 mL 20 mmol/L底物溶液混匀后,在490 nm波长下连续测定吸光值,A490值每分钟增加0.001定义为1个活力单位(U)。分别以左旋多巴、多巴胺为底物,将分离得到的各PO溶液调成400 U/mL,用于抗菌活性分析。
1.6 光棘球海胆PO氧化产物的抗菌活性分析分别使用左旋多巴或多巴胺作为底物。100 μL细菌悬液、50 μL PO溶液与150 μL 20 mmol/L底物溶液(溶于生理盐水)混匀后于30°C孵育1 h。孵育后的混合物离心(4°C,6000 r/min)7 min,弃上清,将细菌沉淀用500 μL生理盐水重悬后,再离心(4°C,6000 r/min)7 min,弃上清,最后将细菌沉淀接种到3 mL 2216E培养基中进行震荡培养(28°C,150 r/min)。培养过程中,每隔1 h取100 μL细菌培养悬液测定A600。对照组包括以下3种孵育方式:(1)100 μL细菌悬液、50 μL 生理盐水与150 μL 20 mmol/L底物溶液(溶于生理盐水)混匀后于30°C孵育1 h;(2)100 μL细菌悬液、50 μL PO溶液与150 μL生理盐水混匀后于30°C孵育1 h;(3)100 μL细菌悬液与200 μL生理盐水混匀后于30°C孵育1 h。其中,对照(1)用于检测PO底物对受试细菌生长的影响,对照(2)用于检测光棘球海胆PO自身对细菌生长的影响,对照(3)用作空白对照。本实验重复3次。当PO与底物处理后的细菌生长曲线同时低于对照(1)、(2)、(3)中的细菌生长曲线,且对照(1)和(2)中的细菌生长曲线与对照(3)中的相比无明显差别时,定义PO与底物的反应产物对该细菌有抗菌作用。
1.7 数据分析抗菌活性中检测的实验数据使用SPSS 11.5分析计算标准差,结果以平均值±标准差表示。
2 结果 2.1 光棘球海胆PO的分离纯化非变性电泳后,经邻苯二酚发色,共发现3条PO条带,分别呈现褐色、黄色和紫色(图 1)。3种PO按分子量由高到低分别命名SnPO1、SnPO2、SnPO3,3种PO的分子量均小于Marker中的最小标准蛋白,其中SnPO2的分子量与溴酚蓝指示剂相近,而SnPO3在非变性电泳中的迁移速率要大于溴酚蓝指示剂。
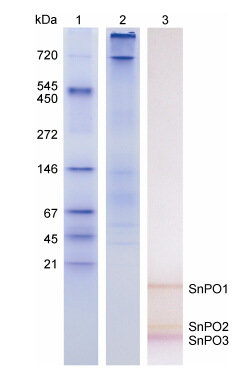 |
| 图 1 光棘球海胆体腔液上清非变性电泳图 Fig. 1 Native-PAGE of the supernatant of coelomic fluid from S. nudus 1: 非变性电泳标准蛋白; 2: 光棘球海胆体腔液上清考马斯亮蓝染色结果; 3: 光棘球海胆体腔液上清PO定位结果 |
与空白对照组相比,光棘球海胆中的3种PO对受试的8株细菌的生长均无明显影响(数据在结果中省略)。
在受试的4株G-细菌中,光棘球海胆PO氧化产物对灿烂弧菌和哈维氏弧菌有显著抗菌作用(图 2)。当以多巴胺为底物时,SnPO1的氧化产物对灿烂弧菌和哈维氏弧菌的生长均有抑制作用,而SnPO2和SnPO3的氧化产物仅抑制哈维氏弧菌的生长; 以左旋多巴为底物时,光棘球海胆中3种PO的氧化产物对4种G-细菌的生长均无明显影响。
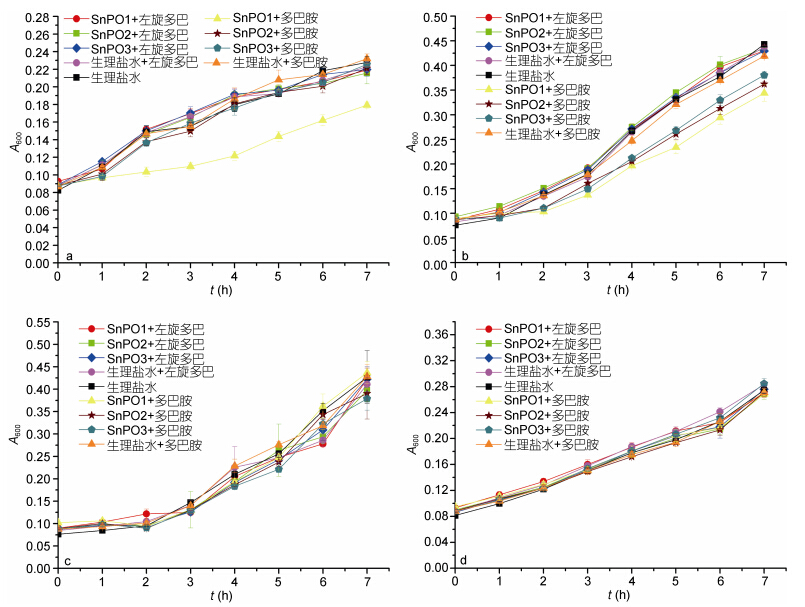 |
| 图 2 光棘球海胆PO氧化产物对G-细菌生长的影响Fig. 2 The effects of PO oxidation products on growth of Gram-negative bacteria a: 灿烂弧菌; b: 哈维氏弧菌; c: 假交替单胞菌; d: 希瓦氏菌 |
在受试的4株G+细菌中,光棘球海胆PO氧化产物对金黄色葡萄球菌和拟诺卡式菌有显著抗菌作用(图 3)。多巴胺对停乳链球菌有抑制作用,因此光棘球海胆PO与多巴胺的反应产物对停乳链球菌的抗菌作用无法判断。当以多巴胺为底物时,SnPO1氧化产物仅抑制金黄色葡萄球菌的生长,SnPO3氧化产物仅抑制拟诺卡式菌的生长,而SnPO2氧化产物对金黄色葡萄球菌和拟诺卡式菌的生长均有抑制作用; 以左旋多巴为底物时,SnPO2氧化产物对拟诺卡式菌的生长有抑制作用,SnPO1和SnPO3的氧化产物对4种G+细菌的生长无明显影响。
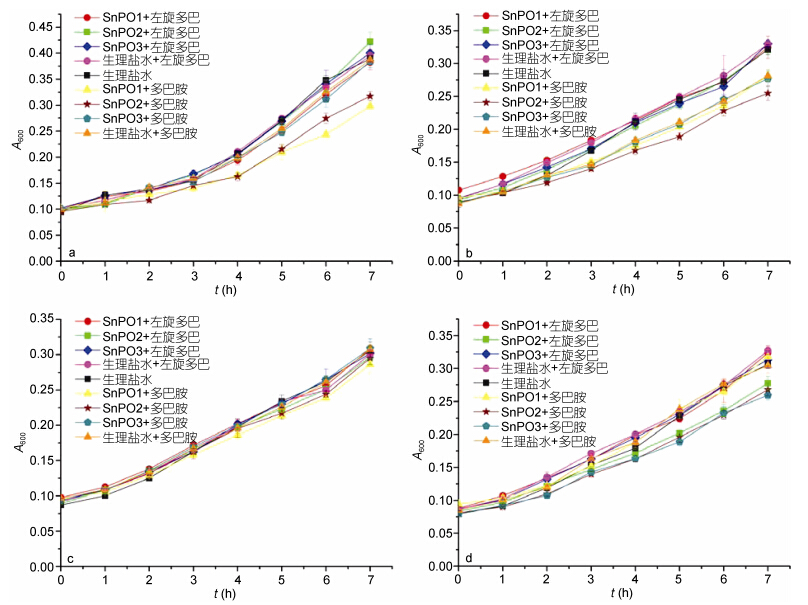 |
| 图 3 光棘球海胆PO氧化产物对G+细菌生长的影响Fig. 3 The effects of PO oxidation products on growth of Gram-positive bacteria a: 金黄色葡萄球菌; b: 停乳链球菌; c: 溶壁微球菌; d: 拟诺卡式菌 |
PO作为无脊椎动物体内的重要免疫因子,通过与底物反应生成的产物直接参与杀菌和抑菌过程(Bai et al,1997; Ballarin et al,1998; Cerenius et al,2004)。已有的研究表明,不同物种PO的氧化产物呈现不同的抗菌特性(Zhao et al,2007; Xing et al,2012; Jiang et al,2014),而海胆在养殖过程中经常受到细菌病害的影响(王斌等,2006; 周玮等,2008),因此了解光棘球海胆PO氧化产物的抗菌特性对通过免疫手段预防和控制海胆细菌病害具有重要意义。
不同于菲律宾蛤仔Ruditapes philippinarum、栉孔扇贝和大鳌虾Panulirus argus中检测到的单条PO带(Perdomo-Morales et al,2007; 蒋经伟等,2012; Xing et al,2012),在本研究中,作者从光棘球海胆体腔液上清中分离得到3种PO。光棘球海胆中3种PO的分子量非常小,而且在非变性聚丙烯酰胺凝胶中
与邻苯二酚反应分别呈现褐色、黄色和紫色的条带,与仿刺参中的结果(Jiang et al,2014)非常相似,表明光棘球海胆和仿刺参中的PO系统在进化上具有很高的同源性。以左旋多巴或多巴胺为底物时,光棘球海胆PO的氧化产物仅对哈维氏弧菌、灿烂弧菌、金黄色葡萄球菌和拟诺卡式菌有抑制作用,而对假交替单胞菌、希瓦氏菌和溶壁微球菌的生长无明显影响,表明光棘球海胆PO氧化产物具有窄谱抗菌活性,与栉孔扇贝和仿刺参中的结果相似(Xing et al,2012; Jiang et al,2014),不同于烟草天蛾和淡水龙虾PO氧化产物的广谱抗菌活性(Zhao et al,2007; Cerenius et al,2010)。在受试的G-细菌中,光棘球海胆PO氧化产物对弧菌有显著的抗菌作用,与太平洋牡蛎、栉孔扇贝和仿刺参等海洋无脊椎动物中的结果非常相似(Luna-Acosta et al,2011; Xing et al,2012; Jiang et al,2014)。由于弧菌是海洋无脊椎动物中最常见的致病菌之一,上述结果表明,PO氧化产物对弧菌的显著抗菌作用可能是海洋无脊椎动物PO免疫系统适应性进化的结果。光棘球海胆PO氧化产物还对部分G+细菌有抗菌作用,与栉孔扇贝中的结果明显不同。在栉孔扇贝中,PO氧化产物仅对部分G-细菌有抗菌作用,而对G+细菌的生长无明显影响(Xing et al,2012)。光棘球海胆PO和仿刺参PO在亚型组成和邻苯二酚显色反应上具有很高的相似性,然而在氧化产物抗菌谱上还是有显著的差异。光棘球海胆PO氧化产物显著抑制拟诺卡式菌的生长,而仿刺参PO氧化产物对拟诺卡式菌无明显的抗菌作用(Jiang et al,2014)。这一结果进一步证明,不同物种间PO氧化产物的抗菌谱是有明显差异的。此外,SnPO1氧化产物对灿烂弧菌、哈维氏弧菌和金黄色葡萄球菌有抑制作用,SnPO2氧化产物对哈维氏弧菌、金黄色葡萄球菌和拟诺卡式菌有抑制作用,而SnPO3氧化产物仅对哈维氏弧菌和拟诺卡式菌有抑制作用,表明同一物种的不同PO亚型之间,氧化产物的抗菌谱也存在差异,与仿刺参中报道的结果相似(Jiang et al,2014)。本研究还发现,多巴胺氧化产物对灿烂弧菌、哈维氏弧菌、金黄色葡萄球菌和拟诺卡式菌有抗菌作用,而左旋多巴氧化产物仅对拟诺卡式菌有抗菌作用,表明在光棘球海胆中PO与多巴胺反应产物的抗菌活力高于PO与左旋多巴的反应产物。在其他一些无脊椎动物如烟草天蛾、淡水龙虾、栉孔扇贝和仿刺参中也发现多巴胺氧化产物的抗菌活力高于左旋多巴氧化产物(Zhao et al,2007; Cerenius et al,2010; Xing et al,2012; Jiang et al,2014)。有报道认为多巴胺氧化产物与左旋多巴氧化产物抗菌活力的差异是由PO催化底物后生成产物的成分不同造成的,PO与多巴胺反应后生成二羟吲哚,二羟吲哚及其自氧化产物被证明具有很强的杀菌、抑菌作用,而PO与左旋多巴反应后生成多巴醌,多巴醌及其自氧化产物仅具有微弱抗菌作用(Nappi et al,1992; Zhao et al,2007)。上述推论可以从一定程度上解释多巴胺氧化产物与左旋多巴氧化产物的抗菌活性差异,然而该推论尚无法解释不同PO间多巴胺氧化产物在抗菌谱和抗菌特性上的差异,PO氧化产物的抗菌机制有待进一步研究。
致谢 拟诺卡式菌(Nocardiopsis sp.)由中国科学院大连化学物理研究所海洋生物产品工程组惠赠,谨致谢忱。| 王 斌, 李 岩, 李 霞等, 2006.虾夷马粪海胆"红斑病"病原弧菌特性及致病性.水产学报, 30(3): 371-376 |
| 王轶南, 刘学伟, 刘艳萍等, 2011.虾夷马粪海胆(Strongylocentrotus intermedius)体腔液的酚氧化酶活性分析.中国农业科技导报, 13(2): 116-120 |
| 吴 曙, 王淑红, 王艺磊等, 2009.软体动物和甲壳动物酚氧化酶的研究进展.动物学杂志, 44(5): 137-146 |
| 周 玮, 孙 俭, 王俊杰等, 2008.我国海胆养殖现状及存在问题.水产科学, 27(3): 151-153 |
| 蒋经伟, 邢 婧, 战文斌, 2012.菲律宾蛤仔(Ruditapes philippinarum)漆酶型酚氧化酶的纯化及特性分析.海洋与湖沼, 43(2): 294-298 |
| 湛垚垚, 黄显雅, 沈 妍等, 2013.不同性别光棘球海胆(Strongylocentrotus nudus)性腺蛋白质组差异分析.海洋与湖沼, 44(6): 1642-1647 |
| Aladaileh S, Nair S V, Raftos D A, 2007.Induction of phenoloxidase and other immunological activities in Sydney rock oysters challenged with microbial pathogen-associate molecular patterns.Fish & Shellfish Immunology, 23(6): 1196-1208 |
| Bai G X, Brown J F, Watson C et al, 1997.Isolation and characterization of phenoloxidase from egg masses of the gastropod mollusc, Biomphalaria glabrata.Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 118(2): 463-469 |
| Ballarin L, Cima F, Sabbadin A, 1998.Phenoloxidase and cytotoxicity in the compound ascidian Botryllus schlosseri.Developmental & Comparative Immunology, 22(5-6): 479-492 |
| Cerenius L, Babu R, Söderhäll K et al, 2010.In vitro effects on bacterial growth of phenoloxidase reaction products.Journal of Invertebrate Pathology, 103(1): 21-23 |
| Cerenius L, Lee B L, Söderhäll K, 2008.The proPO-system: pros and cons for its role in invertebrate immunity.Trends in Immunology, 29(6): 263-271 |
| Cerenius L, Söderhäll K, 2004.The prophenoloxidase-activating system in invertebrates.Immunological Reviews, 198(1): 116-126 |
| Jiang J W, Zhou Z C, Dong Y et al, 2014.In vitro antibacterial analysis of phenoloxidase reaction products from the sea cucumber Apostichopus japonicus.Fish & Shellfish Immunology, 39(2): 458-463 |
| Luna-Acosta A, Saulnier D, Pommier M et al, 2011.First evidence of a potential antibacterial activity involving a laccase-type enzyme of the phenoloxidase system in Pacific oyster Crassostrea gigas haemocytes.Fish & Shellfish Immunology, 31(6): 795-800 |
| Muñoz P, Meseguer J, Esteban M A, 2006.Phenoloxidase activity in three commercial bivalve species.Changes due to natural infestation with Perkinsus atlanticus.Fish & Shellfish Immunology, 20(1): 12-19 |
| Nappi A J, Vass E, Carton Y et al, 1992.Identification of 3, 4-dihydroxyphenylalanine, 5, 6-dihydroxyindole, and N-acetylarterenone during eumelanin formation in immune reactive larvae of Drosophila melanogaster.Archives of Insect Biochemistry and Physiology, 20(3): 181-191 |
| Perdomo-Morales P, Montero-Alejo V, Perera E et al, 2007.Phenoloxidase activity in the hemolymph of the spiny lobster Panulirus argus.Fish & Shellfish Immunology, 23(6): 1187-1195 |
| Söderhäll K, 1981.Fungal cell wallβ-1, 3-glucans induce clotting and phenoloxidase attachment to foreign surfaces of crayfish hemocyte lysate.Developmental & Comparative Immunology, 5(4): 565-573 |
| Söderhäll K, Cerenius L, 1998.Role of the prophenoloxidase-activating system in invertebrate immunity.Current Opinion in Immunology, 10(1): 23-28 |
| Xing J, Jiang J W, Zhan W B, 2012.Phenoloxidase in the scallop Chlamys farreri: Purification and antibacterial activity of its reaction products generated in vitro.Fish & Shellfish Immunology, 32(1): 89-93 |
| Zhao P C, Li J J, Wang Y et al, 2007.Broad-spectrum antimicrobial activity of the reactive compounds generated in vitro by Manduca sexta phenoloxidase.Insect Biochemistry and Molecular Biology, 37(9): 952-959 |
| Zhao P C, Lu Z Q, Strand M R et al, 2011.Antiviral, anti-parasitic, and cytotoxic effects of 5, 6-dihydroxyindole (DHI), a reactive compound generated by phenoloxidase during insect immune response.Insect Biochemistry and Molecular Biology, 41(9): 645-652 |
 2015, Vol. 46
2015, Vol. 46


