中国海洋湖沼学会主办。
文章信息
- 郭伟, 于仁成, 亢振军, 孔凡洲, 周名江. 2015.
- GUO Wei, YU Ren-Cheng, KANG Zhen-Jun, KONG Fan-Zhou, ZHOU Ming-Jiang. 2015.
- 绿硫细菌色素的高效液相色谱分析及其应用
- ANALYSIS ON PIGMENTS IN GREEN SULFUR BACTERIA WITH HIGH PERFORMANCE LIQUID CHROMATOGRAPHY AND THE APPLICATION
- 海洋与湖沼, 46(5): 1001-1009
- Oceanologia et Limnologia Sinica, 46(5): 1001-1009.
- http://dx.doi.org/10.11693/hyhz20141100323
-
文章历史
- 收稿日期: 2014-11-17
- 收修改稿日期: 2015-06-18
2. 中国科学院大学 北京 100049;
3. 钦州学院 钦州 535000
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Qinzhou University, Qinzhou 535000, China
绿硫细菌(green sulfur bacteria,简称GSB)是一类不产氧光合细菌(anoxygenic phototrophic bacteria),能够在无氧条件下利用光能同化二氧化碳合成有机物(Overmann,2001; Sakurai et al,2010)。在一些常年层化的淡水湖泊里,以及黑海等封闭海域,绿硫细菌与紫硫细菌(purple sulfur bacteria,另一类光合细菌)常常存在于光线能够到达的无氧且含有游离硫化氢的水体或沉积物表面,是无氧环境中重要的初级生产者。根据Overmann(2008)统计,在有绿硫细菌和紫硫细菌的湖泊中,这些光合细菌对初级生产力的贡献平均为28%,最高可达83%。在一些常年存在层化现象的湖泊中,它们甚至可以大量增殖,形成“菌华”(bacterial bloom)。目前,对于绿硫细菌和紫硫细菌的分类学、生理学和生态学方面的研究工作已有全面、系统的综述(Van Gemerden et al,1995; Overmann,2008)。
绿硫细菌含有独特的色素,随着高效液相色谱和色谱-质谱联用技术的发展,人们对于绿硫细菌色素的认识也在不断深入(Airs et al,2002; Glaeser et al,2002; Nishimori et al,2011)。根据绿硫细菌所含色素的差异,可以将绿硫细菌分为两类(Overmann,2008)。其中,绿色菌株主要含有细菌叶绿素d和绿硫菌烯(chlorobactene); 而褐色菌株主要含有细菌叶绿素e和异海绵烯(isorenieratene)。各种色素的化学结构如图 1所示。
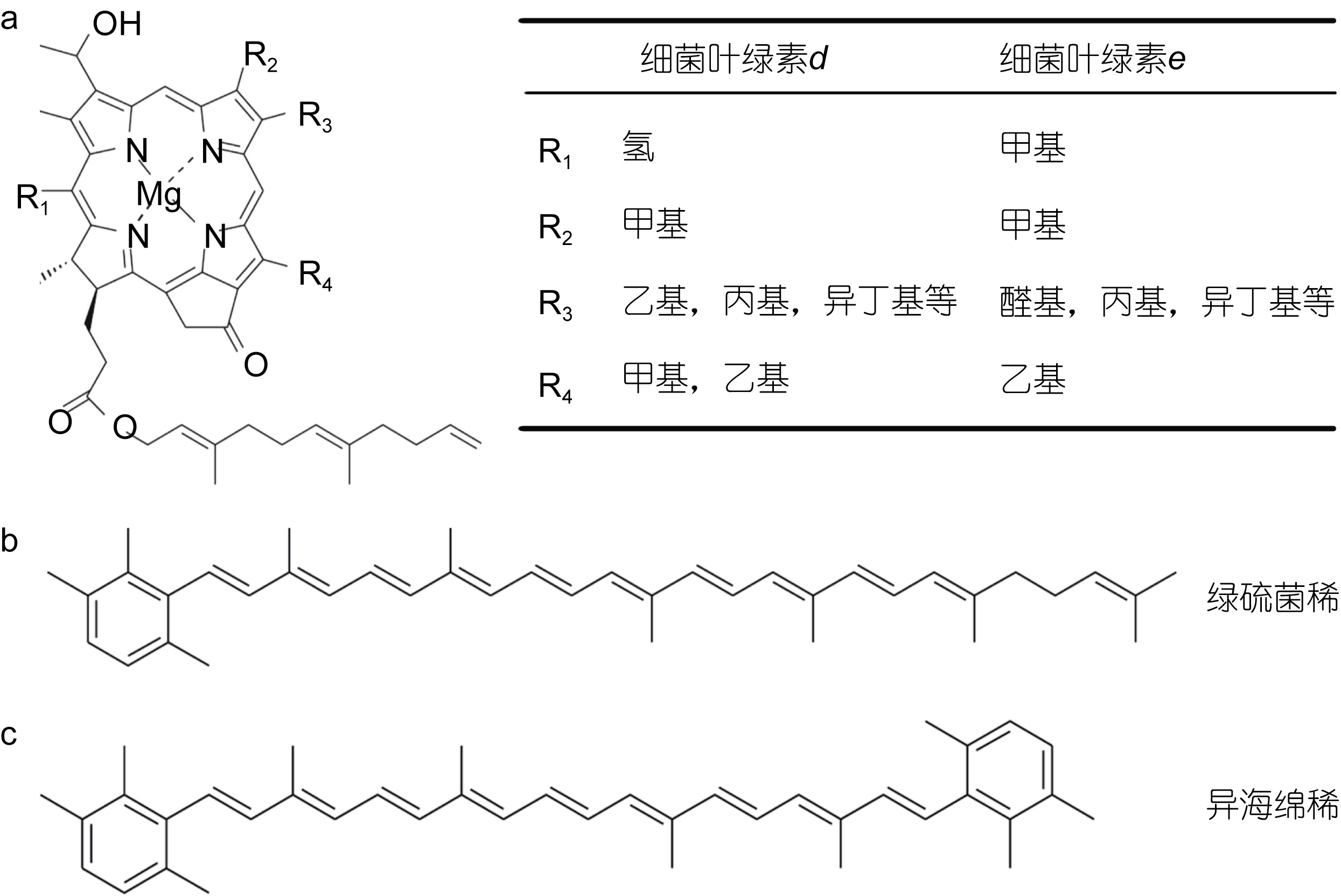 |
| 图 1 细菌叶绿素d、e(a),绿硫菌烯(b)和异海绵烯(c)的化学结构(引自Sinninghe Damsté et al,2006) Fig. 1 Chemical structure of bacteriochrolophyll d,e(a); chlorobactene(b); and isorenieratene(c)(from Sinninghe Damsté et al,2006) |
绿硫细菌能够在含有硫化氢的无氧真光层水体中大量生长,而且含有独特的色素,因此,绿硫细菌色素及其老化产物常被用来分析海洋、湖泊环境的真光层无氧事件(euphotic anoxia event)以及生态系统演变状况(Overmann,2008)。研究表明,显生宙时期海洋真光层中可能发生过多次大范围的水体无氧事件,与几次大规模的生物灭绝有密切联系。在这些研究中,绿硫细菌产生的异海绵烯及其衍化产物提供了重要的证据(Richoz et al,2012)。绿硫细菌色素不仅可用于指示地质年代上的海洋环境演变,也被用来研究近期水生生态系统中的无氧和缺氧问题。在美国、印度和日本,许多学者围绕淡水湖泊中绿硫细菌类群组成、分布特征及其与水体溶解氧和硫化氢分布的关系开展了系统研究(如Kurian,2012)。除淡水湖泊外,在黑海深层的无氧水体中也存在绿硫细菌: 通过对黑海海域沉积物中异海绵烯等相关色素的分析,发现黑海的真光层无氧问题可追溯至6000年前(Repeta,1993)。尤为令人关注的是,Chen等(2001)在存在季节性底层水体缺氧现象的墨西哥湾北部陆架区发现了绿硫细菌产生的细菌叶绿素e及其降解产物脱镁细菌叶绿素e,为该海域缺氧问题提供了确切无疑的证据。同时,根据沉积物柱状样中细菌叶绿素e含量的变化,分析了墨西哥湾海域缺氧区的发展过程。这表明,绿硫细菌色素有可能作为一类重要的指标,指示水体缺氧现象的发生和发展过程(Gooday,2009)。
在长江口邻近海域,底层水体缺氧问题近年来不断加剧,直接威胁该海域生态系统和渔业资源。观测发现,一方面缺氧区面积不断扩展; 另一方面,底层水体中最低溶解氧水平也在不断下降(Wang,2009)。对此,本研究培养了两种典型的绿硫细菌,并尝试通过高效液相色谱技术对其所产色素进行分析; 应用这一方法及得到的细菌叶绿素d,e和异海绵烯的吸收光谱,对长江口邻近海域缺氧区表层沉积物样品中的绿硫细菌色素进行了初步分析。
1 材料与方法 1.1 绿硫细菌培养本研究采用的两株绿硫细菌购自德国莱布尼茨研究所。其中,绿硫细菌Chlorobium phaeovibrioides(DSM269)为褐色菌株,Prosthecochloris vibrioformis(DSM260)为绿色菌株(Gloe et al,1975; Borrego et al,1994)。两株细菌分别采用29号培养基(配方见表 1)和40号培养基进行培养。与29号培养基相比,40号培养基仅NaCl含量增加1%,其余保持不变。培养基配制过程中,先将溶液A高压灭菌45min; 冷却至室温后,在强搅拌条件下充入高纯CO2至饱和(30min)。然后加入表 1中所列出的溶液B、C(5mL)、D(5mL)、E和F(30mL),并持续通入高纯氮气,避免氧气污染。用灭菌的HCl和Na2CO3溶液(浓度均为2mol/L)调节培养基pH为6.8。最后,培养基中加入1mg/mL刃天青钠溶液(1mL/L培养基)作为氧化还原电位指示剂(Hungate,1969)。
| 溶液名称 | 组成 | 浓度 | 配制方法 |
| 溶液A | CaCl2·2H2O | 1.25g | 高压灭菌45min; 冷却至室温后, 在强磁力搅拌条件下充高纯CO2至饱和。 |
| KH2PO4 | 1.70g | ||
| NH4Cl | 1.70g | ||
| KCl | 1.70g | ||
| MgSO4·7H2O | 15g | ||
| NaCl | 100g | ||
| 蒸馏水 | 4000mL | ||
| 溶液B | 蒸馏水 | 860mL | 瓶口用棉花塞住经高压蒸汽灭菌, 在N2条件下冷却至室温。 |
| 溶液C | VB12溶液(0.002%) | 5mL | 溶液经过滤灭菌。 |
| 溶液D | HCl (25%) | 7.7mL | 121oC高压灭菌15min。 |
| FeSO4·7H2O | 1.50g | ||
| ZnCl2 | 70mg | ||
| MnCl2·4H2O | 100mg | ||
| H3BO3 | 300mg | ||
| CoCl2·6H2O | 190mg | ||
| CuCl2·2H2O | 2.0mg | ||
| NiCl2·6H2O | 24.0mg | ||
| Na2MoO4·2H2O | 36.0mg | ||
| 蒸馏水 | 1000mL | ||
| 溶液E | NaHCO3 | 7.5g | 溶液中充CO2至饱和, 然后过滤灭菌到消毒密闭的培养容器中。 |
| 蒸馏水 | 100mL | ||
| 溶液F | Na2S·9H2O | 10g | 溶液充N2至饱和, 密封后经高压灭菌。 |
| 蒸馏水 | 100mL | ||
| 还原剂补充液 | Na2S·9H2O | 1.5g | 溶液充N2至饱和, 密封后经高压灭菌。 |
| 蒸馏水 | 100mL |
菌株培养参照莱布尼茨研究所推荐方法,采用Hungate型厌氧管培养。厌氧管管塞采用丁基橡胶材料,并及时更换,避免漏气。菌悬液分装量控制在厌氧管长度1/3以下。厌氧管置于恒温培养箱中进行培养,培养温度为25°C,光照强度为2000 lx。培养期间注意观察菌悬液颜色,并及时补充还原剂。当菌株长到一定密度时进行分接,待获得足量菌悬液后,以0.22μm玻璃纤维滤膜过滤收集培养的细菌,并将滤膜置于超低温冰箱中保存,用于色素提取和分析。
1.2 绿硫细菌色素提取与分析对绿硫细菌色素的提取和分析参照本实验室的藻类色素提取和分析方法进行(Kong et al,2012)。将过滤收集的细菌膜样在黑暗中解冻5min,并剪成细条,放入1.5mL样品瓶中。加入1500μL甲醇,冰浴中超声处理5min。上清液用0.22μm PTFE滤头过滤后,取700μL至样品瓶内,并加入140μL超纯水,振荡混匀后立即用于分析。所有操作过程均在弱光环境下进行。
色素方法主要参照Zapata等建立的方法(Zapata et al,2000),对分析过程简述如下: 采用Waters e2695高效液相色谱系统,应用Waters Symmetry C8色谱柱(4.6×150mm,3.5μm)分离色素,柱温控制在27°C。采用二元梯度洗脱程序,流动相A为甲醇/乙腈/吡啶水溶液(50:25:25,V/V/V),其中吡啶水溶液中含有2%吡啶,并以乙酸调整pH值至5.0; 流动相B为甲醇/乙腈/丙酮溶液(20:60:20,V/V/V)。梯度洗脱过程参考Kong等(2012),洗脱液流速为1mL/min。样品室温度4°C,进样量100μL。细菌叶绿素e和异海绵烯分析时DAD检测波长470nm,细菌叶绿素d和绿硫菌烯分析时DAD检测波长425nm,所有分析均同时扫描记录300—750nm的光谱信息。通过与以往文献中报道的细菌叶绿素d、细菌叶绿素e、绿硫菌烯和异海绵烯的吸收光谱和保留时间进行对比,对细菌样品中的色素组分进行鉴别。
1.3 沉积物样品的采集、处理和分析沉积物样品于2011年5月采自长江口邻近海域,采样站位如图 2所示。沉积物样品以箱式采泥器采集,刮取采泥器中央未扰动的表层沉积物样品(1—3cm)用于色素分析。表层样品为灰黑色软泥,采集后立即放入-20°C冷冻保存。色素分析方法如1.2所示,提取方法如下。
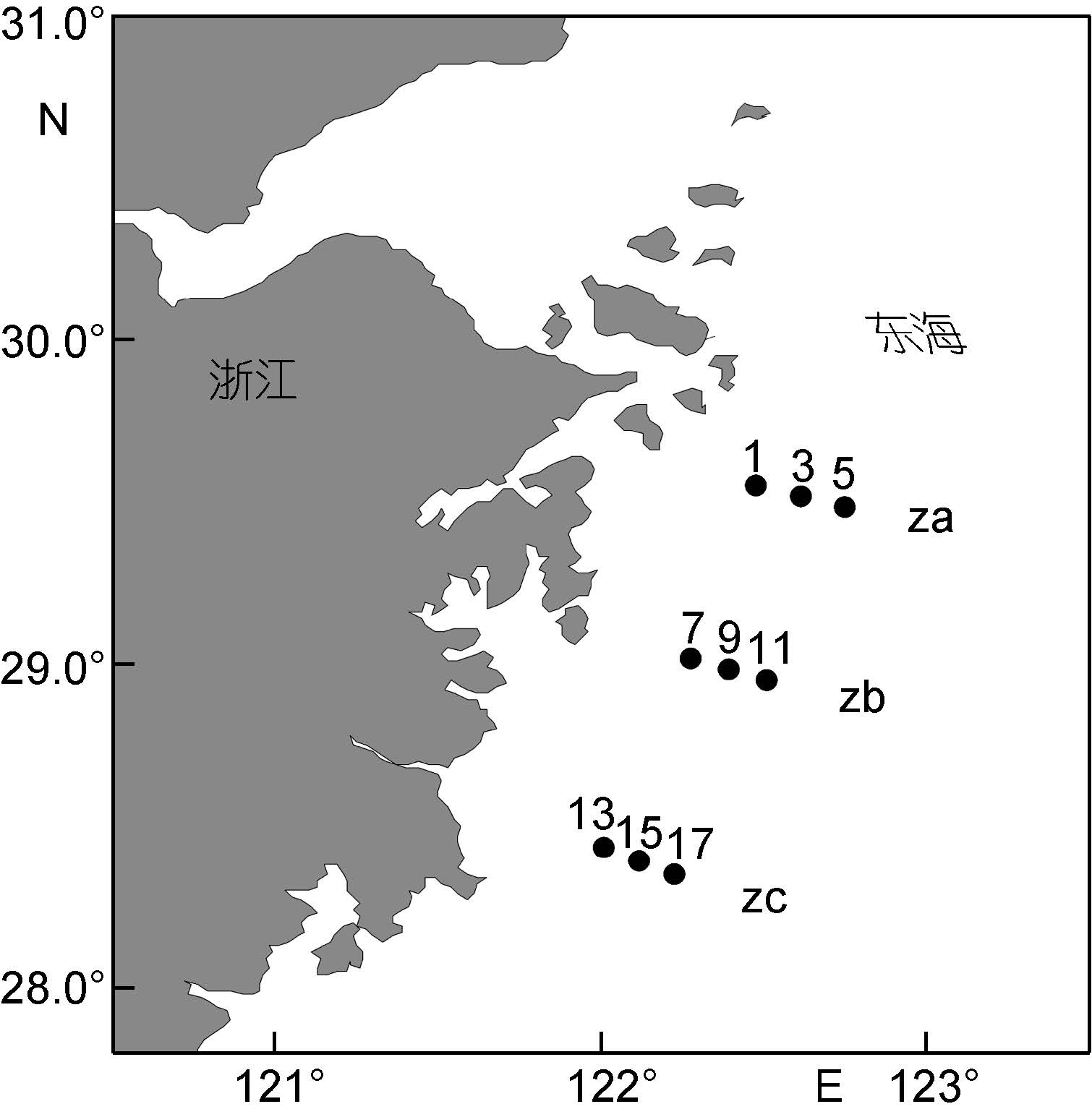 |
| 图 2 长江口邻近海域采样站位示意图 Fig. 2 The sampling deployment in the sea area adjacent to the Changjiang River mouth 图中za, zb, zc为调查断面, 数字代表调查站位 |
将沉积物样品冷冻干燥,研磨后过100目筛。准确称取2g研磨样品置于10mL玻璃离心管中,加入3mL 100%甲醇,同时加入100μL内标(8'-阿朴-β,ψ-胡萝卜醛),于冰浴中超声处理5min,之后进行过夜提取。12h后,将样品冷藏离心(5000r/min,5min,4°C),取上清液。沉淀以3mL甲醇冰浴超声萃取5min,收集萃取液,重复萃取三次。收集全部上清液用0.22μm PTFE滤头过滤后,用柔和氮气气流吹干,加入1mL甲醇复溶。取700μL样品至样品瓶内,并加入140μL超纯水,震荡混匀后立即用于分析。浮游植物色素的高效液相色谱分析方法如1.2所述,检测波长为440nm,同时扫描记录300—750nm的光谱信息。沉积物样品中的浮游植物色素通过与购买的色素标准品(购自丹麦DHI公司)对比进行确认,绿硫细菌色素则通过在特定检测波长下与两株细菌提取液中的相应色素对比,并参考数据库信息(http://lipidbank.jp)进行鉴别。
2 实验结果 2.1 菌株Chlorobium phaeovibrioides(DSM269)所产色素分析将绿硫细菌DSM269菌株培养5—7d后,细菌培养液呈黄褐色时,收集细菌进行色素分析,所得色谱图如图 3所示。检测到的细菌色素集中出现在24— 41min时间段内。根据每一色谱峰的吸收光谱图,并参照以往绿硫细菌色素的有关文献(Gloe et al,1975; Hurley et al,1991; Repeta,1993; Borrego et al,1994; Takaichi,2000),对色素组分进行了初步鉴别。可以看出,DSM269菌株色素组成分成明显的三簇。第一簇各组分主要出现在24—27min,色素吸光度值较高,且具有基本相同的吸收光谱特征(图 4a),依据其吸收光谱特征可以确定为细菌叶绿素e的同系物; 第二簇各组分出现在保留时间29—35min的时间段内,色素吸光度值略低,其吸收光谱特征基本一致且与第一簇各组分相似(表 2),应为细菌叶绿素e的衍生物(图 4b)。第三簇出现在37—42min,两个主要组分的吸收光谱基本一致,应为异海绵烯化合物(图 4c)。
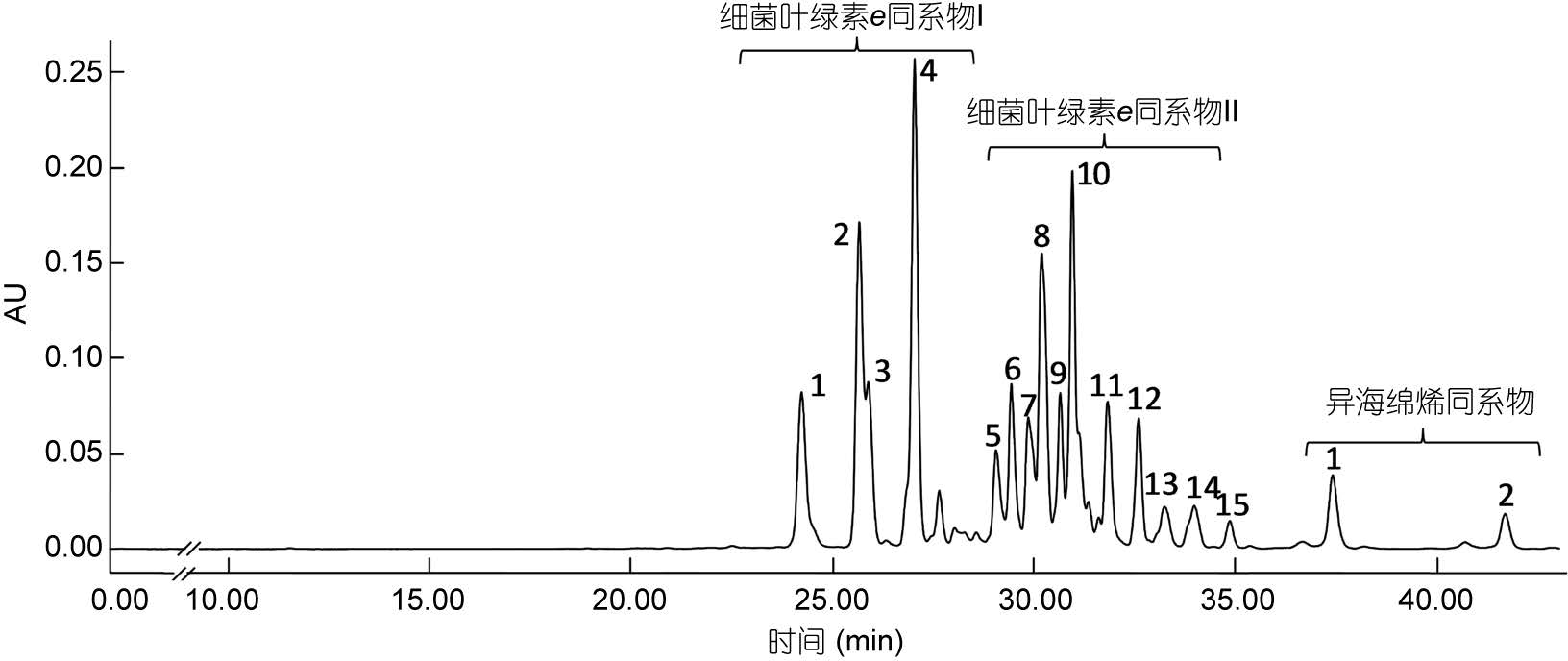 |
| 图 3 菌株Chlorobium phaeovibrioides (DSM269)所产色素的高效液相色谱图(检测波长470nm) Fig. 3 Chromatogram of pigments extracted from Chlorobium phaeovibrioides (DSM269) (detection wave length: 470nm) |
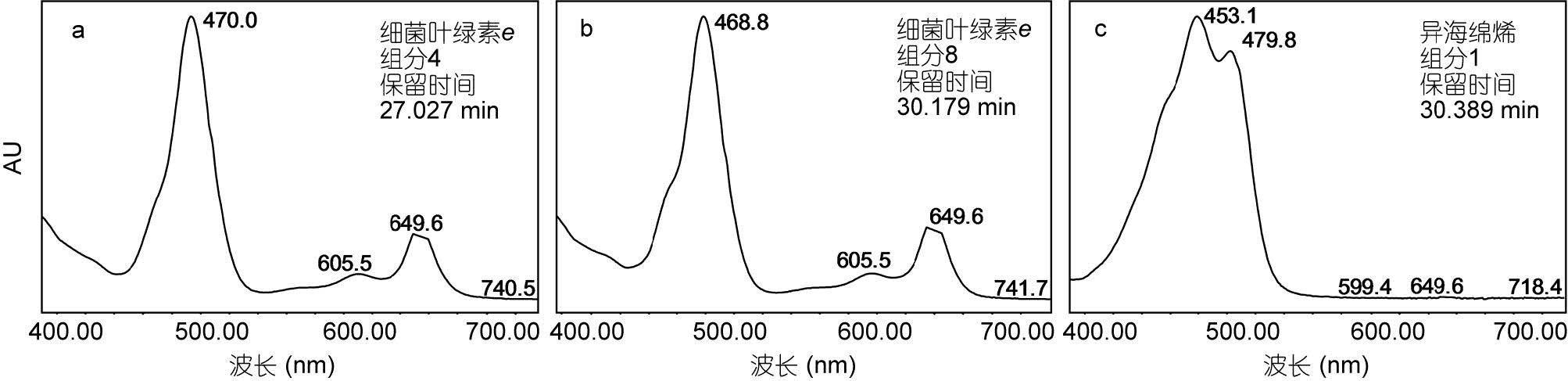 |
| 图 4 菌株Chlorobium phaeovibrioides (DSM269)所产典型色素的吸收光谱图 Fig. 4 Absorption spectra of pigments extracted from Chlorobium phaeovibrioides (DSM269) a: 细菌叶绿素e组分4; b: 细菌叶绿素e同系物Ⅱ组分9; c: 异海绵烯组分1 |
| 色素组分名称 | 保留时间(min) | 最大吸收波长(nm) |
| 细菌叶绿素e同系物I | ||
| 1 | 24.22 | 470.0, 605.5, 649.6 |
| 2 | 25.65 | 470.0, 606.7, 649.6 |
| 3 | 25.90 | 470.0, 606.7, 649.6 |
| 4 | 27.02 | 470.0, 605.5, 649.6 |
| 细菌叶绿素e 同系物Ⅱ | ||
| 5 | 29.04 | 468.8, 600.6, 649.6 |
| 6 | 29.42 | 468.8, 604.3, 649.6 |
| 7 | 29.84 | 468.8, 605.5, 649.6 |
| 8 | 30.18 | 468.8, 605.5, 649.6 |
| 9 | 30.64 | 468.8, 603.0, 649.6 |
| 10 | 30.93 | 468.8, 604.3, 649.6 |
| 11 | 31.81 | 468.8, 603.0, 649.6 |
| 12 | 32.58 | 468.8, 605.5, 649.6 |
| 13 | 33.22 | 467.6, 605.5, 649.6 |
| 14 | 33.96 | 468.8, 603.0, 649.6 |
| 15 | 34.84 | 468.8, 603.0, 649.6 |
| 异海绵烯 | ||
| 1 | 37.39 | 453.1, 479.8 |
| 2 | 41.66 | 453.1, 478.6 |
绿硫细菌DSM260菌株培养3—5d后,待细菌培养液呈黄绿色时,收集细菌进行色素分析,色谱图如图 5所示。检测到的细菌色素集中出现在从26—35min时间段内。如图 6和表 3所示,DSM260菌株所产色素吸收光谱特征相似,主要为细菌叶绿素d的同系物。
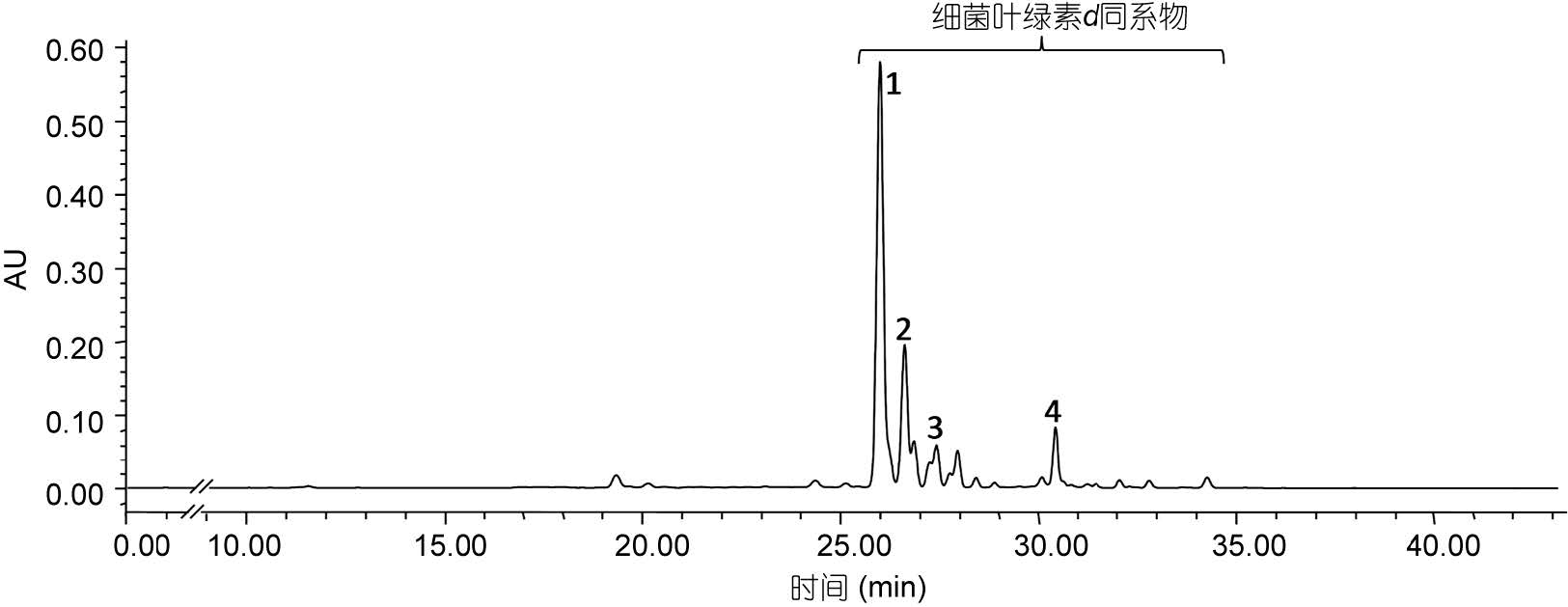 |
| 图 5 菌株Prosthecochloris vibrioformis (DSM260)所产色素的高效液相色谱图(检测波长425nm) Fig. 5 Chromatogram of pigments extracted from Prosthecochloris vibrioformis(DSM260) (detection wave length: 425nm) |
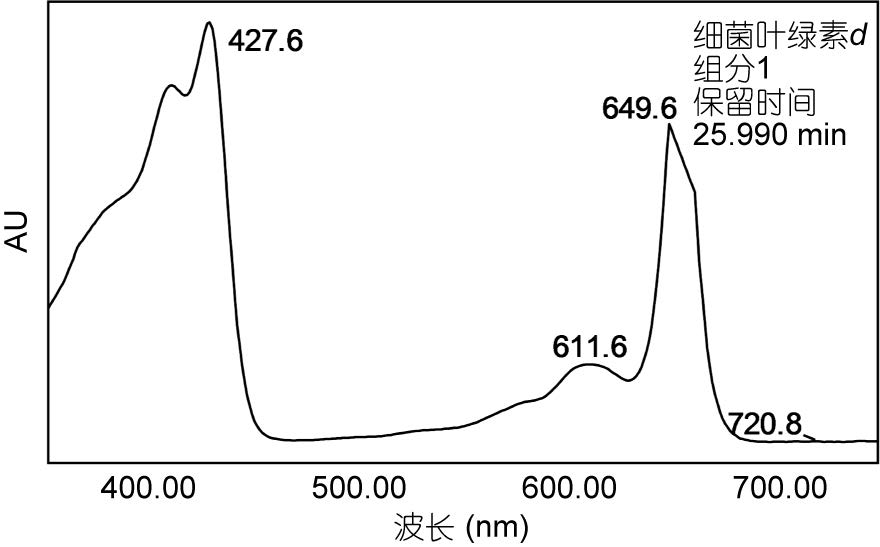 |
| 图 6 菌株Prosthecochloris vibrioformis (DSM260)所产典型色素的吸收光谱图 Fig. 6 Absorption spectrum of a pigment extracted from Prosthecochloris vibrioformis (DSM260) |
| 色素组分名称 | 保留时间(min) | 最大吸收波长(nm) |
| 细菌叶绿素d同系物 | ||
| 1 | 25.991 | 427.6, 611.6, 649.6 |
| 2 | 26.604 | 433.7, 666.8, 633.0 |
| 3 | 27.420 | 427.6, 610.4, 649.6 |
| 4 | 30.410 | 410.7, 611.6, 649.6 |
对长江口邻近海域采集的表层沉积物样品进行了分析(图 7),在样品中检测到叶绿素c2,多甲藻素、岩藻黄素、甲藻黄素、别藻黄素、硅藻黄素、玉米黄素、叶黄素、叶绿素a、b-胡萝卜素等常见的浮游植物色素。然而,在关注的保留时间段内,几个色谱峰的吸收光谱明显有别于细菌叶绿素d、e和异海绵烯,未检测到相应的绿硫细菌色素。
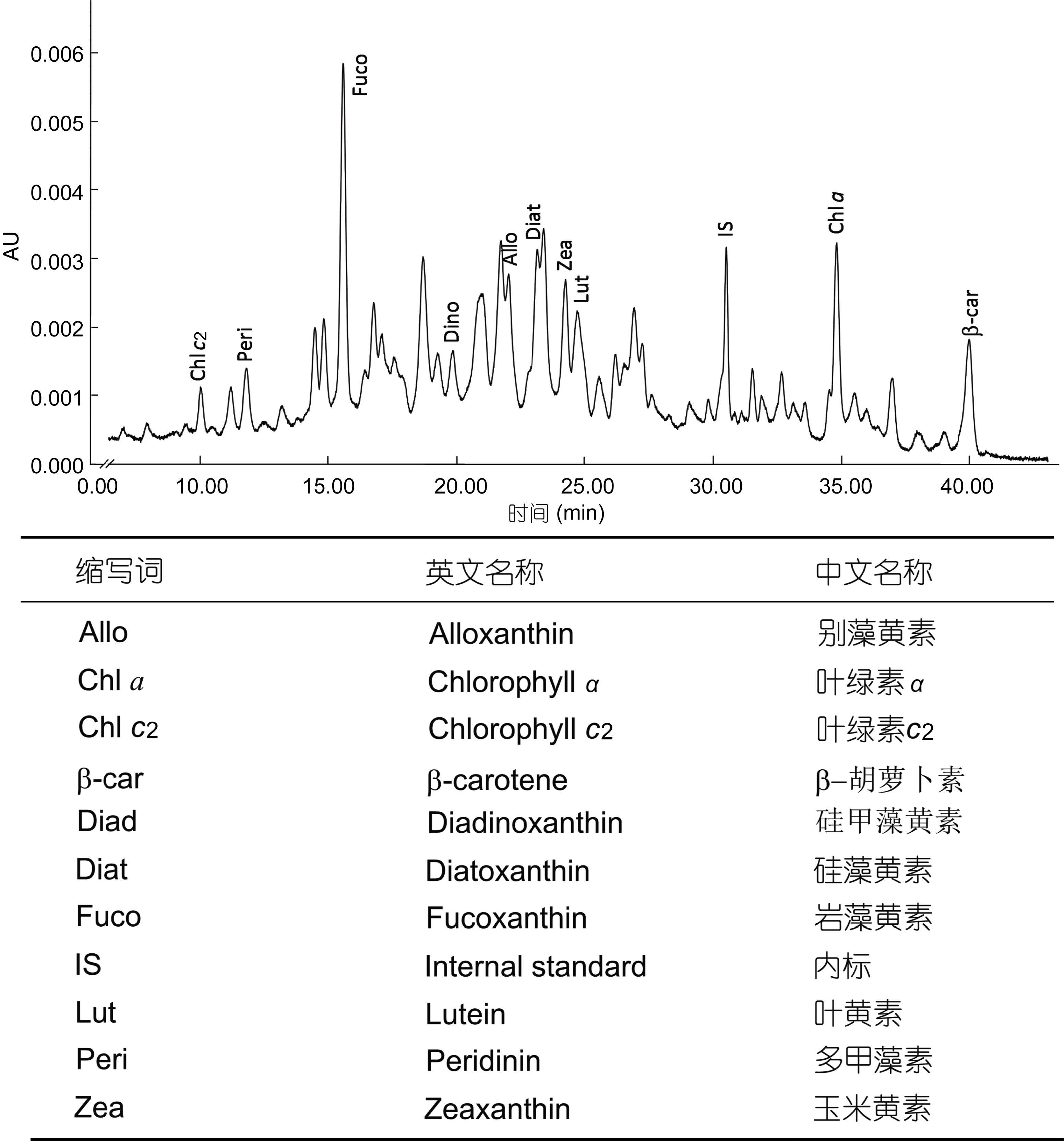 |
| 图 7 长江口邻近海域表层沉积物色素分析的高效液相色谱图(检测波长440nm) Fig. 7 Chromatogram of pigments extracted from a surface sediment sample collected from the sea area adjacent to the Changjiang River mouth (detection wave length: 440nm) |
绿硫细菌色素,特别是异海绵烯,能够指示水体真光层无氧事件,因此在存在无氧环境的海洋(如黑海)和淡水湖泊中,绿硫细菌及其色素研究受到密切关注。而Chen等(2001)对墨西哥湾北部海域的研究表明,绿硫细菌色素有可能作为一类重要的化学指标用于分析现代底层水体缺氧现象的演变过程。然而,绿硫细菌色素的分析受到许多因素限制,其中最突出的是缺少细菌叶绿素d、细菌叶绿素e、绿硫菌烯、异海绵烯等色素的标准品。针对这一问题,我们从莱布尼茨研究所购置了绿硫细菌菌株,并以实验室成熟的高效液相色谱色素分析方法分析其所产色素,基本明确了细菌叶绿素d、细菌叶绿素e、异海绵烯等几类主要色素的保留时间和吸收光谱特征。与以往文献相比,色素的吸收光谱特征基本一致,而保留时间变化较大。通过分析,为进一步应用该高效液相色谱方法分析缺氧海区绿硫细菌色素的状况提供了依据。
尽管本文采用的色素分析方法系针对浮游植物色素设计和优化,但从分析结果来看该方法对细菌色素同样具有良好分析能力,在两种绿硫细菌中检测到了细菌叶绿素e同系物I组分4种,同系物II组分11种,细菌叶绿素d组分4种,与之前其它高效液相色谱分析方法的检测结果基本吻合(Borrego et al,1994; Airs et al,2001)。在以往研究中,通过结合液相色谱-质谱联用技术,初步确认了几种绿硫细菌所产的色素成分。Airs等(2002)将一株绿硫细菌C. phaeobacteroides中检测到的四种细菌叶绿素e组分确定为[乙基,甲基]、[乙基,乙基]、[丙基,乙基]、[异丁基,乙基]取代的细菌叶绿素e。但是,考虑到不同菌种、菌株之间所产色素可能存在差异,以及高效液相色谱技术自身在定性分析能力方面的限制,本研究没有对检测到的细菌色素逐一进行确认,仅按照洗脱顺序对主要色素成分进行了分类和编号。在今后的研究中,将液-质联用方法应用于绿硫细菌色素分析,有望提供更精确、可靠的分析结果。
3.2 以绿硫细菌色素作为标志物研究长江口邻近海域缺氧问题在对近海缺氧区的研究中,由于缺少长期、连续的观测资料,很难对缺氧区的演变情况进行系统分析。因此,利用沉积物中的生物或化学标志物来反演缺氧问题的发展历程,对于了解缺氧区环境与生态系统的演变过程和发展趋势非常重要。包括绿硫细菌色素在内的很多标志物可以反映水体缺氧环境的长期变化情况(Hodgson et al,1998; Itoh et al,2003; Gooday et al,2009)。
在我国近海,长江口邻近海域底层水体的季节性缺氧现象最为严重。早在1959年的海洋普查中即发现,夏季海水底层溶解氧(DO)低值区浓度仅有2.57mg/L(顾宏堪,1980)。近20年来,在长江口邻近海域多次观测到大范围的底层水体缺氧区。1999年8月,在调查中发现缺氧区的影响范围为13700km2(DO<2mg/L)(Li et al,2002)。2003年夏季,调查发现长江口东南部海域存在缺氧区,影响范围达12000km2(Chen et al,2007)。2006年夏季,东海西部海域发现缺氧区的影响范围超过20000km2(Wei et al,2007)。同时,底层水体的溶解氧水平也呈现出持续下降态势。对长江口北侧32°N断面的长期调查(1974—1995)发现,从1974年至1995年,调查断面不同水层溶解氧水平有明显降低。近年来的观测结果多在1mg/L左右(Ning et al,2011)。
尽管长江口邻近海域的缺氧问题非常突出,但通过沉积物中的标志物来反演缺氧区演变过程的研究仍然较少。Li等(2011)根据沉积物中有孔虫类化石的分析结果,认为长江口邻近海域底层水体缺氧现象加剧,表明了开展此类研究的必要性。在常用的各类化学和生物标志物中,绿硫细菌和紫硫细菌的色素是无氧和缺氧环境的特异性标志物(Sinninghe Damsté et al,2006),但是两类细菌所含色素及其对光照的适应特征有明显差别。通常紫硫细菌对光照的需求较高,而绿硫细菌对光照的需求较低,可以在水深达数十米的海水中存在。在黑海深层水体中的硫化氢跃层区,由于绿硫细菌对低光照的适应性,尽管光线很弱,也能够达到一定丰度。在墨西哥湾北部海域,在表层沉积物中也检测到了绿硫细菌产生的细菌叶绿素e。因此,在本文研究中,我们尝试将高效液相色谱技术应用于绿硫细菌典型色素的分析,并初步检测了长江口邻近海域缺氧区沉积物中绿硫细菌色素的存在状况。
对长江口南部海域缺氧区表层沉积物进行初步分析,未能检测到绿硫细菌色素。这可能是受到高效液相色谱方法本身的限制,尽管高效液相色谱搭配光电二极管阵列检测器具有一定的定性分析能力,但是从分析结果来看,表层沉积物中的色素组成极为复杂,而且存在较为严重的基质干扰现象,含量较低的色素很难被检测到。与高效液相色谱方法相比,高灵敏度、高特异性的液-质联用技术在沉积物中细菌色素检测方面更具应用潜力。此外,细菌色素稳定性差异很大,异海绵烯等类胡萝卜素能够存在较长时间,常用于地质年代海洋真光层无氧事件的分析。与之相比,细菌叶绿素容易分解,很难长期存在。研究发现,并非所有绿硫细菌褐色菌株都会同时产生细菌叶绿素e和异海绵烯,有的菌株只能产生细菌叶绿素e(Meyer et al,2011)。在墨西哥湾北部陆架区的研究中就仅检测到细菌叶绿素e及其降解产物(Chen et al,2001)。稳定性较差的细菌叶绿素e很有可能会在水体中降解,因而很难检测到。尽管目前尚未在长江口邻近海域沉积物中检测到绿硫细菌色素,但应当看到,长江口邻近海域底层水体缺氧问题正在加剧。细菌色素作为一类能够反映底层水体溶解氧状况、特别是无氧事件的标志物,应当给予充分关注。
4 结论绿硫细菌色素及其衍化产物可以作为标志物,指示水体真光层的无氧事件以及水生生态系统在缺氧环境的演变过程。本文应用高效液相色谱分析手段,对两种典型的绿硫细菌所产色素进行了分析,获得了细菌叶绿素d、细菌叶绿素e和异海绵烯等特征色素的保留时间和特征吸收光谱。依据上述结果,对底层水体缺氧问题突出的长江口南部邻近海域表层沉积物样品进行了初步分析,但未检测到绿硫细菌色素。考虑到长江口邻近海域底层水体缺氧问题正在不断加剧,因此绿硫细菌色素仍可作为一类潜在的指标,用于研究长江口邻近海域底层水体缺氧程度和演变状况。
| 顾宏堪, 1980.黄海溶解氧垂直分布的最大值.海洋学报, 2(2):70-79 |
| Airs R L, Atkinson J E, Keely B J, 2001. Development and application of a high resolution liquid chromatographic method for the analysis of complex pigment distributions. Journal of Chromatography A, 917(1-2):167-177 |
| Airs R L, Keely B J, 2002. Atmospheric pressure chemical ionisation liquid chromatography/mass spectrometry of bacteriochlorophylls from Chlorobiaceae:characteristic fragmentations. Rapid Communications in Mass Spectrometry, 16(5):453-461 |
| Borrego C M, Garcia-Gil L J, 1994. Separation of bacteriochlorophyll homologues from green photosynthetic sulfur bacteria by reversed-phase HPLC. Photosynthesis Research, 41(1):157-164 |
| Chen C C, Gong G C, Shiah F K, 2007. Hypoxia in the East China Sea:one of the largest coastal low-oxygen areas in the world. Marine Environmental Research, 64(4):399-408 |
| Chen N H, Bianchi T S, McKee B A et al, 2001. Historical trends of hypoxia on the Louisiana shelf:application of pigments as biomarkers. Organic Geochemistry, 32(4):543-561 |
| Glaeser J, Bañeras L, Rütters H et al, 2002. Novel bacteriochlorophyll e sturctures and species variability of pigment composition in green sulfur bacteria. Archives of Microbiology, 177(6):475-485 |
| Gloe A, Pfennig N, Brockmann H Jr et al, 1975. A new bacteriochlorophyll from brown-colored chlorobiaceae. Archives of Microbiology, 102(1):103-109 |
| Gooday A J, Jorissen F, Levin L A et al, 2009. Historical records of coastal eutrophication-induced hypoxia. Biogeosciences, 6(8):1707-1745 |
| Hodgson D A, Wright S W, Tyler P A et al, 1998. Analysis of fossil pigments from algae and bacteria in meromictic Lake Fidler, Tasmania, and its application to lake management. Journal of Paleolimnology, 19(1):1-22 |
| Hungate R E, 1969. A roll tube method for cultivation of strict anaerobes. In:Norris J R, Ribbons D W eds. Methods in Microbiology. New York:Academic Press, 3B:117-132 |
| Hurley J P, Watras C J, 1991. Identification of bacteriochlorophylls in lakes via reverse-phase HPLC. Limnology and Oceanography, 36(2):307-315 |
| Itoh N, Tani Y, Nagatani T et al, 2003. Phototrophic activity and redox condition in Lake Hamana, Japan, indicated by sedimentary photosynthetic pigments and molybdenum over the last 250 years. Journal of Paleolimnology, 29(4):403-422 |
| Kong F Z, Yu R C, Zhang Q C et al, 2012. Pigment characterization for the 2011 bloom in Qinhuangdao implicated "brown tide" events in China. Chinese Journal of Oceanology and Limnology, 30(3):361-370 |
| Kurian S, Roy R, Repeta D J et al, 2012, Seasonal occurrence of anoxygenic photosynthesis in Tillari and Selaulim reservoirs, Western India. Biogeosciences, 9(7):2485-2495 |
| Li D J, Zhang J, Huang D J et al, 2002. Oxygen depletion off the Changjiang(Yangtze River) Estuary. Science in China Series D:Earth Sciences, 45(12):1137-1146 |
| Li X X, Bianchi T S, Yang Z S et al, 2011. Historical trends of hypoxia in Changjiang River estuary:Applications of chemical biomarkers and microfossils. Journal of Marine Systems, 86(3-4):57-68 |
| Meyer K M, Macalady J L, Fulton J M et al, 2011. Carotenoid biomarkers as an imperfect reflection of the anoxygenic phototrophic community in meromictic Fayetteville Green Lake. Geobiology, 9(4):321-329 |
| Ning X, Lin C, Su J et al, 2011. Long-term changes of dissolved oxygen, hypoxia, and the responses of the ecosystems in the East China Sea from 1975 to 1995. Journal of Oceanography, 67(1):59-75 |
| Nishimori R, Mizoguchi T, Tamiaki H et al, 2011. Biosynthesis of unnatural bacteriochlorophyll c derivatives esterified with α, ω-diols in the green sulfur photosynthetic bacterium Chlorobaculum tepidum. Biochemistry, 50(36):7756-7764 |
| Overmann J, 2001. Green sulfur bacteria. In:Boone D R, Castenholz R W, Garrity G M eds. Bergey's Manual of Systematic Bacteriology. 2nd ed. New York:Springer, 601-623 |
| Overmann J, 2008. Ecology of phototrophic sulfur bacteria. In:Hell R. Dahl C, Knaff D et al eds. Sulfur metabolism in phototrophic organisms. Advance in Photosynthesis and Respiration. New York:Springer, 27:375-396 |
| Repeta D J, 1993. A high resolution historical record of Holocene anoxygenic primary production in the Black Sea. Geochimica et Cosmochimica Acta, 57(17):4337-4342 |
| Richoz S, Van De Schootbrugge B, Pross J et al, 2012. Hydrogen sulphide poisoning of shallow seas following the end-Triassic extinction. Nature Geoscience, 5(9):662-667 |
| Sakurai H, Ogawa T, Shiga M et al, 2010. Inorganic sulfur oxidizing system in green sulfur bacteria. Photosynthesis Research, 104(2-3):163-176 |
| Sinninghe Damsté J S, Schouten S, 2006. Biological markers for anoxia in the photic zone of the water column. In:Volkman J K ed. Marine Organic Matter:Biomarkers, Isotopes and DNA. The Handbook of Environmental Chemistry. Berlin:Springer, 2N:127-163 |
| Takaichi S, 2000. Characterization of carotenes in a combination of a C18 HPLC column with isocratic elution and absorption spectra with a photodiode-array detector. Photosynthesis Research, 65(1):93-99 |
| Van Gemerden H, Mas J, 1995. Ecology of phototrophic sulfur bacteria. In:Blankenship R E, Madigan M T, Bauer C E eds. Anoxygenic Photosynthetic Bacteria. Advances in Photosynthesis and Respiration. Dordercht:Kluwer Academic Publishers, 2:49-85 |
| Wang B D, 2009. Hydromorphological mechanisms leading to hypoxia off the Changjiang Estuary. Marine Environmental Research, 67(1):53-58 |
| Wei H, He Y C, Li Q J et al, 2007. Summer hypoxia adjacent to the Changjiang Estuary. Journal of Marine Systems, 67(3-4):292-303 |
| Zapata M, Rodríguez F, Garrido J L, 2000. Separation of chlorophylls and carotenoids from marine phytoplankton:a new HPLC method using a reversed phase C8 column and pyridine-containing mobile phases. Marine Ecology-Progress Series, 195:29-45 |
 2015, Vol. 46
2015, Vol. 46


