
中国海洋湖沼学会主办。
文章信息
- 邢婧, 王洋, 宋晓青, 唐小千, 绳秀珍, 战文斌. 2015.
- XING Jing, WANG Yang, SONG Xiao-Qing, TANG Xiao-Qian, SHENG Xiu-Zhen, ZHAN Wen-Bin. 2015.
- 牙鲆(Paralichthys olivaceus)浸泡免疫鳗弧菌(Vibrio anguillarum)灭活疫苗后11种免疫相关基因的表达变化
- VARIATIONS IN EXPRESSION OF ELEVEN IMMUNE RELATED GENES IN FLOUNDER(PARALICHTHYS OLIVACEUS) INJECTED WITH INACTIVATED VIBRIO ANGUILLARUM
- 海洋与湖沼, 46(5): 1024-1033
- Oceanologia et Limnologia Sinica, 46(5): 1024-1033.
- http://dx.doi.org/10.11693/hyhz20150200043
-
文章历史
- 收稿日期: 2015-02-02
- 收修改稿日期: 2015-04-13
随着海水养殖业的不断发展,构建健康、无公害的养殖体系已经成为一种趋势,接种疫苗是防治鱼类细菌、病毒性疾病的有效方法(Ellis,1988)。浸泡免疫方式接种疫苗具有省时省力、节约成本且对鱼体刺激小等优点,是疫苗接种最便捷的途径。为研究免疫后鱼体免疫系统的变化以及疫苗的接种效果,常检测一些非特异性指标及特异性指标,如鱼类血清及黏液抗体水平变化(刘雨果等,2011)、免疫相关酶活性(Dan et al,2013)、淋巴细胞数量(Tang et al,2010)、呼吸爆发(Dan et al,2013)、补体活性(Dan et al,2013)等。近年来,从基因水平对疫苗免疫效果进行研究的报道越来越多,有研究发现,哈维氏弧菌(Vibrio harveyi)浸泡免疫斜带石斑鱼(Epinephelus coioide)后,MHCⅡ类分子在鳃、皮肤、头肾、脾脏和后肠中表达量均有不同程度的上调(王庆等,2010); 浸泡免疫鳗弧菌(Vibrio anguillarum)灭活疫苗后,大菱鲆(Scophthalmus maximus)多聚免疫球蛋白受体(plgR)基因在皮肤、鳃、脾脏中有较高水平的上调表达(丁冰洁等,2013)。虹鳟鱼(Oncorhynchus mykiss)浸泡免疫鲁氏耶尔森菌(Yersinia ruckeri)后血清淀粉样蛋白A(SSA)、白介素(IL)8、肿瘤坏死因子(INF)α、Toll-like受体(TLR)5、T细胞表面标志(TCR)β、IgT基因在脾脏中的表达量出现不同程度的上调,其中SSA基因的上调最为显著(Evenhuis et al,2012); 浸泡免疫杀鲑气单胞菌(Aeromonas salmonicida)后,虹鳟鱼鳃和肾中IL-1β、IL-8、CD4、IgM和IgD基因的表达量均呈现上调的趋势,IL-1β基因在肾脏中的表达量最高可达对照组的10倍(Cobo Labarca et al,2015)。这些研究结果均表明疫苗免疫能引起鱼类诸多免疫相关基因的快速变化。但浸泡免疫后多组织多基因表达变化的研究还较少,本文通过制备鳗弧菌全菌灭活疫苗,将牙鲆经浸泡免疫,利用荧光定量PCR法研究免疫后牙鲆脾、头肾、鳃3种组织中TLR2、TLR5M、髓样分化因子MyD88、核转录因子(NF)- κB、IL-6、IFNγ、趋化因子CXC、补体C3、HSP70、CD4、自然杀伤细胞增强因子(NKEF)十一种免疫相关基因表达的动态变化,从基因水平探究浸泡免疫对牙鲆免疫应答的影响,筛选浸泡免疫效果的评价指标。
1 材料与方法 1.1 实验动物牙鲆购自山东日照某牙鲆养殖场,体长为10— 13cm,实验前将健康牙鲆在水槽中暂养1周,水温为20—22°C,pH为7.4—7.8,期间连续充气,每天换水一次,投喂标准饲料一次。
1.2 鳗弧菌全菌灭活疫苗的制备鳗弧菌由本实验室保存,将菌种接种于2216 E固体培养基中,28°C培养24h,挑取单菌落至2216 E液体培养基中震荡培养24h,之后6000g 4°C离心15min,去上清液,无菌磷酸盐缓冲液(PBS,pH 7.4)清洗沉淀3次,最后以含0.5%甲醛(V/V)的PBS重悬,4°C放置48h,平板培养检测无活菌存在,再以PBS离心洗涤3次,4°C保存备用。
1.3 牙鲆的免疫及取样将暂养后的牙鲆随机分为2组,每组60尾。第一组浸泡于浓度为1×108CFU/mL灭活疫苗菌液中,连续充气浸泡30min; 第二组海水充气浸泡30min作为对照。处理后于0h、4h、8h、12h、24h、48h、72h、96h、7d、14d分别在各组随机取3尾牙鲆,分别取脾、头肾、鳃3种组织,同一时间点来源于3尾牙鲆同一组织的样品混匀后用于检测比较11种免疫相关基因表达的变化及差异。
1.4 RNA 的提取及 cDNA 的合成取各组织样品约20mg,应用Trizol法提取总RNA,1%琼脂糖凝胶电泳检测RNA的完整性,以微量核酸测定仪(NanoDrop 8000,Thermo,美国)测定RNA的浓度和纯度。提取的RNA利用反转录试剂盒(Applied Biosystems)经RT-PCR合成cDNA。所得cDNA样品-20°C保存,备用。
1.5 荧光定量 PCR 所用引物的设计与验证根据已知的牙鲆核糖体RNA(18S RNA)、TLR2、TLR5M、MyD88、NF-κB、IL-6、IFNγ、CXC、C3、HSP70、CD4、NKEF基因序列,采用Primer Premier 5.0软件设计各基因特异性引物,随机选取对照组的脾、头肾、鳃的cDNA样品,进行PCR扩增,经琼脂糖凝胶电泳检测,选择产物为单一条带的引物,利用SYBR® Premix Ex Taq试剂盒(Takara,美国)在荧光定量PCR仪(Light Cycler® 480ⅡPCR,Roche,德国)上进行扩增,最终以扩增反应产生的溶解曲线是单一波峰的引物作为荧光定量PCR的特异性引物。
1.6 荧光定量 PCR 检测采用微量核酸测定仪测定所有取样组织cDNA样品的浓度,用DEPC水(焦碳酸二乙酯灭菌水)调整所有组织cDNA浓度统一为0.05μg/μL,以18S RNA为内参,利用SYBR® Premix Ex Taq试剂盒在Light Cycler® 480ⅡPCR仪上进行扩增,扩增体系为20μL,即: 模板cDNA 2μL,正反向引物各0.4μL(引物浓度为10μmol/L),反应混合液10μL,无菌水7.2μL。为减小系统误差每个样品设置3个重复实验,扩增的条件为: 95°C 30s,1个循环; 95°C 10s,60°C 30s,45个循环; 95°C 5s,60°C 1min,95°C 5s,1个循环; 40°C冷却。再次确认每个样品扩增反应产生的溶解曲线是单一波峰,并获取Ct值(循环阈值),用于数据处理及分析。
1.7 数据处理及分析荧光定量PCR所得数据按照2−ΔΔCt法(纪冬等,2009)进行处理,所有数值均用平均值±标准差(x±SD)表示。利用Origin 8.0软件作图,SPSS19.0软件进行数据统计分析,采用T-检验分析不同时间点基因表达量的差异,以P<0.05作为差异显著的标准。
2 结果与分析 2.1 荧光定量 PCR 所用引物的获得经过常规PCR-琼脂糖凝胶电泳及荧光定量PCR溶解曲线验证,最终获得11种基因以及18S RNA内参的特异性引物,各基因引物名及引物序列、退火温度等信息见表 1。应用特异性引物进行荧光定量PCR,所有检测样品的扩增结果均为单一产物。
| 引物名 | 引物序列 | 退火温度(°C) | NCBI登录号 |
| 18S RNA-F | GGTCTGTGATGCCCTTAGATGTC | 60 | EF126037 |
| 18S RNA-R | AGTGGGGTTCAGCGGGTTAC | ||
| TLR2 -F | CTGCGGTGTAGCGTTAGTGG | 58 | AB109393 |
| TLR2-R | CGAAGGCATCATAGGAAAGC | ||
| TLR5M -F | TCCAGCATCATTACCAA | 58 | AB562152 |
| TLR5M -R | TCATACCCAAGTTAGCG | ||
| MyD88-F | AACGCTGAGATGAGATTGAA | 58 | AB241074 |
| MyD88-R | ATGGTGAGGGAGGAAGTGAC | ||
| NF-κB -F | GCTTCTCTGGGTAGCACACC | 58 | HM771267 |
| NF-κB -R | GGGTTCAGAAGGTCCACAAA | ||
| CD4-F | CCAGTGGTCCCCACCTAAAA | 60 | AB643634 |
| CD4-R | CACTTCTGGGACGGTGAGATG | ||
| IFN-γ-F | TGTCAGGTCAGAGGATCACACAT | 58 | AB435093 |
| IFN-γ-R | GCAGGAGGTTCTGGATGGTTT | ||
| CXC-F | ATTCGATTACTGCACTCTTGG | 58 | AB809049.1 |
| CXC-R | GCGACTCGTCTACCGCTCTCTAC | ||
| IL-6-F | CTCCGCAATGGGAAGGTG | 58 | DQ267937 |
| IL-6-R | GATGGATGGGTGGAATAA | ||
| C3 - F | CCTTTGCCTCTATCGCCTCA | 58 | AB021653 |
| C3 -R | CCTTGGTCGGATGGTTCA | ||
| HSP70-F | TCCTCATGGGTGACACTTCG | 58 | AF053059 |
| HSP70-R | TTGTCCTTGGTCATGGCTCT | ||
| NKEF-F | ATGGCTGCAGGCAAAGCACA | 60 | JQ307466 |
| NKEF-R | TTAATGCTTGGCGAAGAAGT |
脾脏中,TLR2基因的表达量自12h起显著高于对照组,48h达到最高值,是对照组的12.15倍,而后逐渐下降,至14d时降至与对照组无显著差异(图 1a); 头肾中,TLR2基因的表达量自4h起显著高于对照组,48h达到最高值,是对照组的5.40倍,而后逐渐下降,至14d与对照组无显著差异(图 1b); 鳃中,TLR2自4h起显著高于对照组,之后快速上升,24h达到最高值,是对照组的3.66倍,之后逐渐下降,至14d时与对照组无显著差异(图 1c)。
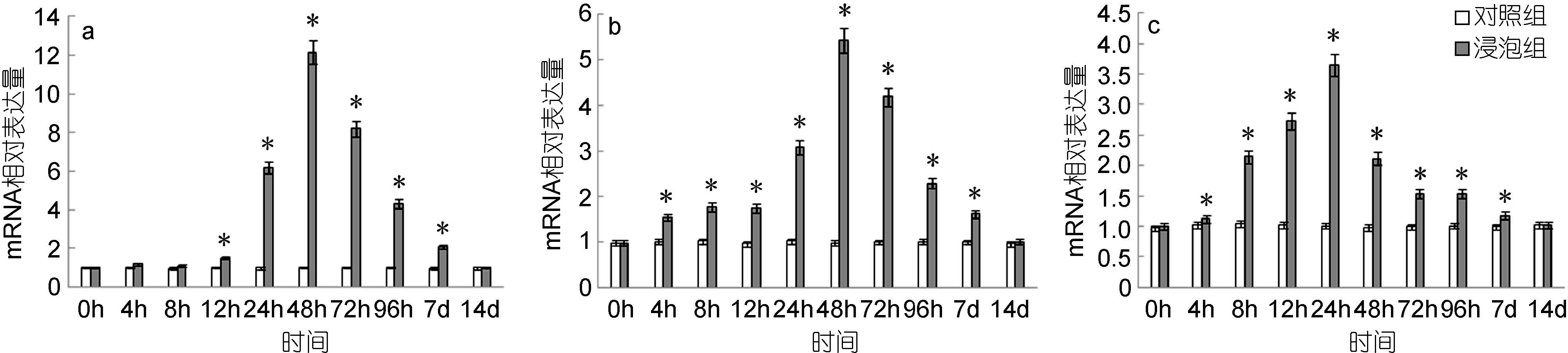 |
| 图 1 鳗弧菌灭活疫苗免疫后牙鲆脾(a)、头肾(b)、鳃(c)中TLR2相对表达量 Fig. 1 Expression of TLR2 in spleen (a), head kidney (b) and gills (c) post immunization with formalin inactivated V. anguillarum “*”表示该浸泡组与对照组之间有显著差异(P<0.05) |
在脾脏中,TLR5M基因的表达量虽然略有变化,但相对于对照组变化不显著(图 2a); 头肾中,TLR5M基因的表达相对于对照组也无显著变化(图 2b); 鳃中,TLR5M基因的表达呈现显著上调,表达量自8h起显著高于对照组,24h达到最高值,是对照组的2.75倍,而后逐渐下降,至7d时降至与对照组无显著差异(图 2c)。
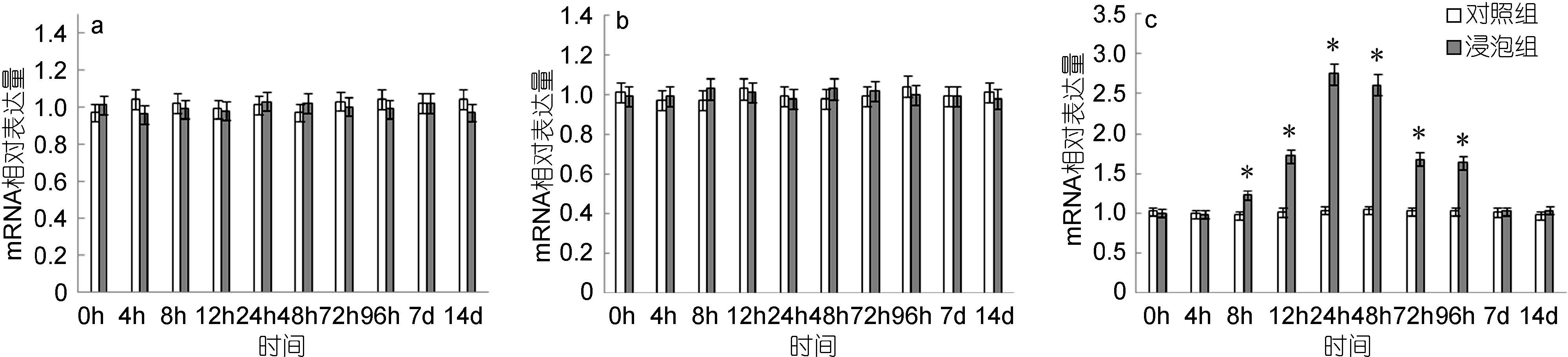 |
| 图 2 鳗弧菌灭活疫苗免疫后牙鲆脾(a)、头肾(b)、鳃(c)中TLR5M相对表达量 Fig. 2 Expression of TLR5M in spleen (a), head kidney (b) and gills (c) post immunization with formalin inactivated V. anguillarum “*”表示该浸泡组与对照组之间有显著差异(P<0.05) |
脾脏中,MyD88基因的表达量自12h起显著高于对照组,48h达到最高值,是对照组的4.82倍,而后逐渐下降,至7d时降至与对照组无显著差异(图 3a); 头肾中,MyD88基因的表达量自24h起显著高于对照组,48h达到最高值,是对照组的3.04倍,之后维持在较高水平,96h后逐渐下降,至14d时降至与对照组无显著差异(图 3b); 鳃中,MyD88基因的表达量自4h起显著高于对照组,略有下降后再次上升,48h达到最高值,是对照组的2.58倍,之后逐渐下降,至14d时与对照组无显著差异(图 3c)。
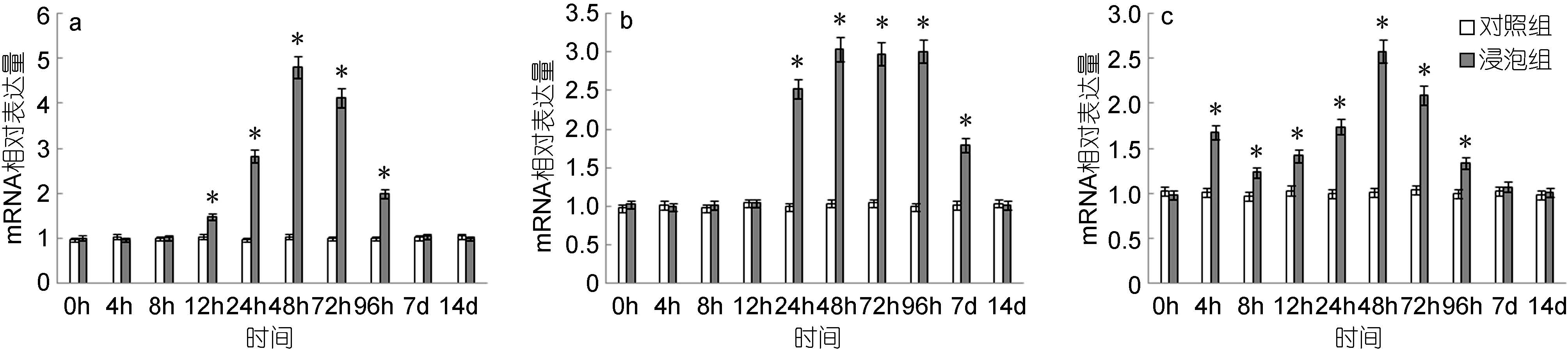 |
| 图 3 鳗弧菌灭活疫苗免疫后牙鲆脾(a)、头肾(b)、鳃(c)中MyD88相对表达量 Fig. 3 Expression of MyD88 in spleen (a), head kidney (b) and gills (c) post immunization with formalin inactivated V. anguillarum “*”表示该浸泡组与对照组之间有显著差异(P<0.05) |
脾脏中,NF-κB基因的表达量自4h起显著高于对照组,24h达到最高值,是对照组的10.43倍,而后逐渐下降,至14d时降至与对照组无显著差异(图 4a); 头肾中,NF-κB基因的表达量自4h起显著高于对照组,24h达到最高值,是对照组的8.33倍,而后逐渐下降,至7d时降至与对照组无显著差异(图 4b); 鳃中,NF-κB基因的表达量自4h起显著高于对照组,24h达到最高值,是对照组的2.04倍,之后逐渐下降,至72h时与对照组无显著差异(图 4c)。
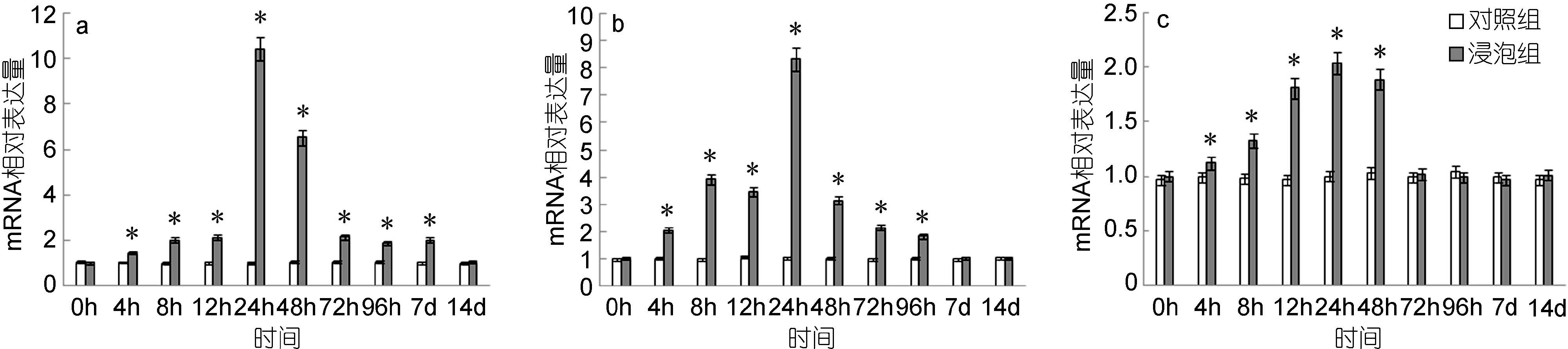 |
| 图 4 鳗弧菌灭活疫苗免疫后牙鲆脾(a)、头肾(b)、鳃(c)中NF-κB相对表达量 Fig. 4 Expression of NF-κB in spleen (a), head kidney (b) and gills (c) post immunization with formalin inactivated V. anguillarum “*”表示该浸泡组与对照组之间有显著差异(P<0.05) |
脾脏中,CD4表达量自免疫后12h开始出现显著高于对照组,至96h达到峰值,为对照组的6.62倍,之后呈现逐渐下降的趋势(图 5a); 头肾中,CD4基因的表达量自8h起显著高于对照组,72h达到最高值,是对照组的6.25倍,而后逐渐下降(图 5b); 鳃中,CD4基因的表达量自8h起显著高于对照组,72h达到最高值,是对照组的2.15倍,之后逐渐下降,至14d时降至与对照组无显著差异(图 5c)。
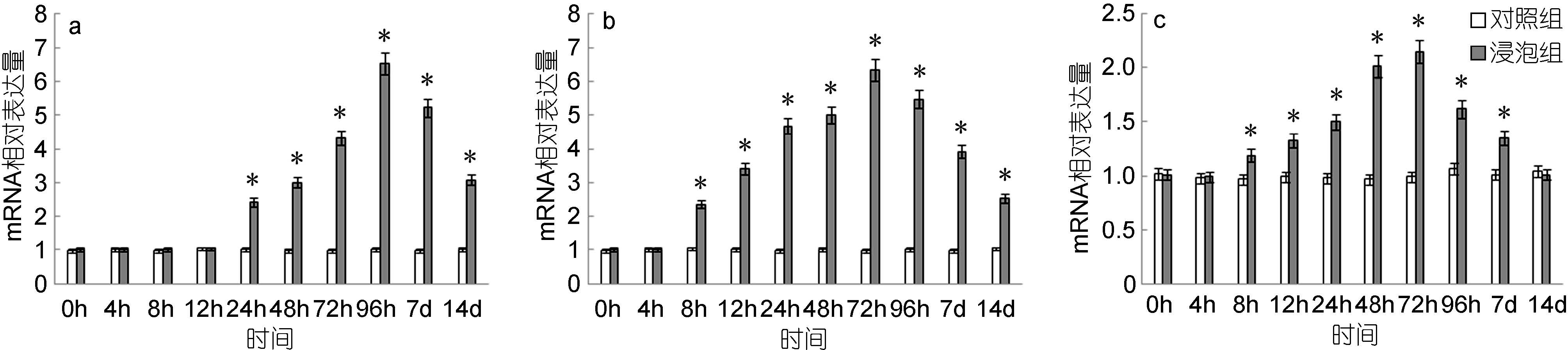 |
| 图 5 鳗弧菌灭活疫苗免疫后牙鲆脾(a)、头肾(b)、鳃(c)中CD4相对表达量 Fig. 5 Expression of CD4 in spleen (a), head kidney (b) and gills (c) post immunization with formalin inactivated V. anguillarum “*”表示该浸泡组与对照组之间有显著差异(P<0.05) |
脾脏中,IL-6基因的表达量自4h起显著高于对照组,24h达到最高值,是对照组的10.65倍,而后逐渐下降,至7d时降至与对照组无显著差异(图 6a); 头肾中,IL-6基因的表达量自8h起显著高于对照组,24h达到最高值,是对照组的7.93倍,而后逐渐下降,至7d时降至与对照组无显著差异(图 6b); 鳃中,IL-6基因的表达量自4h起显著高于对照组,24h达到最高值,是对照组的10.42倍,之后逐渐下降,至7d时与对照组无显著差异(图 6c)。
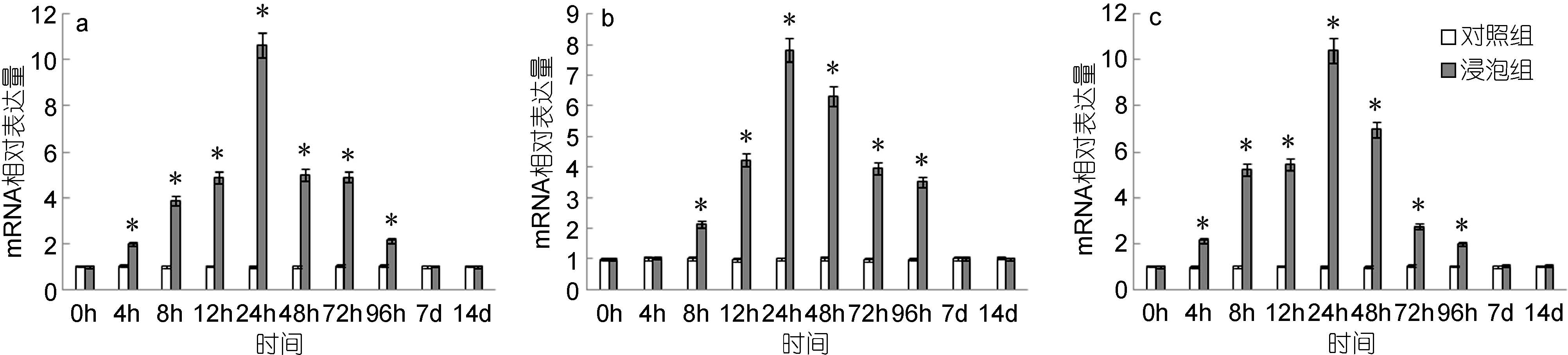 |
| 图 6 鳗弧菌灭活疫苗免疫后牙鲆脾(a)、头肾(b)、鳃(c)中IL-6相对表达量 Fig. 6 Expression of IL-6 in spleen (a), head kidney (b) and gills (c) post immunization with formalin inactivated V. anguillarum “*”表示该浸泡组与对照组之间有显著差异(P<0.05) |
IFNγ基因在脾脏和头肾2种组织中的表达均呈现先上升后下降的趋势。脾脏中,IFNγ基因的表达量自8h起显著高于对照组,24h达到最高值,是对照组的2.76倍,而后逐渐下降,48h出现小幅度上调,至7d时降至与对照组无显著差异(图 7a); 头肾中,IFNγ基因的表达量自4h起显著高于对照组,48h达到最高值,是对照组的3.77倍,而后逐渐下降,96h时与对照组无显著差异,而后出现短暂的上升,至14d时降至与对照组无显著差异(图 7b); 鳃中,IFNγ基因的表达量自8h起显著高于对照组,之后快速上升,24h达到最高值,是对照组的2.30倍,之后逐渐下降,至14d时与对照组无显著差异(图 7c)。
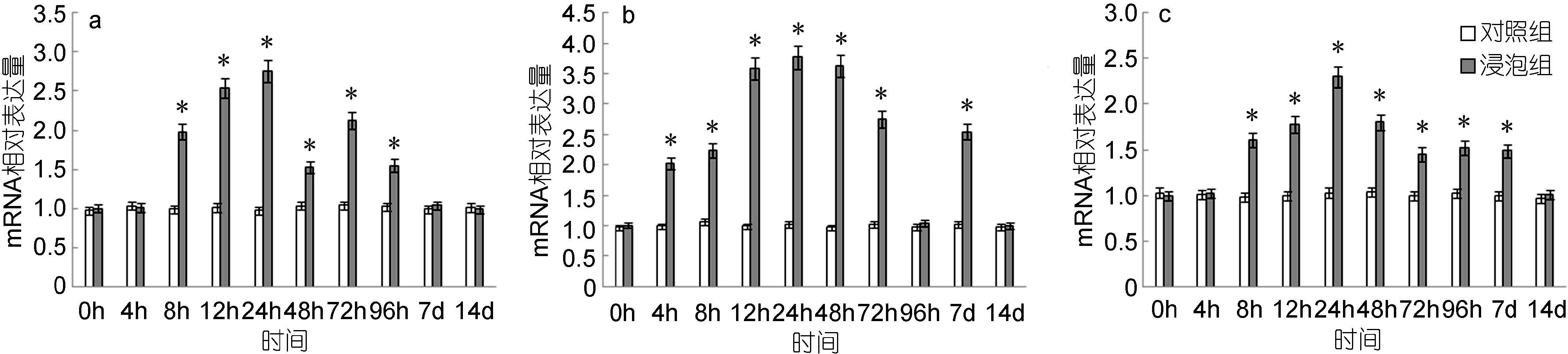 |
| 图 7 鳗弧菌灭活疫苗免疫后牙鲆脾(a)、头肾(b)、鳃(c)中IFNγ相对表达量 Fig. 7 Expression of IFNγ in spleen (a), head kidney (b) and gills (c) post i“*”表示该浸泡组与对照组之间有显著差异(P<0.05) mmunization with formalin inactivated V. anguillarum |
脾脏中,CXC基因的表达量自8h起显著高于对照组,48h达到最高值,是对照组的3.28倍,而后逐渐下降,至7d时降至与对照组无显著差异(图 8a); 头肾中,CXC基因的表达量自48h起显著高于对照组,72h达到最高值,是对照组的3.33倍,而后逐渐下降,至14d时降至与对照组无显著差异(图 8b); 鳃中,CXC基因的表达量自8h起显著高于对照组,48h达到最高值,是对照组的3.19倍,之后逐渐下降,至14d时与对照组无显著差异(图 8c)。
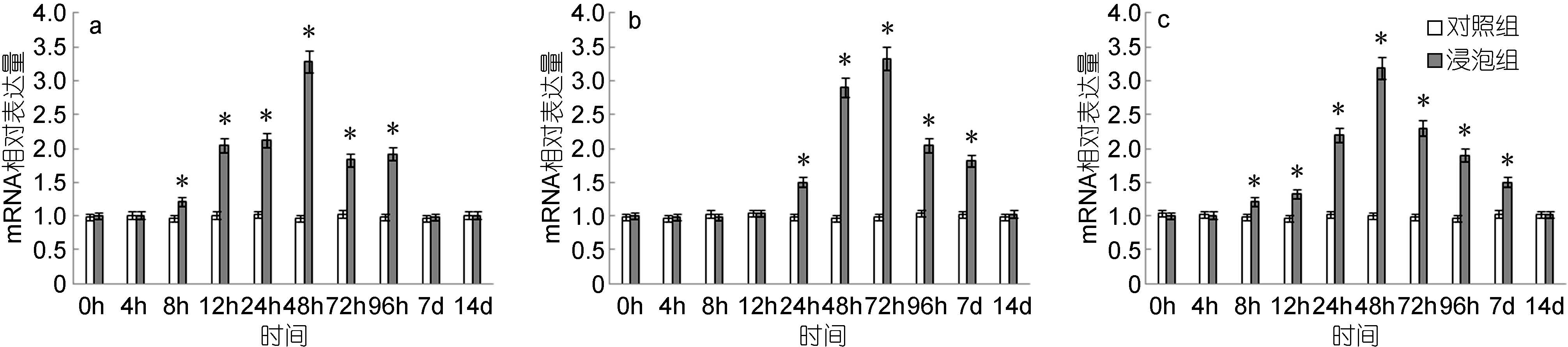 |
| 图 8 鳗弧菌灭活疫苗免疫后牙鲆脾(a)、头肾(b)、鳃(c)中CXC相对表达量 Fig. 8 Expression of CXC in spleen (a), head kidney (b) and gills (c) post immunization with formalin inactivated V. anguillarum “*”表示该浸泡组与对照组之间有显著差异(P<0.05) |
免疫后C3在脾脏、头肾和鳃组织中的表达量均有上调,但上调幅度都较低,峰值是对照组的3倍左右。脾脏中,自8h起显著高于对照组,48h达到最高值,为对照组的2.52倍,而后有所下降,7—14d时又出现小幅度上调表达(图 9a); 头肾中,C3的表达量自4h起显著高于对照组,48h达到最高值,为对照组的3.71倍,而后逐渐下降,至14d与对照组无显著差异(图 9b); 鳃中,C3的表达量自8h起显著高于对照组,48h达到最高值,为对照组的2.73倍,之后逐渐下降,至7d与对照组无显著差异(图 9c)。
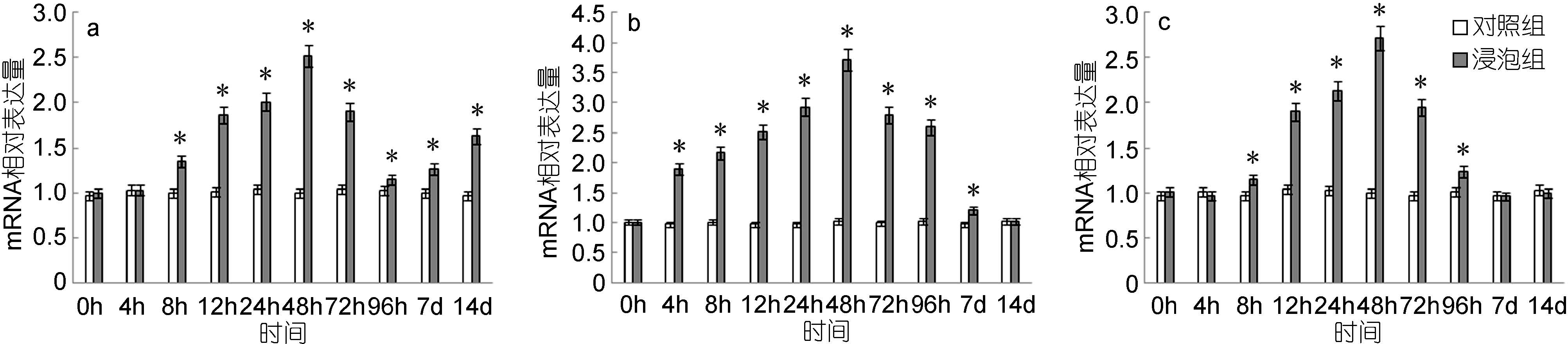 |
| 图 9 鳗弧菌灭活疫苗免疫后牙鲆脾(a)、头肾(b)、鳃(c)中C3相对表达量 Fig. 9 Expression of C3 in spleen (a), head kidney (b) and gills (c) post immunization with formalin inactivated V. anguillarum “*”表示该浸泡组与对照组之间有显著差异(P<0.05) |
脾脏中,HSP70基因的表达量自4h起显著高于对照组,24h达到最高值,是对照组的7.69倍,而后逐渐下降,至7d时降至与对照组无显著差异(图 10a); 头肾中,HSP70基因的表达量自8h起显著高于对照组,24h达到最高值,是对照组的4.67倍,而后逐渐下降,至14d时降至与对照组无显著差异(图 10b); 鳃中,HSP70基因的表达量自4h起显著高于对照组,24h达到最高值,是对照组的9.65倍,之后逐渐下降,至7d时降至与对照组无显著差异(图 10c)。
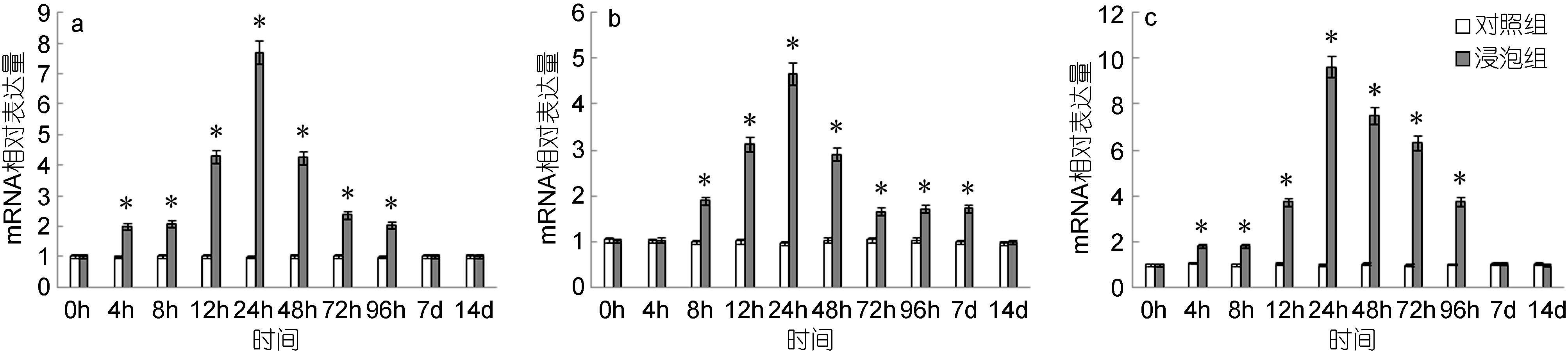 |
| 图 10 鳗弧菌灭活疫苗免疫后牙鲆脾(a)、头肾(b)、鳃(c)中HSP70相对表达量 Fig. 10 Expression of HSP70 in spleen (a), head kidney (b) and gills (c) post immunization with formalin inactivated V. anguillarum “*”表示该浸泡组与对照组之间有显著差异(P<0.05) |
脾脏中,NKEF基因的表达量自8h起显著高于对照组,24h达到最高值,是对照组的3.11倍,而后逐渐下降,至7d时恢复对照组水平(图 11a); 头肾中,NKEF基因的表达量自4h起显著低于对照组,48h达到最低值,是对照组的0.49倍,而后逐渐上调(图 11b); 鳃中,NKEF基因的表达量自4h起显著高于对照组,24h达到最高值,是对照组的4.39倍,之后逐渐下降,至14d时与对照组无显著差异(图 11c)。
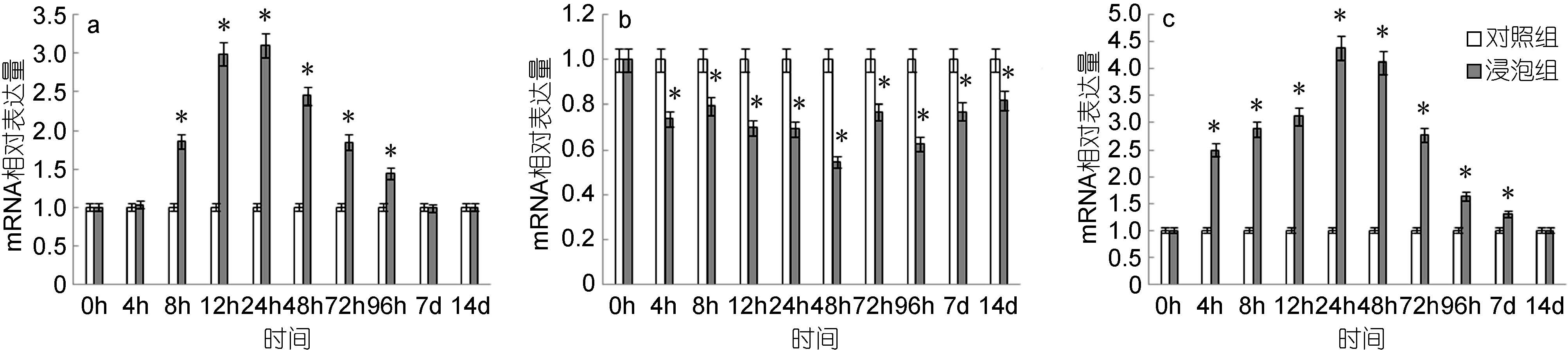 |
| 图 11 鳗弧菌灭活疫苗免疫后牙鲆脾(a)、头肾(b)、鳃(c)中NKEF相对表达量 Fig. 11 Expression of NKEF in spleen (a), head kidney (b) and gills (c) post immunization with formalin inactivated V. anguillarum “*”表示该浸泡组与对照组之间有显著差异(P<0.05) |
本实验结果显示,浸泡免疫方式能引起牙鲆11种免疫相关基因在三种组织中的显著上调或下调表达。TLR2、TLR5M、NF-κB和MyD88是TLR信号通路的关键分子,TLR2可识别合成的三酰脂肽Pam3CSK4和革兰氏阳性细菌的脂肽(Wei et al,2011); 在哺乳动物中,膜结合的TLR5可以识别细菌的鞭毛蛋白成分,TLR5M基因依赖MyD88途径激活鞭毛介导的NF-κB,之后诱导前炎性细胞因子(白细胞介素和肿瘤坏死因子等)和I型干扰素的产生(Hwang et al,2010),由I型干扰素介导直接的防御反应,而MyD88是除TLR3以外所有TLRs的信号转导因子(Tang et al,2012)。CD4是T细胞重要的表面分子,CD4+T细胞具有辅助性T细胞的功能,是MHCⅡ类分子的受体,
在机体特异性免疫识别外源性抗原中具有重要意义(Kato et al,2013)。IL-6是由辅助性T细胞分泌的一种多效的细胞因子,有效促进B细胞的增殖分化和T细胞的成熟,在非特异性及特异性免疫应答中都能发挥重要的调节作用,在炎症反应的早期即可大量表达(Naka et al,2002)。IFNγ属于Ⅱ型干扰素,除具有抗病毒、抗增殖活性外,其主要生物学活性为免疫调节作用(Yang et al,2013)。HSP70可作为分子伴侣,参与蛋白质代谢,协助蛋白质折叠、组装及转运,并能降解错误装配的蛋白质等,它的表达受外界环境及机体自身变化的调控,能够在外源病原体刺激机体时发挥应激作用(Cui et al,2011)。CXC能够募集免疫细胞迁移,在炎性反应及病原侵染中发挥重要作用。C3是存在于血清中的具有非特异性抵抗作用的体液分子,是补体活化途径的重要因子,发挥直接的抗微生物作用和调理作用,在鱼类免疫防御机制中发挥着重要作用(陈勇等,2008)。NKEF最初在人类红细胞中克隆得到,是一种可溶性因子,属于一个保守的Prx基因家族,从原核生物到高等哺乳动物中均有发现,它可以增强自然杀伤细胞的细胞毒性活动,从而促进机体非特异性免疫的发生(孙晶等,2014)。本研究发现,所研究的11种基因中,TLR2、MyD88、NF-κB、IL-6、IFNγ、CXC、C3 、HSP-70和CD4九种基因呈现了上调表达趋势,表达量峰值出现在免疫后24—96h,为对照组的2—12倍。说明这些基因通过快速大量的表达参与牙鲆的免疫应答。
3.2 C3 、TLR5M 、NKEF 三种基因的表达变化有研究发现,南亚野鲮(Labeo rohita)经迟纯爱德华氏菌(Edwardsiella tarda)免疫后,C3基因在肾组织中的表达量呈显著上调的趋势(Mohanty et al,2010),本实验上调表达的基因中,C3的表达存在其独特性,C3在3种组织中的表达上调呈现出双波峰现象,第一次峰值出现在免疫后48h,在14d时出现第二次峰值,但低于48h时。结合补体的活化机制推断,第一个峰值的出现可能与浸泡免疫后疫苗直接刺激机体使C3基因大量表达以发挥其直接的抗微生物作用有关; 基因的第二次上调表达可能与补体系统的激活有关,机体受到抗原刺激后启动特异性免疫应答,浆细胞分泌IgM到血液、黏液中,形成抗原抗体复合物,进而激活补体活化途径。
本研究中,免疫后TLR5M基因表达量在脾脏和头肾中与对照组无显著差异,在鳃中呈现上调趋势,为对照组的2.75倍。结合之前的相关报道,鳗弧菌及其鞭毛刺激虹鳟细胞系后TLR5M表达变化不显著,而TLR5S显著上调(Tsujita et al,2004)。推断TLR5M在消化道的细菌识别中发挥重要作用而在其他器官作用不显著,且TLR5M与TLR5S识别鞭毛的成分有可能不同,导致其表达出现差异。鳃中TLR5M基因的上调表达可能与浸泡免疫时病原直接接触到鳃组织,短时间内引起了TLR5M的应激表达有关。
研究发现,鲤鱼(Cyprinus carpio L.)注射感染鲤春病毒(Spring Viraemia of Carp Virus)后,脾脏和鳃组织中的NKEF-B基因的表达量相对于对照组显著上调,而头肾中NKEF-B基因的表达量显著下调(Huang et al,2009)。实验结果显示,牙鲆浸泡免疫鳗弧菌灭活疫苗后,NKEF基因的表达量在脾脏和鳃组织中显著上调,而在头肾中显著下调,表达量最小值为对照组的0.49倍,与之前的研究结果一致,推测NKEF基因在机体非特异性免疫防御中可能起重要作用,头肾作为鱼类主要的造血和淋巴器官,它在受到外来抗原的刺激时会将产生的血细胞和淋巴细胞转运到血液及其它组织中,这也许是造成NKEF基因在头肾中下调表达的原因,但详细的作用机制还有待进一步研究。
3.3 11 种基因表达变化的组织差异性实验结果显示,在脾脏和头肾中,TLR2、NF-κB、和CD4基因的表达峰值高于鳃; 在脾脏和鳃中,IL-6、HSP70和NKEF基因的表达峰值均高于脾脏; TLR5M、MyD88、IFNγ、CXC和C3基因在三个组织中的表达峰值差异不大; 在三个组织中每个基因表达峰值出现的时间基本一致。结合之前的研究结果,注射免疫后脾脏和头肾中免疫相关基因的表达量均显著高于鳃,且表达量峰值出现的时间早于鳃(宋晓青等,2014),推测浸泡免疫可以迅速启动鱼类的黏膜免疫,使鳃组织中免疫相关基因表达量上调。因此,在评价疫苗浸泡免疫效果时,除检测脾脏和头肾等主要的免疫器官外,鳃也是需要检测的组织。
本文通过比较免疫后11种基因在三种组织中的表达量变化趋势,发现IL-6和HSP70基因在三种组织中的表达量上调峰值较高,为对照组的5—11倍,且变化较为迅速,4h即出现显著上调,在24h达到峰值。有研究也发现,鳗弧菌感染金头鲷(Sparus aurata)后,IL-6基因在4h内即呈现上调表达(Castellana et al,2008); 海豚链球菌(GIFT Strepstococcus iniae)免疫吉富罗非鱼(Oreochromis niloticus)后,HSP70基因表达量在48h之内上调至对照组的5倍多(王瑞等,2010)。由此可见,IL-6和HSP70基因在浸泡免疫灭活疫苗后是较为敏感的因子,可以作为疫苗浸泡免疫后的效果评价指标。
4 结论浸泡免疫后,鳗弧菌灭活疫苗有效引起了牙鲆的特异性和非特异性免疫应答反应,各免疫相关基因在脾脏、头肾和鳃三种组织中出现了不同程度的上调或下调表达,其中IL-6和HSP70基因在三个组织中均表达变化迅速,表达丰度较高,可以作为浸泡免疫后免疫效果的评价指标。在监测浸泡免疫效果时,除脾脏和头肾外,鳃也是重要的检测组织。
| 丁冰洁,绳秀珍,唐小千等, 2013.大菱鲆多聚免疫球蛋白受体基因的克隆及表达分析.中国水产科学, 20(4):792-801 |
| 王庆,吴光辉,巩华等, 2010.斜带石斑鱼浸泡免疫哈维氏弧菌灭活疫苗后MHC-Ⅱ类分子的表达变化.广东农业科学, 37(12):136-139 |
| 王瑞,黄艳华,陈明等, 2010.罗非鱼感染链球菌后hsp70基因表达研究.广西农业科学, 41(4):371-377 |
| 刘雨果,潘厚军,石存斌等, 2011. 3种免疫途径对嗜水气单胞菌灭活疫苗保护作用的影响.广东海洋大学学报, 31(4):81-85 |
| 孙晶,薛壮,王歆睿等, 2014.自然杀伤细胞增强因子研究进展.生命的化学, 34(2):235-240 |
| 纪冬,辛绍杰, 2009.实时荧光定量PCR的发展和数据分析.生物技术通讯, 20(4):598-600 |
| 宋晓青,邢婧,战文斌, 2014.牙鲆经注射和浸泡免疫鳗弧菌灭活疫苗后7种免疫相关基因表达的变化.中国水产科学, 21(4):747-758 |
| 陈勇,郭丽,陈舒泛, 2008.感染后暗纹东方鲀补体组分C3、C4表达分析.江苏农业科学,(2):175-179 |
| Castellana B, Iliev D B, Sepulcre M P et al, 2008. Molecular characterization of interleukin-6 in the gilthead seabream(Sparus aurata). Molecular Immunology, 45(12):3363-3370 |
| Cobo Labarca C, Makhutu M, Lunsdon A E et al, 2015. The adjuvant effect of low frequency ultrasound when applied with an inactivated Aeromonas salmonicida vaccine to rainbow trout(Oncorhynchus mykiss). Vaccine, 33(11):1369-1374 |
| Cui M, Zhang Q Z, Yao Z J et al, 2011. Molecular cloning and expression analysis of heat-shock protein 70 in orange-spotted grouper Epinephelus coioides following heat shock and Vibrio alginolyticus challenge. Journal of Fish Biology, 79(2):486-501 |
| Dan X M, Zhang T W, Li Y W et al, 2013. Immune responses and immune-related gene expression profile in orange-spotted grouper after immunization with Cryptocaryon irritans vaccine. Fish & Shellfish Immunology, 34(3):885-891 |
| Ellis A E, 1988. Current aspects of fish vaccination. Diseases of Aquatic Organisms, 4:159-164 |
| Evenhuis J P, Cleveland B M, 2012. Modulation of rainbow trout(Oncorhynchus mykiss) intestinal immune gene expression following bacterial challenge. Veterinary Immunology and Immunopathology, 146(1):8-17 |
| Huang R, Gao L Y, Wang Y P et al, 2009. Structure, organization and expression of common carp(Cyprinus carpio L.) NKEF-B gene. Fish & Shellfish Immunology, 26(2):220-229 |
| Hwang S D, Asahi T, Kondo H et al, 2010. Molecular cloning and expression study on Toll-like receptor 5 paralogs in Japanese flounder, Paralichthys olivaceus. Fish & Shellfish Immunology, 29(4):630-638 |
| Kato G, Goto K, Aoka I et al, 2013. CD4 and CD8 homologues in Japanese flounder, Paralichthys olivaceus:Differences in the expressions and localizations of CD4-1, CD4-2, CD8α and CD8β. Developmental and Comparative Immunology, 39(3):293-301 |
| Mohanty B R, Sahoo P K, 2010. Immune responses and expression profiles of some immune-related genes in Indian major carp, Labeo rohita to Edwardsiella tarda infection. Fish & Shellfish Immunology, 28(4):613-621 |
| Naka T, Nishimoto N, Kishimoto T, 2002. The paradigm of IL-6:from basic science to medicine. Arthritis Research, 4(S3):S233-S242 |
| Tang D, Gao Y H, Wang R X et al, 2012. Characterization, genomic organization, and expression profiles of MyD88, a key adaptor molecule in the TLR signaling pathways in miiuy croaker(Miichthys miiuy). Fish Physiology and Biochemistry, 38(6):1667-1677 |
| Tang X Q, Zhan W B, Sheng X Z et al, 2010. Immune response of Japanese flounder Paralichthys olivaceus to outer membrane protein of Edwardsiella tarda. Fish & Shellfish Immunology, 28(2):333-343 |
| Tsujita T, Tsukada H, Nakao M et al, 2004. Sensing bacterial flagellin by membrane and soluble orthologs of Toll-like receptor 5 in rainbow trout(Onchorhynchus mikiss). The Journal of Biology Chemistry, 279(47):48588-48597 |
| Wei Y C, Pan T S, Chang M X et al, 2011. Cloning and expression of Toll-like receptors 1 and 2 from a teleost fish, the orange-spotted grouper Epinephelus coioides. Veterinary Immunology and Immunopathology, 141(3-4):173-182 |
| Yang D H, Liu Q, Ni C S et al, 2013. Gene expression profiling in live attenuated Edwardsiella tarda vaccine immunized and challenged zebrafish:Insights into the basic mechanisms of protection seen in immunized fish. Developmental and Comparative Immunology, 40(2):132-141 |
 2015, Vol. 46
2015, Vol. 46


