
中国海洋湖沼学会主办。
文章信息
- 白雪秋, 庞震国, 张伟杰, 常亚青, 高银雪, 丁君. 2015.
- BAI Xue-Qiu, PANG Zhen-Guo, ZHANG Wei-Jie, CHANG Ya-Qing, GAO Yin-Xue, DING Jun. 2015.
- 高温诱导对中间球海胆hsp70基因和hsp90基因的表达研究
- RELATIVE EXPRESSION OF GENES HSP70 AND HSP90 IN SEA URCHIN STRONGYLOCENTROTUS INTERMEDIUS IN THERMAL STRESS
- 海洋与湖沼, 46(5): 1034-1039
- Oceanologia et Limnologia Sinica, 46(5): 1034-1039.
- http://dx.doi.org/10.11693/hyhz20141200366
-
文章历史
- 收稿日期: 2014-12-31
- 收修改稿日期: 2015-05-13
中间球海胆(Strongylocentrotus intermedius)主要分布于日本的北海道和俄罗斯远东地区的海域(常亚青等,2004),具有生长快和性腺品质好等优点,1989年由大连海洋大学从日本引入我国,目前已成为我国最具有经济价值的海胆种类之一(Ding et al,2007)。温度是影响海洋动物生长和生理活动的重要因子(Burge et al,2014),温度直接影响中间球海胆的生长发育、摄食代谢、繁殖存活、性腺产量和品质等(常亚青等,1999; 马福恒,2002)。中间球海胆在原产地的生存水温为-2—25°C,在15°C左右摄食最为活跃,超过23°C即可导致生长减慢、疾病暴发甚至大量死亡(常亚青等,2004)。热休克蛋白(Heat Shock Protein)是一种高度保守的蛋白质,其主要的功能是作为分子伴侣,防止蛋白折叠、重新折叠变性蛋白及将变性蛋白降解等。根据分子量不同,热休克蛋白可分为HSP90、HSP70、HSP60、HSP40和小分子量的HSP蛋白。HSP70蛋白和HSP90蛋白是热休克蛋白家族中的重要成员,通过在应激反应中快速调节细胞的防御体系使细胞得到修复和保护,对可能造成蛋白质损伤的环境因素产生诱导性表达,可以用来分析生物对环境变化的响应(董云伟等,2008; 于姗姗等,2012)。HSPs蛋白家族成员在凋亡体形成的不同阶段发挥阻断作用,HSP70蛋白作为分子伴侣可以通过阻断细胞色素c的释放、阻断Apaf-1寡聚化及阻断casepase-9的活化等多种方式阻断凋亡体的形成,因而认为hsp70基因(简称hsp70)的表达能保护细胞免受热激引起凋亡(Mosser et al,2000; Saleh et al,2000); hsp90基因(简称hsp90)则通过阻断Apaf-1寡聚化,参与阻断凋亡体的形成(Yahara,1998)。温度变化可诱导海胆(Paracentrotus lividus)(Matranga et al,2000)和海参(Apostichopus japonicus)(Dong et al,2007)hsps的表达。Matranga等(2002)用hsp70作为胁迫标记通过海胆体腔细胞来分析海胆对温度胁迫、酸性pH和重金属的响应。Dong等(2007)发现高温胁迫幼参影响hsp70的表达量。吉成龙等(2011)报道在28°C的热激条件下刺参体壁中hsp70的表达量增加。Zhao等(2014)通过加入捕食者来研究海胆的遮蔽行为中hsp70的表达量差异。Osovitz等(2005)研究了环境温度对紫色球海胆(Strongylocentrotus purpuratus)管足组织hsp70基因表达的影响。本研究对中间球海胆在高温胁迫条件下hsp70和hsp90基因的表达差异进行初步研究,在分子水平上探究海胆的耐热性能,阐释海胆中热休克蛋白对高温诱导的响应。
1 材料与方法 1.1 实验材料实验所需中间球海胆均取自农业部北方海水增养殖重点实验室。
1.1.1 海胆不同组织样品从健康海胆随机选取40枚[壳径为(43.09±0.53)mm,体重为(32.15±0.36)g],用于海胆的不同组织中hsp70、hsp90基因的表达研究。
1.1.2 海胆不同家系样品从11月龄的海胆耐热品系中随机选取3个家系(2013Si1-1,2013Si7-2,2013Si13-2),并与3个对照家系(2013SiC-3,2013SiC-5,2013SiC-6)共同用于研究hsp70、hsp90基因在海胆不同家系中的表达,每个家系随机选取40枚海胆[壳径为(16.32±0.63)mm,体重为(2.02±0.20)g],共240枚。
1.2 温度处理将实验海胆置于同一个升温水槽内进行升温实验。初始温度为19°C(0h),温度以每0.5h升高2°C,升至29°C,然后维持至6h后让水温自然回落。分别在实验开始0h、1.5h、3h、6h、12h、24h、48h的时间点取样(常亚青等,1999; 马福恒,2002)。
1.3 样品采集用于不同组织实验海胆的取样组织部位为海胆管足、体腔细胞(离心体腔液得到)、口器、性腺和肠,将样品收集于1.5mL RNase离心管中,经液氮冷冻后,存于-80°C冰箱保存。
海胆耐热家系和对照家系的取样部位为海胆管足,将海胆管足样品存于1.5mL RNase离心管后迅速用液氮冷冻,于-80°C冰箱保存。
其中每个海胆单独采集样品,然后将每5个生物学重复的样品等量混合后进行RNA提取,用于后续实验。
1.4 总RNA的提取及cDNA的制备将冻存的组织取出10—20mg,提取总RNA(RNA提取试剂盒,天根生化科技有限公司,北京)。1%的琼脂糖凝胶电泳检测RNA完整性,NV3000 sepctrophotometer检测RNA纯度及浓度,将符合实验要求的RNA溶液冻存于-80°C冰箱中备用。
PrimeScriptTM RT reagent Kit(TaKaRa,中国大连)试剂盒进行反转录。20μL反应体系包含4μL 5× PrimeScriptTM buffer,1μL PrimeScriptTM RT enzyme Mix I,25pmol Oligo dT Primer,50pmol R and om 6 mers,500ng Total RNA,RNase Free ddH2O补足至20μL。样品混匀后在PCR仪上进行反转录,条件为37°C 15min,85°C 5s。
1.5 引物设计筛选及RT-PCR采用primer premier5.0(韩俊英等,2011)软件对每个基因设计实时荧光定量PCR引物,检测其引物特异性及扩增效率,经过筛选每个基因各得到一对特异性引物,引物序列信息见表 1,引物于上海生工生物工程技术服务有限公司合成。
| 基因 | 引物序列(5′→3′) |
| hsp70-F | ACACTCATCTCGGAGGAG |
| hsp70-R | CTTTCTTATGCTTTCGCTTGA |
| hsp90-F | CCCACCAGACCATTATCA |
| hsp90-R | TCTCAGCCTTCTCCATTT |
| 18S rRNA-F | GTTCGAAGGCGATCAGATAC |
| 18S rRNA-F | CTGTCAATCCTCACTGTGTC |
利用RT-PCR研究hsp70和hsp90在中间球海胆各组织中的表达量,使用SYBR® Premix Ex TaqTM II Kit(Tli RNaseH Plus,TaKaRa)试剂盒,在Applied Biosystems 7500 real-time PCR system(Life Technologies,USA)上进行荧光定量PCR。20μL反应体系为10μL 2×SYBR Premix Ex TaqTM II(Tli RNaseH Plus),0.4μL ROX Reference Dye II,1μL cDNA模板,上下游引物各0.4μL,ddH2O补足至20μL。反应程序为95°C 30s,40个循环的95°C 5s,60°C 32s;溶解曲线阶段95°C 30s,60°C 1min,95°C 15s。以18SrRNA为内参基因,采用2-△△Ct法计算目的基因的相对表达水平。
1.6 数据处理用SPSS17.0对实验数据进行统计分析,通过正态分布和方差同质性检验,验证各实验数据之间有无明显交互作用后,单因素方差分析(ANOVA)和Duncan多重比较用于比较不同样品的数据差异的显著性,P<0.05表示差异显著。
2 结果 2.1 RNA提取结果及引物筛选结果将提取的RNA进行RNA完整性检测,经1%琼脂糖凝胶电泳进行检测分析,由图 1可知,样品电泳后所得到的条带显示28S,18S条带清晰,且28S条带的亮度明显高于18S。表明提取的RNA完整性良好,符合后续实验要求。
 |
| 图 1 海胆部分样品RNA的琼脂糖电泳图 Fig. 1 Agarose electrophoresis pattern of RNA 1—6点样口为海胆样品 |
在高温诱导过程中,以hsp70和hsp90基因在海胆各组织中0时刻的表达量作为初始值。hsp70和hsp90在海胆的管足、体腔细胞和肠组织中的表达趋势基本相同,即随着温度其相对表达量迅速升高,在温度达到设置的最高温度(29°C)时其相对表达量也均达到最大且显著高于其初始值(P<0.05),其中在实验进行至6h时,海胆管足中hsp70和hsp90的相对表达量分别高于初始值236倍和109倍。
性腺中hsp70的相对表达量经过12h达到最大值,为106.56; hsp90的相对表达量经过24h达到最高,为45.33,且显著高于其初始值(P<0.05)。口器中hsp70和hsp90两基因的相对表达量均经过12h达到最大值,分别为145.55和45.56,显著高于其初始值(P<0.05)(图 2,图 3)。
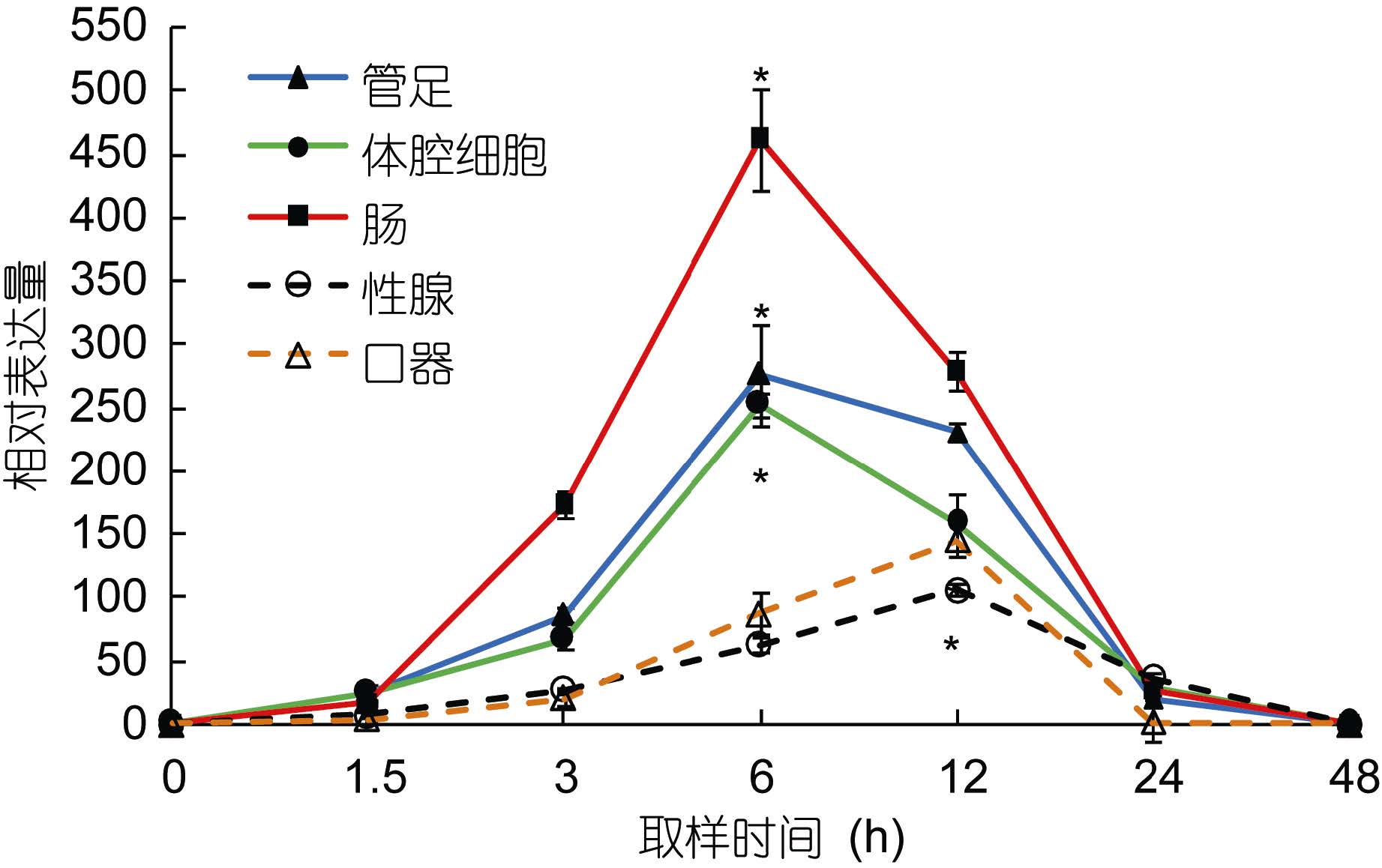 |
| 图 2 中间球海胆不同组织中hsp70的相对表达量 Fig. 2 Relative expression of hsp70 in different tissues of S. intermedius *代表同一组织样中此时间点的相对表达量与初始值相比差异显著(P<0.05)。横坐标为实验开始后进行取样的时间点, 纵坐标为基因的相对表达量。下同 |
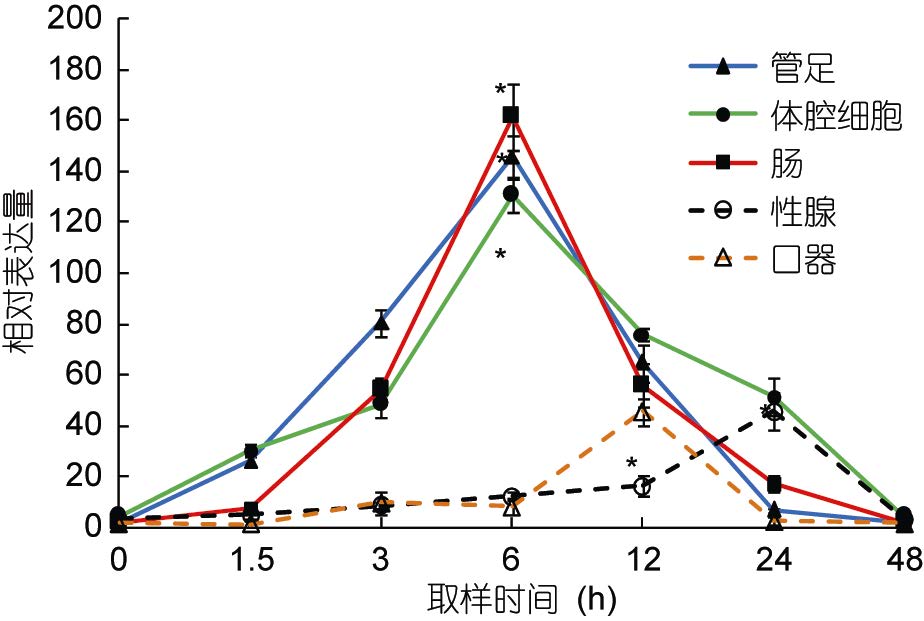 |
| 图 3 中间球海胆不同组织中hsp90的相对表达量 Fig. 3 Relative expression of hsp90 in different tissues of S. intermedius |
图 4为中间球海胆耐热家系和对照家系中hsp70基因的荧光定量表达结果,各组以0h的hsp70表达量作为初始值。在实验过程中,耐热家系(2013Si1-1,2013Si7-2,2013Si13-2)和对照家系(2013SiC-3,2013SiC-5,2013SiC-6)中hsp70的表达趋势基本相同,从适宜水温19°C(0h)升至29°C(3h)的过程中,hsp70的相对表达量均逐渐升高并在29°C时出现最大值(分别为329.75、97.29、239.31、230.02、120.51、194.75),且显著高于其初始值(P<0.05)。在0h、1.5h、6h、24h和48h,6个家系之间hsp70基因的相对表达量差异不显著(P>0.05)。在3h耐热家系2013Si7-2和对照家系2013SiC-5,耐热家系2013Si13-2和对照家系2013SiC-3之间hsp70基因的相对表达量显著不显著(P>0.05)。在温度维持在29°C的过程中hsp70的相对表达量逐渐下降,且在随后的温度逐渐自然回落的过程中,hsp70的相对表达量出现了明显的下降并在实验开始后48h(19°C)降至接近初始值。
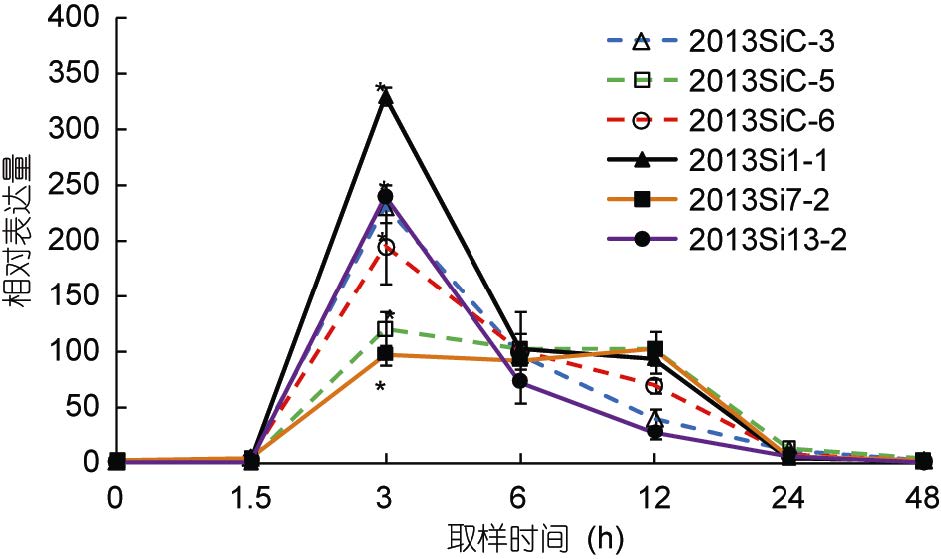 |
| 图 4 中间球海胆不同家系中hsp70基因的相对表达量 Fig. 4 Relative expression of hsp70 in different chains of S. intermedius 耐热家系2013Si1-1、2013Si7-2、2013Si13-2; 对照家系2013SiC-3、2013SiC-5、2013SiC-6。下同 |
高温诱导对中间球海胆hsp90基因表达的影响如图 5所示,其中各组以0h的hsp90表达量作为初始值。在实验过程中,hsp90的相对表达量均有不同程度的增加,各组达到最大值的时间点不同,并且随着温度的变化其表达趋势也不同。hsp90在这6组中均随着温度而升高,虽然每组hsp90的相对表达量达到最大值的时间点有差异,但三个耐热家系和一个对照家系(2013SiC-5)的相对表达量的最大值均显著高于其初始值(P<0.05)。由图 5可看出,耐热家系在高温诱导过程中,hsp90的相对表达量增加的速率明显快于对照家系,且耐热家系(2013Si1-1和2013Si7-2)在12h的相对表达量显著高于对照家系(2013SiC-3和2013SiC-6)(P<0.05)。在实验开始后48h(19°C),6个家系中hsp90的相对表达量均降至接近初始值。
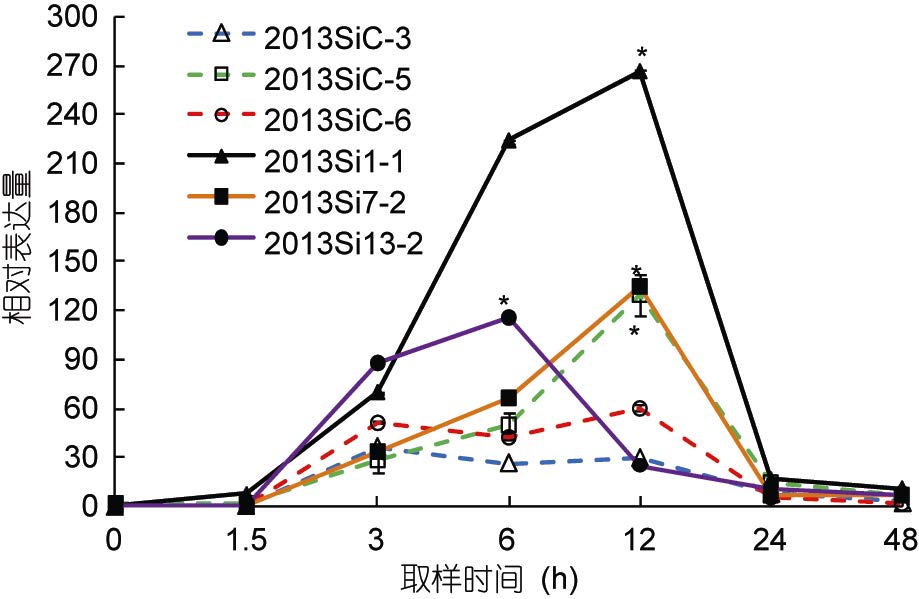 |
| 图 5 中间球海胆不同家系中hsp90基因的相对表达量 Fig. 5 Relative expression of hsp90 in different chains of S. intermedius |
热休克蛋白作为分子伴侣与胞内多肽形成复合物,有助于蛋白质折叠、防止蛋白质聚集和胞内蛋白质运输,满足细胞最基本的生存功能(Pratt et al,2003)。本研究对中间球海胆hsp70和hsp90基因的组织特异性表达进行了分析,结果表明,所检测的5个不同组织(管足、体腔细胞、肠、性腺和口器)中均有hsp70和hsp90的表达。在正常条件下,海胆能合成hsp70和hsp90。
以往对hsp70和hsp90基因在生物体不同组织中的表达也有研究报道。周鑫等(2013)报道了草鱼热休克蛋白组织特异性表达与不同组织对温度变化的敏感和耐受程度有关; 黄桂菊等(2007)研究高温刺激合浦珠母贝不同组织中热休克蛋白hsp70的表达量,结果显示,hsp70的表达量大小依次为鳃、消化腺、外套膜、闭壳肌、性腺; 韩俊英等(2011)通过RT-PCR对hsp70在脊尾白虾的肝胰腺和肌肉中的表达分析发现,温度引起该基因的高表达,且在肝胰腺中的高表达时间相对肌肉较早,肝胰腺胁迫比肌肉较敏感。本研究结果显示,当温度升高后,海胆hsp70基因在各组织中的表达均发生了变化,由图 2和图 3可知,hsp70和hsp90在口器和性腺中的表达趋势不同于管足、体腔细胞和肠,且hsp70和hsp90的相对表达量也明显低于后三者,与黄桂菊等(2007)和韩俊英等(2011)的实验结果相似,推测hsp70和hsp90在中间球海胆的管足、体腔细胞和肠三种组织中优先转录和表达,可见各组织对高温产生应激的次序和程度存在差异。
3.2 高温诱导对中间球海胆不同家系中hsps表达的影响体腔细胞多用于研究生物体对环境胁迫的敏感响应(Matranga et al,2000),小个体海胆不能提供足量的体腔液,而海胆的选育工作通常在个体较小的早期进行。管足是棘皮动物水管系统的主要组成部分(常亚青等,2004),易于获取,且可活体取样,对海胆伤害较小。本实验研究了海胆的管足和体腔细胞中hsp70和hsp90基因的相对表达量,结果显示这两个基因在管足和体腔细胞中的表达趋势相似,且在各个时间点的相对表达量差异不显著(P>0.05)。Osovitza等(2005)也曾用管足组织研究了环境温度对紫色球海胆(Strongylocentrotus purpuratus)hsp70表达的影响。因此本研究以管足作为样本进行海胆耐热家系和对照家系hsps的相关研究。
高温诱导条件下,hsp70和hsp90作为分子伴侣在阻止细胞凋亡的过程中扮演着不同的角色(Yahara,1998; Mosser et al,2000; Saleh et al,2000),因此如果用内源hsps作为环境热应激的指标,应该将不同类型hsps分开研究。Wang等(2014)报道,急性热应激和渗透压胁迫对刺参hsp70、hsp90和sod基因表达的影响。董云伟等(2008)发现,刺参的hsp70的表达量在温度升高后立即升高; 曲凌云等(2005)报道,高温刺激栉孔扇贝后,其血淋巴细胞中hsp70的表达量逐渐升高。本研究结果显示,海胆耐热家系和对照家系中hsp70的表达量在温度升高过程中逐渐增加,与两位研究者的结论一致,推测海胆在受到温度升高刺激时,机体迅速合成hsps,从而可以增强机体的应激耐受性以保护组织细胞(Matranga et al,2002)。
Dong等(2008)指出刺参在30°C预处理后,其耐受性的变化与hsps的变化模式一致。Dubeau等(1998)指出鲑鱼(Salmo salar)成活率的提高与hsps水平在热激后显著升高有直接关系。本研究高温诱导过程中,hsp70基因在海胆耐热家系和对照家系中的表达未出现明显差异(P>0.05); hsp90在耐热家系中的相对表达量增加的速率明显比对照家系的快,且在12h(温度升至最高的时间点)耐热家系(2013Si1-1和2013Si7-2)的相对表达量显著高于对照家系(2013SiC-3和2013SiC-6)(P<0.05); 而在耐热家系2013Si13-2中该基因的相对表达量高于对照家系中2013SiC-5的原因可能是由于本研究的中间球海胆耐热家系和对照家系的样本都是从耐热家系总体和未经过筛选的家系总体中随机挑选的,所以两个总体内部的样本点之间也会存在差异(组内方差),对照家系也会存在潜在的“耐热家系”。综上所述,hsp90基因可作为中间球海胆耐热品系选育的候选指示因子。在后续的研究中,还将对在高温诱导条件下hsp70、hsp90基因与海胆活性及死亡率的相关性进行进一步验证,为中间球海胆耐热品系的快速选育提供参考。
3.3 Hsps基因表达的时序性hsp70和hsp90这两个基因的表达具有时序性,在高温环境条件下,机体合成热休克蛋白作为分子伴侣防止变性蛋白被降解(董云伟等,2008),并且hsp70和hsp90对凋亡体形成的不同阶段发挥各自的阻断作用(Mosser et al, 2000; Saleh et al,2000)。仿刺参经热激72h后hsp70表达量降至初始值(Dong et al,2008; Meng et al,2011)。Roberts等(1997)也指出hsps的表达具有可塑性,且与环境因子有关。本研究结果也显示,hsp70和hsp90基因在中间球海胆中均出现时序性表达,性腺中hsp70和hsp90达到最大值的时间点也不相同,hsp90较hsp70延迟; 在海胆耐热家系和对照家系中,hsp70基因的表达量在升温过程中的3h达到最大值,hsp90基因的表达量达到最高值的时间点不同。说明HSP70和HSP90虽都是热休克蛋白家族的成员,但在海胆耐热诱导过程中响应不同。
| 于姗姗,王青林,孟宪亮等, 2012.盐度骤变对仿刺参hsp70及hsp90基因表达的影响.中国海洋大学学报(自然科学版), 42(9):22-27 |
| 马福恒, 2002.盐度和温度对中间球海胆摄食与存活的影响.水产科学, 21(6):1-3 |
| 吉成龙,孙国华,杨建敏等, 2011.刺参(Apostichopus japonicus)高温胁迫消减cDNA文库的构建与分析.海洋与湖沼, 42(1):60-66 |
| 曲凌云,相建海,孙修勤等, 2005.温度刺激下栉孔扇贝不同组织热休克蛋白HSP70的表达研究.高技术通讯, 15(5):96-100 |
| 周鑫,董云伟,王芳等, 2013.草鱼hsp70和hsp90对温度急性变化的响应.水产学报, 37(2):216-221 |
| 常亚青,丁君,宋坚等, 2004.海参、海胆的生物学研究与养殖.北京:海洋出版社, 217-218 |
| 常亚青,王子臣,王国江, 1999.温度和藻类饵料对虾夷马粪海胆摄食及生长的影响.水产学报, 23(1):69-76 |
| 黄桂菊,曲妮妮,喻达辉等, 2007.合浦珠母贝热休克蛋白hsp70基因的克隆与表达分析.中国水产科学, 14(5):726-732 |
| 董云伟,董双林,纪婷婷, 2008.水生动物热休克蛋白研究进展.中国海洋大学学报(自然科学版), 38(1):39-44 |
| 韩俊英,李健,李吉涛等, 2011.脊尾白虾热休克蛋白HSP70基因的克隆及其表达分析.水产学报, 35(8):1130-1138 |
| Burge C A, Eakin C M, Friedman C S et al, 2014. Climate change influences on marine infectious diseases:implication for management and society. Annu Rev Mar Sci, 6:249-277 |
| Ding J, Chang Y Q, Wang C H et al, 2007. Evaluation of the growth and heterosis of hybrids among three commercially important sea urchins in China:Strongylocentrotus nudus, S. intermedius and Anthocidaris crassispina. Aquaculture, 272(1-4):273-280 |
| Dong Y W, Ji T T, Dong S L, 2007. Stress responses to rapid temperature changes of the juvenile sea cucumber(Apostichopus japonicus Selenka). Journal of Ocean University of China, 6(3):275-280 |
| Dong Y W, Dong S L, 2008. Induced thermotolerance and expression of heat shock protein 70 in sea cucumber Apostichopus japonicus. Fisheries Science, 74(3):573-578 |
| DuBeau S F, Pan F, Tremblay G C et al, 1998. Thermal shock of salmon in vivo induces the heat shock protein hsp 70 and confers protection against osmotic shock. Aquaculture, 168(1-4):311-323 |
| Matranga V, Bonaventura R, Di B G, 2002. Hsp70 as a stress marker of sea urchin coelomocytes in short term cultures. Cell Molecular Biology(Noisy-le-grand), 48(4):345-349 |
| Matranga V, Toia G, Bonaventura R et al, 2000. Cellular and biochemical responses to environmental and experimentally induced stress in sea urchin coelomocytes. Cell Stress and Chaperones, 5(2):113-120 |
| Meng X L, Dong Y W, Dong S L et al, 2011. Mortality of the sea cucumber, Apostichopus japonicus Selenka, exposed to acute salinity decrease and related physiological responses:Osmoregulation and heat shock protein expression. Aquaculture, 316(1-4):88-92 |
| Mosser D D, Caron A W, Bourget L et al, 2000. The chaperone function of hsp70 is required for protection against stress-induced apoptosis. Molecular and Cellular Biology, 20(19):7146-7159 |
| Osovitza C J, Hofmann G E, 2005. Thermal history-dependent expression of the hsp70 gene in purple sea urchins:Biogeographic patterns and the effect of temperature acclimation. Journal of Experimental Marine Biology and Ecology, 327(2):134-143 |
| Pratt W B, Toft D O, 2003. Regulation of signaling protein function and trafficking by the hsp90/hsp70-based chaperone machinery. Experimental Biology and Medicine, 228(2):111-133 |
| Roberts D A, Hofmann G E, Somero G N, 1997. Heat-shock protein expression in Mytilus californianus:acclimatization(seasonal and tidal-height comparisons) and acclimation effects. Biological Bulletin, 192(2):309-320 |
| Saleh A, Srinivasula S M, Balkir L et al, 2000. Negative regulation of the Apaf-1 apoptosome by Hsp70. Nature Cell Biology, 2(8):476-483 |
| Wang Q L, Yu S S, Qin C X et al, 2014. Combined effects of acute thermal and hypo-osmotic stresses on osmolality and hsp70, hsp90 and sod expression in the sea cucumber Apostichopus japonicus Selenka. Aquaculture international, 22(3):1149-1161 |
| Yahara I, 1998. Structure and function of molecular chaperones:Functions of HSP90, a major stress protein. Neuroscience Research, 31(1):S15 |
| Zhang W J, Zhao C, Liu P J et al, 2010. First report on tube feet differential pigmentation in the cultivated sea urchin Strongylocentrotus intermedius(Agassiz, 1863) and its relationship with growth performance. Aquaculture Research, 41(10):e706-e708 |
| Zhao C, Ji N J, Zhang B L et al, 2014. Effects of covering behavior and exposure to a predatory crab Charybdis japonica on survival and HSP70 expression of juvenile sea urchins Strongylocentrotus intermedius. PLoS One, 9(5):e97840 |
 2015, Vol. 46
2015, Vol. 46


