
中国海洋湖沼学会主办。
文章信息
- 强俊, 杨弘, 马昕羽, 王辉, 徐跑, 何杰, 朱志祥. 2015.
- QIANG Jun, YANG Hong, MA Xin-Yu, WANG Hui, XU Pao, HE Jie, ZHU Zhi-Xiang. 2015.
- 基于响应曲面法研究亚硝酸盐与养殖密度对吉富罗非鱼幼鱼生长与肝脏抗氧化力的影响
- USING RESPONSE SURFACE METHODOLOGY TO DETERMINE EFFECTS OF CHRONIC NITRITE EXPOSURE AND STOCKING DENSITY ON GROWTH OF GIFT TILAPIA OREOCHROMIS NILOTICUS JUVENILES
- 海洋与湖沼, 46(5): 1166-1174
- Oceanologia et Limnologia Sinica, 46(5): 1166-1174.
- http://dx.doi.org/10.11693/hyhz20150200041
-
文章历史
- 收稿日期: 2015-02-01
- 收修改稿日期: 2015-03-10
2. 南京农业大学无锡渔业学院 无锡 214081;
3. 淮阴师范学院生命科学学院 淮安 223300
2. Nanjing Agricultural University, Wuxi Fisheries College, Wuxi 214081, China;
3. Huaiyin Normal University, School of Life Science, Huaian 223300, China
NO2-对鱼体的毒性与许多环境因子相互联系,如温度( et al,2006)、盐度(Lin et al,2003)、溶氧(曲克明等,2007)、pH(Chen et al,2000)与氯化物含量(Perrone et al,1977; Wang et al,2006)等。尤其是氯化物,Wang等(2006)研究发现,尼罗罗非鱼(Oreochromis niloticus)的NO2-半致死浓度在水中氯化物含量较低时(35mg/L)为28.18mg/L,而含量较高时(70.0mg/L)为44.67mg/L; Perrone等(1977)报道,银大马哈鱼(Oncorhynchus kisutch)暴露在NO2-与Cl-含量分别为29.8和261.3mg/L水环境中,48h时未见死亡发生,而浓度分别为3.8和2.5mg/L时,12h后死亡率达到58.3%。另外,鱼体对NO2-的耐受性也与自身规格有关。Atwood等(2011)发现,小规格尼罗罗非鱼(4.4g)与大规格的(90.7g)相比,96h NO2-的半致死浓度分别为81 mg/L和8mg/L。
养殖密度是影响水产养殖生产力和水产品品质的重要因素。随着我国南方地区罗非鱼集约化养殖的大规模发展,合理地增加养殖密度有助于提高水体利用与养殖效益。然而,鱼类种群数目增加可能对其生存空间与摄食产生影响,引起拥挤胁迫(Montero et al,1999),影响养殖群体生长率和存活率(马爱军等,2005; Merino et al,2007)。同时高密度集约化养殖也会增加水环境中氨氮、亚硝酸盐等有毒物质含量,影响机体的免疫力,增加鱼病发生的几率(王文博等,2004; Nga et al,2005)。
已有研究发现,养殖密度与水环境因子对水生动物生长、存活(Salama,2005)以及生化指标(董晓煜等,2008)存在联合影响。养殖密度与水环境因子之间是相互联系、相互制约的关系。本实验主要研究了不同养殖密度下,慢性亚硝酸盐胁迫对吉富罗非鱼幼鱼生长与肝脏抗氧化力的影响,利用响应曲面法分析了因子间可能的二次效应与互作效应,建立了相关的曲面模型。本研究对保障罗非鱼集约化养殖高产、高效、安全、健康,实现罗非鱼产业的可持续发展具有重要的意义。
1 材料与方法 1.1 材料实验开始前将吉富罗非鱼幼鱼放置于室内4.2m3水泥池中暂养8d,暂养条件为水温(28±0.5)℃),pH 7.4±0.2,亚硝酸盐低于0.01 mg/L,溶氧高于5mg/L。暂养期间每天投喂膨化饲料2次(8: 00和15: 00),饲料中粗蛋白含量为28%,粗脂肪为6%。
1.2 实验设计与分组正式实验开始前,采用预实验分析实验鱼正常生长的亚硝酸盐范围。本实验运用中心复合实验设计(Central Composite Rotatable Design: CCD),以亚硝酸盐(0.02—2.8mg/L)与养殖密度(1—5尾/10L)为实验考察因子,分别以N和D表示。实验组合见表 1,实验中每个组合重复3次。特定生长率(specific growth rate: SGR)和肝脏SOD、CAT活力与MDA含量为本实验的响应值,具体的编码水平与实际值见表 1。
| 组别 | 编码值 | 实际值 | 特定生长率(%/d) | 丙二醛(nmol/mg) | 超氧化物歧化酶[U/(mg prot)] | 过氧化氢酶 [U/(mg prot)] | ||
| N | D | N(mg/L) | D(尾/10L) | |||||
| 1 | 1 | 0 | 2.80 | 3.00 | 3.98±0.34 | 0.95±0.11 | 87.51±6.53 | 30.58±4.52 |
| 2 | a | -a | 2.39 | 1.59 | 4.72±0.59 | 0.74±0.06 | 94.17±8.14 | 24.44±3.17 |
| 3 | -a | -a | 0.43 | 1.59 | 7.09±0.67 | 0.61±0.07 | 77.44±6.72 | 21.79±3.55 |
| 4 | 0 | 0 | 1.41 | 3.00 | 6.58±0.53 | 0.75±0.04 | 96.57±7.13 | 47.32±5.32 |
| 5 | 0 | -1 | 1.41 | 1.00 | 4.81±0.39 | 0.72±0.06 | 91.72±8.11 | 17.23±1.96 |
| 6 | 0 | 1 | 1.41 | 5.00 | 3.47±0.41 | 0.94±0.12 | 76.52±7.17 | 27.25±2.82 |
| 7 | a | A | 2.39 | 4.41 | 4.28±0.37 | 0.97±0.13 | 71.39±6.33 | 18.29±2.53 |
| 8 | -a | A | 0.43 | 4.41 | 4.32±0.38 | 0.88±0.09 | 77.24±8.25 | 32.61±3.94 |
| 9 | 0 | 0 | 1.41 | 3.00 | 6.72±0.58 | 0.78±0.07 | 108.52±9.18 | 45.63±5.13 |
| 10 | 0 | 0 | 1.41 | 3.00 | 6.14±0.48 | 0.83±0.06 | 104.28±8.42 | 44.57±4.72 |
| 11 | 0 | 0 | 1.41 | 3.00 | 6.49±0.55 | 0.75±0.06 | 104.68±9.13 | 43.68±5.02 |
| 12 | 0 | 0 | 1.41 | 3.00 | 6.07±0.42 | 0.82±0.06 | 106.9±8.61 | 42.63±4.13 |
| 13 | -1 | a | 0.02 | 3.00 | 7.26±0.61 | 0.71±0.05 | 75.43±5.33 | 35.36±2.85 |
| (1)-a、-1、0、1、a分别为计算机编码水平,α为星号臂,|α| =1.41421; 中心点重复5次 | ||||||||
选取39个容积为1200L的塑料养殖桶,每个桶1000L自来水,曝气3d后使用。本实验中采用NaNO2调节水中亚硝酸盐浓度,实验开始前先配制4.93 g/L的亚硝酸盐母液。实验中每隔4h调节水中亚硝酸盐浓度一次,检测方法按照Chen等(2000)。实验用鱼的驯化采用渐进方式,每天水中亚硝酸盐浓度增加0.2—0.3 mg/L,分别驯化至实验所需浓度(0.02,0.43,1.41,2.39和2.8 mg/L),在此亚硝酸盐浓度下驯养10d左右,吉富罗非鱼可以正常摄食与活动后开始实验。实验期间采用恒温加热棒控温在(28±0.5)℃,pH 7.6±0.2。实验用鱼体重为(2.97±0.06)g,体长为(4.45±0.12)cm,将表 1的养殖密度: 1、1.59、3、4.41和5尾/10L)转换为实际鱼数为100、159、300、441和500尾/m2,实验共需11700尾鱼,各实验组合鱼体均重无显著差异(ANOVA,P>0.05)。饲料投喂量为体重的4%—6%。实验期间连续充气,每隔3d换水1/3,换水前后温差不超过±0.5℃,自然光周期。未添加亚硝酸盐前的实验用水中NO2-<0.01 mg/L,NO3-<3.5 mg/L,总氨氮0.02mg/L,Cl- 16mg/L。
1.4 响应值测定取样前停饲24h,每个实验组合随机挑选20尾鱼测量体重,特定生长率(SGR)(%/d)= [(lnW2-lnW1)/(t2-t1)] ×100。式中,W1、W2分别为起始时间t1、终末时间t2时的体重(g)。
每个养殖桶随机取5尾鱼,取0.1g左右的肝脏用液氮速冻后,于-70℃保存,用于酶活与MDA分析。用预冷生理盐水冲洗解冻后的肝脏样品,滤纸吸干水分,分析天平称重后加入4倍体积(W/V)预冷生理盐水,使用匀浆器研磨制匀浆,粗酶液置于4℃保存,在24h内测定完毕。肝脏组织中丙二醛(Malondialdehyde: MDA)含量测定参照Xiang等(1990); 超氧化物歧化酶(Superoxide dismutase: SOD)含量测定参照Ōyanagui(1984); 过氧化氢酶(Catalase: CAT)含量测定参照Sinha(1972); 蛋白质采用Felin-酚试剂法(Lowry et al,1951),试剂盒购于南京建成生物科技有限公司。
1.5 数据处理与模型建立本实验中的测定结果用平均值±标准差(Mean± St and ard diversion)表示。实验设计与结果处理采用STATISTICA 8.0软件,通过最小二乘法拟合因子与响应值之间的二次多项回归模型为:
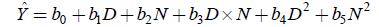
式中,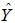 为响应预测,在此响应指标为SGR、MDA、SOD和CAT; b0、b1、b2、b3、b4、b5,分别为回归常数、N与D的一次效应、N与D间互作效应、N与D的二次效应。显著水平P<0.05,极显著水平P<0.01。
为响应预测,在此响应指标为SGR、MDA、SOD和CAT; b0、b1、b2、b3、b4、b5,分别为回归常数、N与D的一次效应、N与D间互作效应、N与D的二次效应。显著水平P<0.05,极显著水平P<0.01。
将表 1中SGR结果采用最小二乘法进行回归拟合,结果列于表 2。回归方程系数显著性检验中N、D、D×N和N2和D2对SGR均有显著影响(P<0.05)(表 2)。同时,由表 2回归系数可见,在对SGR影响效应上,N占主效应。D和N与SGR之间模型为(1):
SGR=5.2675 +2.1810D-1.1775N+0.4191D×N-0.5372D2- 0.3461N2(决定系数R2=0.9384)
| 变异来源 | 回归系数 | 标准误 | 95%置信下限 | 95%置信上限 | P值 |
| Intercept | 6.4000 | 0.1894 | 5.9522 | 6.8478 | |
| D | -0.6381 | 0.1497 | -0.9922 | -0.2841 | 0.0037 |
| N | -0.8811 | 0.1497 | -1.2351 | -0.5270 | 0.0006 |
| D×N | 0.5825 | 0.2117 | 0.0818 | 1.0832 | 0.0285 |
| D2 | -1.0744 | 0.1606 | -1.4540 | -0.6947 | 0.0003 |
| N2 | -0.3344 | 0.1606 | -0.7140 | 0.0453 | 0.0758 |
| R2= 0.9384 Adj R2=0.8944(Adj R2为校正系数) | |||||
| 表中系数为因子编码水平下的估计 | |||||
N和D与SGR之间的响应曲面图及其等高线图见图 1(a和b)。本实验条件下,随着水环境中N升高,SGR基本在6.90%/d; 然而,N高于0.70mg/L时,SGR呈下降趋势(P<0.05); SGR随D的增加呈先上升后下降的趋势。D为2.03—2.36尾/10L,N为0.43—0.48mg/L时,SGR介于7.26—7.29%/d。
 |
| 图 1 亚硝酸盐、密度及其交互作用对吉富罗非鱼幼鱼特定生长率影响的响应面(a)和等高线(b) Fig. 1 Response surface plot(a) and its contour plot(b)of the effect of nitrite and stocking density and their mutual interactions on SGR in GIFT tilapia juvenile |
采用最小二乘法对表 1的MDA数据进行回归拟合,分析结果列于表 3。D和N对MDA有极显著影响(P<0.01),D2、N2和D×N对MDA没有显著影响(P>0.05)(表 3); 在对MDA的影响效应上,D较为显著。回归模型为(2):
MDA=0.5353+0.0383D+0.0504N-0.0072D×N +0.0073D2+ 0.0150N2(决定系数R2=0.9004)
| 变异来源 | 回归系数 | 标准误 | 95%置信下限 | 95%置信上限 | P值 |
| Intercept | 0.7860 | 0.0198 | 0.7391 | 0.8329 | |
| D | 0.1014 | 0.0157 | 0.0643 | 0.1385 | 0.0003 |
| N | 0.0699 | 0.0157 | 0.0329 | 0.1070 | 0.0029 |
| D×N | -0.0100 | 0.0222 | -0.0624 | 0.0424 | 0.6656 |
| D2 | 0.0145 | 0.0168 | -0.0253 | 0.0543 | 0.4170 |
| N2 | 0.0145 | 0.0168 | -0.0253 | 0.0543 | 0.4170 |
| R2= 0.9004 Adj R2=0.8292(Adj R2为校正系数) | |||||
| 表中系数为因子编码水平下的估计 | |||||
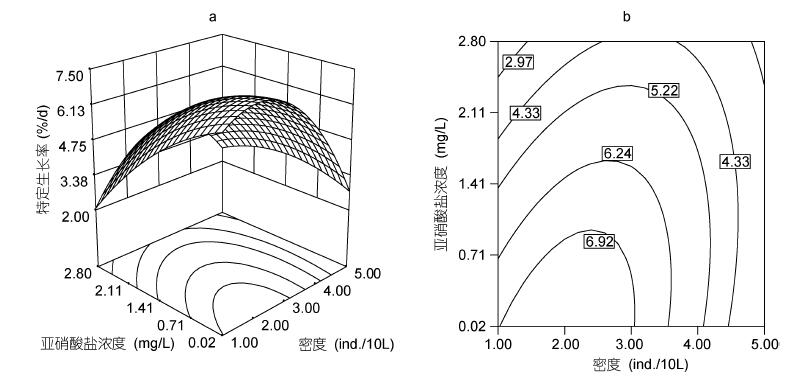
由图 2可见,MDA含量随着N与D的增加而上升。当N为1.41mg/L,D为1尾/10L时,幼鱼肝脏MDA含量为0.67nmol/mgprot; 高密度刺激了肝脏MDA含量的增加,D为5尾/10L,MDA含量达到0.96nmol/mg prot。
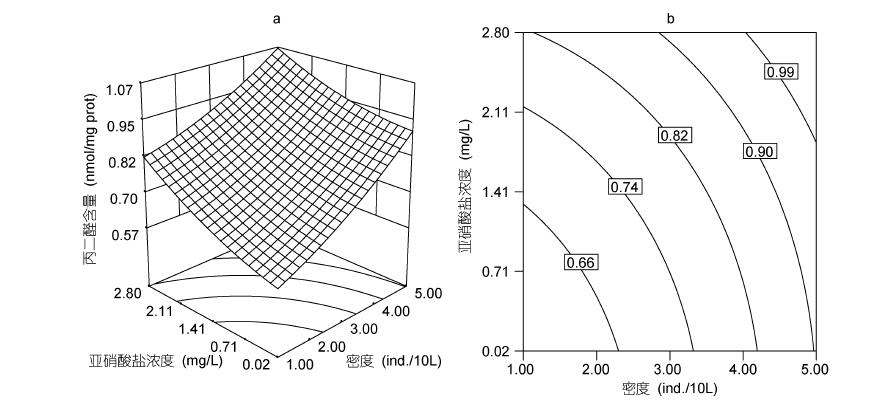 |
| 图 2 亚硝酸盐、密度及其交互作用对吉富罗非鱼幼鱼肝脏MDA含量影响的响应面(a)和等高线(b) Fig. 2 Response surface plot(a) and its contour plot(b)of the effect of nitrite and stocking density and their mutual interactions on hepatic MDA contents in GIFT tilapia juvenile |
SOD回归分析结果见表 4。D、D2和N2对SOD有极显著影响(P<0.01),而N与D×N对SOD也有显著影响(P<0.05)(表 4); 回归系数显示,D对SOD的效应较N明显。回归模型为(3):
SOD=20.7658+33.9543D+50.8997N-4.0612D×N- 5.3599D2-12.4680N 2(决定系数R2=0.9520)
| 变异来源 | 回归系数 | 标准误 | 95%置信下限 | 95%置信上限 | P值 |
| intercept | 104.1920 | 1.7280 | 100.1060 | 108.2780 | |
| D | -5.5595 | 1.3661 | -8.7898 | -2.3292 | 0.0048 |
| N | 3.4955 | 1.3661 | 0.2652 | 6.7257 | 0.0376 |
| D×N | -5.6450 | 1.9319 | -10.2133 | -1.0767 | 0.0223 |
| D2 | -10.7198 | 1.4650 | -14.1838 | -7.2557 | 0.0002 |
| N2 | -12.0448 | 1.4650 | -15.5088 | -8.5807 | < 0.0001 |
| R2= 0.9520 Adj R2=0.9178(Adj R2为校正系数) | |||||
| 表中系数为因子编码水平下的估计 | |||||
本实验条件下,当D为3尾/10L时,SOD活力随水环境中N浓度增加(从0.02 mg/L到1.50mg/L)而上升; 然而,随着N浓度继续上升(>1.50mg/L),SOD活力显著降低(P<0.05)(图 3); 同时,N为1.63 mg/L,D为2.55尾/10L时,肝脏SOD活力为105.46 U/(mg prot),其可靠性为0.918。
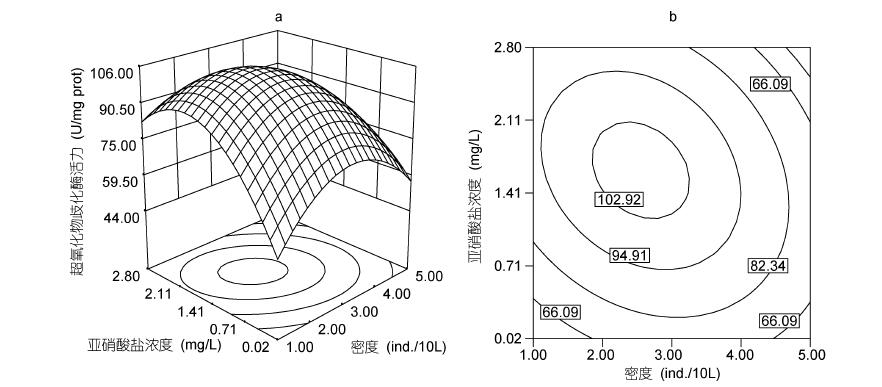 |
| 图 3 亚硝酸盐、密度及其交互作用对吉富罗非鱼幼鱼超氧化物歧化酶活力影响的响应面(a)和等高线(b) Fig. 3 Response surface plot(a) and its contour plot(b)of the effect of nitrite and stocking density and their mutual interactions on hepatic SOD activities in GIFT tilapia juvenile |
CAT活力拟合与显著性检验结果见表 5。回归模型极显著(P<0.01); 失拟项P=0.1186>0.05,模型有效。N,D和D×N对CAT活力有显著影响(P<0.05),N2与D2对CAT活力有极显著影响(P<0.01)(表 5); 回归系数显示,N与D对CAT活力的影响无明显差异。D、N与CAT活力之间的实际二次回归模型(4):
CAT=-38.1042+42.2497D+26.4542N-3.0522D×N - 6.0468D2-6.9651N2(决定系数R2=0.9650)
| 变异来源 | 回归系数 | 标准误 | 95%置信下限 | 95%置信上限 | P值 |
| Intercept | 44.7660 | 1.1883 | 41.9561 | 47.5759 | |
| D | 2.3551 | 0.9394 | 0.1336 | 4.5765 | 0.0406 |
| N | -2.3037 | 0.9394 | -4.5252 | -0.0823 | 0.0440 |
| D×N | -4.2425 | 1.3286 | -7.3841 | -1.1009 | 0.0152 |
| D2 | -12.0936 | 1.0074 | -14.4759 | -9.7114 | < 0.0001 |
| N2 | -6.7286 | 1.0074 | -9.1109 | -4.3464 | 0.0003 |
| R2= 0.9650 Adj R2=0.9401(Adj R2为校正系数) | |||||
| 表中系数为因子编码水平下的估计 | |||||
本实验条件下,D为3尾/10L,肝脏CAT活力随水中N浓度的增加(从0.02mg/L上升为1.35mg/L)而上升; 然而,水环境中N高于1.35mg/L时,罗非鱼肝脏CAT活力呈下降趋势(图 4); D对CAT活力的影响与SOD相似。当D为3.19尾/10L,N为1.20 mg/L时,CAT活力为45.17 U/(mg prot),其可靠性为0.929。
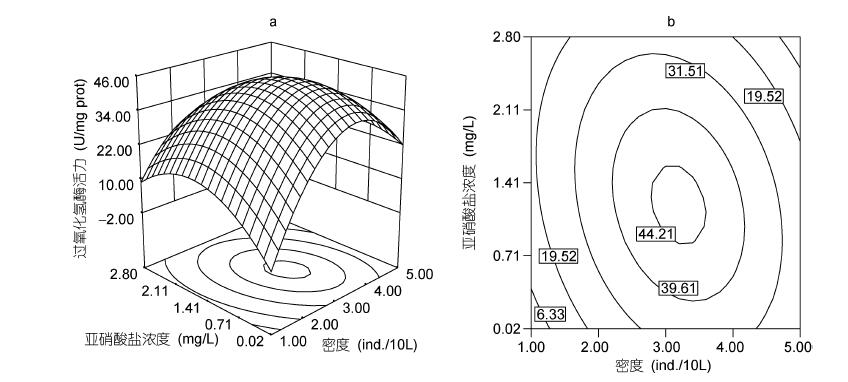 |
| 图 4 亚硝酸盐、密度及其交互作用对吉富罗非鱼幼鱼过氧化氢酶活力影响的响应面(a)和等高线(b) Fig. 4 Response surface plot(a) and its contour plot(b)of the effect of nitrite and stocking density and their mutual interactions on CAT activities in GIFT tilapia juvenile |
在含氮化合物中,氨氮与亚硝酸盐是水产养殖系统中主要的污染物。水环境中亚硝酸盐的毒性依据实验条件的不同以及生物个体的特点,在不同鱼类中差异较大,这就给比较不同鱼类对于亚硝酸盐的敏感程度带来了困难。红肚鲳鱼(Colossoma macropomum)在急性亚硝酸盐胁迫下96h的半致死浓度为0.54mg/L,显示对亚硝酸盐胁迫极为敏感( Da Costa et al,2004); 虹鳟在温度为14.0—15.5℃时,96h的半致死浓度为11.2mg/L,而在10.0℃时仅为0.24mg/L(Russo et al,1977); 鲑类对亚硝酸盐的耐受性可达140mg/L(Russo et al,1977)。本研究中,在亚硝酸盐浓度不同、其它水环境因子基本相同的条件下,比较了水中Cl-浓度为16 mg/L时,不同养殖密度下慢性亚硝酸盐胁迫对吉富品系尼罗罗非鱼生长与肝脏抗氧化因子的影响。
3.1 亚硝酸盐与养殖密度对吉富罗非鱼幼鱼生长的影响亚硝酸盐能直接或间接影响鱼类的生长和生存,其对鱼类的毒害作用会严重制约水产养殖业的发展。亚硝酸盐对淡水生物的毒性远高于海洋生物,可能是因为海水中有较高的氯化物浓度以及对渗透压调节能力的不同(Jensen,2003)。本实验中,吉富罗非鱼不同实验组合下饲养35d后,养殖密度为3尾/10L时,亚硝酸盐浓度为0.02mg/L的实验组,幼鱼的特定生
长率是2mg/L组的1.82倍。Frances等(1998)研究发现石首鱼(Bidyanus bidyanus)在水中亚硝酸盐浓度低于16.2mg/L时,不会引起死亡; 而浓度高于1.43mg/L时,25d后,其生长速度显著降低。Siikavuopio等(2006)研究发现,大西洋鳕鱼span>(Gadus morhua)在0—5mg/L的亚硝酸盐浓度的水环境中,31d后,生长速度随浓度升高而降低,但对摄食率无明显影响。本研究中发现,当亚硝酸盐浓度高于0.7mg/L时,幼鱼的生长率显著下降。血红蛋白中的Fe2+可以通过水体的亚硝酸盐氧化为Fe3+,从而产生高铁血红蛋白,由于高铁血红蛋白缺乏运输氧气的能力,因而血液的载氧能力降低,呼吸机能下降,造成组织缺氧(Jensen,2003)。鱼体需要更多能量来加快自身解毒功能,鱼类活动能力会增强,呼吸频率加快,耗氧率上升(Mallasen et al,2006),因而用于生长的将会减少。与本实验结论相反,Kamstra等(1996)研究发现,随着水中亚硝酸盐浓度升高,50d后,高浓度实验组欧洲鳗鲡(Anguilla anguilla)的死亡率较高,但亚硝酸盐对其生长与饲料利用无显著影响,可能是因为各组鱼的死亡引起密度差异或其它环境因子的复合影响,导致无法更加有效的解释其生长数据。
Kebus等(1992)认为,高养殖密度抑制鱼类生长主要是由于高负载造成水质恶化引起的。本实验中,除了水中亚硝酸盐浓度不同外,其它各项水环境指标均在罗非鱼正常生长的范围之内。实验中发现,适当的提高养殖密度可能会刺激罗非鱼的能量代谢,通过提高外源食物的获取,在一定程度上促进罗非鱼的生长。然而,随着密度的增加,高养殖密度对罗非鱼产生了生理应激,动员体内更多的能量来弥补应激对能量的额外需求,从而导致用于生长的能量减少(Qiang et al,2013),对生长产生了抑制作用。
3.2 亚硝酸盐与养殖密度对吉富罗非鱼幼鱼肝脏MDA、SOD与CAT指标影响通常,氧化系统中特异酶活表达水平或活力的变化可以用于环境胁迫时机体氧化应激的生物指标(强俊等,2012)。本实验中,慢性亚硝酸盐胁迫改变了罗非鱼肝脏MDA含量和CAT与SOD的活力。亚硝酸盐浓度为1.35—1.41mg/L时,肝脏中较高的SOD与CAT活力可能与鱼体增加代谢来适应环境胁迫,减轻脂质过氧化损伤有关。然而,当水环境中的亚硝酸盐浓度高于罗非鱼自身的耐受范围时,MDA含量随着氧自由基积累而增加(强俊等,2011)。随着亚硝酸盐浓度继续上升,鱼体的SOD与CAT活力明显下降,可能是细胞代谢发生一定程度的改变而不是氧化应激的结果(Martínez-Álvarez et al,2002)。Wang等(2004)研究发现,日本沼虾(Macrobrachium nipponense)在半致死亚硝酸盐浓度下胁迫24h,SOD、CAT与GPx活力分别下降了67%、80.6%和82.7%。本研究中发现,罗非鱼肝脏SOD与CAT活力对水环境中亚硝酸盐的波动较为敏感,可用作评估其面对亚硝酸盐应激时的良好指示物。
鱼类工厂化养殖中,较高的水体亚硝酸盐浓度通常与高密度的养殖条件密切相连(Mallasen et al,2006)。Aksakal等(2011)发现,增加养殖密度会抑制抗氧化酶的代谢活力。罗非鱼养殖密度较低时(<3尾/ 10L)时,肝脏SOD与CAT活力的增加有助于降低鱼体氧化应激。同时,本研究发现SOD与CAT活力随着密度的继续升高(>3尾/10L)而下降,造成肝脏组织中的脂质过氧化物的进一步增加,MDA含量也呈上升趋势。这与彭士明等(2010)对银鲳(Pampus argenteus)幼鱼的研究结论相似,适当的养殖密度下可以刺激SOD与CAT活力的表达。
3.3 亚硝酸盐与养殖密度的互作与二次效应对吉富罗非鱼幼鱼生长及肝脏抗氧化指标的联合影响通过响应曲面分析法可以更好地分析因子对响应值的互作效应。本实验首次发现罗非鱼的生长(表 2)与SOD(表 4)、CAT(表 5)活力与考察因子亚硝酸盐与养殖密度之间存在显著的互作效应,而对MDA含量无互作效应。养殖密度对生长的影响随着水体中亚硝酸盐浓度的变化而变化。当水体中亚硝酸盐浓度为0.02 mg/L,特定生长率在密度为1尾/10L时,为6.90%/d; 而密度为5尾/10L时,仅为2.76%/d。亚硝酸盐浓度为2.8 mg/L,密度为5尾/10L时,特定生长率为2.60%/d。可能是因为,养殖密度较低时,亚硝酸盐对生长的影响被充足的水中溶氧所减弱(Foss et al,2007)。随着养殖密度的增加,高浓度的亚硝酸盐环境影响了罗非鱼呼吸频率与代谢率,鱼体消耗更多能量用于缓解胁迫。水体中亚硝酸盐的毒性也会破坏鱼体血液中血红蛋白的载氧能力,造成机体供氧不足,降低罗非鱼的代谢速率,机体产生的能量又主要用于应对生理胁迫,从而引起生长减慢、抗氧化能力减弱。此外,亚硝酸盐效应对生长的影响较养殖密度明显; 而密度对肝脏MDA含量与SOD活力上较亚硝酸盐明显。
同时,本研究首次发现养殖密度的二次效应对生长、SOD与CAT活力有显著影响,亚硝酸盐的二次效应对SOD与CAT活力也有显著影响。这在实际生产中有较高的应用价值。说明适当的养殖密度与亚硝酸盐的刺激对生长与抗氧化酶活力并无抑制作用,甚至有所提高。提高的抗氧化酶活力有助于罗非鱼增强其自身的非特异性免疫力,提高抗应激能力。
本实验建立了考察因子与响应值的二次回归数学模型,模型决定系数分别为0.9384、0.9004、0.9520和0.9650,可用于分析与预测。然而,需要注意的是,在实际集约化养殖中,如果养殖过大,对水质管理不规范,会引起水环境亚硝酸盐浓度升高,对鱼体产生生理胁迫。通过及时加注新水,增加溶氧,可以降低亚硝酸盐毒性,减少鱼体发病的几率,促进罗非鱼产业健康持续的发展。
| 马爱军, 陈 超, 雷霁霖等, 2005. 饲育密度对大菱鲆(Scophthalmus maximus L.)生长、饲料转化率及色素的影响. 海洋与湖沼, 36(3): 207—212 |
| 王文博, 李爱华, 汪建国等, 2004. 拥挤胁迫对草鱼非特异性免疫功能的影响. 水产科学, 28(2): 139—144 |
| 曲克明, 徐 勇, 马绍赛等, 2007. 不同溶解氧条件下亚硝酸盐和非离子氨对大菱鲆的急性毒性效应. 海洋水产研究, 28(4): 83—88 |
| 彭士明, 施兆鸿, 孙 鹏等, 2010. 养殖密度对银鲳幼鱼生长及组织生化指标的影响. 生态学杂志, 29(7): 1371—1376 |
| 董晓煜, 张秀梅, 张沛东, 2008. 溶解氧与养殖密度对褐牙鲆幼鱼血细胞数量及血红蛋白含量影响的研究. 海洋水产研究, 29(6): 40—46 |
| 强 俊, 杨 弘, 王 辉等, 2012. 急性温度应激对吉富品系尼罗罗非鱼(Oreochromis niloticus)幼鱼生化指标和肝脏HSP70 mRNA表达的影响. 海洋与湖沼, 48(5): 943—953 |
| 强 俊, 徐 跑, 何 杰等, 2011. 氨氮与拥挤胁迫对吉富品系尼罗罗非鱼幼鱼生长和肝脏抗氧化指标的联合影响. 水产学报, 35(12): 140—144 |
| Aksakal E, Ekinci D, Erdoğan O et al, 2011. Increasing stocking density causes inhibition of metabolic-antioxidant enzymes and elevates mRNA levels of heat shock protein 70 in rainbow trout. Livestock Science, 141(1): 69—75 |
| Atwood H L, Fontenot Q C, Tomasso J R et al, 2001. Toxicity of nitrite to niletilapia: effect of fish size and environmental chloride. North American Journal of Aquaculture, 63: 49—51 |
| Camargo J A, Alonso A, Salamanca A, 2005. Nitrate toxicity to aquatic animals: a review with new data for freshwater invertebrates. Chemosphere, 58(9): 1255—1267 |
| Chen J C, Cheng S Y, 2000. Recovery of Penaeus monodon from functional anaemia after exposure to sublethal concentration of nitrite at different pH levels. Aquatic Toxicology, 50(1—2): 73—83 |
| Da Costa O T F, Ferreira D J D S, Mendonça F L P et al, 2004. Susceptibility of the Amazonian fish, Colossoma macropomum (Serrasalminae), to short-term exposure to nitrite. Aquaculture, 232(1—4): 627—636 |
| Deane E E, Woo N Y S, 2007. Impact of nitrite exposure on endocrine, osmoregulatory and cytoprotective functions in the marine teleost Sparus sarba. Aquatic Toxicology, 82(1): 85—93 |
| De Lima R L, Braun N, Kochhann D et al, 2011. Survival, growth and metabolic parameters of silver catfish, Rhamdia quelen, juveniles exposed to different waterborne nitrite levels. Neotropical Ichthyology, 9(1): 147—152 |
| Frances J, Allan G L, Nowak B F, 1998. The effects of nitrite on the short-term growth of silver perch (Bidyanus bidyanus). Aquaculture, 163(1—2): 63—72 |
| Foss A, Imsland A K, Roth B et al, 2007. Interactive effects of oxygen saturation and ammonia on growth and blood physiology in juvenile turbot. Aquaculture, 271(1—4): 244—251 |
| Holt G J, Arnold C R, 1983. Effects of ammonia and nitrite on growth and survival of red drum eggs and larvae. Transactions of the American Fisheries Society, 112: 314—318 |
| Jensen F B, 2003. Nitrite disrupts multiple physiological functions in aquatic animals. Comparative Biochemistry and Physiology A: Molecular & Integrative Physiology, 135(1): 9—24 |
| Kamstra A, Span J A, van Weerd J H, 1996. The acute toxicity and sub-lethal effects of nitrite on growth and feed utilization of European eel, Anguilla anguilla (L.). Aquaculture Research, 27(12): 903—911 |
| Kebus M J, Collins M T, Brownfield M S et al, 1992. Effects of rearing density on the stress response and growth of rainbow trout. Journal of Aquatic Animal Health, 4(1): 1—6 |
| Kroupova H, Machova J, Piackova V et al, 2008. Effects of subchronic nitrite exposure on rainbow trout (Oncorhynchus mykiss). Ecotoxicology and Environmental Safety, 71(3): 813—820 |
| Kroupová H, Máchová J, Piacková V et al, 2006. Nitrite intoxication of common carp (Cyprinus carpio L.) at different water temperatures. Acta Veterinaria Brno, 75(4): 561—569 |
| Lin Y C, Chen J C, 2003. Acute toxicity of nitrite on Litopenaeus vannamei (Boone) juveniles at different salinity levels. Aquaculture, 224(1—4): 193—201 |
| Lowry O H, Rosebrough N J, Farr A L et al, 1951. Protein measurement with the Frolin phenol reagent. The Journal of Biological Chemistry, 193(1): 265—275 |
| Mallasen M, Valenti W C, 2006. Effect of nitrite on larval development of giant river prawn Macrobrachium rosenbergii. Aquaculture, 261(4): 1292—1298 |
| Martínez-Álvarez R M, Hidalgo M C, Domezain A et al, 2002. Physiological changes of sturgeon Acipenser naccarii caused by increasing environmental salinity. The Journal of Experimental Biology, 205(23): 3699—3706 |
| Merino G E, Piedrahita R H, Conklin D E, 2007. The effect of fish stocking density on the growth of California halibut (Paralichthys californicus) juveniles. Aquaculture, 265(1— 4): 176—186 |
| Montero D, Izquierdo M S, Tort L et al, 1999. High stocking density produces crowding stress altering some physiological and biochemical parameters in gilthead seabream, Sparus aurata, juveniles. Fish Physiology and Biochemistry, 20(1): 53—60 |
| Nga B T, Lürling M, Peeters E T H M et al, 2005. Chemical and physical effects of crowding on growth and survival of Penaeus monodon Favricius post-larvae. Aquaculture, 246(1—4): 455—465 |
| Ōyanagui Y, 1984. Reevaluation of assay methods and establishment of kit for superoxide dismutase activity. Analytical Biochemistry, 142(2): 290—296 |
| Park I S, Lee J, Hur J W et al, 2007. Acute toxicity and sublethal effects of nitrite on selected hematological parameters and tissues in dark-banded rockfish, Sebastes inermis. Journal of the World Aquaculture Society, 38(2): 188—199 |
| Perrone S J, Meade T L, 1977. Protective effect of chloride on nitrite toxicity to coho salmon (Oncorhynchus kisutch). Journal of the Fisheries Research Board of Canada, 34(4): 486—492 |
| Qiang J, Yang H, Wang H et al, 2013.Physiological responses and HSP70 mRNA expression in GIFT tilapia juveniles, Oreochromis niloticus under short-term crowding. Aquaculture Research, 46(2): 335—345, doi: 10.1111/are.12189 |
| Russo R C, Thurston R V, 1977. The acute toxicity of nitrite to fishes. In: Tubb R A ed. Recent Advances in Fish Toxicology. Corvallis: U. S. Environmental Protection Agency, 118—131 |
| Salama A J, 2005. Effect of high salinity water on growth and survival of Penaeid postlarvae from the red sea at different stocking densities. Journal of King Abdulaziz University- Science, 17(1): 3—9 |
| Sinha A K, 1972. Colorimetric assay of catalase. Analytical Biochemistry, 47(2): 389—394 |
| Siikavuopio S I, Sæther B S, 2006. Effects of chronic nitrite exposure on growth in juvenile Atlantic cod, Gadus morhua. Aquaculture, 255(1—4): 351—356 |
| Svobodová Z, Máchová J, Poleszczuk G et al, 2005. Nitrite poisoning of fish in aquaculture facilities with water-recirculating systems. Acta Veterinaria Brno, 74(1): 129—137 |
| Wang W N, Wang A L, Zhang Y J et al, 2004. Effects of nitrite on lethal and immune response of Macrobrachium nipponense. Aquaculture, 232(1—4): 679—686 |
| Wang Y B, Zhang W J, Li W F et al, 2006. Acute toxicity of nitrite on tilapia (Oreochromis niloticus) at different external chloride concentrations. Fish Physiology and Biochemistry, 32(1): 49—54 |
| Xiang R, Wang D N, 1990. The improvement of the method spectrophotometer on lipid peroxides thiobarbituric acid. Progress in Biochemistry and Biophysics, 7: 241—242 |
| Yildiz H Y, Köksal G, Borazan G et al, 2006. Nitrite-induced methemoglobinemia in Nile tilapia, Oreochromis niloticus. Journal of Applied Ichthyology, 22(5): 427—426 |
 2015, Vol. 46
2015, Vol. 46


