
中国海洋湖沼学会主办。
文章信息
- 唐瞻杨, 陈文治, 罗永巨, 梁军能, 郭忠宝, 钟欢, 谭芸, 甘西, 贺融兴. 2015.
- TANG Zhang-Yang, CNEN Wen-Zhi, LUO Yong-Ju, LIANG Jun-Neng, GUO Zhong-Bao, ZHONG Huan, TAN Yun, GAN Xi, HE Rong-Xing. 2015.
- 尼罗罗非鱼(Tilapia nilotica)不同月龄数量性状遗传力估计
- ESTIMATING QUANTITATIVE TRAIT HERITABILITY FOR TILAPIA NILOTICA OF DIFFERENT MONTHS
- 海洋与湖沼, 46(5): 1180-1185
- Oceanologia et Limnologia Sinica, 46(5): 1180-1185.
- http://dx.doi.org/10.11693/hyhz20150200053
-
文章历史
- 收稿日期: 2015-02-12
- 收修改稿日期: 2015-07-29
2. 上海海洋大学水产与生命学院 上海 201306;
3. 南宁市动物园 南宁 530003
2. College of Fisheries & Life, Shanghai Ocean University, Shanghai 201306, China;
3. Nanning Zoo, Nanning 530003, China
罗非鱼因其生长快、食性杂及抗病性好等特点被广大消费者喜爱(Florio et al,2009)。近年来,在加工出口需求的拉动和政府优惠政策的扶持下,罗非鱼的养殖面积和产量呈逐年较快增长态势。据统计,2013年中国罗非鱼总产量达165万吨,加工出口86.7万吨(农业部渔业渔政管理局,2014)。罗非鱼产业发展得利于良种选育,培育优良品种是缩短成鱼上市时间,降低养殖成本的有效途径。尼罗罗非鱼雌鱼与奥利亚罗非鱼杂交生产单性尼奥罗非鱼进行商品养殖,加强尼罗罗非鱼的选育,有利于提高单性尼奥罗非鱼的经济性能。遗传力是指亲代将其某一数量性状的差异或变异遗传给后代的能力(吴仲庆,2000)。遗传力的大小体现了遗传因数和环境条件两者对表型性状的影响程度,说明了动物表型与基因型的相关水平,揭示了数量性状表现的遗传效应。
遗传力是罗非鱼遗传育种的重要遗传参数,是数量遗传学中由表及里、从表型变异研究其遗传实质的一个关键定量指标。准确估计尼罗罗非鱼数量性状的遗传参数是正确制定尼罗罗非鱼育种规划和个体遗传评定的基础,对提高育种准确率具有重要作用。在国内外,水产动物数量性状的遗传力有广泛的研究。在国内,大菱鲆的体重(马爱军等,2009)、虹鳟的体重、体长和肥满度(王炳谦等,2009)、长牡蛎幼体壳高及壳长(王庆志等,2009)、哲罗鲑幼鱼体长及体重(王俊等,2011)等性状的遗传力已被研究; 在国外,罗非鱼的体重(Nguyen et al,2007)、身体尺寸及形体(Velasco et al,1995; Nguyen et al,2010; Trọng et al,2013)、出肉率(Thodesen et al,2012)、肌肉组分(Ponzoni et al,2011)、繁殖(Trịnh et al,2013)等性状的遗传参数估计也已经开展了许多研究,但仅分析了罗非鱼生长发育的某一阶段数量性状的遗传力,没有对生长发育过程中不同阶段数量性状的遗传力变化进行分析。因此,本研究采用不平衡巢式配对的技术,建立其半同胞家系共30个,测定其生长阶段3、4、5月龄的数量性状的表现值,并运用多性状非求导方法估计测定性状的表型方差和协方差组分,研究罗非鱼不同生长发育阶段数量性状的遗传力为尼罗罗非鱼选育提供技术支撑。
1 材料与方法 1.1 亲本材料本实验于2014年5月30日至11月30日,在广西水产研究所那马中试基地进行,尼罗罗非鱼(Tilapia nilotica)亲鱼240 尾,其中雄鱼80尾,雌鱼160尾,雌雄比为2︰1。
1.2 实验方法2014年5月上旬,挑选性腺发育良好的亲本进行配对。雌鱼选择轻挤压腹部,有金黄色鱼卵排出的个体,雄鱼选择轻挤压腹部,有白色精液排出的个体,放入长×宽×高为1.0m×1.0m×1.5m的网箱进行配对,网箱网目为40目。网箱挂置于667×3.0m2的池塘内,试验期间池塘水温平均为27.5℃,每7天检查雌鱼1次,发现雌鱼嘴里有受精卵,将其取出,并放入孵化车间进行人工孵化。为避免雌鱼重复使用和进一步研究的需要,对已交配过的雌鱼进行电子数码标记。获得全同胞家系54个,其中半同胞家系30个。
家系早期未标记同塘混养之前,家系分池培育容易受环境条件差异的影响。为了减少环境差异对家系幼鱼的影响,采用标准化培育方式对尼罗罗非鱼鱼苗进行培育。鱼苗出膜后第15天,选取生长状态
良好的仔鱼1000尾放置在60cm×45cm×15cm的孵化盆内培育。鱼苗出膜后第30天,选取生长状态良好的稚鱼800尾放置在2.0m×1.0m×1.5m的网箱池内培育。鱼苗出膜后第60天,选取生长状态良好的幼鱼500尾放置在6.0m×2.0m×1.0m的水泥池中培育。8月初,育苗达到标记规格时,即家系个体平均体重达25g以上,进行拔鳍条标记,每个家系随机标记约30尾,同塘混合养殖,试验鱼共计872尾。
1.3 统计分析在同塘养殖过程中,使用精确度为0.01mm的游标卡尺测量3、4、5月龄的所有家系的家系个体的体重、全长、体长、头长、躯干长、体高、尾柄长、尾柄高及体高共9个数量性状进行测量,并记录。对生长性状的表型和遗传参数的估计采用动物模型(宋传文等,2013):
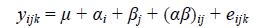
式中,μ为总体平均数; αi和βj分别为A因素的第i个水平效应与B因素第j个水平效应;(αβ)ij为A因素第i个水平、B因素第j个水平时的交互作用效应; eijk为随机误差。雄性内交配的雌性个体有效平均后代数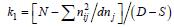 ; 雌性个体的有效平均后代数目
; 雌性个体的有效平均后代数目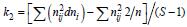 ; 雄性个体的有效平均后代数目
; 雄性个体的有效平均后代数目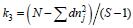 。式中,n为第i个雄性第j个雌性后代数; N为全部后代数总和。
。式中,n为第i个雄性第j个雌性后代数; N为全部后代数总和。
对数据的方差分析,通过SPSS软件的一般线性模型(General Linear Model)过程实现,全同胞资料表型变量的方差组成见表 1,表型变量的各个原因方差组分与全同胞和半同胞协方差之间的关系见表 2。
| 变异来源 | 自由度df | 平方和SS | 均方MS | 期望均方EMS |
| 雄性 | S-1 | SSS | MSS | σ²e+k2×σ²D+k3×σ²D |
| 雄内雌间 | D-S | SSS | MSS(D) | σ²e+k1×σ²D |
| 后代个体间 | N-D | SSE | MSe | σ²e |
| 总和 | N-1 | SST |
| 方差组分 | 协方差组分 | 原因组分 | 方差组分的计算 |
| σ²S | COVHS | 1/4VA | |
| σ²D | COVFS-COVHS | 1/4VA+1/4VNA+VEC | {MSS-[(MSS(D)-MSe)/k1]×k2-MSe}/k3 |
| σ²e | VP-COVFS | 1/2VA+3/4VD+VES | (MSS(D)-MSe)/k1 |
| σ²T-σ²S+σ²D+σ²e | VP | VA+VNA+VEC+VFS | MSe |
| σ²S+σ²D | COVFS | 1/2VA+1/4VD+VEC |
尼罗罗非鱼3、4、5月龄体重、全长、体长、头长、躯干长、体高、尾柄长、尾柄高及体高共9个数量性状参数见表 3,各月龄中体重的变异系数最大,分别是28.77%、27.62%及29.00%,体宽的变异系数次之,分别是14.68%、13.31%、14.47%,全长的变异系最小,分别是8.75%、8.38%及7.85%。
| 月龄 | 性状 | 平均数及标准差 | 变异系数(%) |
| 3月龄 | 体重 | 142.21±40.91 | 28.77 |
| 全长 | 18.70±1.64 | 8.75 | |
| 体长 | 15.28±1.36 | 8.92 | |
| 头长 | 4.88±0.51 | 10.44 | |
| 躯干长 | 6.99±0.74 | 10.62 | |
| 体高 | 6.13±0.72 | 11.82 | |
| 尾柄长 | 1.83±0.26 | 14.35 | |
| 尾柄高 | 2.13±0.27 | 12.41 | |
| 体宽 | 3.07±0.45 | 14.68 | |
| 4月龄 | 体重 | 247.45±68.34 | 27.62 |
| 全长 | 22.31±1.87 | 8.38 | |
| 体长 | 18.24±1.56 | 8.56 | |
| 头长 | 5.75±0.61 | 10.51 | |
| 躯干长 | 7.92±0.85 | 10.68 | |
| 体高 | 7.36±0.86 | 11.67 | |
| 尾柄长 | 2.26±0.34 | 15.12 | |
| 尾柄高 | 2.57±0.26 | 10.03 | |
| 体宽 | 3.55±0.47 | 13.31 | |
| 5月龄 | 体重 | 285.93±82.91 | 29.00 |
| 全长 | 23.59±1.85 | 7.85 | |
| 体长 | 19.14±1.56 | 8.12 | |
| 头长 | 6.06±0.56 | 9.26 | |
| 躯干长 | 8.03±0.89 | 11.04 | |
| 体高 | 7.74±2.16 | 27.9 | |
| 尾柄长 | 2.21±0.23 | 10.61 | |
| 尾柄高 | 2.58±0.32 | 12.25 | |
| 体宽 | 3.81±0.55 | 14.47 |
尼罗罗非鱼3、4、5月龄9个数量性状的方差分析见表 4。方差分析表明,雄性亲本间和雄性内的9个性状的F检验P<0.05,差异极显著。雄性亲本和雌性亲本间的有效平均后代数目计算结果: 雄性亲本内与配的雌性亲本的后代数k1=29.61; 每个雌性亲本的后代数k2=30.45; 每个雌性亲本的平均后代数目k3= 60.03。尼罗罗非鱼数量性状不同月龄表型变量的原因方差组分列于表 4。根据各亲本后代数及方差分析的结果,计算了尼罗罗非鱼雄性亲本、雄性亲本和雄雌内全同胞间组分的方差,其中雌性亲本的方差大于雄性亲本的方差,表明雌性亲本间半同胞个体具有较大的变异程度,存在着较大的母性效应。
| 月龄 | 性状 | 变异来源 | |||||||
| 雄亲间 | 雄内雌间 | 后裔间 | |||||||
| df | MS | F | df | MS | F | df | MS | ||
| 三月龄 | 体重 | 14 | 27247.38 | 6.77 | 15 | 5394.33 | 5.20 | 871 | 1037.83 |
| 全长 | 14 | 54.14 | 5.95 | 15 | 8.92 | 5.12 | 871 | 1.74 | |
| 体长 | 14 | 34.32 | 6.25 | 15 | 5.40 | 4.23 | 871 | 1.28 | |
| 头长 | 14 | 4.23 | 6.35 | 15 | 0.66 | 3.46 | 871 | 0.19 | |
| 躯干长 | 14 | 8.05 | 5.68 | 15 | 1.39 | 3.36 | 871 | 0.42 | |
| 体高 | 14 | 10.79 | 7.24 | 15 | 1.46 | 4.26 | 871 | 0.34 | |
| 尾柄长 | 14 | 0.47 | 5.67 | 15 | 0.08 | 1.32 | 871 | 0.06 | |
| 尾柄高 | 14 | 0.79 | 4.40 | 15 | 0.18 | 3.11 | 871 | 0.06 | |
| 体宽 | 14 | 3.61 | 9.21 | 15 | 0.39 | 2.65 | 871 | 0.15 | |
| 四月龄 | 体重 | 14 | 23247.42 | 2.44 | 15 | 9415.11 | 2.20 | 871 | 4289.31 |
| 全长 | 14 | 18.40 | 2.73 | 15 | 6.66 | 2.08 | 871 | 3.20 | |
| 体长 | 14 | 13.24 | 2.93 | 15 | 4.47 | 2.01 | 871 | 2.23 | |
| 头长 | 14 | 2.40 | 5.01 | 15 | 0.48 | 1.44 | 871 | 0.33 | |
| 躯干长 | 14 | 2.59 | 2.12 | 15 | 1.21 | 1.79 | 871 | 0.68 | |
| 体高 | 14 | 4.84 | 4.06 | 15 | 1.18 | 1.78 | 871 | 0.67 | |
| 尾柄长 | 14 | 0.26 | 1.53 | 15 | 0.17 | 1.47 | 871 | 0.11 | |
| 尾柄高 | 14 | 0.34 | 2.47 | 15 | 0.14 | 2.24 | 871 | 0.06 | |
| 体宽 | 14 | 0.97 | 2.89 | 15 | 0.33 | 1.59 | 871 | 0.21 | |
| 五月龄 | 体重 | 14 | 33735.27 | 1.11 | 15 | 29756.83 | 4.92 | 871 | 6048.78 |
| 全长 | 14 | 18.67 | 1.60 | 15 | 11.46 | 3.76 | 871 | 3.05 | |
| 体长 | 14 | 11.72 | 1.36 | 15 | 8.48 | 3.92 | 871 | 2.16 | |
| 头长 | 14 | 2.24 | 3.13 | 15 | 0.71 | 2.55 | 871 | 0.28 | |
| 躯干长 | 14 | 3.34 | 1.15 | 15 | 2.85 | 4.01 | 871 | 0.71 | |
| 体高 | 14 | 8.87 | 1.14 | 15 | 7.74 | 1.70 | 871 | 4.55 | |
| 尾柄长 | 14 | 0.19 | 1.34 | 15 | 0.14 | 2.77 | 871 | 0.05 | |
| 尾柄高 | 14 | 0.43 | 1.07 | 15 | 0.40 | 4.47 | 871 | 0.09 | |
| 体宽 | 14 | 1.53 | 1.60 | 15 | 0.94 | 3.46 | 871 | 0.27 | |
依据表 4,父系半同胞、母系半同胞和全同胞的方差组分,估计了尼罗罗非3、4、5月不同数量性状的遗传力列于表 5。3月龄尼罗罗非鱼数量性状遗传力由大到小的顺序是: 全长(0.73)>体高(0.72)>体重(0.66)>体长(0.65)>体宽(0.58)>头长(0.57)>躯干长(0.51)>尾柄高(0.38)>尾柄长(0.21); 4月龄状尼罗罗非鱼遗传力的估计值由大到小的顺序是: 体高(0.21)>头长(0.2)>全长(0.18)=体长(0.18)=尾柄高>体重(0.17)>体宽(0.13)>躯干长(0.11)>尾柄长(0.06); 5月龄状尼罗罗非鱼遗传力的估计值估计值由大到小的顺序是: 体重(0.25)=头长(0.25)>全长(0.23)>体长(0.22)>尾柄高(0.21)=体宽(0.0.21)>躯干长(0.20)>尾柄长(0.14)>体高(0.05)。尼罗罗非鱼3、4、5月龄性状的遗传力显著性检验结果为: 依据父系半同胞、母系半同胞方差组分估计的遗传力均未达到显著水平,依据全同胞方差组分估计的遗传力达到极显著水平。由此可见,尼罗罗非鱼各性状的遗传力随着月龄增长而减小,遗传力在3月龄最高,4月龄和5月龄较低并相接近。不同月龄尼罗罗非鱼的体重及体长的遗传力不同,体重的遗传力在3月龄达到最大,为0.66; 4月龄最低,为0.17; 5月龄为0.25。体长的遗传力在3月龄达到最大,为0.65,4月龄最低,为0.18; 5月龄为0.22。体高的遗传力在5月龄最低仅为0.05。
| 月龄 | 遗传力 | 体重 | 全长 | 体长 | 头长 | 躯干长 | 体高 | 尾柄长 | 尾柄高 | 体宽 |
| 三月龄 | hd2(母系半同胞) | 0.94 | 1.1 | 1.01 | 0.89 | 0.78 | 1.16 | 0.39 | 0.55 | 1.01 |
| hs2(父系半同胞) | 0.38 | 0.35 | 0.29 | 0.24 | 0.23 | 0.28 | 0.04 | 0.22 | 0.15 | |
| h2全同胞 | 0.66 | 0.73 | 0.65 | 0.57 | 0.51 | 0.72 | 0.21 | 0.38 | 0.58 | |
| 四月龄 | hd2(母系半同胞) | 0.19 | 0.22 | 0.24 | 0.35 | 0.13 | 0.32 | 0.05 | 0.2 | 0.19 |
| hs2(父系半同胞) | 0.15 | 0.13 | 0.12 | 0.06 | 0.1 | 0.09 | 0.07 | 0.16 | 0.07 | |
| h2全同胞 | 0.17 | 0.18 | 0.18 | 0.2 | 0.11 | 0.21 | 0.06 | 0.18 | 0.13 | |
| 五月龄 | hd2(母系半同胞) | 0.03 | 0.13 | 0.08 | 0.32 | 0.04 | 0.01 | 0.06 | 0.01 | 0.13 |
| hs2(父系半同胞) | 0.46 | 0.33 | 0.35 | 0.18 | 0.37 | 0.09 | 0.23 | 0.42 | 0.3 | |
| h2全同胞 | 0.25 | 0.23 | 0.22 | 0.25 | 0.2 | 0.05 | 0.14 | 0.21 | 0.21 |
本研究分析了3、4、5月龄尼罗罗非鱼的体重、全长、体长、头长、躯干长、体高、尾柄长、尾柄高及体高共9个表型性状的遗传参数。3月龄尼罗罗非鱼数量性状遗传力的估计值较大,为0.73—0.21; 4月龄尼罗罗非鱼数量性状遗传力的估计值为0.21—0.06; 5月龄尼罗罗非鱼数量性状遗传力的估计值为0.25—0.05。4月龄与5月龄尼罗罗非鱼的数量性状遗传力估计值比较相近,但与3月龄相比,发生了较大变化,数量性状的遗传力普遍低于0.3。Rutten等
(2004,2005)认为,在罗非鱼育种过程中,体重与出肉率、生长速度有较密切的相关性,是育种方案中重要的选择性状。尼罗罗非鱼体重的遗传力在3月龄达到最大,为0.66,4月龄最低,为0.17,5月龄为0.25,这与Rutten等(2004)估计罗非鱼收获体重遗传力(0.26)相似。
Sheridan(1997)研究发现,在生物生长初期数量性状比较容易受母性效应影响,Silverstein等(1994)认为在计算银大马哈鱼幼鱼生长期的遗传参数时,应考虑母性效应对幼鱼在生长阶段的影响。Falconer(1989)认为在哺乳动物中,母性效应是遗传变异的重要来源。因此,本实验的结果揭示,3月龄尼罗罗非鱼数量性状遗传力估计值中母系半同胞遗传力的估计值高于父系半同胞遗传力的估计值,4月龄尼罗罗非鱼数量性状遗传力估计值中母系半同胞遗传力的估计值父系半同胞遗传力的估计值相近,5月龄尼罗罗非鱼数量性状遗传力估计值中父系半同胞遗传力的估计值大于母系半同胞遗传力的估计值,由此推测,3月龄尼罗罗非鱼数量性状遗传力估计值偏高(0.73—0.21)是由母性效应影响造成的。在建立模型分析遗传力时,应充分考虑不同因素的作用。Gjedrem(2005)认为在鱼类数量性状的遗传力估计过程中,由于环境因素会错误地放大个体间差异,导致遗传力估计值产生较大误差,从而降低选择的准确性,选育效果不理想。本研究采用巢式配对设计和父系半同胞组内方差相关分析方法,并采用环境标准化及数量标准化方法进行苗种培育,有效地降低了环境差异造成的偏差,提高了尼罗罗非鱼不同生长阶段遗传力估计值的准确性。
| 马爱军, 王新安, 雷霁霖, 2009. 大菱鲆(Scophthalmus maximus)不同生长阶段体重的遗传参数和育种值估计. 海洋与湖沼, 40(2): 187—194 |
| 王 俊, 匡友谊, 佟广香等, 2011. 不同温度下哲罗鲑幼鱼生长性状的遗传参数估计. 中国水产科学, 18(1): 75—82 |
| 王庆志, 李 琪, 刘士凯等, 2009. 长牡蛎幼体生长性状的遗传力及其相关性分析. 中国水产科学, 16(5): 736—743 |
| 王炳谦, 刘宗岳, 高会江等, 2009. 应用重复力模型估计虹鳟生长性状的遗传力和育种值. 水产学报, 33(2): 182—187 |
| 农业部渔业渔政管理局, 2014. 2014中国渔业统计年鉴. 北京: 中国农业出版社, 88 |
| 吴仲庆, 2000. 水产生物遗传育种学(第三版). 厦门: 厦门大学出版社, 67 |
| 宋传文, 闫喜武, 桑士田等, 2013. 紫贻贝生长性状的遗传力估计. 水产学报, 37(2): 201—206 |
| Falconer D S, 1989. Introduction to Quantitative Genetics. 3rd edn. New York: Longman Scientific and Technical |
| Florio D, Gustinelli A, Caffara M et al, 2009. Veterinary and public health aspects in tilapia (Oreochromis niloticus) aquaculture in Kenya, Uganda and Ethiopia. Ittiopatologia, 6: 51—93 |
| Gjedrem T, 2005. Selection and breeding programs in aquaculture. Dordrecht, The Netherlands: Springer |
| Nguyen N H, Khaw H L, Ponzoni R W et al, 2007. Can sexual dimorphism and body shape be altered in Nile tilapia (Oreochromis niloticus) by genetic means? Aquaculture, 272(S1): S38—S46 |
| Nguyen N H, Ponzoni R W, Abu-Bakar K R et al, 2010. Correlated response in fillet weight and yield to selection for increased harvest weight in genetically improved farmed tilapia (GIFT strain), Oreochromis niloticus. Aquaculture, 305(1—4): 1—5 |
| Ponzoni R W, Nguyen N H, Khaw H L et al, 2011. Genetic improvement of Nile tilapia (Oreochromis niloticus) with special reference to the work conducted by the World Fish Center with the GIFT strain. Reviews in Aquaculture, 3(1): 27—41 |
| Rutten M J M, Bovenhuis H, Komen H, 2004. Modeling fillet traits based on body measurements in three Nile tilapia strains (Oreochromis niloticus L.). Aquaculture, 231(1—4): 113—122 |
| Rutten M J M, Bovenhuis H, Komen H, 2005. Genetic parameters for fillet traits and body measurements in Nile tilapia (Oreochromis niloticus L.). Aquaculture, 246(1—4): 125—132 |
| Sheridan A K, 1997. Genetic improvement of oyster production——a critique. Aquaculture, 153(3—4): 165—179 |
| Silverstein J T, Hershberger W K, 1994. Genetic parameters of size pre-and post-smoltification in coho salmon (Oncorhynchus kisutch). Aquaculture, 128(1—2): 67—77 |
| Thodesen J, Rye M, Wang Y X et al, 2012. Genetic improvement of tilapias in China: Genetic parameters and selection responses in fillet traits of Nile tilapia (Oreochromis niloticus) after six generations of multi-trait selection for growth and fillet yield. Aquaculture, 366: 67—75 |
| Trịnh Q T, Van Arendonk J A M, Komen H, 2013. Genetic parameters for reproductive traits in female Nile tilapia (Oreochromis niloticus): II. Fecundity and fertility. Aquaculture, 416—417: 72—77 |
| Trọng T Q, Mulder H A, van Arendonk J A M et al, 2013. Heritability and genotype by environment interaction estimates for harvest weight, growth rate, and shape of Nile tilapia (Oreochromis niloticus) grown in river cage and VAC in Vietnam. Aquaculture, 384—387: 119—127 |
| Velasco R R, Janagap C C, de-Vera M P et al, 1995. Genetic improvement of fanned tilapias: estimation of heritability of body and carcass traits of Nile tilapia (Oreochromis niloticus). Aquaculture, 137(1—4): 280—281 |
 2015, Vol. 46
2015, Vol. 46


