中国海洋湖沼学会主办。
文章信息
- 李猛, 周素明, 刘璐, 彭頔, 王国良. 2015.
- LI Meng, ZHOU Su-Ming, LIU Lu, PENG Di, WANG Guo-Liang. 2015.
- 文蛤(Meretrix meretrix)C-型凝集素基因的分子克隆及表达分析
- MOLECULAR CLONE AND EXPRESSION OF C-TYPE LECTIN IN MERETRIX MERETRIX
- 海洋与湖沼, 46(5): 1186-1192
- Oceanologia et Limnologia Sinica, 46(5): 1186-1192.
- http://dx.doi.org/10.11693/hyhz20150100017
-
文章历史
- 收稿日期: 2015-01-16
- 收修改稿日期: 2015-05-25
文蛤(Meretrix meretrix)隶属于软体动物门(Mollusca)、瓣鳃纲(Lamellibranchiata)、帘蛤目(Veneroida)、帘蛤科(Veneridae)、文蛤属(Meretrix)。具有很高的食用和药用价值,广泛分布于山东、江苏、广西、浙江等沿海地区。近年来,由于养殖规模扩大,环境恶化,管理方法不当等导致病害滋生,严重阻碍了文蛤养殖业的健康发展。为提高文蛤的抗病害能力,有必要对其免疫相关因子进行深入研究。
凝集素是一类可结合糖类物质的蛋白,最初于植物中发现,在细菌、真菌和动物中同样大量存在。凝集素在多种生命过程包括细胞间通信、蛋白的折叠和装配、信号转导、非己识别等中发挥着重要作用(Vasta et al,2004)。根据凝集素糖类识别结构域CRD的结构特征不同,可将凝集素分为C-、L-、P-、I-、R-和S-型凝集素等(Janeway et al,2002)。C-型凝集素家族是目前研究最多的一类凝集素,其主要特征是在蛋白质分子的C末端含有糖识别的结构域CRD,具有保守特征性功能域,其凝集活性具有钙离子依赖性(罗展等,2010)。贝类动物的免疫机制以非特异性免疫为主,其中C-型凝集素作为可与糖专一性结合并能促使细胞凝集的蛋白质或糖蛋白,在免疫识别和防御系统中专一地与异物表面特定的糖基结合,从而吸附和凝集异物,促进机体清除和杀灭异物(Tamplin et al,1989)。目前,已经在栉孔扇贝(Chlamys farreri)(Wang et al,2007; Zhang et al,2009a)、海湾扇贝(Argopecten irradians)(Zhu et al,2008)、合浦珠母贝(Pinctada fucata)(胡钰婷等,2011)、刺参(Apostichopus japonicus)(Han et al,2012)、凡纳滨对虾(Litopenaeus vannamei)(Zhang et al,2009b)、三疣梭子蟹(Portunus trituberculatus)(于金红等,2013)等不同海洋动物中发现并克隆获得C-型凝集素基因的全长序列,但在文蛤中对C-型凝集素的研究相对较少。本实验成功获得了文蛤C-型凝集素基因的cDNA全序列,明确了它的序列特征、系统进化关系及其对环境因子胁迫影响的表达变化,为进一步深入研究文蛤C-型凝集素的免疫功能提供实验依据和理论基础。
1 材料与方法 1.1 实验材料文蛤采样于温州市龙湾区文蛤养殖场,选择壳色正常、无异味,健康无发病症状的文蛤于实验室暂养3天后进行试验。大肠杆菌E.coli TG1和溶藻弧菌菌株为本实验室保存,连接载体pMD18T购于TaKaRa公司。
TRizol总RNA提取试剂盒(Invitrogen),3'-Full RACE Core Set with PrimeScriptTM Rtase(TaKaRa),5'-Full RACE Core Set with PrimeScriptTM Rtase(TaKaRa),PrimeScriptTM 1st Str and cDNA Synthseis Kit(TaKaRa),GenClean柱式琼脂糖凝胶DNA回收试剂盒(上海捷瑞生物工程有限公司)。PCR仪(Bio-Rad),微量核酸蛋白测定仪(Bio-Rad),冷冻离心机(Eppendorf),凝胶成像仪(Bio-Rad)。
1.2 引物设计与合成根据GenBank上已有的贝类C-型凝集素基因序列,设计克隆及定量PCR所需引物(表 1,表 2)。
| 引物 | 序列 | 作用 |
| CTL-R1 | 5' -AGTATGGCAGACAGTGGGAGG-3' | 保守序列克隆引物 |
| CTL-F1 | 5' -ACATCCACATCCATTGCTTGG-3' | |
| 3R1 | 5' -GGGTCAATGTCAACAAGGAT-3' | 3'RACE引物 |
| 3R2 | 5' -TGGGTGGTGACCTTGTATCTC-3' | |
| 5R1 | 5' -CAACATTTAACACAACATGGTATG-3' | 5'RACE引物 |
| 5R2 | 5' -TAGGGGTCAATGTCAACAAG-3' | |
| 5R3 | 5' -CAGAGTATTACGGGGAGCAC-3' |
| 引物 | 序列 |
| P-β-ACTIN-F | 5' -ACTGTGCCCATCTATGAAGGTTA-3' |
| P-β-ACTIN-R | 5' -CGTTCGGTAAGGATCTTCATCA-3' |
| P-C-F | 5' -ACAGTGGGAGGTCAAATGAAGAT-3' |
| P-C-R | 5' -CCCTAGCATCATACCATGTTGTGTT-3' |
挑选三只健康文蛤并取肝胰腺组织20—50mg,采用RNA提取试剂盒(Trizol Reagent,Invitrogen)提取总RNA。使用反转录试剂盒(PrimeScriptTM 1st Str and cDNA Synthseis Kit,TaKaRa)将之反转录成cDNA,37 ℃反转录15min,85℃ 5s。合成的cDNA产物于-20℃保存以供后续实验使用。
1.4 文蛤C-型凝集素基因克隆根据文蛤C-型凝集素基因(Mm-CTL)的EST序列设计一对引物CTL-R1和CTL-F1(表 1),以cDNA为模板PCR扩增。扩增体系: 超纯水15.7μL,cDNA 1.0μL,10×PCR buffer 2.5μL,MgCl2 1.5μL,dNTP 2.0μL,CTL-R1 1.0μL,CTL-F1 1.0μL,rTaq 0.3μL。反应条件: 94℃ 5min,94℃ 30s,56℃ 30s,72℃ 40s,共35个循环,72℃延伸10min。扩增产物经过凝胶电泳后,利用GenClean 柱式琼脂糖凝胶DNA回收试剂盒回收目的条带,与pMD18T载体连接并转化进大肠杆菌TG1中,PCR检测正确并送至上海英骏生物公司测序。
根据所得序列分别设计3'RACE和5'RACE引物(表 1),按照3'-Full RACE Core Set with PrimeScriptTM RTase试剂盒和5'-Full RACE Core Set with PrimeScriptTM RTase试剂盒说明书进行扩增。扩增产物进行凝胶电泳确认,并将出现的条带割胶回收,回收产物连接转化,PCR检测正确并送样测序。
1.5 生物信息学分析将拼接后的Mm-CTL进行生物信息学分析。利用 NCBI 的ORF Finder(http://www.ncbi.nlm.nih.gov/ gorf/orfig.cgi)程序对所得序列作开放阅读框分析,预测编码氨基酸序列,同时利用Smart(http://smart. embl-heidelberg.de/)预测蛋白的功能域。使用NCBI的blastn(http://www.ncbi.nlm.nih.gov/)进行氨基酸同源性分析,用MEGA 4.1软件构建系统进化树。
1.6 感染及环境胁迫实验制备浓度为107 cells/mL的溶藻弧菌菌悬液,取菌悬液以1︰100的比例与过滤海水稀释后,将文蛤放入其中浸染,对照组采用过滤后海水,盐度20,温度25℃。对照组与实验组同步取样,分别在0h、6h、12h、24h、48h、72h随机选取每组三只文蛤提取肝胰腺RNA,反转录成cDNA备用。
将健康的文蛤随机分成6组,分别放在盐度为5、10、15、20、25、30的海水中25℃培养,12h后每组随机选取3只文蛤提取肝胰腺RNA,反转录成cDNA备用。
将健康的文蛤随机分成6组,分别放在温度分别为10、15、20、25、30、35℃的海水中(盐度20)培养,12h后每组随机选取3只文蛤提取肝胰腺RNA,反转录成cDNA备用。
分别以上述所制备的cDNA为模板,以P-β- ACTIN-F、P-β-ACTIN-R、P-C-F、P-C-R(表 2)为引物进行目的基因和内参基因β-actin的RT-PCR扩增,扩增体系同上。目的基因扩增条件为94℃ 5min,94℃ 30s,55℃ 30s,72℃ 30s,共35个循环,72℃ 延伸10min。内参基因扩增条件为94℃ 5min,94℃ 30s,56℃ 30s,72℃ 30s,共28个循环,72℃ 延伸10min。反应重复三次RT-PCR。将PCR结果用1.2%琼脂糖凝胶电泳检测后,在凝胶成像仪下成像。
2 结果 2.1 文蛤C-型凝集素的基因克隆与生物信息学分析通过PCR和RACE技术获得Mm-CTL核心序列和3'端与5'端序列,经过拼接该基因的全长为1855bp(GenBank序列号: JX232217),其开放阅读框为519bp,编码172个氨基酸(图 1)。利用Smart软件预测蛋白的功能域(图 1,图 2)。结果显示,第34个蛋白到168个蛋白为Mm-CTL的糖识别结构域(CRD),该CRD 含有的参与二硫键形成的6个保守的半胱氨酸,分别位于Cys34、Cys47、Cys64、Cys143、Cys159、Cys167。在CRD区域中找到决定糖结合的特异性序列“EPN”。
 |
| 图 1 文蛤C-型凝集素基因cDNA序列 Fig. 1 cDNA sequences of C-lectin gene in M. meretrix 阴影表示CRD,曲线下划线表示决定糖结合特异性的序列(EPN) |
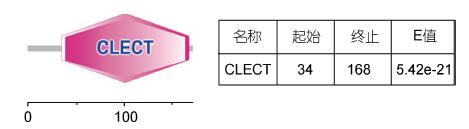 |
| 图 2 C-型凝集素预测蛋白结构域 Fig. 2 Domain analysis on putative C-lectin protein |
将拼接后的序列进行同源性比对,结果显示与日本刺参(Apostichopus japonicus),青鳉(Oryzias latipes),中国对虾(Fenneropenaeus chinensis),日本囊对虾(Marsupenaeus japonicus),长牡蛎(Crassostrea gigas),大竹蛏(Solen gr and is)相对应的氨基酸序列相似性分别为13.5%、13.5%、21.5%、23.2%、23.9%、56.5%(图 3)。
 |
| 图 3 文蛤C-型凝集素氨基酸序列与其它物种凝集素氨基酸序列的比对 Fig. 3 Multiple alignments of amino acid sequence of C-lectin of M. meretrix with other known species genes 黑色背景表示相同的氨基酸,灰色背景表示性质相似的氨基酸 |
利用MEGA4.1软件对Mm-CTL进行生物信息学分析,构建进化树,用N-J方法进行聚类分析。进化树结果显示(图 4),不同物种的凝集素各自成簇,脊椎动物聚在一类,无脊椎动物聚在一类。从文蛤体内获得的Mm-CTL与大竹蛏(Solen gr and is)聚类在一起,与长牡蛎(Crassostrea gigas)进化距离较近。
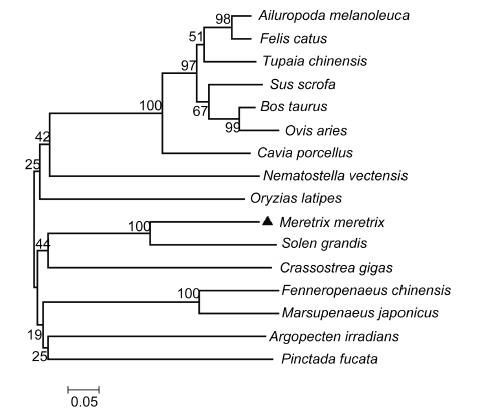 |
| 图 4 不同物种凝集素氨基酸序列系统进化树 Fig. 4 The evolutionary tree of lectin amino acid sequence of different species |
在溶藻弧菌刺激下,文蛤肝胰腺Mm- CTL表达量变化结果见图 5。溶藻弧菌感染6h时表达量明显上升,在12h时达到最高值,随后有所下降,72h时趋于稳定并与对照组无明显差异。
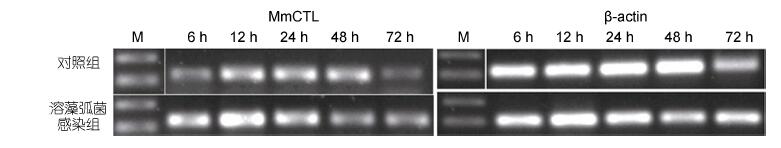 |
| 图 5 文蛤肝胰腺C-型凝集素在溶藻弧菌刺激后的RT-PCR电泳图 Fig. 5 RT-PCR electrophoregrams of C-lectin gene in hemocytes of M. meretrix after V. alginolyticus challenge |
在不同盐度胁迫下,文蛤肝胰腺Mm- CTL表达量变化结果见图 6。在盐度5时Mm-CTL表达量比较低,在盐度10—20范围时Mm-CTL表达量相对较高,当盐度高于20时,Mm-CTL的表达量反而较低。
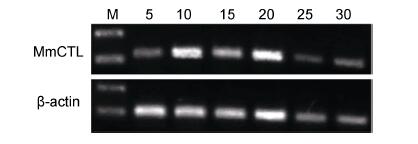 |
| 图 6 文蛤肝胰腺C-型凝集素基因在不同盐度刺激后的RT-PCR电泳图谱 Fig. 6 RT-PCR electrophoregrams of C-lectin gene in hemocytes of M. meretrix in different salinities |
在不同温度胁迫下,文蛤肝胰腺Mm- CTL表达量变化结果见图 7。在水温25℃以上时,随着水温的上升表达量明显上升,水温25℃以下时,随着温度下降表达量明显下降。35℃时表达量相对最高,10℃时表达量明显较低。
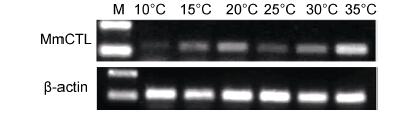 |
| 图 7 文蛤肝胰腺C-型凝集素基因在不同温度刺激后的RT-PCR电泳图谱 Fig. 7 RT-PCR electrophoregrams of C-lectin gene in hemocytes in M. meretrix in different temperatures |
C-型凝集素是一类钙离子依赖活性的糖蛋白,包含至少一个保守的糖基识别结构域(陈政良,1997),低等生物的C-型凝集素基因一般只有一个CRD,而其它物种则有的两个或多个CRD(Song et al,2010)。对于虾类而言,日本囊对虾已报道的C-型凝集素基
因中均只含1个CRD结构域,罗氏沼虾已报道的4个C-型凝集素基因中都含2个CRD结构域(Ren et al,2012)。中国明对虾和凡纳滨对虾则存在C-型凝集素基因中既有包含1个CRD的又有含2个CRD结构域的情况(Liu et al,2007; Sun et al,2008; Wei et al,2012)。合浦珠母贝和栉孔扇贝C-型凝集素基因中也都包含1个CRD结构域(胡钰婷等,2011)。本研究中克隆获得的文蛤C-型凝集素基因和合浦珠母贝和栉孔扇贝相似,只含1个CRD结构域。CRD结构域中,主要由2个基序与钙离子共同作用完成对糖基分子的结合,第一个典型的基序为EPN或QPD,第二个典型的基序为WND。EPN可对甘露糖进行识别,QPD则可识别半乳糖(Drickamer,1992; Kolatkar et al,1996)。本研究显示,文蛤C-型凝集素基因糖基结合位点为EPN,表明文蛤C-型凝集素可能对甘露糖进行识别并结合。
贝类具有非特异免疫系统,免疫系统比较简单,易受外界胁迫影响。在通过先天免疫对病原菌感染的应答过程中,C-型凝集素扮演着重要的作用(Willment et al,2008)。吴彪等(2013)用鳗弧菌感染虾夷扇贝后4h表达量显著上升,8h达到最高峰,随后下降,16h后与对照基本无差异。胡钰婷等(2011)在合浦珠母贝C-型凝集素基因研究中,用溶藻弧菌刺激后的4h至24 h表达量显著上调。本实验用溶藻弧菌感染文蛤,Mm-CTL在6h时表达量明显上升,在12h时达到最高值,随后有所下降,72h时趋于稳定。说明Mm-CTL的表达量可受微生物刺激而诱导,也表明Mm-CTL参与对微生物入侵的免疫应答,有助于提高文蛤的免疫防御能力。
温度和盐度是影响贝类生长,摄食,免疫应答等非常重要的环境因子(Kim et al,2009)。有研究表明,贝类病害的爆发与盐度的变化有直接的关系,这可能与盐度胁迫导致贝类免疫能力下降有关。Cheng等(2004)研究盐度对杂色鲍(Haliotis diversicolor supertexta)免疫能力的影响表明,当杂色鲍由盐度30的环境,转移到盐度20、25和35的环境中时,其血细胞数量减少,酚氧化酶活力、吞噬活力、呼吸爆破活力和清除副溶血弧菌的能力降低,杂色鲍容易受到致病菌的侵袭而死亡。盐度变化不仅可以通过影响免疫因子活力的方式来影响机体的免疫能力,还可以通过影响免疫因子表达量变化来影响机体免疫能力。本实验在研究不同盐度对Mm-CTL表达量变化时发现,盐度10、15和20时Mm-CTL的表达量相对较高。表明盐度在一定的变化幅度内能诱导Mm-CTL的表达,起免疫保护作用,但超出一定范围则免疫功能将受到抑制。
Dang等(2012)的研究发现欧洲鲍螺(Haliotisrubra)在水温由18℃升至21℃和24℃时,其抗菌活力和抗病毒活力上升,但长时间胁迫,会导致欧洲鲍螺抗菌活力和抗病毒活力受到抑制。李晓英等(2009)对青蛤(Cyclina sinensis)的研究表明,短时间内,温度骤升能提升青蛤超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活力,但长时间的高温刺激,反而会抑制两种酶活性。本实验结果显示,在温度高于25℃时,Mm- CTL的表达量随温度升高明显上升,表明温度的变化可以诱导文蛤免疫因子的表达,从而调节免疫反应。
4 结论本研究从文蛤中克隆到一种C-型凝集素的基因,通过蛋白序列分析,发现在Mm-CTL存在典型的糖基识别结构域。通过表达分析发现,Mm-CTL的表达不仅受到弧菌感染的影响,同时也受环境温度和盐度变化的影响。由于贝类是一种海洋无脊椎动物,其免疫系统极有可能对环境的变化做出响应。本研究结果将为贝类先天性免疫因子表达的调控以及贝类病害的防控奠定基础。
| 于金红, 潘鲁青, 2013. 三疣梭子蟹C-型凝集素的原核表达和活性检测. 渔业科学进展, 34(5): 58—63 |
| 李晓英, 沈睿杰, 董志国等, 2009. 温度骤升和窒息胁迫对青蛤抗氧化酶活性的影响. 中国饲料, 20(1): 39—42 |
| 吴 彪, 迟长凤, 杨爱国等, 2013. 虾夷扇贝C-型凝集素母源传递与抑菌作用的初步研究. 水产学报, 37(5): 777—783 |
| 陈政良, 1997. 哺乳类 C-型凝集素超级家族. 生物化学与生物物理展, 24(6): 491—496 |
| 罗 展, 张继泉, 李富花等, 2010. 凡纳滨对虾C-型凝集素LvLec2对不同刺激的免疫应答. 海洋科学, 34(11): 103—110 |
| 胡钰婷, 张殿昌, 崔淑歌等, 2011. 合浦珠母贝C-型凝集素基因的序列特征和功能分析. 水产学报, 35(9): 1327—1336 |
| Cheng W, Juang F M, Hsu C H, 2004. The immune response of Taiwan abalone Haliotis diversicolor supertexta and its susceptibility to Vibrio parahaemolyticus at different salinity levels. Fish & Shellfish Immunology, 16(3): 295—306 |
| Dang V T, Speck P, Benkendorff K, 2012. Influence of elevated temperatures on the immune response of abalone, Haliotis rubra. Fish & Shellfish Immunology, 32(5): 732—740 |
| Drickamer K, 1992. Engineering galactose-binding activity into a C-type mannose-binding protein. Nature, 360(6400): 183—186 |
| Han L L, Yuan Z, Dahms H U et al, 2012. Molecular cloning, characterization and expression analysis of a C-type lectin (AJCTL) from the sea cucumber Apostichopus japonicus. Immunology Letters, 143(2): 137—145 |
| Janeway C A Jr, Medzhitov R, 2002. Innate immune recognition. Annual Review of Immunology, 20(1): 197—216 |
| Kim M, Ahn I Y, Cheon J et al, 2009. Molecular cloning and thermal stress-induced expression of a pi-class glutathione S-transferase (GSP) in the Antarctic bivalve Laternulaelliptica. Comparative Biochemistry and Physiology, Part A: Molecular & Integrative Physiology, 152(2): 207—213 |
| Kolatkar A R, Weis W I, 1996. Structural basis of galactose recognition by C-type animal lectins. The Journal of Biological Chemistry, 271(12): 6679—6685 |
| Liu Y C, Li F H, Dong B et al, 2007. Molecular cloning, characterization and expression analysis of a putative C-type lectin (Fclectin) gene in Chinese shrimp Fenneropenaeus chinensis. Molecular Immunology, 44(4): 598—607 |
| Ren Q, Li M, Du J et al, 2012. Immune response of four dual-CRD C-type lectins to microbial challenges in giant freshwater prawn Macrobrachium rosenbergii. Fish & Shellfish Immunology, 33(2): 155—167 |
| Song X Y, Zhang H, Wang L M et al, 2010. An immune responsive multidomain galectin from bay scallop Argopectens irradians. Fish & Shellfish Immunology, 28(2): 326—332 |
| Sun Y D, Fu L D, Jia Y P et al, 2008. A hepatopancreas-specific C-type lectin from the Chinese shrimp Fenneropenaeus chinensis exhibits antimicrobial activity. Molecular Immunology, 45(2): 348—361 |
| Tamplin M L, Fosher W S, 1989. Occurrence and characteristics of agglutination of Vibrio cholerae by serum from the eastern oyster, Crassostrea virginica. Applied and Environmental Microbiology, 55(11): 2882—2887 |
| Vasta G R, Ahmed H, Du S J et al, 2004. Galectins in teleost fish: Zebrafish (Danio rerio) as a model species to address their biological roles in development and innate immunity. Glycoconjugate Journal, 21(8—9): 503—521 |
| Wang H, Song L S, Li C H et al, 2007. Cloning and characterization of a novel C-type lectin from Zhikong scallop Chlamys farreri. Molecular Immunology, 44(5): 722—731 |
| Wei X M, Liu X Q, Yang J M et al, 2012. Two C-type lectins from shrimp Litopenaeus vannamei that might be involved in immune response against bacteria and virus. Fish & Shellfish Immunology, 32(1): 132—140 |
| Willment J A, Brown G D, 2008. C-type lectin receptors in antifungal immunity. Trends Microbiology, 16(1): 27—32 |
| Zhang H, Wang H, Wang L L et al, 2009a. Cflec-4, a multidomain C-type lectin involved in immune defense of Zhikong scallop Chlamys farreri. Developmental and Comparative Immunology, 33(6): 780—788 |
| Zhang Y, Qiu L M, Song L S et al, 2009b. Cloning and characterization of a novel C-type lectin gene from shrimp Litopenaeus vannamei. Fish & Shellfish Immunology, 26(1): 183—192 |
| Zhu L, Song L S, Xu W et al, 2008. Molecular cloning and immune responsive expression of a novel C-type lectin gene from bay scallop Argopecten irradians. Fish & Shellfish Immunology, 25(3): 231—238 |
 2015, Vol. 46
2015, Vol. 46


