中国海洋湖沼学会主办。
文章信息
- 方卫东, 唐旭, 刘源森, 林凌, 黄仕新, 高培丽, 徐长安. 2015.
- FANG Wei-Dong, TANG Xu, LIU Yuan-Sen, LIN Ling, HUANG Shi-Xin, GAO Pei-Li, XU Chang-An. 2015.
- 一株海洋生境芽孢杆菌FA08的筛选、鉴定及其酶学特性和抗菌性能分析
- SCREENING AND IDENTIFICATION, ENZYME CHARACTERISTICS, AND ANTIBACTERIAL ACTIVITY OF A MARINE BACILLUS STRAIN FA08
- 海洋与湖沼, 46(5): 1228-1234
- Oceanologia et Limnologia Sinica, 46(5): 1228-1234.
- http://dx.doi.org/10.11693/hyhz20150300072
-
文章历史
- 收稿日期: 2015-03-10
- 收修改稿日期: 2015-04-26
2. 福建省海新集团有限公司 漳州 363102;
3. 国家海洋局第三海洋研究所 厦门 361005
2. Fujian Provincial Haixin Group Co., Ltd., Zhangzhou 363102, China;
3. Third Institute of Oceanography, State Oceanic Administration, Xiamen 361005, China
随着健康养殖业的发展,有益微生物的应用越来越广泛,如在水产养殖过程中,使用光合细菌、枯草芽孢杆菌等微生物制剂改善养殖环境,降低疾病的发生,取得了较好的效果(Vanittanakom et al,1986; Burgess et al,1993; Barsby et al,2001; Vaseeharan et al,2003; 顾继锐等,2011; 张庆华等,2011; 高存川等,2012; 潘娟等,2012; 张峰峰等,2012); 通过筛选生防细菌,利用生防细菌对水产病原菌的抑制作用,寻找替代抗生素的新途径,如从高度污染的海滩污泥中,分离得到一株枯草芽孢杆菌LHB02对三种弧菌包括哈维氏弧菌(Vibrio harveyi)、溶藻弧菌(Vibrio alginolyticus)和鳗弧菌(Vibrio anguillarum)都有很强的抑制作用(徐长安等,2011); 从不同生长阶段的对虾肠道中分离对病原菌(鳗弧菌、副溶血弧菌、哈维氏弧菌)有拮抗作用的细菌(李海兵等,2008)。另外专家学者也开展了利用益生菌、酶制剂促进水产养殖动物的健康和提高饲料利用率方面的研究(Tamehiro et al,2002; Liu et al,2010),并取得了很好的试验效果,如芽孢杆菌、低聚木糖、复合酶制剂及它们的配伍物可以促进异育银鲫的生长,提高饲料利用率,促进肠道有益微生物的生长和抑制有害微生物,并且能提高肝胰脏蛋白酶mRNA表达量和肠道酶活性(刘文斌等,2007); 在饲料中添加粪肠球菌能够促进罗非鱼生长,提高饲料利用率,降低血清胆固醇和甘油三酯含量以及谷丙转氨酶活性,同时增加肠道乳酸菌数量,改善肠道微环境(周晓波等,2014); 纤维素酶可降低动物胃肠内容物的粘稠度,促进内源酶的扩散,提高养分的消化吸收(胡喜峰等,2004); 饲料中添加纤维素酶,草鱼增重率提高,饵料系数降低,干物质、粗蛋白、粗脂肪和粗纤维消化率都提高,体成分没有显著变化(高春生等,2006)。
目前,同时具有产酶和抗菌性能的功能菌株筛选报道较少,本实验室在前期的功能菌筛选中,筛选到一株既产纤维素酶又具有拮抗水产病原菌的芽孢杆菌,本研究报道了该功能菌的筛选、鉴定,及对功能菌产生的纤维素酶进行耐温、耐酸碱和对紫外线的稳定性进行考察,并开展功能菌对水产常见病原菌的拮抗效果分析,初步评估该功能菌株的价值,为以后开发该菌株提供依据。
1 材料与方法 1.1 样品来源用于筛菌的样品采自福建省宁德市养殖池底泥。
1.2 培养基LB培养基: 蛋白胨10g,酵母提取物5g,氯化钠 10g,水1000 mL,pH 7.2—7.4。
SLB培养基: 蛋白胨10g,酵母提取物5g,氯化钠 10g,琼脂20g,水1000 mL,pH 7.2—7.4。
产纤维素酶培养基: 蛋白胨 9.0 g、酵母膏 10.0 g,羧甲基纤维素钠 5.0 g,水1000 mL。
CMC-Na平板: 羧甲基纤维素钠15.0 g、硫酸铵1.0 g、酵母膏1.0 g、硫酸镁1.0 g、磷酸二氢钾1.0 g、琼脂20.0 g、水1000 mL,pH为自然值。
1.3 测试菌嗜水气单胞菌(Aeromonas hydrophila),爱德华氏菌(Edwardsiella),哈维氏弧菌(Vibrio harveyi),溶藻弧菌(Vibrio alginolyticus),副溶血弧菌(Vibrio parahaemolyticus),金黄色葡萄球菌(Staphylococcus aureus)。
1.4 仪器设备常规玻璃器皿、电子天平、超净工作台、打孔器、移液枪、台式摇床、高压蒸汽灭菌锅、恒温培养箱,PCR仪,核酸电泳仪,凝胶成像仪,多功能酶标仪和手提式紫外反射仪等。
1.5 功能菌的筛选 1.5.1 目标菌的分离取10g污泥样品,加入100mL 0.85% NaCl中,搅拌后取上层浊液置于LB培养基,37°C,180 r/min,富集培养30h后,菌液置于75°C水浴20min。水浴后的菌液进行梯度稀释及平板涂布法进行分离。
1.5.2 功能菌产纤维素酶检测分别挑取初筛得到的目标菌,标示为: FA01、FA02、FA03、FA04、FA05、FA06、FA07、FA08、FA09、FA10等以此类推,将这些目标菌置于LB培养基中,37°C,180 r/min,活化6 h,活化好的菌液按10%接种至产纤维素酶培养基,37°C,180 r/min,发酵48h 后,10000 r/min,离心6min,弃去沉淀,得上清液,为粗酶液; 采用CMC-Na平板,打孔后,孔内添加50μL所得的上清液,之后置于37°C过夜; 反应后的平板用刚果红染色1h,接着用0.85% NaCl脱色,观察是否出现水解圈,出现水解圈的即定为功能菌。每株菌做三个重复。
1.6 功能菌的鉴定参照《常见细菌系统鉴定手册》(东秀珠等,2001)进行功能菌生物学特征观察和生理生化试验,并结合16S rDNA序列分析方法进行鉴定。
1.6.1 生物学特征观察将功能菌接种至SLB培养基的培养皿平板,放入温度设置为37°C的恒温箱中,培养24 h,观察菌落形态特征。
1.6.2 生理生化试验进行功能菌部分生理生化试验,包括D-葡萄糖、L-阿拉伯糖、D-木糖、D-甘露醇的产酸试验; 接触酶、苯丙氨酸脱氨酶试验、明胶、淀粉、酪氨酸水解试验; V-P测定、吲哚产生试验、利用柠檬酸盐试验。
1.6.3 16S rDNA序列分析参照文献(徐长安等,2011),采用磁珠法基因组DNA抽提试剂盒提取功能菌全基因组。以全DNA为模板,使用细菌16S rDNA通用引物,27F: 5’-AGAGTTTGATCCTGGCTCAG-3’和1492R: 5’-GGTTACCTTGTTACGACTT-3’。用Taq DNA聚合酶进行PCR扩增,PCR程序为: 94°C预变性4min; 94°C 45s,55°C 45s,72°C 1 min,30个循环; 72°C 10 min修复延伸; 4°C ∞终止反应。使用SanPreP柱式DNA胶回收试剂盒纯化PCR产物。纯化后的PCR产物送至上海生工测序。将测得的16S rDNA序列输入www.ncbi.nlm.nih.gov Blast进行同源性搜索,选取其中与之同源性较高的菌株,用MEGA软件进行系统发育树分析,构建进化树。
1.7 酶活特性分析接种功能菌株至LB培养基中,37°C,180 r/min,活化6h,活化好的菌液按10% 接种至产纤维素酶培养基,37°C,180 r/min,发酵24h后,10000 r/min,离心6min,弃去沉淀,得上清液,为粗酶液。参照文献(韩铭等,2012; 于岚等,2013),采用3,5-二硝基水杨酸比色定糖法(DNS)进行酶活测定,分别考察功能菌株所产的纤维素酶对温度、pH值和紫外线的耐受能力。
1.7.1 酶对pH值的耐受能力检测粗酶液在不同pH缓冲液(3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0)混合均匀,置于37°C,处理1h,测定残存酶活,以最高酶活为100%。
1.7.2 酶对温度的耐受能力检测粗酶液分别在温度为 30、40、50、60、70、80°C的水浴锅中处理1h后,测定残存酶活,以最高酶活为100%。
1.7.3 紫外线对酶活性的影响粗酶液分别在紫外线波长365nm,距离10cm下照射10、20、30、40、50、60 min后,测定残存酶活,以最高酶活为100%。
1.8 拮抗性能检测 1.8.1 抑菌板的制作选择嗜水气单胞菌、爱德华氏菌、哈维氏弧菌、溶藻弧菌、副溶血弧菌、金黄色葡萄球菌,用接种环刮下菌体接种至装有5mL LB培养基的试管中,放入温度设置为37°C,转速为180 r/min的摇床中培养16h后,取1 mL的培养液至100 mL的45—50°C的SLB培养基中,迅速摇匀倒板,待凝固后用打孔器打孔。
1.8.2 发酵上清的制备功能菌FA08斜面接种至装有5mL LB培养基的试管中,放入温度设置为37°C,转速为180 r/min的摇床中活化6 h后,按10%的接种量至装有50 mL LB培养基的三角瓶中,放入温度设置为37°C,转速为180 r/min的摇床中发酵17 h,10000 r/min 离心6 min,得发酵上清。
1.8.3 采用琼脂扩散法(agar diffusion method)进行测定(Tagg et al,1971)。通过测量圆形的透明带(抑菌圈)直径的大小来表示发酵上清液抑菌活性的强弱 2 结果与分析 2.1 目标菌筛选结果经实验发现,标识为FA08的菌株,三个重复均出现水解圈,如图 1所示,而其它菌株未出现水解圈,因此 FA08为目标功能菌。
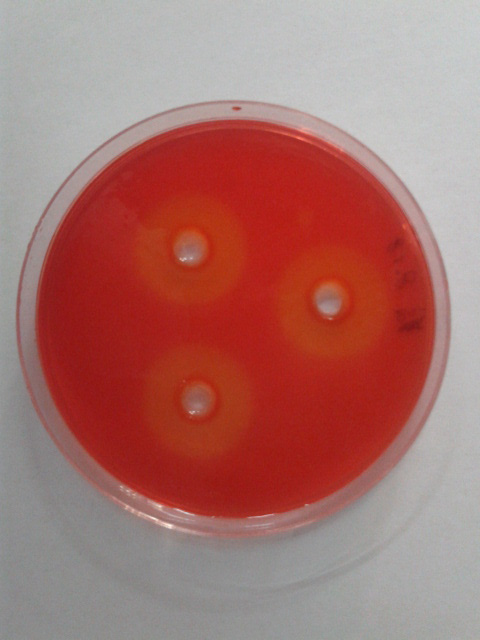 |
| 图 1 功能菌FA08水解圈 Fig. 1 The hydrolysis circle of strain FA08 |
将功能菌FA08接种至SLB培养基的培养皿平板,37°C培养24h,发现菌落白色微黄,中间凸起,表面光滑,边缘不规则,革兰氏染色为阳性,产芽孢。
2.3 生理生化试验功能菌FA08的部分生理生化实验结果如表 1所示。
| 试验项目 | 结果 |
| D-葡萄糖 | + |
| L-阿拉伯糖 | + |
| D-木糖 | + |
| D-甘露糖 | + |
| 接触酶 | + |
| 苯丙氨酸脱氨酶 | - |
| 明胶水解 | + |
| 淀粉水解 | + |
| 酪氨酸水解 | - |
| V-P测定 | + |
| 吲哚试验 | - |
| 利用柠檬酸盐 | + |
| “+”为阳性, “-”为阴性 | |
16S rDNA测序结果显示,菌株FA08的16S rDNA序列全长为1407bp。全序列见图 2。将测得的序列输入国际核酸数据库(http: //www.ncbi.nlm.nih. gov),用Blast进行同源序列搜索,在搜索结果中,选出同源性较高的菌株系列(表 2),用MEGA 软件进行系统发育分析,并构建系统进化树,结果如图 3所示,通过比较可以明显看出,FA08在遗传位置上与Bacillus licheniformis(X68416)和Bacillus licheniformis(NR118959)两株地衣芽孢杆菌最近,且与Bacillus licheniformis(X68416)同源性最高达99%。结合其形态学及生理、生化特征,鉴定功能菌 FA08为地衣芽孢杆菌(Bacillus licheniformis),登录号为KM892857。
 |
| 图 2 功能菌FA08 16S rDNA 测序结果 Fig. 2 The 16S rDNA sequence of strain FA08 |
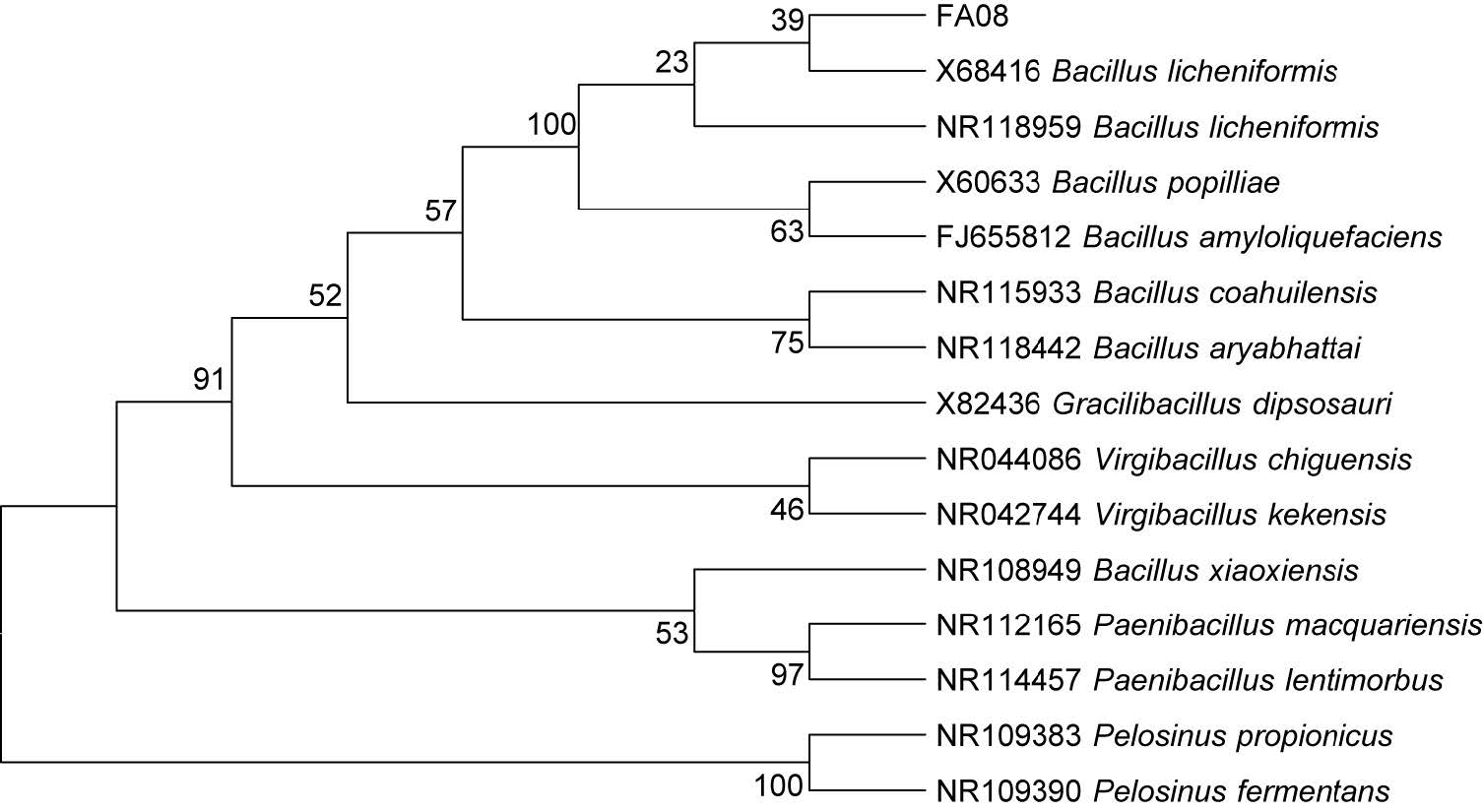 |
| 图 3 基于16S rDNA序列的系统发育树 Fig. 3 Phylogenetic dendrogram based on 16S rDNA sequence |
| 基因库录入编号 | 菌株名称 |
| X68416 | Bacillus licheniformis |
| NR118959 | Bacillus licheniformis |
| X60633 | Bacillus popilliae |
| NR115933 | Bacillus coahuilensis |
| NR044086 | Virgibacillus chiguensis |
| NR042744 | Virgibacillus kekensis |
| X82436 | Gracilibacillus dipsosauri |
| NR118442 | Bacillus aryabhattai |
| NR108949 | Bacillus xiaoxiensis |
| NR112165 | Paenibacillus macquariensis |
| NR114457 | Paenibacillus lentimorbus |
| NR109383 | Pelosinus propionicus |
| NR 109390 | Pelosinus fermentans |
| FJ655812 | Bacillus amyloliquefaciens |
如图 4所示,FA08所产纤维素酶在pH 4下稳定性最好,且pH 3和pH 5—10下保持较好的稳定性,相对酶活保持在85%以上,因此该酶对酸碱的耐受能力较强。
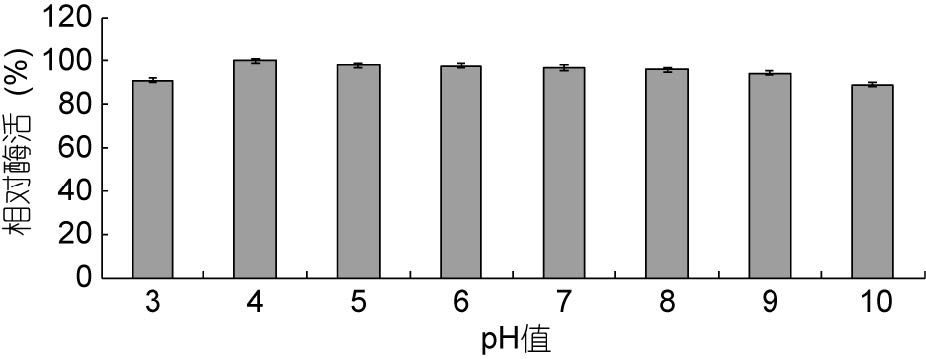 |
| 图 4 pH值对FA08所产生的纤维素酶稳定性的影响 Fig. 4 The effect of pH on the stability of cellulase produced by strain FA08 |
如图 5所示,FA08所产纤维素酶在30—40°C保持较好的稳定性,50—70°C相对酶活保持在75%以上,80°C下相对酶活仍能保持在70%以上,因此该酶对温度具有较好的耐受能力。
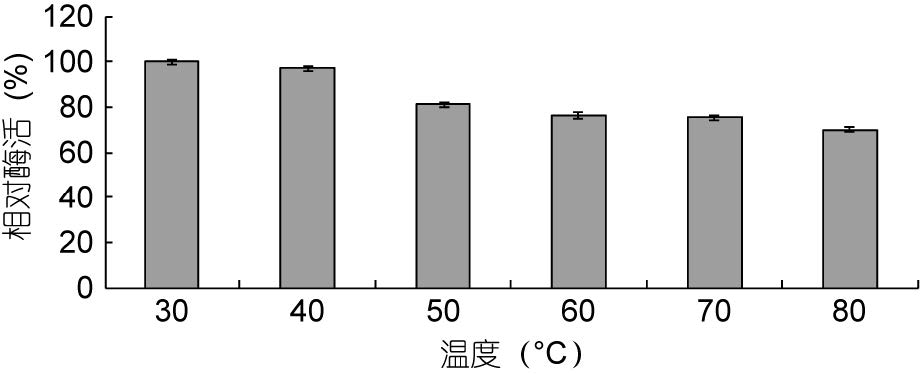 |
| 图 5 温度对FA08所产生的纤维素酶稳定性的影响 Fig. 5 The effect of temperature on the stability of cellulase produced by strain FA08 |
从图 6可以看出在紫外线照射的条件下FA08所产生的纤维素酶保持稳定性,酶活均接近100%,因此该纤维素酶对紫外线具有很强的耐受性。
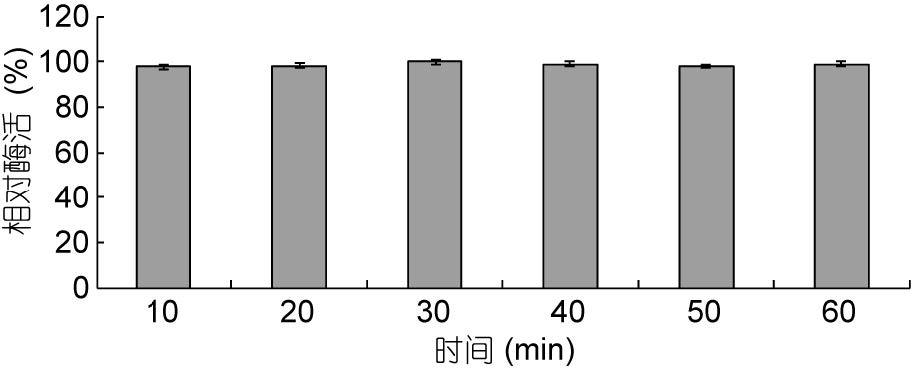 |
| 图 6 紫外线对FA08所产生的纤维素酶稳定性的影响 Fig. 6 The effect of UV on the stability of cellulase produced by strain FA08 |
拮抗试验结果表明: 如表 3所示,功能菌 FA08 对水产养殖常见致病菌: 嗜水气单胞菌、哈维氏弧菌、溶藻弧菌、副溶血弧菌和金黄色葡萄球菌均有较强的抑制作用,其中对嗜水气单胞菌抑制作用最强。
| 病原菌 | 抑菌圈直径(mm) |
| 嗜水气单胞菌(Aeromonas hydrophila) | 20.54±0.34 |
| 爱德华氏菌(Edwardsiella) | 10.31±0.25 |
| 哈维氏弧菌(Vibrio harveyi) | 18.12±0.46 |
| 溶藻弧菌(Vibrio alginolyticus) | 17.16±0.18 |
| 副溶血弧菌(Vibrio parahaemolyticus) | 17.46±0.22 |
| 金黄色葡萄球菌(Staphylococcus aureus) | 17.95±0.31 |
地衣芽孢杆菌作为生防细菌广泛应用于植物病害防治、饲料加工、医药开发、环境污染治理等方面(唐娟等,2008)。1989年,美国FDA和美国饲料控制官员协会公布了地衣芽孢杆菌是安全的微生物物种,可以直接饲用; 我国农业部也把地衣芽孢杆菌列入饲料添加剂目录(马鑫等,2011),允许在饲料中直接添加。另外,地衣芽孢杆菌在水产养殖方面也有很好的应用价值,如地衣芽孢杆菌作为鱼饲料添加剂,不仅可以促进鱼体生长,而且益于养殖水体的保护(葛文霞等,2014); 地衣芽孢杆菌和低聚木糖,可提高鱼体中消化酶的活性,有助于维持肠道内的微生态平衡,促进动物生长(刘波等,2006); 地衣芽孢杆菌增加了肠道消化酶活性,促进了鱼体生长(刘波等,2005)。另有研究表明,地衣芽孢杆菌具有耐高温、耐酸碱的特性,并能产生蛋白酶、脂肪酶、淀粉酶和纤维素酶等,有助于降解植物性饲料中某些复杂的碳水化合物,消除抗营养因子(董尚智等,2009)。本实验所筛选的功能菌FA08鉴定为地衣芽孢杆菌,且可产生纤维素酶,预示着该菌具有较好的开发与应用前景。
通过考察地衣芽孢杆菌FA08产生的纤维素酶对酸碱稳定性的影响,发现FA08产生的纤维素酶对酸碱均能保持较好的稳定性,pH3和pH 5—10下相对酶活保持在85%以上,与杨丽娜等(2012)筛选到的芽孢杆菌属(Bacillus)微生物所产的纤维素酶相比,在酸性条件下的耐受能力强,具有相似性,而在中性、碱性条件下地衣芽孢杆菌FA08产生的纤维素酶更具耐受能力。水产动物大多数无胃,消化道呈中性(鲤科鱼类)或偏碱性(王仁华等,2011),因此地衣芽孢杆菌FA08产生的纤维素酶不仅适合于有胃的动物,而且也适合应用于水产动物。另外,地衣芽孢杆菌生长条件要求低,繁殖快,能迅速定植在肠黏膜上,在短时间内成为肠道的优势菌群(张菊等,2012),并在肠道中发挥作用,有利于开发成为内服的微生物制剂。
实验发现,地衣芽孢杆菌FA08产生的纤维素酶对温度有较好的耐受能力,耐受80°C下相对酶活仍能保持在70%以上,与葛春辉(2009)筛选到的蜡质芽孢杆菌所产的纤维素酶相比,更具有耐温特性。在饲料原料中,杂粕类的原料粗纤维含量高,存在抗营养因子,大大限制了其在饲料中的使用量,目前发酵技术的应用,可提高杂粕类原料的使用价值,降解杂粕原料中水产动物难以消化的纤维素,消除抗营养因子,提高杂粕原料的利用率。一般饲料原料的发酵温度可达60—80°C,而地衣芽孢杆菌FA08产生的纤维素酶可较好耐受发酵温度,可应用于杂粕的发酵,提高杂粕的营养价值。
地衣芽孢杆菌对有害微生物具有拮抗作用: 如地衣芽孢杆菌Wl0能产生抗菌蛋白,对多种植物病原菌有较好的抑制效果(纪兆林等,2013); 又如地衣芽孢杆菌c-4具有较广的抑菌范围,对番茄枯萎病菌、玉米弯孢叶斑病菌、胶孢炭疽病菌、棉花枯萎病菌、棉花黄萎病菌、小麦赤霉病菌和西瓜枯萎病菌等均有抑制作用(孙正祥等,2009)。然而地衣芽孢杆菌对水产养殖病原菌的拮抗特性报道较少。本实验也探讨了地衣芽孢杆菌FA08发酵上清对水产常见病原菌的拮抗效果,发现地衣芽孢杆菌FA08对水产病原菌: 嗜水气单胞菌、爱德华氏菌、哈维氏弧菌、溶藻弧菌、副溶血弧菌和金黄色葡萄球菌均有较强的拮抗作用。由于地衣芽孢杆菌具有在水产动物肠道定植的特性,这意味着地衣芽孢杆菌FA08进入水产动物肠道后,在肠道内可产生拮抗物质,对病原菌进行抑制或杀灭作用,促进水产动物肠道健康,有着重要的意义,另外,也可利用FA08的拮抗性能,制备微生物杀菌剂。
本研究开展了地衣芽孢杆菌FA08的筛选与鉴定,考察了该菌的酶学性质和抗菌特性,初步评估该菌的开发与应用价值,下一步将进行其作为养殖动物肠道定植菌、杂粕饲料发酵菌及制备微生物杀菌剂的研究与开发,实现FA08在水产养殖中的应用价值。
| 于岚,程芳,邵文琦等, 2013.一株嗜热纤维素酶生产菌的分离、鉴定及酶学研究.安徽农业科学, 41(17):7413-7417 |
| 马鑫,郭宏,张宝国等, 2011.地衣芽孢杆菌作为饲料添加剂的研究进展.中国饲料添加剂,(2):10-13 |
| 王仁华,刘晓兰,王琤韡, 2011.水产动物纤维素酶的应用研究.饲料研究,(12):62-64 |
| 东秀珠,蔡妙英, 2001.常见细菌系统鉴定手册.北京:科学出版社, 43-65 |
| 刘波,刘文斌,王恬, 2005.地衣芽孢杆菌对异育银鲫消化机能和生长的影响.南京农业大学学报, 28(4):80-84 |
| 刘波,谢骏,刘文斌等, 2006.地衣芽孢杆菌与低聚木糖对异育银鲫消化酶活性、肠道菌群及生长的影响.大连水产学院学报, 21(4):336-340 |
| 刘文斌,尹君,方星星等, 2007. 3种益生素配伍对异育银鲫(Carassius auratus gibelio)生长、消化及肠道菌群组成的影响.海洋与湖沼, 38(1):29-35 |
| 孙正祥,王振中, 2009.生防细菌C-4的特性鉴定及其对香蕉枯萎病的防治效果.植物保护学报, 36(5):392-396 |
| 纪兆林,宋浩,徐敬友等, 2013.地衣芽孢杆菌Wl0发酵产生抗茵蛋白的研究.中国生物防治学报, 29(4):579-585 |
| 李海兵,宋晓玲,韦嵩等, 2008. 4株对虾肠道益生菌的筛选及鉴定.海洋与湖沼, 39(4):374-380 |
| 杨丽娜,杨明明,龚月生, 2012.产耐热性纤维素酶菌株的分离·鉴定及其酶学性质研究.安徽农业科学, 40(14):8103-8105 |
| 张菊,李金敏,张志焱等, 2012.地衣芽孢杆菌的研究进展.中国饲料,(17):9-11 |
| 张庆华,封永辉,王娟等, 2011.地衣芽孢杆菌对养殖水体氨氮、残饵降解特性研究.水生生物学报, 35(3):498-503 |
| 张峰峰,谢凤行,周可等, 2012.利用复合微生物降解养殖水体中亚硝酸盐的初步研究.水产科学, 31(10):593-596 |
| 周晓波,黄燕华,曹俊明等, 2014. 5种乳酸菌对罗非鱼生长性能、体成分、血清生化指标及肠道茵群的影响.动物营养学报, 26(7):2009-2017 |
| 胡喜峰,王成章,张春梅等, 2004.纤维素酶在水产中的应用及展望.中国水产,(4):73-74 |
| 顾继锐,苏艳秋,伍翠芳等, 2011.一株嗜盐光合菌的分离及对养殖污水的处理效果.淡水渔业, 41(5):45-51 |
| 徐长安,罗秀针,俞超超, 2011.海洋源生防细菌LHB02的筛选、鉴定及其抑菌谱检测.海洋与湖沼, 42(2):284-288 |
| 高存川,徐春厚, 2012.微生态制剂在水产养殖水质改良中的应用.湖北农业科学, 51(7):1419-1422 |
| 高春生,范光丽,李建华等, 2006.纤维素酶对草鱼生长性能和饲料消化率及体成分的影响.中国农学通报, 22(10):473-475 |
| 唐娟,张毅,李雷雷等, 2008.地衣芽孢杆菌应用研究进展.湖北农业科学, 47(3):351-354 |
| 葛文霞,柳旭伟, 2014.地衣芽孢杆菌在养殖业中的应用研究进展.上海畜牧兽医通讯,(1):17-19 |
| 葛春辉,徐万里,邵华伟等, 2009.一株产纤维素酶细菌的筛选、鉴定及其纤维素酶的部分特性.生物技术, 19(1):36-40 |
| 董尚智,王国霞,陈远凤等, 2009.饲用地衣芽孢杆菌的生物学特性研究.饲料研究,(7) 14-18 |
| 韩铭,袁月祥,闫志英等, 2012.一株产耐热纤维素酶菌株的筛选及酶学性质.应用与环境生物学报, 18(1):75-79 |
| 潘娟,李利,刘丽媛, 2012.益生菌在水产养殖生产中的应用.畜牧与饲料科学, 33(4):90-92 |
| Barsby T, Kelly M T, Gagne S M et al, 2001. Bogorol a produced in culture by a marine Bacillus sp. reveals a novel template for cationic peptide antibiotics. Org Lett, 3(3):437-440 |
| Burgess J G, Miyashita H, Sudo H et al, 1993. Gene transfer in Chromatium purpuratum, a marine photosynthetic bacterium producing antibiotics. J Mar Biotechnol, 1(2):101 |
| Liu K-F, Chiu C-H, Shiu Y-L et al, 2010. Effects of the probiotic, Bacillus subtilis E20, on the survival, development, stress tolerance, and immune status of white shrimp, Litopenaeus vannamei larvae. Fish Shellfish Immunol, 28(5-6):837-844 |
| Tagg J R, McGiven A R, 1971. Assay system for bacteriocins. Appl Microbiol, 21(5):943 |
| Tamehiro N, Okamoto-Hosoya Y, Okamoto S et al, 2002. Bacilysocin, a novel phospholipid antibiotic produced by Bacillus subtilis 168. Antimicrob Agents Chemother, 46(2):315-320 |
| Vanittanakom N, Loeffler W, Koch U et al, 1986. Fengycin-A novel antifungal lipopeptide antibiotic produced by Bacillus subtilis F-29-3. J Antibiotics, 39(7):888-901 |
| Vaseeharan B, Ramasamy P, 2003. Control of pathogenic Vibrio spp. by Bacillus subtilis BT23, a possible probiotic treatment for black tiger shrimp Penaeus monodon. Lett App Microbiol, 36(2):83-87 |
 2015, Vol. 46
2015, Vol. 46


