中国海洋湖沼学会主办。
文章信息
- 曹政飞, 张伟, 赵宏. 2015.
- CAO Zheng-Fei, ZHANG Wei, ZHAO Hong. 2015.
- 红纤维虾海藻(Phyllospadix iwatensis)形态结构特征及其对海洋环境的适应性
- MORPHOLOGY AND ANATOMY OF PHYLLOSPADIX IWATENSIS MAKINO AND THEIR ADAPTATION TO MARINE ENVIRONMENT
- 海洋与湖沼, 46(6): 1326-1332
- Oceanologia et Limnologia Sinica, 46(6): 1326-1332.
- http://dx.doi.org/10.11693/hyhz20150100021
-
文章历史
- 收稿日期:2015-01-24
- 改回日期:2015-03-20
在进化历程中,植物形态结构已经形成了大量的精确适应环境的各种表观性状,其发育过程、功能体现机制以及适应意义等是进化生物学和发育生物学研究的核心问题之一。目前对植物形态结构与环境的适应性研究取得了一系列的进展,如Harder等(2009)根据达尔文的进化理论,进一步阐释了花的结构特征分化与适应性的关系; Ren等(2011)通过对兰科植物与昆虫的传粉关系研究,揭示了毛瓣杓兰叶片模仿真菌感染的拟态与其传粉生物的适应性关系; Mao等(2009)对46 科80 种不同花型及传粉模式的植物花型与花粉进行了观察研究,发现接触水分会影响花粉寿命,而花结构则对花粉起保护作用,表明花的结构也是对雨水的一种适应; De Micco等(2012)研究了植物抗干旱的结构特征和适应策略,发现不同形态结构的特征组合有助于植物对干旱环境不同程度的适应。这些研究在一定程度上加深了我们对适应性进化的理解,但是上述研究主要针对陆生植物,对海洋植物尤其是海洋高等植物的研究鲜有报道。海洋沉水高等植物是极其稀少的类群,目前已报道60 余种,仅占高等植物多样性的0.02%,然而它们对于海洋生态环境的维护乃至渔业生产具有举足轻重的作用(Orth et al,2006)。
红纤维虾海藻(Phyllospadix iwatensis Makino)是海洋沉水高等植物的代表性物种之一,隶属于大叶藻科(Zosteraceae)、虾海藻属(Phyllospadix),是构成海草床的重要建群物种。虾海藻属全球共5 种,分布于北太平洋沿岸,中国有2 种,即红纤维虾海藻(P. iwatensis)和黑纤维虾海藻(Phyllospadix japonicas Makino)。红纤维虾海藻历史上曾广泛分布于泛太平洋沿海,但由于自然及人为原因目前数量及分布锐减,已被列为世界濒危物种(Short et al,2011),在中国也仅在辽东半岛、山东半岛及河北沿海零星分布(Guo et al,2010)。目前对于红纤维虾海藻的研究多集中于资源与生态学调查(杨宗岱等,1984; 郭栋等,2010; 刘炳舰,2012),而对其形态结构与适应性的研究相对较少,仅见对其叶片解剖结构和亚显微结构及其功能的初步报道,以及对其果实解剖结构的描述(Kuo et al,1988,1990),郭栋等(2010)对红纤维虾海藻进行了分类学描述。上述研究均未深入探讨形态结构与适应性,使得人们对这一重要且濒危的物种认识不足。本研究对红纤维虾海藻的生境状况进行了近三年的跟踪调研,通过形态观察、精细解剖、组织结构、花粉电镜等多个角度综合研究了红纤维虾海藻的形态结构特征及对海洋环境的适应性。并通过与近缘属物种形态结构与生境的比较,进一步阐述了红纤维虾海藻的形态结构与环境的适应性特点,以期为海洋高等植物的形态结构与环境适应性进化提供基础资料。
1 材料与方法本实验所用材料自2012 年4 月至2014 年6 月多次采集于威海双岛湾潮间带的不同小生境(37°29'25.84"N,121°58'23.80"E)。这些实验材料,一部分用于观察群体水平的形态变化特征,另一部分用于个体形态特征、精细解剖的观察与拍摄。实验材料经FAA(Formalin-Aceto-Alcohol)固定,用石蜡切片机(LeicaRM 2235)进行切片,在Olympus CX41 显微镜下观察并拍摄。花粉处理后用日立S4800 冷场发射扫描电子显微镜(HITACHI S-4800 FESEM)进行观察与拍摄。 凭证标本(No.201204001)由山东大学(威海)海洋学院赵宏副教授鉴定,与照片信息一起保存在山东大学(威海)海洋学院植物标本室。
2 结果 2.1 红纤维虾海藻形态结构红纤维虾海藻根状茎粗短(图 1a,b),匍匐,须根成对,末端膨大并密生根毛(图 1b)。叶2 列互生,具抱轴叶鞘,腐烂后常于植株基部形成丛状红棕色纤维(图 1b); 叶舌明显(图 2c),叶耳钝尖(图 2d); 叶片线形,下部全缘(图 2a),上部边缘具连续的鳍刺状齿,叶端钝(图 2b)。雌雄异株,佛焰花序腋生; 花序常向腹侧弯曲呈虾形(图 3a)。花单性,呈两列平行着生在扁平的舟状花序轴上,花序轴两侧着生两列桨状小苞片(retinacule)(图 3b,图 d); 雄花序由单一雄蕊沿花序轴交互排列,无花丝,花药二室(图 3d); 雌花序相对较小,由雌蕊与退化雄蕊共同组成,斜向穗轴方向交互贴生于扁平的花序轴两侧(图 3b),心皮1,箭形,花柱较短,柱头2 裂,丝毛状(图 3c)。小坚果较扁,马掌形,两翅内侧着生整齐而密集的倒向生长的长鬃毛(图 4a),种子扁平,近圆形(图 4b)。

|
| 图 1 红纤维虾海藻植株、根及根状茎的形态 Fig. 1 Morphology of the plant, roots, and rhizome of Phyllospadix iwatensis Makino a. 植株全株。b. 根状茎和须根: rf, 红棕色纤维; rh, 根状茎; ro, 须根; ir, 须根膨大的末端及密集的根毛 |

|
| 图 2 红纤维虾海藻叶的形态与解剖结构 Fig. 2 Morphology and anatomy of the leaf of P. iwatensis a. 叶: lf, 叶片。b. 叶先端: ls, 叶锯齿。c. 叶舌。d. 叶耳 |

|
| 图 3 红纤维虾海藻花的形态与解剖结构 Fig. 3 Morphology and anatomy of the flowers of P. iwatensis a. 佛焰花序: fi, 雌花序; mi, 雄花序。b. 雌花序: re, 小苞片; sd, 退化雄蕊; ca, 心皮。c. 雌蕊及其横纵切面: sg, 柱头; ca, 心皮. ov; 胚 珠。d. 雄花序: re, 小苞片; st, 雄蕊 |

|
| 图 4 红纤维虾海藻果实和种子的形态 Fig. 4Morphology of the fruit and seed of P. iwatensis a. 果实: br, 倒向长鬃毛。b. 种子 |
红纤维虾海藻的须根着生在根状茎的节处,细长且具有一定的硬度,并在末端膨大且密生根毛(图 1b),主要起到固定植株和吸收营养物质的作用。显微镜下观察: 由外到内依次为表皮细胞、皮层和维管柱(图 5a)。表皮细胞长方形,排列致密,细胞壁具有类似栓化细胞的初生壁性质的六面加厚现象,个别表皮细胞会外凸生长形成根毛(图 5a); 外皮层内侧有多层厚角细胞,形成机械组织区(图 5a),使得红纤维虾海藻的须根强度增加。
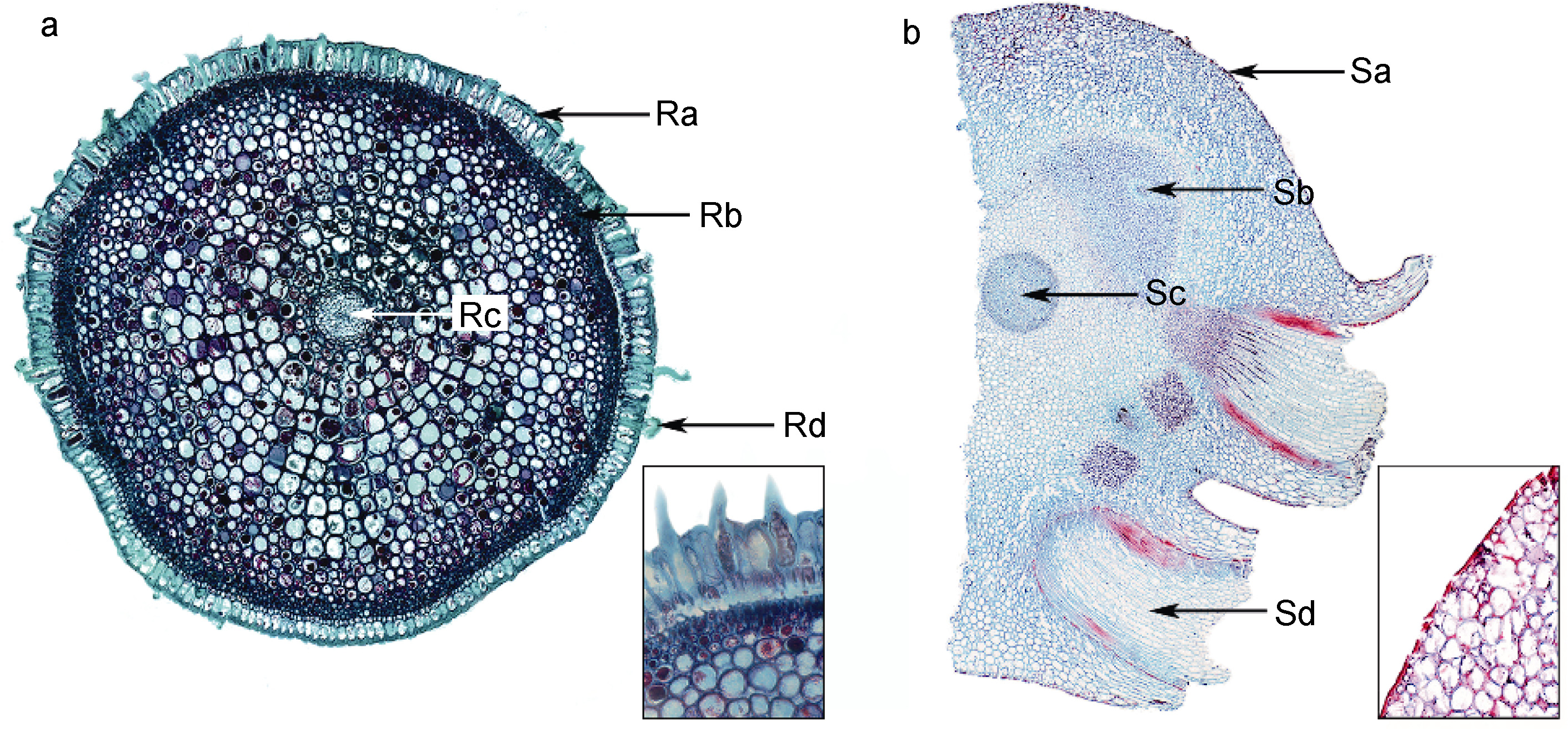
|
| 图 5 红纤维虾海藻须根与根状茎横切, 右下角示表层局部放大 Fig. 5 Transection of root and rhizome, with close-up of epidermis and part of cortex at bottom right a. 须根: Ra, 表皮细胞; Rb, 外部皮层厚角组织; Rc, 维管柱; Rd, 根毛细胞。b. 根状茎: Sa, 表皮细胞; Sb, 维管束; Sc, 中央维管束; Sd, 须根 |
如图 5b 所示,根状茎节间极度缩短,横切结构从外至内依次为表皮细胞、皮层薄壁细胞和中央维管束。表皮细胞排列极为紧密,外表面有明显角质层; 除中央维管束外在皮层中还散布两束较小的维管束。
如图 6 所示,叶线形,叶片横切面的主要结构为表皮细胞、薄壁细胞、气道和5 个维管束。表皮细胞排列异常紧密,未见气孔,表皮细胞外侧具有角质层; 叶肉组织中有许多气道。在叶鞘内侧有较多明显的机械组织细胞群。
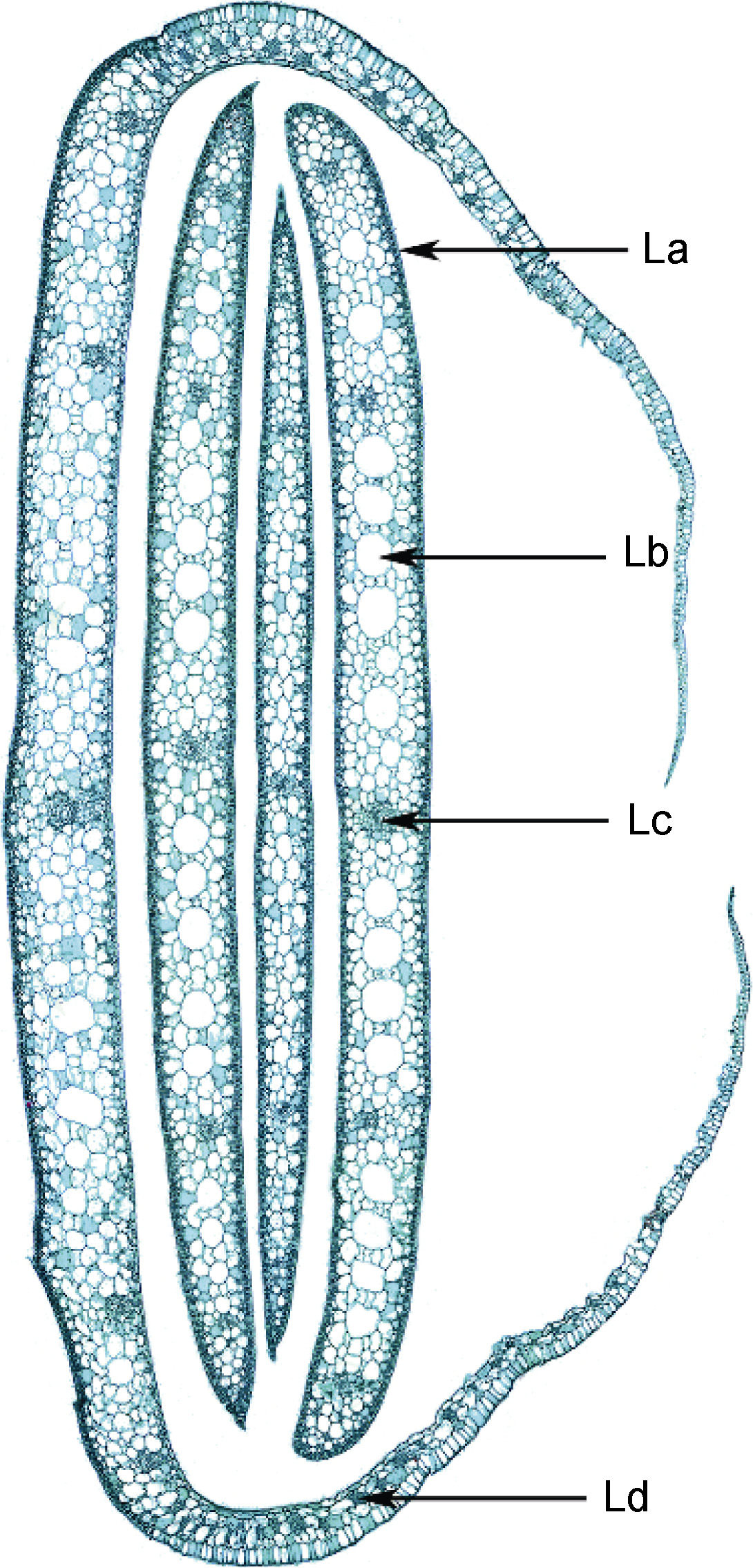
|
| 图 6 红纤维虾海藻叶鞘与叶片横切 Fig. 6 Transection of leaves and leaf sheath La, 表皮细胞及角质层; Lb, 气道; Lc, 维管束; Ld, 叶鞘内侧的机械组织细胞群 |
雌雄异株,在花序轴边缘着生两排小苞片,雄花序小苞片与花药互生(图 7a),雌花序小苞片与子房对生(图 7b)。雌雄花均为无被花,雄蕊的花药交互排列,紧密,无花丝(图 7a); 雌蕊1 心皮,1 胚珠,基底胎座,柱头二裂,具退化雄蕊(图 7b)。雌雄花序轴由表皮细胞、 皮层薄壁细胞、气道和维管束组成,与叶相似(图 7a,b)。
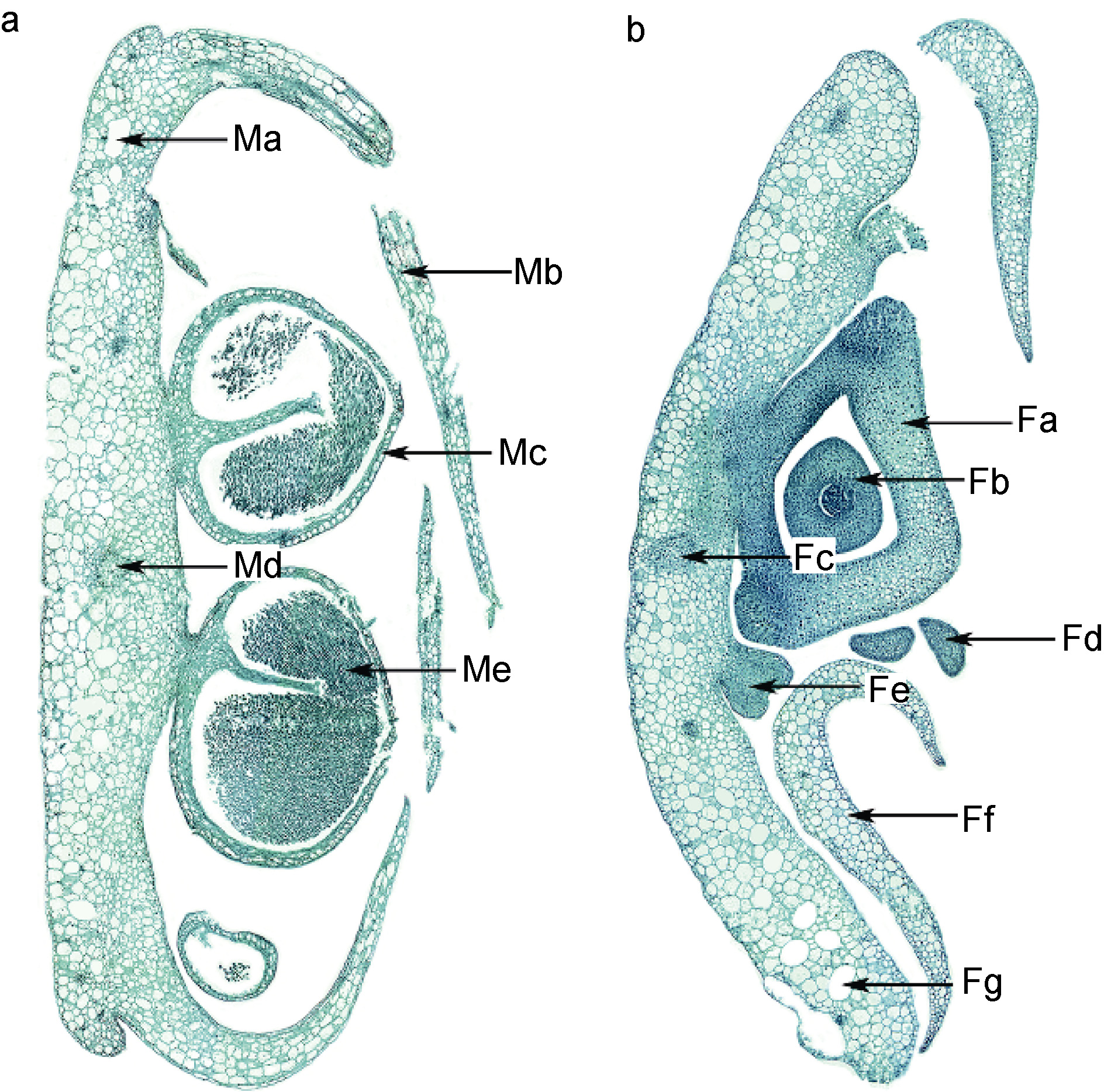
|
| 图 7 红纤维虾海藻花序轴横切 Fig. 7 Transection of rachis a. 雄花序: Ma, 气道; Mb, 小苞片; Mc, 花药; Md, 维管束; Me, 花粉。b. 雌花序: Fa, 子房; Fb, 胚珠; Fc, 维管束; Fd, 柱头;Fe, 退化雄蕊; Ff, 小苞片; Fg, 气道 |
红纤维虾海藻花粉丝状,细长线形,长度约 600—1000μm,直径约4—10μm,花粉表面光滑,无纹饰,未发现萌发沟和萌发孔(图 8)。
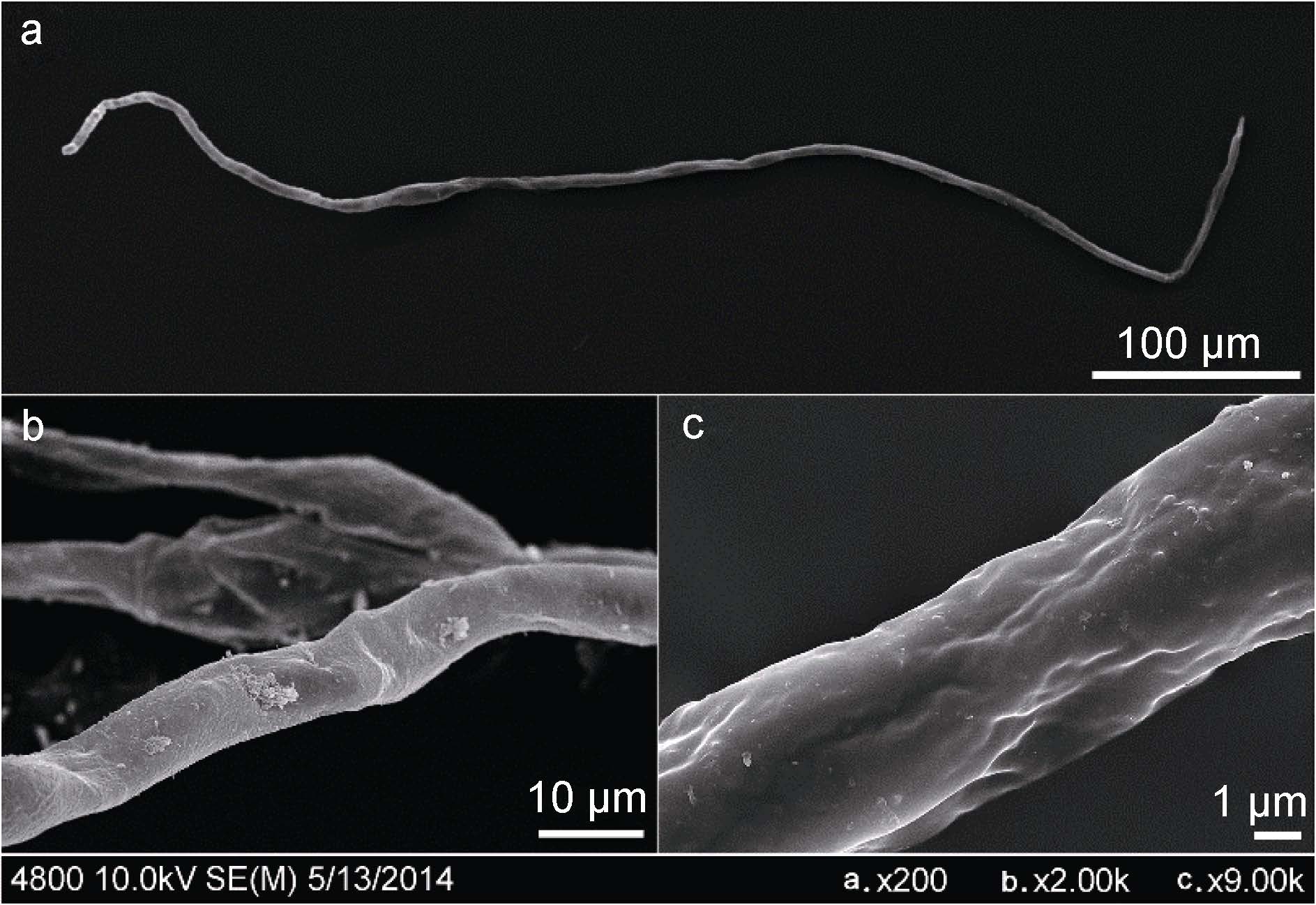
|
| 图 8 红纤维虾海藻花粉电镜 Fig. 8 The pollen under scanning electron microscope a. 丝状花粉。b. 花粉表面。c. 花粉表面放大 |
通过对红纤维虾海藻的跟踪观察、生境分析及形态与组织结构的研究,我们发现红纤维虾海藻的形态特征与生活环境具有高度适应性。其适应性特征主要体现在以下几个方面:
3.1 营养器官的适应性3.1.1 根
红纤维虾海藻根部末端膨大,并密生根毛,这种膨大的结构增加了与岩礁底质的接触面积,增强了固着能力,并通过发达根毛的辅助作用,适应坚硬岩礁底质和海流冲击(图 1b)。此外,在末端未与底质接触的部分,根毛也相对发达,有研究者认为这主要是为了吸收海水和底质沉积物中的无机营养(Cooper et al,1988)。而与其同科的大叶藻(Zostera marina L.)根末端并不膨大,且根毛稀疏(Kuo et al,2006),与其泥沙底质的生长环境相适应。 这两种不同生境中产生的结构差异充分说明了各自的结构适应性特点。
须根的表皮细胞排列极为紧密,这种致密的栓化细胞结构使组织内部与外部海水隔离,防止组织渗透压失衡,而外部皮层细胞形成厚角组织区(图 5a),这些机械组织的存在是红纤维虾海藻提高海水中抗压能力的结构性适应对策。维管柱相对较小,木质部与韧皮部分化并不明显,这可能是由于海水的压力较大,植株本身较小,所以无需特别发达的维管系统。皮层较厚,对维管柱具有充分的保护作用。此外,发达的表皮和外部皮层机械组织使须根具有坚硬的质地,抗性加强,能承受较强的海流冲击。
3.1.2 茎匍匐生长的根状茎极度缩短,簇生状,增加了单位面积上须根的数量,增大了植株的岩礁抓附力,同时也有效降低了海浪对植株的冲击损伤。 根状茎组织结构与须根相似,均有致密的表层结构起保护作用。
3.1.3 叶叶线形,较窄,长而柔韧。表皮细胞外具有明显的角质层,叶鞘不闭合,在弯折叶鞘内侧存在具有加固作用的机械组织细胞群(图 6),能有效抵抗海浪的冲击。表皮无气孔,表皮细胞具有叶绿体,叶肉细胞无叶绿体,这是海洋沉水植物对光照的适应(叶春江等,2002)。气道发达,通气效率较高,有助于光合作用产生的氧气在植株体内的快速传输(于函等,2007)和利用。
3.2 繁殖器官的适应性 3.2.1 花大叶藻科植物的花成两排排列在扁平的佛焰花序轴上,外由佛焰苞片包裹,成熟时,花药释放出丝状花粉,雌蕊柱头接受花粉完成受精,丝状的花粉是生态学和进化上的重要证据(Soros-Pottruff et al,1994,1995)。Cox(1988)指出传粉有一个混合的模式,即花粉不仅在水面传播,也在水面以下传播,即水媒(hydrophilous pollination)和半水媒传粉(submarine pollination)。大叶藻科花序的结构比较复杂,花序包括雌雄同株和雌雄异株两种类型,对于雌雄同株的类型,目前普遍支持的说法是佛焰花序上每列雄花与雌花交替排列,雄花由两个独立的花粉囊构成,雌花由单个雌蕊构成,花的结构高度简化(Soros-Pottruff et al,1994,1995; Tomlinson et al,2001)。对雌雄异株的虾海藻属而言,雄花序比雌花序大,雄花序中全为雄蕊,且雄蕊只有花药(图 3d),无花丝,丝状花粉量大,从而增加柱头受粉率; 雌花序中不仅包含雌蕊,亦包含退化雄蕊(图 3b),柱头二裂,有利于丝状花粉的缠绕。对比大叶藻科具两性花结构的属,虾海藻属更为进化。红纤维虾海藻雌雄花序上均有发达的小苞片(retinacule),这可能与传粉过程有关系。雌花序上的小苞片在传粉过程中闭合,可以有效地保护幼嫩的子房; 雄花序上的小苞片在传粉过程中打开,有利于散播花粉。
红纤维虾海藻在繁殖方式上具有高度的适应性,除了都利用根状茎进行大量的无性繁殖外,其有性生殖比同科的其他属更为进化。虾海藻属是大叶藻科唯一的雌雄异株属,能有效避免自交授粉产生的近交衰退。红纤维虾海藻自然种群分布呈现出雌雄株比例严重失衡,在我们调查的其中一个约500m2 的样地范围内,仅发现两个雄株种群,且每个种群的分布面积不超过1m2,其余面积几乎都被雌株种群所占据,推测导致这种现象的主要原因是: 在海洋环境中,植物的无性繁殖占主导地位,虾海藻属主要繁殖方式为根状茎克隆式无性繁殖,具有繁殖速度快、生殖投入量小、难度低等特点,易使植株迅速繁殖占领栖息地; 相比之下,海洋环境中的有性繁殖生殖投入量大、难度较高,但雄株的适当保留可以进行基因交流,有效防止过度无性繁殖产生的种群退化。在有性繁殖过程中,雌雄花序开放时间长短不同,雄花开放时间很短,产生的丝状花粉量大,而雌花花期很长,只有和雄花开放时间同步的雌花才有可能被授粉,这是有效调节繁殖方式的一种适应。花药开裂,丝状花粉通过海浪作用被释放到成熟的雌花序处,随着波浪移动并形成棉絮般的漂浮物(Cox et al,1992),雌蕊柱头二裂,向上弯曲,与周围水流方向垂直,使传粉几率增加(Ackerman,1955; 1986; 1997),伸出小苞片之外,使柱头更容易被丝状花粉缠绕,防止由于水流冲击导致花粉脱落。同时,激烈的海流冲击有助于将花粉传播至更远的距离,从而保证种群内雌株的授粉率。花粉散布以后经水流运输作用抵达雌蕊处,随海浪起伏冲刷反复与柱头接触,从而被柱头捕获完成授粉过程。花序上的桨状小苞片只在花序成熟后打开,推测可能与传粉过程有关,这使雌蕊能以一种更好的方向接受花粉,起到导向作用。小苞片还可能起到缓解水流过度冲击的作用,相比之下,处于静水环境中的大叶藻属则不具有或具有异常简化的小苞片(Soros-Pottruff et al,1995)。
3.2.2 果实果实马掌形,在果实前端具有两翅,并随果实的生长和成熟而伸长,果实成熟后从残存的花序轴上脱落,下部两侧的翅已经比较明显,且较为坚硬,此时外果皮仍包被在果实上,到后期下部外果皮分解,露出翅内侧密生的倒向鲸须般长鬃毛(图 4a)。在水流冲击下,由于有倒向的长鬃毛,果实会嵌入到附近一些大型藻类或其他适合的固着物上,从而使果实固定,以保证种子顺利萌发。在此过程中,翅上的倒向鬃毛发挥了至关重要的作用,是果实锚定在固着物上的结构基础,体现了红纤维虾海藻对海水环境的高度适应。
4 结论本研究从多角度较为全面的阐述了红纤维虾海藻形态结构对海洋环境的适应性,得出的主要结论有: 红纤维虾海藻的须根坚硬,末端膨大,根毛发达,有利于增强植株的抓附能力和吸收能力; 叶片细长坚韧,适应海水激流环境,叶片无气孔,气道发达,能有效利用光合作用产生的氧气; 雌雄异株,性比差异显著,是调节繁殖方式的有效策略; 具水媒和半水媒双重传粉方式; 花序具有桨状小苞片,可能与传粉机制有关; 花粉丝状,柱头二裂,有助于增加授粉几率; 小坚果先端具翅,其上倒向的长鬃毛有助于果实锚定在附着物上。上述结构特征充分体现了红纤维虾海藻与海洋环境的高度适应性。
| 于函, 马有会, 张岩等. 2007. 大叶藻的生态学特征及其与环境的关系. 海洋湖沼通报, S1: 112-120 |
| 叶春江, 赵可夫. 2002. 高等植物大叶藻研究进展及其对海洋沉水生活的适应. 植物学通报, 19(2): 184-193 |
| 刘炳舰. 2012. 山东典型海湾大叶藻资源调查与生态恢复的基础研究. 青岛: 中国科学院海洋研究所硕士学位论文,49-50 |
| 杨宗岱, 吴宝玲. 1984. 青岛近海的海草场及其附生生物. 黄渤海海洋, 2(2): 56-67 |
| 郭栋, 张沛东, 张秀梅等. 2010. 山东近岸海域海草种类的初步调查研究. 海洋湖沼通报, (2): 17-21 |
| Ackerman J D. 1955. Convergence of filiform pollen morphologiesin seagrasses: functional mechanisms. Evolutionary Ecology,9(2): 139-153 |
| Ackerman J D. 1986. Mechanistic implications for pollination inthe marine angiosperm Zostera marina. Aquatic Botany,24(4): 343-353 |
| Ackerman J D. 1997. Submarine pollination in the marineangiosperm Zostera marina (Zosteraceae). I. The influenceof floral morphology on fluid flow. American Journal ofBotany, 84(8): 1099-1109 |
| Cooper L W, McRoy C P. 1988. Anatomical adaptations to rockysubstrates and surf exposure by the seagrass genusPhyllospadix. Aquatic Botany, 32(4): 365-381 |
| Cox P A. 1988. Hydrophilous pollination. Annual Review ofEcology and Systematics, 19: 261-279 |
| Cox P A, Tomlinson P B, Nieznansiki K. 1992. Hydrophilouspollination and reproductive morphology in the seagrassPhyllospadix scouleri (Zosteraceae). Plant Systematics andEvolution, 180(1-2): 65-75 |
| De Micco V, Aronne G. 2012. Morpho-anatomical traits for plantadaptation to drought. In: Ricardo A ed. Plant Responses toDrought Stress. Berlin, Germany: Springer-Verlag Press,37-61 |
| Guo Y H, Robert R H, Hellquist C B. 2010. Zosteraceae. In: WuZY, Raven PH eds. Flora of China, Vol. 23. Beijing, China:Science Press & St. Louis, USA: Missouri Botanical GardenPress, 106-107 |
| Harder L D, Johnson S D. 2009. Darwin's beautiful contrivances:evolutionary and functional evidence for floral adaptation.New Phytologist, 183(3): 530-545 |
| Kuo J, Aioi K, Iizumi H. 1988. Comparative leaf structure and itsfunctional significance in Phyllospadix iwatensis Makinoand Phyllospadix japonicus Makino. Aquatic Botany, 30(3):169-187 |
| Kuo J, den Hartog C. 2006. Seagrass morphology, anatomy, andultrastructure. In: Larkum A W D, Orth R J, Duarte C M eds.Seagrasses: Biology, Ecology and Conservation. BerlinNetherlands, Germany: Springer, 51-87 |
| Kuo J, Iizumi H, Nilsen B E et al. 1990. Fruit anatomy, seedgermination and seedling development in the Japaneseseagrass Phyllospadix (Zosteraceae). Aquatic Botany, 37(3):229-245 |
| Mao Y Y, Huang S Q. 2009. Pollen resistance to water in 80angiosperm species: flower structures protect rain-susceptiblepollen. New Phytologist, 183(3): 892-899 |
| Orth R J, Carruthers T J B, Dennison W C et al. 2006. A globalcrisis for seagrass ecosystems. BioScience, 56(12):987-996 |
| Ren Z X, Li D Z, Bernhardt P et al. 2011. Flowers ofCypripedium fargesii (Orchidaceae) fool flat-footed flies(Platypezidae) by faking fungus-infected foliage.Proceedings of the National Academy of Sciences of theUnited States of America, 108(18): 7478-7480 |
| Short F T, Polidoro B, Livingstone S R et al. 2011. Extinctionrisk assessment of the world's seagrass species. BiologicalConservation, 144(7): 1961-1971 |
| Soros-Pottruff C L, Posluzny U. 1994. Developmentalmorphology of reproductive structures of Phyllospadix(Zosteraceae). International Journal of Plant Sciences,155(4): 405-420 |
| Soros-Pottruff C L, Posluzny U. 1995. Developmental morphologyof reproductive structures of Zostera and a reconsideration ofHeterozostera (Zosteraceae). International Journal of PlantSciences, 156(2): 143-158 |
| Tomlinson P B, Posluzny U. 2001. Generic limits in the seagrassfamily Zosteraceae. Taxon, 50(2): 429-437 |
 2015, Vol. 46
2015, Vol. 46


