中国海洋湖沼学会主办。
文章信息
- 张龙涛, 吕建建, 高保全, 刘萍, 付萍. 2015.
- ZHANG Long-Tao, LV Jian-Jian, GAO Bao-Quan, LIU Ping, FU Ping. 2015.
- 三疣梭子蟹ftz-f1 基因的克隆及相关核受体基因在蜕皮中的功能分析
- CLONING OF PORTUNUS TRITUBERCULATUS ftz-f1 cDNA AND EXPRESSION ANALYSIS OF RELATED NUCLEAR RECEPTORS DURING MOLTING CYCLE
- 海洋与湖沼, 46(6): 1390-1397
- Oceanologia et Limnologia Sinica, 46(6): 1390-1397.
- http://dx.doi.org/10.11693/hyhz20150300077
-
文章历史
- 收稿日期:2015-03-15
- 改回日期:2015-08-08
2. 上海海洋大学水产与生命学院 上海 201306;
3. 青岛海洋科学 与技术国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266235
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. Function Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266235, China
核受体(nuclear receptor)是多细胞生物中含量最丰富的几大类转录因子超家族之一,机体的生长发育、细胞分化以及许多生理、代谢过程都可归于核受体与相应配体及其它调节因子的相互作用(Boulanger et al,2011)。在哺乳类中,ftz-f1 可归于核受体第5 家族的甾类激素受体,这一家族也包括重要的甾类(类固醇)合成调控因子SF-1。ftz-f1 首先是作为转录因子激活果蝇(Drosophila)早期胚胎形成阶段分化基因fushi tarazu 的同源异性盒(homeobox)而被发现的(Kuroiwa et al,1984)。随后在其它许多物种中都发现了其同源类似物,如小鼠(Mus musculus)、家蚕(Bombyx mori)、烟草天蛾(M and uca sexta)和半滑舌鳎(Cynoglossus semilaevis)等(Chai et al,2000; Choi et al,2005; Cao et al,2012; Shafi et al,2013)。它们在DNA结合结构域和ftz-f1 box 区域都有相对的高度保守性,且在其它区域保守性较弱。蜕皮激素(20E)与核受体EcR 以及核受体家族的类视黄酸受体RXR 形成异二聚体复合物(配体-受体)复合物是引发20E 初级应答基因表达的关键环节(Riddiford et al,2000)。20E-EcR-USP 与共激活因子TAIMAN 复合物结合于启动子后,启动早期的核受体应答基因的表达,如fzt-f1 、HR3等(Crossgrove et al,2008)。通过这些早期应答的核受体基因进一步调控下游基因的表达,如天冬氨酸凋亡酶编码基因、死亡激活因子等,导致蜕皮和变态过程中的细胞自噬和凋亡,从而调控蜕皮、变态等生理过程(Liu et al,2009; Spindler et al,2009)。此外,也有研究证明ftz-f1 基因在调控表皮基因的表达以及表皮蛋白的沉积上具有不可替代的作用(Yamada et al,2000)。然而有关ftz-f1 基因在甲壳动物蜕皮中的功能研究尚无报道。
通过对本实验室三疣梭子蟹(Portunus trituberculatus)转录组数据库的筛选,获得一个在三疣梭子蟹不同蜕皮时期显著差异表达的核受体超家族基因ftz-f1 的EST 序列,克隆出该基因的全长cDNA 序列并命名为PTNHr。采用生物信息学软件分析该基因及其翻译的氨基酸序列; 借助Blast 程序对与其相近物种的ftz-f1氨基酸序列同源性进行建树分析。采用实时荧光定量技术对核受体基因ftz-f1、EcR和RXR 在蜕皮周期中的表达情况进行分析,对ftz-f1 基因在去除单侧眼柄后的表达情况进行分析,初步的阐明这些基因与蜕皮激素在蜕皮过程中的相互联系。本研究结果将有助于补充ftz-f1、EcR和RXR 基因在三疣梭子蟹中与蜕皮激素相互作用与调控关系,进一步的丰富三疣梭子蟹蜕皮过程分子调控机制的研究。
1 材料与方法1.1 实验动物实验所用三疣梭子蟹取自黄海水产研究所实验基地日照开航水产养殖有限公司,体重为(32±5)g。暂养于室内圆柱形水泥池内,水池底面积为20m2,高度1.5m,池水深保持为20—30cm,水温25°C 左右,pH 8.7,溶解氧5.5mg/L。暂养3d,每日8: 00 定时换掉1/2 的水,16: 00 投喂蛤类或者野杂鱼(投喂量为蟹重的1/10)。
1.2 总RNA 的提取及cDNA 第一链的合成采用Trizol 法分别提取三疣梭子蟹各个组织的总RNA,用1.0%的琼脂糖凝胶电泳检验总RNA 的质量和完整性。取等量的眼柄、肝胰腺和肌肉组织的总RNA混匀,严格按照SMARTTM RACE Amplification Kit 试剂盒的说明方法来合成3′和5′RACE 的cDNA 第一链。
1.3 转录组测序选取不同蜕皮时期三疣梭子蟹眼柄组织RNA。构建cDNA 文库,送交诺禾致源公司的Illumia Hiseq2000 平台进行测序。从29889 个unigene 中总共筛选出1389 个蜕皮相关的功能基因,挑选出三疣梭子蟹ftz-f1 基因序列做进一步的研究。
1.4 引物的设计根据得到的三疣梭子蟹ftz-f1 基因的EST 序列,利用Primer Premier 5.0 软件基于RACE 原理设计3′和5′末端特异性引物。根据NCBI 上已公布的三疣梭子蟹蜕皮激素受体基因(EcR JQ250795)和类视黄酸受体基因(RXR KF061043.1)设计荧光定量引物。实验中所用到的引物由上海生工生物有限公司合成(表 1)。
利用Advantage 2 PCR Kit 试剂进行末端扩增,3′用通用引物UPM和NUP 分别与相应的特异性引物NHr-F1和NHr-F2 进行巢式PCR 扩增(反应程序94°C30s,68°C 30s,72°C 3min,27 个循环); 同样的程序以及相应的特异性引物进行5′端的扩增。
将3′和5′RACE 的扩增产物经琼脂糖凝胶电泳,切胶纯化并且连接到PMD18-T载体,转化入大肠杆菌Top ten 感受态细胞中,在培养基中37°C 过夜培养后,挑取阳性菌落继续培养。进行菌落PCR 后,挑选含有目的条带的菌液送交上海桑尼公司测序。在该基因的两端设计正反向引物,进行全长cDNA 的验证。
1.6 三疣梭子蟹ftz-f1 基因的生物信息学分析利用NCBI 中的BLAST 主页程序进行主要的核苷酸序列以及氨基酸序列的比对。利用 Vector NTI11.0 进行核苷酸序列的拼接比对、冗余序列的去除、开放阅读框的预测和氨基酸的翻译。利用DNAMAN进行氨基酸序列的比对。利用SMRAT和InterProScan进行蛋白质跨膜区的分析。利用ProParam tool 进行氨基酸残基分析及蛋白质等电点、分子量等预测。利用MEGA 6.0 构建系统进化树。
1.7 蜕皮过程的分期及去除单侧眼柄实验采用解剖镜观察三疣梭子蟹游泳足表皮生长状况的方法来区分不同蜕皮时期(沈洁等,2011)。取处于蜕皮间期、蜕皮前期、蜕皮后期的蟹各6 只,分别取其眼柄、肌肉、肝胰腺、心脏、血液、鳃,每两只螃蟹的组织放入一个EP 管中,存放于液氮中保存,用以之后的提取RNA和定量分析使用。
采用烫伤法去除三疣梭子蟹的单侧眼柄。将烧红的镊子夹住蟹眼后红色膨大部分基部(此处为眼柄窦宪复合体)1—2s,破坏单侧眼柄的分泌及调控功能。用土霉素按照50—100mg/L 的浓度进行全池的消毒。暂养7d后挑取处于蜕皮间期、前期、后期的蟹,取眼柄、肌肉、肝胰腺、心脏、血液、鳃组织,存放于液氮中保存。
1.8 三疣梭子蟹ftz-f1、EcR和RXR 基因的表达定量分析用研钵将采集的组织样品在液氮中研磨,每个EP管单独研磨,然后在每1mL Trizol 试剂中加入50—100mg 的组织粉末,震荡混匀分开标记后放入-80°C 中保存。按照Trizol 法提取RNA 的步骤提取各个组织的总RNA,利用核酸定量仪和琼脂糖凝胶电泳检测RNA的质量和完整性,使用Transcriptor First Str and cDNA Synthesis Kit(ROX)试剂盒将RNA 反转录为cDNA。
采用 FastStart Universal SYBR Green Master 试剂,在 ABI 7500 Real Time PCR 仪对各个组织的基因表达情况进行测定。反应体系为10μL,包括5μL的FastStart Universal SYBR Green Master(ROX)、0.1μL 的正反向引物、3.8μL 的PCR 反应水、1μL 的cDNA。反应程序为95°C 10min,95°C 10s,60°C 34s,40 个循环; 95°C 15s,60°C 1min,95°C 15s。为了得到更为可靠的定量分析结果,采用geNorm 软件对β-actin和18S rRNA 这两个内参基因进行分析,结果显示β-actin 在蜕皮周期更为稳定。以β-actin 基因作为内参,样本和内参均设置3 个重复,每个样本为单个 EP 管中组织合成的模版。采用 2-△△Ct 方法计算各个基因的相对表达量,使用SPSS 19.0 统计软件进行单因素方差分析其显著性,P<0.05 认为差异显著。
2 结果2.1 总RNA 提取采用Trizol 法提取的各个组织的RNA,经1.0%琼脂糖凝胶电泳检测后,呈现3 条清晰的条带,说明RNA 完整性较好; 用核酸定量仪检测RNA,其OD260/OD280 均在1.9—2.0 之间,说明RNA 纯度较高,可用于后续实验。
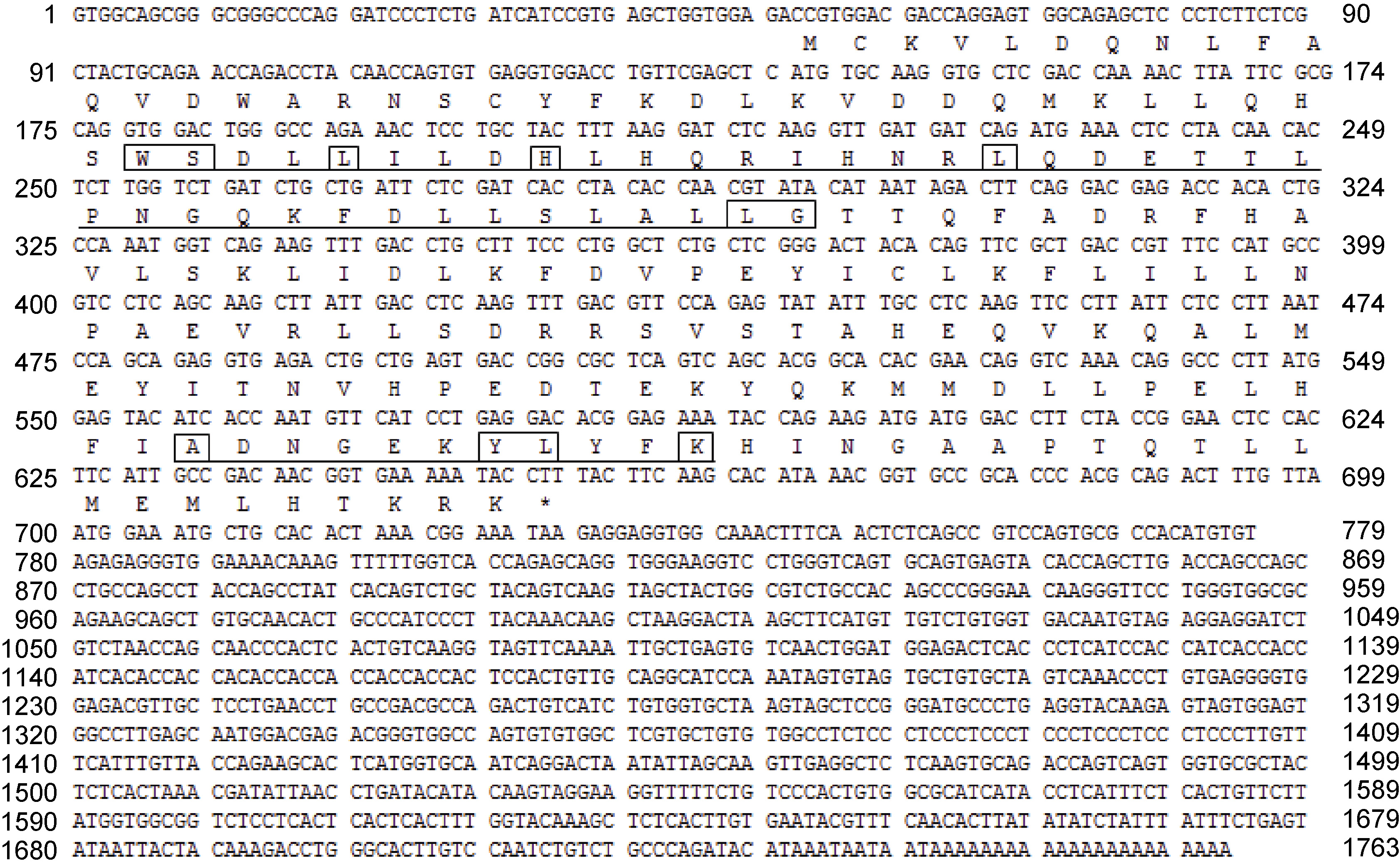
2.2 三疣梭子蟹ftz-f1 基因全长cDNA 的克隆及验证该基因的EST 序列长1165bp,用blastx 对序列进行在线比对,结果显示: 该序列与其它物种的ftz-f1 的相似度在65%以上。3′RACE 扩增结果得到大小为666bp 的cDNA 片段,5′RACE 扩增结果得到大小为539bp 的cDNA 片段。将这两个片段与已知EST序列进行拼接,去除冗余序列得到三疣梭子蟹ftz-f1基因的全长cDNA 序列,命名为PTNHr。对该基因全长cDNA 进行测序验证,验证出覆盖开放阅读框的1585bp 序列准确、可靠。该cDNA 序列全长为1763bp(GenBank 登录号KP299258),其中包括588bp 的开放阅读框(ORF),141bp 的5’端非编码区(UTR),1034bp的3’端非编码区(UTR)(图 1)。
|
|
图 1 三疣梭子蟹ftz-f1 基因cDNA 全长及其编码的氨基酸序列
Fig. 1 ftz-f1 nucleotide sequence and deduced amino acid sequence of P. trituberculatus ATG: 起始密码子; *: 终止密码子; 下划线: ftz-f1 基因DNA 结合域和配体结合域; 方框: 配体结合位点 |
DNAstar 软件分析表明,三疣梭子蟹ftz-f1 基因编码一个由195 个氨基酸组成的蛋白质,分子量为22.8kDa,理论等电点为6.35。该蛋白具有核受体家族标志的DNA 结合域(DBD)和配体结合域(LBD)。ProtParam tool 软件分析表明,ftz-f1 蛋白带有负电的氨基酸残基为26 个(Asp和Glu),带有正电的氨基酸残基为23 个(Arg和Lys),不稳定系数为27.7,亲水性平均数为-0.291,属于稳定蛋白。使用SMRAT和InterProScan 在线软件分析,ftz-f1 基因翻译的蛋白质结构中无跨膜结构域。
2.4 三疣梭子蟹ftz-f1 基因的同源性分析BLAST 同源性分析三疣梭子蟹ftz-f1 基因的氨基酸序列,发现与刀额新对虾(Metapenaeus ensis)同源性达到75.4%,与切叶蚁(Acromyrmex echinatior)、德国小蠊(Blattella germanica)、黑腹果蝇(Drosophila melanogaster)、烟草天蛾(M and uca sexta)、赤拟谷盗(Tribolium castaneum)的同源性分别为66.0%、67.5%、61.9%、61.9%和66.0%(图 2)。

|
| 图 2 三疣梭子蟹ftz-f1 氨基酸序列与其它物种的ftz-f1 氨基酸序列比对 Fig. 2 The amino acid sequence of P. trituberculatus ftz-f1 alignment with other species |
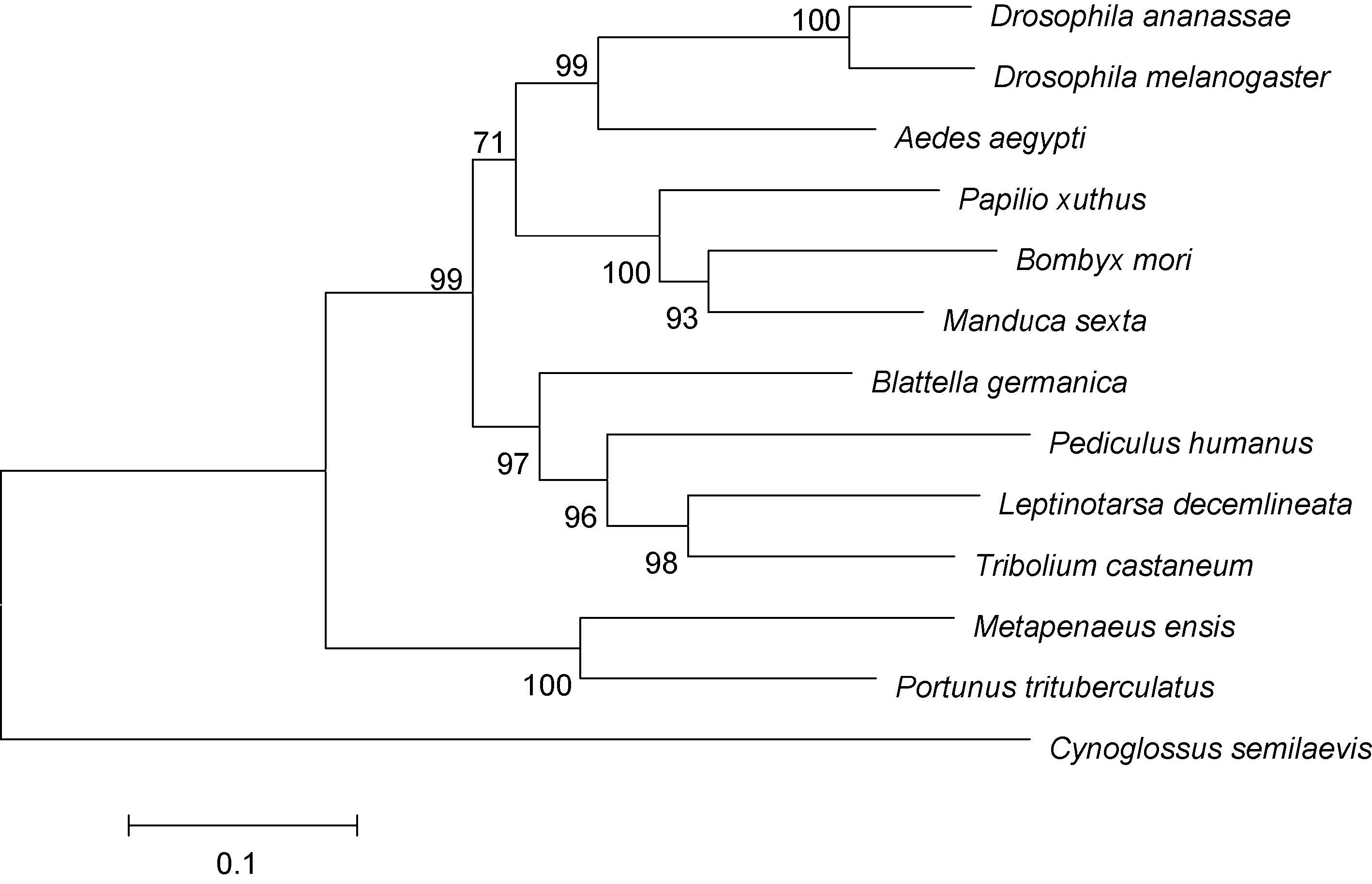
利用MEGA6.0 软件进行系统进化分析,构建系统进化树(图 3)。结果显示13 个物种中,三疣梭子蟹与刀额新对虾紧密聚为一支,之后与赤拟谷盗、德国小蠊亲缘关系较近。在昆虫中,黑腹果蝇与嗜凤梨果蝇紧密聚为一支,家蚕与烟草天蛾等聚为一支。
|
|
图 3 MEGA 6.0 软件采用邻接法构建的三疣梭子蟹与其它物种的ftz-f1 氨基酸的系统进化树
Fig. 3 NJ phylogenetic tree of amino acid sequence of P. trituberculatus ftz-f1 and other species made by MEGA 6.0 注: 分叉处数值表示1000 次重复抽样所得到的置信度,只显示置信度>80%的数值; 标尺长度代表每个位点发生0.05 次置换。各种登录号: 嗜凤梨果蝇(XM_001958169.1)、黑腹果蝇(M63711.1)、埃及伊蚊(AF274870.1)、柑橘凤蝶(AK404795.1)、家蚕(NM001044063.2)、烟草天蛾(AF288089.1)、德国小蠊(FM163377.1)、人虱(XM_002430334.1)、马铃薯甲虫(KM091936.1)、赤拟谷盗(XM_008193152.1)、刀额新对虾(AF159132.1)。 GenBank accession number of different species: Drosophila ananassae(XM_001958169.1),Drosophila melanogaster(M63711.1),Aedes aegypti(AF274870.1),Papilio xuthus(AK404795.1),Bombyx mori(NM 001044063.2),Manduca sexta(AF288089.1),Blattella germanica(FM163377.1),Pediculus humanus(XM_002430334.1),Leptinotarsa decemlineata(KM091936.1),Tribolium castaneum(XM_008193152.1),Metapenaeus ensis(AF159132.1) |
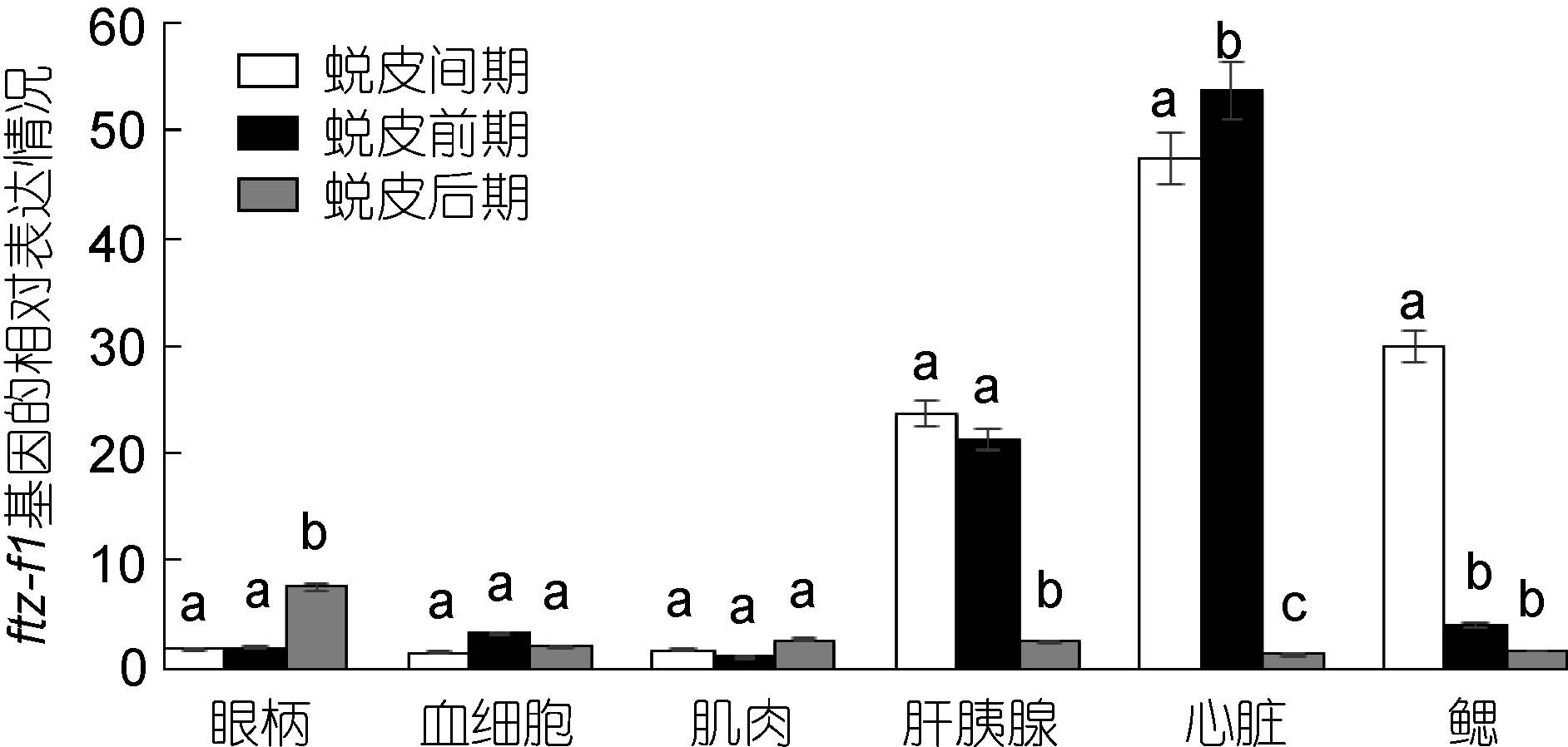
采用实时荧光定量PCR 方法,分析三疣梭子蟹各个组织中ftz-f1 基因在不同的蜕皮时期的表达特征。结果表明,眼柄中ftz-f1 基因在蜕皮后期的表达量明显高于蜕皮间期和蜕皮前期; 但是肝胰腺、心脏和鳃中ftz-f1 基因在蜕皮后期却明显低于蜕皮间期和蜕皮前期; 血细胞和肌肉中该基因的表达量在蜕皮各个时期的变化不明显(图 4)。
|
|
图 4 三疣梭子蟹ftz-f1 基因在不同蜕皮时期各个组织中的表达分布情况
Fig. 4 Distribution of ftz-f1 gene expression in different tissues in different molt stages 同一组织内,不同字母之间为差异显著(P<0.05),相同字母之间为差异不显著(P>0.05)。不同组织之间不具有可比性。下同 |
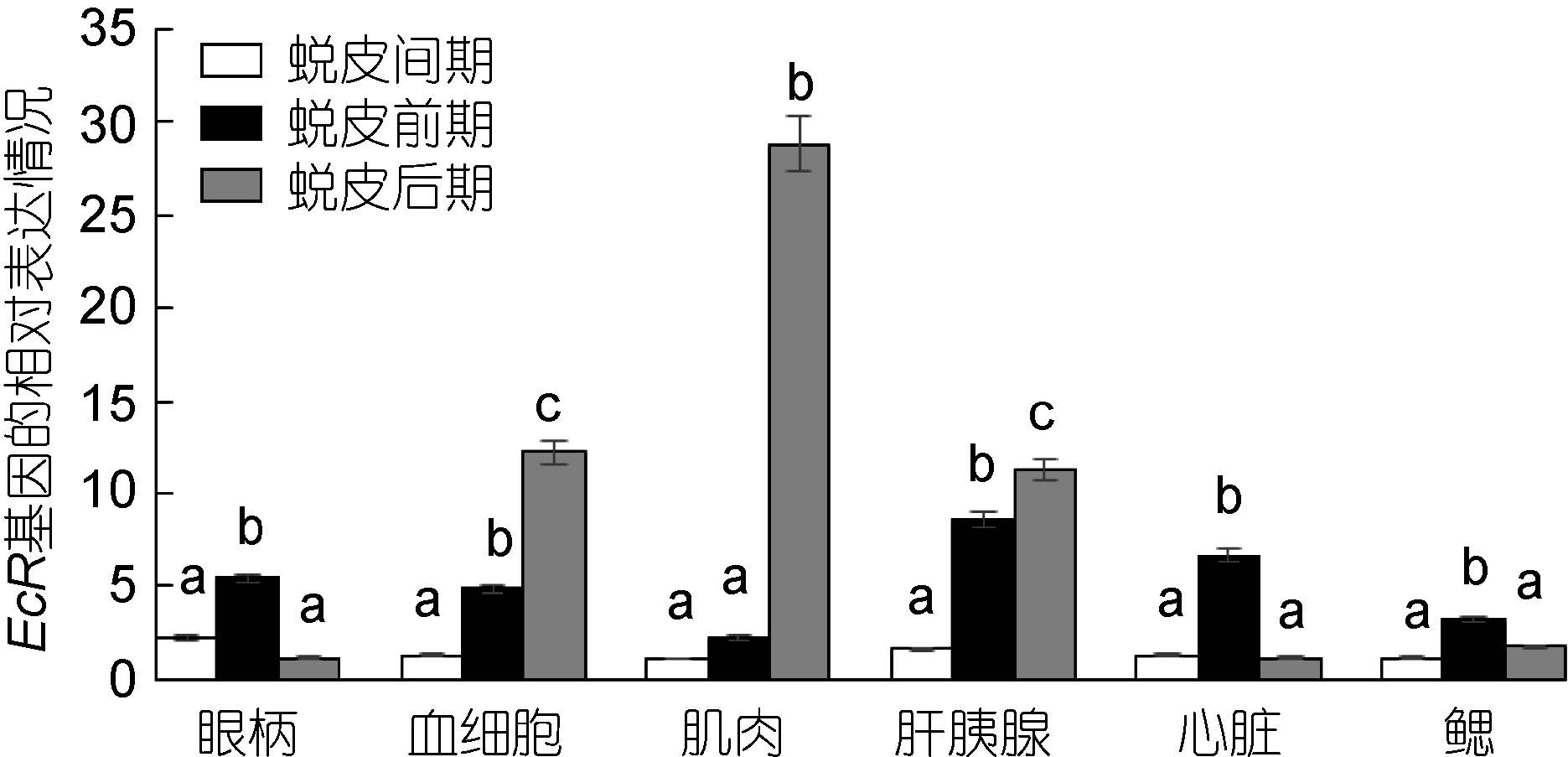
三疣梭子蟹各个组织中EcR 基因在不同的蜕皮时期的表达情况: 在眼柄、心脏和鳃中,三疣梭子蟹EcR 基因的表达量均为蜕皮前期高于蜕皮间期和蜕皮后期; 在血细胞、肌肉和肝胰腺中,EcR 基因的表达量为蜕皮后期高于蜕皮间期和蜕皮前期(图 5)。
|
| 图 5 三疣梭子蟹EcR 基因在不同蜕皮时期各个组织中的表达分布情况 Fig. 5 Distribution of EcR gene expression in different tissues in different molt stages |
三疣梭子蟹各个组织中RXR 基因在不同的蜕皮时期的表达情况: 眼柄中RXR 基因在蜕皮后期表达量低于蜕皮间期和蜕皮前期; 血细胞、肝胰腺、心脏和鳃中RXR 基因在蜕皮后期表达量明显高于蜕皮间期和蜕皮前期; 肌肉中RXR 基因表达量在蜕皮各个时期中变化不明显(图 6)。
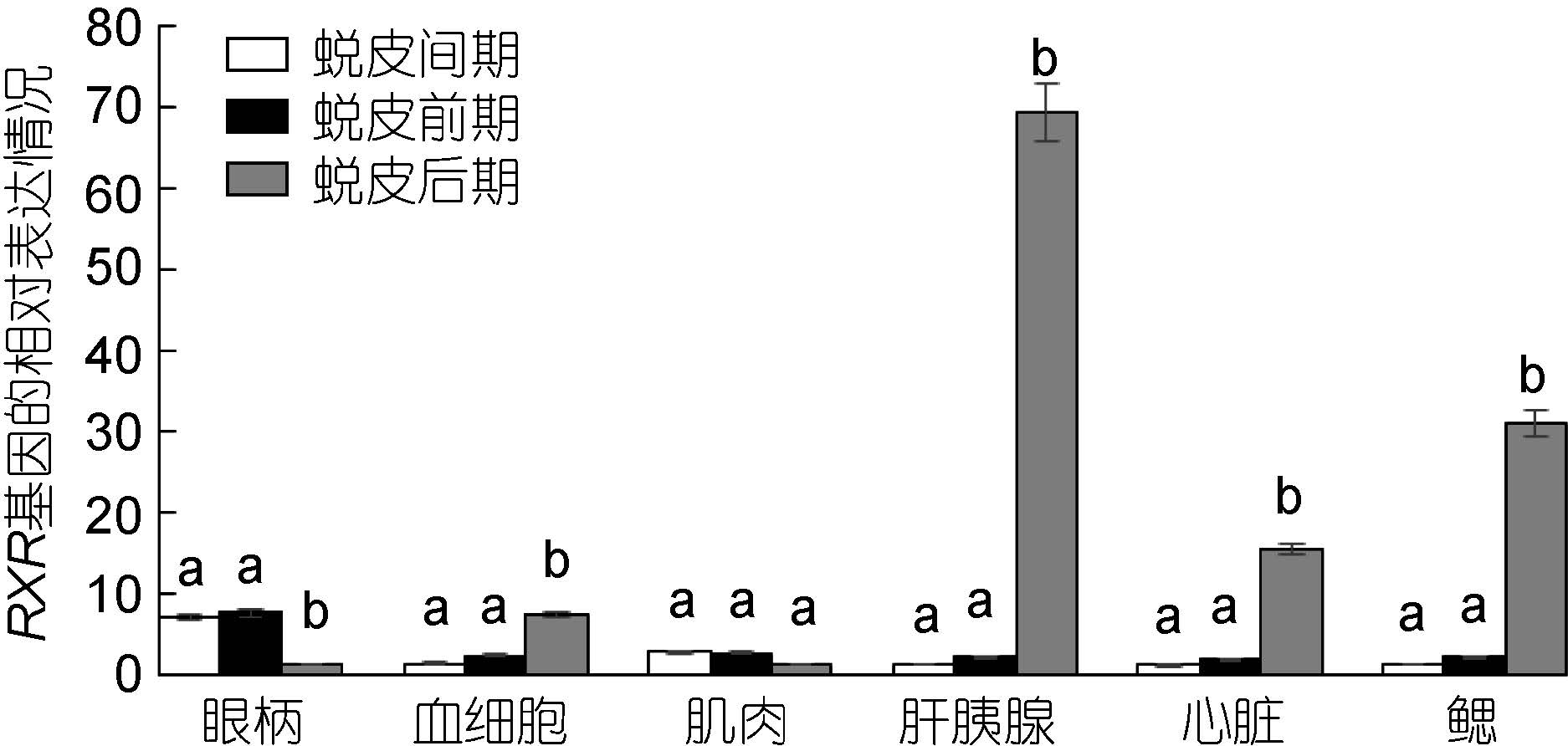
|
| 图 6 三疣梭子蟹RXR 基因在不同蜕皮时期各个组织中的表达分布情况 Fig. 6 Distribution of RXR gene expression in different tissues in different molt stages |
对去除单侧眼柄的三疣梭子蟹在不同蜕皮时期,与相应的正常对照组进行实时荧光定量。结果显示: 在蜕皮前期与蜕皮间期,去除单侧眼柄后ftz-f1 基因的表达量在整体上明显低于相应的正常对照组,并且表达差异较大(图 7、图 8)。但是在蜕皮后期,去除单侧眼柄后ftz-f1 基因的表达量在肝胰腺、心脏和鳃中的表达量却是高于正常对照组(图 9)。
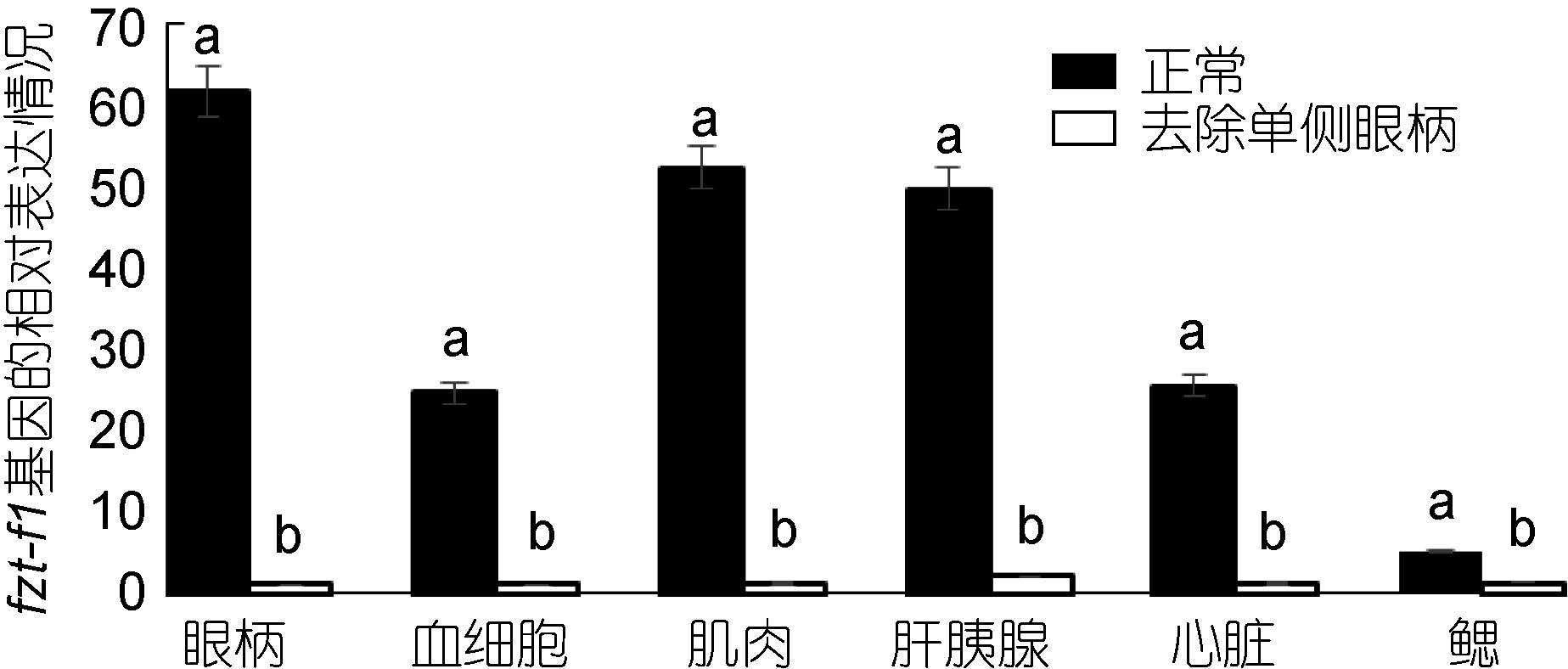
|
| 图 7 去除单侧眼柄后,ftz-f1 基因在三疣梭子蟹蜕皮前期与正常对照各个组织中的相对表达情况 Fig. 7 After single eye- ablation,distribution of ftz-f1 gene expression in different tissues of pre-molt stage compare to those in normal condition |
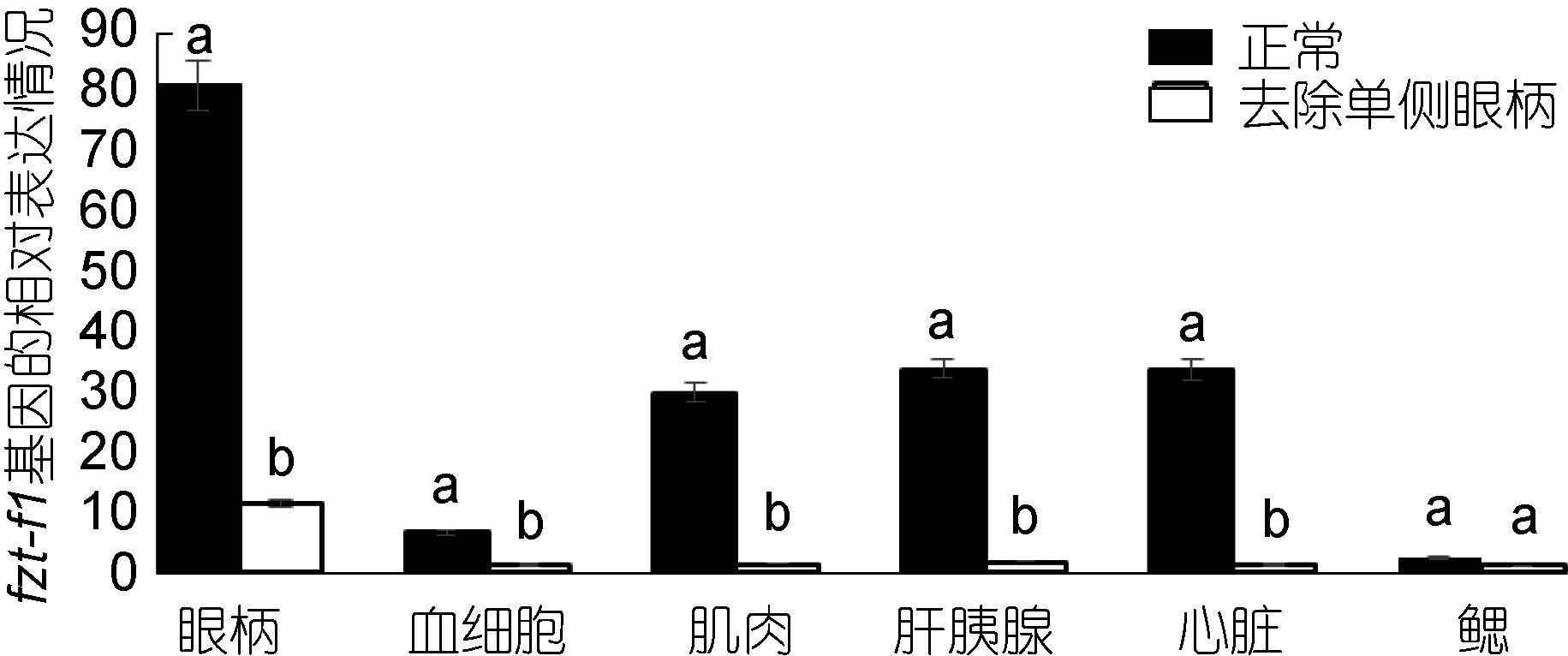
|
| 图 8 去除单侧眼柄后,ftz-f1 基因在三疣梭子蟹蜕皮间期与正常对照各个组织中的相对表达情况 Fig. 8 After single eye- ablation,distribution of ftz-f1 gene expression in different tissues in inter-molt stage compare to that in normal condition |
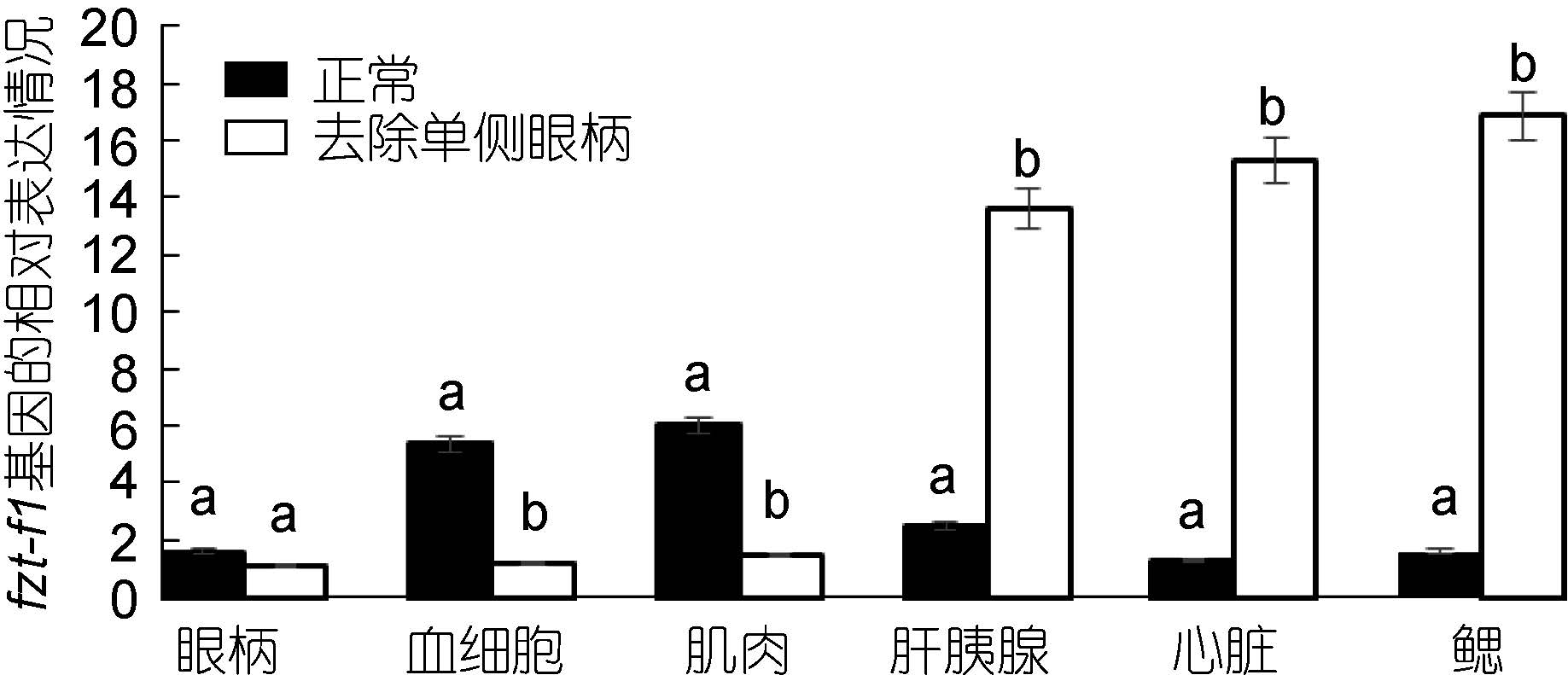
|
| 图 9 去除单侧眼柄后,ftz-f1 基因在三疣梭子蟹蜕皮后期与正常对照各个组织中的相对表达情况 Fig. 9 After single eye- ablation,distribution of ftz-f1 gene expression in different tissues of post-molt stage compare to normal condition |
核受体是配体依赖性转录因子超家族,能够直接与DNA 结合,调节下游靶基因的表达,与机体的代谢、生殖和发育等多种生理过程密切相关(Mckenna et al,2002)。fzt-f1 基因属于核受体第5 家族A 组,该组内的核受体基因是重要的甾类激素合成调控因子(Lu et al,2001)。fzt-f1 基因在鱼类中研究较为深入,但是在甲壳类中却很少有报道(Liu et al,1997;Masuda et al,1998; Lin et al,2000)。本实验克隆得到三疣梭子蟹fzt-f1 基因,该基因具有核受体基因特有的DNA 结合结构域(DBD)和配体结合区(LBD)。该基因序列与刀额新对虾克隆出的fzt-f1 蛋白同源性达到75.4%,系统进化分析中也与刀额新对虾聚为一支。
蜕皮激素对于甲壳类的蜕皮过程起着至关重要的作用。已有的研究证明,蜕皮激素在血液中是以20-羟蜕皮酮(20E)形式存在。20E 在血液内的浓度在蜕皮前期逐渐升高,临近蜕皮时,形成一个峰值,然后浓度再迅速下降(Wang et al,2000; Watson et al,2001)。整个调控过程是通过20E-EcR-RXR 配体-受体复合物引发的应答基因级联放大反应完成,20E 与蜕皮激素受体EcR和类视黄酸受体(RXR)异二聚体复合物在细胞核内形成转录复合体,进而引发20E 初级应答基因(如fzt-f1 、HR3等)表达(Durica et al,1999;LeBlanc,2007)。初级反应基因编码的转录因子诱导表达的20E 次级应答基因级联放大20E 信号,进而调控下游基因表达。
实时定量分析ftz-f1 基因在不同蜕皮时期各个组织中的相对表达情况,结果表明: 眼柄中ftz-f1 基因的表达量为蜕皮后期高于蜕皮前期和蜕皮间期,而在肝胰腺、心脏和鳃组织中ftz-f1 基因的表达量为蜕皮后期低于蜕皮前期和蜕皮间期。推测在眼柄中,该基因与20E 呈负调控关系,而在肝胰腺、心脏和鳃中该基因与20E 呈正调控关系。由于眼柄中X 器-窦腺复合体合成蜕皮抑制激素(MIH)(Nakatsuji et al,2004),因此该基因在眼柄中的表达可能与MIH 更为相关。对核受体基因EcR 在蜕皮周期中的定量分析结果显示: 眼柄、心脏和鳃组织中,EcR 基因在蜕皮前期表达量高于其它两蜕皮时期,表达模式与20E 在蜕皮时期的浓度变化相似,说明了该基因与20E 的协同调节作用,这与日本囊对虾(Marsupenaeus japonicus)的研究结果一致(Asazuma et al,2007)。在血细胞、肝胰腺和肌肉中,EcR 基因的表达模式为蜕皮后期高于蜕皮前期高于蜕皮间期,出现了与20E 浓度不协调的现象。也有学者发现,在蓝蟹(Callinectes sapidus)体内EcR 基因的表达量与20E 在血淋巴中的浓度并不协同,关于这一现象的解释还有待于进一步的研究(Techa et al,2013)。核受体基因RXR 在蜕皮周期的定量结果显示: RXR 与ftz-f1 基因在肝胰腺、心脏和鳃组织中的表达模式上呈现出完全相反的趋势,这预示着RXR和fzt-f1 这两个基因之间可能存在典型的抑制调控作用。而RXR 与EcR 基因在整体上呈现相似的表达模式,这与中国对虾(Fenneropenaeus chinensis)和中华绒螯蟹(Eriocheir sinensis)中的研究相一致(Priya et al,2009; 王瑶等,2013)。由于RXR 蛋白和EcR 蛋白是作为20E 异二聚体复合物的组成部分,因此这两个基因在三疣梭子蟹的蜕皮功能上也更趋向于协同调节作用。
甲壳类蜕皮激素是由Y 器官合成与分泌,而Y器官则受MIH 的调控(罗荣生等,1990; Gong et al,2015)。眼柄中X 器-窦腺复合体是MIH 制造与分泌的器官,去除单侧眼柄将会造成20E 浓度的上升(Devaraj et al,2006; Wang et al,2013)。去除单侧眼柄后对fzt-f1 基因在各个组织中的表达量进行分析,发现在去除单侧眼柄后该基因的表达量在各个蜕皮时期组织中出现明显下降; 说明20E 浓度的升高对ftz-f1 基因的表达起到了明显的抑制作用。由此可以推测出,ftz-f1 基因在蜕皮过程中具有重要的作用,与20E 具有紧密的联系,且更可能为抑制调控关系。
4 结论本研究成功克隆出了三疣梭子蟹ftz-f1 基因全长cDNA 序列,并进行了生物信息学的分析。对三疣梭子蟹ftz-f1 基因以及相关的核受体基因EcR和RXR,在蜕皮周期各个组织中的表达情况进行了分析并预测之间可能存在的联系。本实验证明了ftz-f1 基因在蜕皮过程中的调控作用,并对与三个重要的蜕皮功能相关核受体基因之间的联系进行了初步的探讨。有关ftz-f1 基因以及核受体基因在蜕皮中的功能,还需要更多的研究。关于核受体基因之间的相互作用与联系也需要更为深入的生物学技术来进行研究。
| 王瑶, 杨志刚, 郭子好等. 2013. 中华绒螯蟹RXR 基因全长cDNA 克隆及表达分析. 水产学报, 37(12): 1761- 1769 |
| 沈洁, 朱冬发, 胡则辉等. 2011. 三疣梭子蟹蜕皮周期的分期. 水产学报, 35(10): 1481-1487 |
| 罗荣生, 王幽兰, 曹梅讯等. 1990. 中华绒螯蟹血淋巴20-羟蜕皮酮诱发蜕皮和卵巢发育的作用. 动物学报, 36(2):157-164 |
| Asazuma H, Nagata S, Kono M et al. 2007. Molecular cloningand expression analysis of ecdysone receptor and retinoid Xreceptor from the kuruma prawn, Marsupenaeus japonicus.Comp Biochem Physiol B Biochem Mol Biol, 148(2):139-150 |
| Boulanger A, Clouet-Redt C, Farge M et al. 2011. Ftz-f1 andHr39 opposing roles on EcR expression during Drosophilamushroom body neuron remodeling. Nat Neurosci, 14(1):37-44 |
| Cao J L, Chen J J, Jiang Z L et al. 2012. Molecular cloning andexpression analysis of FTZ-F1 in the GIFT tilapia,Oreochromis niloticus. Zool Res, 33(E3-4): E40-E46 |
| Chai C, Chan W K. 2000. Developmental expression of a novelFtz-F1 homologue, ff1b (NR5A4), in the zebrafish Daniorerio. Mech Dev, 91(1-2): 421-426 |
| Gong J, Ye H H, Xie Y J et al. 2015. Ecdysone receptor in themud crab Scylla paramamosain: a possible role in promotingovarian development. J Endocrinol, 224(3): 273-287 |
| Choi C Y, Habibi H R. 2005. Molecular cloning and tissuedistribution of SF-1-related orphan receptors during sexualmaturation in female goldfish. Biotechnol Lett, 27(17):1283-1290 |
| Crossgrove K, Maina C V, Robinson-Rechavic M et al. 2008.Orthologues of the Drosophila melanogaster E75 moltingcontrol gene in the filarial parasites Brugia malayi andDirofilaria immitis. Mol Biochem Parasitol, 157(1): 92-97 |
| Durica D S, Chung A C K, Hopkings P M et al. 1999.Characterization of EcR and RXR gene homologs andreceptor expression during the molt cycle in the crab, Ucapugilator. Amer Zool, 39(4): 758-773 |
| Devaraj H, Natarajan A. 2006. Molecular mechanisms regulatingmolting in a crustacean. FEBS J, 273(4): 839-846 |
| LeBlanc G A. 2007. Crustacean endocrine toxicology: a review.Ecotoxicology, 16(1): 61-81 |
| Kuroiwa A, Hafen E, Gehring W J. 1984. Cloning andtranscriptional analysis of the segmentation gene fushitarazu of Drosophila. Cell, 37(3): 825-831 |
| Wang C J, Zhu D F, Qi Y Z et al. 2013. Molt-inhibiting hormonelevels and ecdysteroid titer during a molt cycle of Portunustrituberculatus. Acta Hydrobiol Sin, 37(1): 22-28 |
| Lin W W, Wang H W, Sum C et al. 2000. Zebrafish ftz-f1 genehas two promoters, is alternatively spliced, and is expressedin digestive organs. Biochem J, 348(2): 439-446 |
| Liu D, Le Drean Y, Ekker M et al. 1997. Teleost FTZ-F1homolog and its splicing variant determine the expression ofthe salmon gonadotropin IIbeta subunit gene. MolEndocrinol, 11(7): 877-890 |
| Liu Y, Sheng Z T, Liu H H et al. 2009. Juvenile hormonecounteracts the bHLH-PAS transcription factors MET andGCE to prevent caspase-dependent programmed cell deathin Drosophila. Development, 136(12): 2015-2025 |
| Lu T T, Repa J J, Mangelsdorf D J. 2001. Orphan nuclearreceptors as eLiXiRs and FiXeRs of sterol metabolism. JBiol Chem, 276(41): 37735-37738 |
| Ito M, Masuda A, Yumoto K et al. 1998. cDNA cloning of a newmember of the FTZ-F1 subfamily from a rainbow trout.Biochim Biophys Acta. 1395(3): 271-274 |
| McKenna N J, O'Malley B W. 2002. Combinatorial control ofgene expression by nuclear receptors and coregulators. Cell,108(4): 465-474 |
| Wang W L, Spaziani E, Huang H Z et al. 2000. Ecdysteroidhormones and metabolites of the stone crab, Menippemercenaria. J Exp Zool, 286(7): 725-735 |
| Nakatsuji T, Sonobe H. 2004. Regulation of ecdysteroid secretionfrom the Y-organ by molt-inhibiting hormone in theAmerican crayfish, Procambarus clarkii. Gen CompEndocrinol, 135(3): 358-364 |
| Priya T A J, Li F H, Zhang J Q et al. 2009. Molecularcharacterization and effect of RNA interference of retinoid Xreceptor (RXR) on E75 and chitinase gene expression inChinese shrimp Fenneropenaeus chinensis. Comp BiochemPhysiol B Biochem Mol Biol, 153(1): 121-129 |
| Riddiford L M, Cherbas P, Truman J W. 2000. Ecdysonereceptors and their biological actions. Vitam Horm, 60(1):1-73 |
| Shafi M, Wang Y N, Zhou X S et al. 2013. Isolation andexpression analysis of FTZ-F1 encoding gene of black rockfish (Sebastes schlegelii). J Ocean Univ China, 12(1):183-189 |
| Spindler K D, Hönl C, Tremmel C H et al. 2009. Ecdysteroidhormone action. Cell Mol Life Sci, 66(24): 3837-3850 |
| Techa S, Chung J S. 2013. Ecdysone and retinoid-X receptors ofthe blue crab, Callinectes sapidus: Cloning and theirexpression patterns in eyestalks and Y-organs during themolt cycle. Gene, 527(1): 139-153 |
| Watson R D, Lee K J, Qiu S H et al. 2001. Molecular cloning,expression, and tissue distribution of crustacean moltinhibitinghormone. Am Zool, 39(5): 407-417 |
| Yamada M, Murata T, Hirose S et al. 2000. Temporally restrictedexpression of transcription factor betaFTZ-F1: significancefor embryogenesis, molting and metamorphosis in Drosophilamelanogaster. Development, 127(23): 5083-5092 |
 2015, Vol. 46
2015, Vol. 46



