中国海洋湖沼学会主办。
文章信息
- 赵吉臣, 王刚, 邓中宁, 陈兆明, 孙成波. 2015.
- ZHAO Ji-Chen, WANG Gang, DENG Zhong-Ning, CHEN Zhao-Ming, SUN Cheng-Bo. 2015.
- 不同条件下哈维氏弧菌(Vibrio harvey)对墨吉明对虾(Fenneropenaeus merguiensis)致病性研究
- PATHOGENICITY OF VIBRIO HARVEY TO FENNEROPENAEUS MERGUIENSIS UNDER DIFFERENT CONDITIONS
- 海洋与湖沼, 46(6): 1413-1419
- Oceanologia et Limnologia Sinica, 46(6): 1413-1419.
- http://dx.doi.org/10.11693/hyhz20151000266
-
文章历史
- 收稿日期:2015-10-19
- 改回日期:2015-10-27
2. 广东高校海产无脊椎动物养殖工程技术研究中心 湛江 524025
2. Tropical Invertebrates Aquaculture Research Center of Guangdong Colleges and Universities, Zhanjiang 524025, China
哈维氏弧菌(Vibrio harvey)又称哈氏弧菌(张晓华等,2007),是一种具有发光特性的革兰氏阴性细菌,是正常海水微生物群体(Ramesh et al,1989; 房海等,2009),也是海水中一种常见的致病菌,部分有毒菌株对海产品种具有一定的致病性(Ruby et al,1979),主要引起对虾及鱼类和贝类的感染发病。在泰国、印度、澳大利亚、厄瓜多尔、委内瑞拉及中国,哈维氏弧菌是养殖对虾的主要病原菌(Ruby et al,1979;Karunasagar et al,1994; Robertson et al,1998;Vandenberghe et al,1998); 同时其可以引起澳大利亚、印度以及中国台湾等地的对虾育苗场斑节对虾幼体和墨吉明对虾幼体大量死亡(Pizzutto et al,1995; Liu et al,1996)。在中国,哈维氏弧菌可引起中国明对虾(Fenneropenaeus chinensis)及凡纳滨对虾(Litopenaeus vannamei)幼体、长毛明对虾(P. penicillatus)及日本囊对虾(P. japonicus)成虾发病(孔凡骏等,1998; 李军等,1998),严重危害水产养殖业发展,因此对其免疫防治的研究具有重要意义。
墨吉明对虾(Fenneropenaeus merguiensis)属于十足目(Decapoda)、枝鳃亚目(Dendrobranchiata)、对虾科(Penaeidae)、明对虾属(Fenneropenaeus),在中国东南沿海以及亚洲和澳大利亚的热带和亚热带海域都有分布; 因其个体较大、生长迅速和滋味鲜美等特点,我国很早就对其进行人工养殖(杨世平等,2014),其曾在我国南方对虾养殖中占有重要地位。近年来,由于凡纳滨对虾进口亲虾价格升高而养殖成功率降低,养殖效益严重下降。因此,广东湛江对虾种苗协会建议开展墨吉明对虾的人工繁殖和养殖技术研究,以期能替代部分凡纳滨对虾的养殖,优化我国对虾养殖结构(杨世平等,2014)。已有研究显示,哈维氏弧菌是一种条件致病菌(谢珍玉等,2007),在养殖环境恶劣、对虾体质虚弱时,会大量繁殖,从而引起对虾弧菌病的暴发和迅速蔓延。因此,本研究以墨吉明对虾为研究对象,探讨不同数量哈维氏弧菌以及不同温度、盐度、pH、硝酸氮浓度、亚硝酸氮浓度和氨氮浓度下哈维氏弧菌对墨吉明对虾的致病性,以期为墨吉对虾弧菌病防控提供理论依据。
1 材料与方法1.1 实验材料 1.1.1 实验用虾墨吉明对虾取自广东海洋大学东海岛海洋生物研究基地,是广东省湛江地区外海天然捕捞的野生墨吉明对虾进行人工繁育培育出来的子一代对虾,体长(10.0±0.5)cm。实验前随机抽取10 尾对虾对哈维氏弧菌进行检测,结果均为阴性。对虾取回后暂养于温度(26±1)°C、盐度(26±1)的自然海水中1 周。期间每天投喂对虾人工配合饲料2 次,吸污并换水1/4。沙滤海水于实验前经次氯酸钠消毒并曝气1 周,经测氯试纸检测无余氯残留,经TCBS 平板检测实验用水无菌落生长。实验于2014 年8 月在广东高校热带海产无脊椎动物养殖工程技术研究中心进行。
1.1.2 菌株及菌悬液的制备哈维氏弧菌由广东海洋大学水产品加工与安全重点实验室赠予。将哈维氏弧菌涂布于TCBS 琼脂培养基上,过夜培养,挑取单菌落,接种于盐度为10 的营养肉汤液体培养基中,置于恒温培养箱中(30°C,120 r/min)培养16 h 后,分装于50 mL 离心管中,4°C 4000 r/min 离心15 min,移去上清,沉淀用PBS(磷酸缓冲盐溶液,phosphate buffer saline)重悬,既得感染对虾菌悬液。同时进行涂平板计数。
1.1.3 统计分析运用Excel 软件对实验记录数据进行处理,作出时间与累计死亡率关系的相关折线图。采用SPSS 19.0 统计软件进行单因素方差分析检验,0.01<P<0.05 表示差异显著,P<0.01 表示差异极显著。
1.2 实验方法 1.2.1 感染方式实验采用人工注射感染方式,在墨吉明对虾第2 腹节与第3 腹节之间往心脏方向注射40 μL 不同浓度的哈维氏弧菌病原悬浮液(数量因浓度而异)。
1.2.2 实验方法(1)不同数量下哈维氏弧菌对墨吉明对虾的致病性。将对虾培养在温度(24±1)°C、盐度(18±1)的海水中,实验组设置4 个哈维氏弧菌数量组,即3.16×108、3.16×107、3.16×106、3.16×105 CFU,通过肌肉注射的方式感染对虾,注射量为40 μL,对照组注射40 μL PBS 缓冲液,各组均设置3 个平行实验组,每组10 尾墨吉明对虾,置于盛有20 L 海水的白桶中。实验开始第0、6、12、24、48、72、96 h 取样和计数。
(2)不同温度、盐度、pH、硝酸氮浓度、亚硝酸氮浓度和氨氮浓度下哈维氏弧菌对墨吉明对虾的致病性。温度实验,设置20°C、26°C和32°C 三个温度条件下哈维氏弧菌感染组和对照组,各组均设三个平行,盐度为(22±1)。实验组注射40 μL 哈维氏弧菌即3.16×105 CFU,对照组注射40 μL PBS 缓冲液。采用加热棒加温方法和冰袋降温方法控制温度,及时观察,确保温差控制在0.5°C 以内。各组暂养24 h 后进行攻毒实验。盐度实验,设置10、20和30 三个盐度梯度,饲养温度为(24±1)°C,实验方法同温度实验。pH 实验设置7.0、8.0和9.0 三个pH 梯度,利用Na2CO3、NaHCO3、HCl 调节pH。不同硝酸氮浓度下攻毒实验,设置10.0、20.0和30.0 mg/L 三个浓度梯度,采用NaNO3 溶解法调节水体中的硝酸氮浓度。不同亚硝酸氮浓度下攻毒实验,设置1.0、5.0和10.0 mg/L 三个浓度梯度,采用NaNO2 溶解法调节水体中的亚硝酸氮浓度。不同氨氮浓度下攻毒实验,设置0.5、1.0和1.5 mg/L 三个浓度梯度,采用NHCl4 溶解法调节水体中的氨氮浓度。pH、硝酸氮、亚硝酸氮、氨氮实验,设置温度为(24±1)°C,盐度为(22±1),每天换水100%,注射哈维氏弧菌数量同温度实验,计数时间同数量实验。
2 实验结果2.1 不同数量下哈维氏弧菌对墨吉明对虾死亡情况的影响如图 1 所示。感染6 h 后,各实验组大部分墨吉明对虾活动减弱、趴伏于桶底、厌食; 且3.16×105、3.16×107和3.16×108 CFU 实验组首先出现死亡对虾;濒死对虾体色呈白色、附肢微红、壳变软,3.16×106 CFU实验组对虾出现死亡的时间在12 h 后。感染24 h 后,3.16×108 CFU 实验组对虾几乎全部死亡; 而其余各实验组对虾死亡相继出现高峰,随后每天均有对虾死亡。感染96 h 后实验结束,此时对照组和各实验组墨吉明对虾累计死亡率分别为0、36.67%、50.00%、60.00%和96.67%。其中,3.16×105 CFU 实验组、3.16×106 CFU 实验组与3.16×108 CFU 实验组差异显著(P<0.05)。
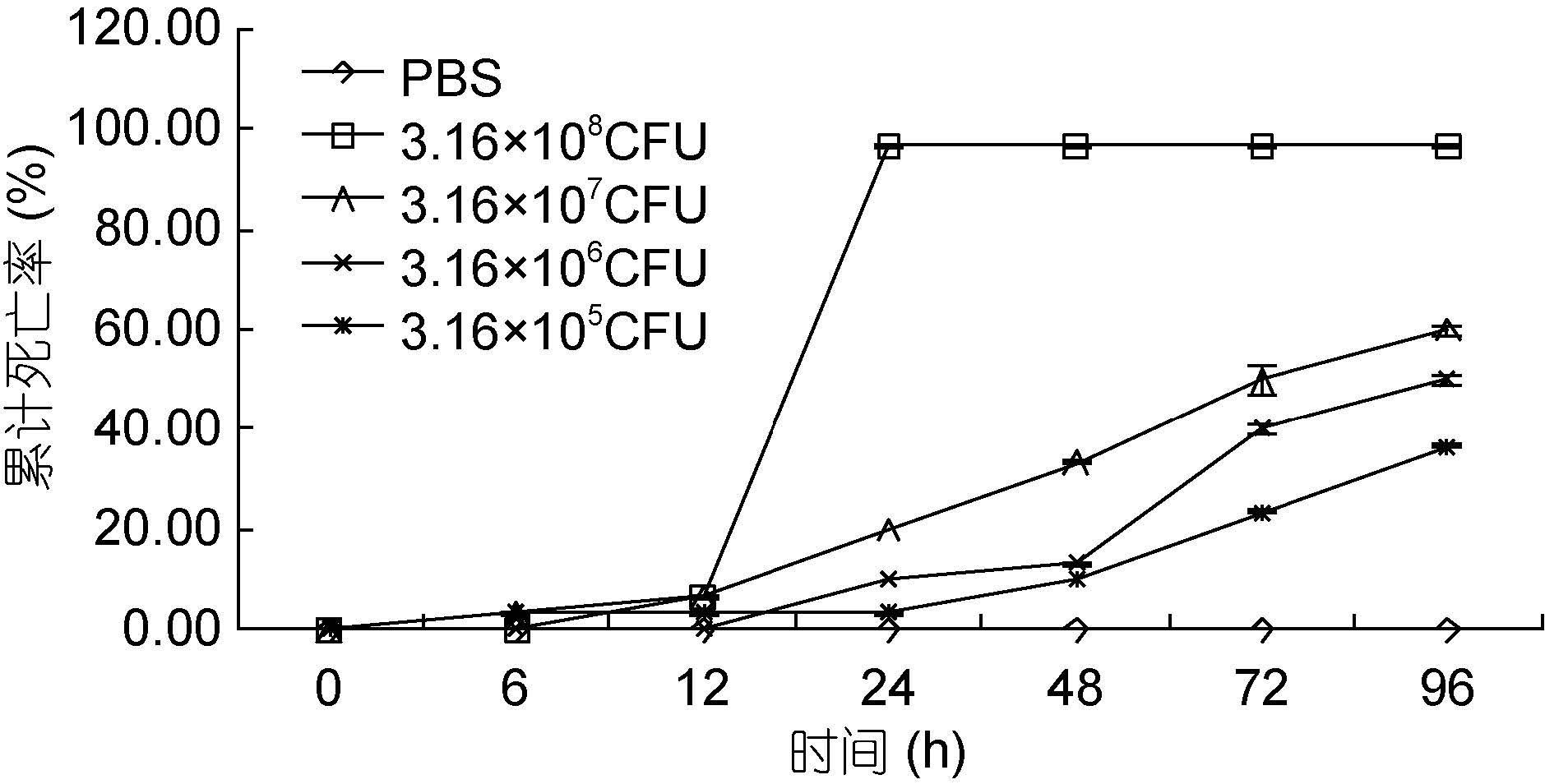
|
| 图 1 不同数量下哈维氏弧菌对墨吉明对虾死亡情况的影响 Fig. 1 The pathogenicity of V. harvey to F. merguiensis under different quantity |
如图 2 所示。弧菌感染6 h 后,各实验组对虾相继出现死亡。在6—24 h 之间,20°C 实验组和26°C 实验组对虾基本不再出现死亡对虾; 而32°C 实验组对虾死亡速度则突然增大,死亡率逐渐超过20°C 实验组和26°C 实验组。在24—96 h 之间,在同一时间点,随着温度的升高,实验组对虾的累计死亡率明显增加。96 h 时,各实验组的累计死亡率分别为13.33%、20.00%、36.67%。其中20°C 实验组与26°C 实验组对虾累计死亡率无显著差异(P>0.05),但显著低于32°C 实验组(P<0.05)。
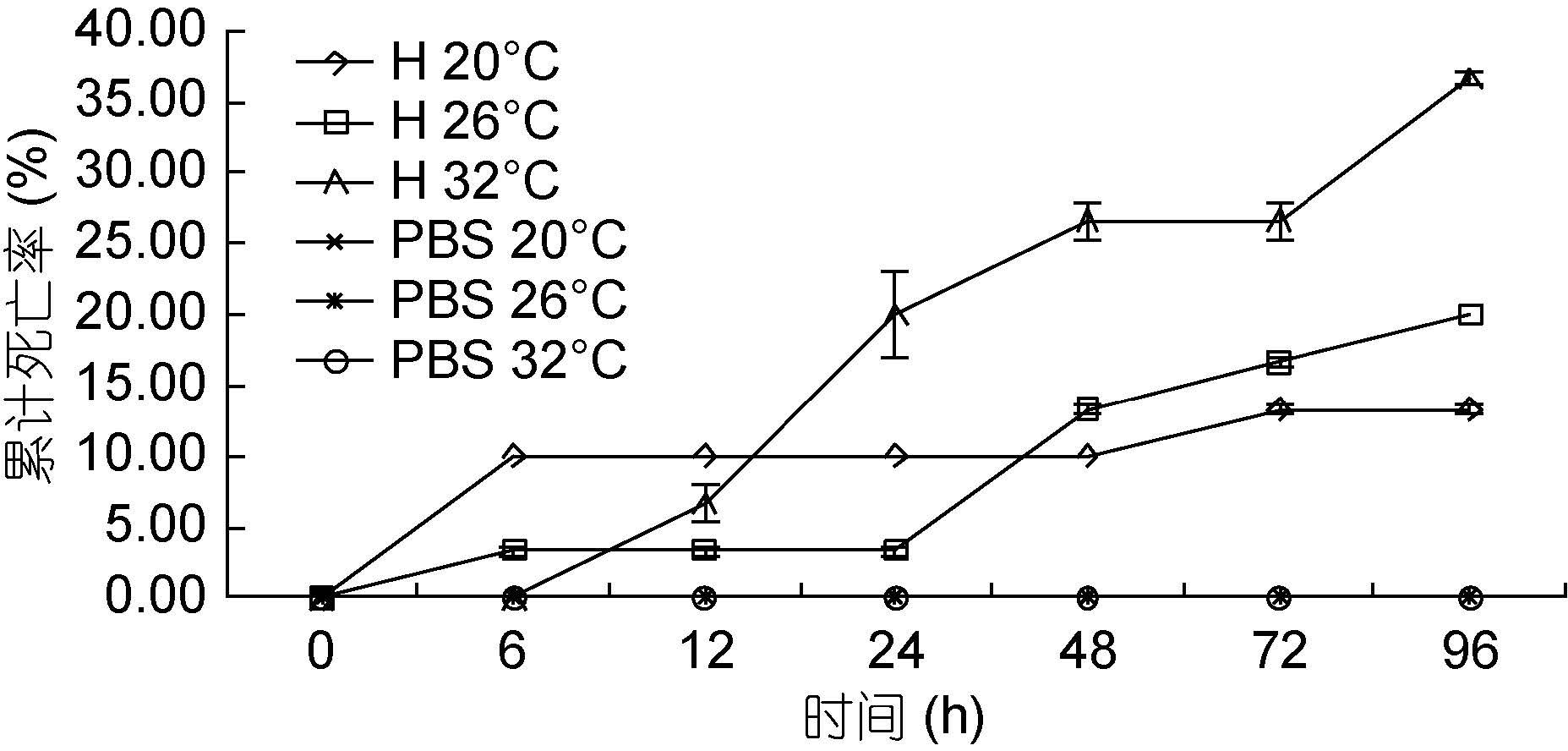
|
|
图 2 不同温度下哈维氏弧菌对墨吉明对虾死亡情况的影响
Fig. 2 The pathogenicity of V. harvey to F. merguiensis under different temperature 图例中“H”表示哈维氏弧菌。下同 |
如图 3 所示。感染6 h 后,盐度10 实验组和盐度30 实验组对虾开始出现死亡,盐度20 实验组对虾感染哈维氏弧菌出现死亡的时间在24 h 后,且其累计死亡率始终明显低于另两组实验组。弧菌感染24—72 h之间,盐度20 实验组对虾死亡速度虽然增加,但始终低于另两盐度实验组。实验结束时,各实验组的累计死亡率: 盐度10 实验组为34.52%、盐度20 实验组为35.12%、盐度30 实验组为47.62%。其中各实验组与各对照组之间对虾的累计死亡率显著差异(P<0.05),而实验组之间的差异不显著(P>0.05)。
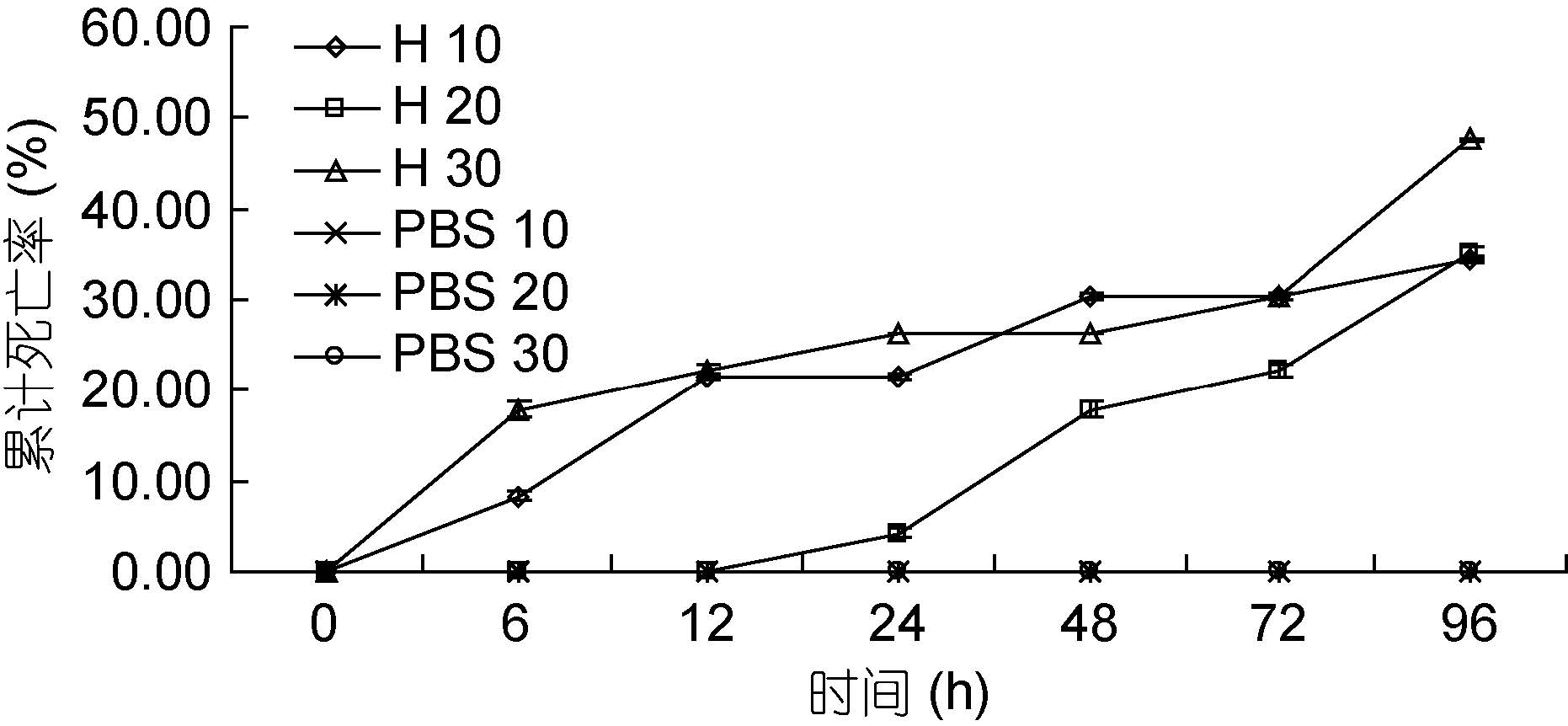
|
| 图 3 不同盐度下哈维氏弧菌对墨吉明对虾死亡情况的影响 Fig. 3 The pathogenicity of V. harvey to F. merguiensis under different salinity |
如图 4 所示。墨吉明对虾感染哈维氏弧菌6 h 后,三个实验组均对虾开始出现死亡。48 h 后,pH 8.0 实验组和pH 7.0 对照组以及pH 9.0 对照组对虾不再死亡,此时同一时间点上,各组对虾累计死亡率与pH关系为: pH 7.0和pH 9.0 对照组
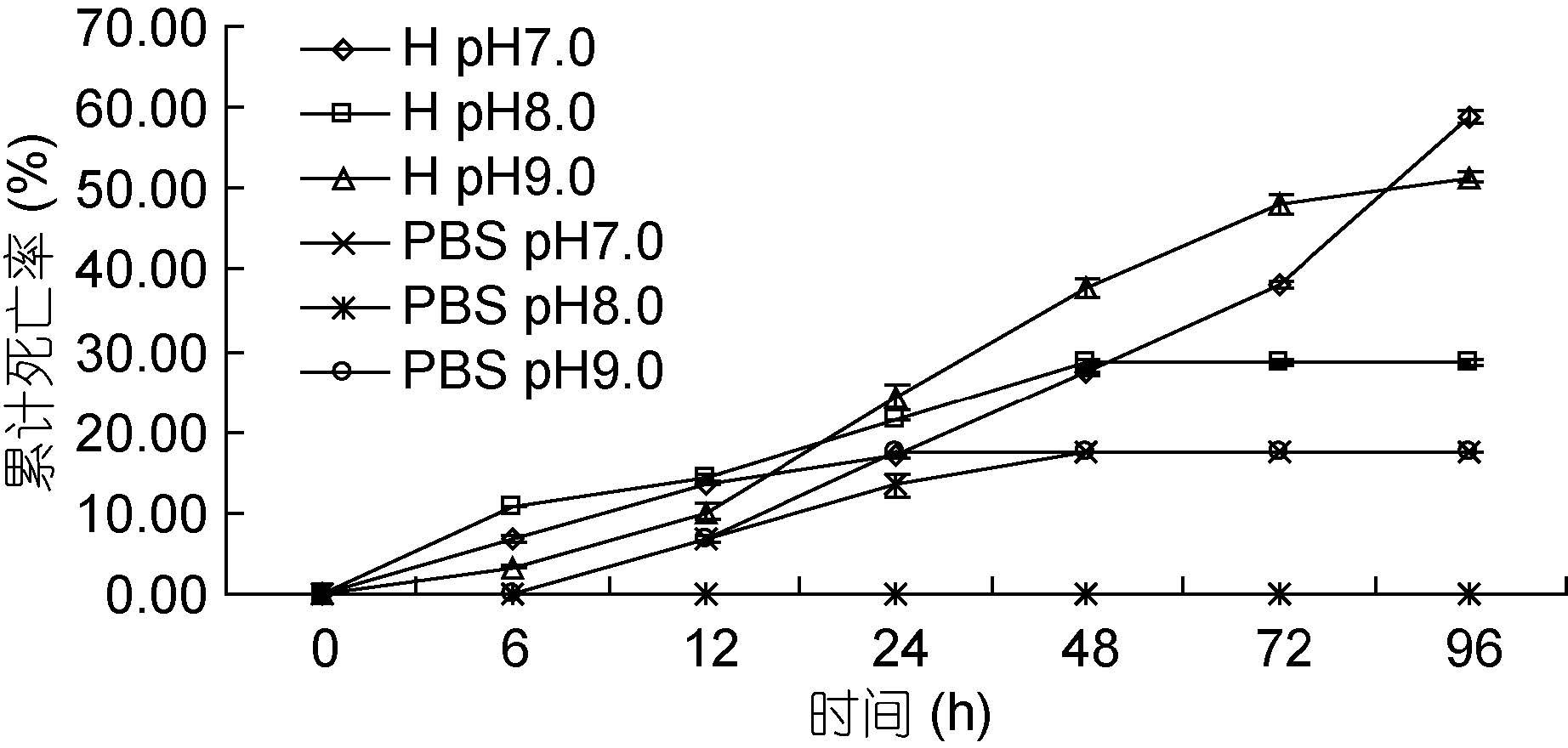
|
| 图 4 不同pH 下哈维氏弧菌对墨吉明对虾死亡情况的影响 Fig. 4 The pathogenicity of V. harvey to F. merguiensis under different pH |
如图 5 所示。在6—48 h 之间,20.0 mg/L 实验组对虾累计死亡率高于另两个实验组; 48 h 后,基本呈现出随硝酸氮浓度的升高,对虾累计死亡率增大的关系。实验结束时,对照组、10.0 mg/L 实验组、20.0 mg/L 实验组和30.0 mg/L 实验组对虾累计死亡率分别为: 57.50%、68.89%和75.93%。其中,实验组间对虾的累计死亡率无明显差异(P>0.05),但显著高于对照组(P<0.05)。
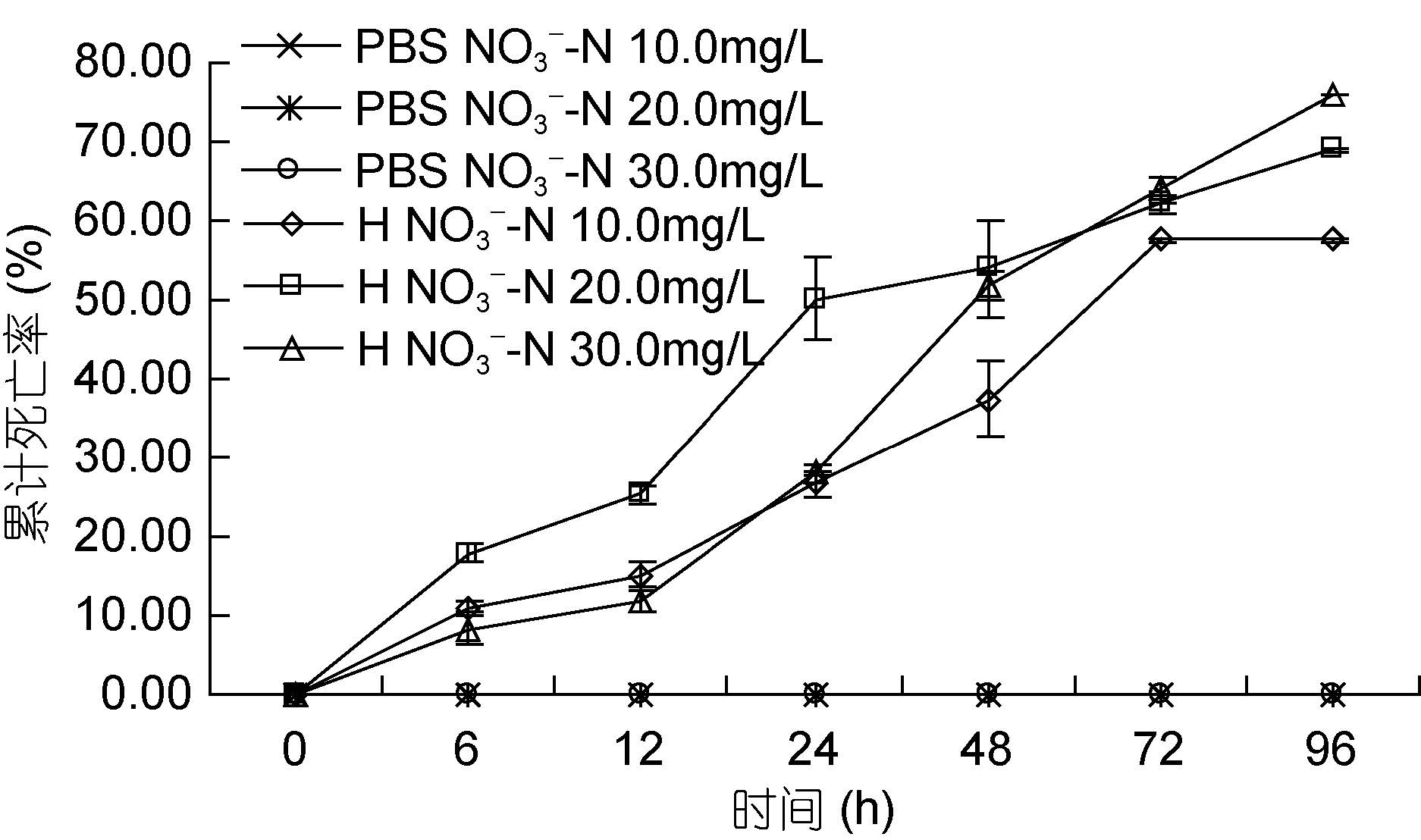
|
| 图 5 不同硝酸氮浓度下哈维氏弧菌对墨吉明对虾死亡情况的影响 Fig. 5 The pathogenicity of V. harvey to F. merguiensis under different concentration of nitrate nitrogen |
如图 6 所示。在6 h 后,各实验组对虾相继出现死亡; 在12—24 h 之间,各实验组对虾累计死亡率逐渐增高。感染24—72 h 之间,各实验组对虾死亡速度达到最大,且在72 h 后5.0 mg/L 实验组和10.0 mg/L 实验组对虾累计死亡率均明显大于1.0 mg/L 实验组。而对照组中,1.0 mg/L 对照组、5.0 mg/L 对照组和10.0 mg/L对照组对虾分别在12 h、24 h和48 h 时出现死亡,但之后对虾几乎不再出现死亡。实验结束时,1.0 mg/L 对照组、5.0 mg/L 对照组和10.0 mg/L 对照组对虾累计死亡率分别为12.50%、13.69%和8.93%。1.0 mg/L 实验组、5.0 mg/L 实验组和10.0 mg/L 实验组对虾累计死亡率分别为58.89%、75.48和84.87。其中实验组间对虾的累计死亡率的差异不显著(P>0.05),但均显著高于对照组(P<0.05)。
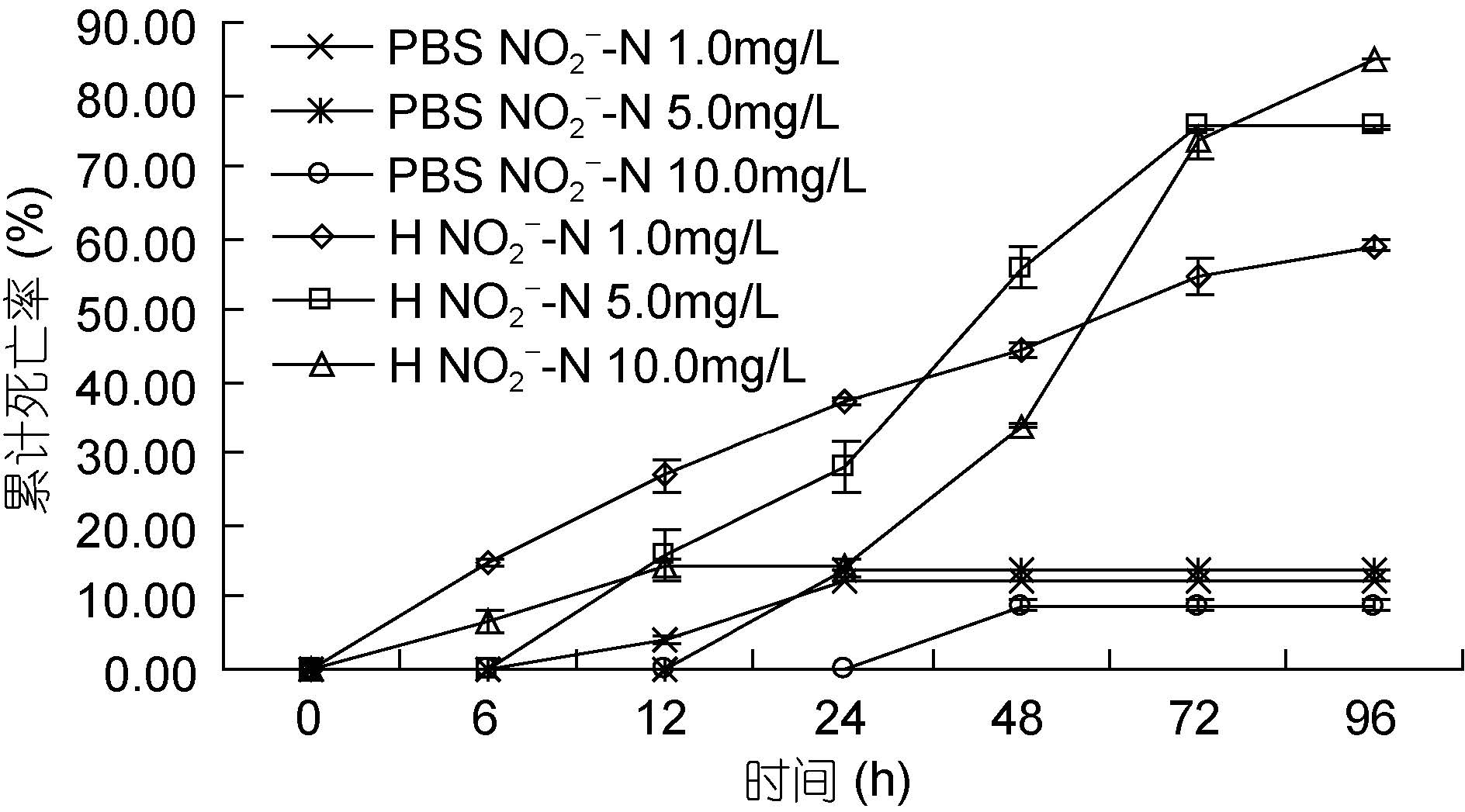
|
| 图 6 不同亚硝酸氮浓度下哈维氏弧菌对墨吉明对虾死亡情况的影响 Fig. 6 The pathogenicity of V. harvey to F. merguiensis under different concentration of nitrite nitrogen |
如图 7 所示。整个实验期间,只有0.5 mg/L 对照组不出现对虾死亡,其它组对虾均出现不同程度的死亡。1.0 mg/L 对照组和1.5 mg/L 对照组对虾,在感染弧菌24 h 后几乎不再出现死亡。在6—72 h 之间,0.5 mg/L 实验组与1.0 mg/L 实验组对虾的累计死亡率变化情况及大小基本持平; 但在72 h 之后,1.0 mg/L 实验组对虾的死亡速度突然增加,累计死亡率首次超过0.5 mg/L 实验组。实验结束时,0.5 mg/L 对照组、1.0 mg/L 对照组和1.5 mg/L 对照组对虾累计死亡率分别为: 0、12.50%和22.22%,0.5 mg/L 实验组、1.0 mg/L实验组和1.5 mg/L 实验组对虾累计死亡率分别为40.00%、53.33%和70.09%。其中实验组间对虾累计死亡率差异均不显著(P>0.05),且1.5 mg/L 对照组与各实验组间对虾死亡率亦无显著性差异(P>0.05)。
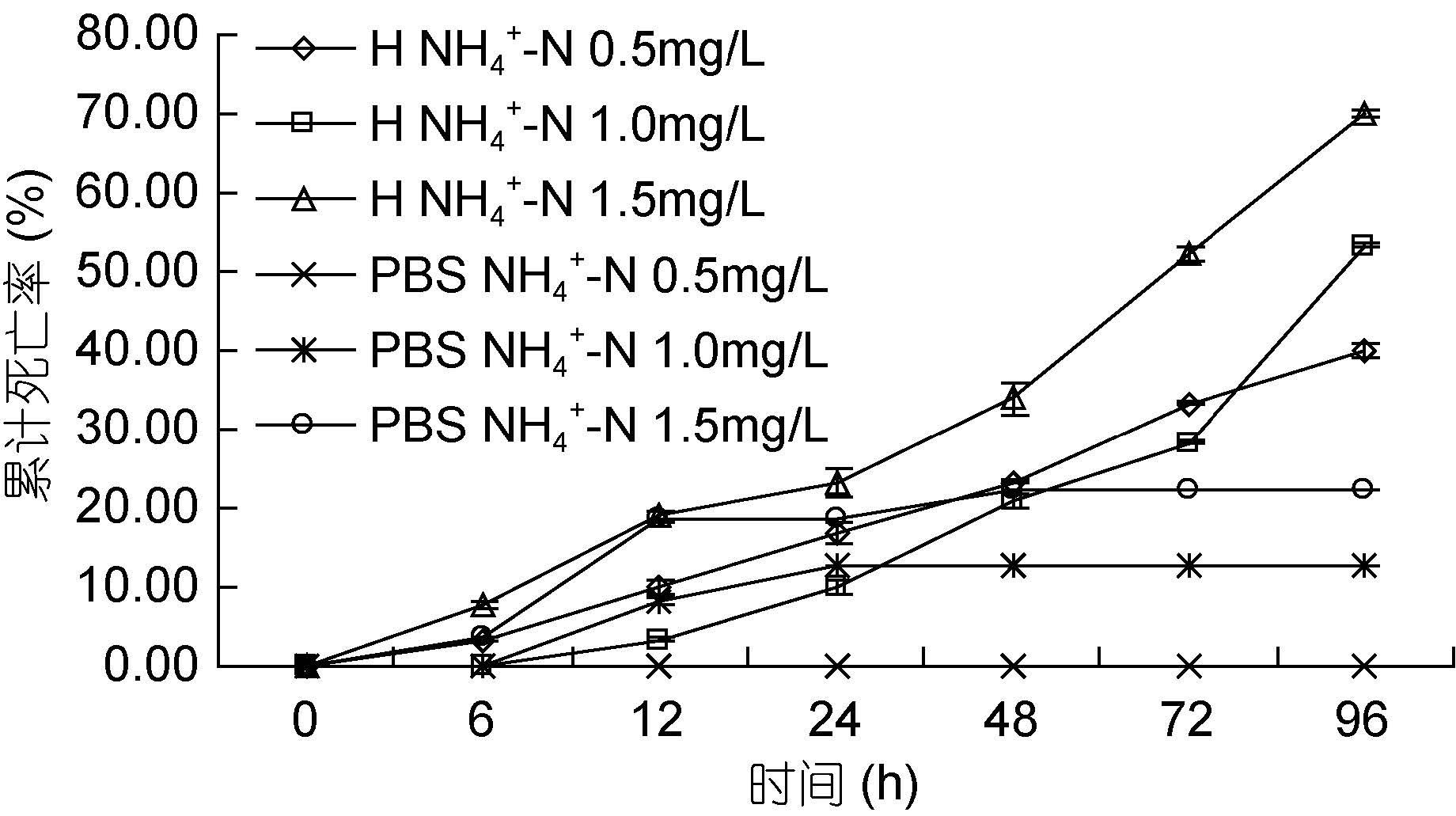
|
| 图 7 不同氨氮浓度下哈维氏弧菌对墨吉明对虾死亡情况的影响 Fig. 7 The pathogenicity of V. harvey to F. merguiensis under different concentration of ammonia nitrogen |
在自然状态下,弧菌是一种条件致病菌,当环境条件出现恶化及较大改变或养殖动物受伤、体弱、抗病力降低时,养殖动物免疫力将会下降而易于感染疾病,对弧菌的易感性也将会提高,弧菌会乘虚而入,从而不仅可以引起鱼类皮肤溃烂和对虾红体病的暴发流行,还可以感染蟹类和贝类致其死亡,是威胁水产养殖业的主要致病菌之一(黄美珍等,2000; 谢珍玉等,2007; 陈子腾等,2014)。基于此,本实验研究不同数量哈维氏弧菌及不同温度、盐度、pH、不同硝酸氮、亚硝酸氮和氨氮浓度六个理化因子胁迫下哈维氏弧菌对墨吉明对虾致病性的影响。
基于弧菌病对水产养殖业造成的巨大危害,前人对弧菌病进行了大量研究。李军等(1998)利用浸泡感染法以2.5×103—5×107 CFU/mL 浓度的哈维氏弧菌感染不同发育时期的中国对虾幼体,发现当病原菌浓度高于2.5×104 CFU/mL 时即可导致蚤状幼体严重感染死亡。本实验研究发现,感染24 h 后,3.16×108CFU 实验组对虾几乎全部死亡; 而其余各实验组对虾死亡相继出现高峰。感染96 h 后实验结束,此时对照组和各实验组墨吉明对虾累计死亡率分别为0、36.67%、50.00%、60.00%和96.67%。并且3.16×105CFU 实验组、3.16×106 CFU 实验组与3.16×108 CFU实验组差异显著。这与雷爱莹(2005)对凡纳滨对虾做肌肉感染副溶血弧菌类似,随着菌液浓度升高,感染虾死亡越快,死亡率越高。因此,当哈维氏弧菌数量为3.16×108 CFU 以及数量为3.16×106 CFU 以上暴发96 h 之后,弧菌病难以控制。
已有研究表明,哈维氏弧菌可在4—40°C 下生存(张晓君等,2008),培养温度范围为25—35°C,最适温度为30°C。本实验研究发现,弧菌感染24 h 后,随着随温度的升高,实验组对虾的死亡率明显增加,说明在一定温度范围内,水体中哈维氏弧菌的生长及其致病性随水温上升而上升(钟硕良等,2001)。20°C实验组和26°C 实验组对虾的累计死亡率显著低于32°C 实验组(P<0.05),表明高温能够极大提高哈维氏弧菌对墨吉明对虾的致病性。因此,在夏季较高温环境下养殖墨吉明对虾过程中,需防控哈维氏弧菌,这也解释了夏季为弧菌病多发季节的原因(汪映,2014)。
陈子腾等(2014)在对环境因子对对虾弧菌致病性的研究中发现,在盐度值为22.4—32.8 时,哈维氏弧菌的生长速度及其对日本对虾仔虾的致病性随盐度的升高而递增,在盐度值达到32.8 时,哈维氏弧菌的生长速度达到高峰,日本对虾仔虾的死亡率也达到最高。本实验研究发现,在96 h 时,当盐度为30时,哈维氏弧菌的致病力强,对虾累计死亡率最高,与上述研究相符。此外,沈丽琼等(2007)对凡纳滨对虾生长及免疫与盐度的关系研究中发现,在盐度为5—10 的低盐环境中,凡纳滨对虾的溶菌活力明显下降,而在盐度15—25 的环境中,对虾的抗菌能力与溶菌能力明显升高,且在盐度20 时尤为突出。本实验在盐度为10 的低盐环境中,对虾死亡率也较高。另外,邱德全等(2007)对副溶血弧菌噬菌体的生理生化特性研究发现,在盐度为20 的情况下,噬菌体对副溶血弧菌的裂解能力最强。实验证实,在绝大多数时间,盐度为20 时,对虾累计死亡率最低,此时对虾处在最适盐度范围内,其活力以及各项生理状况处于较好状态,对虾免疫抗菌能力较强,而哈维氏弧菌对对虾的致病能力较弱,这与上述研究相符,因此盐度为20 时,是一个较好的养殖条件。
墨吉明对虾生活的最适pH 为7.6—8.6(吴琴瑟,1978),当养殖水体pH 低于7.6 或高于8.6 都会影响墨吉明对虾的活力甚至造成对虾死亡。pH 实验中,pH 8.0 对照组未有对虾死亡,而pH 7.0 对照组和pH 9.0 对照组则在12 h 后出现死亡对虾,这与上述结论相符。在注射24 h 后,对照组对虾不再死亡,这可能是墨吉明对虾逐渐适应所处的pH 条件使其仍能存活,但对虾的活力已大大减弱。在pH 为7.64—8.41 时,哈维氏弧菌的生长速度及其对日本对虾的致病性均随pH 的降低而递增(钟硕良等,2001),故实验结束时pH 7.0 实验组的累计死亡率高于pH 8.0 实验组。而pH 7.0和pH 9.0 实验组对虾累计死亡率之间的差异,有待进一步探讨。另有研究表明,弧菌噬菌体的最适条件为pH 8.0,对弧菌裂解活性都在80%以上(邱德全等,2007),因此当pH 为8.0 有利于对虾的养殖。
硝酸氮实验结束时,发现对照组对虾没有出现死亡,这与人们通常认为硝酸氮对水生生物无毒无害是一致的。然而,在96 h,10.0、20.0和30.0 mg/L实验组对虾累计死亡率分别为57.50%、68.89%和75.93%,并且显著高于对照组(P<0.05)。这可能是大量硝酸氮的存在损害了动物的生理机能,进而导致死亡,而成活率随着硝酸氮含量的增加而急剧下降(于顺等,1991)。
亚硝酸氮实验,1.0、5.0和10.0 mg/L 对照组在实验结束时,对虾累计死亡率分别为12.50%、13.69%和8.93%,说明一定浓度的亚硝酸氮对墨吉明对虾本身就有一定的毒性; 这与亚硝酸氮能将血红蛋白的Fe2+氧化为Fe3+,导致低氧血症及耗氧高的组织缺氧(刘淑梅等,1999),引起对虾肝胰腺坏死(吴中华等,1999)等疾病相符,因此水体中亚硝酸盐氮质量浓度应低于4.0 mg/L(葛红星等,2014)。实验结束时,实验组对虾死亡率分别为: 58.89%、75.48%和84.87%,均显著高于对照组(P<0.05); 因此亚硝酸盐氮的升高可能直接抑制对虾免疫力(黄翔鹄等,2006),使对虾对病原菌的易感性增加。这说明在亚硝酸氮水体中,对虾易感染弧菌,弧菌对对虾的生存和抗病力影响显著; 随着亚硝酸氮浓度升高,对虾死亡率升高(周鲜娇等,2009)。
氨氮胁迫下,1.5 mg/L 对照组和1.0 mg/L 对照组对虾存在死亡,且前者死亡率较高,表明一定浓度的氨氮本身对墨吉明对虾存在毒害作用,且浓度越高危害越大。已有研究表明,在养殖池中,氨氮是最主要的危害因子之一,主要以NH3和NH4+两种形式存在,其中NH3 是主要毒性物质,若对虾长期在含氨氮量较高的水体中生活,将对体内氮废物的排泄不利;如果NH3 从水体渗入组织液内,会形成血氨中毒(乔顺风等,2006),解释了对虾死亡的部分原因。在感染96 h 后,实验组对虾累计死亡率随氨氮浓度升高而升高,这可能因为高浓度的氨氮对对虾体内酶的催化作用和细胞膜的稳定性产生严重不良影响,并破坏排泄系统和渗透平衡(蔡继晗等,2010),对虾的抗病力明显下降,对病原菌的易感性提高(孙舰军等,1999),从而造成对虾死亡。本文通过研究不同哈维氏弧菌数量及不同温度、盐度、pH、硝酸氮浓度、亚硝酸氮浓度和氨氮浓度条件下哈维氏弧菌对墨吉明对虾致病性的影响,为墨吉明对弧菌病的防控,提供了理论依据。
4 结论本实验通过人工注射感染的方式,研究了不同数量哈维氏弧菌及在不同温度、盐度、pH、不同硝酸氮、亚硝酸氮和氨氮浓度条件下哈维氏弧菌对墨吉明对虾的致病性的影响,发现当哈维氏弧菌数量为3.16×108 CFU 以及数量为3.16×106 CFU 以上暴发96 h之后,弧菌病很难防治。
在20—32°C 范围内,随着温度的升高,哈维氏弧菌致病力增强,对虾累计死亡率升高; 因此,温度是对虾弧菌病病害的主要影响因子,在温度较高的夏季养殖对虾需要注意防控弧菌病。温度为(24±1)°C时,对虾的死亡率在盐度为20 时较低; 在温度为(24±1)°C,盐度为(22±1)时,pH 8 对虾的死亡率最低;因此,这两个条件是比较好的对虾养殖条件。
通常认为硝酸氮对水生动物无毒无害,然而研究发现硝酸氮对感染哈维氏弧菌的墨吉明对虾有胁迫作用。在一定范围内,随着硝酸氮浓度升高,对虾累计死亡率升高。在亚硝酸氮浓度(1.0—10.0 mg/L)、氨氮浓度(0.5—1.5 mg/L)范围内,哈维氏弧菌对墨吉明对虾的致病性,随着浓度升高而增强,对虾累计死亡率增高; 并且当两者浓度分别在1.0 mg/L 以上时,其自身对墨吉明对虾就有一定的刺激作用,可能会引起早期对虾的不适甚至死亡。
| 于顺, 孙丕喜, 乔聚海等. 1991. 硝酸氮对栉孔扇贝幼虫影响的研究. 海洋科学, (6): 6-8 |
| 孔凡骏, 周凯, 郑国兴. 1998. 三种弧菌对池养中国对虾的急性致死剂量试验. 海洋科学, (4): 6-7 |
| 乔顺风, 刘恒义, 靳秀云等. 2006. 养殖水体氨氮积累危害与生物利用. 河北渔业, (1): 20-22 |
| 刘淑梅, 孙振中, 戚隽渊等. 1999. 亚硝酸盐氮对罗氏沼虾幼体的毒性试验. 水产科技情报, 26(6): 281-283 |
| 孙舰军, 丁美丽. 1999. 氨氮对中国对虾抗病力的影响. 海洋与湖沼, 30(3): 267-272 |
| 李军, 徐怀恕. 1998. 中国对虾幼体致病菌哈维氏弧菌的分离及其生物学特性研究. 海洋与湖沼, 29(4): 353-361 |
| 杨世平, 王成桂, 黄海立等. 2014. 环境温度和盐度对墨吉明对虾(Fenneropenaeus merguiensis)胚胎发育的影响. 海洋与湖沼, 45(4): 817-822 |
| 吴中华, 刘昌彬, 刘存仁等. 1999. 中国对虾慢性亚硝酸盐和氨中毒的组织病理学研究. 华中师范大学学报(自然科学版), 33(1): 119-122 |
| 吴琴瑟. 1978. 墨吉对虾. 水产科技情报, (8): 30-31, 10 |
| 邱德全, 蔺红苹, 谭龙艳. 2007. 一株副溶血弧菌噬菌体生理特性的研究. 微生物学通报, 34(4): 735-739 |
| 汪映. 2014. 副溶血弧菌群体感应与调控的初步研究. 青岛:中国海洋大学硕士学位论文 |
| 沈丽琼, 陈政强, 陈昌生等. 2007. 盐度对凡纳滨对虾生长与免疫功能的影响. 集美大学学报(自然科学版), 12(2):108-113 |
| 张晓华, 钟英斌, 陈吉祥. 2007. 哈维氏弧菌的生物学特性、流行病学及检测技术. 中国海洋大学学报(自然科学版),37(5): 740-748 |
| 张晓君, 阎斌伦, 秦国民. 2008. 水产动物哈氏弧菌病及其防治方法. 科学养鱼, (10): 50-51 |
| 陈子腾, 冯幼, 许合金. 2014. 环境因子对对虾弧菌致病性的影响. 饲料博览, (4): 45-47 |
| 周鲜娇, 邱德全. 2009. 亚硝酸氮和副溶血弧菌对凡纳滨对虾部分免疫指标的影响. 水生态学杂志, 2(1): 49-53 |
| 房海, 秦国民, 陈翠珍等. 2009. 长鳍真鲨源哈氏弧菌的主要生物学性状研究. 渔业科学进展, 30(1): 19-25 |
| 钟硕良, 陈月忠, 周宸. 2001. 环境因子对发光细菌的生长及日本对虾仔虾感染死亡率的影响. 中国水产科学, 8(1):41-45 |
| 黄美珍, 李志棠. 2000. 微生态制剂在虾病防治应用的研究进展. 中山大学学报(自然科学版), 39(S1): 75-79 |
| 黄翔鹄, 李长玲, 郑莲等. 2006. 亚硝酸盐氮对凡纳滨对虾毒性和抗病相关因子影响. 水生生物学报, 30(4):466-471 |
| 葛红星, 李健, 陈萍等. 2014. 亚硝酸盐氮胁迫下凡纳滨对虾对副溶血弧菌的易感性. 中国水产科学, 21(3):629-636 |
| 谢珍玉, 周永灿, 冯永勤. 2007. 对虾弧菌病的研究进展--回顾对虾弧菌病的病原种类、致病机制与条件、症状与组织病变及对虾的防御机制. 海南大学学报(自然科学版),25(1): 88-95 |
| 雷爱莹. 2005. 南美白对虾败血病病原菌(副溶血弧菌)的研究.广西水产科技, (1): 9-12 |
| 蔡继晗, 沈奇宇, 郑向勇等. 2010. 氨氮污染对水产养殖的危害及处理技术研究进展. 浙江海洋学院学报(自然科学版),29(2): 167-172, 195 |
| Karunasagar I, Pai R, Malathi G R et al. 1994. Mass mortality ofPenaeus monodon larvae due to antibiotic-resistant Vibrioharveyi infection. Aquaculture, 128(3-4): 203-209 |
| Liu P C, Lee K K, Chen S N. 1996. Pathogenicity of differentisolates of Vibrio harveyi in tiger prawn, Penaeus monodon.Letters in Applied Microbiology, 22(6): 413-416 |
| Pizzutto M, Hirst R G. 1995. Classification of isolates of Vibrioharveyi virulent to Penaeus monodon larvae by proteinprofile analysis and M13 DNA fingerprinting. Disease ofAquatic Organisms, 21(1): 61-68 |
| Ramesh A, Venugopalan V K. 1989. Response of enteric luminousbacteria to environmental conditions in the gut of the fish.Journal of Applied Bacteriology, 66(6): 529-533 |
| Robertson P A W, Calderon J, Carrera L et al. 1998. ExperimentalVibrio harveyi infections in Penaeus vannamei larvae.Diseases of Aquatic Organisms, 32(2): 151-155 |
| Ruby E G, Morin J G. 1979. Luminous enteric bacteria of marinefishes: a study of their distribution, densities, and dispersion.Applied and Environmental Microbiology, 38(3): 406-411 |
| Vandenberghe J, Li Y, Verdonck L et al. 1998. Vibrios associatedwith Penaeus chinensis (Crustacea: Decapoda) larvae inChinese shrimp hatcheries. Aquaculture, 169(1-2):121-132 |
 2015, Vol. 46
2015, Vol. 46


