中国海洋湖沼学会主办。
文章信息
- 李宗耀, 杨雨佳, 张士璀, 汲广东. 2015.
- LI Zong-Yao, YANG Yu-Jia, ZHANG Shi-Cui, JI Guang-Dong. 2015.
- 斑马鱼(Danio rerio)胚胎免疫反应: 补体基因在早期胚胎以及LPS 刺激胚胎中的表达
- EXPRESSION PATTERN OF COMPLEMENT-RELATED GENES IN NORMAL AND LPS-CHALLENGED ZEBRAFISH EMBRYO/LARVA
- 海洋与湖沼, 46(6): 1444-1450
- Oceanologia et Limnologia Sinica, 46(6): 1444-1450.
- http://dx.doi.org/10.11693/hyhz20150400098
-
文章历史
- 收稿日期:2015-04-04
- 改回日期:2015-08-26
斑马鱼(Danio rerio)是脊椎动物的模式生物,与大多数鱼类相似,均为体外受精并发育。在胚胎发育过程中,鱼卵暴露于水中,同水中大量的病原微生物直接接触。这就引出一个问题,鱼类胚胎在发育过程中是如何保护自身免受外源微生物入侵的?鱼类的特异性免疫于脊椎动物中发育程度较低,免疫球蛋白种类和数量均有限,已有的研究表明,与鱼类特异性免疫相关的基因(Rag2,AID,TCRAC,IgLC-1,mIg,sIg,IgZ和DAB)直到胚胎受精后8 天才对LPS 诱导有强烈反应(Li et al,2011),说明在胚胎发育早期,特异性免疫尚未成熟,非特异性免疫尤其是补体系统在胚胎发育中的构建对其抵御外界病原体的入侵具有重要的意义。
补体系统由30 多种可溶蛋白及膜蛋白构成,在机体非特异性免疫及特异性免疫防御中均起到重要的作用,例如,可以参与细菌裂解,免疫调理、免疫粘附和炎症介质等一系列反应。在这些反应过程中,补体可以通过三条途径激活: 经典途径,凝集素途径和替代途径。经典途径由抗原抗体复合物激活C1q,C1q 进一步激活C1r、C1s,裂解C4 形成C4b,同时与被酶解的C2 结合形成C3 转化酶C4b2a,C4b2a 活化C3,激活过程需要Ca2+及Mg2+。凝集素途径类似经典途径,始于甘露糖结合凝集素(MBL)活化,进一步活化C4 及C2 成分,产生C3 转化酶C4b2a,过程仅需Mg2+参与(Leslie et al,2013)。替代途径无需C1、 C2、C4 成分,可由细菌脂多糖、肽聚糖等活化C3,形成的C3b 同B 因子结合形成C3 转化酶C3bBb,仅需 Ca2+参与(Boshra et al,2006)。上述C3 转化酶可裂解 C3 为C3b,C3b 同C3 转化酶结合,形成C5 转化酶,后共用一套终末途径,即C5 转化酶裂解C5 形成的 C5b 顺次与C6,C7,C8 以及C9 结合形成攻膜复合体引起细胞溶解(Kuo et al,2000)。
随着对鱼类补体系统的研究已日益深入,鉴定了大量的补体蛋白和基因,研究了鱼类补体的信号通路,发现在鱼类中存在较为完备的补体系统。鱼类的补体系统同其他脊椎动物相比,具有更低的耐热性,如虹鳟、罗非鱼等鱼补体在40—50°C 即可灭活(Sakai,1981),而哺乳动物通常需要更高温度; 由于基因组复制,具有多个C3、C4、Bf/C2、C5、C7、MBL、 B 因子和I 因子亚型(Holland et al,2002),近来亦有研究鉴定出了斑马鱼的H 因子(Sun et al,2010)、RCA2.1、 RCA2.2(Wu et al,2012)等补体调节因子基因。许多研究已经表明成体鱼类的补体系统分子功能与哺乳动物的类似,但补体系统在鱼类早期胚胎发育中的功能研究较少。补体及其调节因子在早期胚胎发育中的表达模式,以及早期发育的胚胎对外来免疫原刺激的反应报道较少。因此研究鱼类早期胚胎发育过程中补体系统的功能对鱼类免疫系统发生及水产苗种抗病繁育和养殖等都具有重要的理论意义和实用价值。
由于C3、C4、C9、Bf/C2 是补体反应和膜攻击阶段非常重要的分子,其中C3 为三条激活通路所共同经过的核心因子,更是调节蛋白作用的核心因子之一; C4 为经典及凝集素激活途径反应必须的重要因子; 虽然在鱼类中Bf/C2 不能相互区分为C2 及B 因子,但其多种亚型在不同通路中均是构成C3 转化酶的关键分子; C9 是攻膜复合体中形成孔洞来裂解细胞的重要分子; 而RCA2.1、RCA2.2 可以通过作用 C3 转化酶调控补体反应的强度。本文用胚胎整体原位杂交技术研究了斑马鱼补体C3、C4、C9、Bf/C2 及其亚型、补体调节因子RCA2.1、RCA2.2 基因在早期胚胎中的表达模式; 利用实时荧光定量PCR 技术,对LPS 刺激下胚胎各补体基因表达量的变化进行了研究,以期为斑马鱼早期胚胎发育过程中补体系统的构建及形成机制,提供理论依据。
1 材料与方法 1.1 实验动物斑马鱼本实验选用的4—10 月龄野生型斑马鱼购自青岛市南山水产市场。斑马鱼饲养水温为28°C,自然光周期处理,每日投喂两次饵料。
成熟斑马鱼按照雌雄比例2: 1 配鱼,给予光照刺激,促使斑马鱼交配产卵。收集鱼卵后,使用胚胎培养液(MgSO4·7H2O0.163 mg/mL,KCl0.03 mg/mL,NaCl1 mg/mL,CaCl2 0.04 mg/mL)在28°C 下自然光周期培养。
1.2 斑马鱼胚胎总RNA 提取及cDNA 制备在9 个时期(4cell,3hpf,5hpf,10hpf,15hpf,24hpf,48hpf,72hpf,96hpf)中,每个时期取25 个胚胎,加入 1mL TRIZOL 研磨,存–80°C 备用。
使用总RNA 提取试剂盒(Total RNA Kit I,OMEGA),按照说明书提取胚胎总RNA。使用反转录试剂盒(PrimeScript RT reagent Kit with gDNA Eraser,TaKaRa)制备反转录体系,于PCR 仪中对总RNA 进行反转录,得到cDNA 模板,保存于–20°C,以备目的基因片段的扩增。
1.3 斑马鱼补体基因片段克隆从NCBI 网站(http: //www.ncbi.nlm.nih.gov/)获取相关基因信息,依据各基因片段使用Primer Premier program(version 5.0,Canada)设计引物,表 1 为引物信息。
以上述cDNA 为模板,PCR 反应扩增补体相关基因片段。反应体系: 向0.2mL PCR 管中加入5μL 10×Ex buffer(Mg2+),1μL cDNA(50 ng/μL)模板,引物各1.5μL(20 mmol /L),4μL dNTP(10 mmol/L),0.25μL Ex Taq DNA 聚合酶,用三蒸水将体系补至50μL; PCR 反应的程序为: 95°C 预变性5min; 95°C 变性30s,55—60°C 退火30s,72°C 延伸30—60s,35 个循环; 72°C 延伸7min。反应结束后取4μL PCR 产物进行琼脂糖(1%)凝胶电泳,观察结果,并进行PCR 产物纯化。
1.4 基因探针合成将纯化片段连接到PGEM-Teasy 载体中,然后转化到大肠杆菌感受态细胞(Trans5α,TransGen)中进行克隆,通过蓝白斑筛选和菌落PCR挑选阳性克隆,提取质粒DNA(Plasmid Mini Kit I,OMEGA),并测序。 在确定扩增序列正确及插入载体方向后,选择反义探针和正义探针的酶切位点。完全切开并纯化后,以其为模板转录合成地高辛标记的RNA 探针[DIGRNA Labelling Kit(SP6/T7),Roche]。
1.5 原位杂交取上述发育阶段(4cell,3hpf,5hpf,10hpf,15hpf,24hpf,48hpf,72hpf,96hpf)的斑马鱼胚胎和幼鱼,对胚胎进行剖膜。然后在上述样品中加入4%多聚甲醛固定,置–4°C 过夜。
参照Thisse等(2007)方法进行实验。具体如下: 取上述固定胚胎用2×PBST 溶液复水,用蛋白酶K 消化后,将胚胎置于杂交炉中65°C 预杂交4h,后加入预热的反义RNA 探针70°C 杂交过夜(约16h)。第2 天回收探针,用梯度SSCT 溶液清洗胚胎,室温下加入含有5%山羊血清的PBST 封闭2h,后加入0.05% anti-Dig-AP(Roche)浓度的封闭液室温放置3h。用 2×PBST 溶液清洗未结合的抗体,用Coloration Buffer 清洗胚胎,后用2% NBT/BCIP 的Detection Buffer 显色液,在黑暗中显色。显色完全后用4% PFA 黑暗中固定1h,用70%乙醇脱色后保存于–4°C。在解剖镜下观察并拍照记录结果。
1.6 显微注射每次实验取10hpf、15hpf、24hpf、48hpf 不同发育时期的斑马鱼胚胎共约800 颗,每个时期分别分为实验组和对照组,在体式镜下用解剖针剥去卵膜。分别在上述发育各时期向实验组每胚胎注射6×10–3 μL 10mg/L LPS 溶液,同时向对照组注射溶剂6×10–3 μL 2×PBS 溶液。分别取注射后2h、5h、10h 三个时期胚胎,每组每时期取25 个胚胎,按照步骤2 所示方法提取RNA 并反转录为cDNA 模板。
1.7 实时定量PCR根据各基因序列,在其编码区使用Primer Premier program(version 5.0,Canada)软件设计real-time PCR 引物,以下为筛选出来的可用引物。
采用步骤6 方法提取的模板,用持家基因β-actin 作为内参,对以上各基因进行real-time PCR 实验,使用 2–△△CT 算法,得到各基因相对表达量。上述试验重复三次,数据使用SPSS 13.0 软件分析,使用独立样本 T 检验方法,对实验组和对照组表达量变化进行分析。
原位杂交结果显示,上述8 个补体相关基因(C3,C4,C9,Bf1,Bf2,Bf3,RCA2.1,RCA2.2)在早期发育过程中从卵裂期至体节期表达明显,均泛表达于胚胎中(图 1 Ⅰa—e,Ⅱa—e,⋯,Ⅷa—e),无组织特异性分布。在胚胎发育至24—48hpf 时,上述8 个基因均主要表达于胚胎头部、眼部及脑(图 1 Ⅰ—Ⅷf,Ⅰ—Ⅷg),Bf1、Bf2、Bf3和RCA2.1 基因在胸鳍下方的肝脏原基也有表达位点(图 1 Ⅳ—Ⅶg)。C3、C4 基因在胚胎发育至72hpf 时,表达于肝脏原基; 96hpf 时表达于肝脏及肠道(图 1 Ⅰh—i,Ⅱh—i)。 C9 基因在72hpf 及96hpf 时表达于肝脏及消化道(图 1 Ⅲh—i)。Bf1 基因在72hpf 时表达于肝脏及消化道; 96hpf 时主要表达于肝脏(图 1 Ⅵh—i)。Bf2 基因于 72hpf、96hpf 时主要表达于整个肝脏及肠道(图 1 Ⅴh—i)。Bf3 基因在胚胎发育至72hpf 时表达于肝脏基部; 96hpf 时表达于肝脏及肠道(图 1 Ⅵh—i)。 RCA2.1 基因在72hpf 时表达于肝脏基部; 96hpf 时表达于肝脏(图 1 Ⅶh—i)。RCA2.2 基因在72hpf 时表达于肝脏基部; 96hpf 时表达于肝脏及肠道,表达信号较弱(图 1 Ⅷh—i)。以上各基因的正义探针均无明显表达信号。
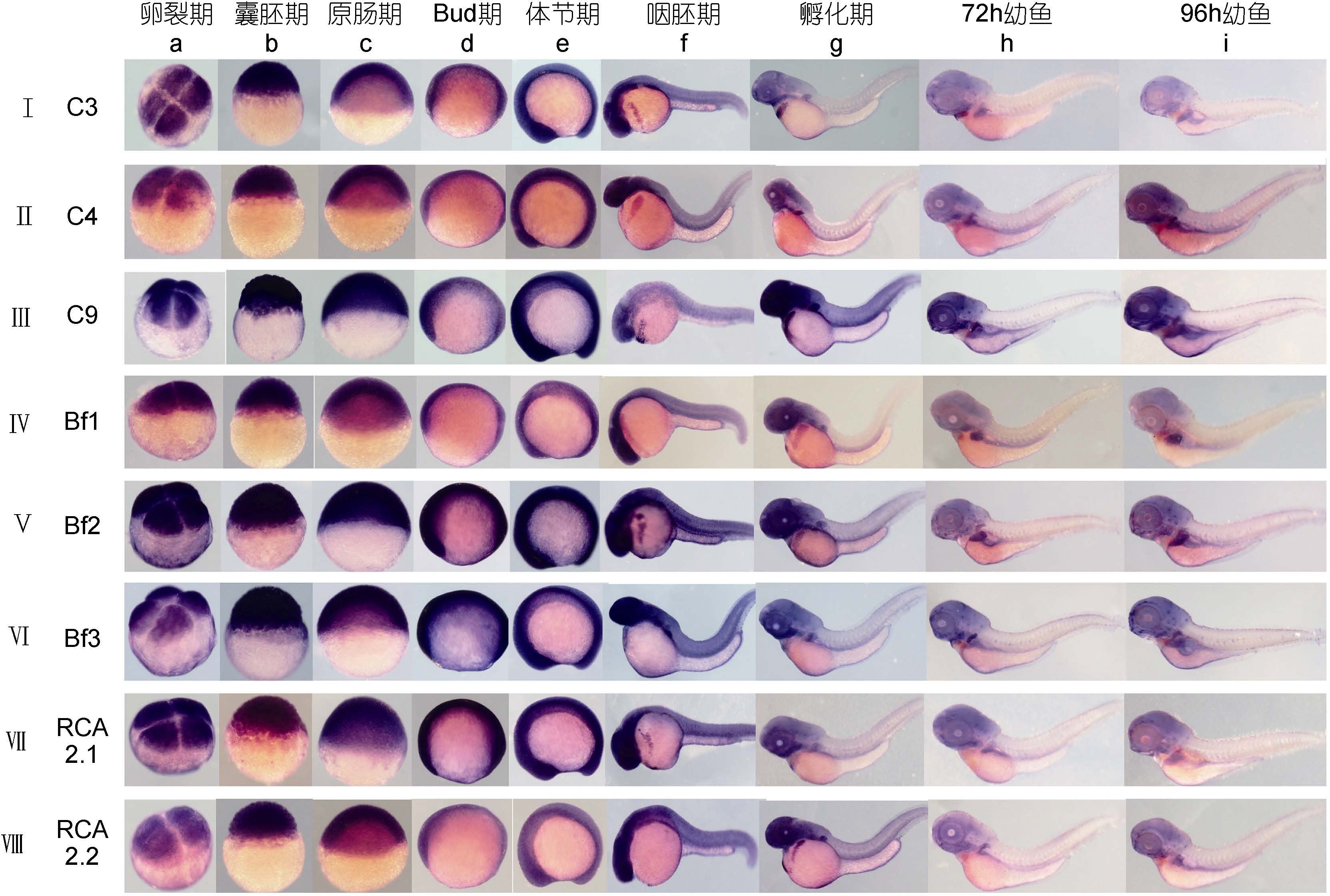
|
| 图 1 斑马鱼胚胎中补体相关基因(C3, C4, C9, Bf1, Bf2, Bf3, RCA2.1, RCA2.2)的表达模式 Fig. 1 Expression pattern of complement-related genes (C3, C4, C9, Bf1, Bf2, Bf3, RCA2.1, and RCA2.2) in zebrafish embryos/larvae 图中各发育时期分别对应的发育时间如下; 卵裂期(1.25hpf)、囊胚期(3hpf)、原肠期(5hpf)、Bud 期(10hpf)、体节期(15hpf)、咽胚期(24hpf)、孵化期(48hpf)、72h 幼鱼(72hpf)、96h 幼鱼(96hpf)。分别以罗马数字Ⅰ、Ⅱ、Ⅲ、⋯Ⅷ, 从上至下标明各基因, 分别以字母a、b、c、⋯i 从左至右标明各时期 |
总之,上述斑马鱼补体相关基因mRNA 表达模式类似,在胚胎发育到24hpf 之前都广泛表达于整个胚胎,后表达于头部,后期主要特异性表达于肝脏基部或整个肝脏及消化道中。
2.2 补体及其调节基因mRNA在LPS 刺激下的表达变化使用qRT-PCR 方法,对10h、15h、24h 及48h 胚胎给予LPS 刺激,以研究各补体基因表达量的变化情况。实验结果如图 2,对照组与实验组使用不同色块标注,条形图均表示平均值±标准差,使用T 检验对表达量变化进行显著性检验并标注(*: P<0.05,**: P<0.01)。
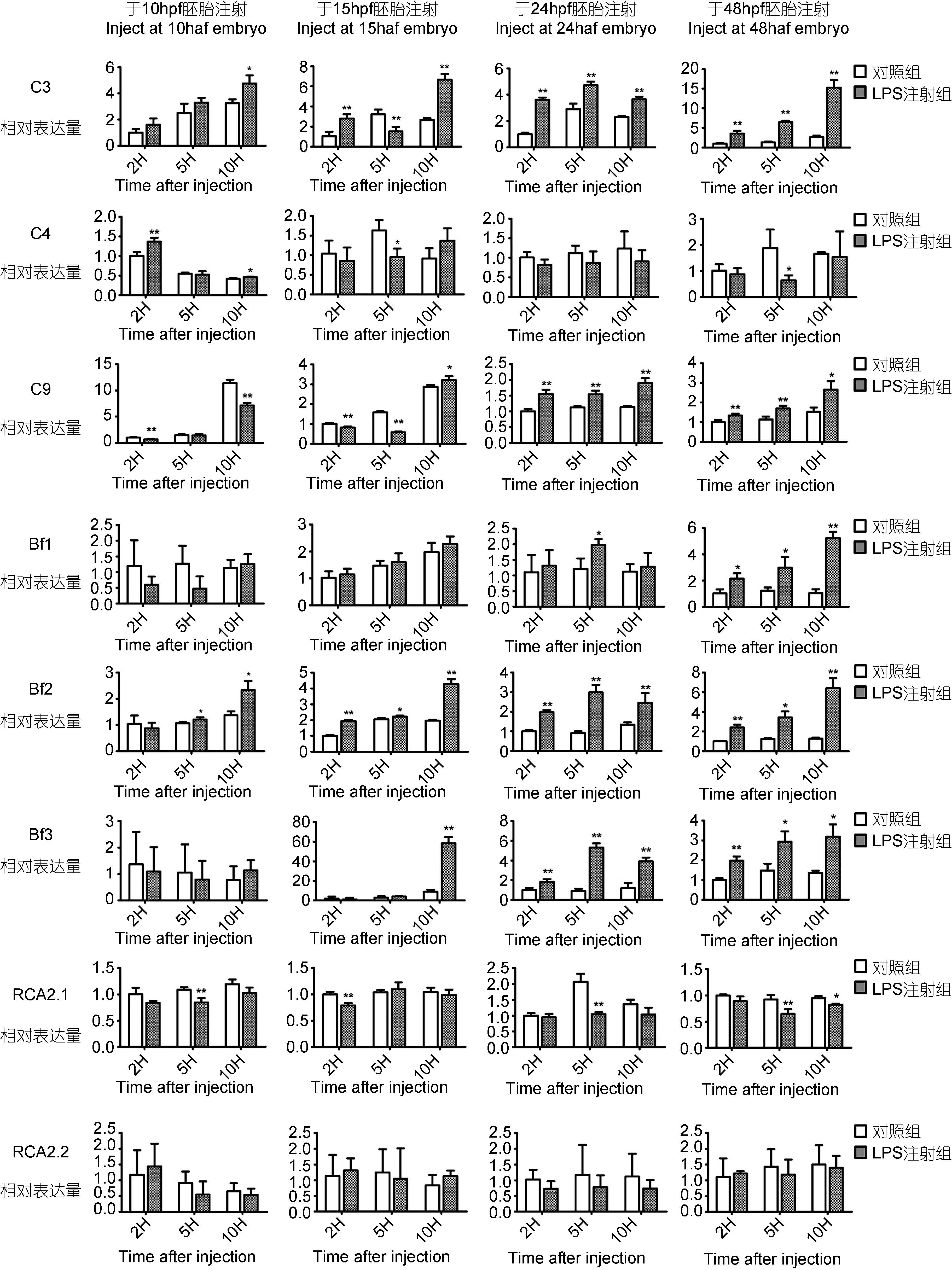
|
| 图 2 斑马鱼不同发育时期胚胎注射LPS 处理后, 各补体相关基因(C3, C4, C9, Bf1, Bf2, Bf3, RCA2.1, RCA2.2)实验组同对 照组基因相对表达量 Fig. 2 Expression profiles of complement-related genes (C3, C4, C9, Bf1, Bf2, Bf3, RCA2.1, and RCA2.2) in normal and LPS-challenged embryos/larvae at different developmental stages *. P<0.05, **. P<0.01 |
实验结果显示,C3 基因表达量在10hpf 胚胎注射后10h 开始出现显著性上升,在15hpf、24hpf、48hpf 胚胎中注射2h、5h、10h 均出现表达量上调。C4 在 LPS 刺激后,基因表达量于早期10hpf 胚胎注射后2h 升高,之后无显著性差异; 15hpf 及48hpf 胚胎在注射后5h 出现了下降。C9 基因10hpf、15hpf 胚胎注射后出现下降,但于15hpf 胚胎处理后10h 及24hpf、48hpf 胚胎注射后2h、5h、10h 基因mRNA 上调表达。Bf1 基因于10hpf、15hpf、24hpf 时期均无反应,48hpf 时期在LPS 处理后2h、5h、10h 出现升高。Bf2 基因表达量在10hpf 胚胎注射后5h、10h 开始出现显著性上升,在15hpf、24hpf、48hpf 胚胎中注射2h、5h、10h 后出现表达量上调,并保持上调。Bf3 基因早期表达量低,在10hpf 胚胎对LPS 刺激无反应; 15hpf 胚胎于注射10h 后升高; 24hpf 及48hpf 胚胎均为注射2h、 5h、10h 后表达量升高。RCA2.1 基因表达量于10hpf、 24hpf、48hpf 胚胎注射5h 及15hpf 胚胎注射后2h 较对照组表达量下调。RCA2.2 基因实验组同对照组均无显著性差异,对LPS 刺激无反应。
总之,C3、Bf2 均在胚胎发育至10—15hpf 在LPS刺激后表达上调,RCA2.1 基因在15hpf 胚胎在LPS 刺激后5h 表达下调; C9、Bf3 在胚胎发育至24hpf 时对外界刺激产生表达上调,Bf1 在胚胎发育至48hpf 时对外界刺激产生表达上调; C4 及RCA2.2 基因对 LPS 刺激反应小、无规律或无显著性变化。
3 讨论本文首次通过原位杂交的方式研究了几个重要补体基因尤其是Bf2、Bf3 两个亚型及RCA2.1、 RCA2.2 两个补体调节因子在早期胚胎中的表达图示。有报道称成年斑马鱼C3、C4、Bf1 基因表达于肝脏(Cheng et al,2006; Wang et al,2008),C9 表达于肝脏及肠道(Cheng et al,2006; Jima et al,2009),RCA2.1 具有广泛的表达谱而RCA2.2 基因主要表达于肝脏和肌肉(Wu et al,2012)。本文研究表明在斑马鱼胚胎发育早期,各补体基因(C3,C4,C9,Bf1,Bf2,Bf3,RCA2.1,RCA2.2)在胚胎内就有母源性表达,为泛表达,后主要集中在头部。在随后的发育过程中,B 因子各亚型基因(Bf1,Bf2,Bf3)与RCA2.1 基因在 48hpf 就表达于早期肝脏原基而后表达于早期肝脏,其余补体基因(C3,C4,C9,RCA2.2)在72hpf 表达在早期肝脏; 补体相关基因(C3,C4,C9,Bf1,Bf2,Bf3,RCA2.1,RCA2.2)在96hpf 主要表达于肝脏及肠道。 这均是斑马鱼体内重要的免疫器官,表明肝脏及肠道为补体在早期胚胎中的主要表达器官。对比已报道的斑马鱼成鱼的表达模式,成鱼相关补体基因也均主要表达于肝脏,其次为肠道,本实验证明在幼鱼期即形成了这种表达模式。
本文还进一步通过real-time PCR 的手段探究了斑马鱼早期胚胎在LPS 刺激后上述补体基因的反应。 C3、C9、Bf2、Bf3 基因表达量于胚胎发育24hpf 内对LPS 刺激就有显著性升高,表明斑马鱼在胚胎发育的较早时期就可通过上调相关基因表达量,来针对外界刺激启动激活补体系统。有研究表明,RCAgroup2 家族蛋白主要通过结合C3b,抑制C3 转化酶形成或将其裂解来调控其活性状态。RCA2.1 于 15hpf 胚胎LPS 刺激后出现表达量显著降低,表明在斑马鱼胚胎早期发育中,针对外界刺激可通过下调 RCA2.1 基因表达量减少对C3 转化酶的抑制和分解来进行补体系统调节; 而RCA2.2 基因表达量对LPS 刺激没有反应,这可能与其在胚胎早期表达量低有关(Wu et al,2012),与此时原位杂交表达信号弱的结果是相符的。序列分析也表明,尽管斑马鱼RCA2.2 与RCA2.1 有较高同源性,但RCA2.1 有膜蛋白位点而RCA2.2 为可溶蛋白。上述结果表明,RCA2.1 与 RCA2.2 基因很可能在补调控或激活补体系统中扮演不同的角色。其实,在鲫鱼中也发现了类似的 RCA2 家族基因分化现象,存在一个膜相关蛋白基因及两个可溶蛋白基因,各亚型在成鱼中存在表达部位的差异(Nur et al,2013)。综上所述,在脊椎动物早期进化过程中,RCA2 家族基因开始出现基因功能的分化。
C2/Bf 家族三个亚型Bf1、Bf2、Bf3 中,Bf1 同 Bf2、Bf3 两蛋白的同源性分别为34%和33%,而Bf2、 Bf3 两亚型间蛋白同源性为57%。有报道称,此三个亚型基因是由一个基因复制而产生的(Seeger et al,1996),而在LPS 刺激后,三个C2/Bf 亚型基因产生反应的时间各不相同,表明其功能已经有了分化。有研究表明,虽然在鱼类中不能明确的通过蛋白结构区分C2 及B 因子,但系统进化分析结果显示,Bf1 同哺乳动物的C2 处于同一进化分支,而Bf2 及Bf3 与哺乳动物B 因子亲缘关心更近(Zhang et al,2014)。与 C2 亲缘关系相近的Bf1 基因的反应时间较Bf2、Bf3 基因要晚很多,同时C4 基因反应不明显且无规律,提示Bf1、C4 两基因可能较少参与早期胚胎发育过程中的补体激活作用或参与时间较晚。由此可以推测,斑马鱼早期胚胎发育过程中补体系统针对LPS 的刺激,主要经由替代途径激活,而经典途径以及凝集素途径参与较少,其实鱼类成体的补体激活也主要通过替代途径进行(Sunyer et al,1998; 王志平等,2008)。实际上,在补体的三条途径中,一般认为替代途径出现最早且最原始,而后出现凝集素途径,最后经过基因组广泛复制后才出现经典途径(王长法等,2004; 余英才等,2012)。
4 结语总之,本研究首次通过显微注射LPS 刺激斑马鱼胚胎的方法,研究了斑马鱼补体基因(C3,C4,C9,Bf1,Bf2,Bf3)及其调节基因(RCA2.1,RCA2.2)的在早期发育中表达模式及其对LPS 的应激反应模式,证明了斑马鱼早期胚胎可以通过替代途径对外界刺激进行补体激活反应。上述研究为探索斑马鱼免疫系统早期发生提供了基础研究资料,相关试验方法也为研究免疫系统的发生提供了新的思路,同时补体系统的发生过程及各补体亚型功能和作用通路还需进一步实验探究。
| 王长法, 张士璀, 王勇军. 2004. 补体系统的进化. 海洋科学,28(8): 55-58 |
| 王志平, 张士璀, 王光锋. 2008. 鱼类补体系统成分及补体特异性和功能的研究进展. 水生生物学报, 32(5): 760-769 |
| 余英才, 张纯, 夏循礼等. 2012. 补体系统的进化. 生命科学, 24(4): 362-367 |
| Boshra H, Li J, Sunyer J O. 2006. Recent advances on thecomplement system of teleost fish. Fish & ShellfishImmunology, 20(2): 239-262 |
| Cheng W, Guo L, Zhang Z H et al. 2006. HNF factors form anetwork to regulate liver-enriched genes in zebrafish.Developmental Biology, 294(2): 482-496 |
| Holland M C H, Lambris J D. 2002. The complement system inteleosts. Fish & Shellfish Immunology, 12(5): 399-420 |
| Jima D D, Shah R N, Orcutt T M et al. 2009. Enhancedtranscription of complement and coagulation genes in theabsence of adaptive immunity. Molecular Immunology,46(7): 1505-1516 |
| Kuo M M, Lane R S, Giclas P C. 2000. A comparative study ofmammalian and reptilian alternative pathway ofcomplement-mediated killing of the Lyme disease spirochete(Borrelia burgdorferi). The Journal of Parasitology, 86(6):1223-1228 |
| Leslie J D, Mayor R. 2013. Complement in animal development:Unexpected roles of a highly conserved pathway. SeminarsImmunology, 25(1): 39-46 |
| Li F L, Zhang S C, Wang Z P et al. 2011. Genes of the adaptiveimmune system are expressed early in zebrafish larvaldevelopment following lipopolysaccharide stimulation.Chinese Journal of Oceanology and Limnology, 29(2):326-333 |
| Nur I, Harada H, Tsujikura M et al. 2013. Molecularcharacterization and expression analysis of threemembrane-bound complement regulatory protein isoforms inthe ginbuna crucian carp Carassius auratus langsdorfii. Fish& Shellfish Immunology, 35(4): 1333-1337 |
| Sakai D. 1981. Heat inactivation of complements and immunehemolysis reactions in rainbow trout, masu salmon, cohosalmon, goldfish and tilapia. Nippon Suisan Gakkaishi,47(5): 565-571 |
| Seeger A, Mayer W E, Klein J. 1996. A complement factor B-likecDNA clone from the zebrafish (Brachydanio rerio). MolecularImmunology, 33(6): 511-520 |
| Sun G N, Li H Y, Wang Y et al. 2010. Zebrafish complementfactor H and its related genes: identification, evolution, andexpression. Functional & Integrative Genomics, 10(4):577-587 |
| Sunyer J O, Lambris J D. 1998. Evolution and diversity of thecomplement system of poikilothermic vertebrates.Immunological Reviews, 166(1): 39-57 |
| Thisse C, Thisse B. 2007. High-resolution in situ hybridization towhole-mount zebrafish embryos. Nature Protocols, 3(1):59-69 |
| Wang Z P, Zhang S C, Wang G F. 2008. Response of complementexpression to challenge with lipopolysaccharide inembryos/larvae of zebrafish Danio rerio: Acquisition ofimmunocompetent complement. Fish & Shellfish Immunology,25(3): 264-270 |
| Wu J, Li H Y, Zhang S C. 2012. Regulator of complementactivation (RCA) group 2 gene cluster in zebrafish:identification, expression, and evolution. Functional &Integrative Genomics, 12(2): 367-377 |
| Zhang S C, Cui P F. 2014. Complement system in zebrafish.Developmental & Comparative Immunology, 46(1): 3-10 |
 2015, Vol. 46
2015, Vol. 46




