
中国海洋湖沼学会主办。
文章信息
- 姜朋, 赵树雨, 李芳, 王宏伟. 2016.
- JIANG Peng, ZHAO Shu-Yu, LI Fang, WANG Hong-Wei. 2016.
- 单条胶黏藻(Dumontia simplex Cotton)孢子早期发育及其生活史的研究
- EARLY DEVELOPMENT OF CARPOSPORES AND LIFE HISTORY OF DUMONTIA SIMPLEX COTTON
- 海洋与湖沼, 47(1): 151-157
- Oceanologia et Limnologia Sinica, 47(1): 151-157.
- http://dx.doi.org/10.11693/hyhz20150600154
-
文章历史
- 收稿日期: 2015-06-01
- 收修改稿日期: 2015-08-16
单条胶黏藻(Dumontia simplex Cotton)隶属于红藻门(Rhodophyta),杉藻目(Gigartinales),胶黏藻科(Dumontiaceae),胶黏藻属(Dumontia Lamouroux),藻体直立,多数丛生,单条不分枝,基部有小盘状固着器,其上有一短细的楔形柄,向上逐渐扩张成为一个倒披针形或线形的扁平叶片,长度可达3—35 cm,宽度有2—22 cm,一般藻体呈紫红色,生长在低潮带的石沼中(图 1)。囊果12月至次年1月成熟,四分孢子囊冬季至春季成熟,除辽宁的大连、长海县外,在山东的青岛、烟台及威海等地均有分布(夏邦美,2004; 曾呈奎,2009)。
 |
| 图 1 单条胶黏藻的野外生境 Fig. 1 Habitat of D. simplex from Fujiazhuang, Dalian |
单条胶黏藻具有较高食用价值,含有较多蛋白质和多糖(Su et al,2004)。夏邦美(2004)及曾呈奎(2009)对其外部形态、内部构造进行了研究。Saunders(2005)对单条胶黏藻细胞色素c氧化酶亚基I(COI)基因序列进行了分析,Saunders等(2011)又对其进行了核酮糖1,5-二磷酸梭化酶/氧化酶大亚基(rbcL)基因和核糖体大亚基(LSUrRNA)基因序列的分析等。温度、光强和盐度是影响海藻生长、发育等生命活动的重要因子(王波等,2007; Chen et al,2012; 丁兰平等,2013),但有关环境因子对该藻的孢子发育影响及生活史方面尚未见报道。
本文通过开展温度、光强和盐度等环境因子对单条胶黏藻孢子早期发育影响的研究,探讨其孢子发生类型和生活史,旨在为单条胶黏藻的种质保存、育苗和人工养殖提供理论依据。
1 材料与方法 1.1 材料采集单条胶黏藻标本于2014年1月15日和2014年2月15日采于大连市付家庄低潮带的石沼中,分别将带有成熟囊果的雌配子体、带有四分孢子囊的四分孢子体活体置于盛有海水的保温箱中,带回实验室。
实验用海水取自付家庄海域的天然海水,经ST20S手持式盐度计(购自美国Ohaus公司)测量,海水盐度为30。
1.2 材料预处理将天然海水经过滤、灭菌,冷却后用于实验。不同盐度的海水,是通过将灭菌后的海水蒸发浓缩,再经蒸馏水稀释后获得。
将四分孢子体和雌配子体进行藻体表面去污处理,使用解剖针和软毛刷轻轻去除藻体表面的附着物,再以灭菌的海水将其冲洗数次。将处理后的藻体分别暂养于已灭菌的玻璃缸(20 cm×10 cm×10 cm)中,玻璃缸底部铺满载玻片,倒入消毒海水并充气培养,暂养条件为温度12°C、光照强度160 μmol/(m2∙s)、盐度30,光周期为光(L)︰暗(D)=12︰12。经过约24h的暂养,将载玻片取出放在显微镜(Nikon 216987)下观察,待视野中(10×10倍)观察到的孢子附着量达到20—25个时,取出进行后续培养及观察实验。
1.3 实验设计温度组试验: 温度设置为6、9、12、15、20、30°C六个梯度,光照强度设置为160 μmol/(m2∙s),盐度为30,光照周期为L:D=12︰12。
光照强度组试验: 光照强度设置为80、120、160、200、240、300、400 μmol/(m2∙s)七个梯度,温度为12°C,盐度为30,光照周期为L︰D=12︰12。
盐度组试验: 盐度设置为15、20、25、30、35、40、50七个梯度,温度为12°C,光强为160 μmol/(m2∙s),光照周期为L:D=12:12。
每组实验重复3次,将已经附着了果孢子和四分孢子的载玻片分别放入灭菌后的D15 cm培养皿中并编码,倒入相应处理的polyethersulphone(PES)培养液(PES培养液是PES原液:灭菌海水=1:49,每1000mL的培养液中加2 mg的GeO2,防止硅藻生长)至培养皿2/3体积处,将培养皿放置在相应条件的光温控制培养箱中持续培养,培养过程中每4天更换1次培养液。
1.4 观察方法与统计分析培养期间每2天一次取出载玻片观察孢子的萌发情况,用Olympus BH2数码相机(Olympus Beijing Co. Ltd.,China)照相保存,形成盘状体后即测量其直径,随后每周每组随机抽取10个盘状体测量一次。盘状体平均相对生长速率利用公式求得:
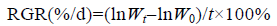
雌配子体表面形成的囊果较小,散生于内皮层,呈小斑点状(图 2a),暂养条件下培养约24h,果孢子放散后附着在载玻片上,单个附着或多个附着于一起,呈黄褐色,近球形,直径为5—10 μm,内含有红色和黄褐色色素(图 2b)。果孢子附着后开始分裂成四个细胞后并在此基础不断分裂(图 2c),分裂期内细胞生长不显著,继续培养,整个细胞团的细胞数量增长明显,显微镜下观察的细胞团仍为近球形(图 2d—e)培养到第6—8天时细胞团的直径达到约60 µm,形成了一个圆盘形的结构,并出现了顶细胞和基细胞的分化,该结构发育成了盘状体(图 2f)。进入盘状体生长阶段,细胞仍然不断分裂,盘状体开始不断地生长、增大(图 2g—h),培养到30天左右时,盘状体停止生长,其一侧隆起,继续分裂伸长形成直立枝(图 2i)。
 |
| 图 2 单条胶黏藻果孢子的萌发过程 Fig. 2 The development of carpospores of D. simplex a. 雌配子体上囊果分布; b. 附着后的果胞子; c. 果孢子开始进行分裂; d—e. 细胞团不断分裂生长; f. 细胞团发育成盘状体; g—h. 盘状体逐渐伸长变大; i. 盘状体萌发出直立枝 |
四分孢子的早期发育情况与果孢子基本一致。
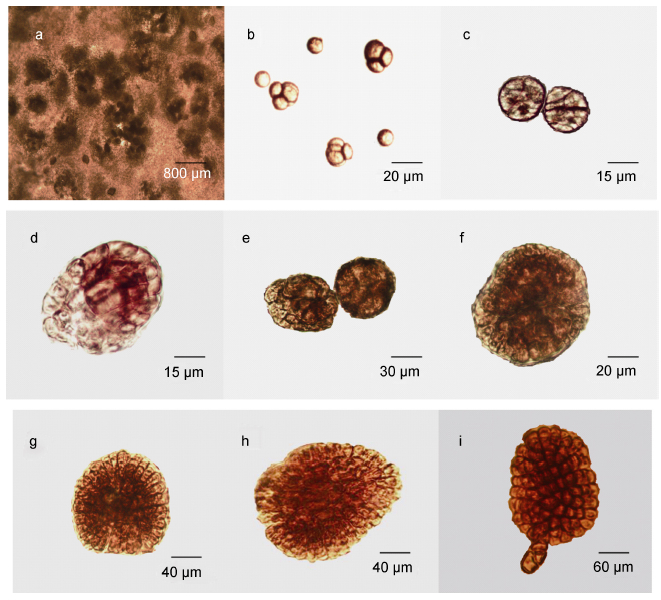
2.2 温度对孢子早期发育的影响温度对果孢子早期发育影响如图 3所示。温度为6°C时,盘状体增长缓慢,第36天时直径接近190 μm,相对生长速率为4.34%; 温度为9°C时,果孢子最先萌发出盘状体,且盘状体直径增长最快,初始盘状体直径达到60 μm,第36天时为290 μm,相对生长速率为5.53%; 温度12°C时盘状体增长较快,36天时直径达到240 μm,相对生长速率为4.98%; 温度为15°C和20°C时,果孢子萌发少许且盘状体生长十分缓慢,培养到后期无法萌发出直立芽体; 温度为30°C时,果孢子不萌发。适合果孢子生长的温度范围为9— 12°C,对其生长影响的优劣顺序为9°C > 12°C > 6°C > 15°C,最适培养温度为9°C。
 |
| 图 3 温度对培养36天果孢子的发育影响 Fig. 3 Effect of temperature on the development of carpospores cultured for 36 days |
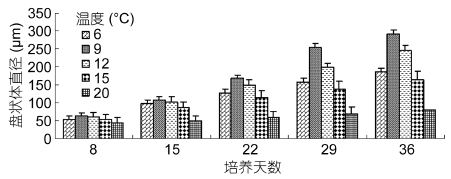
温度对四分孢子早期发育影响见图 4。温度为6°C时,培养34天时盘状体直径为210 μm,相对生长速率为4.79%; 在9°C和12°C时盘状体发育最快,培养34天的直径都接近300 μm,相对生长速率分别为5.48%和5.49%; 温度为15°C时,盘状体发育较快,第34天的直径和相对生长速率分别为230 μm、4.89%; 温度为20°C时四分孢子萌发少许,盘状体生长十分缓慢; 温度为30°C时,四分孢子不萌发。以上分析看出,影响盘状体生长的优劣顺序为9°C=12°C > 15°C > 6°C > 20°C > 30°C,最适温度范围为9—12°C。
 |
| 图 4 温度对培养34天四分孢子发育的影响 Fig. 4 Effect of temperature on the development of tetraspore cultured for 34 days |
图 5表示光照强度对果孢子早期发育的影响。光照强度为80 μmol/(m2·s)时,盘状体生长缓慢,培养36天的相对生长速率为3.57%; 光强120 μmol/(m2·s)下的盘状体在培养36天时直径接近210 μm,相对生长速率为4.42%; 光强为160 μmol/(m2·s)时,盘状体发育最快,第36天时直径接近300 μm,相对生长速率为5.36%; 光强为200 μmol/(m2·s)时,第36天时盘状体直径约为240 μm,相对生长速率分别为4.78%; 光强为240 μmol/(m2·s)和300 μmol/(m2·s)时,盘状体的生长受到明显抑制,培养36天的相对生长速率分别为3.69%和0.10%。光强为400 μmol/(m2·s)时,盘状体培养到后期逐渐死亡。以上分析表明,在适宜盘状体生长的光照强度范围内,优劣顺序为160 μmol/(m2·s)> 200 μmol/(m2·s)> 120 μmol/(m2·s)。
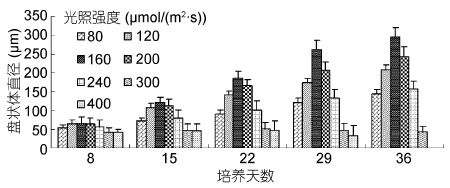 |
| 图 5 光强对培养36天果孢子发育的影响 Fig. 5 Effect of light intensity on the development of carpospores cultured for 36 days |
光照强度对四分孢子早期发育的影响见图 6。光强为80 μmol/(m2·s)时,盘状体的生长受到明显抑制,培养34天时相对生长速率仅为3.74%; 光强为120、160、200、240 μmol/(m2·s)时,盘状体增长较快,取培养34天盘状体直径计算相对生长速率,分别为光强120 μmol/(m2·s)下的4.56%、160 μmol/(m2·s)下的5.54%、200 μmol/(m2·s)下的5.48%和240 μmol/(m2·s)下的4.71%; 高光强300 μmol/(m2·s)和400 μmol/(m2·s)下盘状体增长又受到明显抑制,盘状体萌发少许,后期大量死亡,光强300 μmol/(m2·s)下相对生长速率为3.48%。以上分析表明,影响盘状体生长的趋势为160 μmol/(m2·s)= 200 μmol/(m2·s)> 240 μmol/(m2·s)> 120 μmol/(m2·s)> 80 μmol/(m2·s)> 300 μmol/(m2·s)> 400 μmol/(m2·s),四分孢子生长的适宜范围为120— 240 μmol/(m2·s),最适培养光强为160—200 μmol/(m2·s)。
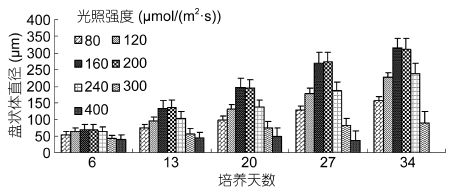 |
| 图 6 光强对培养34天四分孢子发育的影响 Fig. 6 Effect of different light intensity on the development of tetraspore cultured for 34 days |
不同盐度条件下对由果孢子发育成的盘状体进行直径测量,培养初期生长差距不明显,培养到后期各个时间点上的生长差距逐渐加大(图 7)。盐度为15时,盘状体的生长受到明显抑制,发育缓慢; 盐度范围为20、25、30、35时,盘状体生长较快,取培养36天的盘状体计算相对生长速率,在盐度20时为4.10%、盐度25时为5.04%、盐度30时为5.53%和盐度35时为4.69%; 盐度为40和50时,盘状体的生长又受到明显抑制,培养到后期出现盘状体大量死亡的情况。以上分析表明,在适合盘状体生长的盐度范围内,盐度影响其生长的关系为30 > 25 > 35 > 20,盐度为30时盘状体生长最好。
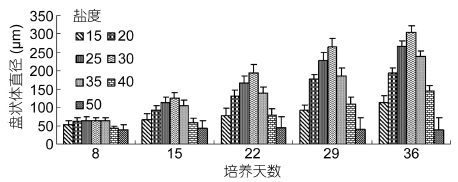 |
| 图 7 盐度对培养36天果孢子发育的影响 Fig. 7 Effect of seawater salinity on the development of carpospores cultured 36 days |
盐度对四分孢子生长影响与果孢子一致。
2.5 生活史图 8展示了单条胶黏藻生活史,根据生殖发育可将其分为有性生殖和无性生殖两个阶段。
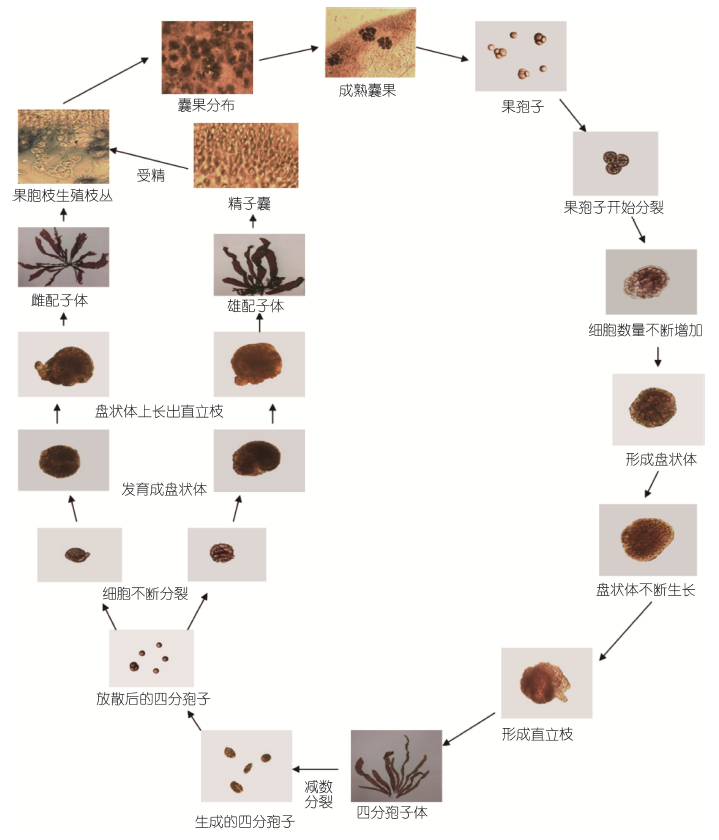 |
| 图 8 单条胶黏藻的生活史 Fig. 8 The life history of D. simplex |
在有性生殖阶段,雄配子体外皮层细胞分裂生成精子囊母细胞,经有丝分裂生成精子囊,精子囊多聚集成群,成熟后释放精子。雌配子体内皮层细胞分化生成了辅助细胞枝丛和果胞枝丛,均由3—7个细胞组成,末端细胞分别为辅助细胞和果胞。游离的精子通过受精丝与果胞内卵子结合形成合子; 受精后,果胞与下位细胞融合产生联络丝; 合子通过联络丝进入辅助细胞并与之融合发育,随后产生产孢丝,该产孢丝向外形成幼果孢子囊,并不断成熟为果孢子囊; 同时由辅助细胞产生的营养丝与周围的髓丝混杂,围绕产孢丝细胞形成一个丝状囊果被,并与果孢子囊一起形成近球形的果孢子体(囊果),果孢子体顶端具小囊孔,寄生于雌配子体中,成熟后的果孢子体通过小囊孔释放二倍体的果孢子。果孢子发育成盘状体后继续生长至萌发出直立枝,直立枝生长成四分孢子体。
在无性生殖阶段,四分孢子体成熟后分化出四分孢子囊,侧生于内皮层细胞,四分孢子囊聚集成群,囊内的原生质体经减数分裂形成4个单倍体的孢子,为四分孢子。四分孢子外形相同,但有性别分化,成熟后即脱离母体,其萌发与果孢子相类似,分别萌发成雄配子体或雌配子体。
由上述结果可知,单条胶黏藻的生活史是由单倍的雌、雄配子体和二倍的果孢子体及四分孢子体构成,配子体和四分孢子体外形一致,交替出现,属于典型的同型世代交替。
3 讨论我们观察到单条胶黏藻果孢子和四分孢子的发生类型均为直接盘状体型,即孢子发育成盘状体的过程中无任何形式的丝状体出现。在培养中发现,盘状体直径范围220—320 μm时萌发出直立枝,之前有报道,舌状蜈蚣藻[Grateloupia livida(Harv.)Yamada]和角叉菜(Chondrus ocellatus Holmes)的盘状体分别在直径达到250—300 μm和200—320 μm时萌发出直立芽体(陈伟洲等,2013; Li et al,2010),由此可见,不同红藻的盘状体萌发出直立芽体时的直径各不相同。另外,我们还发现,两个或多个孢子能联合成一个超级盘状体(图 9),这种早期发生的盘状体自融合
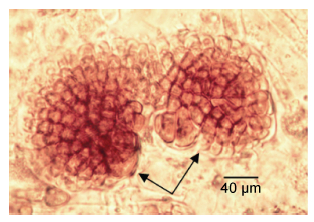 |
| 图 9 超级盘状体 Fig. 9 Coalescence with different spores |
现象,在其他红藻中均有报道(Orduña-Rojas et al,1999; Li et al,2010; Zhao et al,2010)。我们认为,融合后的盘状体面积增大,可增加其固着能力,这与该红藻在潮间带栖息适应能力有关。因为大面积固着可以增加其抗海流的影响,增加直立枝产生及成苗形成,因此,盘状体的融合对单条胶黏藻孢子早期发育有重要的作用。
温度是影响红藻生长发育的主要因子之一,许多研究结果都证明了这一点(Rietema,1982; 汤晓荣等,1997)。对单条胶黏藻果孢子和四分孢子进行培养观察,发现其生长最适温度略有不同,其中四分孢子对温度的耐受性更强,但孢子在温度范围9—12°C时
的发育效果均优于其他条件,这表明孢子适合生长于低温条件,但温度太低(6°C以下)则不利于其生长。这与其他红藻孢子发育有差异,如舌状蜈蚣藻[G. livida(Harv.)Yamada]和带形蜈蚣藻(G. turuturu Yamada)孢子最适发育温度分别为25—30°C和25°C(陈伟洲等,2013; Wei et al,2013),亚洲蜈蚣藻(G. asiatica Kawaguchi et Wang)和细弱蜈蚣藻(G. tenuis Wang et Luan)孢子最适发育温度为20°C和24°C(Adharini et al,2014; 曹翠翠等,2015),而与同属的D. contorta(S. G. Gmelin)Ruprecht最为接近(最适培养温度为12°C)(Rietema et al,1982)。自然环境中,单条胶黏藻生长在冬季和春季,初春季节大连附近黄渤海海区的海面温度在10°C以下(汤明义等,1986),这与低温更适合单条胶黏藻孢子生长结果相符。
实验室条件下,四分孢子与果孢子相比,对光强耐受能性更强,但在120—200 μmol/(m2·s)时,两者发育成的盘状体均生长较快,相对生长速率大,这与D. contorta(S. G. Gmelin)Ruprecht最适培养光强为160 μmol/(m2·s)相接近(Rietema,1982); 当光强高于240 μmol/(m2·s)时,其盘状体生长缓慢,这说明高光强明显抑制盘状体的生长、发育。据报道,光强也会影响海藻的垂直分布(Satoh et al,1983; Gevaert et al,2002),本研究观察到单条胶黏藻位于低潮带和潮下带缘区,暴露在强光照下时间较短,故推测单条胶黏藻的饱和光强很弱,这与其生长在冬季、春季的时间相吻合。因为春季光强明显弱于夏季,初春到夏末海面光强升高很多,期间单条胶黏藻生活在低潮带和潮下带缘的石沼中和岩石上,随着潮汐涨落会暴露在阳光下,过高光强会抑制其生长。
盐度是影响海藻生长的重要环境因子(丁兰平等,2013; Guo et al,2015; 朱晓文等,2015)。一般来讲,单条胶黏藻孢子生长盐度范围为20—35,高盐和低盐均能抑制其正常生长、发育。另外,盐度不仅影响海藻的生物量,还能影响其垂直分布(Fong et al,1996; Iwamoto et al,2003),单条胶黏藻生长于低潮带的石沼中,暴露在空气中的时间较短,因海水蒸发或降水引发盐度变化不太大,我们检测到暴露在潮间带石沼中的海水盐度为33,这与本研究设置的盐度35较接近,因此,单条胶黏藻孢子适宜生长在20—35的盐度范围内。
我们通过培养发现,单条胶黏藻四分孢子和果孢子外形相同,但最适培养条件下,四分孢子从孢子附着到萌发出直立枝所用时间比果孢子平均短了4天,故推测,这与四分孢子和果孢子最适培养条件存在差异有关。另外,从培养孢子所需时间来看,其生活史的完成约需要半年,对生长在潮间带成熟藻体的季节性变化调查时发现其冬季出现、6月份解体,与实验室条件得出的结果相一致。
4 结论(1)单条胶黏藻孢子(果孢子和四分孢子)的发育过程中无丝状体出现,发育类型为直接盘状体型。
(2)温度、光强和盐度对孢子(果孢子和四分孢子)的早期发育均有影响。其中果孢子发育最适条件为温度9°C、光强160 μmol/(m2·s)和盐度30,四分孢子发育最适条件为温度9—12°C、光强160—200 μmol/(m2·s)和盐度30,四分孢子与果孢子相比,对温度和光强的耐受性强,对盐度的耐受性相同。
(3)单条胶黏藻的生活史由单倍的雌、雄配子体和二倍的果孢子体及四分孢子体构成,配子体和四分孢子体外形一致,交替出现,属于典型的同型世代交替。
| 丁兰平,张国栋,黄冰心等,2013.温度和盐度对刺枝鱼栖苔(Acanthophora spicifera)(红藻门,松节藻科)生长及其几种光合色素的影响.海洋与湖沼, 44(4):913-918 |
| 王波,宋凤斌,张金才,2007.植物耐盐性研究进展.农业系统科学与综合研究, 23(2):212-216 |
| 朱晓文,赵卫红,苗辉,2015.盐度胁迫下中肋骨条藻和东海原甲藻的生长及内源多胺含量的变化.海洋与湖沼, 46(1):50-57 |
| 汤明义,曲如美,孟庆莲等,1986.黄渤海海表面多年旬平均水温分布图图集.海洋学报, 5(4):80-81 |
| 汤晓荣,费修绠,1997.光温与坛紫菜自由丝状体生长发育的关系.海洋与湖沼, 28(5):475-482 |
| 陈伟洲,宋志民,黄忠坚,2013.温度、光照强度对舌状蜈蚣藻早期发育的影响.南方水产科学, 9(6):14-19 |
| 夏邦美,2004.中国海藻志(第二卷,红藻门,第三册石花菜目隐丝藻目胭脂藻目).北京:科学出版社, 41-45 |
| 曹翠翠,赵凤琴,郭少茹等,2015.主要环境因子对细弱蜈蚣藻(Grateloupia tenuis)孢子发育的影响及生活史的研究.海洋与湖沼, 46(2):298-304 |
| 曾呈奎,2009.中国黄渤海海藻.北京:科学出版社, 134-140 |
| Adharini R I, Kim H G,2014. Developmental pattern of crust into upright thalli of Grateloupia asiatica (Halymeniaceae, Rhodophyta). Journal of Applied Phycology, 26(4):1911-1918 |
| Chen M, Tang Y L,2012. Investigation on the detrimental effects of salt stress on photosynthesis of Spirulina platensis. Agricultural Science & Technology, 13(8):1625-1627,1770 |
| Fong P, Boyer K E, Desmond J S,1996. Salinity stress, nitrogen competition, and facilitation:what controls seasonal succession of two opportunistic green macroalgae? Journal of Experimental Marine Biology and Ecology, 206(1-2):203-221 |
| Gevaert F, Creach A, Davoult D et al,2002. Photo-inhibition and seasonal photosynthetic performance of the seaweed Laminaria saccharina during a simulated tidal cycle:Chlorophyll fluorescence measurements and pigment analysis. Plant, Cell & Environment, 25(7):859-872 |
| Guo H, Yao J T, Sun Z M et al,2015. Effects of salinity and nutrients on the growth and chlorophyll fluorescence of Caulerpa lentillifera. Chinese Journal of Oceanology and Limnology, 33(2):410-418 |
| Iwamoto K, Kawanobe H, Ikawa T et al,2003. Characterization of salt-Regulatedmannitol-1-Phosphate dehydrogenase in the red alga Caloglossa continua. Plant Physiology, 133(2):893-900 |
| Li X, Zhao P, Wang G G et al,2010. Effects of temperature and irradiance on early development of Chondrus ocellatus Holm (Gigartinaceae, Rhodophyta). Chinese Journal of Oceanology and Limnology, 28(3):508-513 |
| Orduña-Rojas J, Robledo D,1999. Effects of irradiance and temperature on the release and growth of carpospores from Gracilaria cornea J. Agardh (Gracilariales, Rhodophyta). Botanica Marina, 42(4):315-319 |
| Rietema H,1982. Effects of photoperiod and temperature on macrothallus initiation in Dumontia contorta (Rhodophyta). Marine Ecology Progress Series, 8(2):187-196 |
| Rietema H, Breeman A M,1982. The regulation of the life history of Dumontia contorta in comparison to that of several other Dumontiaceae (Rhodophyta). Botanica Marina, 25(12):569-576 |
| Satoh K, Fork D C,1983. A new mechanism for adaptation to changes in light intensity and quality in the red alga Porphyra perforata. Plant Physiology, 71(3):673-676 |
| Saunders G W,2005. Applying DNA barcoding to red macroalgae:a preliminary appraisal holds promise for future applications. Philosophical Transactions of the Royal Society B:Biological Sciences, 360(1462):1879-1888 |
| Saunders G W, Lindstrom S C,2011. A multigene phylogenetic assessment of the Dilsea/Neodilsea species complex (Dumontiaceae, Gigartinales) supports transfer of Neodilsea natashae to the genus Dilsea. Botanica Marina, 54(5):481-486 |
| Su X R, Liu H H, Paul C K,2004. Main nutritional contents of 30 Dalian coastal microalgae species. Chinese Journal of Oceanology and Limnology, 22(4):436-439 |
| Wei X J, Shuai L M, Lu B J et al,2013. Effects of temperature and irradiance on filament development of Grateloupia turuturu (Halymeniaceae, Rhodophyta). Journal of Applied Phycology, 25(6):1881-1886 |
| Zhao F J, Zhao Z G, Wang A H et al,2010. Carpospore early development and callus-like tissue induction of Chrysymenia wrightii (Rhodymeniaceae, Rhodophyta) under laboratory conditions. Journal of Applied Phycology, 22(2):195-202 |
 2016, Vol. 47
2016, Vol. 47


