
中国海洋湖沼学会主办。
文章信息
- 何杰, 吴旭干, 龙晓文, 赵恒亮, 姜晓东, 王幼鹏, 成永旭. 2016.
- HE Jie, WU Xu-Gan, LONG Xiao-Wen, ZHAO Heng-Liang, JIANG Xiao-Dong, WANG You-Peng, CHENG Yong-Xu. 2016.
- 中华绒螯蟹(Eriocheir sinensis)野生和养殖蟹种对池塘养殖成蟹可食率和营养品质的影响研究
- COMPARISON IN EDIBLE YIELD AND NUTRITIONAL QUALITY OF POND-CULTURED ADULT ERIOCHEIR SINENSIS FROM WILD-CAUGHT AND POND-REARED CRABSEEDS
- 海洋与湖沼, 47(1): 140-150
- Oceanologia et Limnologia Sinica, 47(1): 140-150.
- http://dx.doi.org/10.11693/hyhz201401
-
文章历史
- 收稿日期: 2015-11-26
- 收修改稿日期: 2015-12-29
2. 浙江海洋大学海洋与渔业研究所 舟山316002;
3. 上海海洋大学 上海市教委水产动物遗传育种协同创新中心 上海 201306;
4. 宿迁旭邦水产科技有限公司泗洪 223900
2. Marine and Fishery Research Institute of Zhejiang Ocean University, Zhoushan 316002, China;
3. Collaborative Innovation Center of Aquatic Animal Breeding Center Certificated by Shanghai Municipal Education Commission, Shanghai Ocean University, Shanghai 201306, China;
4. Suqian Xubang Fisheries Science and Technology Co., Ltd., Sihong 223900, China
中华绒螯蟹(Eriocheir sinensis)俗称河蟹,因其具有营养丰富、风味独特等优点,已成为我国重要的养殖经济蟹类(He et al,2014)。自20世纪80年代以来,河蟹人工育苗技术取得突破,增养殖在全国各地迅速推广,2013年全国河蟹养殖总产量达72.99万吨(农业部渔业渔政管理局,2014),其中长江流域作为我国河蟹的主产区,主要养殖长江水系河蟹,产量占全国总产量的90%左右(王武等,2013)。近年来,由于育苗场持续采用小规格亲本进行人工育苗、近亲繁殖和不同水系间的盲目引种等原因,长江水系河蟹养殖群体种质退化越趋严重,导致商品蟹规格变小和品质下降(Sui et al,2009; 王武等,2013)。先前的研究表明,与长江水系河蟹养殖群体相比,长江野生蟹种在池塘养殖条件下具有养成成体规格大、性腺成熟晚等特点,总体上表现出更好的养殖性能(He et al,2014),因此采用长江野生河蟹作为基础群体进行良种选育具有一定的可行性(何杰等,2015a)。
先前研究表明,在相同养殖条件下,不同种群的同种水生动物营养组成可能存在较大差异,且可以通过遗传育种进行品质改良(Neira et al,2004; Grahl-Nielsen et al,2010)。迄今为止,尚不清楚养殖群体河蟹品质退化是否与遗传因素有关,这不利于开展河蟹的品质育种工作。性腺、肝胰腺和肌肉是河蟹主要的可食用组织,这些组织中的常规营养成分、必需脂肪酸和必需氨基酸组成是评价其营养品质的重要依据(Chen et al,2007; Wu et al,2007)。另外,饵料、养殖环境和遗传因素均可能影响河蟹可食率和营养品质(朱清顺等,2007; Shao et al,2013,2014; 马明君,2015),有研究表明,长江野生和池塘养殖河蟹在可食率、感官评价、常规生化组成、脂肪酸和氨基酸组成等方面均存在显著差异(朱清顺等,2007; 马明君,2015); 由于长江野生河蟹和池塘养殖河蟹在生长环境和饵料组成均存在较大差异(何杰等,2015b),尚无法确定这种差异是否与遗传因素有关。鉴于此,本研究在相似的池塘养殖条件下,采用长江水系野生和养殖群体河蟹蟹种进行成蟹养殖,首先比较了其养成成蟹的性腺指数、肝胰腺指数、出肉率、总可食率和肥满度等生物学参数,在此基础上测定和比较了肝胰腺、性腺和肌肉中的常规营养组成、脂肪酸和氨基酸组成,以期为河蟹的品质选育和营养调控提供参考,同时也为野生蟹种的合理开发利用提供依据。
1 材料与方法 1.1 扣蟹来源及实验设计长江水系野生蟹种于2013年3月捕捞自长江镇江江段(32°11’ N,119°27’ E),为渔民采用小型拖网捕捞而得; 池塘养殖蟹种取自上海海洋大学崇明蟹种养殖基地,为未经遗传选育的常规养殖群体。从两群体中分别挑选规格接近、肢体完整的健康蟹种备用于实验,野生蟹种雌雄平均体重分别为(6.58±0.55)g和(6.95±0.74)g,池塘养殖蟹种平均体重分别为(6.31±0.62)g和(6.45±0.67)g。蟹种养成实验在上海崇明雨池水产养殖合作社进行,选择六口面积相等的室外土池(长×宽×深=85m×55m×1.5m)进行成蟹养殖实验,蟹种放养密度均为10000只/hm2,放养前采用30mg/L的聚维酮碘溶液浸泡消毒0.5h。
1.2 养殖管理2013年2月使用漂白粉对实验池塘进行整体消毒,10d后种植伊乐藻,伊乐藻株距为1.5m,行距为2m。为调控水质和控制野杂鱼数量,在每口池塘内放养20条白鲢和50条鳜鱼鱼种。同时投放600kg螺蛳作为成蟹的补充饵料,以清除残饵和粪便等,保持水质清新。
实验于4月1日开始正式投喂,每日下午17:00左右按表 1进行投喂,每个池塘放置一个食台以观察摄食情况,投喂后3—4h检查食台上残饵情况,根据水温和摄食情况调整投喂量。养殖期间,根据伊乐藻的长势控制水位,高温期水位一般在1—1.2m左右,必要时割除池塘中过多的伊乐藻,防止夜间和阴雨天缺氧。8月份在各池塘中补种适量水花生供蟹隐蔽和蜕壳。6—9月,每15d全池泼洒聚维酮碘进行水体消毒或者采用微生态制剂调节水质,夜间采用微孔增氧设施进行池塘底部增氧。养殖期间,定期测定水质(包括溶氧、pH、氨氮和亚硝酸盐等指标),根据实际情况不定期换水,每次换水10%—30%,维持良好水质,从而有利于河蟹在成蟹养殖过程中的正常生长和发育,实验期间pH为7.0—8.5,氨氮<0.4mg/L,亚硝酸盐<0.05mg/L,这些水质指标均在河蟹养殖的适宜范围内。每日测定和记录各池塘的平均水温。
| 饲料种类 | 粒径(mm) | 粗蛋白含量(%) | 总脂含量(%) | 投喂时间 |
| 成蟹1# | 2.0 | 41.3 | 10.4 | 4月—6月中 |
| 成蟹2# | 2.5 | 38.8 | 9.5 | 6月中—8月中 |
| 成蟹3# | 3.5 | 37.3 | 7.5 | 8月底—11月底 |
11月28日,从每口实验池塘中随机取8只蟹(雌雄各半),用吸水纸擦干蟹体表水分后,准确称重(精确度0.01g),用游标卡尺(精确度0.001mm)测量壳长、壳宽后进行活体解剖,用镊子等工具取出全部肝胰腺、性腺和肌肉,并精确称重(精确到0.001g)后分别计算每只蟹的肝胰腺指数[hepatosomatic index,HSI(%)]、性腺指数[gonadosomatic index,GSI(%)]、出肉率[meat yield,MY(%)]、总可食率[total edible yield,TEY(%)]及肥满度[condition factor,CF(%)]。
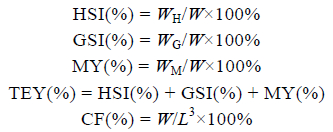
常规营养组成分析: 采用AOAC(1995)的方法测定水分和蛋白质含量; 按Folch等(1957)法,采用氯仿:甲醇(V/V=2: 1)提取各组织中的总脂并测定其含量; 以葡萄糖为标样,采用苯酚-硫酸法测定碳水化合物含量(Kocher et al,1978)。
脂肪酸组成分析: 根据吴旭干等(2014)的方法进行脂肪酸分析,具体采用14%的三氟化硼-甲醇溶液对总脂进行甲酯化处理,然后旋转蒸发到所需浓度进行脂肪酸分析,所用仪器为美国Agiltent公司生产的高效气相色谱仪6890A(G1530A)。
氨基酸分析: 按照Chen等(2007)的方法进行总氨基酸分析,所用仪器为德国赛卡姆公司氨基酸自动分析仪(S-433D)。色氨酸测定采用碱性水解法,甲硫氨酸和半胱氨酸测定采用酸性水解法(Spindler et al,1984),分析方法如上。另外,根据FAO等(1985)方法计算必需氨基酸的分值(essential amino acid score,EAAS):
EAAS = 样品中必需氨基酸含量/FAO参考蛋白中必需氨基酸含量×100
1.5 数据处理所有数据采用平均值±标准误(Mean±SE)表示。采用SPSS 17.0软件对实验数据进行统计分析,用Levene法进行方差齐性检验,当数据不满足齐性方差时对百分比数据进行反正弦或者平方根处理,用t检验(Independent samples t-test)检查两群体间各指标的差异性,取P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析 2.1 两群体成蟹的组织系数和可食率由表 2可见,在体重接近的条件下,无论雌体还是雄体,野生和养殖蟹种养成商品蟹的肝胰腺指数和性腺指数均存在显著差异(P<0.01),即野生群体的肝胰腺指数显著高于养殖群体,而性腺指数显著低于养殖群体; 而两群体间的出肉率、总可食率及肥满度均较为接近,无显著差异(P>0.05)。
| 项目 | 雌体 | 雄体 | ||||
| 野生 | 养殖 | P | 野生 | 养殖 | P | |
| 体重(g) | 137.39±5.22 | 133.63±2.77 | 0.281 | 178.04±4.18 | 178.13±5.39 | 0.982 |
| 甲壳长(mm) | 60.31±0.78 | 60.07±0.48 | 0.647 | 63.68±0.98 | 63.46±0.68 | 0.880 |
| 甲壳宽(mm) | 67.73±0.99 | 66.48±0.62 | 0.072 | 71.56±1.60 | 70.58±0.53 | 0.060 |
| 肝胰腺指数(%) | 7.21±0.40 | 6.11±0.29 | 0.001 | 7.89±1.30 | 6.42±0.34 | 0.000 |
| 性腺指数(%) | 9.15±0.51 | 10.96±0.56 | 0.000 | 2.61±0.17 | 3.09±0.28 | 0.023 |
| 出肉率(%) | 18.99±0.83 | 19.17±0.76 | 0.787 | 21.76±1.32 | 21.90±1.04 | 0.891 |
| 总可食率(%) | 35.35±0.98 | 36.23±0.97 | 0.277 | 32.26±3.13 | 31.41±1.08 | 0.428 |
| 肥满度(%) | 62.51±0.78 | 61.64±0.65 | 0.351 | 70.04±0.85 | 69.95±1.02 | 0.285 |
野生和养殖蟹种经池塘养成成蟹的肝胰腺、性腺及肌肉的常规生化成分见表 3。无论雌体还是雄体,野生群体和养殖群体肝胰腺中的水分、粗蛋白和粗脂肪含量较为接近,野生群体肝胰腺中的碳水化合物含量略高于养殖群体,但两者雄体肝胰腺中存在显著差异(P<0.01); 就性腺而言,两群体间仅野生雄蟹的碳水化合物含量显著高于养殖雄蟹,无论雌体还是雄体,两群体其余各常规营养成分均较为接近; 就肌肉而言,无论是雌体还是雄体,野生群体的粗蛋白含量显著低于养殖群体,而野生雄体的粗脂肪含量和野生雌体的碳水化合物显著高于养殖群体的对应性别成蟹(P<0.05)。
| (%湿重) | ||||||
| (% wet weight) | ||||||
| 项目 | 雌体 | 雄体 | ||||
| 野生 | 养殖 | P | 野生 | 养殖 | P | |
| 肝胰腺 | ||||||
| 水分(%) | 50.19±4.02 | 45.37±1.16 | 0.283 | 49.46±0.68 | 50.87±2.58 | 0.609 |
| 粗蛋白(%) | 8.72±0.64 | 8.67±0.29 | 0.530 | 8.56±0.52 | 9.98±0.59 | 0.069 |
| 粗脂肪(%) | 40.93±6.11 | 44.17±2.54 | 0.638 | 44.03±1.04 | 39.34±3.80 | 0.269 |
| 碳水化合物(%) | 1.20±0.10 | 1.12±0.25 | 0.799 | 1.51±0.12 | 1.04±0.14 | 0.033 |
| 性腺 | ||||||
| 水分(%) | 49.37±0.55 | 49.76±0.69 | 0.668 | 71.30±0.61 | 70.65±0.39 | 0.397 |
| 粗蛋白(%) | 30.72±0.42 | 30.98±0.47 | 0.682 | 18.76±0.34 | 19.45±0.25 | 0.139 |
| 粗脂肪(%) | 17.56±0.39 | 17.17±0.40 | 0.509 | 0.64±0.02 | 0.63±0.01 | 0.539 |
| 碳水化合物(%) | 1.53±0.04 | 1.49±0.04 | 0.500 | 0.29±0.02 | 0.22±0.01 | 0.027 |
| 肌肉 | ||||||
| 水分(%) | 76.98±0.55 | 76.58±0.52 | 0.614 | 77.57±0.35 | 76.97±0.14 | 0.156 |
| 粗蛋白(%) | 17.65±0.26 | 18.88±0.44 | 0.042 | 17.89±0.24 | 18.95±0.22 | 0.013 |
| 粗脂肪(%) | 1.12±0.04 | 1.09±0.04 | 0.597 | 1.20±0.03 | 1.11±0.02 | 0.042 |
| 碳水化合物(%) | 0.96±0.10 | 0.64±0.04 | 0.017 | 0.65±0.05 | 0.62±0.04 | 0.682 |
两群体成蟹肝胰腺的脂肪酸组成见表 4。就雌体而言,野生群体肝胰腺中的C16:0和C18:1n9含量显著高于养殖群体,但野生群体的C17:1n、C18:2n6、C20:5n3和C22:6n3含量显著低于养殖群体(P<0.05); 就雄体而言,野生群体肝胰腺中C18:1n9显著高于养殖群体,但C17:0、C18:0、C17:1n、C20:4n6、C20:5n3和C22:6n3含量显著低于养殖群体。整体上,无论雌体还是雄体,野生群体肝胰腺中的单不饱和脂肪酸(MUFA)/span>含量显著高于养殖群体,但是高度不饱和脂肪酸(HUFA)和n3/n6比例显著低于养殖群体。
| (%总脂肪酸) | ||||||
| (% total fatty acids) | ||||||
| 脂肪酸 | 雌体 | 雄体 | ||||
| 野生 | 养殖 | P | 野生 | 养殖 | P | |
| C14:0 | 0.68±0.06 | 1.01±0.05 | 0.002 | 1.44±0.15 | 2.00±0.18 | 0.046 |
| C16:0 | 16.67±0.54 | 14.48±0.50 | 0.013 | 14.80±0.24 | 15.16±0.51 | 0.458 |
| C17:0 | 0.79±0.11 | 0.74±0.10 | 0.750 | 0.46±0.05 | 1.01±0.14 | 0.005 |
| C18:0 | 2.08±0.70 | 2.33±0.06 | 0.704 | 1.99±0.13 | 2.39±0.14 | 0.031 |
| ΣSFA | 20.64±1.28 | 18.74±0.63 | 0.202 | 18.35±0.49 | 20.02±0.43 | 0.001 |
| C16:1n7 | 10.08±1.29 | 8.15±0.78 | 0.203 | 8.70±0.50 | 8.03±0.56 | 0.313 |
| C17:1n7 | 0.56±0.02 | 0.71±0.04 | 0.009 | 0.55±0.07 | 0.74±0.03 | 0.045 |
| C18:1n9 | 35.48±0.73 | 28.36±0.73 | 0.000 | 34.68±0.95 | 27.79±0.74 | 0.000 |
| C18:1n7 | 4.19±0.42 | 3.56±0.18 | 0.173 | 2.99±0.27 | 3.38±0.16 | 0.173 |
| C20:1n9 | 0.71±0.07 | 1.52±0.39 | 0.070 | 1.24±0.42 | 1.57±0.26 | 0.458 |
| C20:1n7 | 1.62±0.22 | 1.59±0.08 | 0.903 | 1.30±0.15 | 1.57±0.19 | 0.317 |
| ΣMUFA | 53.20±1.30 | 44.51±0.89 | 0.000 | 49.69±0.56 | 43.49±0.87 | 0.000 |
| C18:2n6 | 14.22±1.30 | 18.84±0.56 | 0.006 | 18.43±2.01 | 13.31±2.41 | 0.077 |
| C18:3n3 | 1.41±0.15 | 2.73±0.15 | 0.000 | 1.86±0.44 | 2.35±0.44 | 0.369 |
| C20:2n6 | 1.71±0.36 | 1.53±0.19 | 0.644 | 1.14±0.19 | 1.55±0.26 | 0.152 |
| C20:3n6 | 0.21±0.04 | 0.25±0.04 | 0.293 | 0.46±0.23 | 0.53±0.27 | 0.824 |
| C20:4n6 | 0.98±0.31 | 1.24±0.09 | 0.389 | 0.97±0.06 | 1.98±0.15 | 0.000 |
| C20:3n3 | 0.46±0.10 | 0.50±0.03 | 0.728 | 0.33±0.04 | 0.47±0.08 | 0.095 |
| C20:5n3 | 0.91±0.25 | 1.75±0.11 | 0.010 | 1.35±0.19 | 2.65±0.38 | 0.004 |
| C22:6n3 | 1.03±0.29 | 2.81±0.33 | 0.002 | 1.68±0.12 | 4.34±0.67 | 0.001 |
| ΣPUFA | 21.32±0.86 | 31.00±0.90 | 0.000 | 27.39±1.11 | 28.48±1.70 | 0.537 |
| Σn-3PUFA | 4.29±0.62 | 8.81±0.59 | 0.000 | 6.36±0.88 | 11.12±0.94 | 0.001 |
| Σn-6PUFA | 17.02±0.94 | 22.18±0.68 | 0.001 | 21.03±1.87 | 17.36±2.44 | 0.183 |
| n3/n6 | 0.26±0.04 | 0.40±0.03 | 0.019 | 0.33±0.07 | 0.73±0.15 | 0.015 |
| ΣHUFA | 3.92±1.06 | 7.61±0.63 | 0.011 | 5.63±0.77 | 10.99±1.03 | 0.000 |
| DHA/EPA | 1.14±0.15 | 1.59±0.14 | 0.042 | 1.33±0.17 | 1.64±0.10 | 0.095 |
| 表中仅列出含量大于0.4%的数据 | ||||||
两群体成蟹性腺中的脂肪酸含量见表 5。就雌体而言,野生群体性腺中的C16:1n7、C18:1n9和C18:1n7含量显著高于养殖群体,但野生群体的C20:1n9、C16:3n4、C18:2n6、C20:3n6、C20:4n6、C20:5n3和C22:6n3含量显著低于养殖群体(P<0.05); 就雄体而言,野生群体性腺中C18:1n9和C20:3n6显著高于养殖群体,但C20:1n9、C22:6n3含量显著低于养殖群体。整体上,野生雌体性腺中的MUFA含量显著高于养殖群体,ΣPUFA、HUFA、n3/n6比例显著低于养殖群体(P<0.05),但两群体雄蟹间的差异较小。
| (%总脂肪酸) | ||||||
| (% total fatty acids) | ||||||
| 脂肪酸 | 雌体 | 雄体 | ||||
| 野生 | 养殖 | P | 野生 | 养殖 | P | |
| C14:0 | 0.60±0.09 | 0.55±0.07 | 0.399 | 0.40±0.05 | 0.31±0.05 | 0.255 |
| C16:0 | 13.06±0.45 | 11.20±0.62 | 0.061 | 8.76±0.39 | 8.84±0.51 | 0.901 |
| C18:0 | 3.26±0.11 | 3.54±0.09 | 0.111 | 6.04±0.17 | 6.03±0.06 | 0.967 |
| C22:0 | 0.07±0.01 | 0.10±0.01 | 0.164 | 0.89±0.08 | 0.81±0.06 | 0.429 |
| C23:0 | 0.30±0.04 | 0.46±0.05 | 0.053 | 0.54±0.09 | 0.39±0.01 | 0.143 |
| C24:0 | 0.74±0.04 | 0.83±0.07 | 0.383 | 0.71±0.13 | 0.75±0.04 | 0.790 |
| ΣSFA | 18.26±0.44 | 16.87±0.57 | 0.117 | 17.39±0.40 | 17.29±0.46 | 0.870 |
| C16:1n7 | 11.77±0.32 | 7.62±0.83 | 0.004 | 2.38±0.27 | 2.69±0.27 | 0.448 |
| C18:1n9 | 28.23±0.42 | 23.62±0.73 | 0.002 | 18.27±0.95 | 19.37±0.87 | 0.417 |
| C18:1n7 | 5.33±0.55 | 3.98±0.31 | 0.063 | 4.58±0.35 | 4.25±0.13 | 0.403 |
| C20:1n9 | 0.78±0.06 | 1.25±0.16 | 0.044 | 1.36±0.14 | 1.80±0.05 | 0.018 |
| C22:1 | 0.32±0.04 | 0.26±0.08 | 0.552 | 0.53±0.10 | 0.49±0.04 | 0.704 |
| ΣMUFA | 46.84±0.29 | 37.12±1.32 | 0.000 | 27.46±0.81 | 29.21±1.09 | 0.235 |
| C16:3n4 | 0.20±0.02 | 0.40±0.03 | 0.002 | 0.37±0.04 | 0.44±0.03 | 0.187 |
| C18:2n6 | 13.47±0.55 | 16.70±0.91 | 0.027 | 9.35±0.14 | 5.62±0.45 | 0.000 |
| C18:3n3 | 2.85±0.26 | 3.55±0.16 | 0.058 | 0.89±0.05 | 0.85±0.11 | 0.754 |
| C18:4n3 | 0.16±0.01 | 0.19±0.02 | 0.172 | 0.72±0.07 | 0.73±0.03 | 0.958 |
| C20:3n6 | 0.95±0.04 | 1.22±0.08 | 0.033 | 2.82±0.13 | 2.06±0.10 | 0.002 |
| C20:4n6 | 2.77±0.12 | 3.79±0.21 | 0.007 | 11.96±0.67 | 12.93±0.45 | 0.263 |
| C20:4n3 | 0.21±0.03 | 0.27±0.03 | 0.275 | 0.18±0.04 | 0.13±0.01 | 0.232 |
| C20:5n3 | 5.31±0.31 | 8.02±0.39 | 0.001 | 13.45±1.21 | 11.01±0.55 | 0.103 |
| C22:6n3 | 4.72±0.50 | 7.07±0.71 | 0.042 | 10.91±0.34 | 13.04±0.42 | 0.004 |
| ΣPUFA | 31.76±0.51 | 42.19±1.83 | 0.002 | 52.28±1.32 | 47.60±1.56 | 0.051 |
| Σn-3PUFA | 13.90±0.64 | 19.89±1.21 | 0.005 | 27.04±1.56 | 26.38±0.91 | 0.722 |
| Σn-6PUFA | 17.68±0.52 | 22.16±0.97 | 0.008 | 25.00±0.63 | 21.18±0.90 | 0.008 |
| n3/n6 | 0.79±0.05 | 0.90±0.05 | 0.210 | 1.09±0.08 | 1.25±0.05 | 0.132 |
| ΣHUFA | 14.62±0.77 | 21.16±1.35 | 0.006 | 40.20±1.21 | 39.78±1.25 | 0.814 |
| DHA/EPA | 0.88±0.05 | 0.87±0.05 | 0.891 | 0.83±0.07 | 1.19±0.05 | 0.003 |
两群体成蟹肌肉中的脂肪酸含量见表 6。就雌体而言,野生群体肌肉中的C14:0、C16:1n7和C18:1n9含量显著高于养殖群体,但野生群体的C20:3n6、C20:5n3和C22:6n3含量显著低于养殖群体(P<0.05); 就雄体而言,野生群体肌肉中C16:0和C18:2n6显著高于养殖群体,但C24:0、C20:3n3和C20:5n3含量显著低于养殖群体。整体上,野生雌体肌肉中的MUFA含量显著高于养殖群体,但是ΣPUFA、HUFA、Σn-3PUFA比例显著低于养殖群体(P<0.05),而野生雄体的ΣSFA和Σn-6PUFA含量显著高于养殖群体,n3/n6的比例和ΣHUFA含量显著小于养殖群体。
| (%总脂肪酸) | ||||||
| (% total fatty acids) | ||||||
| 脂肪酸 | 雌体 | 雄体 | ||||
| 野生 | 养殖 | P | 野生 | 养殖 | P | |
| C14:0 | 0.18±0.01 | 0.15±0.03 | 0.040 | 0.11±0.01 | 0.17±0.04 | 0.601 |
| C16:0 | 11.37±0.43 | 9.98±0.81 | 0.166 | 10.43±0.26 | 9.49±0.37 | 0.027 |
| C18:0 | 6.10±0.10 | 6.53±0.11 | 0.019 | 6.96±0.18 | 6.62±0.06 | 0.086 |
| C22:0 | 0.46±0.03 | 0.53±0.04 | 0.214 | 0.51±0.03 | 0.39±0.02 | 0.145 |
| C24:0 | 0.88±0.39 | 0.80±0.08 | 0.481 | 0.69±0.04 | 0.91±0.06 | 0.013 |
| ΣSFA | 19.45±0.01 | 18.44±0.78 | 0.279 | 18.99±0.15 | 18.16±0.40 | 0.002 |
| C16:1n7 | 3.39±0.01 | 2.36±0.29 | 0.037 | 2.40±0.13 | 2.42±0.16 | 0.561 |
| C18:1n9 | 23.14±0.55 | 18.64±0.49 | 0.000 | 20.48±0.35 | 18.84±0.76 | 0.093 |
| C18:1n7 | 3.30±0.16 | 3.17±0.15 | 0.581 | 3.07±0.10 | 3.83±0.12 | 0.952 |
| C20:1n9 | 0.98±0.02 | 1.05±0.06 | 0.300 | 0.93±0.06 | 1.06±0.07 | 0.096 |
| ΣMUFA | 31.45±0.66 | 25.75±0.67 | 0.000 | 27.31±0.33 | 27.08±0.91 | 0.817 |
| C18:2n6 | 12.29±0.81 | 12.69±0.64 | 0.709 | 13.67±0.23 | 7.85±1.25 | 0.002 |
| C18:3n6 | 0.48±0.10 | 0.19±0.05 | 0.054 | 0.32±0.06 | 0.42±0.09 | 0.356 |
| C18:3n3 | 1.53±0.17 | 1.49±0.08 | 0.868 | 1.59±0.62 | 1.41±0.26 | 0.816 |
| C18:4n3 | 0.49±0.02 | 0.53±0.03 | 0.296 | 0.58±0.03 | 0.48±0.03 | 0.058 |
| C20:3n6 | 1.54±0.12 | 2.05±0.14 | 0.021 | 1.73±0.05 | 1.68±0.09 | 0.596 |
| C20:4n6 | 5.18±0.17 | 5.49±0.36 | 0.463 | 5.48±0.24 | 6.27±0.52 | 0.213 |
| C20:3n3 | 0.45±0.04 | 0.53±0.04 | 0.183 | 0.30±0.02 | 0.42±0.04 | 0.044 |
| C20:5n3 | 13.77±0.25 | 16.19±0.51 | 0.003 | 15.48±0.60 | 18.04±0.50 | 0.019 |
| C22:6n3 | 9.65±0.75 | 12.99±0.79 | 0.016 | 12.17±0.62 | 13.42±0.81 | 0.274 |
| ΣPUFA | 46.63±0.61 | 53.29±1.56 | 0.004 | 52.30±0.29 | 50.99±1.12 | 0.289 |
| Σn-3PUFA | 26.48±0.86 | 32.31±1.19 | 0.004 | 30.56±0.23 | 34.27±0.99 | 0.008 |
| Σn-6PUFA | 19.99±0.77 | 20.88±0.74 | 0.428 | 21.60±0.09 | 16.62±2.61 | 0.004 |
| n3/n6 | 1.34±0.09 | 1.55±0.07 | 0.085 | 1.42±0.01 | 2.10±0.17 | 0.005 |
| ΣHUFA | 31.18±1.05 | 37.83±1.62 | 0.009 | 35.60±1.02 | 40.32±0.73 | 0.010 |
| ΣDHA/EPA | 0.70±0.05 | 0.80±0.04 | 0.122 | 0.79±0.05 | 0.74±0.04 | 0.492 |
两群体成蟹性腺和肌肉中均检测出18种氨基酸,其中人体必需氨基酸10种(表 7)。就雌体卵巢而言,尽管野生群体卵巢中必需氨基酸含量、非必需氨基酸含量以及总氨基酸量均略高于养殖群体,但两群体卵巢中18种氨基酸含量均无显著差异(P>0.05); 就雄体而言,野生群体性腺中的赖氨酸、蛋氨酸、半胱氨酸、缬氨酸、甘氨酸、丙氨酸、精氨酸的含量略高于养殖群体,其它种类氨基酸含量均为野生群体低于养殖群体,两群体精巢中仅组氨酸和脯氨酸含量存在显著差异(P<0.05),其它种类均无显著差异(P>0.05)。
| (mg/g湿重) | ||||||
| 氨基酸 | 雌体 | 雄体 | ||||
| 野生 | 养殖 | P | 野生 | 养殖 | P | |
| 异亮氨酸 | 13.65±0.47 | 13.00±0.34 | 0.121 | 10.43±0.20 | 10.84±0.17 | 0.159 |
| 亮氨酸 | 22.78±0.70 | 21.75±0.45 | 0.100 | 14.60±0.29 | 15.11±0.20 | 0.179 |
| 赖氨酸 | 18.79±0.70 | 18.14±0.64 | 0.304 | 8.43±0.16 | 8.11±0.09 | 0.129 |
| 蛋氨酸 | 6.06±0.85 | 5.97±0.77 | 0.902 | 1.39±0.02 | 1.33±0.11 | 0.534 |
| 半胱氨酸 | 3.98±0.13 | 4.19±0.46 | 0.498 | 4.35±0.64 | 3.99±0.67 | 0.648 |
| 苯丙氨酸 | 13.94±0.55 | 13.11±0.39 | 0.102 | 6.96±0.10 | 7.23±0.07 | 0.059 |
| 酪氨酸 | 14.27±0.53 | 13.48±0.35 | 0.099 | 6.43±0.06 | 6.59±0.09 | 0.164 |
| 苏氨酸 | 15.53±0.46 | 15.01±0.34 | 0.185 | 16.04±0.45 | 16.75±0.24 | 0.193 |
| 缬氨酸 | 17.71±0.54 | 16.96±0.30 | 0.104 | 6.50±0.03 | 6.25±0.17 | 0.173 |
| 色氨酸 | 5.26±0.38 | 5.14±0.60 | 0.772 | 1.55±0.06 | 1.63±0.22 | 0.660 |
| 必需氨基酸 | 131.97±2.77 | 126.76±3.29 | 0.104 | 76.67±1.93 | 77.83±2.04 | 0.621 |
| 天冬氨酸 | 25.88±0.83 | 24.79±0.77 | 0.175 | 21.80±0.05 | 22.49±0.33 | 0.101 |
| 丝氨酸 | 16.73±0.51 | 15.94±0.21 | 0.070/td> | 8.61±0.08 | 8.82±0.12 | 0.162 |
| 谷氨酸 | 36.40±1.09 | 34.78±0.86 | 0.113 | 24.32±0.26 | 24.42±0.33 | 0.757 |
| 甘氨酸 | 13.62±0.35 | 13.24±0.04 | 0.134 | 7.21±0.07 | 7.02±0.10 | 0.113 |
| 丙氨酸 | 14.55±0.39 | 14.01±0.29 | 0.123 | 12.33±0.28 | 12.23±0.24 | 0.724 |
| 组氨酸 | 7.88±0.34 | 7.54±0.31 | 0.275 | 4.94±0.02 | 5.24±0.07 | 0.031 |
| 精氨酸 | 21.23±0.72 | 20.30±0.34 | 0.114 | 7.93±0.06 | 7.46±0.09 | 0.027 |
| 脯氨酸 | 14.41±0.21 | 13.96±0.47 | 0.195 | 24.74±0.58 | 26.04±0.34 | 0.114 |
| 非必需氨基酸 | 150.70±3.47 | 144.56±2.83 | 0.076 | 111.88±1.21 | 113.73±1.63 | 0.327 |
| 总氨基酸 | 282.67±6.23 | 271.32±6.00 | 0.085 | 188.56±3.14 | 191.56±3.67 | 0.472 |
| EAA/TAA | 0.47±0.00 | 0.47±0.00 | 1.000 | 0.41±0.00 | 0.41±0.00 | 1.000 |
| 同行数据含有不同上标表示差异显著(P<0.05); EAA: 必需氨基酸; NEAA: 非必需氨基酸; TAA: 总氨基酸 | ||||||
表 8为两群体成蟹肌肉中的氨基酸组成。就雌体而言,两者仅异亮氨酸和蛋氨酸含量差异显著,其余各种氨基酸的含量、必需氨基酸总量、非必需氨基酸总量以及总氨基酸量均无显著差异; 两群体雄体间的氨基酸含量差异较大,除蛋氨酸、谷氨酸、甘氨酸表中仅列出含量大于0.4%的数据和丙氨酸含量无显著差异外,野生群体雄体肌肉中的其它氨基酸含量均低于养殖雄蟹,故野生群体雄体必需氨基酸总量、非必需氨基酸总量和总氨基酸亮也显著低于养殖群体(P<0.05)。
| (mg/g湿重) | ||||||
| 氨基酸 | 雌体 | 雄体 | ||||
| 野生 | 养殖 | P | 野生 | 养殖 | P | |
| 异亮氨酸 | 6.98±0.15 | 7.35±0.05 | 0.015 | 7.22±0.16 | 7.59±0.11 | 0.028 |
| 亮氨酸 | 11.83±0.29 | 12.77±0.69 | 0.098 | 12.07±0.27 | 12.79±0.20 | 0.021 |
| 赖氨酸 | 11.42±0.36 | 12.28±0.12 | 0.017 | 12.26±0.38 | 13.34±0.22 | 0.013 |
| 蛋氨酸 | 2.82±0.09 | 2.95±0.11 | 0.199 | 3.78±0.17 | 3.51±0.19 | 0.140 |
| 半胱氨酸 | 2.92±0.31 | 2.62±0.38 | 0.344 | 2.44±0.22 | 2.58±0.36 | 0.589 |
| 苯丙氨酸 | 6.71±0.18 | 6.93±0.08 | 0.130 | 6.70±0.17 | 7.28±0.08 | 0.006 |
| 酪氨酸 | 6.67±0.23 | 6.91±0.15 | 0.210 | 6.82±0.09 | 7.38±0.03 | 0.001 |
| 苏氨酸 | 6.96±0.23 | 7.25±0.15 | 0.130 | 7.16±0.15 | 7.64±0.15 | 0.016 |
| 缬氨酸 | 7.28±0.23 | 7.58±0.09 | 0.108 | 7.28±0.08 | 8.00±0.17 | 0.002 |
| 色氨酸 | 2.18±0.10 | 2.29±0.14 | 0.357 | 2.28±0.12 | 2.38±0.21 | 0.510 |
| 必需氨基酸 | 65.79±1.76 | 68.93±0.97 | 0.054 | 68.01±1.43 | 72.50±0.89 | 0.010 |
| 天冬氨酸 | 15.29±0.49 | 15.69±0.21 | 0.255 | 15.47±0.41 | 16.67±0.28 | 0.014 |
| 丝氨酸 | 6.37±0.21 | 6.56±0.11 | 0.251 | 6.66±0.15 | 6.97±0.11 | 0.047 |
| 谷氨酸 | 23.63±0.64 | 24.57±0.74 | 0.171 | 25.28±0.12 | 26.14±0.57 | 0.063 |
| 甘氨酸 | 10.63±0.60 | 10.80±0.47 | 0.719 | 11.51±0.94 | 12.02±1.06 | 0.562 |
| 丙氨酸 | 13.47±0.82 | 13.73±0.28 | 0.633 | 13.63±0.32 | 13.29±0.20 | 0.193 |
| 组氨酸 | 4.55±0.16 | 4.62±0.12 | 0.602 | 4.80±0.19 | 5.34±0.09 | 0.011 |
| 精氨酸 | 14.99±0.98 | 15.76±0.23 | 0.256 | 15.49±0.73 | 16.59±0.57 | 0.108 |
| 脯氨酸 | 9.33±0.71 | 10.04±0.57 | 0.248 | 9.94±0.69 | 9.88±0.76 | 0.933 |
| 非必需氨基酸 | 98.26±3.33 | 101.76±1.73 | 0.181 | 102.77±1.52 | 106.91±1.88 | 0.042 |
| 总氨基酸 | 164.05±5.07 | 170.69±1.59 | 0.096 | 170.78±2.64 | 179.41±2.71 | 0.017 |
| EAA/TAA | 0.40±0.00 | 0.40±0.00 | 1.000 | 0.40±0.00 | 0.40±0.00 | 1.000 |
参照FAO/WHO/UNU的标准对两群体性腺和肌肉中必需氨基酸分值(EAAS)进行了评价(表 9),结果发现: 无论雌体还是雄体,野生群体性腺和肌肉中的平均EAAS高于养殖群体; 就不同组织而言,性腺中的平均EAAS高于肌肉。整体上,雌雄体肌肉和雌体卵巢中的EAAS均大于100,无限制性氨基酸; 雄蟹性腺中赖氨酸、色氨酸和缬氨酸的EAAS低于100,是雄体性腺中的限制性氨基酸。
| 必需氨基酸 | 性腺 | 肌肉 | ||||||
| 雌体 | 雄体 | 雌体 | 雄体 | |||||
| 野生 | 养殖 | 野生 | 养殖 | 野生 | 养殖 | 野生 | 养殖 | |
| 异亮氨酸 | 159 | 150 | 199 | 119 | 141 | 139 | 144 | 143 |
| 亮氨酸 | 112 | 106 | 118 | 118 | 102 | 102 | 102 | 102 |
| 赖氨酸 | 105 | 101 | 78 | 72 | 112 | 112 | 118 | 121 |
| 蛋氨酸+半胱胺酸 | 131 | 131 | 122 | 109 | 130 | 118 | 139 | 128 |
| 苯丙氨酸+酪氨酸 | 146 | 136 | 113 | 113 | 120 | 116 | 120 | 123 |
| 苏氨酸 | 149 | 142 | 251 | 253 | 116 | 113 | 118 | 119 |
| 色氨酸 | 156 | 151 | 75 | 76 | 112 | 110 | 116 | 114 |
| 缬氨酸 | 165 | 156 | 99 | 92 | 118 | 115 | 116 | 121 |
| 平均值 | 140 | 134 | 132 | 129 | 119 | 116 | 122 | 121 |
| EAAS=100×样品中某必需氨基酸含量/FAO参考蛋白中必需氨基酸含量(FAO/WHO/UNU,1985) | ||||||||
肝胰腺(蟹黄)、性腺(蟹膏)和肌肉是河蟹最重要的可食部分,三者所占体质量的比例是评价商品蟹质量的重要指标(Wu et al,2007)。本研究结果表明,在相似的养殖条件下,野生群体成蟹11月底的性腺指数显著低于养殖群体,这说明野生蟹种在池塘成蟹养殖过程中的性腺发育速度明显慢于养殖扣蟹,这与先前的研究结果基本一致(He et al,2014)。造成这种性腺发育速度差异的可能原因如下:(1)池塘养殖蟹种的有效积温高于长江野生蟹种。水体积温是影响甲壳动物蜕壳的重要因素之一,通常积温越高,蜕壳周期越短(陈再忠,2002; Daoud et al,2010)。池塘养殖蟹种在生长过程中的平均水温高于长江野生蟹种的平均水温(张列士等,2001),且长江水系野生大眼幼体出现时间通常晚于池塘养殖群体的土池培育大眼幼体近1个月,故池塘养殖蟹种比长江野生蟹种具有更高的有效积温(张列士等,2002),导致其在成蟹养殖过程中生长蜕壳和生殖蜕壳提前,故性腺发育快于野生蟹种,这在先前的研究已经被证实(He et al,2014);(2)池塘养殖群体的种质退化可能是其二年性早熟的重要原因。有研究表明,经过多年人工繁殖和养殖的长江水系池塘养殖群体中华绒螯蟹遗传多样性较低,存在较严重的种质退化和种质混杂(刘青等,2015; 何杰等,2015b); 有研究者通过形态学研究结果表明长江水系中华绒螯蟹养殖群体已受辽河水系中华绒螯蟹的基因污染(马海涛等,2007; 王武等,2007),而辽河水系中华绒螯蟹具有二龄早熟特性(李晨虹等,2002);(3)长江野生蟹种对池塘养殖环境和配合饲料不适应可能也是其生长发育较慢的原因之一。由于长江野生蟹种在长江中的活动空间较大、食性较杂,在池塘养殖早期可能对养殖环境及饲料不太适应,而池塘养殖群体蟹种经过多世代人工繁殖和养殖,已经适应人工养殖环境和配合饲料。
尽管池塘养殖群体性腺指数高于野生群体,但是其肝胰腺指数显著低于野生群体,故两种群成蟹的总可食率和肥满度接近。肝胰腺是河蟹营养物质的储存和消化器官,存储着大量脂类(成永旭等,1998),在性腺发育过程中,由于肝胰腺中储存的营养物质向性腺中转移,因此性腺指数较高的个体,其肝胰腺指数相对较低(韦众等,1999; 滕炜鸣等,2008),这可能是野生群体肝胰腺指数高于养殖群体的重要原因。整体上,野生群体具有二龄晚熟特性、养殖群体具有二龄早熟特性,今后可以进一步这种不同成熟时间的特性进行良种选育,培育不同上市时间的中华绒螯蟹品系,均衡商品蟹的市场供应时间。
3.2 两群体成蟹常规生化、脂肪酸及氨基酸含量的比较河蟹的营养组成受养殖环境、饵料以及自身发育阶段等因素的影响(朱清顺等,2007; Shao et al,2013,2014; 马明君,2015),本研究中尽管野生和养殖蟹种在放养起始阶段机体肝胰腺、肌肉中的常规生化组成存在较大差异,如野生扣蟹肝胰腺中的粗脂肪含量显著高于养殖扣蟹,水分含量显著低于后者(何杰等,2015b),但在相似的养殖条件下经过8个月成蟹养殖,所得成蟹各组织中的常规生化组成均较为接近,野生和养殖群体间无明显差异,这可能与肌肉和性腺中的常规生化组成较为稳定有关(Wu et al,2007)。野生群体雄蟹肝胰腺和性腺中的碳水化合物含量显著高于养殖群体,这可能与野生群体性腺尚属于快速发育阶段,肝胰腺和性腺中代谢较为旺盛,需要足够的碳水化合物供应性腺发育或供能(于智勇等,2007)。
可食部位中的脂肪酸和氨基酸的组成及含量是评价蟹类营养品质的重要指标(汪倩等,2013; 吴旭干等,2014)。本研究野生和养殖蟹种、养成成蟹在肝胰腺、性腺、肌肉中的脂肪酸含量均存在很大差异,整体上野生群体在各组织中的SFA和MUFA含量较高,而PUFA的含量较低,并且野生群体肌肉中的各类氨基酸含量也较低于养殖群体,作者认为一方面可能是品质遗传所致,已有研究表明,不同地理种群/品系的银鲑(Oncorhynchus kisutch)和欧洲扇贝(Pecten maximus)在相同条件下养殖,其肌肉中的脂肪酸组成有所不同; 4种不同种群的淡水鲶鱼子代在相同条件下养殖,其肌肉中的氨基酸组成也存在明显差异(Hoffman et al,1995),说明部分水生生物肌肉中的脂肪酸、氨基酸组成可能和遗传有关,并可通过遗传育种来改良(Neira et al,2004; Grahl-Nielsen et al,2010)。另一方面,两群体间脂肪酸含量的差异也可能与其性腺发育有关。养殖群体肝胰中DHA和EPA高于野生群体,16:0和18:0含量低于野生群体,这可能是因为养殖群体此时性腺发育基本成熟,性腺中不再需要大量的DHA和EPA,因此肝胰腺中积累了相对较高的DHA和EPA。无论雌体还是雄体,养殖群体性腺中的DHA均显著高于野生群体,但野生群体卵巢16:1n7和18:1n9含量高,这可能是因为野生群体性腺还处在快速发育过程中,性腺中DHA积累不足,故卵巢中16:1n7和18:1n9相对含量较低(马明君,2015)。肌肉中仅养殖雌体肌肉中DHA和EPA显著高于野生群体,可能是因为野生群体性腺发育较慢,肌肉中尚未积累到足够的DHA和EPA; 也可能是因为养殖群体长期适应人工养殖环境,对配合饲料中的EPA和DHA利用较高,而长江野生河蟹天然饵料中EPA和DHA含量相对较低,因此野生群体对饲料中的EPA和DHA利用率较低(何杰等,2015b)。单不饱和脂肪酸(MUFA)、多不饱和脂肪酸含量(PUFA)和n-3PUFA/n- 6PUFA比值对人体健康较为重要,通常认为MUFA和PUFA有益于人体健康,可以降低胆固醇和血脂沉积(王光慈,2001)。FAO等(1994)推荐人类膳食中的n-3/n-6适宜比值为0.1—0.2,大于此值对人类健康更加有益,食品中MUFA和n-3PUFA含量越高越有利于人体健康。本研究结果表明两群体各可食部位的n-3/n-6比值均大于0.2,因此河蟹各可食组织均具有较高的脂肪酸营养价值。C22:6n3(DHA)、C20:5n3(EPA)和C20:4n6(ARA)不仅对甲壳动物自身的生长、蜕壳和生殖有着重要作用(成永旭等,1998; 常国亮等,2008; Wu et al,2011),并且对人类具有促进神经发育、降血脂、抗血栓及抗肿瘤等生理功能(唐传核等,2000),因此其含量和组成也是评价脂肪酸营养价值的重要指标。综上,养殖群体和野生群体可食部位具有较高的脂肪酸营养价值,两者各有优势,野生群体中的MUFA含量较高,养殖中的n3/n6、ΣHUFA和DHA/EPA较高。
必需氨基酸分(EAAS)和必需氨基酸/总氨基酸(EAA/TAA)比值是评价水产品氨基酸营养价值的重要指标(吴旭干等,2014),食品中某种氨基酸的EAAS 大于100说明该氨基酸是食品中非限制性氨基酸,EAA/TAA理想比值为0.4左右(FAO et al,1985)。本研究结果表明,野生和养殖群体性腺及肌肉中的氨基酸组成接近,大部分氨基酸含量均无显著差异,整体上野生群体性腺和肌肉中的平均EAAS均高于养殖群体,这说明野生种群河蟹的营养价值略优于养殖群体。河蟹卵巢和肌肉中的必需氨基酸分均大于100,这说明肌肉和卵巢的氨基酸营养价值较高,精巢的必需氨基酸营养价值较差,赖氨酸、色氨酸和缬氨酸为其限制性氨基酸。两群体河蟹性腺和肌肉中的EAA/TAA均等于或大于0.4,这也说明河蟹的性腺和肌肉均具有较高的氨基酸营养价值。就不同可食组织而言,河蟹卵巢中的平均EAAS和EAA/TAA比值均大于肌肉和精巢,这说明卵巢的氨基酸营养价值优于肌肉和精巢。河蟹膏蟹蒸煮后,味道十分鲜美,这可能与其体内高含量的呈味氨基酸有关,成蟹卵巢和肌肉中的两种鲜味氨基酸(谷氨酸和天冬氨酸)含量均高于15mg/g湿重,此外甘氨酸、丙氨酸和脯氨酸这三种甜味氨基酸含量也较高(倪娟等,2003; 吴旭干等,2014)。
综上,野生群体和养殖群体蟹种养成后成蟹的总可食率和肥满度接近,养殖群体的性腺指数较高,野生群体的肝胰腺指数高于养殖群体; 无论雌体还是雄体,两者肌肉、肝胰腺和性腺中的常规营养成分含量接近,但养殖群体的脂肪酸营养价值略优于野生群体,野生群体的氨基酸营养价值略高于养殖群体,有关其重要品质的遗传力有待进一步深入研究。
| 于智勇,吴旭干,常国亮等,2007.中华绒螯蟹第二次卵巢发育期间卵巢和肝胰腺中主要生化成分的变化.水生生物学报, 31(6):799-806 |
| 马明君,2015.不同养殖模式下中华绒螯蟹营养品质比较.上海:上海海洋大学硕士学位论文 |
| 马海涛,常玉梅,于冬梅等,2007.利用微卫星分子标记分析四个中华绒螯蟹群体的遗传多样性(英文).动物学研究, 2(2):126-133 |
| 王武,王成辉,马旭洲,2013.河蟹生态养殖.北京:中国农业出版社, 59-84 |
| 王武,徐灿,张文博等,2007.四个地方种群绒螯蟹形态差异的比较研究.中国农学通报, 23(6):648-653 |
| 王光慈,2001.食品营养学.北京:中国农业出版社, 19-24 |
| 韦众,鲍传和,1999.池塘养殖与湖泊放流河蟹的性腺肝脏指数比较.淡水渔业, 29(9):16-17 |
| 成永旭,严生良,王武等,1998.饲料中磷脂和多不饱和脂肪酸对中华绒螯蟹大眼幼体育成仔蟹的成活率和生长的影响.水产学报, 22(1):9-15 |
| 朱清顺,柏如发,2007.池塘养殖的中华绒螯蟹与长江野生中华绒螯蟹生物学特性比较.江苏农业学报, 23(3):218-223 |
| 刘青,刘皓,吴旭干等,2015.长江、黄河和辽河水系中华绒螯蟹野生和养殖群体遗传变异的微卫星分析.海洋与湖沼, 46(4):958-968 |
| 农业部渔业渔政管理局,2014. 2014年中国渔业统计年鉴.北京:中国农业出版社 |
| 李晨虹,李思发,邢益于等,2002.池养长江蟹、辽河蟹生长性能及其遗传环境交互作用分析.水生生物学报, 26(4):335-341 |
| 吴旭干,汪倩,楼宝等,2014.育肥时间对三疣梭子蟹卵巢发育和营养品质的影响.水产学报, 38(2):170-182 |
| 何杰,吴旭干,龙晓文等,2015a.长江水系中华绒螯蟹野生和养殖群体选育子一代养殖性能和性腺发育的比较.海洋与湖沼, 46(4):808-818 |
| 何杰,吴旭干,龙晓文等,2015b.池塘养殖和野生长江水系中华绒螯蟹扣蟹形态学及生化组成的比较研究.水产学报, 39(11):1665-1678 |
| 汪倩,吴旭干,楼宝等,2013.三疣梭子蟹不同部位肌肉主要营养成分分析.营养学报, 35(3):310-312 |
| 张列士,李军,2002.河蟹增养殖技术.北京:金盾出版社 |
| 张列士,徐琴英,2001.自然及养殖水体河蟹性成熟和性早熟的研究.水产科技情报, 28(3):106-111 |
| 陈再忠,2002.中华绒螯蟹性早熟及其机理的研究.上海:上海海洋大学博士学位论文 |
| 倪娟,赵晓勤,陈立侨等,2003.日本沼虾4种群肌肉营养品质的比较.中国水产科学, 10(3):212-215 |
| 唐传核,徐建祥,彭志英,2000.脂肪酸营养与功能的最新研究.中国油脂, 25(6):20-23 |
| 常国亮,吴旭干,成永旭等,2008.不同脂类营养对中华绒螯蟹(Eriocheir sinensis)幼蟹生长、成活、肝胰腺指数和生化成分的影响.海洋与湖沼, 39(3):276-283 |
| 滕炜鸣,成永旭,吴旭干等,2008.莱茵种群和长江种群子一代中华绒螯蟹性腺发育及相关生物学指数变化的比较.上海水产大学学报, 17(1):65-71 |
| AOAC,1995. Official Methods of Analysis of AOAC International. Arlington, VA, USA:Association of Analytical Communities |
| Chen D W, Zhang M, Shrestha S,2007. Compositional characteristics and nutritional quality of Chinese mitten crab (Eriocheir sinensis). Food Chemistry, 103(4):1343-1349 |
| Daoud D, Lambert Y, Audet C et al,2010. Size and temperature-dependent variations in intermolt duration and size increment at molt of northern Shrimp, Pandalus borealis. Marine Biology, 157(12):2655-2666 |
| FAO, WHO,1994. Fats and oils in human nutrition. Report of a Joint Expert Consultation. Rome, Italy:Food and Agriculture Organization of the United Nations, 168 |
| FAO, WHO, UNU,1985. Energy and protein requirements. Report of a Joint FAO/WHO/UNU expert consultation. Geneva, Switzerland:WHO, 121-123 |
| Folch J, Lees M, Sloane-Stanley G H,1957. A simple method for the isolation and purification of total lipids from animal tissues. Journal of Biological Chemistry, 226(1):497-509 |
| Grahl-Nielsen O, Jacobsen A, Christophersen G et al,2010. Fatty acid composition in adductor muscle of juvenile scallops (Pecten maximus) from five Norwegian populations reared in the same environment. Biochemical Systematics and Ecology, 38(4):478-488 |
| He J, Wu X G, Li J Y et al,2014. Comparison of the culture performance and profitability of wild-caught and captive pond-reared Chinese mitten crab (Eriocheir sinensis) juveniles reared in grow-out ponds:implications for seed selection and genetic selection programs. Aquaculture, 434:48-56 |
| Hoffman L C, Prinsloo J F, Theron J et al,1995. The genotypic influence of four strains of Clarias gariepinus on the larvae body proximate, total lipid fatty acid, amino acid and mineral compositions. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 110(3):589-597 |
| Kochert A G,1978. Carbohydrate determination by the phenol-sulfuric acid method. In:Hellebust J A, Craigie J S eds. Handbook of Phycological Methods:Physiological and Biochemical Methods. Cambridge, London, UK:Cambridge University Press, 95-97 |
| Neira R, Lhorente J P, Araneda C et al,2004. Studies on carcass quality traits in two populations of Coho salmon (Oncorhynchus kisutch):phenotypic and genetic parameters. Aquaculture, 241(1-4):117-131 |
| Shao L C, Wang C, He J et al,2013. Hepatopancreas and gonad quality of Chinese mitten crabs fattened with natural and formulated diets. Journal of Food Quality, 36(3):217-227 |
| Shao L C, Wang C, He J et al,2014. Meat quality of Chinese mitten crabs fattened with natural and formulated diets. Journal of Aquatic Food Product Technology, 23(1):59-72 |
| Spindler M, Stadler R, Tanner H,1984. Amino acid analysis of feedstuffs:determination of methionine and cystine after oxidation with performic acid and hydrolysis. Journal of Agricultural and Food Chemistry, 32(6):1366-1371 |
| Sui L Y, Zhang F M, Wang X M et al,2009. Genetic diversity and population structure of the Chinese mitten crab Eriocheir sinensis in its native range. Marine Biology, 156(8):1573-1583 |
| Wu X G, Cheng Y X, Sui L X et al,2007. Biochemical composition of pond-reared and lake-stocked Chinese mitten crab Eriocheir sinensis (H. Milne-Edwards) broodstock. Aquaculture Research, 38(14):1459-1467 |
| Wu X G, Wang Z K, Cheng Y X et al,2011. Effects of dietary phospholipids and highly unsaturated fatty acids on the precocity, survival, growth and hepatic lipid composition of juvenile Chinese mitten crab, Eriocheir sinensis (H. Milne-Edwards). Aquaculture Research, 42(3):457-468 |
 2016, Vol. 47
2016, Vol. 47


