
中国海洋湖沼学会主办。
文章信息
- 罗璇, 于仁成, 王晓杰, 周名江. 2016.
- LUO Xuan, YU Ren-Cheng, WANG Xiao-Jie, ZHOU Ming-Jiang. 2016.
- 中国沿海部分地区半褶织纹螺的毒性及毒素组成分析
- TOXICITY AND TOXIN COMPOSITION OF MARINE GASTROPOD NASSARIUS SEMIPLICATUS FROM DIFFERENT REGIONS ALONG THE COAST OF CHINA
- 海洋与湖沼, 47(2): 327-335
- Oceanologia et Limnologia Sinica, 47(2): 327-335.
- http://dx.doi.org/10.11693/hyhz20151100289
-
文章历史
- 收稿日期:2015-11-20
- 改回日期:2015-12-25
2. 中国科学院大学 北京 100049;
3. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室 青岛 266071;
4. 上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室 上海 201306
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Laboratory for Marine Ecology and Environmental Science, Qingdao National Oceanography Laboratory, Qingdao 266071, China;
4. The Key Laboratory of Aquatic Genetic Resources Excavation and Utilization Conjunctive Administrated by Ministry of Education and Shanghai Ocean University, Shanghai 201306, China
织纹螺(Nassarius spp.)是一类海洋腹足类动物,腐食性,广泛分布于热带、亚热带及温带地区的潮间带及海底(Britton et al,1994a,b)。我国沿海部分地区的居民素有食用织纹螺的习惯,因食用织纹螺导致的食物中毒事件近年来多次发生。1991-2003年期间,江苏省连云港市发生了10起食用织纹螺导致的中毒事件,其中40人中毒,8人死亡(林祥田等,2005)。从1979年到2000年,浙江省舟山市发生类似中毒事件42起,导致307人中毒,其中16人死亡。1985年至2000年期间,浙江省宁波市有59人因食用有毒织纹螺中毒,其中18人死亡(水黎明等,2001; 秦品章等,2003)。1989至2010年期间,福建省宁德市共发生类似中毒事件22起,导致79人中毒,其中10人死亡(郭胜利,2012)。另外,海南、广东及台湾地区也多次发生食用织纹螺导致的食物中毒事件(Hwang et al,1995,2002; Hwang et al,2005)。对此,我国卫生部门采取了多种相关措施,并在中毒事件高发期限制水产品市场上的织纹螺交易,一定程度上减少了中毒事件的发生。但是,由于对织纹螺的毒性消长规律及毒素组成情况仍缺乏清楚的认识。2012年7月浙江省温州市再次发生中毒事件,引起了公众的广泛关注(林学尧等,2015)。
以往研究发现,采集自福建省的织纹螺毒性消长具有明显的季节性和地域性特征(罗璇等,2008),河豚毒素及其衍生物(tetrodotoxins,TTXs)是织纹螺中主要的致毒成分(Hwang et al,2002; Hwang et al,2005; Shui et al,2003; 于仁成等,2007)。但是,也有学者发现织纹螺(Nassarius papillosus)中同时存在河豚毒素和麻痹性贝毒毒素(paralytic shellfish toxins,PSTs)(Hwang et al,1995; 徐景野等,2010)。TTX是一种钠离子通道阻断剂,广泛存在于陆地和海洋生物体内。在法螺、细纹玉螺、蛙螺、日本油螺、骨螺、榧螺和织纹螺等腹足类软体动物体内,经常检测到TTX(Narita et al,1981; Noguchi et al,1981,1984; Yasumoto et al,1981; Jeon et al,1984; Hwang et al,1990,1991a,b c; Hwang et al,2003)。TTX存在一系列结构相似的同系物,如4-epiTTX、6-epiTTX、11-deoxyTTX、4,9-anhydroTTX、11-norTTX-(S)-ol、5,6,11-trideoxyTTX、11-oxoTTX等,其毒性存在较大差异(Lai et al,2003)。在带有TTX的有毒生物中,由于毒素来源不同,毒素同系物间转化情况也有差别(Yotsu-Yamashita et al,1999),毒素组成往往有明显差异。运用LC-MS等分析技术,可以对织纹螺中的毒素成分进行定性定量检测,进而比较不同地域织纹螺中的毒素组成。
在本研究中,我们选取了中国沿海多个发生过食用织纹螺中毒事件的地区,采集织纹螺样品,并运用LC-MS方法对样品中的TTX及其同系物进行了分析,以研究不同地域织纹螺的毒素组成,探讨毒素组成与其毒性的关系。
1 材料与方法 1.1 样品采集自2006-2007年间,选取江苏省连云港市和盐城市、浙江省舟山市和宁波市,以及福建省宁德市和莆田市,在沿海地区潮间带和潮下带设立采样点,定期采集织纹螺样品(采样地如图 1所示),所有样品均采自4-8月织纹螺种群数量较高的季节,其余月份由于织纹螺种群数量急剧下降,无法满足采样需求。采集到的样品被迅速冷冻处理,尽快运送到实验室,于-20°C下保存。选取各地采集的半褶织纹螺样品(N. semiplicatus)进行毒性测试和毒素分析。
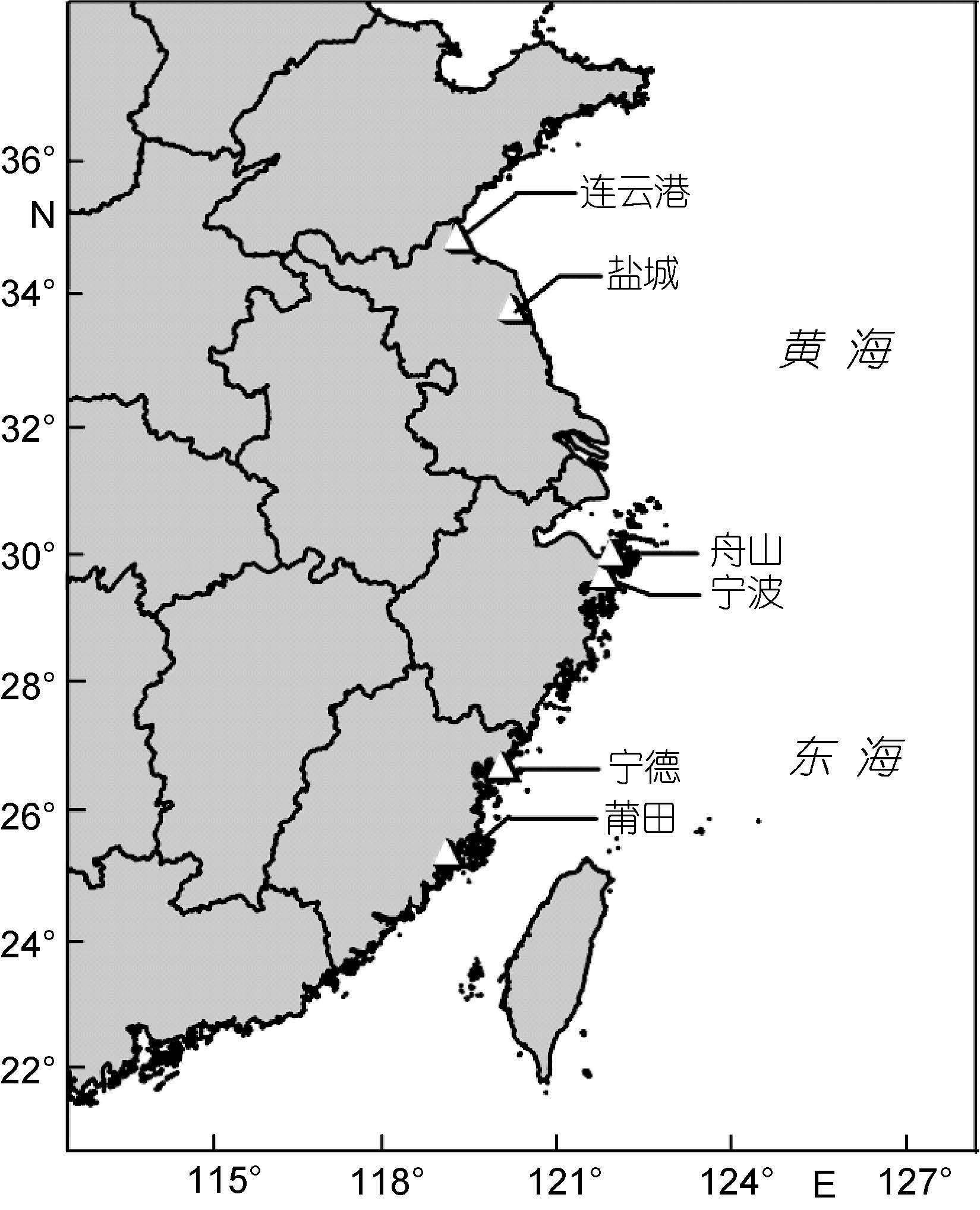 |
| 图 1 中国沿海织纹螺样品采样点设置图 Fig. 1 Sampling locations for nassariids |
半褶织纹螺样品的毒性测试采用小鼠生物法,过程参照美国分析化学家协会(Association of Analytical Communities,AOAC)公布的针对PSP的毒性测试方法(Williams,1984)。这种方法对PSP毒素和TTX毒素的毒性测试都很有效。解剖取出完整的织纹螺软体组织,匀浆,称取5g匀浆后组织,加入5mL HCl溶液(0.1mol/L)进行提取,用组织高速分散器打碎,以1.0mol/L HCl调整其pH值至2.0-4.0。将混合物放到沸水浴中加热10min,取出冷却至室温后,再次以1.0mol/L HCl调整其pH值至2.0-4.0,并将提取体系的最终体积定容到10mL,在6000r/min转速下离心15min,取上清液对实验小鼠(昆明系小鼠,购买自青岛市药品检验所)进行腹腔注射,观察小鼠的反应并记录下死亡时间和体重。样品的毒性水平依照Hwang等建立的剂量-死亡时间关系进行计算,以小鼠单位(mouse unit,MU)表示,1MU代表能够在30min内杀死1只体重为20g雄性小鼠的毒素量(Hwang et al,1991)。用于生物毒性测试法的化学试剂均为分析纯级别以上。
1.3 毒素分析半褶织纹螺样品的毒素分析采用LC-MS方法,系参照李爱峰等和于仁成等所用的方法(李爱峰等,2007; 于仁成等,2007),并略有改动。用于LC-MS分析的化学试剂均为色谱纯,实验用水为经Millipore纯水系统净化的超纯水(Millipore,美国)。TTX标准品购买自美国Calbiochem公司。
取2g匀浆后的织纹螺组织,加入4mL酸化甲醇水(甲醇︰水=80︰20,含0.1%乙酸),在冰浴中用组织分散器处理5min后静置,进行毒素提取,在20°C下6000r/min离心15min,取上清液。向离心后剩余残渣中再加入4mL酸化甲醇水重复提取1次。合并提取液,在45°C下旋转蒸发至干。以4mL 0.05mol/L乙酸分多次溶解残余物,并定容至5mL。前后加入等体积二氯甲烷进行二次脱脂后,将含有毒素的水相吸出,用孔径为3000Da的超滤离心管(Millipore,Bedford,MA,USA)在12000r/min转速下离心15min,滤出液用于LC-MS/MS分析TTX及其同系物。
对数量相对较多的采集自的江苏连云港和浙江舟山两地的织纹螺样品进行了组织分离,将其分为肌肉、消化腺及其它组织三部分,并分别提取毒素和分析,以了解毒素在织纹螺不同解剖学组织中的含量与分布情况。
样品分析所用的LC-MS系统为Varian 2100 L(Varian公司,美国)型高效液相色谱仪串联三重四极杆质谱仪,采用电喷雾离子化源。毒素的分离采用亲水性相互作用色谱柱SeQuant ZIC-HILIC(150× 2.1mm,5m),购自瑞典SeQuant AB公司。流动相A为超纯水,流动相B为90%乙腈,两者中均含有5mmol/L甲酸铵和5mmol/L甲酸。洗脱采用了梯度洗脱,洗脱液的初始比例为A:B=30:70,前7min内流动相A的比例逐渐增加至50%,在第8分钟回复至初始比例,并保持12min。流速为0.2mL/min,进样量3-10μL(根据样品小鼠测试毒性结果大小而定)。
检测模式采用多反应检测方式(Multiple reaction monitoring,MRM),分别检测trideoxy TTX(272.30/162.10),anhydro TTX(302.30/162.10),deoxy TTX(304.30/162.10),TTX及其同分异构体4-epi TTX(320.30/162.10),oxo TTX(336.30/162.10)。通过流动注射(FIA)方式,以0.25µg/mL的TTX标准品溶液(流速0.2mL/min)对质谱检测器进行调谐后,设定参数为: 质谱进液针(needle)电压5400V,电流为31µA; 干燥气温度为150°C,气压为19psi; 电喷雾离子化源氮气压为57psi; 毛细管扫描电压为79V; 电离室温度为50°C; 保护电压600V; 阳离子模式检测器电压为1750V; 离子导向电压(Q0),一级(Q1)和二级(Q3)电压分别为-4.9V、-0.8V和-0.2V; 碰撞能-36.5V。
将TTX毒素标准品用0.05mol/L乙酸溶液稀释,得到0.002、0.01、0.05、0.25、1.00、2.5、5.0和10μg/mL不同浓度的系列标准,用于绘制方法标准曲线。
织纹螺样品中TTX含量依照TTX的标准品浓度计算。由于缺少TTX同系物的标准品,对TTX同系物的定量分析参照TTX标准品的浓度进行计算。
2 实验结果 2.1 织纹螺样品毒性状况根据小鼠生物法测试结果,采用Hwang提出的小鼠死亡时间与样品毒性关系表(Hwang et al,1991)进行分析,表明采自各地的织纹螺样品毒性范围在2-664MU/g 组织(湿重)之间。1MU 大约相当于0.22μg TTX。在所有采样点中,来自江苏省连云港的织纹螺毒性最高,均在100MU/g组织(湿重)以上,最高达到664MU/g组织(湿重),相当于每100g组织中含有14.6mg TTX毒素。根据织纹螺软组织的平均湿重计算,所采集的高毒性织纹螺个体中 含有约58.4μg TTX。采集自其它五个地区的织纹螺毒性相对较低,在2-6MU/g 组织之间(表 1)。
| 采样地点 | 采样日期 | 平均个体组织重量(g) | 毒性(MU/g) | |
| 江苏 | 盐城射阳 | 2006-05-06 | 0.30 | 4.4 |
| 盐城射阳 | 2006-05-25 | 0.31 | 4.9 | |
| 盐城射阳 | 2006-06-19 | 0.34 | 3.6 | |
| 连云港赣榆 | 2007-05-21 | 0.40 | 664.3 | |
| 连云港赣榆 | 2007-06-06 | 0.43 | 611.7 | |
| 连云港赣榆 | 2007-08-08 | 0.40 | 151.9 | |
| 浙江 | 宁波象山港 | 2006-07-11 | 0.23 | 2.5 |
| 宁波象山港 | 2006-08-02 | 0.21 | 2.4 | |
| 舟山定海 | 2006-07-07 | 0.31 | 3.2 | |
| 舟山定海 | 2006-08-28 | 0.20 | 6.4 | |
| 福建 | 莆田哆头 | 2006-05-02 | 0.20 | 4.4 |
| 莆田哆头 | 2006-05-12 | 0.22 | 3.3 | |
| 莆田哆头 | 2006-05-30 | 0.24 | 3.2 | |
| 宁德霞浦 | 2006-04-03 | 0.24 | 3.4 | |
| 宁德霞浦 | 2006-07-24 | 0.25 | 2.4 | |
实验采用了亲水性相互作用色谱法对TTX毒素及其同系物进行分离,结果显示,亲水性相互作用色谱柱(ZIC-HILIC)对TTX有很好的保留效果,TTX保留时间为9.84min(图 2a),在测定的TTX毒素浓度范围内(25-400ng/mL),信号与毒素浓度之间有良好的线性响应,R2=0.9968(图 3)。同时,由于串联质谱对杂质信号优异的去除能力,该方法对TTX的检出限较低,信噪比等于3(Signal/Noice=3)时为0.01pg。同一浓度的TTX标准溶液(150ng/mL)分析结果的变异系数小于7%( n=3),说明该方法具有较高的精密度(见表 2)。
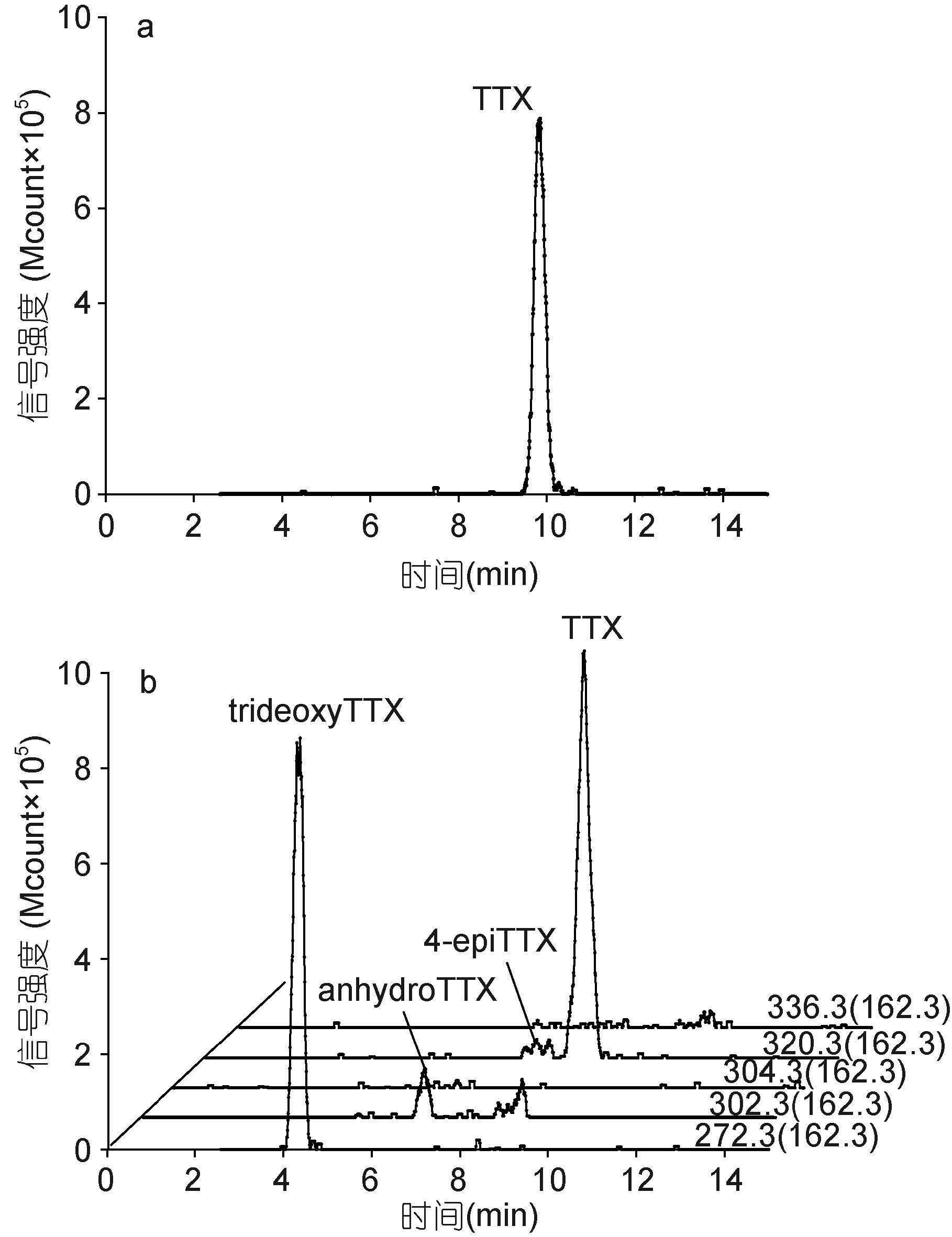 |
| 图 2 应用LC-MS/MS方法分析TTX毒素标准品和织纹螺样品(采集自江苏连云港赣榆)的色谱图 Fig. 2 LC-MS/MS chromatograms of the TTX (tetrodotoxin) standard and a nassariid sample collected from Lianyungang |
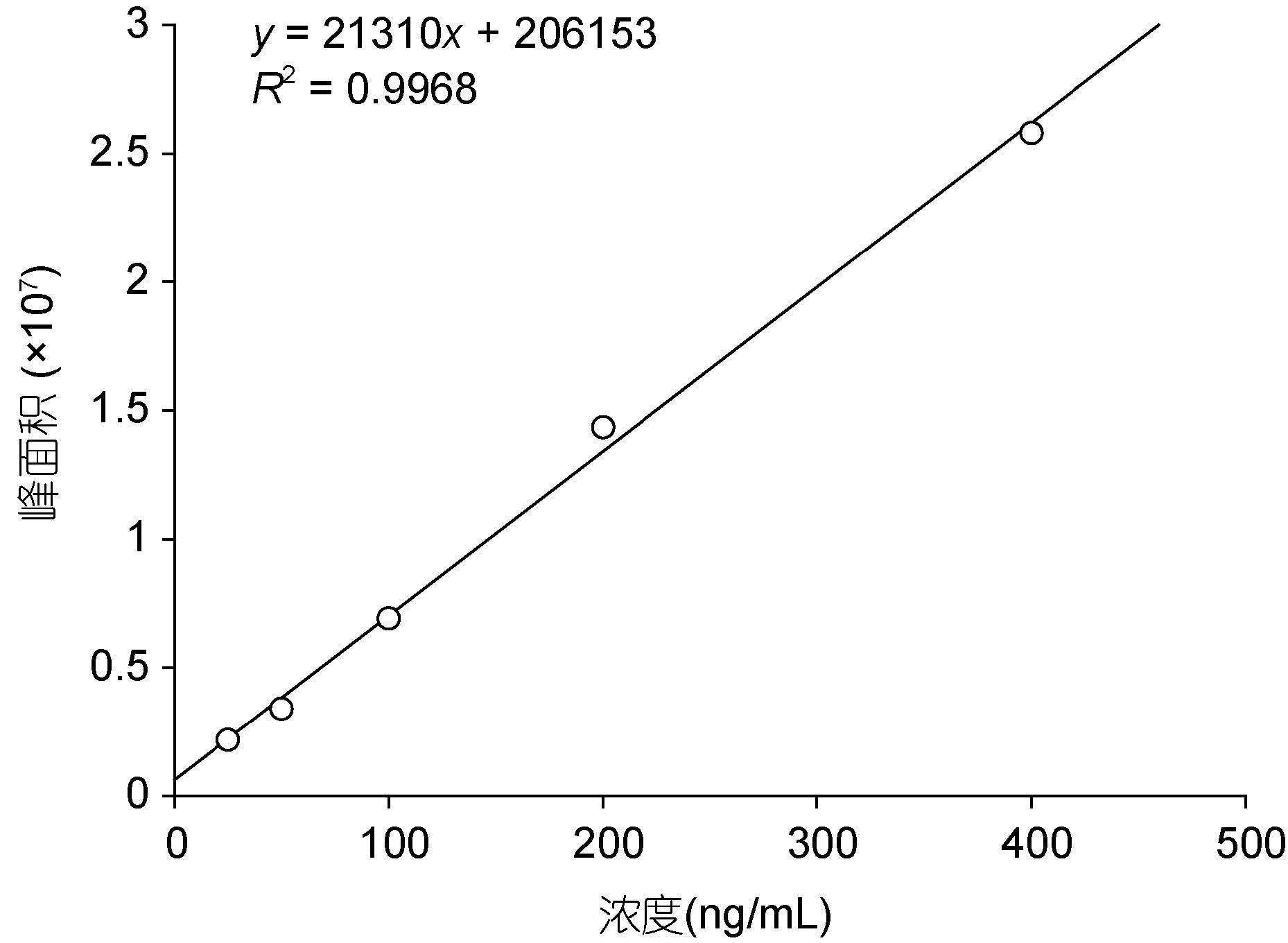 |
| 图 3 用LC-MS 分析TTX 的标准工作曲线 Fig. 3 Calibration curve for TTX using LC-MS method |
| TTX | 150ng/mL | |
| 峰面积 | 峰高 | |
| 平均值(n=3) | 27816667 | 1589000 |
| 标准偏差 | 1255242 | 105910 |
| 相对标准偏差(%) | 4.51 | 6.67 |
运用上述LC-MS方法,从有毒织纹螺样品中检测到了TTX及trideoxyTTX,4-epiTTX和anhydroTTX等毒素同系物(图 2b)。毒素分析结果显示,在采集自中国沿海不同地域的织纹螺样品中,毒素成分基本一致,但TTX和trideoxyTTX所占的比例有所不同(图 4-图 6)。采集自江苏省盐城市、浙江省宁波市,福建省莆田市和宁德市的织纹螺样品中,TTX是主要的毒素成分,其次是trideoxyTTX,4-epiTTX和anhydroTTX含量最低(图 4A-C,图 5A-B,图 6)。而在采集自江苏省连云港市和浙江省舟山市的织纹螺样品中,trideoxyTTX的含量最高,远高于TTX和其它同系物(图 4D-F,图 5C-D)。对比织纹螺样品的毒性测试和TTX毒素含量(图 7)可以看出,织纹螺的毒性主要由其高毒性成分TTX决定(R2=0.839),而与其体内各种毒素的总量关系不大。
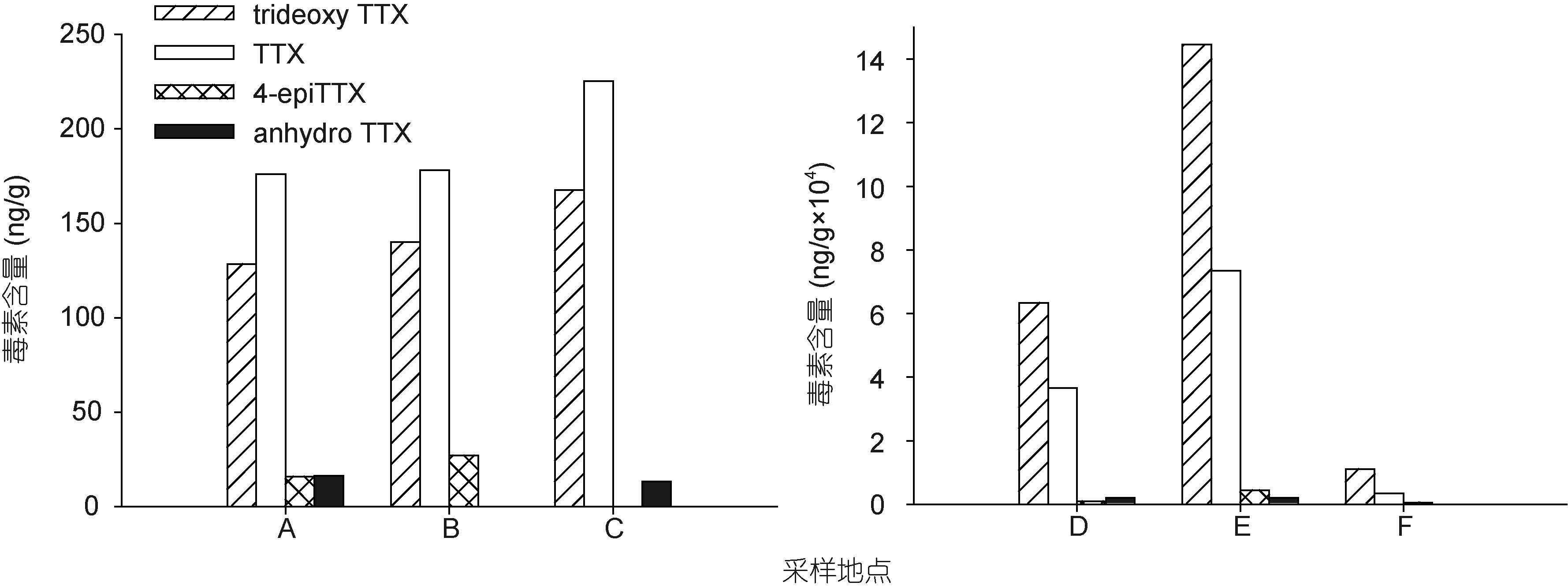 |
| 图 4 采集自江苏省不同地区的半褶织纹螺样品毒素组成 Fig. 4 The toxin profiles of N. semiplicatus collected from two locations of Jiangsu Province |
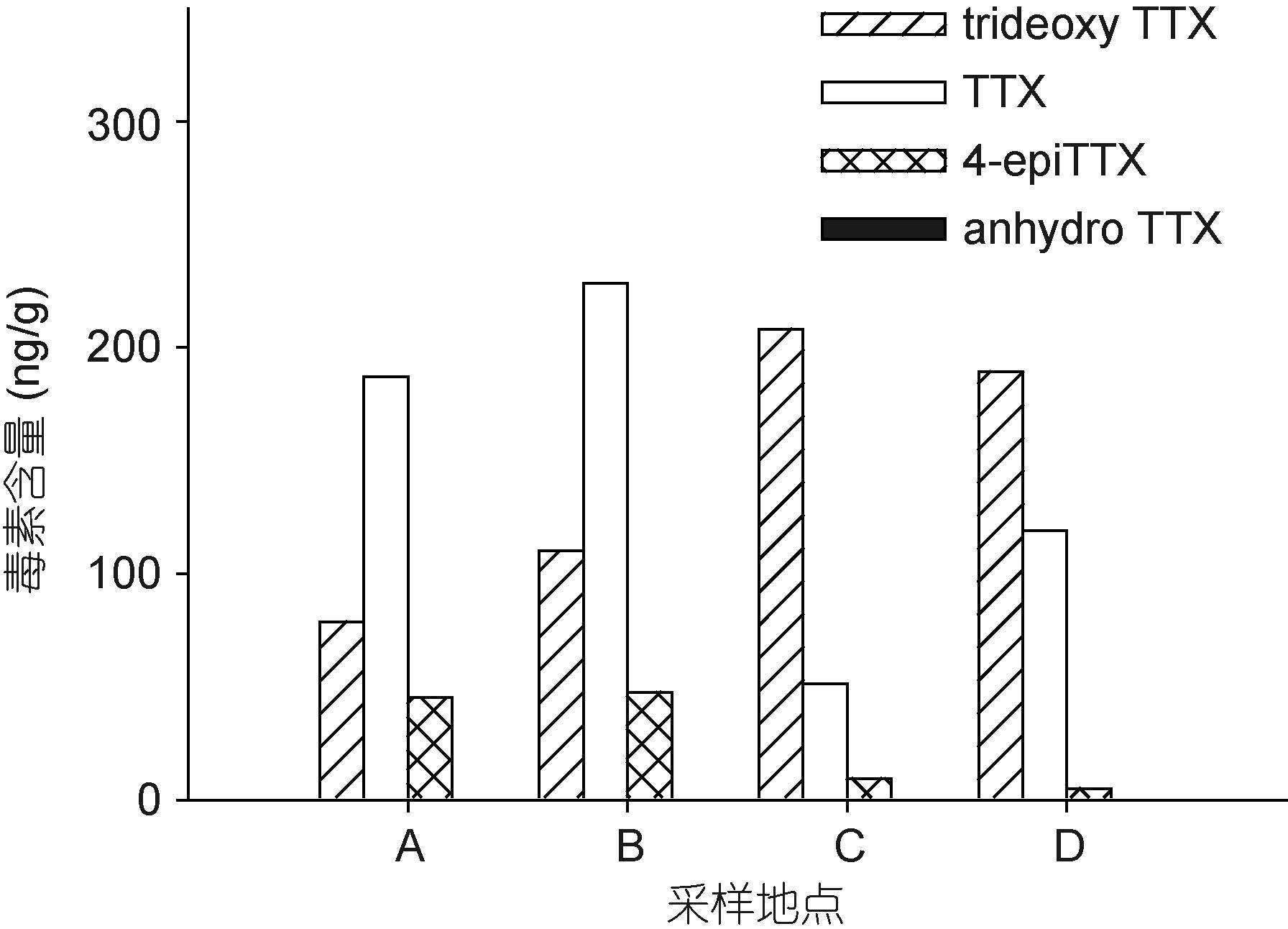 |
| 图 5 采集自浙江省不同地区的半褶织纹螺样品毒素组成 Fig. 5 The toxin profiles of N. semiplicatus collected from two locations of Zhejiang Province |
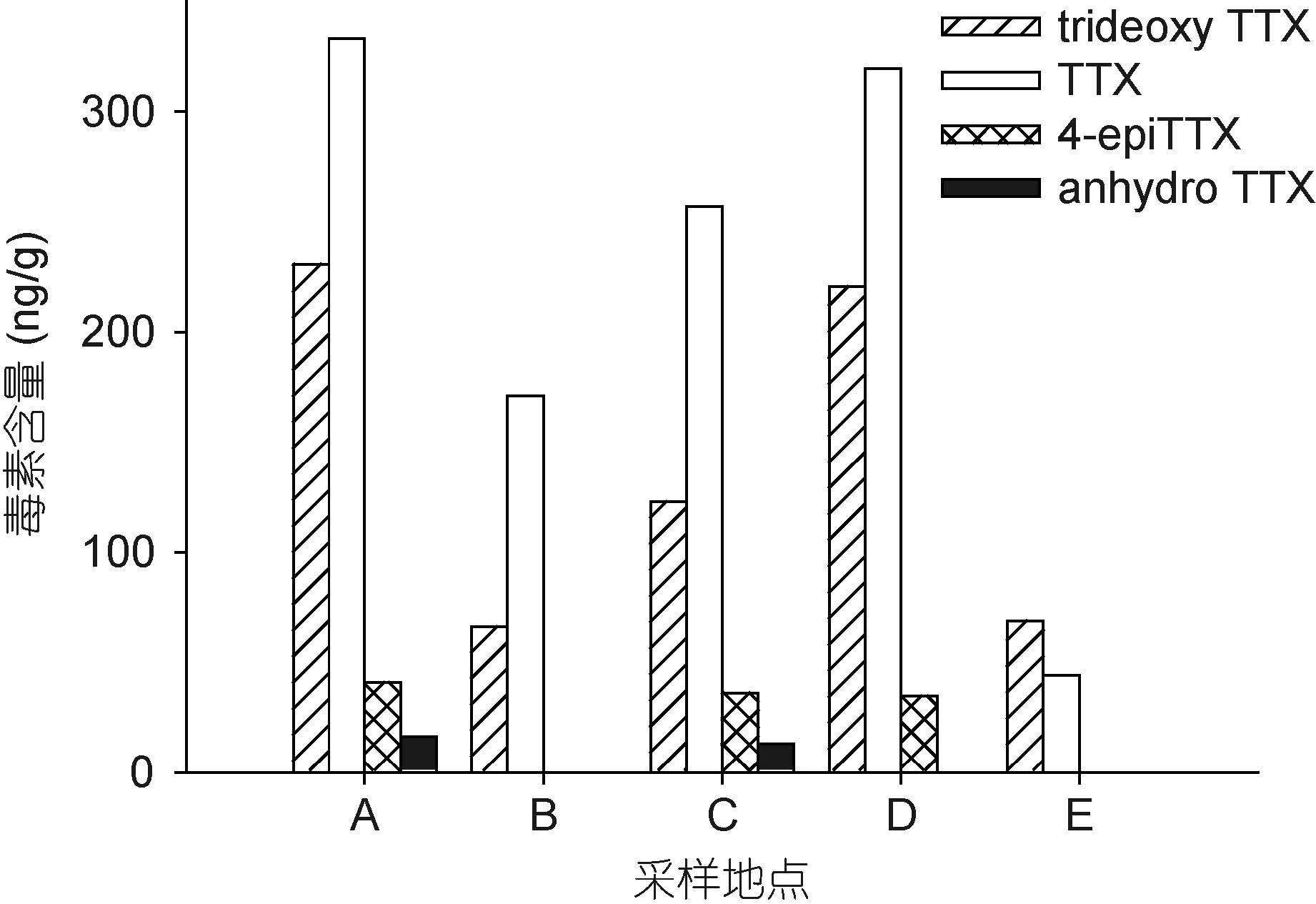 |
| 图 6 采集自福建省不同地区的半褶织纹螺样品毒素组成 Fig. 6 Comparison of toxin profiles of N. semiplicatus collected from two locations of Fujian Province |
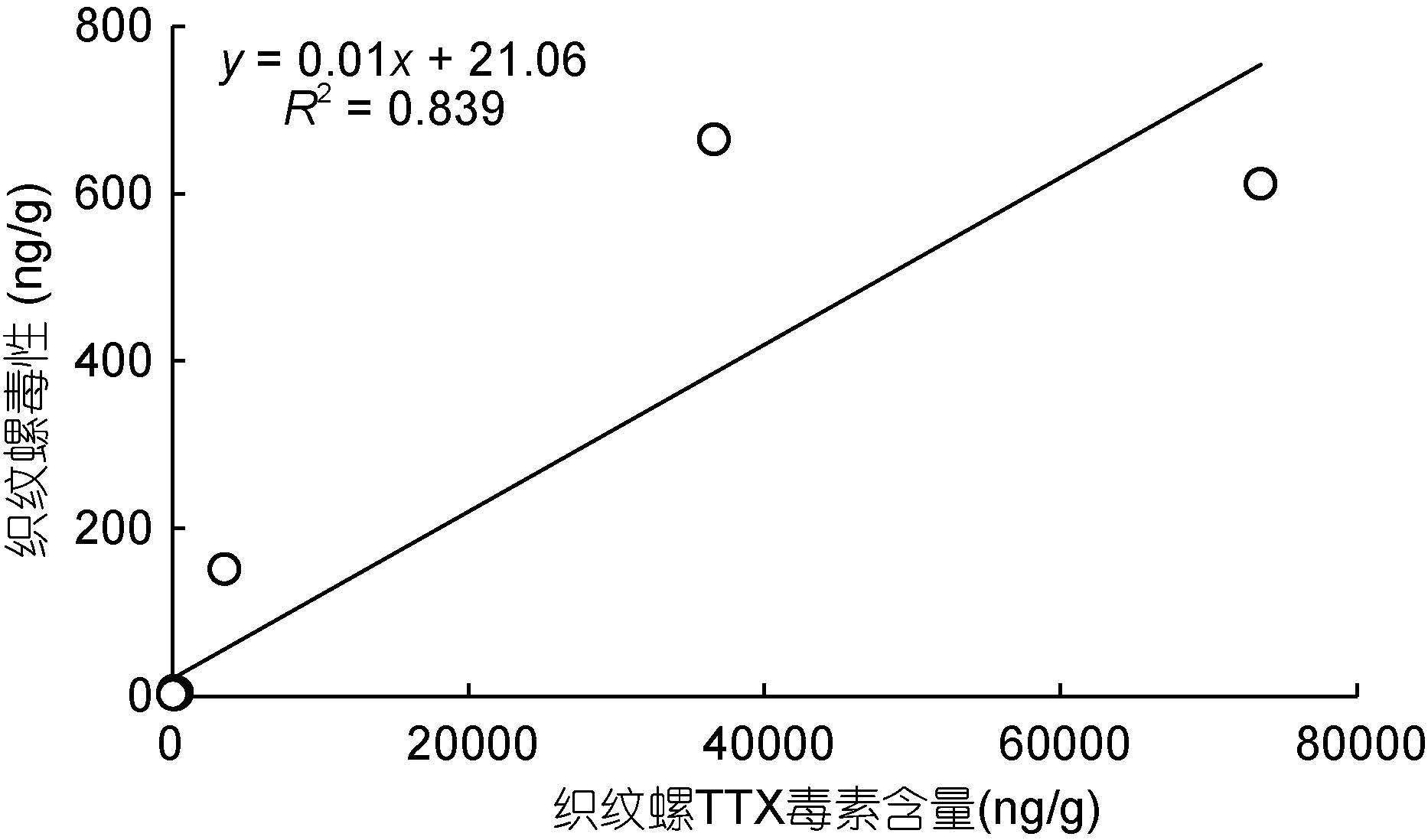 |
| 图 7 半褶织纹螺毒性与其 TTX 含量之间的关系 Fig. 7 The relationship between the toxicity of N. semiplicatus and TTX content |
对采集自江苏省连云港市和浙江省舟山市的半褶织纹螺样品进行了组织分离、毒素提取和分析。如图 8所示,除2007年8月6日采集的织纹螺样品外,其余两个采集自江苏连云港的样品中肌肉组织的毒素总量最高,其次是消化腺组织,而其它组织中的毒素总量最低。各组织中主要的毒素成分均是trideoxyTTX,其次是TTX和其它毒素成分。而采集自浙江舟山的两个织纹螺中,均是肌肉组织中的毒素总量最高,其次是消化腺组织与其它组织。肌肉组织和其它组织中的主要毒素成分是trideoxyTTX,TTX次之; 消化腺组织中trideoxyTTX和TTX的含量相当,均为主要毒素成分(图 9)。
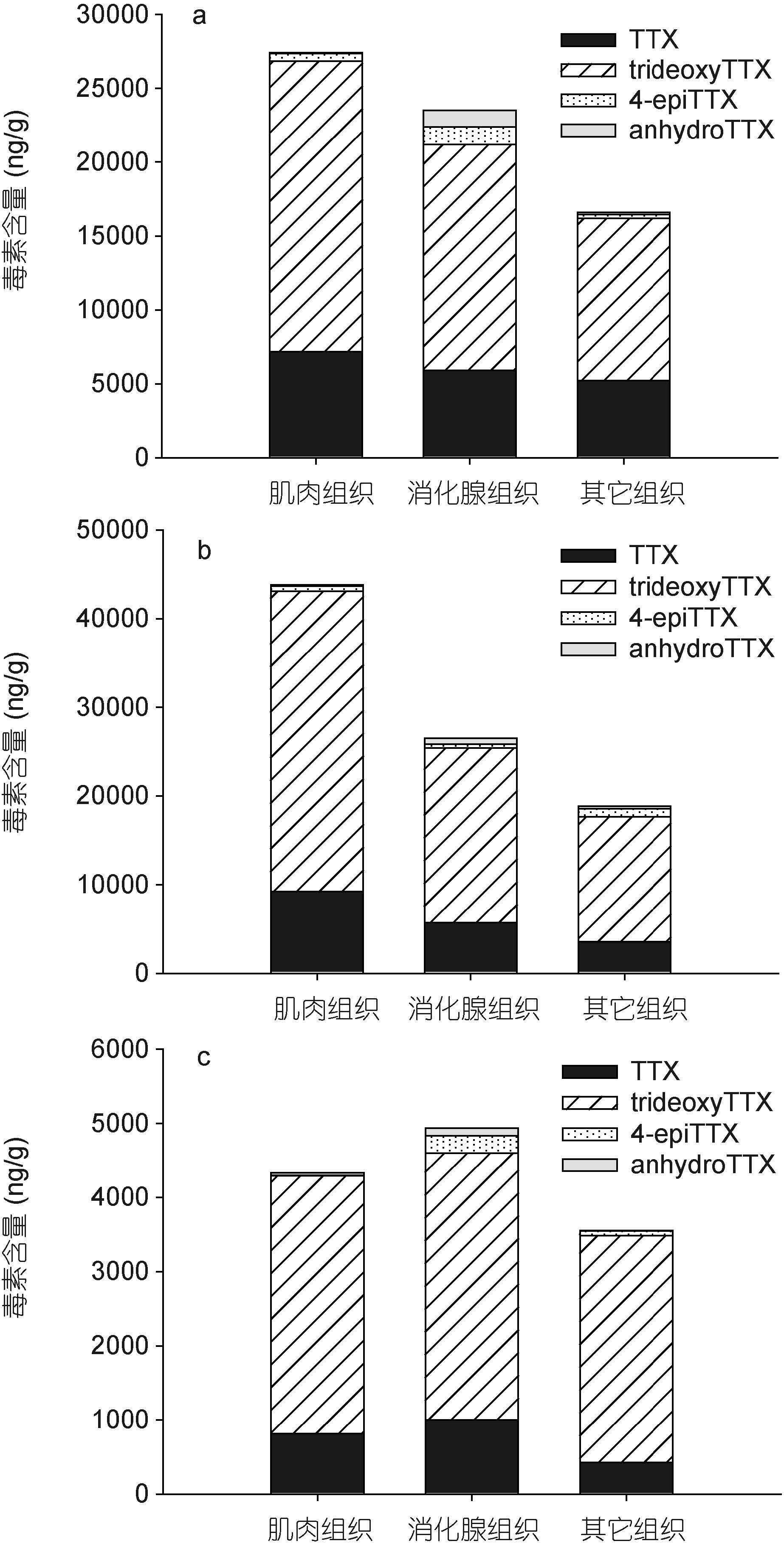 |
| 图 8 江苏连云港采集半褶织纹螺体内河豚毒素的解剖学分布 Fig. 8 Anatomical distribution of toxins in N. semiplicatus collected from Lianyungang, Jiangsu Province |
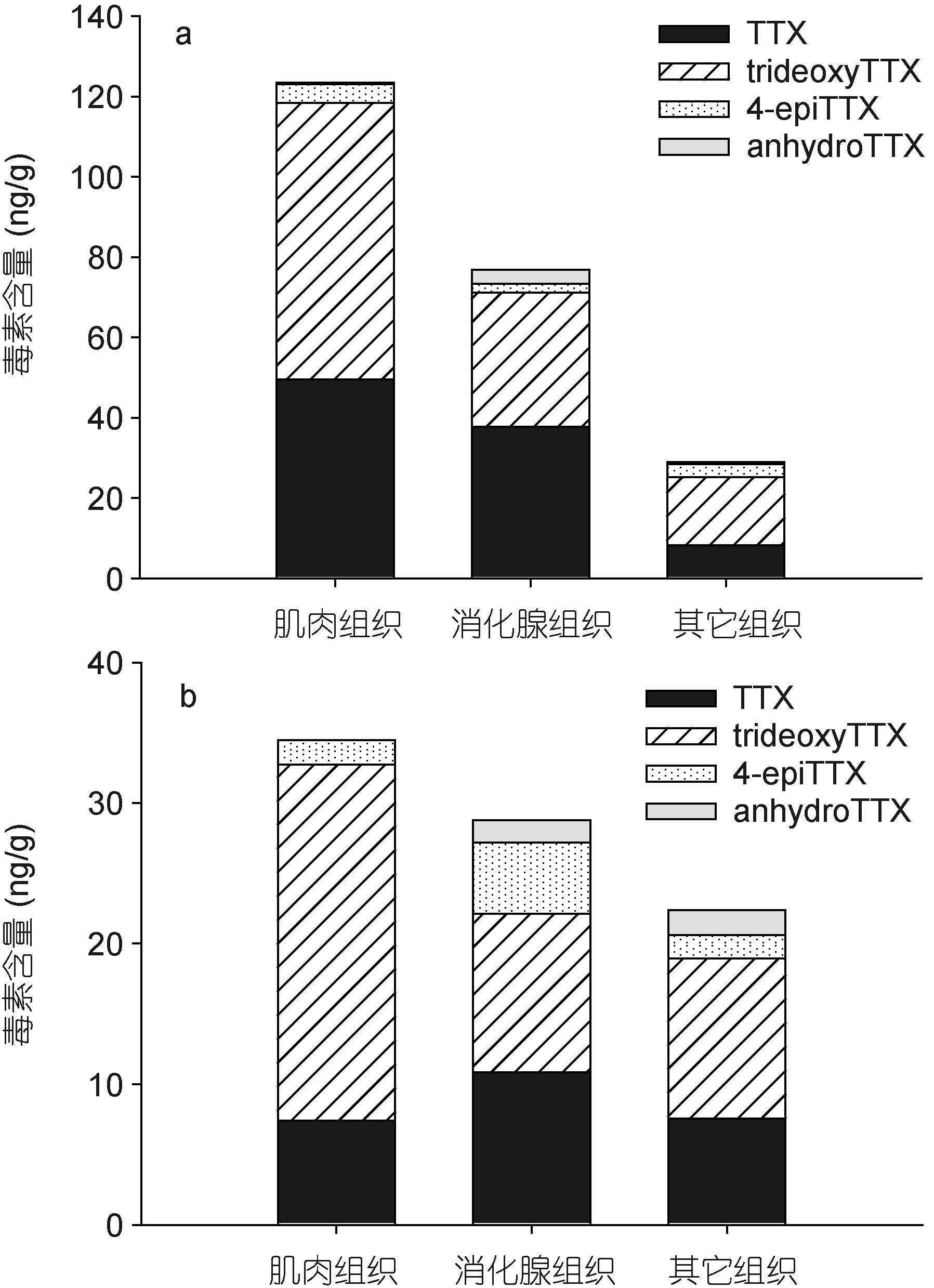 |
| 图 9 浙江舟山采集半褶织纹螺体内河豚毒素的解剖学分布 Fig. 9 Anatomical distribution of toxins in N. semiplicatus collected from Zhoushan, Zhejiang Province |
TTX是一种非蛋白类神经性毒素,可导致食物中毒。TTX最早在河豚鱼中检测到,随着研究的深入,在多种陆地和海洋生物体内检测到TTX及其同系物(Yasumoto et al,1986),如河豚鱼(Mahmud et al,1999)、蛙类(Mebs et al,1995)、腹足类软体动物(Hwang et al,1992a,b)、纽虫(Asakawa et al,2000,2003)、蝾螈(Yotsu-Yamashita et al,2007a)、章鱼(Yotsu-Yamashita et al,2007b)、蟹(Ho et al,2006)及海星(Lin et al,2001)等。因食用含TTX的腹足类软体动物而导致的中毒事件首先在日本报道(Narita et al,1981)。之后,多种织纹螺(如Zeuxius scalaris和Natica clathrata等)在台湾引发食物中毒事件(Hwang et al,1995)。自1977年开始,我国浙江省发生了40多起织纹螺导致的中毒事件(水黎明等,2001)。在肇事织纹螺中,大部分样品只含有TTX及其衍生物(主要是anhydroTTX)。但也有学者发现,在部分玉螺科和织纹螺科的软体动物中,除 TTX 外,还存在麻痹性贝类毒素(Hwang et al,1994,1995; 徐景野等,2010)。
本研究从中国沿海三省六个地区采集了15份织纹螺样品。经毒性测试,大部分样品毒性在2-6 MU/g组织(湿重)之间,而采自江苏省连云港的样品毒性较高,均在100 MU/g组织(湿重)以上,远高于其它地区的样品,毒性最高可达664 MU/g组织(湿重)。根据Tani提出的TTX对于人类的口服致死剂量为10000 MU的标准(Tani,1945),食用数粒高毒性织纹螺样品就足以导致中毒。因此,建议江苏省连云港赣榆当地的水产品安全监督部门对当地织纹螺的毒性进行长期监测,禁止居民食用,以避免食物中毒事件。
本研究采用了亲水性相互作用色谱分离河豚毒素及其衍生物,通过三重四级杆串联质谱在多反应检测模式下分析织纹螺中的TTX及其同系物。2001年,Shoji等(2001)首先应用LC-MS方法分析了河豚鱼体内的TTX,后来的研究发现亲水性相互作用色谱对于TTX及其同系物的分析很有优势(Nakagawa et al,2006)。本研究的结果同样表明亲水性相互作用色谱与串联质谱的结合非常适合织纹螺中的TTX及其同系物的检测,是一种高效、快速的毒素分析方法。
通过毒素提取、超滤处理及LC-MS/MS分析,在半褶织纹螺中均检测到了TTX及trideoxyTTX,4- epiTTX和anhydroTTX等毒素同系物。受到毒素标准品限制,在分析时使用TTX标准品对TTX的衍生物进行了定量计算,与其实际含量可能存在一定偏差,但不会影响不同样品间毒素组成的比较。通过对江苏省连云港市和浙江省舟山市的织纹螺样品毒素组成情况进行4-5个月的连续监测,发现同一地区织纹螺毒素组成和毒素成分间相对比例非常稳定,说明季节性因素对织纹螺毒素组成无明显影响(Luo et al,2012)。而对比各地采集的织纹螺样品可以看出,样品中河豚毒素组成基本一致,仅TTX和trideoxyTTX所占的比例有所不同。这一差异是否与各地海域环境条件有关,仍有待于进一步研究。在检测到的TTX及其同系物中,TTX的毒性最强,通过腹腔注射对小鼠的半致死剂量LD50约为8μg/kg,而其余几种毒素成分的毒性远低于TTX(Lai et al,2003)。通过对比织纹螺毒性与TTX含量之间的关系,发现两者呈明显的正相关性,说明高毒性毒素成分TTX对织纹螺毒性的贡献较大。
从江苏连云港和浙江舟山两地半褶织纹螺不同组织中的毒素组成来看(图 8-9),毒性相对较低的trideoxyTTX在肌肉组织、消化腺组织和其它组织中是主要的毒素成分,而毒性较大的TTX含量次之,4-epi-TTX和anhydroTTX的含量最少。大部分样品中,毒素总量最高的是肌肉组织,其次是消化腺组织,其它组织中毒素总量最低,但主要致毒成分TTX含量最高值出现在肌肉或消化腺组织中。李爱峰等(2008)对2004年导致福建仙游地区中毒事件的红带织纹螺(N. succinctus)进行研究,也发现其不同组织中trideoxyTTX相对比例最高,且高毒性毒素成分主要分布在内脏组织中。这种不同毒素成分在织纹螺不同组织的分布差异,可能与其代谢过程有关,具体机制还有待于进一步探讨。
4 结论本研究通过应用液-质联用分析方法和小鼠生物毒性测试法,对采自我国沿海不同地区的15份半褶织纹螺样品进行了毒性和毒素分析。结果表明,所采集的半褶织纹螺样品毒性范围为2-664MU/g湿重,存在较大地域性差异,其中江苏省连云港地区的半褶织纹螺样品毒性远高于其它地区。各地半褶织纹螺样品中的毒素成分基本一致,均检测出TTX及trideoxyTTX、4-epiTTX和anhydroTTX等衍生物,但各种毒素成分所占的比例存在差异。江苏连云港和浙江舟山的织纹螺样品中,TrideoxyTTX是主要的毒素成分; 而江苏盐城、浙江宁波及福建宁德、莆田的织纹螺样品中,TTX的含量最高。江苏连云港和浙江舟山的大部分织纹螺样品中不同组织间毒素含量存在差异,肌肉组织的毒素含量最高,其次是消化腺组织,其余组织中的毒素含量最低,高毒性成分TTX的最高值主要出现在肌肉组织或消化腺组织中。
 2016, Vol. 47
2016, Vol. 47


